-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAMETYST – observační studie fáze 4 sledující vliv intramuskulárně podávaného interferonu beta‑1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
AMETYST – Observational Phase IV Study Following the Influence of Intramuscularly Administered Interferon Beta‑1a in Patients with Clinically Isolated Syndrome/ Clinically Definite Multiple Sclerosis
Intramuscular interferon beta‑1a (IM IFNβ ‑ 1a) exerts positive effect on a number of clinical parameters; it reduces number of relapses and slows down disability progression.
Aim:
The primary aim of the study is to evaluate quality of life and cognitive functions in patients treated with IM IFNβ ‑ 1a using a visual analogue scale (VAS), Short Form Health Survey ‑ 36 (SF ‑ 36) and Paced Auditory Serial Addition Test (PASAT). As the secondary aim, the effects on relapse rate and disability progression (Expanded Disability Status Scale, EDSS) are also evaluated.Patient sample and methods:
AMETYST is a prospective, observational, non‑interventional phase IV study in patients with Clinically Isolated Syndrome (CIS) or Clinically Definitive Multiple Sclerosis (CDMS) involving 14 Centres for the Treatment of Multiple Sclerosis (MS) in the Czech Republic and 10 Centres in the Slovak Republic. We present an interim analysis of 121 patients who completed 12 months of treatment with IM IFNβ ‑ 1a.Results:
Sociodemographic data were consistent with the general MS population. Within the last six months before treatment initiation, 65.3% patients experienced relapse, after six and 12 months of treatment, 9.2% and 14% of patients, respectively, had a relapse. EDSS, both SF ‑ 36 domains and quality of life assessment by patients on VAS were stable throughout the treatment (p < 0.05). VAS evaluation by physicians and PASAT results were statistically significantly better following the treatment (30.0 vs 23.2; p < 0.001 for VAS and 82,7 vs 86,7; p < 0,05 for PASAT).Conclusions:
The interim analysis confirmed significant effect of treatment with IM IFNβ – 1a on relapse rate reduction and stabilization of patients’ clinical status. Of the quality of life and cognition parameters, the treatment had a positive effect on physician ‑ reported VAS and PASAT. Other evaluated parameters remained stable.Key words:
multiple sclerosis – clinically isolated syndrome – quality of life – cognition – clinical course
Autoři: P. Štourač 1; D. Horáková 2
; I. Mavrov 3; P. Turčáni Za Tým Studie Ametyst 4
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 2; Biogen Idec s. r. o., Praha 3; I. neurologická klinika LF UK a UN Bratislava 4
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(4): 465-472
Kategorie: Původní práce
* za tým studie AMETYST
Sponzorem studie AMETYST je společnost Biogen Idec (Czech Republic) s.r.o., Na Pankráci 1683/127, 140 00 Praha 4.
Souhrn
Intramuskulárně podávaný interferon beta‑1a (IM IFNβ ‑ 1a) vykazuje pozitivní účinek na řadu klinických parametrů, redukuje počet relapsů a zmírňuje progresi roztroušené sklerózy.
Cíl:
Primárním cílem studie AMETYST je zjistit účinek IM IFNβ ‑ 1a na parametry kvality života a kognitivní funkce pomocí vizuální analogové škály (VAS), krátkého dotazníku ohledně zdraví SF ‑ 36 a testu PASAT (neurokognitivní test postupného přičítání). Sekundárními cíli studie je hodnocení vlivu léčby IM IFNβ ‑ 1a na počet relapsů a progresi onemocnění (EDSS).Soubor a metodika:
AMETYST je prospektivní, observační, neintervenční studie fáze 4 s IM IFNβ ‑ 1a u pacientů s klinicky izolovaným syndromem či klinicky definitivní roztroušenou sklerózou (RS)prováděná ve 14 centrech v České republice a v 10 centrech ve Slovenské republice. Zde předkládáme výsledky mezianalýzy 121 pacientů, kteří dokončili 12 měsíců léčby IM IFNβ ‑ 1a.Výsledky:
Sociodemografická data souboru odpovídala populaci s RS. V posledním půlroce před zahájením studie mělo 65,3 % pacientů relaps, po šesti měsících léčby se relaps vyskytl u 9,2 % pacientů a po 12 měsících u 14 % pacientů. EDSS, obě domény SF ‑ 36 a hodnocení kvality života pacientem na VAS byly po dobu léčby stabilní (p < 0,05). Statisticky významně lepší byla skóre na VAS hodnocené lékařem (30,0 vs 23,2; p < 0,001) a výsledky PASAT (82,7 vs 86,7; p < 0,05).Závěry:
Interim analýza potvrdila signifikantní vliv na redukci počtu atak a stabilizaci klinického stavu. Z parametrů kvality života a kognice léčba pozitivně ovlivnila VAS hodnocenou lékařem a PASAT. Ostatní vyšetřované parametry zůstaly stabilní.Klíčová slova:
roztroušená skleróza mozkomíšní – klinicky izolovaný syndrom – kvalita života –kognice – klinický průběhÚvod
Intramuskulárně podávaný interferon beta‑1a (IM IFNβ ‑ 1a) vykazuje dlouhodobý účinek v podobě redukce počtu relapsů, zlepšení v nálezech na magnetické rezonanci a snížení progrese onemocnění. Efekt IM IFNβ ‑ 1a na kvalitu života pacientů je méně prokázán [1,2]. Údaje sledované v dotaznících a měřeních kvality života jsou stále více považovány za důležitý faktor u chronických onemocnění, jakým je i roztroušená skleróza mozkomíšní, charakterizovaná vysokou morbiditou, nízkou mortalitou a pouze částečně účinnou léčbou s řadou vedlejších účinků a potenciálních rizik [3]. Cílem studie AMETYST je určení efektu IM IFNβ ‑ 1a na parametry kvality života hodnocené pacienty a lékaři (vizuální analogová škála, VAS a Short Form Health Survey ‑ 36, SF ‑ 36) u klinicky izolovaného syndromu (Clinically Isolated Syndrome, CIS) a klinicky definitivní roztroušené sklerózy (Clinically Definitive Multiple Sclerosis, CDMS) u pacientů léčených po dobu až tří let. Studie dále hodnotí postižení (disabilitu) pomocí Expanded Disability Status Scale (EDSS) vyplněné jak lékaři, tak pacienty a orientačně kognitivní funkce pomocí Paced Auditory Serial Addition Test (PASAT). V této publikaci je prezentována předběžná analýza hodnotící pacienty, kteří dokončili 12 měsíců léčby.
Metodika
AMETYST je prospektivní, observační, neintervenční studie fáze 4 s IM IFNβ ‑ 1a u pacientů s CIS a CDMS prováděná ve 14 centrech v České republice a v 10 centrech ve Slovenské republice.
Do studie byli zařazeni pacienti, kteří dosáhli nejméně 18 let věku, měli diagnózu CIS/ CDMS, léčba byla zahájena nejpozději tři měsíce před vstupem do studie a pacienti měli relaps v posledním roce, ne však v posledních 30 dnech před vstupem do studie.
Kvalita života je pacienty hodnocena každých šest měsíců za pomoci VAS a dotazníkem SF ‑ 36 [4]. VAS hodnotí kvalitu života vyjádřenou mírou subjektivní zátěže na stupnici 0 – 100, kde vyšší hodnoty vyjadřují nižší kvalitu života. Lékař hodnotí kvalitu života pacienta za použití VAS každých 12 měsíců. Kognitivní funkce jsou hodnoceny orientačně, a to každých šest měsíců testem PASAT, který měří rychlost zpracování informace a flexibilitu, stejně jako početní dovednost [5]. Fyzické postižení je hodnoceno každých šest měsíců lékařem i pacientem za použití EDSS. V tomto sdělení je prezentována analýza souboru pacientů, kteří dokončili nejméně 12 měsíců sledování.
Statistická analýza
Data byla zhodnocena deskriptivními statistickými metodami. Jednotlivé parametry dotazníku SF ‑ 36 a skóre PASAT při zahájení a po 12 měsících byly porovnány za použití Wilcoxonova testu. Hodnoty EDSS hodnocené lékařem i pacientem byly porovnány za použití korelačních analýz.
Výsledky
Pacienti
Do předběžné analýzy je zahrnuto 121 pacientů, u nichž byla k dispozici data po 12 měsících léčby. Demografická data a charakteristiky onemocnění jsou souhrnně uvedeny v tab. 1. Věkový průměr souboru a zastoupení mužů a žen odpovídalo zhruba typické populaci s roztroušenou sklerózou. V populaci byl přibližně stejný podíl pacientů s CIS a CDMS. Pacienti byli diagnostikováni průměrně 1,5 roku před zařazením do studie a poslední relaps měli zhruba sedm měsíců před zařazením do studie. Tomu odpovídá i skutečnost, že necelé 2/ 3 pacientů měly v posledním půlroce před zařazením do studie jeden relaps.
Tab. 1. Demografické údaje a základní parametry onemocnění (n = 134). 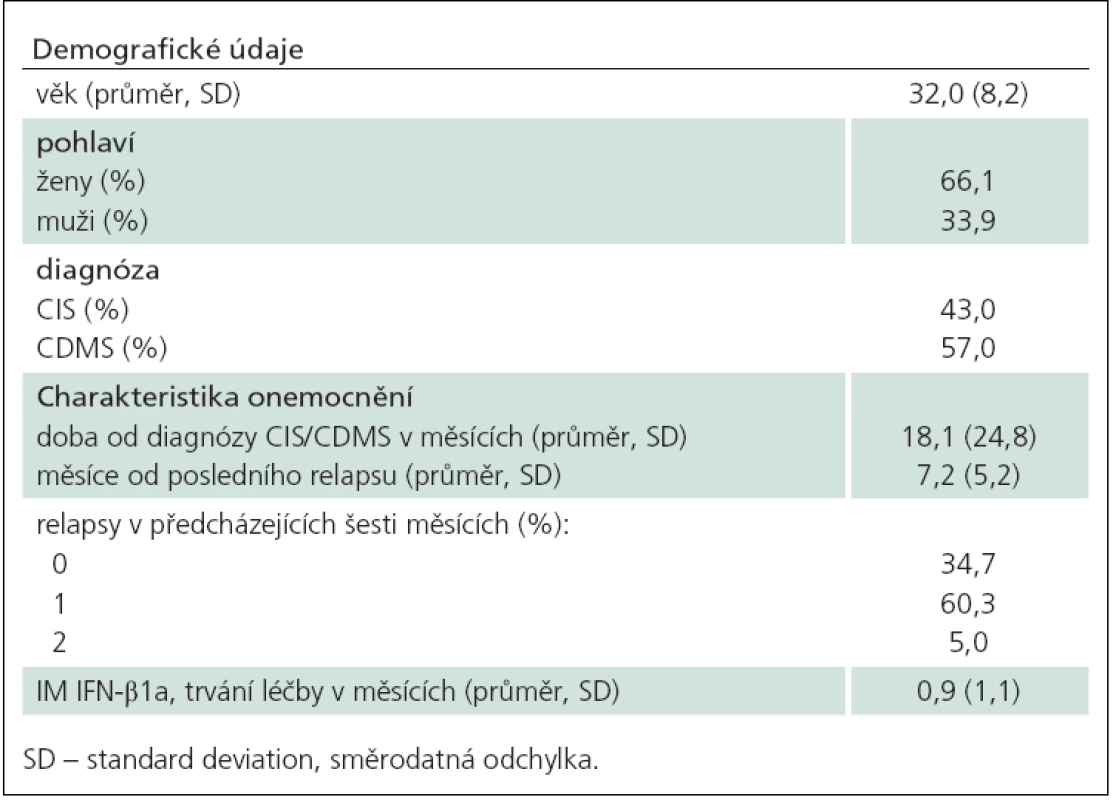
Relapsy
V období šesti měsíců před zahájením studie mělo 65,3 %, tj. 79 ze 121 pacientů, alespoň jeden relaps. Po šesti měsících ve studii došlo k relapsu u 9,2 % (11 ze 119) pacientů. Po 12 měsících ve studii mělo relaps 14 % (17 ze 121) pacientů.
Kvalita života
Průměrná hodnota VAS skóre udávaná pacientem i lékařem po 12 měsících léčby poklesla (pokles představuje zlepšení hodnoceného parametru), avšak pouze změna ve skóre VAS hodnocené lékařem dosáhla statistické významnosti (graf 1). Průměrné hodnoty psychických parametrů (MCS) a fyzických parametrů (PCS) SF ‑ 36 testu se mírně zvýšily nebo zůstaly stabilní (nárůst představuje zlepšení hodnoceného parametru), ale nedosáhly statistické významnosti (graf 2).
Graf 1. Výsledky hodnocení kvality života pacientem a lékařem po 12 měsících léčby za použití VAS. 
Graf 2. Výsledky SF-36 pro mentální a fyzické parametry po 12 měsících léčby. 
Kognitivní funkce (PASAT)
Hodnoty skóre PASAT (udávané zde jako podíl správných odpovědí) se zvýšily z průměrné hodnoty 82,7 (SD = 17,5) při zahájení léčby na 86,7 (SD = 14,5) po 12 měsících léčby (p = 0,0001) (graf 3).
Graf 3. Výsledky testu PASAT po 12 měsících léčby. 
Disabilita (EDSS)
Stupeň disability hodnocený pomocí EDSS na počátku, po šesti a 12 měsících sledování nevykazoval známky zhoršení (tab. 2). EDSS skóre hodnocené lékařem i pacientem vykazovalo malé, avšak statisticky nevýznamné zlepšení po šesti měsících léčby. Hodnocení disability pacientem a lékařem při zahájení (r = 0,41), po šesti měsících (r = 0,48) a 12 měsících (r = 0,34) léčby dosahovala středního stupně korelace (p ≤ 0,0001) (graf 4).
Tab. 2. Výsledky EDSS hodnocené pacientem a lékařem po šesti a 12 měsících léčby. 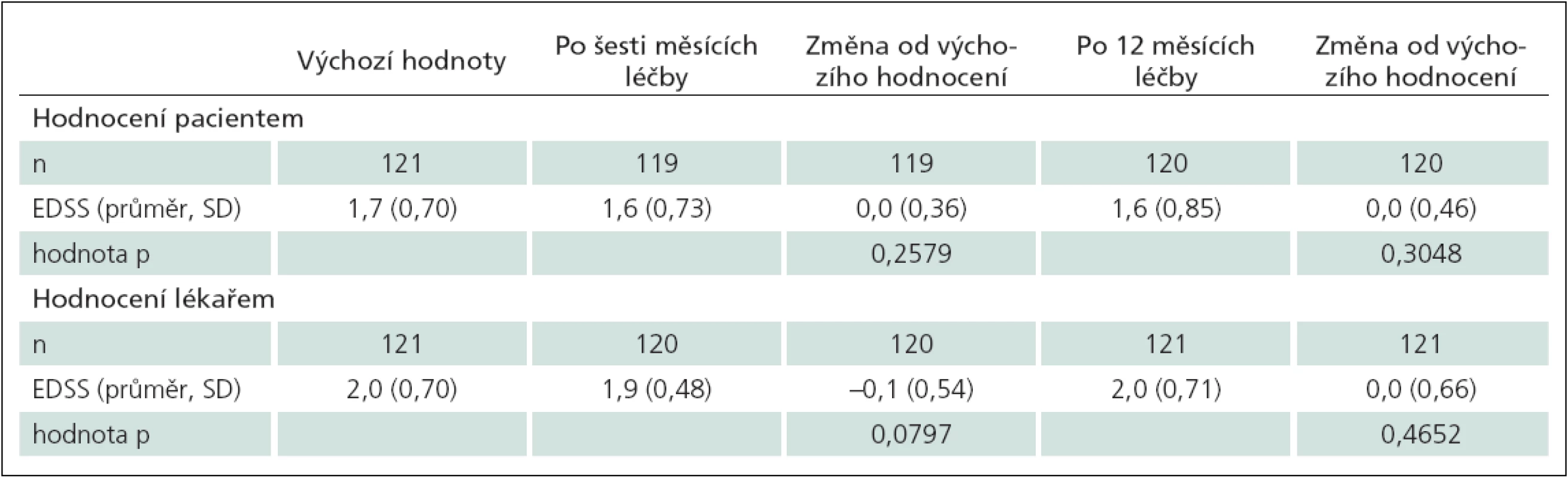
Graf 4. Korelace mezi hodnocením EDSS pacientem a lékařem ve výchozím období a po 6 a 12 měsících. 
Graf 4 – pokračování. Korelace mezi hodnocením EDSS pacientem a lékařem ve výchozím období a po 6 a 12 měsících. 
Diskuze
U interferonu beta‑1a (Avonex®) byl prokázán klinický účinek u klinicky jisté roztroušené sklerózy zpomalením progrese onemocnění, tzv. fyzické disability, redukcí klinických relapsů, redukcí ložisek při zobrazení magnetickou rezonancí a snížením progrese atrofie mozku [6 – 9]. Účinnost IM IFNβ ‑ 1a podávaného jedenkrát týdně byla prokázána i u klinicky izolovaného syndromu (CIS), kde bylo prokázáno statisticky signifikantní prodloužení konverze do klinicky definitivní roztroušené sklerózy [1]. Výsledky předběžné analýzy studie AMETYST potvrzují výše uvedené skutečnosti; ve studii došlo k výraznému poklesu počtu relapsů oproti výchozímu období (89 % pacientů bez relapsů po šesti měsících a 84 % pacientů bez relapsů po 12 měsících). V pilotní studii MSCRG bylo po dvou letech léčby 38 % pacientů bez relapsů [6]. Výraznější podíl pacientů bez atak než tomu bylo v první klinické studii (studie MSCRG) lze částečně vysvětlit rozdílným designem studií, kdy u studie MSCRG [6] se jednalo o fázi 3 klinického hodnocení se striktními zařazovacími a vylučovacími kritérii, o pacienty, kteří měli klinicky jistou roztroušenou sklerózu s těžším průběhem po dobu alespoň jednoho roku, a delší dobou sledování (dva roky). V případě studie AMETYST se jedná o fázi 4, tzn. observační studii, jež zahrnuje rovněž pacienty s CIS, a výsledky jsou k dispozici zatím za 12 měsíců.
EDSS bylo hodnoceno jednak pacienty a jednak lékaři na počátku sledování a dále po šesti a 12 měsících. Po šesti měsících od zahájení studie vykazovalo EDSS skóre mírné, avšak statisticky nevýznamné zlepšení v hodnocení pacientů i lékařů. Ani po 12 měsících nedošlo ke zhoršení EDSS skóre a stav lze označit jako stacionární. V obdobných studiích zabývajících se kvalitou života u nemocných s roztroušenou sklerózou léčených interferonem beta‑1a (Avonex®), kde současně korelovaly změny v EDSS a MSFC, nebyla pozorována po dvou letech léčby změna v EDSS a skóre zůstávalo stacionární [10]. Obdobně stacionární EDSS skóre pozorovali autoři další studie, zabývající se vlivem tzv. Disease Modifying Therapy (DMT) na parametry kvality života [11]. Uvedené výsledky prokazující stabilitu EDSS skóre jsou rovněž v souladu s výsledky studií fáze 3, neboť zde není komparativní skupina a stabilitu v klinickém obraze lze interpretovat jako pozitivní léčebný účinek IM IFNβ ‑ 1a.
Kvalitu života pacientů může ovlivňovat několik faktorů, včetně míry postižení, léčby či psychického stavu pacienta. Dosavadní studie prokazovaly různé výsledky ohledně vztahu mezi stupněm neurologického postižení (disabilitou) a kvalitou života, čímž poukazují na pouze částečný vliv disability na kvalitu života [12 – 15]. Jiné studie prokázaly jednoznačně pozitivní efekt léčby interferony na parametry kvality života [16,17]. Za významné faktory negativně ovlivňující kvalitu života jsou pokládány únava a deprese a jejich ovlivnění léčbou je posuzováno jako významné [18].
Ve studii AMETYST jsou ke zhodnocení parametrů souvisejících s kvalitou života zvoleny následující testy: VAS, SF ‑ 36 a PASAT. Hodnocení parametrů, jako jsou kvalita života nebo kognice, které nelze měřit objektivními metodami, je tradičně metodologicky nesnadné a všechny používané nástroje mají svá omezení. Výběr hodnotících škál má nepochybně vliv na rozdílné výsledky publikovaných studií hodnotících vliv DMT terapie na kvalitu života pacientů. To platí i pro studii AMETYST, kde např. test PASAT, ačkoli se jedná o validovaný a široce používaný test, zachycuje pouze úzkou oblast kognitivních domén a jeho použití je pro hodnocení kognitivního postižení spíše orientační. Statisticky významné změny, které byly ve studii AMETYST zjištěny po 12 měsících sledování u VAS hodnocené lékařem a u testu PASAT, zatím z tohoto pohledu nutno hodnotit jako předběžné a musí být potvrzeny dalším sledováním. U VAS hodnocené pacientem a u SF ‑ 36 mentálních i fyzických parametrů se objevilo zlepšení, ale výsledky nedosáhly statistické významnosti. U žádného z měřených parametrů nedošlo ke zhoršení [10,16,17].
Závěr
Výsledky této mezianalýzy potvrzují, že u pacientů léčených IM IFNβ ‑ 1a v běžné klinické praxi došlo během prvních 12 měsíců ke stabilizaci nemoci, a to jak z pohledu poklesu počtu relapsů a stabilizace EDSS, tak při orientačním hodnocení kvality života a hodnocení testu PASAT. Další sledování umožní zhodnocení dlouhodobého účinku terapie na kvalitu života a klinické parametry nemoci.
Seznam účastnících se center
Česká republika
- Všeobecná fakultní nemocnice, Neurologická klinika 1. LF UK, Karlovo nám. 32, 120 00 Praha 2MU Dr. Dana Horáková
- FN v Motole, Neurologická klinika 2. LF UK, V Úvalu 84, 150 06 Praha 5MU Dr. Eva Meluzínová
- FN Hradec Králové, Neurologická klinika LF UK, Sokolská 581, 500 05 Hradec Královédoc. MU Dr. Martin Vališ, Ph.D.
- FN Brno, Neurologická klinika LF MU, Jihlavská 20, 625 00 Brno doc. MU Dr. Pavel Štourač, Ph.D.
- FN Ostrava, Neurologická klinika, 17. listopadu 1790, 708 52 Ostrava ‑ PorubaIng. MU Dr. David Zeman, Ph.D.
- FN u sv. Anny, Neurologická klinika LF MU, Pekařská 53, 656 91 Brno MU Dr. Michal Dufek
- FN Olomouc, Neurologická klinika LF UP, I. P. Pavlova 6, 775 20 Olomoucdoc. MU Dr. Jan Mareš, Ph.D.
- Pardubická krajská nemocnice, a.s., Neurologická klinika, Kyjevská 44, 532 03 PardubiceMU Dr. Alena Novotná
- Thomayerova nemocnice, Neurologická klinika, Vídeňská 800, 140 00 Praha 4MU Dr. Romana Vančurová
- Nemocnice České Budějovice a.s., Neurologické odd., B. Němcové 585/ 54, 370 87 České Budějovice MU Dr. Libuše Lhotáková
- FN Plzeň, Neurologická klinika LF UK, Alej Svobody 80, 304 60 Plzeň prim. MU Dr. Jiří Fiedler, Ph.D.
- Krajská zdravotní, a.s. – Nemocnice Teplice, o.z., Neurologické odd., Duchcovská 53, 415 28 Teplice prim. MU Dr. Marta Vachová
- FN Královské Vinohrady, Neurologická klinika, Šrobárova 50, 100 34 Praha 10doc. MU Dr. Ivana Štětkářová, CSc.
- Nemocnice Jihlava, Neurologické odd., Vrchlického 59, 586 33 Jihlava MU Dr. Radek Ampapa
Slovenská republika
- Neurologická ambulancia, Gorkého 1, 811 01 Bratislavaprof. MU Dr. Peter Turčáni, PhD.
- FNsP F. D. Roosevelta Banská Bystrica, II. neurologická klinika SZU, Námestie gen. L. Svobodu 1, 975 17 Banská Bystricadoc. MU Dr. Vladimír Donáth, PhD.
- FNsP J. A. Reimana, Neurologická klinika FZ PU, Hollého 14, 081 81 Prešovdoc. MU Dr. Eleonóra Klímová, CSc.
- UN Bratislava, Nemocnica akademika Ladislava Dérera, II. neurologická klinika LF UK, Limbova 5, 833 05 BratislavaMU Dr. Ľubica Procházková, CSc.
- UN Bratislava, Nemocnica Ružinov, Neurologická klinika SZU, Ružinovská 6, 826 06 Bratislavaprof. MU Dr. Ľubomír Lisý, DrSc.
- UN L. Pasteura Košice, Neurologická klinika LF UPJŠ, Tr. SNP 1, 040 11 Košicedoc. MU Dr. Jarmila Szilasiová, PhD.
- ÚVN SNP Ružomberok – FN, Neurologická klinika, Gen. Miloša Vesela 21, 034 26 RužomberokMU Dr. Anna Šaffová
- FNsP Trnava, A. Žarnova 11, 917 75 TrnavaMU Dr. Georgi Krastev, PhD.
- FN Nitra, Neurologická klinika, Špitálska 6, 949 01 Nitradoc. MU Dr. Miroslav Brozman, CSc.
- Martinská FN, Neurologická klinika LF UK, Kollárova 2, Martin 036 01 MU Dr. Milan Grofik
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Pavel Štourač, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: pstourac@fnbrno.cz
Přijato k recenzi: 10. 12. 2013
Přijato do tisku: 12. 3. 2014
Zdroje
1. Jacobs LD, Beck RW, Simon JH, Kinkel RP, Brownscheidle CM, Murray TJ et al. Intramuscular interferon beta‑1a therapy initiated during a first demyelinating event in multiple sclerosis. N Eng J Med 2000; 343(13): 898 – 904.
2. Kinkel RP, Kollman C, O’Connor P, Murray TJ, Simon JH, Arnold D et al. IM interferon beta‑1a delays definite multiple sclerosis 5 years after a first demyelinating event. Neurology 2006; 66(5): 678 – 684.
3. Miller DM, Kinkel RP. Health ‑ related quality of life assessment in multiple sclerosis Rev Neurol Dis 2008; 5(2): 56 – 64.
4. Ware JE jr, Kosinski M, Gandek B. How to score version 2 of the SF ‑ 36 health survey: standards & acute forms. Lincoln RI: Quality Metric Incorporated: 2000.
5. Cutter GC, Beier ML, Rudick RA, Cookfair DL, Fischer JS, Petkau J et al. Development of a multiple sclerosis functional composite as a clinical trial outcome measure. Brain 1999; 122(5): 871 – 882.
6. Jacobs LD, Cookfair DL, Rudick RA, Herndon RM, Richert JR, Salazar AM et al. Intramuscular interferon beta‑1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Ann Neurol 1996; 39(3): 285 – 294.
7. Rudick RA, Goodkin GE, Jacobs MD, Cookfair DL, Herndon RM, Richert JR et al. Impact of interferon beta‑1a on neurologic disability in relapsing multiple sclerosis.Neurology 1997; 49(2): 358 – 363.
8. Vermersch P, de Seze J, Stojkovic T, Hautecoeur P.Interferon beta‑1a (Avonex) treatment in multiple sclerosis:similarity of effect on progression of disability in patients with mild and moderate disability. J Neurol 2002; 249(2): 184 – 187.
9. Simon JH, Jacobs LD, Campion M, Wende K, Simonian N, Cookfair DL et al. Magnetic resonance studies of intramuscular interferon beta‑1a for relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research group. Ann Neurol 1998; 43(1): 79 – 87.
10. Jongen PJ, Sindic C, Carton H, Zwanikken C, Lemmens W, Borm G et al. Improvement of health‑related quality of life in relapsing remitting multiple sclerosis patients after 2 years of treatment with intramuscular interferon beta‑1a. J Neurol 2010; 257(4): 584 – 589. doi: 10.1007/ s00415 ‑ 009 ‑ 5378 ‑ x.
11. Lily O, McFadden E, Hensor E, Johnson M, Ford H.Disease ‑ specific quality of life in multiple sclerosis: the effect of disease modifying treatment. Mult Scler 2006; 12(6): 808 – 813.
12. Amato MP, Ponziani G, Rossi F, Liedl CL, Stefanile C,Rossi L. Quality of life in multiple sclerosis: the impact of depression, fatigue and disability. Mult Scler 2001; 7(5): 340 – 344.
13. Zivadinov R, Zorzon M, Tommasi MA, Nasuelli D, Bernardi M, Monti‑Bragadin L et al. A longitudinal study of quality of life and side effects in patients with multiple sclerosis treated with interferon beta‑1a. J Neurol Sci 2003; 216(1): 113 – 118.
14. Patti F, Capocardo M, Palermo F, Ciancio MR, Lopez R, Restivo D et al. Health‑related quality of life and depression in an Italian sample of multiple sclerosis patients. J Neurol Sci 2003; 211(1 – 2): 55 – 62.
15. Janssen ACJW, van Doorn PA, de Boer JB, Kalkers NF, van der Meché FG, Paschier J et al. Anxiety and depression influence the relation between disability status and quality of life in multiple sclerosis. Mult Scler 2003; 9(4): 397 – 403.
16. Cohen JA, Cutter GR, Fischer JS, Goodman AD, Heidenreich FR, Kooijmans MF et al. Benefit of interferon beta‑1a on MSFC progression in secondary progressive MS. Neurology 2002; 59(5): 679 – 687.
17. Arnoulds JH, Kilestein J, Pfennings L, Jelles B, Uitdehaag BM, Polman CH. Quality of life during the first 6 months of interferon‑beta treatment in patients with MS. Mult Scler 2000; 6(5): 338 – 342.
18. Jongen PJ, Lehnick D, Sanders E, Seeldrayers P, Fredrikson S, Andersson M et al. Health‑related quality of life in relapsing ‑ remitting multiple sclerosis patients during treatment with glatiramer acetate: a prospective, observational, international, multi‑center study. Health Qual Life Outcomes 2010; 8 : 133. doi: 10.1186/ 1477 ‑ 7525 ‑ 8 ‑ 133.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Vyšetření senzitivityČlánek Projekt ncRNAPainČlánek Informace o členstvíČlánek Nabídka pro partneryČlánek Neurovaskulární kongres 2014Článek Webové okénkoČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Vyšetření senzitivity
- Postižení nervového systému z nutriční nedostatečnosti po bariatrických operacích
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Anaplastické oligodendrogliomy – nadešel čas pro personalizovanou medicínu?
- Prospektivní paměť a její vyšetření – validace Testu paměti pro záměry
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
- Rozdíly v postižení prostorové orientace u demencí neurodegenerativní etiologie
- Hodnocení písma u pacientů s Parkinsonovou nemocí
- Projekt ncRNAPain
- AMETYST – observační studie fáze 4 sledující vliv intramuskulárně podávaného interferonu beta‑1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Informace o členství
- Význam (CA)n repetitivní sekvence genu pro beta‑3 podjednotku GABA(A) receptoru při manifestaci tinnitu
- Dědičné ulceromutilující senzitivní neuropatie – klinická, elektrofyziologická a molekulárně genetická studie tří rodin
- Limity zkoušky verbální fluence v diferenciální diagnostice neurologických onemocnění
- Nabídka pro partnery
- Validace dotazníkové sady pro diagnostiku syndromu neklidných nohou v populaci českých těhotných žen
- Nálezy v mozkomíšním moku u dětí s akutním paretickým postižením
- Dlouhodobé sledování kognitivních, emočních a behaviorálních změn u pacientky s roztroušenou sklerózou – kazuistika
- Neurovaskulární kongres 2014
- Spinální arteriovenózní malformace – dvě kazuistiky
- Totální avulze bulbu kombinovaná s poraněním chiazmatu – kazuistika
- Výsledky soutěže o ceny ČNS za rok 2013
- Primář MUDr. Svatopluk Káš, CSc., zemřel
- Zemřel doc. MU Dr. Otakar Keller, CSc. (1945– 2014)
- Vzpomínka na pplk. MU Dr. Ladislava Houšťavu, Ph.D.
- Webové okénko
-
Analýza dat v neurologii
XLVI. Různé typy observačních studií nesou různá rizika zkreslení - Výroční kongres České neurochirurgické společnosti
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vyšetření senzitivity
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Spinální arteriovenózní malformace – dvě kazuistiky
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



