-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu – stereotaktická procedura a intraoperační nálezy
Deep Brain Stimulation in Patients Suffering from Movement Disorders – Stereotactic Procedure and Intraoperative Findings
Introduction:
Deep brain stimulation (DBS) is the method of choice in the treatment of various movement disorders.Methods:
Between 1998 and 2009, we performed DBS in 100 patients (F : M = 37 : 63; median 56 yrs /12–73 yrs/). Fourteen patients suffered from essential tremor (ET), 2 from tremor of other aetiology (T), 73 from Parkinson’s disease (PD), 10 from generalized (GD) and 1 from cervical (CD) dystonia. Implantation was targeted in the ventral intermedial thalamus (VIM) for ET, T and PD, subthalamic nucelus (STN) for PD and internal pallidum (GPi) for GD, CD and PD. Intracerebral electrodes were totally implanted into 187 nuclei. We evaluated stimulation parameters, while clinical response and parameters determined the accuracy of implantation.Results:
The lowest effective amplitude of stimulation ranged from 0.3 to 2.5 V (median 1 V). The therapeutic interval ranged from 0 to 5 V (median 2.5 V). Tremor was eliminated in 92.9% of cases, rigidity in 94.7% and akinesia in 18.9%. The central trajectory was used for final electrode implantation in 56.7% of procedures. In STN the trajectory passed through the nucleus in the range of 3.5–7.5 mm (median 5 mm). The difference of coordinates between expected and real position of electrodes was: ΔX = 0.5 (0–1.5), ΔY = 0.7 (0–1.7), ΔZ = 0.5 (0–1.7). The most frequent side effects were paraesthesias (VIM 38%) and dysarthria (STN 28.3%). Overall morbidity occurred in 21% of patients.Conclusion:
The results showed accurate targeting and optimal implantation technique with minimal morbidity.Key words:
deep brain stimulation – Parkinson’s disease – dystonia – tremor – intraoperative results – accuracy of implantation – intraoperative complication
Autoři: D. Urgošík 1,2; R. Jech 2; E. Růžička 2
Působiště autorů: Odd. stereotaktické a radiační neurochirurgie, Nemocnice Na Homolce, Praha 1; Neurologická klinika a Centrum klinických neurověd1. LF UK a VFN v Praze 2
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(2): 175-186
Kategorie: Původní práce
Souhrn
Úvod:
V této práci popisujeme naše zkušenosti s hlubokou mozkovou stimulací (DBS).Metoda a soubor:
V rozmezí let 1998 až 2009 jsme provedli DBS u 100 nemocných (Ž : M = 37 : 63; medián 56 let: 12 až 73 let). Z toho 14 trpělo esenciálním tremorem (ET), dva jiným třesem (T), 73 Parkinsonovou nemocí (PN), 10 generalizovanou dystonií různého původu (GD) a jeden cervikální (CD) dystonií. Cílem implantace bylo ventrální intermediální jádro thalamu (VIM) pro ET, T a PN, nc. subthalamicus (STN) pro PN a vnitřní pallidum (GPi) pro GD, CD, PN. Intracerebrální elektrody byly implantovány do 187 jader. Hodnotili jsme intraoperační stimulační parametry, klinickou odpověď na stimulaci a parametry určující přesnost implantace.Výsledky:
Medián nejnižší účinné stimulace byl 1 V (0,3–2,5 V). Terapeutický interval byl 0–5 V (medián 2,5 V). Tremor byl odstraněn během implantace do jednotlivých jader VIM v 92,9 %, rigidita a akineze při implantaci do STN v 94,7; resp. v 18,9 %. Vypočítaný cíl byl použit pro konečnou implantaci elektrody v 56,7 % případů. Implantovaná elektroda procházela STN jádrem v rozmezí 3,5–7,5 mm (medián 5 mm). Rozdíl souřadnic mezi předpokládanou a skutečnou pozicí elektrody dle pooperačního RTG byl: ΔX = 0,5 (0–1,5), ΔY = 0,7 (0–1,7), ΔZ = 0,5 (0–1,7). Nejčastější vedlejší příznaky stimulace byly u VIM parestezie v 38 % a u STN dysartrie v 28,3 % případech. Intraoperační klinické, technické a hardwarové komplikace se objevily u 21 % nemocných.Závěr:
Intraoperační výsledky prokázaly přesné zacílení a dobrou techniku implantace s minimální morbiditou.Klíčová slova:
hluboká mozková stimulace – Parkinsonova nemoc – dystonie – tremor – intraoperační výsledky – přesnost implantace – intra-operační komplikaceÚvod
Přestože první stimulace centrální nervové soustavy byly prováděny již v 70. letech (Bechtěreva), hluboká mozková stimulace (deep brain stimulation, DBS) byla uvedena jako metoda funkční stereotaktické neurochirurgie pro léčbu Parkinsonovy nemoci (PN) a esenciálního tremoru (ET) až na přelomu 80. a 90. let 20. století [1–7]. V následujících dvou desetiletích se chronická stimulace pomocí intracerebrálních stereotakticky (obr. 1) zavedených elektrod a implantovaného neurostimulátoru (obr. 2) stala rutinní metodou léčby pro vybrané pacienty s PN a ET. Indikace DBS se rozšířily i u dalších extrapyramidových poruch pohybu (movement disorders), jako např. u různých forem dystonií, kde se nejlepších výsledků dosahuje u geneticky vázaných dystonií typu DYT1 a DYT2 [8] a také u pacientů s neurodegenerací asociovanou s pantotenátkinázou (pantothenate kinase-associated neurodegeneration, PKAN) [9,10].
Obr. 1. Leksellův stereotaktický rám a oblouk. 
Obr. 2. Kvadripolární stimulační elektroda a implantabilní neurostimulátor. 
Cíle pro implantaci elektrod [11] byly voleny dle druhu choroby (tab. 1) a jednotlivých příznaků:
Tab. 1. Ovlivnění příznaků extrapyramidových poruch dle lokalizace DBS. 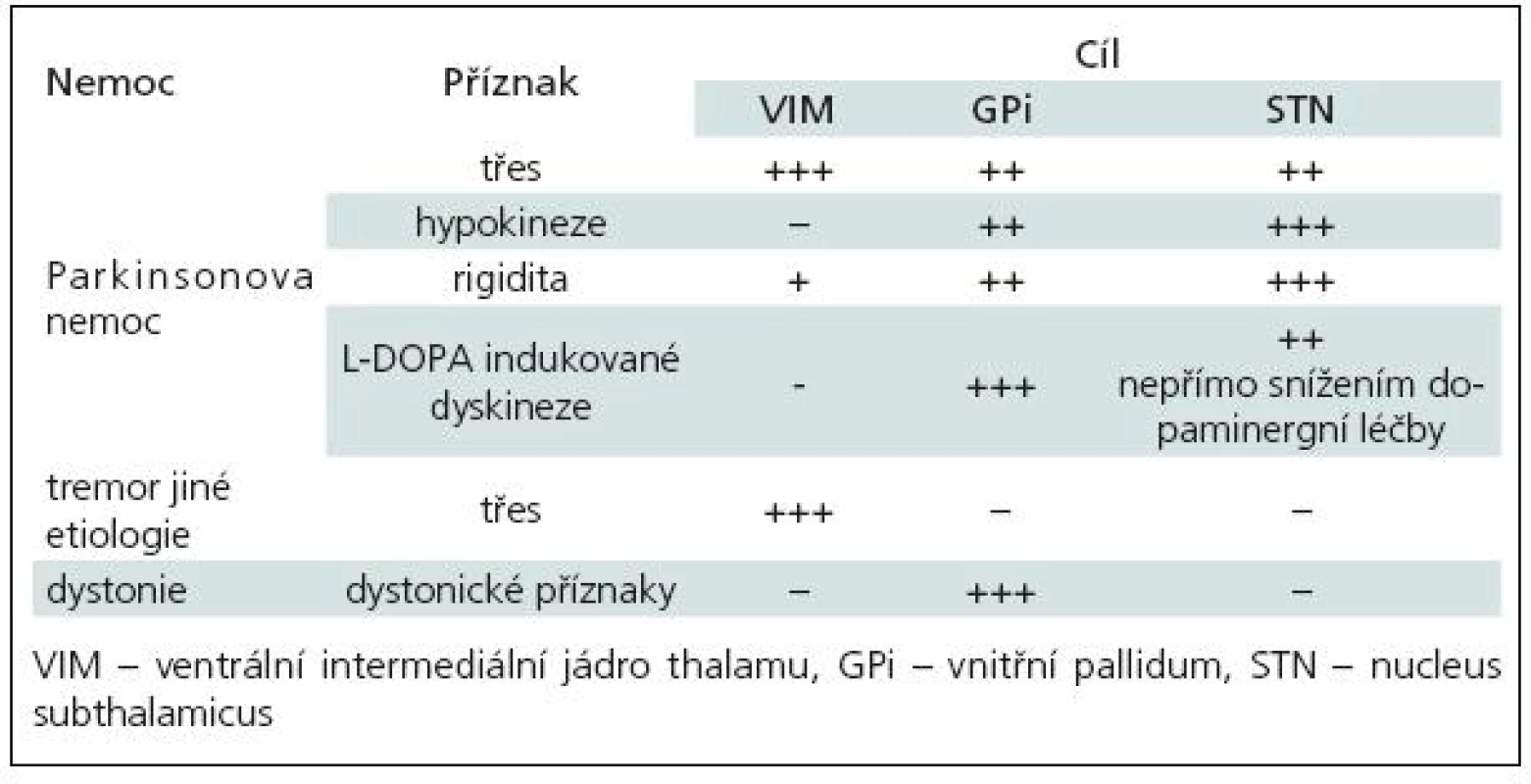
- ventrální intermediální jádro thalamu (VIM) [3,12] zejména pro neparkinsonský třes nezávisle na etiologii
- nucleus subthalamicus (STN) [5,7] jako univerzální cíl pro PN
- ventroposterolaterální jádro vnitřního pallida (GPi) [11,13] pro PN (v menšině případů, zejména u nemocných s převažujícími dyskinezami) a jako dominantní cíl pro generalizované, segmentové a fokální dystonie [8–10].
Mimo správný výběr nemocných je základní podmínkou dobrého výsledku operace přesné zobrazení a definování cíle pro implantaci elektrody a přesnost samotné operační procedury. Intraoperační výsledky elektrofyziologického vyšetření, klinická odezva na intraoperační stimulaci a dokumentace konečné pozice implantované elektrody jsou ukazatelem správně provedené implantace a budou předmětem našeho sdělení. Klinické pooperační výsledky části této skupiny byly prezentovány v České a slovenské neurologii a neurochirurgii v r. 2004 [14]. Z pozdních efektů uvedeme jen komplikace, které měly souvislost se samotnou operační procedurou.
Soubor nemocných
Od března 1998 do května 2009 jsme implantovali systém pro DBS u 100 nemocných (Ž : M = 37 : 63; věk v rozmezí 12 až 73 let; medián 56 let) trpících ET (14 nemocných), PN (73 pacientů), neuropatickým třesem při monoklonální gamapatii (jeden nemocný), třesem při spinocerebelární degeneraci (jeden nemocný), dále u 10 nemocných s generalizovanou dystonií (GD) včetně dvou sourozenců s GD při PKAN a u jedné nemocné s fokální cervikální dystonií (CD).
U většiny pacientů byla DBS první operační procedurou k ovlivnění jejich obtíží, u čtyřech nemocných s PN předcházely lezionální výkony v oblasti pallida a thalamu, u jedné nemocné s GD byly v minulosti provedeny tři léze v oblasti nucleus dentatus, talamu a globus pallidus externus.
Výběr nemocných
Výběr pacientů probíhal v Centru extrapyramidových onemocnění UK 1. LF a VFN za účasti neurochirurga, neurologů, psychiatra a psychologa. V předchozí práci [14] byla podrobně uvedena naše indikační kritéria pro výběr nemocných s PN k DBS, jež odpovídají mezinárodním zvyklostem [15]. U pacientů s ET, monoklonální gamapatií [12] a spinocerebelární degenerací byl hlavním indikačním kritériem těžký invalidizující akční třes stupně 3–4 dle příslušné škály [16] neodpovídající na farmakoterapii. U pacientů s generalizovanou nebo segmentovou dystonií jsme indikovali DBS GPi, pokud byly vyčerpány všechny možnosti farmakoterapie a dystonie pacienta invalidizovala.
Metoda
Stereotaktické zaměření cíle
Implantace systému pro DBS sestávala ze dvou fází:
- stereotaktického zavedení kvadripolárních (KE) intracerebrálních elektrod a
- implantace neurostimulátoru do pod-koží.
U nemocných s PN a ET stereotaktický výkon probíhal v lokální anestezii a u většiny pacientů s dystonií v celkové anestezii. K stereotaktickému výkonu jsme použili Leksellův rám (obr. 3) a plánovací systém SurgiPlan Software (Elekta). Zobrazení a lokalizace anatomického cíle byly prováděny na přístrojích magnetické rezonance Expert 1T, Symphony 1,5T a Trio 3T Siemens [17]. Pomocí přední (AC) a zadní ( PC) komisury a dalších přímo viditelných mozkových struktur (obr. 4) jsme stanovili souřadnice (x, y, z) vybraného cíle [18], které byly určeny podle těchto algoritmů:
Obr. 3. Leksellův stereotaktický rám a indikátorový box. Indikátorový box připevněný na rám umožňuje stanovení souřadnic v nitrolebním prostoru. 
Obr. 4. Přední (AC) a zadní (PC) komisura na řezech MR. a) horizontální rovina; b) sagitální rovina. 
1. VIM – x = 11 mm laterálně od stěny III. komory; y = 3/12 vzdálenosti spojnice AC-PC před PC; z = na úrovni AC-PC linie (obr. 5).
Obr. 5. VIM jádro thalamu a oblast vnitřního pallida v AC-PC rovině. MR – sekvence inversion recovery: levý přední kroužek (z pohledu čtenáře) na hranici vnitřního pallida zobrazuje trajektorii pro zacílení ventroposterolaterální části pallida; pravý zadní kroužek ukazuje cílový bod pro implantaci elektrody do VIM jádra thalamu. 
2. STN – přímo viditelný cíl (obr. 6). Vybírali jsme střed jádra v úrovni předního okraje nucleus ruber: x = v rozmezí 10–14 mm laterálně od střední čáry (medián 12 mm); y = 2–4 mm za polovinou AC-PC linie (medián 3 mm); z = 4–6 mm pod AC-PC (medián 5 mm).
Obr. 6. Nucleus subthalamicus (STN). a) horizontální řez b) koronální řez. Šipky označují STN jádro. 
3. GPi – vzdálenost od střední čáry byla určována podle hranice pallida s vnitřní kapsulou a spodní hranice pro umístění elektrody těsně nad retrochiazmatickou částí optické dráhy: x = 17–23 mm od střední čáry, y = 2–4 mm před středem spojnice AC-PC, z = 2–5 mm pod AC-PC linií. Pro malý počet operovaných medián koordinát nebyl počítán (obr. 5).
Po určení cíle byla stanovena trajektorie pro zavedení centrální elektrody, která vedla trepanačním návrtem před koronárním švem, přes některý z gyrů frontálního laloku laterálně tak, aby se vyhýbala komorovému systému a cévním strukturám, které se eventuálně zobrazily po podání kontrastní látky.
Intraoperační elektrofyziologie, implantace elektrod
Pomocí speciálního vodiče (Ben’s gun) s mikroposunovačem (obr. 7) jsme vedli do cíle testovací elektrody v paralelních trajektoriích vzdálených od sebe 2 mm. U prvních 25 nemocných jsme zaváděli makroelektrodu vlastní konstrukce (obr. 8), která umožňovala pouze testovací stimulaci (tzv. makrostimulaci) a hodnocení klinické odpovědi na ni až v devíti trajektoriích. Stimulaci jsme vždy zahajovali v centrální trajektorii (šíře pulzu 100 us, 130 Hz, 0,5–4 V), pokud klinická odpověď nebyla uspokojivá, pokračovali jsme stimulací ve zbývajících trajektoriích.
Obr. 7. Mikroposunovač (microdriver) s testovacími elektrodami. 
Obr. 8. Testovací stimulační makroelektroda naší konstrukce. 
U ostatních 75 nemocných jsme snímali elektrickou aktivitu neuronové populace metodou mikroregistrace (microelectrorecording, MER) [19] a prováděli makrostimulaci pomocí kombinované mikroelektrody (obr. 9) až v pěti paralelních trajektoriích – centrální, laterální, mediální, anteriorní a posteriorní. Kompletní pětici testovacích elektrod jsme simultánně zaváděli pouze v případě STN, a to u většiny nemocných. Různý počet mikroelektrod závisel na anatomickém cíli a konkrétní strategii operačního týmu. Kvalita a kvantita neuronové aktivity určila trajektorii s nejvýraznější aktivitou typickou pro dané jádro (obr. 10). V těchto místech jsme pak provedli makrostimulaci pulzy o trvání 60 μs, frekvenci 130 Hz, amplitudě 0,5 až 5 V. U obou skupin byl hodnocen ústup patologických příznaků (rigidita, akineze, tremor u cíle implantace v STN, tremor při implantaci do VIM) a výskyt vedlejších efektů stimulace. K evaluaci jsme použili stupnici UPDRS III. Celkem byla makrostimulace hodnocena v obou skupinách u 86 pacientů. Výjimku tvořilo 14 nemocných s cílem implantace v GPi. Protože u většiny z nich implantace probíhala v celkové anestezii, výsledky klinických odpovědí na intraoperační stimulaci u těchto nemocných neuvádíme.
Obr. 9. Testovací mikroelektroda. Na obrázku je patrný jemnější zatažitelný „mikro“ konec pro registraci neuronové aktivity a silnější „makro“ část pro testovací stimulaci 
Obr. 10. Mikroregistrace elektrické aktivity z jednotlivých úrovní bazálních ganglií. Voa – ventrální orální anteriorní jádro thalamu, STN – nucleus subthalamicus, SNpr – substantia nigra. 
V případě, že MER aktivita byla dostatečně patrná v centrální trajektorii, začínali jsme vždy s makrostimulací v této pozici a při dobré klinické odpovědi jsme již další exploraci jádra neprováděli.
Po stanovení optimálního místa pro terapeutickou stimulaci byla do tohoto místa za skiaskopické kontroly zavedena KE pro DBS (obr. 11).
Obr. 11. Tvar elektromagnetického pole u jednotlivých typů kvadripolárních elektrod 
Implantace generátoru pulzů – neurostimulátoru
U většiny nemocných s PN a s třesem proběhla implantace stimulátoru do podkožní kapsy v podklíčkové krajině až za několik dní po sérii klinických testů. U pacientů s dystonií bylo vložení neurostimulátoru provedeno v jedné době (obr. 12) bezprostředně po implantaci KE.
Obr. 12. Schéma implantovaného stimulačního systému (elektroda, spojovací kablík, neurostimulátor). 
Přesnost stereotaktické implantace elektrod
Na základě parametrů sledovaných během operace (1.), klinické odpovědi na stimulaci (2.) a výsledků postoperační rtg kontroly pozice elektrod (3.) jsme hodnotili přesnost celé stereotaktické procedury.
1. Intraoperační parametry zahrnovaly:
- a) počet trajektorií testovacích elektrod, ve kterých bylo nutné provést makrostimulaci k ověření správné pozice (čím byla menší četnost /potřeba/ testovacích stimulací, tím přesněji byly elektrody zavedeny do blízkosti vybraného jádra). U tohoto bodu jsme zvlášť hodnotili výsledky operací nemocných s pouhou makrostimulací („makro“ skupina) a zvlášť u implantací skupiny s využitím mikroregistrace („mikro-makro“ skupina). Důvodem byl fakt, že rozdílná technika již z podstaty věci vedla k rozdílným hodnotám;
- b) četnost využití centrální trajektorie pro konečnou implantaci KE;
- c) četnost průchodu centrální trajektorie vybraným jádrem;
- d) počet trajektorií procházejících jádrem;
- e) délku průchodu trajektorie vybrané pro implantaci KE jádrem.
Body c–e jsme hodnotili jen u STN při použití MER a v případě „d“ jen tehdy, pokud bylo použito při MER maximum, tj. všech pět trajektorií, aby byla jednotlivá hodnocení srovnatelná.
2. Klinická odpověď na stimulaci: způsob hodnocení je uveden výše. Na základě klinické reakce jsme dále stanovili nejnižší amplitudu stimulace, která vedla k zřetelnému snížení příznaků, a amplitudu, jež již vyvolávala nežádoucí účinky. Rozdíl těchto hodnot vedl k určení terapeutického intervalu.
3. Kontrola pozice elektrod: závěrečné stereotaktické rentgenové (RTG) vyšetření umožnilo stanovit souřadnice jednotlivých kontaktů KE, a tak provést kontrolu skutečné pozice a srovnání (stanovení diference) předpokládaných koordinát s reálným stavem (obr. 13). Diference (Δ) předpokládaných vypočítaných souřadnic X, Y, Zvyp odpovídajících zamýšlené pozici implantované elektrody a reálných souřadnic X, Y, Zreal získaných z RTG kontroly po výkonu byla stanovena u 32 nemocných (61 pozic elektrod).
Obr. 13. Intraoperační rentgenologická kontrola zanořených elektrod. 
Intraoperační komplikace a komplikace v souvislosti s implantovaným materiálem
Intraoperační morbidita a pooperační komplikace v souvislosti s implantovaným systémem pro DBS byly sledovány u všech nemocných. Komplikace v souvislosti s reimplantací neurostimulátoru pro vybití zdroje elektrické energie nebyly v tomto sdělení hodnoceny.
Výsledky
V našem souboru bylo STN cílem u 66 nemocných, VIM u 20 nemocných a Gpi u 14 nemocných. U dvou pacientů s cílem ve VIM ale KE nebyly nakonec zavedeny. Elektrody byly implantovány tedy celkem (pro všechny cíle) do 187 jader (tab. 2).
Tab. 2. Rozložení implantací do 187 jader bazálních ganglií dle diagnózy. 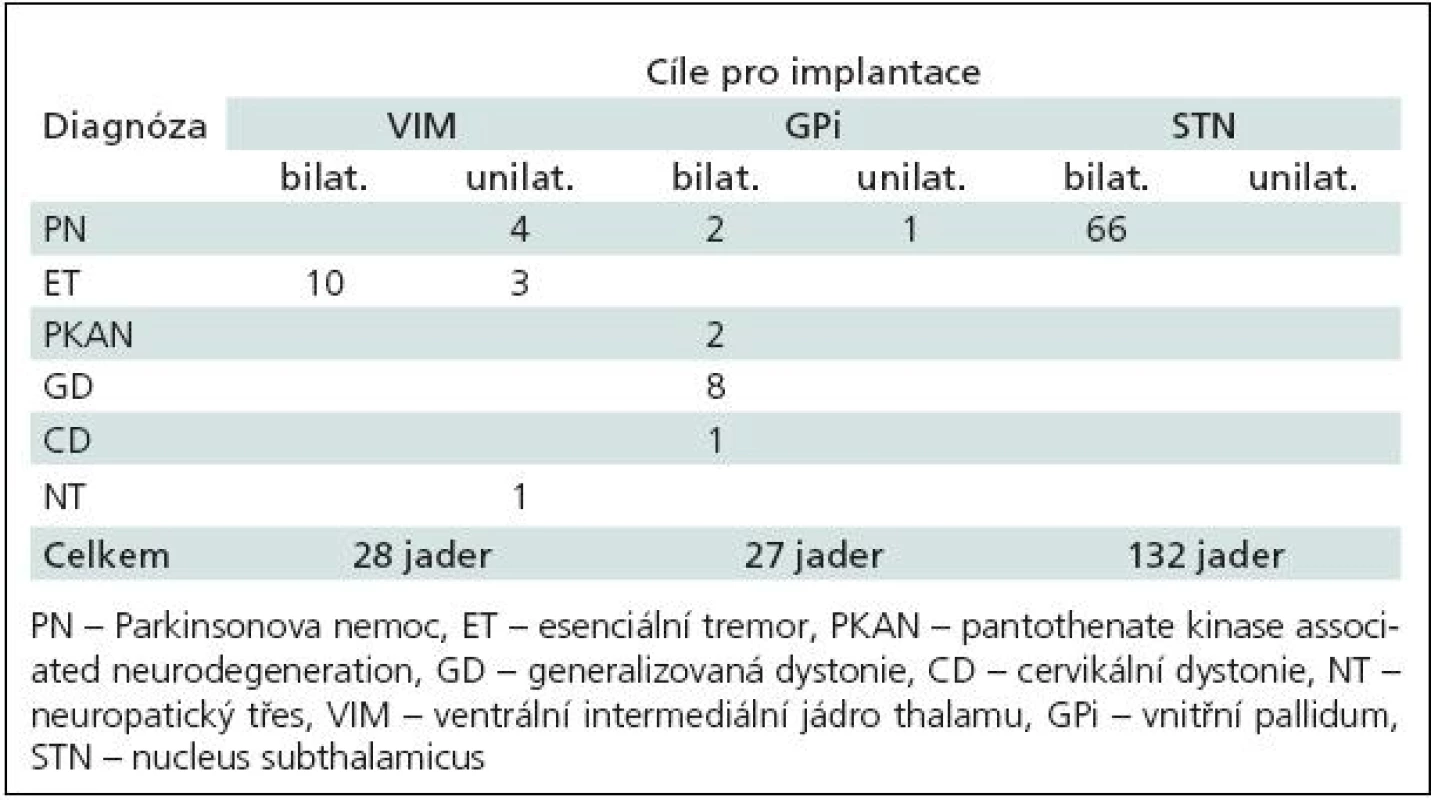
Intraoperační elektrofyziologie a klinické testování
Stereotaktické zaměření s použitím samotné makrostimulace bylo provedeno u 40 jader (VIM, STN). U ostatních cílů byla použita MER samostatně nebo v kombinaci s makrostimulací (tab. 3).
Tab. 3. Rozdělení 187 zaimplantovaných cílů dle jednotlivých jader, použití makro stimulace, microelectrorecordingu a počtu použitých trajektorií. 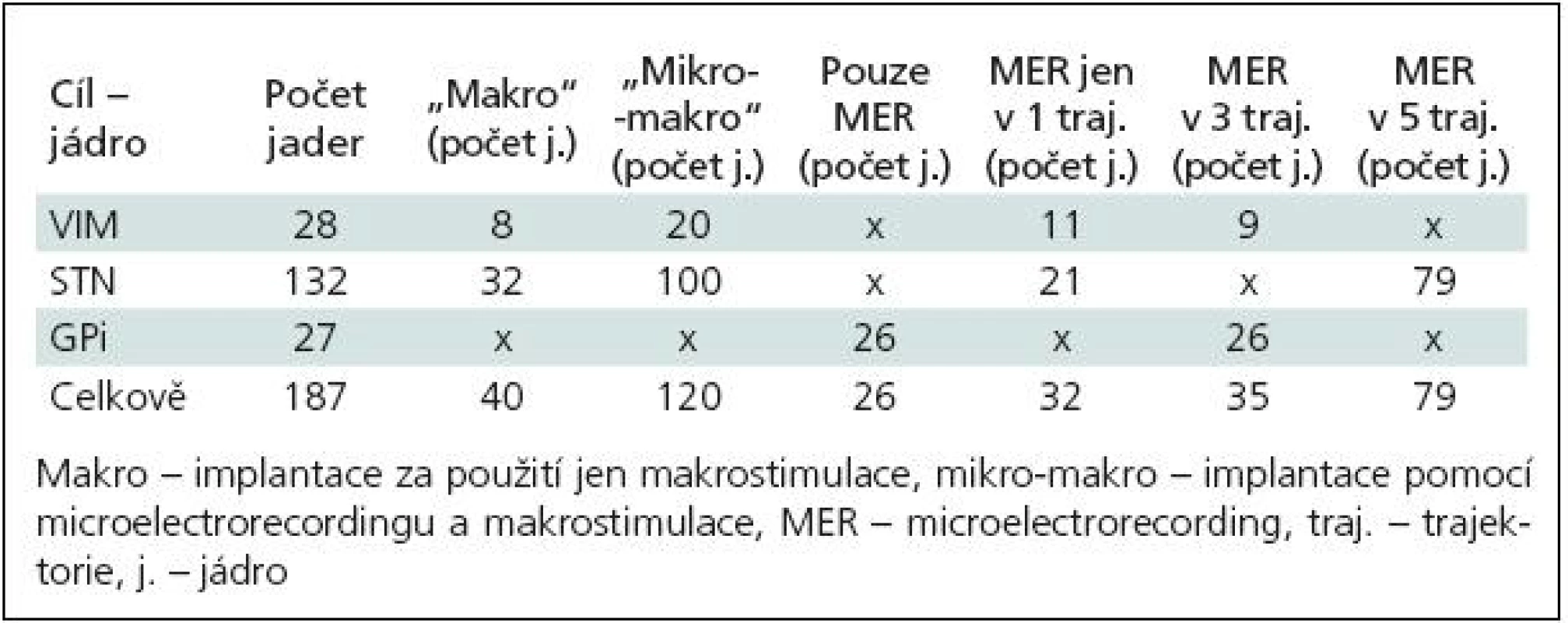
Kompletní intraoperační elektrofyziologie – kombinace MER a makrostimulace – byla provedena u 60 nemocných (120 jader).
Přesnost stereotaktického zobrazení a identifikace jednotlivých jader
a) Četnost použití makroelektrody potřebné k stimulačnímu určení nejlepší pozice KE u obou skupin je uvedeno v tab. 4. V „mikro-makro“ skupině stimulace rozhodovala o konečném výběru finálního umístění KE pouze v 31 případech (25,8 %), kdy MER nabídla více srovnatelných trajektorií.
Tab. 4. Počty trajektorií ve VIM, STN a GPi – 187 jader. 
b) Centrální, tj. původně vypočítaná trajektorie použitá jako konečný cíl pro implantaci KE: v celém souboru zaimplantovaných pacientů (187 jader) se podařilo KE zavést do první, tj. centrální stopy u 106 cílů (56,7 %).
c) V STN souboru v „mikro-makro“ skupině (100 jader) pak centrální stopa procházela cílem v 84 případech (84 %), ale pouze u 51 jader (51 %) byla vyhodnocena jako nejlepší pro konečnou implantaci.
d) Počet trajektorií procházejících STN u „mikro-makro“ pacientů: při zavedení celé pětice mikroelektrod (79 jader) jsme při MER zasáhli STN primárně v 77 (97,5 %) případech (interval skupiny 1–5 mikroelektrod na jádro, medián 3). U dvou jader jsme cíl pro technickou chybu minuli. Po úpravě souřadnic jsme zasáhli úspěšně i tato jádra.
e) Délka trajektorie procházející STN: u definitivní trajektorie se délka průchodu stimulační elektrody jádrem pohybovala od 3 do 7,5 mm (medián 5 mm). Pro přehlednost jsme rozdělení celého souboru podle jednotlivých cílů, použití makrostimulace, MER a dle počtu trajektorií uvedli v tab. 3. Samotné výsledky jsou pak v tab. 4.
Závěrečná pozice elektrod po ukončení implantace
Diference vypočítaných koordinát cíle a reálných souřadnic distálního kontaktu elektrody po dokončení implantace:
a) Diference souřadnice ΔX se pohybovala v rozmezí 0–1,5 mm; medián 0,5 mm; ΔY v intervalu 0–1,7 mm; medián 0,7 mm a ΔZ v rozmezí 0–1,7 mm; medián 0,5 mm (tab. 5).
Tab. 5. Rozdíl koordinát mezi vypočítanou lokalizací konce kontaktu „0“ zavedené elektrody a skutečnou pozicí implantované elektrody (61 elektrod). 
Intraoperační klinická odpověď na stimulaci
Intraoperační klinická odpověď byla vyhodnocena celkem u 160 stimulací (132 jader STN a 28 jader VIM). Výsledky viz tab. 6.
Tab. 6. Klinická odpověď (pokles jednotlivých příznaků na stupeň 0 dle UPDRs) na peroperační stimulaci, nejnižší účinná amplituda unipolární stimulace (60 us, resp. 100 us, 130 Hz) a terapeutický interval (TI) stimulace (28 jader VIM a 132 jader STN). 
Vedlejší účinky intraoperační stimulace
Elektrická stimulace vyvolávala, zejména při vyšších amplitudách stimulu, četné vedlejší klinické příznaky, které jsou uvedeny v tab. 7 a 8. Terapeutické intervaly stimulací, jejichž překročení vyvolávalo vedlejší příznaky, byly uvedeny v předchozím odstavci. V absolutních hodnotách se vedlejší efekty objevovaly při amplitudě stimulu v rozmezí 2–6 V (medián 4 V).
Tab. 7. Vedlejší efekty při testovací stimulaci ve VIM thalamu. 
Tab. 8. Vedlejší efekty při testovací stimulaci v STN (nucleus subthalamicus). 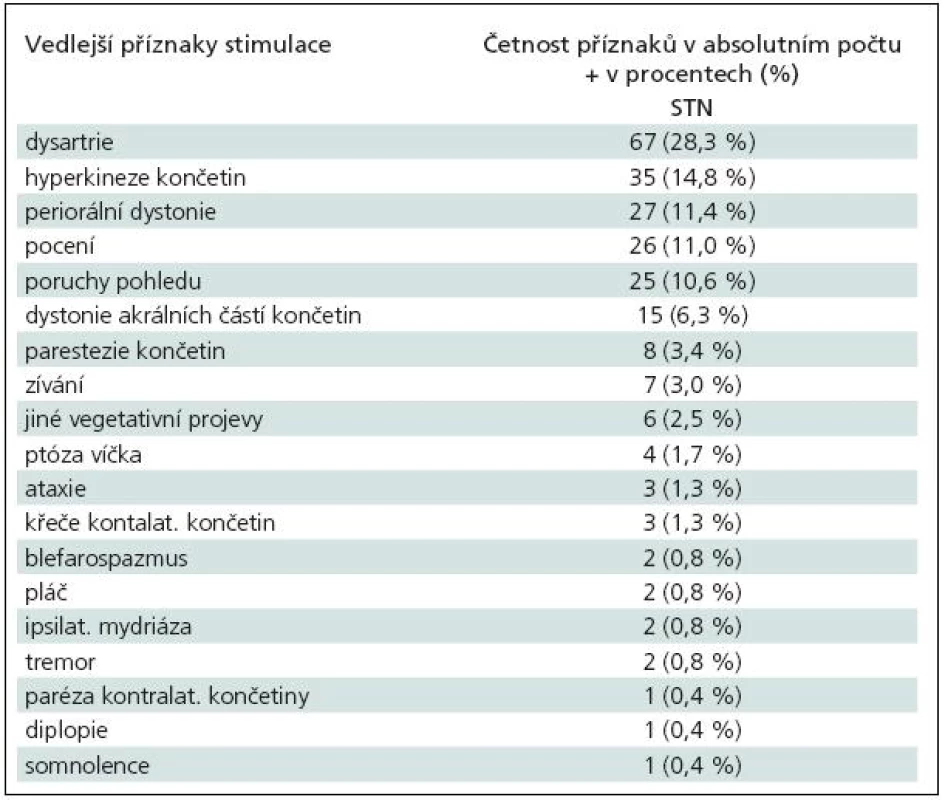
Peroperační komplikace – technické
Technické peroperační problémy nastaly celkem u šesti pacientů (6 %) (tab. 9): u pac. 1 a 8 došlo k nesprávnému umístění elektrody (u pac. 8 byla nutná reimplantace), u pac. 41 a 46 k rozpojení mikroposunovače, u pac. 70 a 77 k chybnému nastavení koordináty „X“. Po korekci všech zmíněných komplikací jsme KE nakonec správně zaimplantovali.
Tab. 9. Peroperační komplikace a komplikace v souvislosti s implantovaným materiálem. Nemocní řazeni dle data implantace elektrod v absolutním pořadí celého souboru. 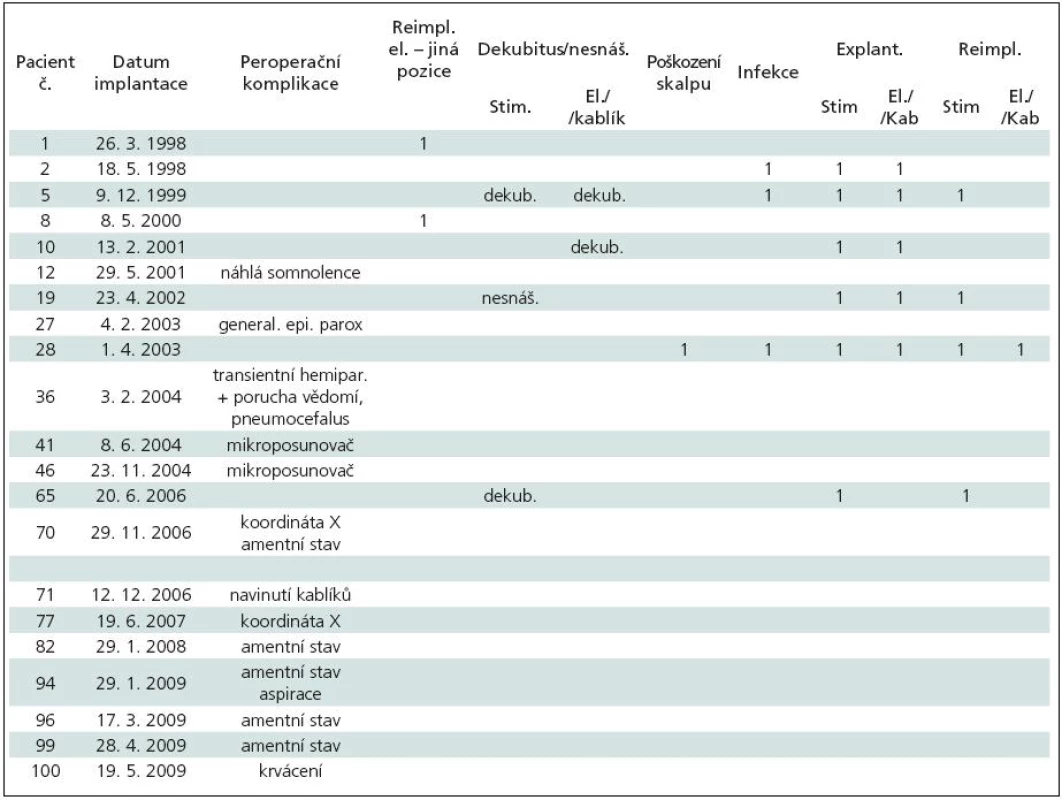
Peroperační komplikace – klinické
Klinické komplikace se objevily celkem u osmi (8 %) nemocných (tab. 9): u tří nemocných (pac. 12, 27, 36) se objevily kvantitativní poruchy vědomí včetně generalizovaného paroxyzmu u jednoho nemocného. U pěti nemocných s PN (pac. 70, 82, 94, 96, 99) se během implantace elektrod objevil amentní stav se zmateností a motorickým neklidem. U pacienta 94 navíc došlo k nadměrné salivaci s aspirací a následným přerušením výkonu. Věk těchto nemocných se pohyboval od 64 do 77 let. Tranzientní ložiskový nález (hemiparéza) s korelátem na CT mozku – rozsáhlý frontální pneumocefalus – se objevil jen u pacientky 36.
Intrakraniální krvácení
U pacienta100 došlo při trepanačním návrtu k poškození tvrdé pleny, přilehlé části kortexu a následnému krvácení z drobných kortikálních cév. Po zastavení krvácení jsme však mohli pokračovat v operaci.
U nikoho z našich nemocných jsme nezaznamenali permanentní neurologickou morbiditu jako následek operace.
Pooperační komplikace v souvislosti s implantovaným materiálem
Komplikace v souvislosti s implantovaným materiálem jsme řešili u sedmi (7 %) nemocných (tab. 9): pozdní infekce a dekubity v oblasti implantovaného materiálu, poškození kablíku zevním úrazem, nesnášenlivost implantovaného materiálu (obr. 14), poškození kablíků po rotaci uvolněného neurostimulátoru v podkožní kapse (obr. 15).
Obr. 14. Poškozený ochranný film stimulátoru. 
Obr. 15. RTG průběhu spojovacích kablíků na šíji – patrné spirálové navinutí způsobené rotací stimulátoru v podkožní kapse. 
Některá z výše uvedených komplikací – klinických, technických, souvisejících s implantovaným materiálem – se vyskytla celkem u 21 (21 %) nemocných, když pacientka č. 70 byla referovaná dvakrát, a to v souvislosti s technickou i klinickou komplikací.
Diskuze
Uvedené výsledky ukazují vysokou přesnost metodiky zaměřování cílových jader. V našem souboru jen u jednoho pacienta musela být pro neuspokojivý klinický efekt elektroda reimplantována do jiné stopy. Protože tento pacient patřil do skupiny „makro“, ve které nebyla elektrofyziologicky prováděna topografie STN, nemůžeme s jistotou říct, zda jsme STN zcela minuli, nebo jen vybrali málo optimální část jádra. V dalších případech jsme pro chybný odečet koordinát a rozpojení mikroposunovače v první fázi cíl nezasáhli, ale po korekci chyb jsme KE přesně zaimplantovali. To, že jsme u dvou nemocných (s diagnózami spinocerebelární degenerace a ET) nenašli dostatečnou odpověď na intraoperační stimulaci VIM, a proto neimplantovali KE, hodnotíme jako nedostatečnou odpovídavost projevů onemocnění na stimulační metodu, protože kontrolní zobrazovací vyšetření prokázala dobrou pozici mikroelektrod. Úspěšnost cílení proto považujeme prakticky za stoprocentní. Také četnost zásahu STN centrální elektrodou v 84 % případech byla velmi dobrá a ve srovnání s literaturou vysoká (např. Guridi et al [20] udávají zásah jádra v 64 %). Využití centrální trajektorie pro konečné uložení permanentní elektrody v 51 % (pro STN), resp. 56,7 % (pro celý soubor) je srovnatelné s jinými centry. Senatus et al [21] použili centrální trajektorii jako konečné uložení KE v 44 %, Amirnovin et al [22] v 42 %, Guridi et al [20] v 55 %, resp. jejich vypočítaná trajektorie byla v 45 % případů více než 3 mm od finální elektrofyziologicky upřesněné pozice elektrody.
Délka nejlepší trajektorie, která procházela u našich nemocných STN jádrem v mediánu 5 mm, odpovídala zkušenostem ostatních autorů. Hamid et al [23] prezentují délku 4,65 mm, McClelland III et al [24] délku 4,5 mm a Amirnovin et al [22] 5,6 mm.
Přesná pozice elektrody dokumentovaná rozdílem koordinát finální elektrofyziologicky upřesněné pozice KE a skutečnou pozicí zjištěnou po implantaci stereotakticky provedeným radiologickým vyšetření měla medián pro jednotlivé souřadnice 0,5 mm (∆X); 0,7 mm (∆Y) a 0,5 mm (∆Z). Podobné výsledky prezentují i Hamid et al [23], a to 0,48 mm pro ∆X; 0,69 pro ∆Y a 2,9 pro ∆Z, kde pouze poslední souřadnice má výrazně větší rozdíl než naše výsledky. Většina ostatních udává jiná měření, a to rozdíl mezi původně zamýšlenou, vypočítanou pozicí elektrody (u nás centrální), a jejím skutečným uložením definovaným většinou pomocí MR [25,26]. Toto měření nebylo v této práci prezentováno. Zjištěné rozdíly považujeme za minimální a i pro účely jemné adjustace, nutné pro vyhledání optimální neuronové populace, za zcela dostačující.
Intraoperační snížení rigidity a zejména tremoru bylo promptní a ve většině případů úplné. Změny rigidity a třesu na testovací intraoperační stimulaci byly také hlavními klinickými příznaky, podle kterých se dolaďovala finální pozice pro implantaci KE. U akinézy však markantní změna byla zaznamenána v podstatně menším počtu případů, a nebyla tak nejdůležitějším ukazatelem peroperační stimulace.
Intraoperační účinná hodnota testovací stimulace o napětí 1 V (medián) ukazovala na správnou pozici elektrody umístěné v blízkosti místa, které nejlépe ovlivňuje uvedené motorické příznaky. Mnozí autoři pozitivní efekt stimulace nesledují, ale pouze zjišťují, zda v daném místě není příliš nízký práh pro vyvolání nežádoucích klinických projevů [27,28]. V našem souboru pacientů monitorovaných pomocí MER (tab. 5) jsme na základě stimulace rozhodli v 25,8 % případů o změně konečné pozice KE. Na rozdíl od zmíněných prací [27,28] byl při potvrzení či odmítnutí vybrané trajektorie kladen hlavní důraz na pozitivní efekt stimulace, tj. na to, zda dojde k vymizení rigidity, resp. tremoru při dostatečně nízké amplitudě stimulu. Vedlejší efekty stimulace byly námi hodnoceny jako méně důležité, a to s ohledem na pozdější možnou habituaci těchto nežádoucích příznaků [29]. Svoji roli hrála ovšem intenzita, trvání i typ příznaků. Přechodná parestezie trvající jen několik sekund po zahájení stimulace nebyla považována za významnou. Výskyt hyperkinezí u stimulace STN jsme nepokládali za nežádoucí projev v pravém smyslu slova, neboť tento příznak je považován za známku dobrého umístění stimulační elektrody [30]. Také deviace pohledu kontralaterálně ke stimulaci nebyla shledána za zásadní důvod ke změně lokalizace elektrody. Nicméně terapeutický interval menší než 1 či 1,5 V pro závažnou nechtěnou stimulační odezvu jako jsou – dysartrie, tonické stahy svalů, monokulární [29] vedlejší efekty stimulace (změna zornice, addukce, deviace bulbu vzhůru či dolů) – považujeme za kritický, při kterém je třeba zvážit výběr jiné trajektorie (v našem souboru se z monokulárních příznaků objevila jen anizokorie). V každém případě platí, že nežádoucí stimulační efekty by se neměly objevit dříve než motorický efekt DBS. Strategie užití MER a testovací stimulace je u různých autorů různá a souhrnný přehled řady center podávají ve svém sdělení Gross et al [28].
Frekvence vedlejších, stimulací vyvolaných, klinických příznaků se také liší dle různých pracovišť. McClelland III et al [27] uvedli u STN stimulace nejčastější vedlejší příznak kontralaterální parestezie, které se objevovaly při průměrné amplitudě stimulu 2,3 V (interval 1,1–4,4 V), a teprve následně dystonické kontrakce či dyskineze, jež byly v průměru vyvolány při amplitudě 2,8 V (interval 0,9–4,6 V). Podle našich zkušeností však senzorické příznaky nejsou nejčastěji se vyskytujícím vedlejším efektem u stimulace STN. V našem souboru se nejčastěji vyskytovaly dysartrie a hyperkineze kontralaterálních končetin. Dysartrie vzniká nejspíše drážděním kortikobulbární dráhy při laterálním šíření elektrického pole a hyperkineze jsou vlastně důsledkem stimulace samotného STN (anatomickou situaci viz obr. 16). U VIM nejčastější vedlejší efekt – parestezie – vzniká buď při dráždění samotného VIM, nebo posteriorně uloženého jádra thalamu (nucleus ventralis caudalis) [31]. V tom případě jsou parestezie jemné, krátce trvající a lokalizované na malý okrsek kontralaterální části těla a jsou podobně jako hyperkineze u STN známkou dobrého uložení elektrody. Šíření proudu kaudálně pod thalamem do blízkosti mediálního lemnisku vyvolává parestezie vyšší intenzity a rozsáhlejší distribuce na končetinách, trupu.
Obr. 16. Anatomicko-funkční mapa bazálních ganglií v okolí STN (upraveno dle [18]). Jednotlivé anatomické oblasti a jejich vztah ke klinické odpovědi na intraoperační stimulaci. a) sagitální rovina; b) koronální rovina ![Obr. 16. Anatomicko-funkční mapa bazálních ganglií v okolí STN (upraveno dle [18]).
Jednotlivé anatomické oblasti a jejich vztah ke klinické odpovědi na intraoperační stimulaci.
a) sagitální rovina; b) koronální rovina](https://pl-master.mdcdn.cz/media/image/b12973caecd0199b21dd879ed536ad5d.jpeg?version=1537790307)
Intraoperační morbidita byla v našem souboru vždy jen přechodná a vyskytla se v 8 % případů. V našem souboru se nevyskytla trvalá morbidita ani mortalita. Zaznamenali jsme jen ojediněle generalizovaný epileptický záchvat (1 %), kvantitativní (2 %) a kvalitativní poruchy vědomí (5 %). Ve větších souborech se epileptické záchvaty vyskytují kolem 3 % případů [32,33]. U našich pacientů s kvantitativní poruchou vědomí byl jen v jednom případě stav způsoben nitrolební afekcí – masivním pneumocefalem. Přechodná kvalitativní porucha vědomí se objevila v našem souboru u nemocných ve vyšší věkové skupině (64 až 77 let). To odpovídá zkušenostem Vespera et al [34] s vyšším výskytem přechodných psychotických stavů po operaci u nemocných starších 65 let. Intraoperačně někteří autoři [35] pozorovali přechodnou zmatenost nemocných až v 21 % případů. Intrakraniální krvácení bylo zaznamenáno v našem souboru u jednoho (1 %) nemocného. Ze zdrojů různých autorů se intraoperační hemoragie vyskytují v rozmezí 1–5 % [36–38]. Další nejčastější komplikací je pooperační infekce. Ta se pohybuje v rozmezí 1–15 % opět dle různých autorů [32–34]. U našich pacientů se primárně vyskytla jen u jedné nemocné a sekundárně u dvou (2 %) pacientů po protětí skalpu při úrazu a sekundární infekcí dekubitu v místě uložení stimulátoru na hrudníku. V žádném případě nedošlo k průniku infekce intrakraniálně. Komplikace v souvislosti s implantovaným materiálem byly přítomny u sedmi (7 %) nemocných a tvořily nejčastější komplikaci u našich nemocných. Blomstedt a Hariz [39] udávají souhrnné komplikace hardwaru v 15 %. Sixel-Döring et al [40] popsali kožní komplikace v souvislosti s DBS v 24,7 % a PN považují dokonce za samostatný rizikový faktor podílející se na jejich vzniku. Naše intraoperační a postoperační chirurgické komplikace se tedy ve srovnání s literaturou pohybovaly v nižším pásmu uvedených rozmezí výskytu.
Závěr
Naše zkušenosti ve shodě s jinými pracovišti ukazují na kvalitativně jiné problémy, se kterými se při implantační proceduře potýkáme, než tomu bylo v éře lezionální stereotaxe. Mozková stimulace rozšiřuje možnosti stereotaxe ve smyslu indikací a extenze výkonů (větší výběr cílů, možnosti bilaterálních zákroků, léčba nových nozologických jednotek) a využívá nové technologické postupy, které s sebou také přinášejí nové otázky. Jde o přechod k přímé vizualizaci cíle pomocí MR, o snahu porozumět mechanizmu elektrické stimulace pomocí intraoperačního elektrofyziologického monitorování či fMR [41]. V neposlední řadě metoda DBS bourá starý vzorec dvou samotářských vlků – indikujícího neurologa a operujícího stereotaktického neurochirurga – a navozuje nutnost týmové spolupráce, která není přerušena ani operačním výkonem.
Naše intraoperační výsledky jsou plně srovnatelné s jinými centry a přinášejí s sebou potenciál sice omezeného (chorobu bohužel vyléčit nedokážeme), ale pro mnohé nemocné užitečného benefitu.
Děkujeme všem spolupracovníkům, kteří se v průběhu 11 let na práci spojené s programem DBS podíleli:
Nemocnice Na Homolce, Praha:
doc. MUDr. Vilibald Vladyka, CSc., doc. MUDr. Roman Liščák, CSc., prof. MUDr. Josef Vymazal, DSc., doc. Ing. Josef Novotný, CSc., MUDr. Filip Růžička, Romana Caklová, Eva Noháčová, Květa Kozerová, Daniela Vymazalová, Petra Hromádková, Michal Schmitt a Květoslav Vtípil.
Neurologická klinika 1. LF UK a VFN:
doc. MUDr. Jan Roth, CSc., MUDr. Tereza Serranová, MUDr. Petra Havránková, MUDr. Tereza Uhrová, MUDr. Petr Dušek, Mgr. Tomáš Sieger, PhDr. Nataša Špačková, Mgr. Olga Klempířová, Mgr. Ondřej Bezdíček, Markéta Fialová, Olga Kučerová a Martin Voleman.
Medtronic:
Ing. Roman Stodůlka, MUDr. Miroslav Buriánek, MBA a Petra Šedivá.
MUDr. Dušan Urgošík, CSc.
Stereotaktická a radiační neurochirurgie
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: dusan.urgosik@homolka.czPřijato k recenzi: 28. 6. 2010
Přijato do tisku: 10. 1. 2011Článek vznikl za grantové podpory: MŠM0021620849, IGA MZ 1A8629-5, GAČR 309/09/1145
Zdroje
1. Benabid AL, Pollak P, Louveau A, Henry S, de Rougemont J. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol 1987; 50(1–6): 344–346.
2. Blond S, Siegfried J. Thalamic stimulation for the treatment of tremor and other movement disorders. Acta Neurochir (Wien) 1991; 52 : 109–111.
3. Benabid AL, Pollak P, Gervason C, Hoffmann D, Gao DM, Hommel M et al. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus. Lancet 1991; 337(8738): 403–406.
4. Siegfried J. Therapeutic stereotactic procedures on the thalamus for motor movement disorders. Acta Neurochir (Wien) 1993; 124(1): 14–18.
5. Pollak P, Benabid AL, Gross C, Gao DM, Laurent A, Benazzouz A et al. Effects of the stimulation of the subthalamic nucleus in Parkinson disease. Rev Neurol (Paris) 1993; 149(3): 175–176.
6. Siegfried J, Lippitz B. Bilateral chronic electrostimulation of ventroposterolateral pallidum: a new therapeutic approach for alleviating all parkinsonian symptoms. Neurosurgery 1994; 35(6): 1126–1129.
7. Benabid AL, Pollak P, Gross C, Hoffmann D, Benazzouz A, Gao DM et al. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson‘s disease. Stereotact Funct Neurosurg 1994; 62(1–4): 76–84.
8. Coubes P, Cif L, El Fertit H, Hemm S, Vayssiere N, Serrat S et al. Electrical stimulation of the globus pallidus internus in patients with primary generalized dystonia: long-term results. J Neurosurg 2004; 101(2): 189–194.
9. Castelnau P, Cif L, Valente EM, Vayssiere N, Hemm S, Gannau A et al. Pallidal stimulation improves pantothenate kinase-associated neurodegeneration. Ann Neurol 2005; 57(5): 738–741.
10. Krause M, Fogel W, Tronnier V, Pohle S, Hörtnagel K, Thyen U et al. Long-term benefit to pallidal deep brain stimulation in a case of dystonia secondary to pantothenate kinase-associated neurodegeneration. Mov Disord 2006; 21(12): 2255–2257.
11. Uc EY, Follett KA. Deep brain stimulation in movement disorders. Semin Neurol 2007; 27(2): 170–182.
12. Ruzicka E, Jech R, Zarubova K, Roth J, Urgosik D. VIM thalamic stimulation for tremor in a patient with IgM paraproteinaemic demyelinating neuropathy. Mov Disord 2003; 18(10): 1192–1195.
13. Volkmann J, Sturm V, Weiss P, Kappler J, Voges J, Koulousakis A et al. Bilateral high-frequency stimulation of the internal globus pallidus in advanced Parkinson’s disease. Ann Neurol 1998; 44(6): 953–961.
14. Růžička E, Urgošík D, Jech R, Serranová T, Volfová M, Roth J et al. Hluboká mozková stimulace v léčbě Parkinsonovy nemoci a třesu: Pražská zkušenost 1998–2003. Cesk Slov Neurol N 2004; 67/100(6): 423–436.
15. Lang AE, Houeto JL, Krack P, Kubu C, Lyons KE, Moro E et al. Deep brain stimulation: preoperative issues. Mov Disord 2006; 21 (Suppl 14): S171–S196.
16. Fahn S, Tolosa E, Maria C. Clinical rating scale for tremor. In: Jankovic J, Tolosa E (eds). Parkinson’s disease and movement disorders. Baltimore: Williams and Wilkins 1993 : 271–280.
17. Novotny J jr, Vymazal J, Novotny J, Tlachacova D, Schmitt M, Chuda P et al. Does new magnetic resonance imaging technology provide better geometrical accuracy during stereotactic imaging? J Neurosurg 2005; 102 (Suppl): 8–13.
18. Schaltenbrand G, Wahren W. Atlas for stereotaxy of the human brain. Stuttgart: Georg Thieme Publishers 1977.
19. Benazzouz A, Breit S, Koudsie A, Pollak P, Krack P, Benabid AL. Intraoperative microrecordings of the subthalamic nucleus in Parkinson‘s disease. Mov Disord 2002; 17 (Suppl 3): S145–S149.
20. Guridi J, Rodriguez-Oroz MC, Lozano AM, Moro E, Albanese A, Nuttin B et al. Targeting the basal ganglia for deep brain stimulation in Parkinson’s disease. Neurology 2000; 55 (Suppl 6): S21–S28.
21. Senatus PB, Teeple D, McClelland S III, Pullman SL, Yu Q, Ford B et al. A technique for minimally altering anatomically based subthalamic electrode targeting by microelectrode recording. Neurosurg Focus 2006; 20(5): E8.
22. Amirnovin R, Williams ZM, Cosgrove GR, Eskandar EN. Experience with microelectrode guided subthalamic nucleus deep brain stimulation. Neurosurgery 2006; 58 (Suppl 1): ONS96–ONS102.
23. Hamid NA, Mitchell RD, Mocroft P, Westby GW, Milner J, Pall H. Targeting the subthalamic nucleus for deep brain stimulation: technical approach and fusion of pre - and postoperative MR images to define accuracy of lead placement. J Neurol Neurosurg Psychiatry 2005; 76(3): 409–414.
24. McClelland S III, Ford B, Senatus PB, Winfield LM, Du YE, Pullman SL et al. Subthalamic stimulation for Parkinson disease: determination of electrode location necessary for clinical efficacy. Neurosurg Focus 2005; 19(5): E12.
25. Andrade-Souza YM, Schwalb JM, Hamani C, Eltahawy H, Hoque T, Saint-Cyr J et al. Comparison of three methods of targeting the subthalamic nucleus for chronic stimulation in Parkinson‘s disease. Neurosurgery 2005; 56 (Suppl 2): 360–368.
26. Breit S, Pegas JF, Koudsie A, Schulz J, Benazzouz A, Pollak P et al. Pretargeting for the implantation of stimulation electrodes into the subthalamic nucleus: a komparative study of magnetic resonance imaging and ventriculography. Neurosurgery 2006; 58 (Suppl 1): ONS83–ONS95.
27. McClelland S III, Kim B, Winfield LM, Ford B, Edwards TA, Pulman SL et al. Microelectrode recording-determined subthalamic nucleus length not predictive of stimulation-induced side effects. Neurosurg Focus 2005; 19(5): E13.
28. Gross RE, Krack P, Rodriguez-Oroz MC, Rezai AR, Benabid AL. Electrophysiological mapping for the implantation of deep brain stimulators for Parkinson‘s disease and tremor. Mov Disord 2006; 21 (Suppl 14): S259–S283.
29. Pollak P, Krack P, Fraix V, Mendes A, Moro E, Chabardes S et al. Intraoperative micro - and macrostimulation of the subthalamic nucleus in Parkinson’s disease. Mov Disord 2002; 17 (Suppl 3): S155–S161.
30. Steigerwald F, Volkmann J. Intra-operative Microrecording and Stimulation. In: Tarsy D, Vitek JL, Starr PA, Okun MS (eds). Deep Brain Stimulation in Neurological and Psychiatric Disorders. Serie: Current Clinical Neurology. Totowa, NJ, USA: Humana Press 2008 : 111–134.
31. Macchi G, Jones EG. Toward an agreement on terminology of nuclear and subnuclear divisions of the motor thalamus. J Neurosurg 1997; 86(4): 670–685.
32. Goodman RR, Kim B, McClelland S III, Senatus PB, Winfield LM, Pullman SL et al. Operative techniques and morbidity with subthalamic nucleus deep brain stimulation in 100 consecutive patients with advanced Parkinson’s disease. J Neurol Neurosurg Psychiatry 2006; 77(1): 12–17.
33. Seijo FJ, Alvarez-Vega MA, Gutierrez JC, Fdez-Glez F, Lozano B. Complications in subthalamic nucleus stimulation surgery for treatment of Parkinson’s disease. Review of 272 procedures. Acta Neurochir (Wien) 2007; 149(9): 867–875.
34. Vesper J, Haak S, Ostertag C, Nikkhah G. Subthalamic nucleus deep brain stimulation in elderly patients – analysis of outcome and complications. BMC Neurol 2007; 7 : 7.
35. Herzog J, Volkmann J, Krack P, Kopper F, Pötter M, Lorenz D et al. Two-year follow-up of subthalamic deep brain stimulation in Parkinson’s disease. Mov Disord 2003; 18(11): 1332–1337.
36. Rezai AR, Kopell BH, Gross RE, Vitek JL, Sharan AD, Limousin P et al. Deep brain stimulation for Parkinson’s disease: surgical issues. Mov Disord 2006; 21 (Suppl 14): S197–S218.
37. Oh MY, Abosch A, Kim SH, Lang AE, Lozano AM. Long-term hardware-related complications of deep brain stimulation. Neurosurgery 2002; 50(6):1268–1274.
38. Beric A, Kelly PJ, Rezai A, Sterio D, Mogilner A, Zonenshayn M, Kopell B. Complications of deep brain stimulation surgery. Stereotact Funct Neurosurg 2001; 77(1–4): 73–78.
39. Blomstedt P, Hariz MI. Hardware-related complications of deep brain stimulation: a ten year experience. Acta Neurochir (Wien) 2005; 147(10): 1061–1064.
40. Sixel-Döring F, Trenkwalder C, Kappus C, Hellwig D. Skin complications in deep brain stimulation for Parkinson’s disease: frequency, time course, and risk factors. Acta Neurochir (Wien) 2010; 152(2):195–200.
41. Jech R, Urgosik D, Tintera J, Nebuzelsky A, Krasensky J, Liscak R et al. Functional magnetic resonance imaging during deep brain stimulation: a pilot study in four patients with Parkinson‘s disease. Mov Disord 2001; 16(6): 1126–1132.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Syndrom neklidných nohouČlánek Hyperkinetická porucha/„Attention Deficit Hyperactivity Disorder“ u dětských pacientů s epilepsiíČlánek SOUTĚŽ ČNSČlánek Oboustranná neurochorioretinitis na podkladě syfilis u 33leté uživatelky pervitinu – kazuistikaČlánek Náhle vzniklá dušnost jako příznak vedoucí k diagnóze amyotrofické laterální sklerózy – kazuistikaČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2011 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Syndrom neklidných nohou
- Využití kombinace metod magnetické rezonance pro diagnostiku tumorů
- Hyperkinetická porucha/„Attention Deficit Hyperactivity Disorder“ u dětských pacientů s epilepsií
- Invazivní mykotické sinusitidy
- Léčba kraniosynostóz remodelační technikou
- SOUTĚŽ ČNS
- Hluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu – stereotaktická procedura a intraoperační nálezy
- Operační léčba poranění peroneálního nervu
- Radioterapií indukované meningeomy
- Oboustranná neurochorioretinitis na podkladě syfilis u 33leté uživatelky pervitinu – kazuistika
- Neurodegenerácia asociovaná s pantotenátkinázou – kazuistika
- Progredující axonální senzitivně-motorická multifokální polyneuropatie u pacientky s chronickou hepatitidou C
- Virus hepatitidy C a nervový systém: Komentář k práci Ambler et al Progredující axonální senzitivně-motorická multifokální polyneuropatie u pacientky s chronickou hepatitidou C
-
The Greenberg Rapid Review. A Companion to the 7th Edition
L. I. Kranzler. - Pacient s Creutzfeldtovou-Jakobovou nemocí se sníženým prokrvením mozku na Tc-99 ECD SPECT v počátcích choroby
- Náhle vzniklá dušnost jako příznak vedoucí k diagnóze amyotrofické laterální sklerózy – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXVI. Hodnocení diagnostických testů – věrohodnostní poměr a diagnostický poměr šancí - Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2011
- Vzpomínky na neurology, s nimiž jsme rádi spolupracovali
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom neklidných nohou
- Operační léčba poranění peroneálního nervu
- Náhle vzniklá dušnost jako příznak vedoucí k diagnóze amyotrofické laterální sklerózy – kazuistika
- Invazivní mykotické sinusitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



