-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSpasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
Post-Stroke Upper Limb Spasticity – Modulation with Botulinum Toxin Type A Therapy and Reflection in Somatosensory Cortical Activation
Introduction:
The aims of the study were to evaluate the therapeutic effect of botulinum toxin type A (BTX-A) in the management of spasticity, and to assess the level of somatosensory cortex activation and modulation with this therapy in patients suffering from cerebral spasticity after subcortical stroke.Methods:
The patient group consisted of 11 men and 6 women, average age 59.6 years, suffering from upper extremity spasticity developed after ischemic stroke in middle cerebral artery territory. The control group consisted of 19 normal subjects with an average age of 58.2 years. BTX-A was injected into the muscles most affected by spasticity. In total, three examinations were performed: before BTX-A administration (K0), four weeks after administration (K1) and 12 weeks after BTX-A administration (K2). The spasticity was evaluated using the modified Ashworth scale of muscle hypertonia (MAS). Somatosensory evoked potentials (SEPs) of the median nerve were examined in both upper extremities, with off-line analysis of P22/N30 and N20/P23 cortical component amplitudes.Results:
A significant decrease was found for median MAS in the affected upper extremity (Wilcoxon’s test for two dependent samples, p ≤0.05) at time point K1, with consequent return to initial values by K2. No significant effect of BTX-A on the cortical components of SEPs was demonstrated among follow-ups (paired t-test, p >0.05). Significantly higher amplitudes of the N20/P23 component above the unaffected hemisphere were detected in patients with right-sided stroke in interindividual comparison (unpaired t-test, p ≤0.05).Conclusion:
Intramuscular administration of BTX-A is among the most effective measures in cerebral spasticity management available at the present time. The lack of SEP amplitude changes suggests that the central effects of BTX-A are probably not mediated through somatosensory cortex activation. Significant differences of N20/P23 amplitudes between patient groups with distinct side of spasticity may suggest differential involvement of the two hemispheres in the development of this movement disorder or in compensation of functional deficit.Key words:
spasticity – botulinum toxin – somatosensory evoked potentials – somatosensory cortex
Autoři: R. Opavský 1,2; P. Otruba 1; M. Vysloužil 3; M. Král 1; P. Hluštík 1; P. Kaňovský 1
Působiště autorů: Neurologická klinika LF UP a FN Olomouc 1; Neurologické odd., Severomoravská nemocniční a. s. – Nemocnice Šternberk o. z. 2; Ústav sociálního lékařství a zdravotní politiky LF UP v Olomouci 3
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(1): 54-59
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce bylo zhodnocení efektu botulotoxinu typu A (BTX-A) v terapii spasticity, posouzení míry aktivace somatosenzitivního kortexu a její ovlivnění touto terapií u pacientů trpících cerebrální spasticitou po proběhlém subkortikálním mozkovém infarktu.Soubor a metodika:
Soubor pacientů zahrnoval 11 mužů a 6 žen s věkovým průměrem 59,6 let trpících spasticitou horní končetiny po proběhlém mozkovém infarktu v povodí arteria cerebri media. Kontrolní skupinu představovalo 19 zdravých dobrovolníků s věkovým průměrem 58,2 let. BTX-A byl aplikován pacientům do nejvíce spastických svalů. Byla provedena celkem tři vyšetření: před aplikací BTX-A (K0), čtyři týdny po aplikaci (K1) a 12 týdnů po aplikaci BTX-A (K2). Spasticita horní končetiny byla hodnocena Modifikovanou Ashworthovou škálou svalového hypertonu (MAS). Somatosenzitivní evokované potenciály (SEP) n. medianus byly vyšetřeny na obou horních končetinách s následným hodnocením amplitud kortikálních komponent P22/N30 a N20/P23.Výsledky:
Byl zjištěn statisticky významný pokles mediánu MAS horní končetiny v kontrole K1 (Wilcoxonův test pro dva závislé výběry, p ≤ 0,05) s následným návratem k původním hodnotám v K2. Nebyl prokázán statisticky významný efekt BTX-A na změny amplitud kortikálních komponent SEP n. medianus mezi kontrolami (párový oboustranný t-test, p > 0,05). Při interindividuálním porovnání byly nalezeny statisticky významně vyšší amplitudy kortikální komponenty N20/P23 nad nepostiženou hemisférou ve prospěch pacientů po proběhlém pravostranném infarktu (nepárový t-test dvoustranný pro shodné rozptyly, p ≤ 0,05).Závěr:
Intramuskulární aplikace BTX-A patří k nejefektivnějším prostředkům v terapii cerebrální spasticity. Nesignifikantní změny amplitud SEP během terapie botulotoxinem zřejmě znamenají, že efekty BTX-A nejsou zprostředkovány aktivací somatosenzitivního kortexu. Signifikantní rozdíly amplitud N20/P23 u pacientů s různou lateralizací postižení by mohly svědčit pro rozdílnou roli obou hemisfér v rozvoji spasticity nebo při kompenzaci funkčního deficitu.Klíčová slova:
spasticita – botulotoxin – somatosenzitivní evokované potenciály – somatosenzitivní kortexÚvod
Spasticita (spastic movement disorder) je definována jako komplexní porucha svalového tonu závislého na rychlosti protažení svalu. Tato porucha svalového tonu je výsledkem zvýšení tonických napínacích spinálních reflexů (myotatické reflexy) [1]. Přesná etiopatogeneze spasticity není známa a je objektem intenzivního výzkumu posledních let. Předpokládá se, že poruchy senzomotorické integrace na různých etážích centrálního nervového systému (CNS) jsou zodpovědné za abnormní zpracování proprioceptivních impulzů vedených proprioceptivními vlákny tříd Ia a II. Následná dysregulace míšních reverberačních okruhů vede k zvýšení svalového tonu, který se manifestuje jako spastická dystonie, a dále k hyperergní svalové odpovědi označované jako spastická svalová odpověď neboli vlastní spasticita [1].
Odhaduje se, že až 39 % pacientů po prvním proběhlém mozkovém infarktu trpí po jednom roce od příhody spasticitou [2]. Spasticita dosahuje maxima do tří měsíců od iktu a bývá kromě poruchy funkce končetiny spojena s bolestmi. Často vede ke kontrakturám s výslednou abnormní posturou končetiny – nejčastěji ve formě addukované a vnitřně rotované paže, flektovaného lokte, zápěstí či sevřené pěsti [3].
Terapeutické postupy k ovlivnění cerebrální spasticity zahrnují řadu modalit. Mezi historicky nejstarší je možno řadit chirurgické výkony na míše, míšních kořenech a periferních nervech, zejména v případech spasticity u pacientů s dětskou mozkovou obrnou. Kromě fyzioterapie jsou dalšími možnostmi léčby perorálně nebo intratékálně aplikovaná myorelaxancia, jejichž použití ale může být limitováno nežádoucími účinky. V posledních letech je v popředí léčby spasticity použití botulotoxinu typu A (BTX-A) [1,4,5].
Komplexní molekula BTX-A funguje jako zinková proteáza a je nejtoxičtější známou látkou vůbec. BTX-A interakcí s proteiny presynaptické části nervosvalové ploténky (tSNARE, vSNARE) způsobuje pokles uvolňování acetylcholinu, a tím blokuje funkci nervosvalové ploténky s následným oslabením svalové kontrakce. BTX-A ovlivňuje nejen funkci nervosvalové ploténky extrafuzálních svalových vláken inervovaných alfa-motoneurony, ale i ploténky intrafuzálních vláken svalových vřetének inervovaných gama-motoneurony a zapojených do proprioceptivních aferentních okruhů [6]. Efekt botulotoxinu se objevuje u spasticity po několika dnech, maxima dosahuje po 3–4 týdnech a odeznívá průměrně za 3–4 měsíce. V klinické praxi existují pozorování, která kromě periferního účinku BTX-A svědčí i pro pravděpodobný efekt centrální. Jedním z nich je časová diskrepance mezi elektrofyziologickým a klinickým efektem BTX-A. K poklesu sumačních svalových akčních potenciálů (CMAP) začíná docházet po 48 hod, maxima je dosaženo po 21 dnech. Klinický efekt nekoreluje zcela s dynamikou elektrofyziologických změn – rozvíjí se většinou během několika dnů až šesti týdnů. Tato pozdní klinická odpověď může být jen obtížně vysvětlena prostou blokádou uvolňování acetylcholinu na nervosvalové ploténce [7]. Mezi další obdobná pozorování můžeme zařadit nízkou míru korelace svalové slabosti v místě aplikace a klinicky příznivým efektem, pozitivní efekt BTX-A na svalové skupiny mimo místo aplikace, zmírnění senzitivních příznaků a frekvence svalových kontrakcí u dystonií a další [7–9]. Předpokládaným mechanizmem, který by mohl vysvětlovat centrální efekty BTX-A, je redukce Ia a II aferentace do CNS s následnými sekundárními změnami, zřejmě způsobenými reorganizací na úrovni centrálních senzitivně-motorických okruhů [1].
Cílem této studie bylo posoudit funkci somatosenzitivního kortexu a její možné ovlivnění terapií BTX-A u pacientů trpících cerebrální spasticitou horní končetiny po ischemickém iktu prostřednictvím parametrů kortikálních komponent somatosenzorických evokovaných potenciálů a dále zhodnocení efektu léčby spasticity botulotoxinem typu A pomocí Modifikované Ashworthovy škály svalového hypertonu (MAS).
Soubor a metodika
Všichni pacienti a zdraví dobrovolníci podepsali informovaný souhlas s účastí ve studii, protokol studie byl schválen etickou komisí FN Olomouc.
V rámci studie bylo vyšetřeno celkem 17 pacientů trpících spasticitou horní končetiny po proběhlém subkortikálním mozkovém infarktu v povodí arteria cerebri media. Do studie byli z této populace zařazeni pouze ti pacienti, u kterých byly při stimulaci n. medianus vybaveny reprodukovatelné a hodnotitelné somatosenzitivní evokované potenciály. Soubor pacientů zahrnoval 11 mužů a 6 žen s věkovým průměrem 59,6 ± 18,2 let. Spasticitou pravé horní končetiny trpělo devět pacientů, spasticitou levé horní končetiny osm pacientů. Dva pacienti se spasticitou pravé horní končetiny byli leváci, ostatní pacienti byli praváci. Dominance končetin určena dle standardizovaného dotazníku Edinburgh Handedness Inventory (leváci –85 ± 5, praváci 93 ± 6,3). Skupiny pacientů byly homogenní z hlediska zastoupení obou pohlaví a lateralizace postižení (chí-kvadrát test; p > 0,05), stejně jako z hlediska věku a doby od proběhlé cévní mozkové příhody do prvního vyšetření (nepárový t-test dvoustranný pro různé rozptyly; p > 0,05). Devatenáct zdravých dobrovolníků tvořilo kontrolní, věkově i pohlavím odpovídající skupinu s věkovým průměrem 58,2 ± 16,3 let (nepárový t-test dvoustranný pro různé rozptyly; p > 0,05 ). Demografická data pacientů jsou uvedena v tab. 1. Spasticita horní končetiny byla vyšetřována zkušeným neurologem a hodnocena Modifikovanou Ashworthovou škálou svalového hypertonu. U všech pacientů zařazených do studie bylo provedeno MR vyšetření mozku na přístroji Magnetom Symphony 1,5T (Siemens, Erlangen, Německo) s použitím standardní hlavové cívky. Přibližné lokalizace a velikosti mozkových infarktů u jednotlivých pacientů byly manuálně okopírovány z odpovídajícího řezu FLAIR sekvence MR mozku do šablony Talaira-chova atlasu v úrovni z-souřadnice +28 mm (obr. 1).
Botulotoxin typu A (BOTOX®, Allergan, Irvine, CA, USA) byl aplikován v dávce 50 IU u všech pacientů do těchto svalů: m. flexor carpi ulnaris, flexor carpi radialis, flexor digitorum profundus a flexor digitorum superficialis. Injekce BTX-A do každého svalu byly vždy prováděny pod EMG kontrolou. Všichni pacienti užívali antiagregační terapii, proto k zamezení krvácení byla prováděna digitální komprese každého místa vpichu po dobu aspoň jedné minuty. Po 15 minutách bylo každé místo aplikace vizuálně zkontrolováno.
Somatosenzorické evokované potenciály nervus medianus byly vyšetřeny na obou horních končetinách všech pacientů a zdravých dobrovolníků pomocí přístroje Keypoint®. Nervus medianus byl stimulován v oblasti zápěstí. Byla provedena celkem tři vyšetření: před aplikací BTX-A (K0), v době předpokládaného maximálního účinku BTX-A čtyři týdny po aplikaci (K1) a 12 týdnů po aplikaci BTX-A (K2), kdy se očekává odeznění jeho efektu. Byly použity stimuly s čtvercovým průběhem vlny trvající 0,1 ms o intenzitě 1,5násobku motorického prahu vyvolávajícího pohyb palce ruky. Frekvence stimulace 5 Hz byla použita pro všechna vyšetření. Kortikální komponenty byly detekovány Ag/AgCl registračními elektrodami v pozicích C4´, C4+, C3´,C3+ odpovídajícím mezinárodnímu systému 10–20. Jako referenční elektroda byly použity spojené ušní lalůčky. Signál byl filtrován v rozsahu 1-2 000 Hz, časová základna byla 50 ms. Při každém vyšetření byly zprůměrňovány hodnoty 500 stimulací s dvěma repeticemi. Vrcholy jednotlivých detekovaných vln byly označeny podle nomenklatury publikované Donchinem a Desmedtem [10]. Amplitudy mezi vrcholem precentrální vlny N30 a předchozí pozitivní vlnou P22, dále amplitudy mezi vrcholem postcentrální vlny P23 a předchozí negativní vlnou N20 byly odečítány z výsledku superpozice jednotlivých běhů vyšetření. Hodnoty peak-to-peak amplitud kortikálních komponent detekovaných skalpovými elektrodami v pozici C3´ a C4´ pro komponentu P22/N30 a v pozici C3+ a C4+ pro komponentu N20/P23 byly následně testovány pomocí t-testu.
Výsledky
Výsledky jsou shrnuty v tab. 1 a 2, v grafu 1 a obr. 1.
Obr. 1. Lokalizace mozkových infarktů na úrovni z-souřadnice +28 mm Talairachova atlasu. 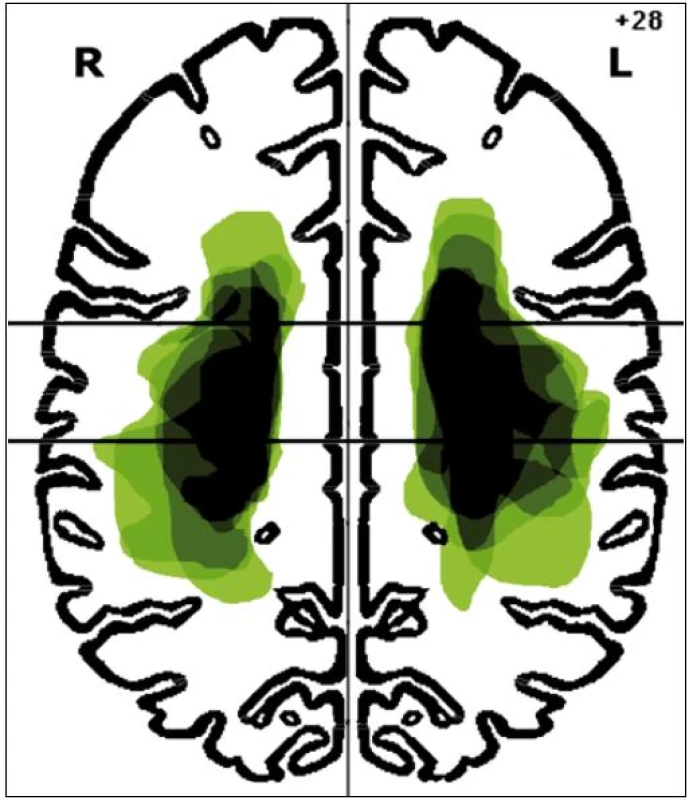
Obě skupiny pacientů s různou lateralizací spastické končetiny byly homogenní při srovnání míry spasticity na počátku studie vyjádřené hodnotou MAS skóre flexorů prstů i flexorů ruky v K0 (Wilcoxonův test pro dva nezávislé výběry; p > 0,05). Byl zjištěn statisticky významný pokles spasticity flexorů prstů i flexorů ruky vyjádřený hodnotou MAS v období maximálního předpokládaného efektu BTX-A, tj. při vyšetření K1 ve srovnání se vstupní hodnotou při vyšetření v K0 (Wilcoxonův test pro dva závislé výběry, flexory ruky:levostranná spasticita – p = 0,016, pravostranná spasticita – p = 0,016; flexory prstů: levostranná spasticita – p = 0,008, pravostranná spasticita – p = 0,031). Tato tvrzení platí jednak pro obě skupiny pacientů s různou lateralizací spasticity, ale i po sloučení obou skupin pacientů na základě společného faktoru – spasticity. Hodnota mediánu MAS skóre obou svalových oblastí ve skupině všech pacientů poklesla z 3 v K0 na 2 v K1. U šesti pacientů s levostrannou spasticitou a sedmi pacientů s pravostrannou spasticitou došlo k poklesu hodnoty MAS aspoň v jedné svalové skupině. Při vyšetřeních v K2 po 12 týdnech od aplikace BTX-A byl pozorován nárůst hodnoty mediánu MAS opět na hodnotu 3 pro obě svalové skupiny v souboru všech pacientů. Rozdíl v míře spasticity v obou svalových skupinách mezi kontrolami K0 a K2 nebyl statisticky významný (Wilcoxonův test pro dva závislé výběry; p > 0,05). Hodnoty jsou uvedeny v tab. 1.
Tab. 1. Demografická a klinická data pacientů. 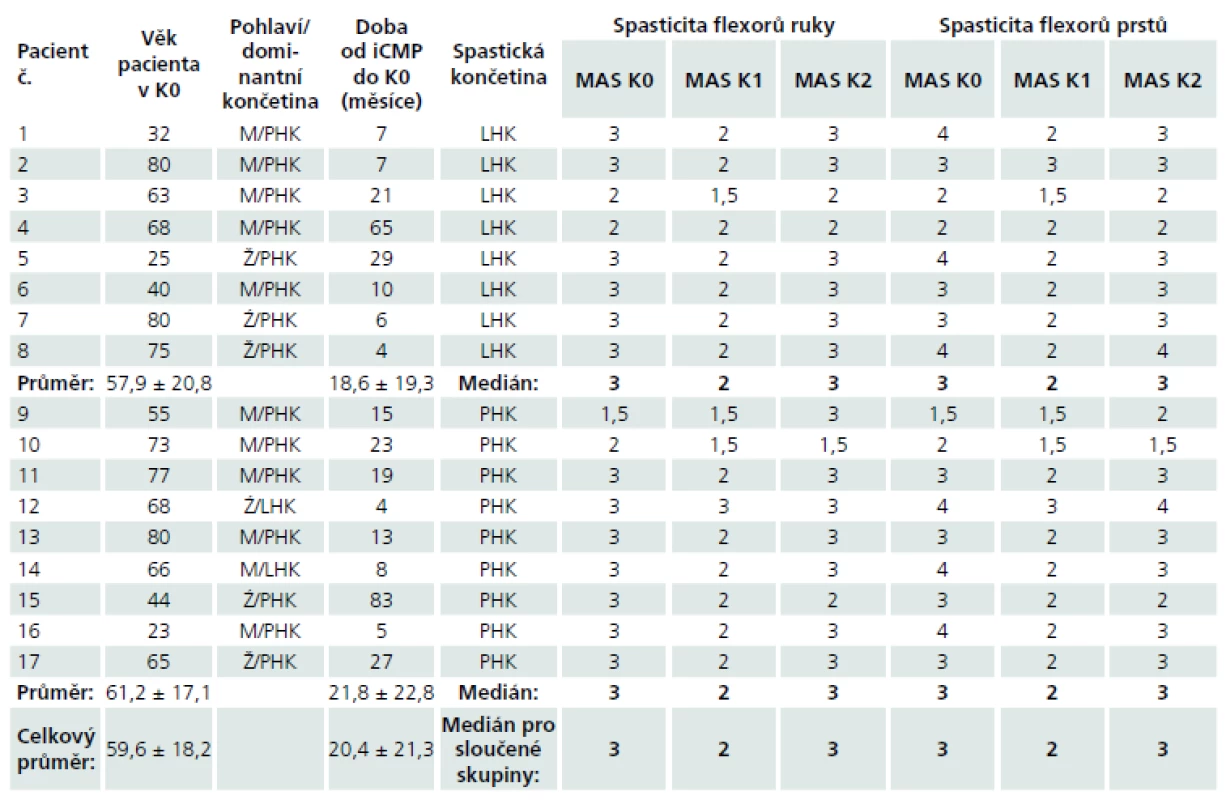
M – muž, Ž – žena, PHK – pravá horní končetina, LHK – levá horní končetina Při analýze dat amplitud jednotlivých kortikálních komponent SEP nebyly nalezeny mezi jednotlivými kontrolami v čase (K0, K1, K2) jejich statisticky významné změny (párový oboustranný t-test; p > 0,05) při intraindividuálním srovnání výsledků získaných při stimulaci jednotlivých končetin (hodnoty amplitud uvedeny v tab. 2).
Tab. 2. Průměrné hodnoty a směrodatné odchylky amplitud kortikálních komponent SEP u pacientů a zdravých dobrovolníků po stimulaci jednotlivých končetin, vyjádřeno v μV. 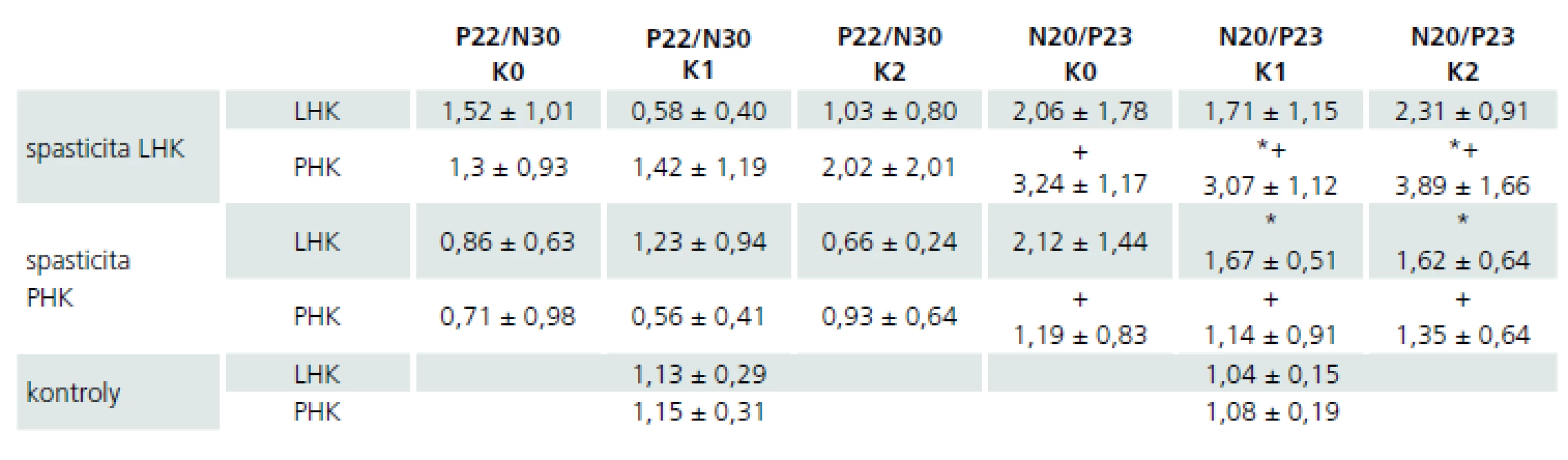
LHK – levá horní končetina, PHK – pravá horní končetina. Symboly + a * indikují statisticky významné rozdíly mezi oběma skupinami pacientů Dále při interindividuálním porovnání hodnot amplitud N20/P23 získaných stimulací spastických končetin byly hodnoty u pacientů s levostrannou spasticitou vyšší než u pacientů s opačnou lateralizací postižení při všech kontrolách, ale tento rozdíl nedosahoval statistické významnosti (nepárový t-test dvoustranný pro shodné rozptyly; p > 0,05) (tab. 2, graf 1).
Graf 1. Průměrné hodnoty amplitud N20/P23 po stimulaci jednotlivých končetin u pacientů a u zdravých dobrovolníků. 
Při interindividuálním porovnání hodnot amplitud N20/P23 získaných stimulací nepostižených končetin byly zjištěny statisticky významně vyšší (nepárový t-test dvoustranný pro shodné rozptyly) tyto hodnoty u pacientů s nepostiženou pravou horní končetinou ve srovnání s nepostiženou levou horní končetinou při kontrolách K1 (p = 0,0099) a K2 (p = 0,0214), v kontrole K0 nedosahoval obdobný rozdíl statistické významnosti (p > 0,05) (tab. 2, graf 1).
Při interindividuálním porovnání hodnot amplitud N20/P23 získaných stimulací pravostranných končetin byly tyto hodnoty statisticky významně vyšší (nepárový t-test dvoustranný pro shodné rozptyly) u pacientů s nepostiženou pravou horní končetinou ve srovnání s postiženou horní končetinou stejné lateralizace ve všech kontrolách (K0: p = 0,0015; K1: p = 0,0058; K2: p = 0,0126) (tab. 2, graf 1). Při obdobném srovnání levostranných končetin nebyly statisticky signifikantní rozdíly nalezeny (nepárový t-test dvoustranný pro shodné rozptyly; p > 0,05).
Při intraindividuálním porovnání amplitud P22/N30 a N20/P23 získaných stimulací každé končetiny ve skupině všech pacientů, v obou podskupinách dle lateralizace postižení i ve skupině zdravých dobrovolníků nebyly zjištěny statisticky významné pravo-levé rozdíly bez ohledu na lateralizaci spastické končetiny (nepárový t-test dvoustranný pro shodné rozptyly; p > 0,05).
Hodnoty amplitud N20/P23 získané stimulací obou horních končetin byly ve skupině pacientů s levostrannou spasticitou ve všech kontrolách statisticky signifikantně vyšší než hodnoty amplitud ve skupině zdravých dobrovolníků (nepárový t-test dvoustranný pro různé rozptyly, levostranné končetiny p = 0,026; pravostranné končetiny p = 0,0069) (tab. 2, graf 1). Při porovnání amplitud N20/P23 pacientů s pravostrannou spasticitou se skupinou zdravých dobrovolníků nebyl podobný statisticky signifikantní rozdíl pozorován (nepárový t-test dvoustranný pro různé rozptyly; p > 0,05).
Rozdíly při obdobných srovnáváních hodnot amplitud P22/N30 mezi skupinami pacientů se spasticitou i se skupinou zdravých dobrovolníků pak nedosahovaly statistické významnosti ani v jednom případě (nepárový t-test dvoustranný pro různé rozptyly; p > 0,05).
Diskuze
Studie prokázala statisticky významné snížení hodnoty skóre MAS spasticity horní končetiny vlivem terapie botulotoxinem typu A u pacientů po proběhlém subkortikálním infarktu v povodí arteria cerebri media ve srovnání se vstupním vyšetřením. Maximální efekt, pozorovaný v období čtyř týdnů po aplikaci BTX-A, byl po 12 týdnech od aplikace u většiny pacientů následován návratem k původním hodnotám MAS zjištěným před zahájením terapie. Tento výsledek je v souladu se závěry dosud publikovaných nečetných dvojitě zaslepených studií s relativně malými počty pacientů, které studovaly efekt BTX-A u spasticity vzniklé po cerebrálním infarktu [11,12] i na jiných modelech spasticity. Je tedy možno konstatovat, že intramuskulární aplikace BTX-A do postižených svalů patří v současné době mezi nejoptimálnější terapeutické postupy v managementu spastického hypertonu vzniklého na podkladě supratentoriální ložiskové léze.
V prezentované studii nebyl potvrzen vliv léčby botulotoxinem typu A na excitabilitu somatosenzitivního kortexu vyjádřenou změnou hodnot amplitud kortikálních komponent SEP. Je možno spekulovat, že centrální – vzdálené efekty BTX-A u cerebrální spasticity mohou souviset se změnami ve zpracování proprioceptivních signálů v jiných, zřejmě subkortikálních, etážích CNS [9]. Předpokládaný efekt BTX-A na excitabilitu somatosenzitivního kortexu vycházel z recentně v literatuře popsaných změn lateralizace komponenty P22/N30 po terapii botulotoxinem u pacientů trpících fokální dystonií [13]. Dosud publikované nečetné práce, které studovaly změnu SEP vlivem terapie BTX-A na spasticitu u dětské mozkové obrny, se dobraly rozporuplných závěrů [14,15].
Je spíše méně pravděpodobné, že se na vzniku těchto změn může kromě funkčního ovlivnění podílet i retrográdní transport a transcytóza BTX-A, které byly demonstrovány na animálních modelech, ale dosud nikdy nebyly prokázány v humánní studii [16].
V předložené studii byly dále nalezeny zvýšené hodnoty amplitud postcentrální komponenty N20/P23 nad oběma hemisférami u pacientů s pravostranným mozkovým infarktem, tedy s levostrannou spasticitou, ve srovnání s pacienty s opačně lateralizovaným postižením. Statistické významnosti dosahoval tento rozdíl nad nepostiženou (kontralezionální) hemisférou.
Tento nález zvýšené aktivace primárních somatosenzitivních kortikálních oblastí, kde je N20/P23 komponenta generována, je zřejmě ovlivněn několika faktory. Jednak faktem, že skupina pacientů s levostrannou spasticitou zahrnovala výhradně praváky – tedy šlo o postižení nedominantní horní končetiny. S touto skutečností souvisí poznatek, že i u zdravých praváků je kortikální kontrola pohybu nedominantní končetinou odlišná od pohybu končetinou dominantní. Je to dáno výraznějším bilaterálním charakterem kortikální aktivace v případě končetiny nedominantní [17]. Dalším faktorem, který je nutno vzít v úvahu, je významná kontralezionální aktivace primárních senzitivně-motorických oblastí detekovaná v různých funkčně zobrazovacích studiích u pacientů se subkortikálním mozkovým infarktem během motorických úloh [18–21].
Rozdíly amplitud N20/P23 nad nepostiženými hemisférami pacientů, zvýšené hodnoty amplitud komponenty N20//P23 nad nepostiženou hemisférou ve skupině pacientů s levostrannou spasticitou a neprokázaný pravo-levý interhemisferální rozdíl amplitud u pacientů i zdravých dobrovolníků pravděpodobně svědčí pro diferentní aktivaci somatosenzitivních kortexů v závislosti na lateralizací mozkového infarktu [22].
Zjištěné rozdíly v aktivaci somatosenzitivního kortexu obou hemisfér u pacientů s rozdílnou lateralizací ložiskové subkortikální léze pravděpodobně souvisejí s nerovnoměrnou aktivací dalších, zejména motorických, kortikálních oblastí, jak prokázaly některé předchozí studie [23]. Poněvadž je somatosenzitivní kortex významnou měrou zapojen do regulace motorických okruhů, nemusí být tyto výsledky překvapením. Nalezená diferentní aktivace somatosenzitivního kortexu u pacientů s různou lateralizací spasticity může být také vysvětlena výraznější atenuací inhibičních (GABA zprostředkovaných) procesů s jejím následným šířením do kontralaterální hemisféry prostřednictvím transkalózních drah v případě pravostranné subkortikální léze [22,24,25]. Další alternativou je možnost rozdílné role obou somatosenzitivních kortexů při rozvoji spastické poruchy pohybu. Amplitudy postcentrálních komponent SEP měřené na skalpu jsou funkcí excitability somatosenzitivního kortexu. Platí tedy, že kortex schopný výraznější excitace na základě periferního stimulu generuje komponentu SEP s vyšší amplitudou. Vyšší excitabilita je neoddělitelně spojena se sníženou intrakortikální inhibicí, jak bylo prokázáno v našich předchozích studiích [26]. Snížená, tj. fakticky porušená intrakortikální inhibice většinou doprovází enhancované synaptické děje označované termínem kortikální plasticita. Je tedy docela dobře možné, že každá z hemisfér (či částí kortexu některé z hemisfér) má různou roli při snaze o korekci spastického hypertonu. Obdobný důkaz byl demonstrován v recentní fMR studii [27].
Problémem při interpretaci dat může být nemožnost odlišení vlivu spasticity samotné od možného efektu funkční kompenzace neurologického (motorického) deficitu na výsledném obrazu kortikální somatosenzitivní aktivace, ačkoliv tyto jevy spolu úzce souvisí. Na některé z těchto otázek v budoucnu jistě odpoví širší implementace zobrazovacích metod (fMR), která v naší skupině pacientů právě probíhá. Přínosem bude rovněž dokonalejší stratifikace pacientské populace dle rozsahu a lokalizace mozkových infarktů a s tím spojená vyšší „homogenita“ postižených nervových traktů.
Interpretaci výsledků také částečně znesnadňují rozporuplná data ze studií srovnávajících amplitudy SEP nervus medianus nad oběma hemisférami u zdravých dobrovolníků [28,29].
Závěr
Prezentovaná studie potvrdila účinnost intramuskulární aplikace botulotoxinu typu A v léčbě cerebrální spasticity. Zjištěné abnormity v aktivaci somatosenzitivního kortexu reprezentované amplitudovými rozdíly postcentrální komponenty N20/P23 mohou souviset s různou úlohou obou hemisfér v rozvoji nebo úpravě spasticity.
Práce podpořena grantem IGA MZ ČR registrační číslo NS/9920-4/2008.
MUDr. Robert Opavský
Neurologické odd.
Severomoravská nemocniční a.s. – Nemocnice Šternberk o.z.
Jívavská 20
785 01 Šternberk
e-mail: robert.opavsky@centrum.cz
Zdroje
1. Kaňovský P, Bareš M, Dufek J. Spasticita – mechanismy, diagnostika a léčba. 1st ed. Praha: Maxdorf 2004.
2. Sommerfeld DK, Eek EU, Svensson AK, Holmqvist LW, von Arbin MH. Spasticity after stroke: its occurrence and association with motor impairments and activity limitations. Stroke 2004; 35(1): 134–139.
3. Shaw L, Rodgers H. Botulinum toxin type A for upper limb spasticity after stroke. Expert Rev Neurother 2009; 9(12): 1713–1725.
4. Simpson DM, Gracies JM, Yablon SA, Barbano R, Brashear A. Botulinum neurotoxin versus tizanidine in upper limb spasticity: a placebo-controlled study. J Neurol Neurosurg Psychiatry 2009; 80(4): 380–385.
5. Ozcakir S, Sivrioglu K. Botulinum toxin in poststroke spasticity. Clin Med Res 2007; 5(2): 132–138.
6. Breidenbach MA, Brunger AT. New insights into clostridial neurotoxin-SNARE interactions. Trends Mol Med 2005; 11(8): 377–381.
7. Giladi N. The mechanism of action of botulinum toxin type A in focal dystonia is most probably through its dual effect on efferent (motor) and afferent pathways at the injected site. J Neurol Sci 1997; 152(2): 132–135.
8. Trompetto C, Bove M, Avanzino L, Francavilla G, Berardelli A, Abbruzzese G. Intrafusal effects of botulinum toxin in post-stroke upper limb spasticity. Eur J Neurol 2008; 15(4): 367–370.
9. Currà A, Trompetto C, Abbruzzese G, Berardelli A. Central effects of botulinum toxin type A: evidence and supposition. Mov Disord 2004;19 (Suppl 8): S60–S64.
10. Donchin E, Callaway E, Cooper R. Publication criteria for studies of evoked potentials in man. In: Desmedt JE (ed). Attention, voluntary contraction and event-related potentials. Progress in clinical neurophysiology. 1st ed. Basel: Karger 1977 : 1–11.
11. Cardoso E, Rodrigues B, Lucena R, Oliveira IR, Pedreira G, Melo A. Botulinum toxin type A for the treatment of the upper limb spasticity after stroke: a meta-analysis. Arq Neuropsiquiatr 2005; 63(1): 30–33.
12. Rosales RL, Chua-Yap AS. Evidence-based systematic review on the efficacy and safety of botulinum toxin-A therapy in post-stroke spasticity. J Neural Transm 2008; 115(4): 617–623.
13. Kanovský P, Streitová H, Dufek J, Znojil V, Daniel P, Rektor I. Change in lateralization of the P22/N30 cortical component of median nerve somatosensory evoked potentials in patients with cervical dystonia after successful treatment with botulinum toxin A. Mov Disord 1998; 13(1): 108–117.
14. Boćkowski L, Okurowska-Zawada B, Sobaniec W, Kułak W, Sendrowski K. Cortical somatosensory evoked potentials and spasticity assessment after botulinum toxin type A injection in children with cerebral palsy. Adv Med Sci 2007; 52 (Suppl 1): 171–175.
15. Park ES, Park CI, Kim DY, Kim YR. The effect of spasticity on cortical somatosensory-evoked potentials: changes of cortical somatosensory-evoked potentials after botulinum toxin type A injection. Arch Phys Med Rehabil 2002; 83(11): 1592–1596.
16. Antonucci F, Rossi C, Gianfranceschi L, Rossetto O, Caleo M. Long-distance retrograde effects of botulinum neurotoxin A. J Neurosci 2008; 28(14): 3689–3696.
17. Kim SG, Ashe J, Hendrich K, Ellermann JM, Merkle H, Uğurbil K et al. Functional magnetic resonance imaging of motor cortex: hemispheric asymmetry and handedness. Science 1993; 261(5121): 615–617.
18. Feydy A, Carlier R, Roby-Brami A, Bussel B, Cazalis F, Pierot L et al. Longitudinal study of motor recovery after stroke: recruitment and focusing of brain activation. Stroke 2002; 33(6): 1610–1617.
19. Zemke AC, Heagerty PJ, Lee C, Cramer SC. Motor cortex organization after stroke is related to side of stroke and level of recovery. Stroke 2003; 34(5): e23–e28.
20. Ward NS, Newton JM, Swayne OB, Lee L, Thompson AJ, Rothwell JC et al. Motor system activation after subcortical stroke depends on corticospinal system integrity. Brain 2006; 129(3): 809–819.
21. Schaechter JD, Perdue KL, Wang R. Structural damage to the corticospinal tract correlates with bilateral sensorimotor cortex reorganization in stroke patients. Neuroimage 2008; 39(3): 1370–1382.
22. Ekusheva EV, Vendrova MI, Danilov AB, Vein AM. The contributions of the right and left hemispheres of the brain to the polymorphism and heterogeneity of pyramidal syndrome. Neurosci Behav Physiol 2005; 35(3): 229–234.
23. Tecchio F, Zappasodi F, Tombini M, Caulo M, Vernieri F, Rossini PM. Interhemispheric asymmetry of primary hand representation and recovery after stroke: a MEG study. Neuroimage 2007; 36(4): 1057–1064.
24. Liepert J, Storch P, Fritsch, Weiller A. Motor cortex disinhibition in acute stroke. Clin. Neurophysiol 2000; 111(4): 671–676.
25. Chollet F, DiPiero V, Wise RJ, Brooks DJ, Dolan RJ, Frackowiak RS. The functional anatomy of motor recovery after stroke in humans: a study with positron emission tomography. Ann Neurol 1991; 29(1): 63–71.
26. Kanovský P, Bareš M, Streitová H, Klajblová H, Daniel P, Rektor I. Abnormalities of cortical excitability and cortical inhibition in cervical dystonia Evidence from somatosensory evoked potentials and paired transcranial magnetic stimulation recordings. J Neurol 2003; 250(1): 42–50.
27. Senkárová Z, Hlustík P, Otruba P, Herzig R, Kanovský P. Modulation of cortical activity in patients suffering from upper arm spasticity following stroke and treated with botulinum toxin A: an fMRI study. J Neuroimaging 2009; 20(1): 9–15.
28. Kakigi R, Shibasaki H. Effects of age, gender, and stimulus side on scalp topography of somatosensory evoked potentials following median nerve stimulation. J Clin Neurophysiol 1991; 8(3): 320–330.
29. Jung P, Baumgärtner U, Bauermann T, Magerl W, Gawehn J, Stoeter P et al. Asymmetry in the human primary somatosensory cortex and handedness. Neuroimage 2003; 19(3): 913–923.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
3.–5. 11. 2010, Clarion Congress Hotel Ostrava
Neurochirurgická klinika Fakultní nemocnice Ostrava - Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Neurologie v České a slovenské neurologii a neurochirurgii
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
-
Botulotoxin v léčbě spasticity horní končetiny po cévní mozkové příhodě
Komentář k práci Opavského et al. Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci - Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Komentář k článku J. Michalika et al Extrémna hypertrofia periférnych nervových štruktúr pri CIDP
- Nokardiové abscesy mozku – dvě kazuistiky
- Komentář k práci Krajina et al Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Komentář ke komentáři Masopust et al k práci Matoušek et al Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Komentář k minimonografii Ošlejšková et al Autizmy: Poruchy autistického spektra v pohledu biomedicíny
- Prof. MUDr. Vladimír Beneš, DrSc., st. – devadesát let
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Monitoring pacientů s těžkým poraněním mozku
- Webové okénko
-
Analýza dat v neurologii
XXV. Hodnocení diagnostických testů – senzitivita a specificita
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



