-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Posttraumatický hypopituitarizmus u dětí a dospívajících
Post-traumatic Hypopituitarism in Children and Adolescents
Hypothalamic-pituitary axis failure significantly affects morbidity in subjects after moderate to severe brain injury. Post-mortem histopathological studies have demonstrated the vulnerability of the hypothalamus and pituitary to external injury. Endocrine changes in the first hours and days after an accident are usually transient and comparable to those observed at other critical stages (known as “sick syndrome”). Frequent and expected complications usually include temporary disturbances of water metabolism. These changes may take the form of diabetes insipidus and can be identified as inappropriate antidiuretic hormone secretion syndrome. Both of these are consequences of transient neuropituitary dysfunction. Hormonal changes that occur months or even years after an accident were once considered exceptional. This view has changed over the past decade in view of the results of several studies in adults that give the prevalence of post-traumatic hypopituitarism at between 23 and 69%. Substantially less is known about the prevalence and implications for neuro-endocrine dysfunction in the pediatric population compared to that in adults. Untreated hormonal disturbances may have significant and permanent impacts upon a child’s mental and physical development. This article provides basic information about trauma-induced hormonal dysfunction in children and adults.
Key words:
brain injury – post-traumatic hypopituitarism
Autoři: J. Zapletalová 1; D. Aleksijević 1; V. Smolka 1; D. Krahulík 2
; Z. Fryšák 3
Působiště autorů: LF UP a FN Olomouc Dětská klinika 1; LF UP a FN Olomouc Neurochirurgická klinika 2; LF UP a FN Olomouc III. interní klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(4): 398-401
Kategorie: Přehledný referát
Souhrn
Porucha hypothalamo-hypofyzární osy může u jedinců po středně těžkém až těžkém úrazu mozku významným způsobem ovlivňovat jejich morbiditu. Histopatologické studie prováděné post mortem prokázaly, že oblast hypothalamu a hypofýzy je značně vulnerabilní vůči zevním inzultům. Endokrinní změny v prvních hodinách a dnech po úrazu jsou obvykle přechodné a srovnatelné se změnami pozorovanými u jiných forem kritických stavů (tzv. sick syndrome). Častou a očekávanou komplikací je (obvykle) dočasná porucha vodního hospodářství (diabetes insipidus nebo syndrom nepřiměřené sekrece adiuretinu) v důsledku tranzitorní dysfunkce neurohypofýzy. Hormonální změny, ke kterým dochází za měsíce až roky po úrazu, byly považovány za výjimečné. Tento pohled se změnil v průběhu uplynulého desetiletí, kdy četné studie prováděné u dospělých udávají prevalenci posttraumatického hypopituitarizmu mezi 23–69 %. U pediatrické populace je o výskytu a významu neuroendokrinní dysfunkce známo méně než u dospělých, přitom nepoznaná, a tedy neléčená hormonální porucha může významně a natrvalo negativně ovlivnit tělesný vývoj. Práce přináší základní informace o traumatem indukované hormonální dysfunkci u dětí a dospělých.
Klíčová slova:
úraz mozku – posttraumatický hypopituitarizmusPodpořeno výzkumným projektem IGA NR-9245-3
Úvod
Úrazy mozku (TBI) u dětí a dospívajících jsou celosvětově považovány za závažný zdravotnický problém a jsou jednou z hlavních příčin závažné morbidity a mortality. V zemích Evropské unie a USA je v průměru ročně zaznamenáno 250 případů na 100 000 dětí a dospívajících. Incidence je dvakrát vyšší u chlapců než u dívek. Nejpočetnější skupinou jsou adolescenti ve věku 15–19 let a druhý vrchol tvoří nejmladší děti do 5 let věku. Příčinou TBI jsou u menších dětí především pády a fyzické týrání (u dětí 0–2 roků tzv. shaken baby syndrome vede ve více než 50 % k nejzávažnějším poraněním), u starších dětí sportovní aktivity a u adolescentů dopravní nehody [1–3]. Důsledky středně těžkého až těžkého cerebrálního poranění jsou často velmi závažné – od fyzického postižení přes psychické problémy a logické sociální důsledky. Porušení integrity a funkce hypothalamo-pituitárních struktur může vést k přechodné nebo trvalé neuroendokrinní dysfunkci a přispívat k následné morbiditě u přeživších jedinců.
Historie
Zatímco asociace mezi poraněním mozku a rozvojem diabetes insipidus (DI) je známa od roku 1886 [4], posttraumatický hypopituitarizmus (PTH) byl popsán poprvé v roce 1918 [5] a po dlouhá léta byl považován za výjimečný a referován pouze kazuisticky. Tento pohled se změnil v posledních 10 letech, kdy četné studie prováděné u dospělých pacientů po těžkých úrazech mozku prokázaly poměrně vysokou prevalenci traumatem indukované hormonální poruchy [6]. Sledování endokrinních funkcí přitom nepatří k algoritmu rutinní péče o pacienty po úrazu mozku a posttraumatický hypopituitarizmus může být přehlédnut nebo být maskován dominujícími neurologickými příznaky a obecnou poúrazovou symptomatologií (únava, porucha koncentrace, deprese...).
Mechanizmus vzniku neuroendokrinní poruchy
Hormonální porucha může vzniknout buď přímým zasažením hypothalamu či hypofýzy včetně její stopky, nebo častěji nepřímo v důsledku mozkové hypoxie, edému, krvácení anebo ischemie. Tupá uzavřená traumata jsou častější příčinou přímého ohrožení hypofýzy než penetrující poranění, protože podvěsek mozkový je proti přímému inzultu chráněn tureckým sedlem. Velmi rizikovou oblastí je stopka, v níž probíhají arterie a portální vény, které jednak zásobují adenohypofýzu kyslíkem, jednak také přímo ovlivňují hormonální sekreci přívodem stimulačních nebo inhibičních hypothalamických faktorů. Zadní lalok (neurohypofýza) není krví zásobován přes stopku, ale přes zadní hypofyzární arterie, proto je méně vulnerabilní. Je zajímavé, že portální vény mohou i regenerovat, což vysvětluje existenci tzv. tranzitorní adenohypofyzární insuficience.
Cévní zásobení centrální oblasti adenohypofýzy je zajišťováno krátkými portálními cévami (kortikotropní buňky), její zevní část je vyživována (70–90 %) dlouhými portálními cévami (somatotropní a gonadotropní buňky) jdoucími přes diafragma selly, které jsou více náchylné na mechanický inzult. Proto je nejčastěji porušena tvorba růstového hormonu (STH) a gonadotropinů (GnH) [6] – tzv. hierarchie buněčné vulnerability (obr. 1).
Obr. 1. Schéma cévního zásobení a hormonální produkce v hypothalamu a v hypofýze (upraveno podle Pearson Education, Inc., publishing as Benjamin Cummings). 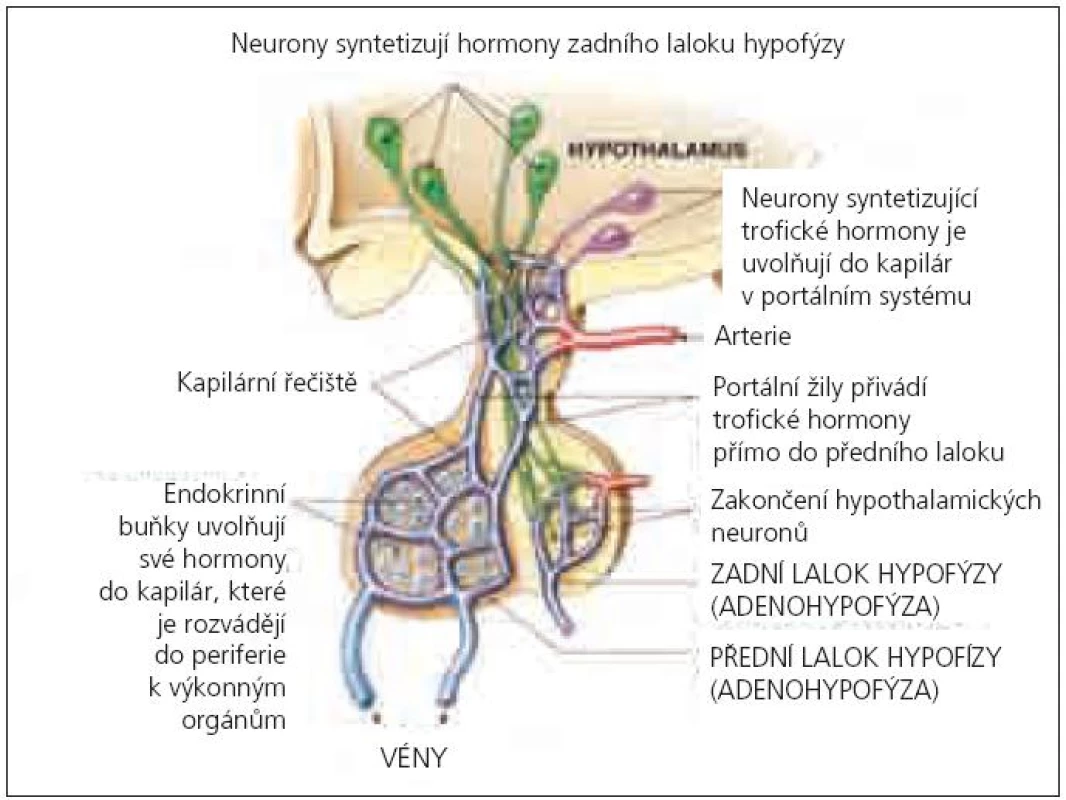
Riziko postižení adenohypofýzy bylo popisováno především u fraktur baze lební, ale je zřejmé, že častý výskyt je i u těžkých traumat bez postižení skeletu v důsledku zvýšeného nitrolebního tlaku [7]. Histopatologické studie u pacientů zemřelých po mozkovém traumatu prováděné od roku 1970 nevykazují jednotné nálezy. Anatomické léze hypothalamo-hypofyzární oblasti jsou uváděny u 14–74 % zemřelých bez rozdílu věku a potvrzují predispozici k postižení předního hypothalamu a adenohypofýzy [8,9]. Děti separátně hodnoceny nebyly, přestože Harper zkoumal post mortem nálezy u 106 pacientů od 0,7 do 85 let (38 % subjektů mělo ischemické a hemoragické léze v předním laloku hypofýzy) [10]. Zatím není přesvědčivě prokázáno, zda dětský mozek reaguje na sekundární inzult odlišně od mozku dospělého. Teorii o zvýšené vulnerabilitě u pediatrických pacientů potvrzují studie vývojové odlišnosti mitochondriálních funkcí nezralého mozku, které vedou k buněčné apoptóze po hypoxicko-ischemickém inzultu [11,12]. Zobrazovací metody (magnetická rezonance nebo počítačová tomografie) provedené u dospělých pacientů s prokázaným PTH vykazují nejčastěji hemoragické léze v hypothalamu (29 %), krvácení do zadního laloku (26,3 %) a infarkty v předním laloku (25 %) podvěsku mozkového. Vzácnější je přerušení stopky hypofýzy (3,9 %) a infarkty v zadním laloku (1,3 %) [7].
Akutní poúrazová fáze
Neodkladná péče je logicky soustředěna na změny vyvolané traumatem a na zachování vitálních funkcí. V tomto období je hormonální dysbalance vnímána především jako porucha vodního hospodářství. Hypernatremie provázející DI je známou komplikací akutního poúrazového stavu [13] a vyskytuje se zhruba u 26 % dospělých pacientů. Může být tranzitorní s následnou remisí nebo dokonce přechodem do syndromu nepřiměřené sekrece adiuretinu (SIADH), který ale nakonec zhruba u 6 % nemocných přechází do trvalého DI (tzv. trojitá reakce). DI vyžaduje okamžitou suplementaci tekutin a léčbu adiuretinem (ADH). Při léčbě je nutné trvalé monitorování centrálního žilního tlaku a natremie [14]. Při hyponatremii může jít o SIADH nebo cerebrální syndrom solné ztráty (CSWS). Odlišení SIADH a CSWS je nezbytné, protože každá z klinických jednotek vykazuje odlišný terapeutický přístup (tab. 1) [15]: u SIADH restrikci tekutin a naopak hydrataci a dodávku elektrolytů u CSWS, při neúspěchu i podání mineralokortikoidů [16]. Incidence CSWS syndromu u neurochirurgických pediatrických pacientů sledovaných 72 hod po úrazu se pohybuje kolem 10 % [17,18].
Tab. 1. Klinické a laboratorní ukazatele u syndromu nepřiměření sekrece adiuretinu (SIADH) a cerebrálního syndromu solné ztráty (CSWS) [16]. ![Klinické a laboratorní ukazatele u syndromu nepřiměření sekrece adiuretinu (SIADH) a cerebrálního syndromu solné ztráty (CSWS) [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6eb1efd7e0ac24d1e2de8d3210d1aede.jpeg)
Ostatní hormonální změny, k nimž dochází několik hodin po úrazu, jsou srovnatelné se změnami hypothalamo-hypofyzární osy pozorovanými u jiných forem kritických stavů (tzv. sick syndrome nebo wasting syndrome). Není zcela jasné, zda k nim dochází v důsledku přímých strukturálních změn nebo (a to je pravděpodobnější) jsou spíše výrazem adaptivních změn organizmu. Uznávanou hypotézou je inhibice sekrece anabolických hormonů – tyreotropinu (TSH), GnH a STH, která vede k redukci výdaje energie a zachování metabolických zdrojů nutných k udržení funkcí pro život důležitých orgánů, jako je mozek, kardiovaskulární systém, ledviny apod. Stresové hormony, jako prolaktin (PRL), kortikotropin (ACTH), bývají naopak zvýšené [19].
U většiny pacientů jsou tyto změny tranzitorní a nevyžadují, s výjimkou porušené tvorby vazopresinu, žádnou léčbu.
Pozdní fáze
Souvislost pozdních následků po úrazu mozku s následnou hormonální poruchou je často opomíjena, přestože výsledky četných retrospektivních a ojedinělých prospektivních longitudinálních studií u dospělých vykazují prevalenci vzniku poruchy alespoň jedné hormonální osy mezi 28–69 % (tab. 2). Klinická diagnostika PTH je u dospělých obtížnější než u dětí, protože symptomy jsou obvykle neurčité (únava, poruchy koncentrace, nárůst hmotnosti, poruchy sexuální apetence...) a mohou být skryté za neurologickou symptomatologií nebo dávány do souvislosti s psychickým traumatem (tab. 3). Z Bevengovy metaanalýzy [6] z roku 2000 vyplývá, že k manifestaci hormonálního deficitu dochází nejčastěji během 6 až 12 měsíců po úrazu, ale není vyloučen i interval několika týdnů až několika let. Nejčastěji bývá postižena osa somatotropní a gonadotropní. Nebylo prokázáno, že tíže úrazu je v přímé korelaci se vznikem endokrinní poruchy. Hodnocené skupiny byly poměrně rozdílné s ohledem na věk pacientů a interval od úrazu.
Tab. 2. Posttraumatický hypopituitarizmus u dospělých [6]. ![Posttraumatický hypopituitarizmus u dospělých [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c1f7b3df42902f31da9b0e6c3deb3862.jpeg)
Tab. 3. Hormony předního laloku hypofýzy a hlavní symptomy provázející poruchu jejich tvorby. 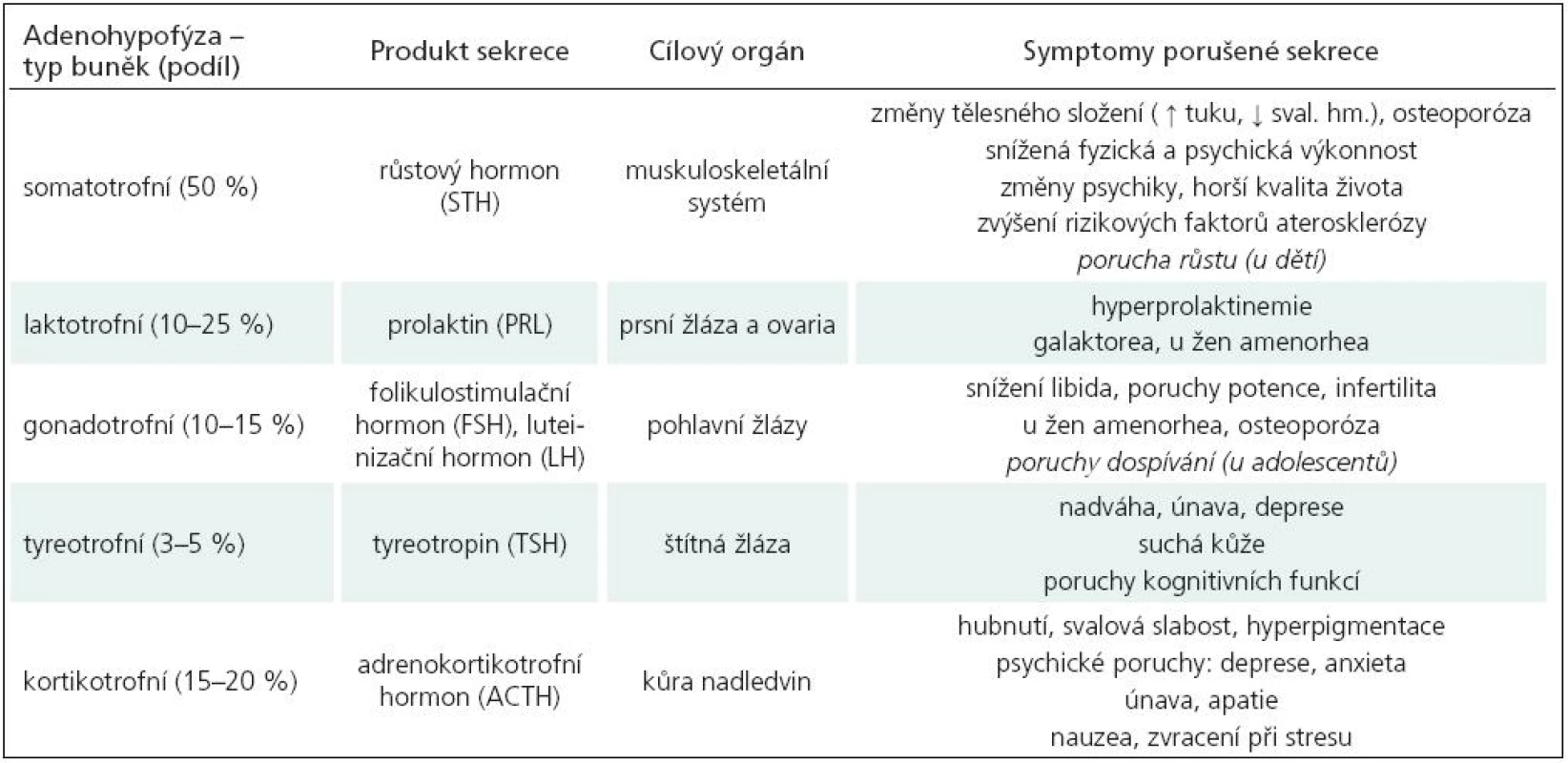
U pediatrické (dětské a adolescentní) populace jsou projevy endokrinní dysfunkce nápadnější – zasahují obvykle růst a pohlavní vývoj, ale podobně jako u dospělých se mohou částečné hormonální endokrinní deficity projevovat velmi nenápadně. Rozhodně je o výskytu PTH u dětí a jeho vlivu na morbiditu a mortalitu známo ještě méně než u dospělých, stejně jako o možnostech a efektu léčby. Z výsledků publikovaných retrospektivních studií je zřejmé, že frekvence PTH je u dětí významně nižší než u dospělých [20–23]. Tyto nálezy z části potvrzuje i Pfizer International Growth Study (KIGS), která shromažďuje v rámci farmako-epidemiologického registru údaje o pacientech s deficitem růstového hormonu. V roce 2008 byly publikovány údaje o zhruba 62 000 dětských a adolescentních pacientech léčených somatotropním hormonem, mezi kterými bylo pouze 141 jedinců, u nichž byl deficit růstového hormonu zapříčiněn mozkovým úrazem [24]. Důvodem může být větší odolnost dětského mozku vůči zevním inzultům, ale tento předpoklad nemá oporu v nálezech postmortem, kde jsou strukturální změny stejné u dětí jako u dospělých, nebo ve studiích, které naopak prokazují, že dětský mozek má menší reparační a regenerační schopnosti [11,12].
Pravděpodobnější se jeví skutečnost, že většina dětí po mozkových úrazech není z tohoto hlediska systematicky sledována, a podobně jako u dospělých je možná hormonální insuficience maskována všeobecnou poúrazovou symptomatologií nebo neurologickými příznaky, na něž je soustředěna následná péče. Situace u dětí je závažnější, protože u jedince s nedokončeným tělesným vývojem může nepoznaná, a tedy neléčená hormonální porucha významně a natrvalo negativně ovlivnit tělesný růst, pohlavní dozrávání a neurokognitivní funkce.
Závěr
Dlouhodobé následky mozkových úrazů jsou komplexnější než se dříve předpokládalo. Jedním z nich může být i hormonální porucha, která se může projevit v akutní i pozdní posttraumatické fázi a být přechodná nebo trvalá. Především u dětských pacientů je nutné hormonální poruchu včas diagnostikovat. Nejčastěji bývá postižena osa gonadotropní a somatotropní, které základním způsobem ovlivňují růst a pohlavní vývoj. Ke klinickým příznakům patří především zpomalení růstového tempa a předčasný (častěji) nebo opožděný nástup dospívání, jak jsme se přesvědčili u našeho retrospektivně sledovaného souboru pacientů.
Vzhledem k prokázané vysoké prevalenci PTH je nutné zařadit do algoritmu péče o pacienty po úrazech mozku i endokrinologické vyšetření. U každého dětského a adolescentního pacienta po kraniocerebrálním poranění by mělo být nejen posouzeno, zda jeho tělesný vývoj odpovídá věku, ale také provedeno alespoň základní hormonální vyšetření, a to jak v akutní fázi, tak i v časovém odstupu (optimálně 6–12 měsíců) bez ohledu na jeho klinický stav.
Adekvátní hormonální léčba může významným způsobem zlepšit kvalitu života a ovlivnit proces úzdravy.
doc. MUDr. Jiřina Zapletalová, Ph.D.
Dětská klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: jirina.zapletalova@fnol.czPřijato k recenzi: 11. 2. 2010
Přijato do tisku: 8. 4. 2010
Zdroje
1. Masson F, Salmi LR, Maurette P, Dartigues JF, Vecsay J, Garros B et al. Characteristics of head trauma in children: epidemiology and 5-years follow up. Arch Pediatr 1996; 3(7): 651–660.
2. Schneier AJ, Schields BJ, Hostetler SG, Xiang H, Smith GA. Incidence of pediatric traumatic brain injury and associated hospital resource utilization in the United States. Pediatrics 2006; 118(2): 483–492.
3. Brichtová E. Analýza souboru pacientů s kraniocerebrálním poraněním léčených na Pracovišti dětské medicíny FN Brno v období let 2000–2007. Cesk Slov Neurol N 2008; 71/104(4): 466–471.
4. Kahler O. Die dauernde Polyurie als cerebrales Herdsymptom. Z Heilk 1886; 7 : 105–220.
5. Cyran E. Hypophysisenschadigung durch Schadel-basis fracture. Dtsch Med Wochenschr 1918; 44 : 1261–1270.
6. Benvenga S, Campenni A, Ruggeri RM, Trimarchi F. Clinical review 113: hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000; 85(4): 1353–1360.
7. Urban RJ, Harris P, Massel B. Anterior hypopituitarism following traumatic brain injury. Brain Inj 2005; 19(5): 349–358.
8. Ceballos R. Pituitary changes in head trauma (analysis of 102 consecutive cases of head injury). Ala J Med Sci 1966; 3(2): 185–198.
9. Crompton MR. Hypothalamic lesions following closed head injury. Brain 1971; 94(1): 165–172.
10. Harper CG, Doyle D, Adams JH, Graham DI. Analysis of abnormalities in pituitary gland in non-missile head injury: study of 100 consecutives cases. J Clin Pathol 1986; 39(7): 769–773.
11. Gaetz M. The neurophysiology of brain injury. Clin Neurophysiol 2004; 115(1): 4–18.
12. Robertson CL, Soane L, Siegel ZT, Fiskum G. The potential role of mitochondria in pediatric traumatic brain injury. Dev Neurosci 2006; 28(4–5): 432–446.
13. Agha A, Rogers B, Myllote D et al. Neuroendocrine dysfunction in the acute phase of traumatic brain injury. Clin Endocrinol 2004; 60(5): 584–591.
14. Agha A, Sherlock M, Phillips J, Tormey W, Thompson CJ. The natural history of posttraumatic neurohypophysial dysfunction. Eur J Endocrinol 2005; 152(3): 371–377.
15. Albanese A, Hidmarsh P, Stanhope R. Management of hyponatremia in patients with acute cerebral insult. Arch Dis Child 2001; 85(3): 246–251.
16. Einaudi S, Bondone C. The effects of head trauma on hypothalamic-pituitary function in children and adolescents. Curr Opin Pediatr 2007; 19(4): 465–470.
17. Palmer BF. Hyponatremia in patients with central nervous system disease: SIADH versus CSW. Trends Endocrinol Metab 2003; 14 (4): 182–187.
18. Jiménez R, Casado-Flores J, Nieto M, García-Teresa MA. Cerebral salt wasting syndrome in children with acute central nervous injury. Pediatr Neurol 2006; 35(4): 261–263.
19. Woolf PD. Hormonal response to trauma. Crit Care Med 1992; 20(2): 216–226.
20. Sockalosky JJ, Kriel RL, Krach LE, Sheehan M. Precocious puberty after traumatic brain injury. J Pediat 1987; 110(3): 373–377.
21. Goldman M, Shahar E, Sack J, Meyerovitch J. Assessment of endocrine function in children following severe head trauma. Pediatr Neurol 1997; 17(4): 339–343.
22. Einaudi S, Matarazzo P, Peretta P, Grossetti P, Giordano F, Altare F et al. Hypothalamo-hypophysial dysfunction after traumatic brain injury in children and adolescents: a preliminary retrospective and prospective study. J Pediatr Endocrinol Metab 2006; 19(5): 691–703.
23. Poomthavorn P, Maixner W, Zacharin M. Pituitary function in paediatric survivors of severe traumatic brain injury. Arch Dis Child 2008; 93(2): 133–137.
24. McDonald A, Lindell M, Dunger DB, Acerini CL. Traumatic brain injury is a rarely reported cause of growth hormone deficiency. J Pediatr 2008; 152(4): 590–593.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Webové okénkoČlánek Neurovaskulární kongres 2010
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Farmakologická léčba epilepsie
- Ložiskové léze CNS u pacientů s HIV infekcí
- Tkáňové kultury pro studium prionových chorob
- Funkční význam pólu temporálního laloku
- Problematika indikace operační léčby u intramedulárních lézí
- Posttraumatický hypopituitarizmus u dětí a dospívajících
- Mozková flebotrombóza – analýza série 33 nemocných
- Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
- Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Syndrom spontánní intrakraniální hypotenze u čínské pacientky s autozomálně dominantní polycystickou nemocí ledvin – kazuistika
- Unilaterální hypoplazie bazálních ganglií u pacientky s epilepsií – kazuistika
- Neobvyklé iatrogenní poranění n. musculocutaneus – dvě kazuistiky
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXII. Rozbor složitějších kontingenčních tabulek je účinným nástrojem pro studium vztahů kategoriálních znaků - Neurovaskulární kongres 2010
- Jsou dekomprese páteřního kanálu a opakované zpevnění páteře u transverzální léze hrudní míchy nutné?
-
III. neuromuskulární kongres
6.–7. května 2010, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Funkční význam pólu temporálního laloku
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



