-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
Neuro-endocrine Dysfunction in Children and Adolescents after Brain Injury
Background:
Neuro-endocrine dysfunction after traumatic brain injury is found in 23–60% of adult patients. Objectives: To evaluate growth, pubertal development and endocrine function in children and adolescents after traumatic brain injury. Patients and methods: We evaluated growth, pubertal development and bone age in 30 patients (18 boys) after traumatic brain injury. They underwent standard endocrine tests – thyreotropin, free thyroxin, insulin-like growth factor, prolactin, morning cortisol, gonadotropins, testosterone (in boys) and oestradiol (in girls). Dynamics tests were performed in patients with abnormalities revealed by clinical examination and/or laboratory results. Median patient age at the time of brain trauma was 9.7 (0.4–14.8) years; 75% of patients were prepubertal. Their range of Glasgow Coma Scale (GCS) was 3–12 (11 of these <8). Results: Diabetes insipidus was observed in three patients and syndrome of inappropriate adiuretine hormone secretion in a further three. The period since trauma ranged from 26 to 36 months (median 29 months). We found growth hormone deficiency in two boys (in one of them combined with thyreotropin deficiency and diabetes insipidus; precocious puberty in one girl (8.3 years) and one boy (7 years); and hypogonadotrophic hypogonadism in one adolescent girl masked by taking contraceptives pills. Conclusion: We found neuroendocrine dysfunction in 16.7% of patients. Brain-imaging techniques revealed abnormalities in most of them. We have started a prospective study in a large cohort of patients after traumatic brain injury, evaluating the frequency of hormonal disorder and its relations to the type of head trauma and the course of acute post-traumatic phase, with a view to identifying risk factors that predispose to hormonal disorder.Key words:
traumatic brain injury – children – post-traumatic hormonal disorder – growth hormone deficiency – precocious puberty – risk factors
Autoři: D. Aleksijević 1; J. Zapletalová 1; V. Smolka 1; E. Klásková 1; J. Wiedermann 1; D. Krahulík 2
; J. Vaverka 2; Z. Fryšák 3
Působiště autorů: LF UP a FN Olomouc Dětská klinika 1; LF UP a FN Olomouc Neurochirurgická klinika 2; LF UP a FN Olomouc III. interní klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(4): 409-414
Kategorie: Krátké sdělení
Souhrn
Úvod:
Neuroendokrinní dysfunkce po kraniotraumatu je popisována u 23–60 % dospělých. Cíl: Retrospektivně zhodnotit tělesný vývoj a endokrinní funkce u dětí po úrazu mozku. Pacienti a metoda: U 30 pacientů (18 chlapců) po kraniocerebrálním traumatu byl zhodnocen tělesný růst, pubertální vývoj a kostní věk. Věk pacientů v době úrazu byl 9,7 (0,4–14,8) roku (medián a rozptyl), 75 % z nich bylo v době úrazu prepubertálních. V době vyšetření byla průměrná délka doby od úrazu 25 (16–33) měsíců. Glasgow coma scale (GCS) bylo v rozmezí 3–12 (u 11 pacientů < 8). Byl proveden laboratorní skríning endokrinních funkcí: tyreotropin, volný tyroxin, inzulinu podobný růstový faktor 1, prolaktin, ranní kortizol, gonadotropiny, estradiol (u dívek), testosteron (u chlapců). V případě patologického klinického a/nebo laboratorního nálezu byly provedeny dynamické testy. Výsledky: U tří pacientů byl v akutní posttraumatické fázi přítomen tranzitorní diabetes insipidus a u tří SIADH. Zjistili jsme: 1. deficit růstového hormonu u dvou chlapců (u jednoho kombinovaný s centrální hypotyreózou); 2. předčasnou pubertu u chlapce a dívky ve věku 7 a 8,3 roku; 3. hypogonadotropní hypogonadizmus, který byl maskován užíváním hormonální antikoncepce u jedné adolescentky. Závěr: Neuroendokrinní dysfunkce jako pozdní následek kraniocerebrálního traumatu byla prokázána u 16,7 % pacientů. Většina z nich měla patologický nález při zobrazení mozku. Současné prospektivní sledování pacientů po úrazu mozku povede ke zjištění frekvence a doby nástupu neuroendokrinní poruchy a její závislosti na typu úrazu a na průběhu akutní posttraumatické fáze jakož i k určení rizikových faktorů, které mohou predisponovat k rozvoji hormonální poruchy.Klíčová slova:
úraz mozku – děti – posttraumatická hormonální porucha – deficit růstového hormonu – předčasná puberta – rizikové faktoryPodpořeno výzkumným projektem IGA NR-9245-3
Úvod
Úrazy mozku jsou jednou z nejčastějších příčin mortality a závažné morbidity u dětí a dospívajících. U přeživších jedinců může být zdravotní stav ovlivněn i nepoznanou, a tedy neléčenou hormonální poruchou. Po dlouhé období byla poúrazová endokrinopatie považována za výjimečný jev a v písemnictví se objevovala pouze kazuistická sdělení o dospělých pacientech s posttraumatickým hypopituitarizmem (PTH) [1,2]. Zpočátku se zájem soustřeďoval pouze na akutní posttraumatickou fázi, trvající od několika hodin do několika dnů až týdnů po úraze, pro kterou je typická porucha vodní a elektrolytové rovnováhy související s alterací sekrece antidiuretického hormonu (ADH), jež může pacienta akutně ohrozit na životě [3]. Porucha tvorby ostatních hormonů vzniklá v akutní fázi je většinou projevem adaptace organizmu na úraz a zahrnuje podobné změny jako u jiných kriticky nemocných pacientů [4], vyjma těch jedinců, u kterých došlo k přímému inzultu hypothalamo-hypofyzární oblasti. Pokusy o systematické pátrání po „chronickém“ PTH začaly až v poslední dekádě, a to zejména u dospělých jedinců. Výsledky retrospektivních studií uvádějí prevalenci neuroendokrinní dysfunkce u dospělých pacientů po středně těžkém až těžkém úrazu mozku mezi 23–69 % [5–10]. Studie u dětských a dospívajících pacientů jsou sice sporadické, ale jejich výsledky poukazují podobně jako u dospělých na nutnost cíleně pátrat po případné hormonální poruše, která může u nezralého organizmu natrvalo negativně ovlivnit tělesný a duševní vývoj (tab. 4) [11–15].
Tab. 1. Posttraumatický hypopituitarizmus u dětí. 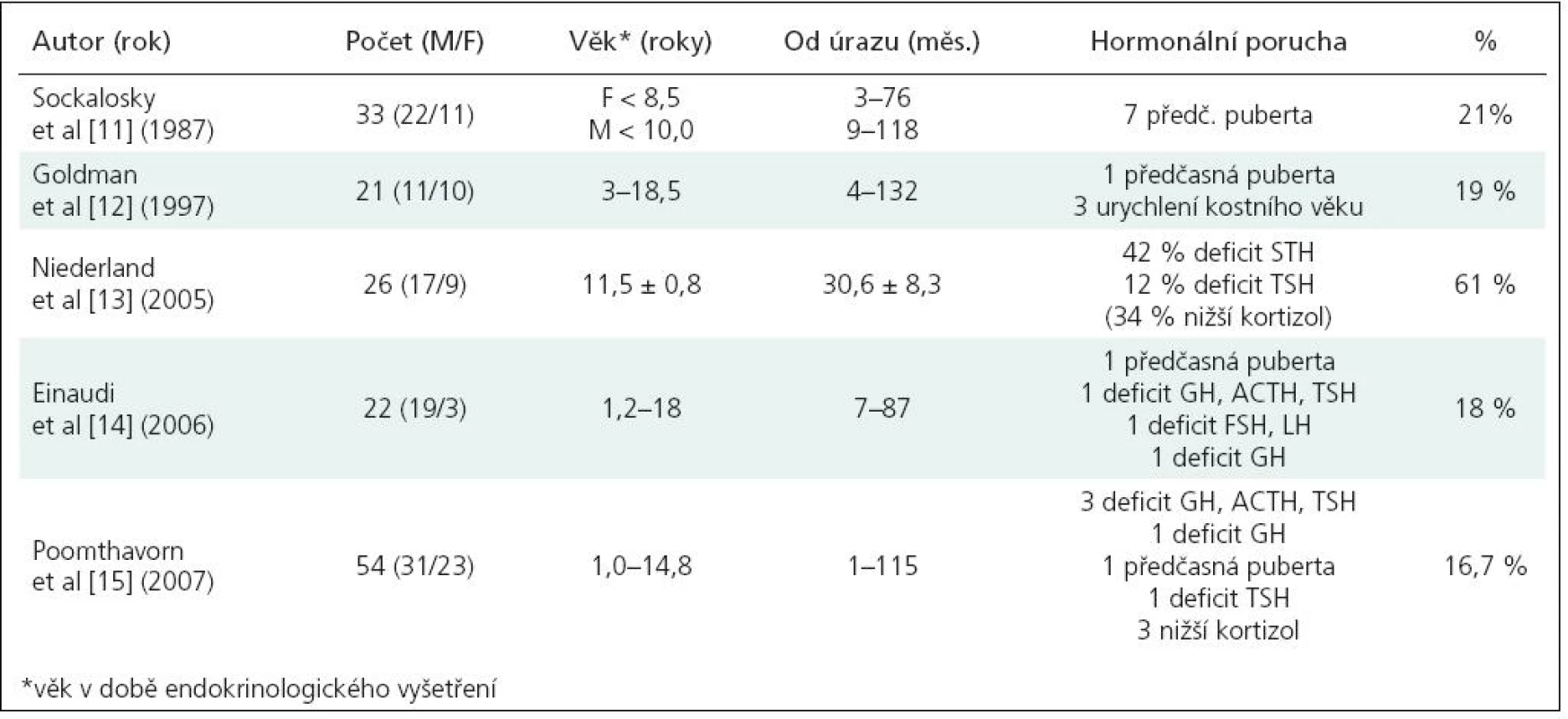
Uvádíme výsledky retrospektivního skríningu u dětí a adolescentů po středně těžkém až těžkém úrazu mozku hospitalizovaných během tří let na jednotce intenzivní a resuscitační péče Dětské kliniky Lékařské fakulty a Fakultní nemocnice Olomouc s cílem retrospektivně zhodnotit jejich tělesný vývoj a endokrinní funkce. Studie byla schválena etickou komisí FN Olomouc a zákonní zástupci všech pacientů podepsali informovaný souhlas.
Soubor pacientů a metodika
Pacienti
Retrospektivní skupina
Zahrnovala 62 dětí a adolescentů (21 dívek), kteří byli hospitalizováni v období od 1. 1. 2004 do 31. 12. 2006 po středně těžkém a těžkém úrazu mozku (GCS < 3–12). Rodičům/zákonným zástupcům všech pacientů byl zaslán zvací dopis s vysvětlením podstaty a účelu vyšetření. S rodiči 16 pacientů nebyl navázán kontakt, od deseti přišla zamítavá odpověď, čtyři změnili bydliště do vzdáleného místa, dva pacienti zemřeli (oba měli apalický syndrom), jeden chlapec měl diagnostikovánu hormonální dysfunkci záhy po úraze (kombinovaný deficit pituitárních hormonů) a je pro ni na našem pracovišti léčen (do hodnocení byl zařazen).
Konečný soubor tvořilo 30 dětí (18 chlapců), kteří měli v době úrazu 6,7 (0,4–14,8) let (medián, rozptyl). Příčinou úrazu byl u 34 % pád (u 2/3 při sportovních aktivitách), u 40 % dopravní nehoda, v 10 % byl úraz zaviněn jiným subjektem a u zbytku se na úrazu podílela jiná příčina. Od úrazu uplynulo 25 (16–33) měsíců a v době vyšetření měli pacienti 8,8 (2,6–17,0) let. Čtrnáct z nich bylo v době vyšetření pubertálních (Tannerova stupnice > II. stadium). Tíže úrazu byla hodnocena dle Glasgow Coma Scale: středně těžký (GCS 8–12) mělo 19 pacientů, těžký (GCS < 8) 11 pacientů. Všichni měli v době úrazu provedeno zobrazení mozku pomocí počítačové tomografie (CT) nebo magnetické rezonance (MR). U 13 z nich byl popsán patologický nález: u tří edém mozku (BE), u tří subdurální hematom (SDH), jeden měl subarachnoideální krvácení (SAH), dva epidurální krvácení (EDH), dva měli současně SDH, BE a difuzní axonální postižení (DAP), dva současně BE a DAP. Klinický stav deseti pacientů si vyžádal umělou plicní ventilaci (UPV) v průměru šest (1–23) dnů.
Metoda
Klinické vyšetření
Při podrobném fyzikálním vyšetření byly hodnoceny auxologické údaje: aktuální výška, hmotnost, Body mass index (BMI), růstová rychlost a stupeň pubertálního vývoje dle Marshallovy a Tannerovy stupnice [16,17]. Retrospektivně byl hodnocen tělesný růst a BMI před úrazem a po něm dle údajů z individuální dokumentace každého pacienta získané od praktického lékaře pro děti a dorost. Výsledky měření byly vztaženy k normám pro českou populaci z roku 2001 a stanoveny jako skóre směrodatné odchylky SDS pro věk a pohlaví [18]. Biologická zralost byla posuzována podle kostní zralosti ze snímku levé ruky a zápěstí dle Greulicha a Pyleové [19]. Ke kontrole pacienti přinesli záznam o 24hodinové bilanci tekutin.
Laboratorní hodnocení
Základní biochemický a hormonální skríning byl prováděn nalačno mezi 7.–8. hod ráno a zahrnoval stanovení mineralogramu, glykemie, osmolality séra a moči, tyreotropního hormonu (TSH), volného tyroxinu (fT4), ranního kortizolu, adrenokortikotropního hormonu (ACTH), inzulinu podobného růstového faktoru 1 (IGF 1), prolaktinu (PRL), folikulostimulačního hormonu, (FSH), luteinizačního hormonu (LH), estradiolu (u dívek), testosteronu (u chlapců).
V případě patologického nálezu při skríningovém laboratorním vyšetření nebo při zjištění opožděného či urychleného tělesného vývoje při klinickém vyšetření (vč. odchylky při stanovení kostní zralosti více než ± 6 měsíců) byly provedeny standardní stimulační testy ověřující činnost jednotlivých hormonálních os [20] a kontrolní MR mozku se zaměřením na oblast hypofýzy a hypothalamu. V případě nízkého IGF 1 (< 1,5 SDS) jsme tvorbu růstového hormonu (STH) ověřovali stimulačním testem s použitím pyridostigminu a katapresanu a testem s inzulinem indukovanou hypoglykemií (ITT) – ITT pouze u pacientů s příznivým neurologickým nálezem, u chlapců starších 9 let a u dívek nad 8 roků pro primingu estrogeny.
Sekrece gonadotropinů (FSH a LH) byla hodnocena pomocí stimulace gonadoliberinem (LHRH) a hodnoty vztaženy k věku a k pohlaví pacienta.
Pro centrální hypotyreózu by svědčila nízká hladina TSH a současně nízká hladina fT4. K diagnóze centrálního hypokorticizmu byla nutná nízká hladina ACTH i ranního kortizolu a nízká odpověď kortizolu v ITT a po podání ACTH.
Statistické hodnocení
Všechna data jsou uváděna jako medián a rozptyl. Auxologické parametry jsou vyjádřeny jako SDS pro pohlaví a věk. Srovnání tělesných parametrů před úrazem a po něm bylo provedeno pomocí Studentova t-testu, rozdíly mezi skupinami nepárovým t-testem. Za statisticky významnou byla považována hodnota p < 0,05. Jako software byl užit GraphPad Prizm, verze 5.01.
Výsledky
Klinická data
V časné poúrazové fázi byl u tří dětí zaznamenán syndrom nepřiměřené sekrece adiuretinu (SIADH) a u tří diabetes insipidus (DI), který byl u dvou tranzitorní.
U 25 pacientů našeho souboru nebyla nalezena žádná poúrazová neurologická porucha. Ze zbylých byl u jedné dívky zaveden ventrikuloperitoneální (VP) shunt pro poúrazový posthemoragický hydrocefalus a současně trpěla poúrazovou epilepsii (pacientka 2), dva pacienti měli hemiparézu, dva bolesti hlavy a poruchy soustředění.
Auxologické parametry před úrazem a po něm jsou uvedeny v tab. 1. U tří pacientů byly odchylky v růstovém tempu před úrazem a po něm, u všech byla prokázána hormonální porucha (pacienti 1–3). Při celkovém hodnocení ale nebyl zjištěn statisticky významný rozdíl v tělesné výšce před úrazem a po něm. Rozdíl byl nalezen při hodnocení BMI před traumatem a po něm, který byl na hranici statistické významnosti. Nebyl nalezen rozdíl mezi pacienty po těžkém a středně těžkém úrazu v obou sledovaných parametrech. Kostní věk byl urychlen u čtyř pacientů, u dvou z nich byla potvrzena předčasná puberta.
Tab. 2. Srovnání auxologických parametrů v době úrazu a v době skríningového endokrinologického vyšetření. 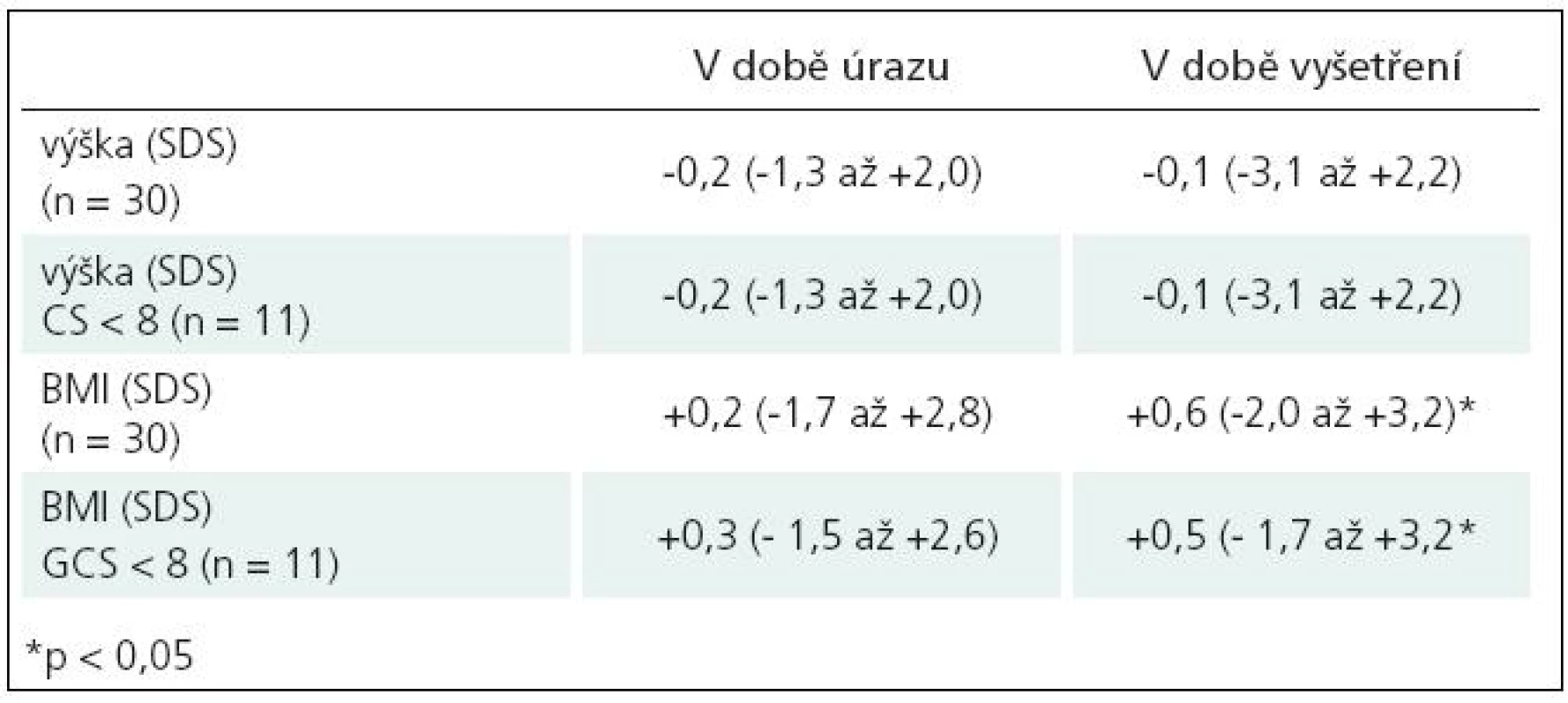
Bilance tekutin byla u všech pacientů ve fyziologických rozmezích. Jeden chlapec byl pro DI trvající od úrazu již léčen adiuretinem.
Laboratorní nálezy
Podezření na hormonální poruchu bylo vysloveno u 11 (37 %) pacientů.
Růstový hormon
Čtyři pacienti měli nízkou hladinu IGF 1, proto u nich byly indikovány stimulační testy ověřující sekreci STH. Deficit STH byl potvrzen u dvou chlapců, přitom pouze jeden měl výrazné opoždění růstu (pacient 1).
ACTH a kortizol
Nízká hladina kortizolu při hraniční nebo normální hladině ACTH byl nejčastější patologický nález (20 %). U všech pacientů byl proveden ITT a ACTH test, který u všech vyloučil centrální hypokorticizmus.
TSH
U žádného z pacientů nebyla prokázána centrální hypotyreóza. Jako náhodný nález byla zjištěna subklinická hypotyreóza (vyšší TSH při normální fT4) u dvou dívek. Příčinou byla autoimunitní tyreoiditis, kterou potvrdil typický sonografický nález a pozitivita antityroideálních protilátek.
Gonadotropiny (FSH a LH)
U tří pacientů (dvou dívek) byla prokázána porušená sekrece gonadotropinů, která vedla u jedné dívky k projevům hypogonadotropního hypogonadizmu (pacientka 5) a u dvou dětí k příznakům centrální předčasné puberty (pacienti 2 a 3).
Hormonální porucha byla nakonec diagnostikována u pěti (16,7 %) pacientů. Pouze jeden z nich (pacientka 2) má poúrazové neurologické následky. Klinická data pacientů a výsledky jejich vyšetření jsou uvedeny v tab. 2 a 3.
Tab. 3. Klinické údaje o pacientech s prokázanou hormonální poruchou v době úrazu. 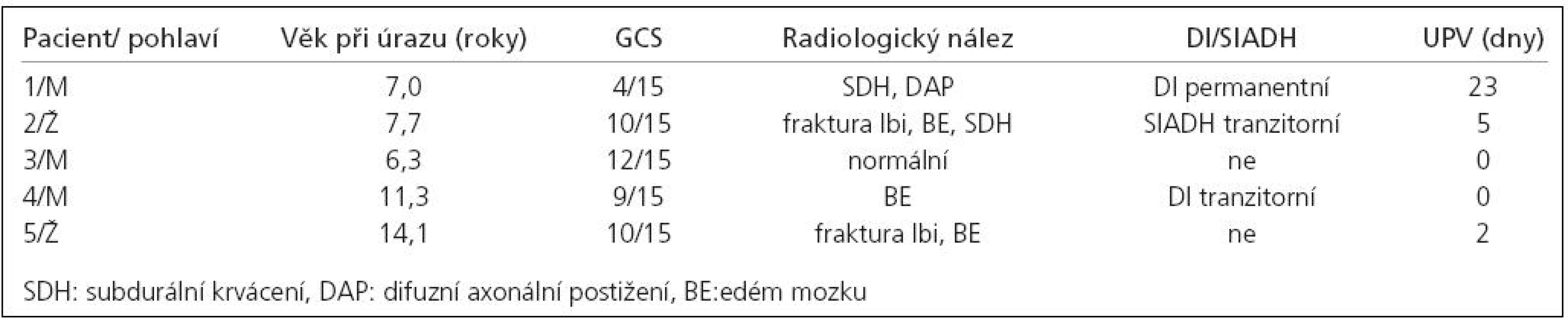
Tab. 4. Výsledky vyšetření u pacientů s prokázanou hormonální poruchou. 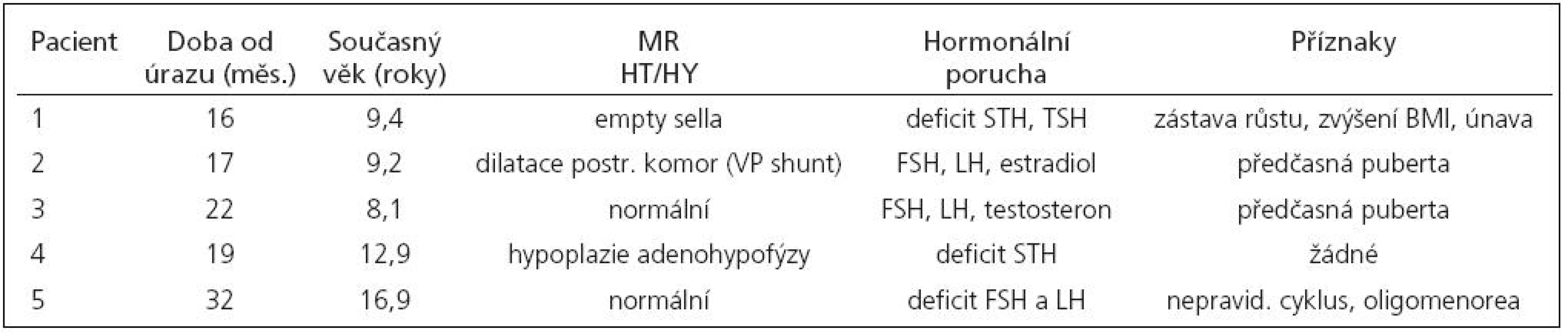
U prvního pacienta bylo příčinou úrazu mozku týrání nevlastním otcem a po propuštění byl svěřen do ústavní péče. Od úrazu měl diabetes insipidus, pro který byl sledován a léčen. Podezření na hormonální poruchu bylo u něj vysloveno ještě před zahrnutím do studie na základě zpomalování v růstu, bradypsychie a únavy. Má prokázán těžký deficit STH (postimulační hladina nepřesáhla 5 ng/ml) a centrální hypotyreózu a je substituován adiuretinem, STH a L-tyroxinem. V současné době odpovídá věkem prepubertě, je pravděpodobné, že se u něj může v období očekávaného počátku dospívání projevit i hypogonadotropní hypogonadizmus. Na kontrolním MR mozku byla nalezena empty sella.
Příčinou úrazu u druhé pacientky byl úder míčem do hlavy a následný pád. V době vyšetření byl u ní zjištěn o dva roky urychlený kostní věk proti věku kalendářnímu a dle matky měla již v osmi letech zvětšené prsní žlázy. V LHRH testu měla pubertální odpověď gonadotropinů (LH 21,1 IU/l, FSH 7,4 IU/l) a vyšší bazální hladinu estradiolu (85 nmol/l). Dívka je po shuntové operaci pro hydrocefalus a má poúrazovou epilepsii, pro kterou medikuje valproát. V časném poúrazovém období měla syndrom nepřiměřené sekrece adiuretinu (SIADH). MR mozku vykazuje lehkou dilataci postranních komor. V oblasti hypofýzy a hypotalamu je nález fyziologický.
Třetí pacient spadl z prolézačky a měl po úraze normální nález na CT, po týdnu pobytu v nemocnici byl propuštěn do domácí péče. Neměl žádné problémy, ale při skríningovém vyšetření bylo zřejmé, že nápadně rychle roste, měl urychlený kostní věk a volum testes 4–5 ml. Gonadotropiny po stimulaci LHRH u něj vykazovaly výrazně zvýšenou odpověď (LH 16,3 IU/l). Při vyšetření mozku pomocí MR nebyla nalezena žádná odchylka.
(Dívka i chlapec mají zablokované předčasné dospívání pomocí analog LHRH).
Čtvrtý pacient byl hospitalizován po pádu z kola s následným bezvědomím. V časném poúrazovém období měl tranzitorní diabetes insipidus. Klinické vyšetření odpovídalo věku, ale laboratorní vyšetření prokázalo nízkou hladinu IGF 1 (-2,6 SDS), proto byly u něj provedeny oba stimulační testy ověřující tvorbu růstového hormonu. Maximální postimulační hladina nepřesáhla 8 ng/ml. Na MR má nález drobné adenohypofýzy. Je substituován STH.
Pacientka 5 byla hospitalizována po autohavárii a po propuštění z nemocnice léčena gynekologem pro poruchy menstruačního cyklu (velmi slabé krvácení a cyklus co 2–3 měsíce), přestože v době před kraniotraumatem měla menstruační cyklus pravidelný (od necelých 12 let). Porucha cyklu byla dlouho dávána do souvislosti s poúrazovým stresem. Při vyšetření však LH RH test vykázal velmi nízkou postimulační odpověď FSH (4,1 IU/l) i LH (3,1 IU/l) svědčící pro hypogonadotropní hypogonadizmus. Oblast hypofýzy a hypothalamu má na MR normální. Doporučena hormonální substituční léčba.
Diskuze
Výsledky námi provedené studie prokázaly výskyt poruchy alespoň jedné hormonální osy u 16,7 % subjektů (což je v souladu s většinou publikovaných prací) [11–15]. Všichni měli dobu od úrazu delší než rok. Patologický nález při zobrazení CNS v době úrazu byl nalezen u 4/6 (80 %), na rozdíl od 43 % z celkového počtu nemocných (13/30). Pouze jeden z nich měl GCS < 8. U tří pacientů byl v akutní posttraumatické fázi zaznamenán DI nebo SIADH. U čtyř pacientů se dala hormonální porucha předvídat na základě klinických příznaků (ale pouze jeden z nich byl z tohoto aspektu endokrinologicky vyšetřen), jeden chlapec byl zcela asymptomatický. Deficit růstového hormonu byl zjištěn u dvou dětí, u jednoho kombinovaný s centrální hypotyreózou. Tento chlapec měl nejzávažnější symptomatologii včetně přetrvávajícího diabetu insipidu. U dvou pacientů byl zaznamenán předčasný nástup puberty. Statisticky hraniční zvýšení BMI v době skríningového vyšetření ve srovnání s BMI před úrazem bylo v důsledku menší fyzické zátěže většiny dětí školního věku, u nichž po propuštění z ústavního léčení rodiče omezili náročnější pohybové aktivity.
Přestože nejsou úrazy mozku tak frekventní jako u dospělých [5–14], jsou dlouhodobé následky daleko závažnější, protože jde o postižení subjektu s neukončeným tělesným vývojem. Doposud byla pacientům po kraniotraumatu logicky věnována pouze péče rehabilitační, neurologická a psychologická, která vycházela z klasického obrazu jedince s hybnou poruchou, bolestmi hlavy, poruchami spánku, soustředění... Mnohé z těchto a dalších problémů (poruchy menstruačního cyklu, snížení libida, chronická únava...) byly dávány do souvislosti s poúrazovým stresem. V posledních letech se zájem lékařů pečujících o tyto pacienty soustředil i na sledování hormonálních funkcí. Zpočátku ojedinělá kazuistická sdělení a posléze i systematické studie u početnějších kohort pacientů začaly poukazovat na možný výskyt neuroendokrinní dysfunkce vzniklé v souvislosti s úrazem [11–15]. Prevalence PTH u dospělých je v současné době udávána mezi 23–69 % [5–10], zatímco výsledky studií prováděných u dětí vykazují prevalenci hormonální poruchy kolem 20 % [11,12,14,15], vyjma retrospektivního pozorování maďarských autorů [13]. Ti vyslovili podezření na částečnou nebo parciální hormonální poruchu u 61 % dětí, aniž některé z nich mělo odpovídající klinickou symptomatologii. U 42 % pacientů prokázali sice sníženou sekreci růstového hormonu, ale stimulační testy nebyly vzhledem k věku pacientů prováděny po klasickém primingu estrogeny, proto mohla být postimulační hladina falešně nižší [13].
Předpokladem exaktní diagnózy endokrinní dysfunkce je adaptace výsledků hormonálních hladin na věk pacienta a jeho předešlý fyziologický hormonální status a případnou medikaci (např. hormonální antikoncepce). Zatímco u věkem prepubertálních dětí je možné diagnostikovat posttraumatický hypogonadizmus až v období očekávaného dospívání, u dospělých je zase nutné počítat s přirozeným snižováním sekrece GH a GnH během života. Výsledky testů ověřující sekreci růstového hormonu mohou být u pacientů s jinou neléčenou hormonální poruchou (např. hypotyreózou nebo hypogonadizmem) zkreslené. V současné době nejsou dostatečné poznatky o hormonálních poruchách u dětí a adolescentů po kraniocerebrálním poranění. Systematických studií s většími počty pacientů je pouze několik a jejich výsledky většinou ukazují na nižší frekvenci pozdní hormonální poruchy, než je popisována u dospělých. Není známo, zda je to dáno jinou vulnerabilitou mozku nebo schopností větší reparace. Další a významnější vysvětlení je, že většina dětí s pozdním posttraumatickým hypopituitarizmem není rozpoznána. Hormonální porucha může být přehlédnuta, může být skryta v neurologické symptomatologii, obtížné spolupráci dítěte při rehabilitaci, zhoršení prospěchu nebo poruchách chování. Přestože nejčastěji postiženými jsou osa somatotropní a gonadotropní (které jsou významně anabolické) a zdálo by se, že hodnocení růstu a nástupu nebo průběhu puberty by nemělo činit obtíže, bývá posouzení fyziologického vývoje u dětí po závažných traumatech často podceňováno a péče soustředěna na poruchy hybné nebo psychické. Někdy brání měření tělesné výšky obtížná nebo nemožná vertikalizace dítěte. Opoždění pubertálního vývoje nebo poruchy menstruačního cyklu bývají často dávány do souvislosti s psychickými posttraumatickými poruchami. Úraz mozku může u dětí paradoxně vyvolat i předčasný nástup puberty podobně jako u dětí s mozkovými nádory, vrozenými vývojovými vadami CNS nebo po shuntových operacích. Výskyt předčasné puberty jako následek kraniocerebrálního poranění uváděli již Sockalosky a Goldmann et al v prvních studiích zabývajících se PTH u dětí [11–12].
Zatím nelze jednoznačně určit rizikové faktory, které predisponují ke vzniku hormonální poruchy a které by více ohraničily skupinu pacientů, jež si zaslouží z tohoto aspektu dlouhodobé sledování. Na základě výsledků retrospektivních studií (včetně naší) lze považovat za rizikovější skupinu děti:
- se středně těžkým až těžkým poraněním mozku (GCS 3–12),
- s patologickým nálezem při zobrazení mozku,
- s poruchami vnitřního prostředí v akutní posttraumatické fázi (DI, SIADH, CSWS),
- s poruchami růstu nebo dospívání.
Až na výjimky byla většina studií prováděných u dětí i u dospělých retrospektivních. V současné době probíhá na našem pracovišti prospektivní studie zaměřující se na sledování pacientů po úrazech mozku. Výsledky sledování dospělých pacientů již byly publikovány [21], pediatrická část studie je před dokončením. Prospektivní sledování pacientů po úrazu mozku bude nepochybně cennější právě s ohledem na identifikaci rizikových faktorů predisponujících k rozvoji pozdního PTH.
Závěr
Pacientům po úrazech mozku je nutné věnovat mimořádnou pozornost nejen z aspektu následné péče neurologické, neurochirurgické, rehabilitační, psychologicko-psychiatrické, ale též endokrinologické. Nezbytná je spolupráce nejen mezi lékaři na JIRP, neurochirurgy, neurology, lékaři první linie, ale také s endokrinology. U každého pacienta po kraniocerebrálním poranění by měl být proveden alespoň základní hormonální skríning, a to jak v akutní fázi, tak i časovém odstupu (optimálně 6–12 měsíců) bez ohledu na jeho klinický stav. Diagnostikovaná hormonální porucha umožní adekvátní hormonální substituci, která může významně zmírnit poúrazové následky, ovlivnit tělesný a duševní vývoj a zlepšit kvalitu života.
MUDr. Darina Aleksijević
Dětská klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: darina.aleksijevic@seznam.czPřijato k recenzi: 11. 2. 2010
Přijato do tisku: 8. 4. 2010
Zdroje
1. Cyran E. Hypophysisenschadigung durch Schadel-basis fracture. Dtsch Med Wochenschr, 1918; 44 : 1261–1270.
2. Escamilla RF, Lisser H. Simmonds disease (Hypophyseal Cachexia): Clinical Report of Several Cases with Discussion of Diagnosis and Treatment. Cal West Med 1938; 48(5): 343–348.
3. Agha A, Rogers B, Mylotte D, Taleb F, Tormey W, Phillips J et al. Neuroendocrine dysfunction in the acute phase of traumatic brain injury. Clin Endocrinol 2004; 60(5): 584–591.
4. Woolf PD. Hormonal response to trauma. Crit Care Med; 1992; 20(2): 216–226.
5. Benvenga S, Campenni A, Ruggeri RM, Trimarchi F. Clinical review 113: Hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000; 85(4): 1353–1361.
6. Urban RJ, Harris P, Masel B. Anterior hypopituitarism following traumatic brain injury. Brain Inj 2005; 19(5): 349–358.
7. Agha A, Thompson CJ. Anterior pituitary dysfunction following traumatic brain injury (TBI). Clin Endocrinol 2006; 64(5): 481–488.
8. Aimaretti G, Ambrosio MR, Di Somma C, Gasperi M, Cannavò S, Scaroni C et al. Residual pituitary function after brain injury-induced hypopituitarism: a prospective 12-month study. J Clin Endocrinol Metab 2005; 90(11): 6085–6092.
9. Bondanelli M, De Marinis L, Ambrosio MR, Monesi M, Valle D, Zatelli MC et al. Occurrence of pituitary dysfunction following traumatic brain injury. J Neurotrauma 2004; 21(6): 685–696.
10. Klose M, Juul A, Struck J, Morgenthaler NG, Kosteljanetz M, Feld-Rasmussen U. Acute and long-term pituitary insufficiency in traumatic brain injury: a prospective single centre study. Clin Endocrinol 2007; 67(4): 598–606.
11. Sockalosky JJ, Kriel RL, Krach LE, Sheehan M. Precocious puberty after traumatic brain injury. J Pediat 1987; 110(3): 373–377.
12. Goldman M, Shahar E, Sack J, Meyerovitch J. Assessment of endocrine function in children following severe head trauma. Pediat Neurol 1997; 17(4): 339–343.
13. Niederland T, Makovi H, Gál V, Andréka B, Abrahám CS, Kovács J. Abnormalities of pituitary function after traumatic brain injury in children. J Neurotrauma 2007; 24(1): 119–127.
14. Einaudi S, Matarazzo P, Peretta P, Grossetti P, Giordano F, Altare F et al. Hypothalamo-hypophyseal dysfunction after traumatic brain injury in children and adolescents: a preliminary retrospective and prospective study. J Pediatr Endocrinol Metab 2006; 19(5): 691–703.
15. Poomthavorn P, Maixner W, Zacharin M. Pituitary function in paediatric survivors of severe traumatic brain injury. Arch Dis Child 2008, 93(2): 133–137.
16. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls. Arch Dis Child 1969; 44(235); 291–303.
17. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child 1970; 45(239): 13–23.
18. Bláha P, Vígnerová J, Riedlová J, Kobzová J, Krejčovský L. VI. Celostátní antropologický výzkum dětí a mládeže 2001. Čes Slov Pediat 2003; 58(12): 766–770.
19. Greuliche WW, Pyle SI. Radiographic atlas of skeletal development of the hand and wrist. 2nd ed. Standfod: Stanford University Press 1959.
20. Ranke M. Diagnostics of endocrine function in children and adolescents. 3rd ed. Basel: Karger Publisher 2003.
21. Krahulík D, Zapletalová J, Fryšák Z, Vaverka M. Dysfunction of hypothalamo-hypophyseal axis after traumatic brain injury in adults. In press 2009.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Webové okénkoČlánek Neurovaskulární kongres 2010
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Farmakologická léčba epilepsie
- Ložiskové léze CNS u pacientů s HIV infekcí
- Tkáňové kultury pro studium prionových chorob
- Funkční význam pólu temporálního laloku
- Problematika indikace operační léčby u intramedulárních lézí
- Posttraumatický hypopituitarizmus u dětí a dospívajících
- Mozková flebotrombóza – analýza série 33 nemocných
- Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
- Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Syndrom spontánní intrakraniální hypotenze u čínské pacientky s autozomálně dominantní polycystickou nemocí ledvin – kazuistika
- Unilaterální hypoplazie bazálních ganglií u pacientky s epilepsií – kazuistika
- Neobvyklé iatrogenní poranění n. musculocutaneus – dvě kazuistiky
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXII. Rozbor složitějších kontingenčních tabulek je účinným nástrojem pro studium vztahů kategoriálních znaků - Neurovaskulární kongres 2010
- Jsou dekomprese páteřního kanálu a opakované zpevnění páteře u transverzální léze hrudní míchy nutné?
-
III. neuromuskulární kongres
6.–7. května 2010, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Funkční význam pólu temporálního laloku
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



