-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mozková flebotrombóza – analýza série 33 nemocných
Cerebral Venous Thrombosis – Analysis of a Consecutive Series of 33 Patients
Objective:
To investigate the risk factors for cerebral venous thrombosis, especially inherited thrombophilic states and the relationships between them, the extent of sinus thrombosis, and brain lesions, together with their overall influence on outcome. Thus the study is intended to record presenting clinical symptoms and their relations to the location of the thrombosis, to monitor the time and the extent of recanalization and to verify its relationship to clinical outcome. Material and methods: 33 patients were included (24 women), average age 37 (33 for the women), with diagnosis confirmed by magnetic resonance angiography (MRA). We thoroughly examined 32 patients for thrombophilias and 31 had MRA checks within 3–4 months. To monitor the possibility of incomplete recanalization, a subsequent MRA scan was planned for two years later. Clinical outcome was assessed after the modified Rankin scale (mRS) 3–4 months after diagnosis. Results: 56% of the patients had a high extent of sinus thrombosis. Isolated lateral sinus thrombosis appeared to be relatively benign. Hormonal contraception (75% of the females) was the most common predisposing factor. An inherited thrombophilic state was diagnosed in 7 (21%) patients. These were younger (average age 24), with greater extent of thrombosis (71% vs 56%), and more often had venous infarction (43% vs 33%), parenchymal hemorrhage (29% vs 21%) and worse clinical outcome. Neither venous infarction itself (33%) nor parenchymal haemorrhage (21%) influenced clinical outcome. Overall prognosis was good for 91% of the patients (30/33), with complete or nearly complete recovery – mRS < 2; only one patient had mRS 3. The single patient who died had generalized bronchogenic carcinoma. Clinical outcome was not influenced by the extent of recanalization (partial/complete recanalization 82%). Conclusion: Young people with undetected inherited thrombophilia represent the most at-risk group for cerebral venous thrombosis.Key words:
cerebral venous thrombosis – thrombophilia – venous infarction – recanalization – clinical outcome
Autoři: D. Krajíčková 1; M. Košťál 2; A. Krajina 3; L. Klzo 3; P. Ďulíček 2; M. Kubíková 1
Působiště autorů: LF UK a FN v Hradci Králové Neurologická klinika 1; LF UK a FN v Hradci Králové II. interní klinika 2; LF UK a FN v Hradci Králové Radiologická klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(4): 402-408
Kategorie: Původní práce
Souhrn
Cíl práce:
Zjistit rizikové faktory intrakraniální flebotrombózy se zvláštním zaměřením na vrozené trombofilní stavy a vzájemné vztahy mezi nimi, rozsahem trombózy, parenchymovou komplikací a klinickým výsledkem, analyzovat prezentující klinické projevy a jejich vztah k lokalizaci postiženého splavu, monitorovat dobu a stav rekanalizace a ověřit její vztah ke klinickému výsledku. Soubor a metodika: Soubor tvoří 33 nemocných (24 žen) s průměrným věkem 37 let (ženy 33 let), u nichž byla diagnóza stanovena pomocí MRA (angiografie metodou magnetické rezonance). 32 z nich bylo kompletně vyšetřeno na přítomnost trombofilního stavu, u 31 nemocných jsme provedli kontrolní MRA za 3–4 měsíce a v případě nekompletní rekanalizace další kontroly po dobu dvou let. Klinický výsledek jsme hodnotili za 3–4 měsíce od stanovení diagnózy pomocí modifikované Rankinovy stupnice (mRS). Výsledky: 56 % nemocných mělo současně postiženo více splavů. Relativně benigní se jevila izolovaná trombóza laterálního splavu. Nejčastějším rizikovým faktorem byla hormonální antikoncepce (75 % žen). Vrozený trombofilní stav jsme prokázali u 7 (21 %) nemocných. Ti byli mladší (průměr 24 let), měli rozsáhlejší trombózu (71 vs 56 %), častější žilní infarkt (43 vs 33 %) a parenchymové krvácení (29 vs 21 %) a horší klinický výsledek. Přítomnost samotného žilního infarktu (33 %) ani krvácení (21 %) klinický výsledek negativně neovlivnila. 91 % (30/33) nemocných dosáhlo mRS < 2, jediný nemocný mRS 3. Jediné úmrtí v celém souboru bylo u generalizovaného plicního karcinomu. Rekanalizace (82 % parciální/kompletní) klinický výsledek neovlivnila. Závěry: Rizikovou skupinou z hlediska intrakraniální flebotrombózy jsou mladí lidé s nepoznaným vrozeným trombofilním stavem, zejména ženy užívající hormonální antikoncepci.Klíčová slova:
mozková flebotrombóza – trombofilní stav – žilní infarkt – rekanalizace – výsledekÚvod
Mozková flebotrombóza (cerebral venous thrombosis, CVT) je vzácné onemocnění s odhadovanou roční incidencí 2–4/1 milion a prevalencí 5/1 milion obyvatel, které postihuje většinou mladé osoby [1,2]. Díky dostupnosti neinvazivních radiologických metod je dříve vzácné onemocnění v současnosti diagnostikováno mnohem častěji, někdy dokonce jako incidentální zjištění [3].
Existuje mnoho příčin a predisponujících situací, které mohou k CVT vést. Kromě všech stavů spojených s rizikem žilní trombózy obecně (chirurgická léčba; porodnicko-gynekologická problematika – gravidita, puerperium, hormonální kontracepce; trombofilní stavy vrozené či získané) jsou to i lokální příčiny infekční i neinfekční – úrazy hlavy, mozkové nádory, zánětlivá onemocnění v oblasti hlavy [3], uváděny jsou i endokrinopatie (tyreotoxikóza, Cushingův syndrom) [4,5]. Vrozené trombofilní stavy se podílejí na vzniku CVT ve vyspělých zemích v 18 až 25 % případů. Nejčastěji se jedná o Leidenskou mutaci faktoru V, G20210A mutaci faktoru II a nově i V617F mutaci JAK2 kinázy, jejíž výskyt se u nemocných s CVT uvádí okolo 5 % (v běžné populaci asi u 1 %) [6–8]. Mutace C677T metylen-tetrahydrofolát-reduktázy (MTHFR) bez zvýšené hladiny homocysteinu není z hlediska mozkové trombózy považována za rizikovou. [9]. U většiny nemocných jsou příčinou trombózy získané trombofilní stavy. Souvislost hormonální antikoncepce (HAK) s CVT bývá zjišťována u 54 až 71 % nemocných [10–12] a je příčinou častějšího postižení žen (až 75 %) ve vyspělých zemích [1,12]. Předpokládaným mechanizmem je zvýšení rezistence na aktivovaný protein C a snížení hladiny proteinu S [13,14]. Asi 20 % CVT u žen je diagnostikováno v období jejich gravidity nebo puerperia [12], 5 % u žen užívajících hormonální substituci (HRT) v období klimaxu [15]. V rozvojových zemích s vysokou porodností a nižší hygienickou úrovní jsou puerperium (až 31 %) nebo infekt (až 18 %) nejčastější příčinou CVT [16–18]. U starších osob bývá podstatně častěji zjišťována souvislost s nádorovým onemocněním [19]. U 12–20 % případů zůstává etiologie neobjasněna.
Klinický obraz je extrémně variabilní s akutním, subakutním i chronickým průběhem. Jsou možné spontánní remise, ale i progresivní zhoršování, které může skončit smrtí. Různé kombinace současného postižení mozkových splavů, kortikálních i hlubokých mozkových žil jsou důvodem toho, proč klinický obraz CVT postrádá „topografické vzorce“ – tak charakteristické pro arteriální okluze.
Nejčastější (75 %) jsou jakékoliv deficitární nebo iritační ložiskové příznaky – hemiparézy, fatické poruchy, hemianopsie, mnestické poruchy a/nebo konvulzivní projevy (až u 40 %), které mohou být i tranzitorní. Jejich asociace s bolestí hlavy a zhoršenou úrovní vědomí by k podezření na CVT měla vést. Druhou nejčastější klinickou manifestací je izolovaný syndrom nitrolební hypertenze (HN), častý (45 %) zejména u izolované trombózy laterálního splavu – LS (sinus transversus a sigmoideus), s malou pravděpodobností vývoje žilního infarktu [20] a epileptických projevů (3 %) [21]. S největším rizikem pozdní či špatné diagnózy jsou spojeny projevy subakutní difuzní encefalopatie, bez jasného fokálního nálezu či syndromu HN. Existuje však i zcela asymptomatická alternativa. U starších osob jsou projevy izolované intrakraniální hypertenze vzácné (8 vs 24 % u mladších), ale běžně můžeme pozorovat různé změny mentálního stavu a poruchy vigility (43 vs 20 % u mladších) [19]. Průměrná doba od vzniku potíží k přijetí do nemocnice je 4 dny a asi 14 % nemocných při přijetí má různě hlubokou poruchu vědomí [12].
Výsledkem kongesce v žilním systému je žilní infarkt, někdy hemoragický – u 34 až 46 % nemocných [12,22]. Bývá provázen ložiskovými příznaky a vzniká častěji při větším rozsahu trombózy, současném postižení hlubokého žilního systémua/nebo rychlém vývoji CVT, protože se nestačí otevřít kolaterály, které mozek do jisté míry chrání před kongescí v žilním systému.
Definitivní diagnózu CVT potvrdí intrakraniální žilní angiografie metodou magnetické rezonance (MRA), někdy je problémem spolehlivé odlišení hypoplastického sinu [23]. Nejčastěji jsou postiženy SSS (sinus sagittalis superior) v 62–80 % a LS u 38–86 % případů. V 75 % trombóza postihuje více splavů současně, nejčastěji se jedná o kombinaci postižení SSS a LS [12]. Izolované postižení SSS je v méně než 30 % a LS v 10–32 % případů [1,20]. K parciální či kompletní rekanalizaci dochází u většiny nemocných (až 85 %) v průběhu prvních měsíců [24–27] a procento rekanalizace v dalším období již nenarůstá [28]. Jasná závislost výsledku na rekanalizaci nebyla prokázána.
Prognóza CVT je ve srovnání s arteriálním infarktem zřetelně lepší. Špatný výsledek lze očekávat asi u 13 % nemocných (mRS > 3, mortalita akutní fáze 5 až 6 %) [12,28–31]. Horší výsledky jsou tam, kde má CVT infekční příčinu, což je častější v rozvojových zemích, v nichž je současně i horší péče (mRS > 2 : 51 %, mortalita 8 %) [18], nebo kde příčinou CVT je nádorové onemocnění. Individuální předpověď vývoje u konkrétního nemocného je extrémně nesnadná, svoji užitečnost neprokázal ani skórovací systém [32]. Na rozdíl od arteriálního infarktu je však možná velmi dobrá úprava i původně těžkého a dlouho trvajícího deficitu. Negativní predikční hodnotu má velmi nízký a velmi vysoký věk (věk 65 let: mortalita 27 vs 7 %; mRS 0–1 : 49 vs 82 %; závislost 22 vs 2 %) [19], kóma, infekční etiologie, postižení hlubokých a mozečkových žil a velký žilní infarkt. Prognóza CVT v těhotenství a šestinedělí je lepší než u jiných příčin, častá je spontánní regrese, vysoké procento rekanalizací a velmi malá pravděpodobnost rekurence – do 1 % [17,28]. Není proto nutné další těhotenství nedoporučovat [33]. Rekurence CVT obecně je velmi vzácná, ale 3,7 % pacientů prodělá v dalším období jinou, extracerebrální, tromboembolickou komplikaci [22,28].
Soubor a metodika
Soubor sestává z 33 po sobě následujících nemocných hospitalizovaných od srpna 1999 do července 2009 ve FN v Hradci Králové s diagnózou CVT, která byla potvrzena metodou MRA. U všech nemocných jsme zjišťovali rizikové faktory CVT a s výjimkou jediného nemocného, který zemřel třetí den po přijetí v důsledku generalizovaného nádorového onemocnění, jsme provedli laboratorní vyšetření na přítomnost trombofilního stavu (Leidenská mutace faktoru V, G20210A mutace faktoru II, V617F mutace JAK2 kinázy, deficit proteinů C a S, hladina antitrombinu, vyšetření na antifosfolipidový syndrom). U některých jsme navíc doplnili onkologický skríning a pátrali po endokrinopatii. S výjimkou dvou případů (zemřelý muž a mladá žena, závislá na návykových látkách, která se k dalším kontrolám nedostavila) ostatní nemocní prodělali kontrolní MRA za 3–4 měsíce ke zjištění stavu a doby rekanalizace a v případě trvající parciální či kompletní okluze opakované vyšetření za 6 měsíců od stanovení diagnózy a dále v půlročních intervalech po dobu dvou let. Klinicky byli dlouhodobě sledováni v cévní poradně neurologické kliniky ve stejných intervalech. Funkční stav jsme hodnotili za 3–4 měsíce od stanovení diagnózy pomocí mRS (0 = kompletní úprava, 1–2 = dobrý výsledek, 3–5 = závislost, 6 = smrt).
Výsledky
Klinická data a radiologické nálezy
Klinická data a radiologické nálezy nemocných v akutní fázi jsou zaznamenány v tab. 1. Ženy tvoří 73 % souboru a jsou zřetelně mladší (33 vs 37 roků celkově). Nejčastějším úvodním příznakem CVT byly bolesti hlavy (36 %) jako součást širšího symptomového komplexu, izolovaný syndrom nitrolební hypertenze jsme zaznamenali u 33 % nemocných. 18 % nemocných mělo různý stupeň poruchy vědomí, jedna nemocná byla při přijetí v kómatu, arteficiálně ventilovaná. U dvou asymptomatických nemocných (6 %) bylo MR vyšetření indikováno z jiných příčin.
Tab. 1. Klinické a radiologické projevy akutní fáze CVT. 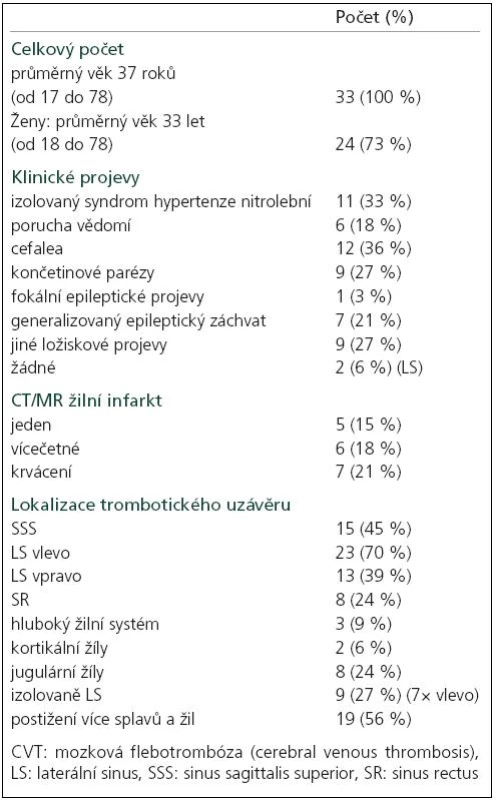
Časné epileptické projevy a reziduální epileptický syndrom
Epileptické projevy, převážně generalizované, jako prezentující příznak CVT jsme zaznamenali u 8 (24 %) nemocných, u 2 z nich (muž a žena), jednoho po dobu pouze 5 měsíců, došlo k vývoji sekundárního epileptického syndromu. Tito nemocní měli prokázaný hemisferální hemoragický infarkt. „De novo“ epileptické projevy jsme v dalším průběhu nepozorovali.
Postižený splav
56 % nemocných mělo současně uzavřeno více splavů, nejčastěji postiženým splavem byl levý LS (70 %). Téměř u třetiny případů (9/27 %) jsme zjistili izolované postižení LS, nápadně častěji vlevo (7/78 %). Izolovanou trombózu LS měli oba z hlediska CVT asymptomatičtí nemocní a 27letá žena, závislá na návykových látkách, s hnisavou endoftalmitidou, pansinusitidou a mastoiditidou vlevo (tab. 2). Třetina nemocných s trombózou pouze LS se prezentovala izolovaným syndromem nitrolební hypertenze. U žádného nemocného s izolovanou trombózou LS nedošlo k vývoji žilního infarktu ani mozkového krvácení a kromě ženy se zánětlivým procesem v oblasti hlavy, o jejímž dalším osudu nemáme zpráv, se všichni ostatní kompletně klinicky upravili.
Žilní infarkt, krvácení – masivnost CVT, akutní projevy, výsledek
U 11 nemocných (33 %) jsme prokázali jeden (5 nemocných) nebo více (6 nemocných) žilních infarktů, z nichž větší část (7/11 = 64 %) byla prokrvácená. Vývoj žilního infarktu souvisel s masivností CVT – v podskupině se současným postižením více splavů jsme zaznamenali žilní infarkty u 73 % nemocných (8/11) – 4krát jeden infarkt, 4krát vícečetné infarkty, zatímco v podskupině s postižením jednoho splavu (vždy SSS) mělo infarkt pouze 27 % nemocných (3/11). Ještě těsnější vztah existoval mezi masivností CVT a prokrvácením parenchymu – 86 % (6/7) nemocných s hemoragickým infarktem mělo trombózu více splavů. Přítomnost žilního infarktu v akutní fázi CVT znamenala těžší klinický obraz (s jedinou výjimkou všichni nemocní měli významný ložiskový nález, tři různý stupeň poruchy vědomí). Naproti tomu konečný výsledek nebyl přítomností samotného žilního infarktu ani krvácení v akutní fázi negativně ovlivněn – výsledné mRS všech nemocných < 2 a mRS 0 dosáhlo 75 % nemocných s žilním infarktem a 57 % s krvácením vs 61 % v celém souboru. Hemoragický infarkt měli oba nemocní s pozdějším vývojem sekundárního epileptického syndromu.
Trombofilní stav – masivnost CVT, postižení parenchymu, výsledek (tab. 2, 3)
Vrozený trombofilní stav jsme prokázali u 7 (21 % ) nemocných, 3 mužů a 4 žen, všechny užívaly hormonální kontracepci. Jeden nemocný byl současným nositelem JAK2 mutace a heterozygotem Leidenské mutace. Do skupiny jsme zařadili i 33letou ženu s izolovanou mutací MTHFR (metylen-tetrahydrofolát-reduktáza) bez zvýšené hladiny homocysteinu, protože její další historie s recidivujícími končetinovými flebotrombózami včetně plicní embolizace pro trombofilní stav svědčila. Nemocní v této skupině byli zřetelně mladší (24 vs 37 let), měli masivnější CVT (u 5/7 postiženo více splavů = 71 vs 56 %), častější žilní infarkt (3/7 = 43 vs 33 %) a častější parenchymové krvácení (2/7 = 29 vs 21 %). Horší byl i klinický výsledek – mRS 0 : 14 % (vs 61 %), mRS 1–2: 71 % (vs 30 %) a v celém souboru jediné mRS 3 bylo u 18letého muže, u nějž dlouhotrvající městnání na očním pozadí způsobilo významné snížení zrakové ostrosti a koncentrické zúžení perimetru. Podíl dosažených parciálních/kompletních rekanalizací byl srovnatelný s celým souborem (86 vs 82 %). Rekurenci CVT jsme během následného sledování nezaznamenali, dva nemocní však prodělali extracerebrální trombotické komplikace (kromě výše zmiňované ženy ještě u 17letého muže byla o rok později diagnostikována trombóza v. lienalis a v. portae).
Tab. 3. Vztah vrozeného trombofilního stavu k závažnosti CVT a výsledku. 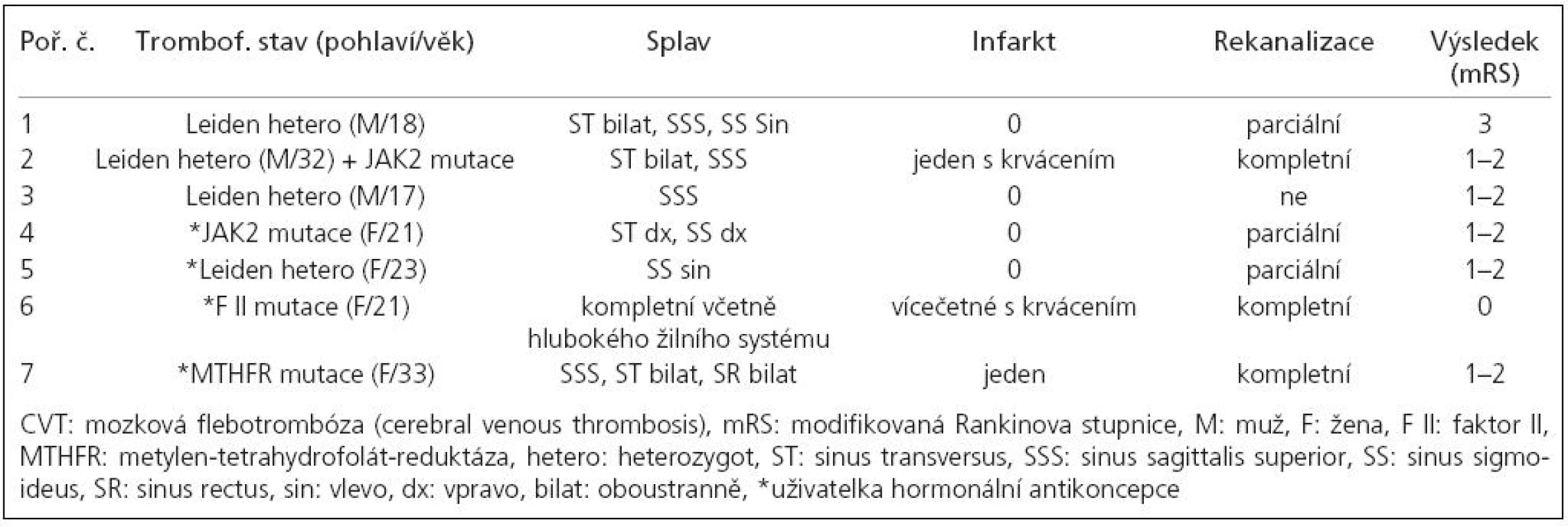
Maligní onemocnění – CVT (tab. 2)
Tři nemocní (9 %) s nádorovým onemocněním představují zvláštní skupinu. Jejich průměrný věk byl zřetelně vyšší (73 vs 37 let), jedinou retrombózu v celém souboru, v tomto případě identického splavu a již asymptomatickou, jsme zjistili u ženy s maligním lymfomem žaludku, a jediné úmrtí v celém souboru, třetí den po stanovení diagnózy CVT, bylo v důsledku generalizovaného plicního karcinomu. Manifestujícím příznakem CVT u obou těchto nemocných byl izolovaný syndrom nitrolební hypertenze, u třetího nemocného, s karcinomem prostaty, se jednalo o incidentální zjištění. U žádného z nich jsme neidentifikovali vrozený trombofilní stav.
Zjištěné rizikové faktory (tab. 2)
Některý z rizikových faktorů jsme identifikovali u 88 % nemocných, 27 % bylo nositeli více rizikových faktorů. Nejčastějším rizikovým faktorem byla hormonální antikoncepce (75 % žen). Zánětlivá flebotrombóza – v souvislosti s infekcí v oblasti hlavy, se v našem souboru vyskytla jedenkrát.
Léčba
Všichni nemocní byli v akutní fázi zajištěni nízkomolekulárním heparinem (LMWH) a následně warfarinizací, která v případě, že na kontrolní MRA po 3 až 4 měsících nebyly známky kompletní rekanalizace, byla prodloužena do další MRA kontroly za 6 měsíců od začátku onemocnění. Dvě nemocné (6 a 7 z tab. 3) byly pro hrozivě progredující stav v akutní fázi indikovány k endovaskulární léčbě pomocí rt-PA, u 21leté ženy, v té době již v kómatu pro edém bazálních ganglií (obr. 1a) na arteficiální ventilaci, byl v úvodu s úspěchem použit Merci katétr (obr. 1b, c). V obou případech vedl výkon k parciální rekanalizaci, která se v časovém odstupu změnila na kompletní, a navzdory klinickým a radiologickým známkám závažného poškození mozkového parenchymu v akutní fázi došlo k promptní a v dlouhodobém horizontu kompletní úpravě klinického stavu.
Obr. 1a. Výrazný edém v oblasti bazálních ganglií a thalamů oboustranně při trombóze hlubokého žilního systému na obrazech sekvence FLAIR. Obr. 1b. Žilní 3D PC MR angiografie prokazuje uzávěr hlubokého žilního systému a sinus rectus. Obr. 1c. Kontrolní 2D TOF MR angiografie po mechanické trombektomii sinus rectus a lokální trombolýze mikrokatétrem zavedeným retrográdně do místa vyústění v. magna do sinus rectus. Hluboký žilní systém je průchodný. Následovala neurologická úprava stavu s postupným odezněním edému. 
Rekanalizace – výsledek – pohlaví (tab. 4)
MRA vyšetření prokázalo parciální nebo kompletní rekanalizaci u 27 (82 %) nemocných. Přestože definitivní výsledek byl u většiny nemocných zřejmý již při první kontrole za 3–4 měsíce, u dvou nemocných (7 %) jsme zaznamenali vývoj z parciální rekanalizace na kompletní rekanalizaci ještě později (za 12 měsíců, za 24 měsíců), zatímco u ženy s maligním lymfomem žaludku (4 %) se dosažená parciální rekanalizace o 6 měsíců později (16 měsíců od počátku onemocnění) změnila na kompletní obliteraci, bez klinické odezvy. Informace o dalším vývoji žilní okluze chybí u dvou nemocných (jeden zemřel v akutní fázi, další nemocná se ke kontrolám nedostavila). 61 % nemocných (20/33) jsme hodnotili mRS 0, 30 % (10/33) mRS 1–2 s tím, že kromě dvou nemocných se sekundárním epileptickým syndromem (jeden přechodný) se u ostatních sledovaných jednalo o chronické bolesti hlavy a event. stavy zvýšené únavnosti, bez objektivních známek mozkového poškození. 3 % (1/33) mRS 3, jedno úmrtí (3 %) mRS 6. Rekanalizace klinický výsledek neovlivnila, i nemocní s trvající obliterací se upravili velmi dobře. Malý počet žen bez specifických „gender“ rizikových faktorů (HAK, HRT, puerperium) v našem souboru nedovolil zhodnocení jejich vlivu na výsledek CVT.
Diskuze
Nejcennějším zdrojem dat o CVT je současné době ISCVT (International Study on Cerebral Vein and Dural Sinus Thrombosis), publikovaná v roce 2004, která analyzuje 624 nemocných z 89 center ve 21 zemích shromážděných od roku 1998 do roku 2001 [12]. Soubory CVT pocházející z jednoho centra jsou malé. Třicet tři našich nemocných představuje pravděpodobně největší soubor publikovaný dosud v České republice [13,34]. Jeho předností je, že se jedná o prospektivně sledovanou sérii po sobě následujících nemocných, u nichž jsme systematicky pátrali po trombofilním stavu a dalších rizikových faktorech CVT, v následném období metodou opakovaných MRA zjišťovali stav a dobu rekanalizace a nemocné dlouhodobě klinicky sledovali.
Nejčastěji postiženým splavem v našem souboru byl levý LS, což zřejmě souvisí s jeho morfologickou méněcenností – často bývá hypoplastický [35,36]. Můžeme potvrdit relativní benignost izolované trombózy LS [20,21] – v některých případech byla zcela asymptomatická, nikdy nebyla komplikována žilním infarktem ani krvácením a všichni sledovaní nemocní se klinicky kompletně upravili. V současné době dříve velmi častá souvislost trombózy LS s lokálním zánětlivým postižením v oblasti nosu, tonzil a středního ucha [37–39] je vzácností [20,34], což potvrzuje i naše zkušenost. Odpovídá to všeobecnému poklesu výskytu zánětlivých flebotrombóz v důsledku rozšíření antibiotické léčby.
V písemnictví jsme nalezli pouze dvě práce zabývající se vztahem rozsahu CVT a rizikem parenchymové komplikace. Zatímco studie z roku 1999 [24] závislost neprokázala, o 10 let později publikovaná práce z Mayo Clinic [22] dospěla k opačnému závěru. Z 56 nemocných s CVT mělo 34 % parenchymovou komplikaci (edém/infarkt, krvácení). Její pravděpodobnost byla přímo úměrná rozsahu trombózy, kdežto věk, pohlaví a trombofilní stav riziko nezvýšily. Funkční výsledek byl však dobrý i u těchto nemocných – průměrné mRS u nemocných s parenchymovou lézí na konci sledování bylo 1,9. My jsme vztah mezi rozsahem trombózy i další závislosti analyzovali separátně pro žilní infarkt a mozkové krvácení a prokázali jsme jasnou závislost – 73 % žilních infarktů a 86 % krvácení vzniklo při velkém rozsahu CVT. Přestože v akutní fázi byly oba typy mozkové komplikace spojeny s těžším klinickým projevem, konečný výsledek nebyl jejich přítomností negativně ovlivněn. Na rozdíl od studie z Mayo Clinic jsme zjistili častější žilní infarkt a krvácení i u nemocných s vrozeným trombofilním stavem, pravděpodobně v důsledku většího rozsahu trombózy v této skupině.
Intrakraniálním krvácením (ICH), které je obvykle provázeno závažnějším klinickým projevem na počátku [30] a někdy i horším konečným výsledkem [3,12,40–42], bývá postižena asi 1/3 nemocných s CVT. Většinou se jedná o malá parenchymová krvácení obklopená normální tkání nebo hypodenzní zónou různého rozsahu, subdurální hematom či subarachnoidální krvácení jsou vzácná. V našem souboru bylo ICH postiženo 21 % nemocných, ve všech případech se jednalo o krvácení do ložiska infarktu. Vyšší riziko trombózy pravého LS pro vývoj hemoragického infarktu [36] jsme nezjistili.
Vrozený trombofilní stav vedl v našem souboru k masivnější CVT, v mladším věku, s častějším důsledkem pro parenchym a horším konečným výsledkem.
Epileptické projevy v akutní fázi postihují až 40 % nemocných (v našem souboru 28 %), reziduálním epileptickým syndromem trpí 10–30 % z nich [12], v našem souboru 24 %. Názory na profylaktické podávání antikonvulziv v akutní fázi CVT jsou kontroverzní a nejsou podpořeny důkazy. Pozorování, že větší pravděpodobnost sekundárního epileptického syndromu je u nemocných se supratentoriálním ložiskem, jak tomu bylo i u našich nemocných, podporuje jejich podávání u této podskupiny [21].
Definitivní důkaz nejlepší léčby CVT, který by vycházel z výsledků randomizovaných studií, v současné době chybí. V akutní fázi jsou všeobecně používána antikoagulancia – nyní spíše nízkomolekulární hepariny (LMWH), kontraindikací není ani přítomnost hemoragických žilních infarktů [2,15,43–45]. Následná léčba warfarinem se v případě, že se jedná o první manifestaci CVT, doporučuje na 3 až 6 měsíců [30], v případě identifikace vrozeného trombofilního stavu doživotně. V dalším životě pro všechny nemocné platí nutnost zajištění rizikových situací LMWH a pro ženy doživotní zákaz HAK.
Endovaskulární léčba spočívající v transvenózním zavedení katétru do místa trombózy s lokálním podáním trombolytika je indikována po neúspěšné léčbě heparinem při zhoršování neurologického stavu a kontraindikací není ani v tomto případě přítomnost mozkového krvácení [46–49]. Vzhledem k velkému objemu trombu je nutné vždy použít kombinace lokální trombolýzy pomocí tkáňového aktivátoru plazminogenu (rt-PA) s přímým narušením povrchu trombu mechanicky pomocí katétru, event. s mechanickou extrakcí trombu pomocí balónku nebo Merci katétru. Dávka rt-PA a délka infuze (nejčastěji 0,5–1 mg/1 hod) je variabilní a závisí na stáří trombu, jeho rozsahu, rychlosti poklesu fibrinogenu a efektu mechanického rozrušení či odstranění trombu. Průměrná doba infuze je 3–10 dní, zároveň je nutná celková heparinizace [48]. Výborný výsledek u našich takto léčených nemocných je důkazem, že snaha o maximální léčbu je na místě i v situacích, které se jeví být zoufalé [50]. V roce 2008 byla publikována série 20 nemocných léčených lokální trombolýzou v kombinaci s mechanickou trombektomií [51], z nichž 60 % bylo při zahájení léčby kómatozních a 70 % mělo rozsáhlý hemoragický infarkt. U 25 % (5/20) vedla léčba k dalšímu mozkovému krvácení. Navzdory tomu 60 % nemocných dosáhlo dobrého výsledku (mRS 2), 28 % zemřelo.
K ovlivnění progredujícího hydrocefalu při expanzivně se chovajícím mozečkovém infarktu lze provést komorovou drenáž nebo u nemocných s narůstající intrakraniální hypertenzí a hrozící tentoriální herniací při rozsáhlém žilním infarktu urgentní dekompresivní kraniektomii. Publikované výsledky vyznívají optimisticky – z 13 publikovaných případů 11 dosáhlo dobrého výsledku – mRS ≤ 3 [52,53].
K rekanalizaci (82 %) u naprosté většiny našich nemocných došlo v prvních 3 až 4 měsících po stanovení diagnózy. Pozorovaný vývoj v průchodnosti žilního systému u 11 % našich nemocných mezi 12. a 24. měsícem je zajímavé zjištění, které však neovlivnilo klinický výsledek ani léčebnou strategii. Domníváme se proto, že delší MRA sledování než po dobu trvání antikoagulační léčby, tj. maximálně 6 měsíců, není v rutinní praxi nutné. Naprostá většina našich nemocných, bez ohledu na rekanalizaci, dosáhla velmi dobrého výsledku (91 % mRS < 2). Pozitivní vliv specifických „gender“ rizikových faktorů (HAK, HRT, gravidita, puerperium) na výsledek [54] jsme pro malý počet žen v našem souboru, které je neměly, nemohli ověřit.
Závěr
CVT je relativně benigní onemocnění, převážně mladých osob, které však může mít i špatný výsledek. Snaha o maximální léčbu je na místě i v situacích, které se jeví být zoufalé. Rizikovou skupinou jsou mladí lidé s nepoznaným vrozeným trombofilním stavem.
MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika LF UK a FN Hradec Králové
Nezvalova 265
500 05 Hradec Králové
e-mail: krajickova@fnhk.czPřijato k recenzi: 23. 11. 2009
Přijato do tisku: 4. 6. 2010
Zdroje
1. Bousser MG, Ferro JM. Cerebral venous thrombosis: an update. Lancet Neurol 2007; 6(2): 162–170.
2. Einhaüpl K, Bousser MG, de Bruijn SF, Ferro JM, Martinelli I, Masuhr F et al. EFNS guidelines on the treatment of cerebral venous and sinus thrombosis. Eur J Neurol 2006; 13(6): 553–559.
3. Biousse V, Tong F, Newman NJ. Cerebral venous thrombosis. Curr Treat Options Neurol 2003; 5(5): 409–420.
4. Strada L, Gandolfo C, Del Sette M. Cerebral sinus and venous thrombosis in a subject with thyrotoxicosis and MTHFR gene polymorphism. Neurol Sci 2008; 29(5): 343–345.
5. Yoshimura S, Ago T, Kitazono T, Yonekura T, Kumai Y, Kuroda J et al. Cerebral sinus thrombosis in a patient with Cushing´s syndrome. J Neurol Neurosurg Psychiatry 2004; 76 : 1182–1183.
6. Košťál M, Dulíček P, Malý J, Krajíčková D. Cerebral venous thrombosis risk factors and incidence of JAK2 V617F mutation. J Tromb Haemost 2009; 7 (Suppl 2): 524.
7. De Stefano V, Fiorini A, Rossi E, Za T, Farina G, Chiusolo P et al. Incidence of the JAK21 V617F mutation among patients with splanchnic or cerebral venous thrombosis and without overt chronic myeloproliferative disorders. J Thromb Haemost 2007; 5(4): 708–714.
8. Ugo V, Le Gal G, Lecucq L, Mottier D, Oger E. Prevalence of the JAK2 V617F mutation is low among unselected patients with a first episode of unprovoked venous thromboembolism. J Thromb Haemost 2008; 6(1): 203–205.
9. Cantu C, Alonso E, Jara A, Martínez L, Ríos C, Fernández Mde L et al. Hyperhomocysteinemia, low folate and vitamin B12 concentrations, and methylene tetrahydrofolate reductase mutation in cerebral venous thrombosis. Stroke 2004; 35(8): 1790–1794.
10. Dentali F, Crowther MA, Ageno W. Thrombophilic abnormalities, oral contraceptives, and risk of cerebral vein thrombosis: a meta-analysis. Blood 2006; 107(7): 2766–2773.
11. Deschiens MA, Conard J, Horellou MH, Ameri A, Preter M, Chedru F et al. Coagulation studies, Factor V Leiden, and anticardiolipin antibodies in 40 cases of cerebral venous thrombosis. Stroke 1996; 27(10): 1724–1730.
12. Ferro JM, Canhão P, Stam J, Bousser MG, Barinagarrementeria F. ISCVT investigators. Prognosis of cerebral vein and dural sinus thrombosis: results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT). Stroke 2004; 35(3): 664–670.
13. Procházka M, Procházka V, Lubušký M, Procházková J, Hrbáč T. Mozková žilní trombóza u uživatelek hormonální antikoncepce. Cesk Slov Neurol N 2007; 70/103(6): 678–684.
14. Rosendaal FR, Helmerhorst FM, Vandenbroucke JP. Oral contraceptives, hormone replacement therapy and thrombosis. Thromb Haemost 2001; 86(1): 112–123.
15. Masuhr F, Mehraein S, Einhäupl K. Cerebral venous and sinus thrombosis. J Neurol 2004; 251(1): 11–23.
16. Bansal BC, Gupta RR, Prakash C. Stroke during pregnancy and puerperium in young females below the age of 40 years as a result of cerebral/venous sinus thrombosis. Jpn Heart J 1980; 21(2): 171–183.
17. Cantú C, Barinagarrementaria F. Cerebral venous thrombosis associated with pregnancy and puerperium: review of 67 cases. Stroke 1993; 24(12): 1880–1884.
18. Khealani BA, Wasay M, Saadah M, Sultana E, Mustafa S, Khan FS et al. Cerebral venous thrombosis: a descriptive multicenter study of patients in Pakistan and Middle East. Stroke 2008; 39(10): 2707–2711.
19. Ferro JM, Canhão P, Bousser MG, Stam J, Barinagarrementeria F. ISCVT investigators. Cerebral vein and sinus thrombosis in elderly patients. Stroke 2005; 36(9): 1927–1932.
20. Damak M, Crassard I, Wolff W, Bousser MG. Isolated lateral sinus thrombosis: a series of 62 patients. Stroke 2009; 40(2): 476–481.
21. Ferro JM, Canhão P, Bousser MG, Stam J, Barinagarrementeria F. ISCVT investigators. Early seizures in cerebral vein and dural sinus thrombosis: risk factors and role of antiepileptics. Stroke 2008; 39(4): 1152–1158.
22. Zubkov AY, McBane RD, Brown RD, Rabinstein AA. Brain lesions in cerebral venous sinus thrombosis. Stroke 2009; 40(4): 1509–1511.
23. Leach JL, Fortuna RB, Jones BV, Gaskill-Shipley MF. Imaging of cerebral venous thrombosis: current techniques, spectrum of findings, and diagnostic pitfalls. Radiographics 2006; 26 (Suppl 1): S19–S43.
24. Bergui M, Bradac GB, Daniele D. Brain lesions due to cerebral venous thrombosis do not correlate with sinus involvement. Neuroradiology 1999; 41(6): 419–424.
25. Favrole P, Guichard JP, Crassard I. Diffusion-weighted imaging of intravascular clots in cerebral venous thrombosis. Stroke 2004; 35(1): 99–103.
26. Stolz E, Trittmacher S, Rahimi A, Gerriets T, Röttger C, Siekmann R et al. Influence of recanalization on outcome in dural sinus thrombosis: a prospective study. Stroke 2004; 35(2): 544–547.
27. Strupp M, Covi M, Seelos K, Dichgans M, Brandt T. Cerebral venous thrombosis: correlation between recanalization and clinical outcome: a long-term follow-up of 40 patients. J Neurol 2002; 249(8): 1123–1124.
28. Dentali F, Gianni M, Crowther MA, Ageno W. Natural history of cerebral vein thrombosis: a systematic review. Blood 2006; 108(4):1129–1134.
29. Ferro JM, Lopes MG, Rosas MJ, Ferro MA, Fontes J. Long-term prognosis of cerebral vein and dural sinus thrombosis. Results of the VENOPORT Study. Cerebrovasc Dis 2002; 13(4): 272–278.
30. Breteau G, Mounier-Vehier F, Godefroy O, Gauvrit JY, Mackowiak-Cordoliani MA, Girot M et al. Cerebral venous thrombosis 3-year clinical outcome in 55 consecutive patients. J Neurol 2003; 250(1): 29–35.
31. Stolz E, Rahimi A, Gerriets T, Kraus J, Kaps M. Cerebral venous thrombosis: an all or nothing disease? Prognostic factors and long-term outcome. Clin Neurol Neurosurg 2005; 107(2): 99–107.
32. Koopman K, Uyttenboogaart M, Vroomen PC, van der Meerb J, De Keyser J, Luijckx GJ. Development and validation of a predictive outcome score of cerebral venous thrombosis. J Neurol Sci 2009; 276(1–2): 66–68.
33. Mehraein S, Ortwein H, Busch M, Weih M, Einhäupl K, Masuhr F. Risk of recurrence of cerebral venous and sinus thrombosis during subsequent pregnancy and puerperium. J Neurol Neurosurg Psychiatry 2003; 74(6): 814–816.
34. Chrobok V, Pellant A, Ehler E, Pokorný K, Šimáková E, Mrklovský M et al. Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu. Cesk Slov Neurol N 2007; 70/103(4): 424–428.
35. Borovanský L. Vena jugularis interna. In: Borovanský L et al (eds). Soustavná anatomie člověka, díl II. 5. vyd. Praha: Avicenum 1976 : 683–691.
36. Girot M, Ferro JM, Canhão P, Stam J, Bousser MG, Barinagarrementeria F et al. ISCVT investigators. Predictors of outcome in patients with cerebral venous thrombosis and intracerebral hemorrhagie. Stroke 2007; 38(2): 337–342.
37. Bárta T. Otogenná sepsa a sinustrombóza na klinike v Bratislave 1946–1965. Česk Otolaryngol 1969; 18 : 115–118.
38. Brosch E. Hnisavý zánět vnitřního ucha, hlíza mozečku a trombóza esovitého splavu jako komplikace vleklého zánětu středoušního. Česk Otolaryngol 1962; 11 : 236–239.
39. Pellant A. Záněty ucha, nosu, vedlejších nosních dutin a nitrolebí a jejich vzájemné vztahy (habilitační práce). Hradec Králové: Lékařská fakulta UK 1995.
40. Mehraein S, Schmidtke K, Villringer A, Valdueza JM, Masuhr F. Heparin treatment in cerebral sinus and venous thrombosis: patients at risk of fatal outcome. Cerebrovasc Dis 2003; 15(1–2): 17–21.
41. de Bruijn SF, de Haan RJ, Stam J. For the Cerebral Venous Sinus Thrombosis Study Group. Clinical features and prognostic factors of cerebral venous sinus thrombosis in a prospective series of 59 patients. J Neurol Neurosurg Psychiatry 2001; 70(1): 105–108.
42. Cakmak S, Derex L, Berruyer M, Nighoghossian N, Philippeau F, Adeleine P et al. Cerebral venous thrombosis: clinical outcome and systematic screening of prothrombotic factors. Neurology 2003; 60(7): 1175–1178.
43. Bousser MG. Cerebral venous thrombosis: nothing, heparin, or local thrombolysis? Stroke 1999; 30(3): 481–483.
44. Fink JN, McAuley DL. Safety of anticoagulation for cerebral venous thrombosis associated with intracerebral hematoma. Neurology 2001; 57(6): 1138–1139.
45. Stam J, de Bruijn SF, deVeber G. Anticoagulation for cerebral sinus thrombosis. Stroke 2003; 34(4): 1054–1055.
46. Biousse V, Bousser MG. Cerebral venous thrombosis. Neurologist 1999; 57(5): 326–349.
47. Ciccone A, Canhão P, Falcão F, Ferro JM, Sterzi R. Thrombolysis for cerebral vein and dural sinus thrombosis. Cochrane Database Syst Rev 2004; 1: CD003693.
48. Krajina A, Krajíčková D, Náhlovský J. Endovaskulární rekanalizace akutní trombózy mozkových splavů. In: Krajina A, Peregrin JH et al (eds). Intervenční radiologie – Miniinvazivní terapie. 1. vyd. Hradec Králové: Aurius s.r.o. 2005 : 397–404.
49. Röttger C, Madlener K, Heil M, Gerriets T, Walberer M, Wessels T et al. Is heparin treatment the optimal management for cerebral venous thrombosis? Effect of abciximab, recombinant tissue plasminogen activator, and enoxaparin in experimentally induced superior sagittal sinus thrombosis. Stroke 2005; 36(4): 841–846.
50. Canhão P, Falcão F, Ferro JM. Thrombolytics for cerebral sinus thrombosis: a systematic review. Cerebrovasc Dis 2003; 15(3): 159–166.
51. Stam J, Majoie CB, van Delden OM, van Lienden KP, Reekers JA. Endovascular thrombectomy and thrombolysis for severe cerebral sinus thrombosis: a prospective study. Stroke 2008; 39(5):1487–1490.
52. Countiho JM, Majoie CB, Coert BA, Stam J. Decompressive hemicraniectomy in cerebral sinus thrombosis: consecutive case series and review of the literature. Stroke 2009; 40(6): 2233–2235.
53. Keller E, Pangalu A, Fandino J, Könü D, Yonekawa Y. Decompressive craniectomy in severe cerebral venous and dural sinus thrombosis. Acta Neurochir Suppl 2005; 94 : 177–183.
54. Countiho JM, Ferro JM, Canhão P, Barinagarrementaria F, Cantu C, Bousser MG et al. Cerebral venous and sinus thrombosis in women. Stroke 2009; 40(7): 2356–2361.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Webové okénkoČlánek Neurovaskulární kongres 2010
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Farmakologická léčba epilepsie
- Ložiskové léze CNS u pacientů s HIV infekcí
- Tkáňové kultury pro studium prionových chorob
- Funkční význam pólu temporálního laloku
- Problematika indikace operační léčby u intramedulárních lézí
- Posttraumatický hypopituitarizmus u dětí a dospívajících
- Mozková flebotrombóza – analýza série 33 nemocných
- Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
- Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Syndrom spontánní intrakraniální hypotenze u čínské pacientky s autozomálně dominantní polycystickou nemocí ledvin – kazuistika
- Unilaterální hypoplazie bazálních ganglií u pacientky s epilepsií – kazuistika
- Neobvyklé iatrogenní poranění n. musculocutaneus – dvě kazuistiky
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXII. Rozbor složitějších kontingenčních tabulek je účinným nástrojem pro studium vztahů kategoriálních znaků - Neurovaskulární kongres 2010
- Jsou dekomprese páteřního kanálu a opakované zpevnění páteře u transverzální léze hrudní míchy nutné?
-
III. neuromuskulární kongres
6.–7. května 2010, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Funkční význam pólu temporálního laloku
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





