-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mozková žilní trombóza u uživatelek hormonální antikoncepce
Cerebral Venous Thrombosis in the Users of Hormonal Contraceptives
Cerebral venous thrombosis (CVT) is a dangerous disease with a difficult diagnosis. We present a retrospective analysis of 8 cases of CVT in young women who were hospitalised between April 2004 and October 2005. Thrombophilic markers were examined in all patients. The most common symptoms included headache (100%), vertigo (87.5%), hemiparesis or quadruparesis (62.5%). CT and MRI showed different types of parenchymal lesion infarction or vasogenic inflation in 62.50% and petechial haemorrhage in 25%. DSA venography confirmed the site of occlusion in the lateral and sigmoide sinus in 75%, and superior sagittal sinus (62.5%). We found 3 cases of the homozygous form of methylenetetrahydrofolate reductase (MTHFR-C677T), two patients had a plasminogen activator inhibitor-1 (PAI-1) homozygous mutation. Coexisting thrombophilic risk factors are usually involved in the onset of CVT. Early diagnosis and application of thrombolytic therapy can improve the clinical outcome.
Key words:
cerebral venous thrombosis – hormonal contraception – thrombophilia – local fibrinolysis
Autoři: M. Procházka 1; V. Procházka 2
; M. Lubušký 1; J. Procházková 3; T. Hrbáč 4
Působiště autorů: Porodnicko-gynekologická klinika LF UP a FN Olomouc 1; Radiodiagnostický ústav FN Ostrava-Poruba 2; Hemato-onkologická klinika LF UP a FN Olomouc 3; Neurochirurgická klinika FN Ostrava-Poruba 4
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(6): 678-684
Kategorie: Krátké sdělení
Poděkování: Autoři si dovolují poděkovat školiteli a příteli doc. MUDr. Pavlu Drábkovi z Neurochirurgické kliniky Fakultní nemocnice Ostrava-Poruba za odbornou pomoc a podporu při zpracovávání tohoto náročného tématu.
Souhrn
Cerebrální venózní trombóza (CVT) představuje nebezpečné onemocnění s náročným diagnostickým algoritmem. Retrospektivně analyzujeme 8 případů CVT u skupiny mladých žen hospitalizovaných v období 18 měsíců mezi dubnem 2004 až říjnem 2005. U všech pacientek bylo provedeno vyšetření trombofilních markerů. Nejčastějším příznakem byla bolest hlavy (100 %), poruchy rovnováhy (87,5 %) a centrální hemiparéza nebo kvadruparéza (62,5 %). CT aMRI prokázaly venózní infarkt nebo venózní kongesci v (62,5 %), s petechiálním krvácením ve (25 %). Digitální subtrakční venografie potvrdila nejčastěji kombinaci okluzí sinus transversus a sigmoideus (75 %) a sinus sagitalis superior (62,5 %). Homozygotní forma mutace metylentetrahydrofolát reduktázy (MTHFR-C677T) byla zjištěna u 3 pacientek, 2 měly mutaci genu pro inhibitor aktivátoru plazminogenu (PAI-1) v homozygotní formě. CVT obvykle vzniká kombinací několika rizikových trombofilních faktorů. Včasná diagnostika a nasazení trombolytické terapie může snížit výskyt závažných následných komplikací.
Klíčová slova:
cerebrální venózní trombóza – hormonální antikoncepce – trombofilie – lokální fibrinolýzaÚvod
Cerebrální venózní trombóza je vzácným, ale život ohrožujícím onemocněním. Podle současných studií umírá až 10 % pacientů s CVT. Ve starších pracích bylo prokázáno, že většina trombóz vznikla sekundárně následkem lokální či systémové infekce, více než 30 % případů bylo považováno za idiopatických. Novější studie popisují další rizikové faktory, mezi které patří trombofilie či užívání hormonální antikoncepce.
Trombofilie je vrozená či získaná porucha hemostatického mechanizmu, charakterizovaná zvýšenou tendencí ke krevnímu srážení a trombotizaci. Typický je výskyt trombóz dolních končetin, jejich časté recidivy nebo lokalizace na neobvyklých místech. V případě vrozených forem je charakteristický rodinný výskyt. U vrozených forem se jedná hlavně o mutaci genů kódujících faktor VLeiden ( Leidenskou mutaci), protrombinu (variantu G20210A), o hyperhomocysteinemii a autozomálně dědičný deficit antitrombinu III (AT III ), proteinu C a proteinu S. Podstatně méně často se setkáváme s trombofilií podmíněnou hyperfibrinogenemií a dysfibrinogenemií.
Vztahem hormonální antikoncepce a hluboké žilní trombózy dolních končetin se zabývaly velké populační studie. Zvýšené riziko bylo popsáno u uživatelek gestagenů 3. generace. Zvláště vysoké riziko vzniku trombózy je u uživatelek hormonální antikoncepce s trombofilií. Toto zjištění potvrzuje domněnku, že u těchto žen dochází k vzájemnému zesílení prokoagulačních mechanizmů.
Problematika trombózy mozkových žil u žen ve fertilním věku, které jsou uživatelkami hormonální antikoncepce, byla studována v několika málo studiích na nízkém počtu pacientů.
Cílem naší studie je analýza případů CVT u 8 žen ve vztahu k věku, užívání hormonální antikoncepce a trombofilním stavům v korelaci s nálezy CT, MRI, DSA a s klinickým neurologickým nálezem.
Soubor a metodika
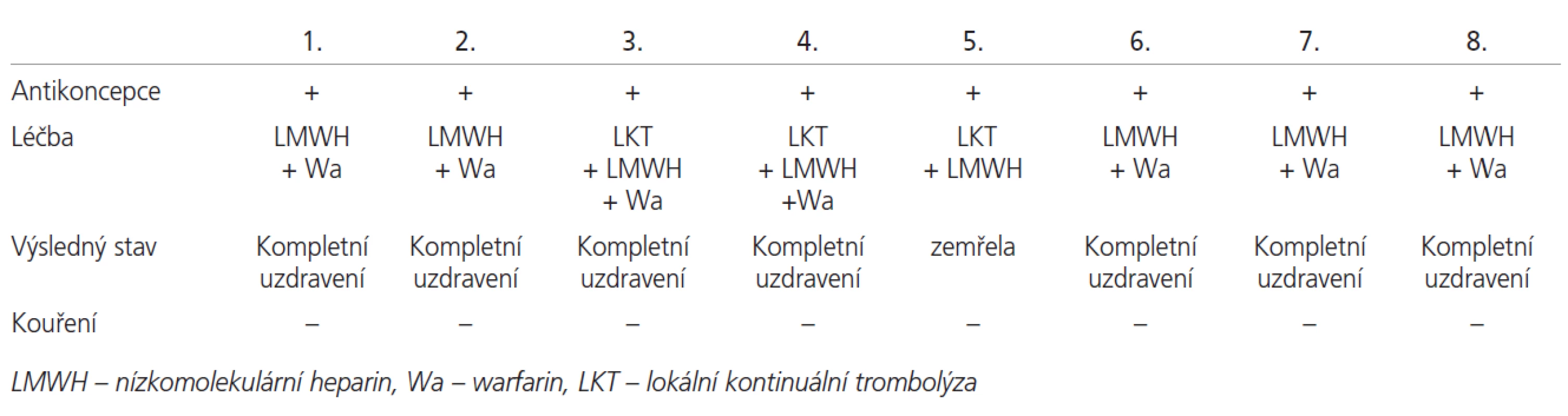
Provedli jsme retrospektivní analýzu souboru 8 případů žen s diagnostikovanou mozkovou žilní trombózou. Věkový rozsah souboru činil 18,7 – 39,3 let, průměrně 28,1 roku. Pacientky byly hospitalizovány v období mezi dubnem 2004 a říjnem 2005. Všechny podstoupily CT/ MRI a DSA. 5 žen bylo léčeno pouze terapeutickou dávkou nízkomolekulárních heparinů (LMWH) s přechodem na perorální antikoagulační léčbu, další 3 pacientky po neúčinné léčbě LMWH podstoupily endovaskulární lokální trombolýzu rekombinantním tkáňovým aktivátorem plazminogenu (rt-PA) a mechanickou disrupcí.
Vyhodnoceny byly všechny lékařské záznamy, pacientky byly vyšetřeny fyzikálně a byla odebrána podrobná anamnéza. 7 pacientek užívalo hormonální antikoncepci s gestageny 3. generace, jedna užívala hormonální preparáty čistě gestagenní, žádná z pacientek nebyla kuřačka. U všech pacientek byly provedeny následně krevní testy na přítomnost možných trombofilních stavů. Krev byla odebrána a testována před nasazením antikoagulační léčby a s odstupem 3-6 měsíců po trombotické příhodě. Rezistence na aktivovaný protein C (APC rezistence) byla vyšetřována testem za užití faktoru V deficitní plazmy ( Coatest® APC rezistence Chromogenix). Dále byla chromogenně stanovována hladina proteinu C, antitrombinu III ( AT III ), protrombinu, heparin II kofaktoru a plazminogenu. Protein S byl stanovován imunologicky jako volný protein S.
Výsledky
Nejčastějšími subjektivními příznaky CVT byly bolesti hlavy (100 %) a poruchy rovnováhy (87,5 %) (tab. 1). Objektivně byly nejčastěji zjištěny poruchy hybnosti - centrální hemiparézy, popřípadě kvadruparéza (v 75 %), v počtu (25 %) byly zastoupeny křečové stavy, poruchy chování, poruchy vědomí, senzitivní poruchy a afázie. CT a MRI vyšetření prokázala venózní infarkt respektive venózní kongesci v 62,5 % s výskytem petechiálního krvácení ve 25 %. Digitální subtrakční venografie potvrdila nejčastěji kombinaci okluzí sinus transversus a sigmoideus (75 %), sinus sagitalis superior (62,5 %), kortikálních žil (62,5 %) a hlubokého žilního systému (50 %) (tab. 2).
Tab. 1. Subjektivní a objektivní příznaky při přijetí. 
Tab. 2. Okluze splavů/ kortikálních žil při DSA 3D-XR venografii. 
Výsledky terapie byly výborné u 7 pacientek v základní terapii. Léčba zahrnovala kombinaci nízkomolekulárního heparinu v léčebné dávce a následné zajištění warfarinem (tab. 3). U 3 pacientek při nedostatečném léčebném efektu LMWH jsme použili lokální trombolýzu pomocí (rt-PA) s mechanickou disrupcí. Jedna žena zemřela i přes akutní trombolýzu a komplexní terapii. Výsledky koagulačních testů prokázaly přítomnost rizikových trombofilních faktorů u všech žen našeho souboru. Homozygotní forma mutace genu MTHFR-C677T byla zjištěna u 3 pacientek a 2 pacientky měly mutaci genu pro PAI-1 v homozygotní formě. Kombinace obou homozygotních mutací byla zjištěna u 1 pacientky, v heterozygotních formách byla kombinace pozorována u 2 pacientek. U 3 pacientek byla zjištěna vysoká hladina faktoru VIII a u 5 pacientek byl nalezen deficit proteinu S, vždy v kombinaci s mutací genu pro MTHFR-C677T, z toho 3x v její homozygotní formě (tab. 4).
Tab. 4. Výsledky vyšetření trombofilních parametrů. 
Pro ilustraci uvádíme kazuistiky 2 pacientek s prokáznou CVT.
1. Případ CVT s aplikací lokální fibrinolýzy
24letá žena s negativním předchorobím, užívala gestagen 3. generace poslední měsíc. Pro týden trvající intenzivní bolesti hlavy v záhlaví provázené zvracením, byla přijata na JIP neurologického oddělení. Při přijetí byla spavá, apatická, dysartrická, šíje oponovala. V neurotopickém nálezu byla zjištěna oboustranná mióza 1mm s divergentním strabizmem a levostranná spastická hemiparéza. CT ukázala hypodenzitu v bazálních gangliích a talamu vpravo, edém temporookcipitálně vpravo a malou hemoragii při pravém transverzálním splavu. AG prokázala částečný uzávěr horního šípového splavu a úplný trombotický uzávěr pravého transverzálního a sigmoidálního splavu, Galenovy žíly a přímého splavu, edém talamu a bazálních ganglií vpravo. MR a MRV (magnetická rezonanční venografie) potvrdila krevní hypervolemii a edém pravé poloviny mezencefala, pravého talamu a bazálních ganglií, a trombózu hlubokých mozkových žil a přímého splavu. Byla zavedena léčba dalteparinem a antibiotiky. Vzhledem k progredující poruše vědomí byla nemocná na umělé plicní ventilaci přeložena na ARO oddělení. Přes aplikaci konvenční antikoagulační léčby a protiedémovou terapii se neurotopický nález zhoršoval. 5. den byla přeložena do intervenčního centra k endovaskulární léčbě. DSA s trojrozměrnou venografií (3D-XRV) potvrdila trombotický uzávěr vv. cerebri internarum, bazální v. Rosenthali, v. cerebri magnae, přímého splavu a pravostranného transverzálního a sigmoidálního splavu (obr. 1). Zavaděč byl zaveden do pravé společné stehenní žíly pro venózní přístup a druhý do stehenní tepny pro arteriální zobrazení. Katétr byl zaveden do pravé v.jugularis int. a mírným tlakem pronikal tromby v žilních splavech až do oblasti confluens sinuum. Byla zahájena kontinuální trombolýza aplikací rtPA se současným podáváním LMWH při sledování hladin fibrinogenu, aPTT, KO a počtu trombocytů v 6hodinových intervalech. Trombolýza byla ukončena po 48 hodinách a obnovení žilního průtoku. Kontrolní 3D-XR venografie (obr. 2) potvrdila rekanalizaci hlubokých žil a žilních splavů v zadní jámě, MR pak regresi hyperemie a edému v krajině talamu a bazálních ganglií vpravo. V následujících dnech ustupoval komatózní stav a kmenová symptomatika. 7. den po výkonu dosáhla NIHSS škála 4 bodů. Vyšetření trombofilních stavů verifikovalo heterozygotní formu MTHFR: A/V 223 a homozygotní formu mutace PAI-I 4G/5G genotypu. Pacientka byla nastavena na perorální antikoagulační léčbu warfarinem. Neuropsychologické vyšetření 3 měsíce po příhodě zjistilo normální psychomotorické tempo, paměťové a intelektové funkce (WAIS-R:IG globální test 141, verbální 128 a nonverbální 146 s Wechslerovým paměťovým kvocientem MQ 101). Objektivní neurologický nález byl v mezích normy.
Obr. 1. DSA, MRI + MR – venografie – „Time of Flight-TOF“. 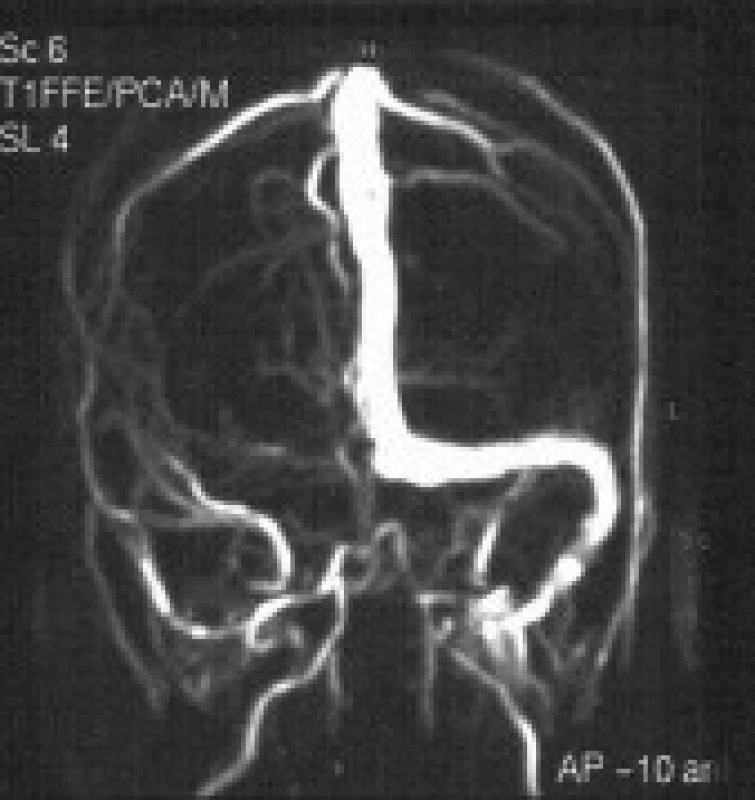
a) DSA (den 1) uzávěr sinus transversus, vena magna cerebri (Galen), vena cerebri interna a vena basalis Rosenthali. Zachována drenáž kortikálních žilních kolektorů. b) T2 – vážené obrazy (den 4) – hyperemie resp. mozková turgescence pravostranných bazálních ganglií a talamu s obrazem hyperintenzity signálu imitující mozkovou ischemii. c) Předo-zadní pohled MR-venografie – trombóza pravostranného sinus transversus a sigmoideus a vena jugularis interna vpravo. Obr. 2. Kontrolní angiografie po trombolýze. 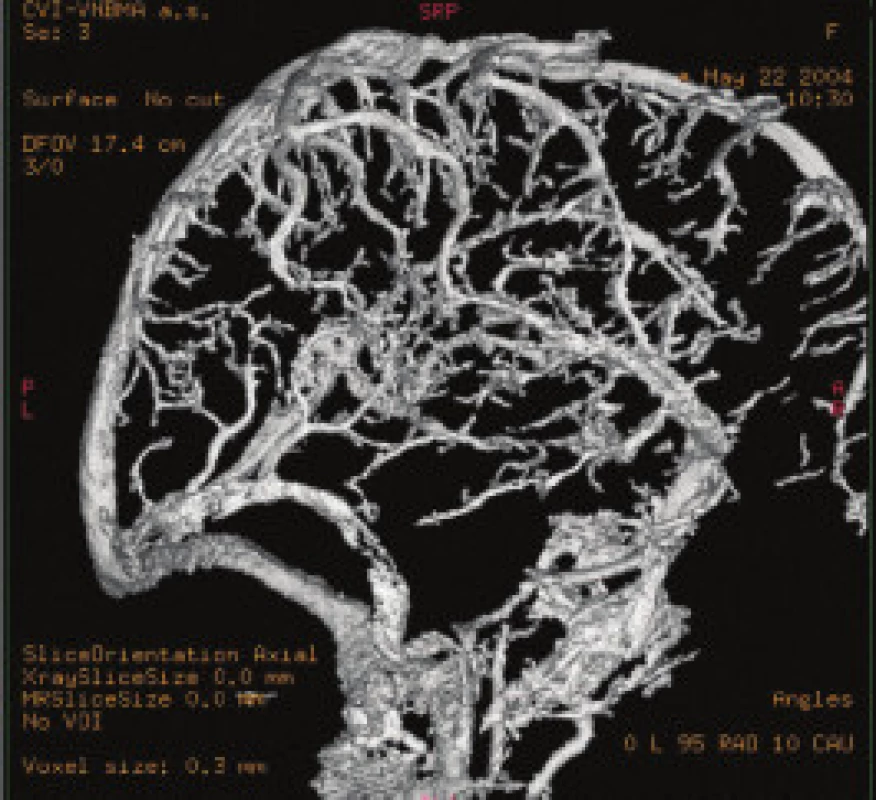
d) Předozadní pohled – DSA (den 7.) – 48 hodin lokální trombolýzy – rekanalizace pravostranného sinus transversus a sigmoideus. e) 3D-Xra digitální rotační angiografie s kompletní rekanalizací sinus rectus, v. magna cerebri, v. basalis Rosenthali a vv. cerebri internae. 2. Případ CVT s maligním průběhem
U 33leté ženy s negativním předchorobím, užívající poslední měsíc gestageny 3. generace, se objevily bolesti hlavy v záhlaví, provázené zvracením, po 5 dnech cefalgií pak zhoršováním zrakové ostrosti pravého oka. Po epileptickém záchvatu byla akutně přijata na neurologické oddělení kde CT nepotvrdilo ložiskovou lézi. 8. den hospitalizace došlo náhle k bezvědomí s tonickými křečemi končetin, poté zmatenost, sledovaná prohlubující se somnolencí s nástupem levostranné centrální hemiparézy a meningeálního syndromu. Při MR vyšetření zjištěn edém pravého temporálního laloku, trombóza všech mozkových splavů a chybění hlubokého žilního systému (obr. 3). Zaintubovaná komatózní pacientka byla převezena do intervenčního centra k emergentnímu endovaskulárnímu výkonu. Při AG byla zjištěna opožděná kapilární náplň obou hemisfér a kompletní trombóza horního šípového splavu, pravého transverzálního a sigmoidálního splavu a celého hlubokého žilního systému včetně přímého splavu. Přes zavaděč v pravé společné stehenní žíle byl instalován katétr do bulbu vnitřní jugulární žíly a odtud postupně zaváděn měkkými tromby v pravém sigmoidálním a transverzálním splavu až do oblasti confluens sinuum. Po umístění katétru v krajině torculy byla zahájena aplikace lokální trombolýzy rtPA se současnou aplikací LMWH. Kontrolní CT po 24 hodinách zjistilo masivní edém celého mozku s vyhlazenou gyrifikací, zašlými mozkovými komorami a bazálními cisternami, setřelou strukturou bazálních ganglií, talamů a mozkového kmene. Neurologické vyšetření prokázalo areaktivní kóma s nevýbavnými kmenovými reflexy bez spontánní dechové aktivity, odpovídající smrti mozku. Pitva potvrdila rozsáhlou cerebrální venózní trombózu - durální, kortikální a hlubokého žilního systému – s průvodným edémem mozku, zvláště v oblasti mozkového kmene (obr. 4). Laboratorní vyšetření trombofilií prokázalo zvýšenou aktivitu faktoru VIII, bez průkazu mutace genu kódujícího faktor V-Leiden.
Obr. 3. MRI vyšetření a MR venografie – (TOF) – subakutní fáze. 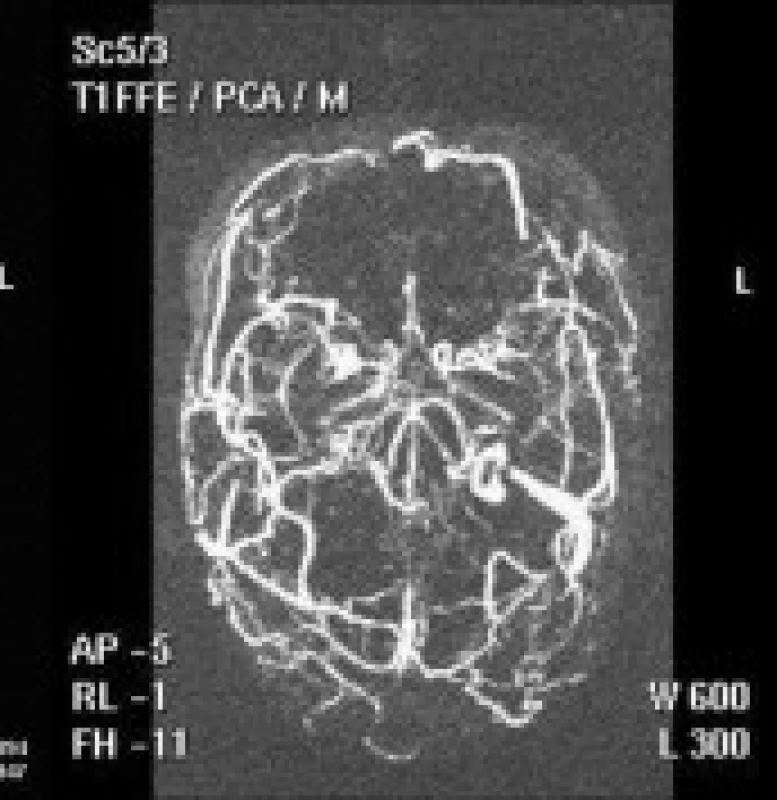
f) T1WI-MRI axiální scan s obrazem hyperintenzního signálu trombózy sinus transversus vpravo a hyperemie resp. venózní kongesce pravého temporálního laloku. g) TOF-MR venografie s nálezem trombózy sinus sagitalis superior, sinus transversus a sigmoideus vpravo, hlubokého žilního systému – sinus rectus, v. magna cerebri, vv. cerebri internae, a v. basalis Rosenthali. Obr. 4. Patologická anatomický nález. 
h) Trombóza sinus sagitalis superior patrna po otevření splavu a po sejmutí tvrdé mozkové pleny. i) Trombóza perimedulárních žil s hyperemií prodloužené míchy. Diskuse
První klinický obraz a patologický nález cerebrální venózní trombózy byl popsán Ribsem v roce 1825 u 45letého muže s generalizovaným maligním procesem. V období bez možnosti angiografického zobrazení byla diagnóza stanovována na základě klinického obrazu - progredujících bolestí hlavy, edému oční papily, křečí, fokálního ložiskového deficitu, kómatu a většinou potvrzena patologicko anatomickým nálezem trombózy durálních sinů, doprovázených hemoragickou infarzací [1]. V éře před CT a MR zobrazením byla dominantní diferenciálně diagnostickou metodou angiografie a doposud dává 3D-XR venografie nejpřesnější zobrazovací výsledky. V roce 2001 byla publikována významná studie „International Study of Cerebral Vein Thrombosis“ - ISCVT, která prospektivně sledovala data 624 pacientů s touto diagnózou [2].
Hluboký žilní systém zahrnující vv. cerebri internae, v. basalis Rosenthali, v. magna cerebri a sinus rectus, drénující mezimozek, bazální ganglia a hluboké struktury bílé hmoty hemisfér, je postižen v 10 % případů cerebrálních venózních trombóz. Těžší klinické obrazy zahrnující hemiparézy nebo kvadruparézy jsou způsobeny útlakem capsula interna při jednostranném nebo oboustranném postižením talamů či bazálních ganglií a lze je diagnostikovat neinvazivními vyšetřeními, jako je CT nebo MRI pod obrazem edému nebo hemoragického infarktu. Omezení žilního odtoku vede k mozkové hyperémii, edému a nakonec k mozkovému infarktu, většinou nalezené při MRI vyšetření pacientů s CVT [3,4,5].
Diagnóza CVT v našem souboru pacientek byla potvrzena MRI zobrazením, MR venografií a následně DSA. Liang et al potvrzují významnost trojdimenzionálního kontrastně zesíleného zobrazení magnetickou rezonanční MP-RAGE venografií v diagnostice trombóz durálních sinů, která byla rovněž užitečná u naší skupiny pacientů [6]. Pro diagnostiku CVT lze alternativně využít CT venografii doplněnou o techniku subtrakce kostních struktur -„Matched Mask Bone Elimination“ (MMBE) [7]. 3D-Xra-digitální rotační venografie dává excelentní alternativu s možností zobrazení rychlosti a směru průtoku v normálním úseku žilního systému jakož i v částečně trombózovaných úsecích durálních splavů a hlubokého žilního systému.
Léčba pacientů s intrakraniální venózní trombózou závisí na včasnosti klinického podezření na CVT a následném potvrzení diagnózy zobrazovacími technikami. Léčba heparinem je v současné době považována za metodu volby pro léčbu CVT [2]. Nicméně efekt heparinu může být u podskupiny pacientů s rychle progredujícími symptomy a postižením většiny durálních sinů a hlubokého systému příliš pomalý. Tato skupina pacientů by měla být indikována k trombolytické léčbě, protože jejich mortalita dosahuje 10 % [8,9,10,11]. Naše zkušenosti rovněž ukazují na možnost mechanické rekanalizace obturovaného žilního řečiště rheolytickou trombektomií a mechanickým rozrušením trombu balónkovými kat0try [12,13].
Trombofilní stavy jsou přítomny u 25-35 % pacientů s mozkovou žilní trombózou [14,15]. Hormonální antikoncepci užívá v současnosti více než 100 miliónů žen. Krátce po jejím zavedení do praxe v 60. letech se objevila zvýšená incidence trombotických vaskulárních komplikací, především hluboké žilní trombózy DKK, spojených s interakcí hormonálních kontraceptiv a hemokoagulačního systému [16,17,18]. Zvýšená aktivita koagulačních faktorů VII, VIII, X a fibrinogenu je všeobecným nálezem u většiny případů [19]. Martinelli et al uvádějí ve své práci relativní riziko vzniku mozkové žilní trombózy u uživatelek hormonální antikoncepce RR=6,1 (95% CI=3,3–11,00). Toto potenciální riziko může být dále umocněno vrozenými poruchami hemostázy [20].
Perorální kontraceptiva vyvolávají rozsáhlé změny ve fibrinolytickém systému. Dochází ke vzestupu plazminogenu, komplexu plazmin-alfa2-antiplazmin, zvyšuje se aktivita tkáňového aktivátoru plazminogenu (tPA) a naopak dochází ke snížení hladiny antigenu inhibitoru aktivátoru plazminogenu-I (PAI-I), poklesu PAI-I aktivity a celé řadě dalších změn. Ve svém důsledku je fibrinolýza u uživatelek antikoncepce zvýšená, což je pravděpodobně odezva a kompenzace protrombogenního stavu vyvolaného hormonálními preparáty. Tyto změny jsou stejné jak u preparátů obsahujících levonorgestrel, tak u preparátů obsahující gestageny třetí generace [21]. Geneticky podmíněné trombofilní stavy fibrinolytického systému (PAI-I) zvyšují potenciální riziko vzniku trombózy u uživatelek HAK. Byla rovněž pozorována zvýšená aktivita destiček a jejich shlukování [22].
Hormonální kontraceptiva s gestageny třetí generace jsou spojovány s vyšším rizikem venózních trombóz než předchozí generace kontraceptiv. Toto riziko je rovněž přítomno i u žen bez mutace faktoru V Leiden nebo pozitivní rodinné anamnézy [23]. Určitým překvapením byl vysoký výskyt homozygotní formy MTHF-C677T v našem souboru (37,5 %), což by mohlo být v souladu se zjištěním Martinelliho et al, kteří prokázal relativní riziko vzniku CVT u uživatelek hormonální antikoncepce s hyperhomocysteinemií RR = 19,5 (95% CI =5,7–67,3). Hladinu homocysteinu jsme u našich pacientek neurčovali. Dalšími častými nálezy byla mutace genu inhibitoru aktivátoru plazminogenu (PAI-1) a deficit proteinu S, které se mohou vyskytovat i v kombinacích zesilujících protrombogenní efekt. Nepozorovali jsme naopak výskyt faktoru V Leiden u pacientek s CVT, který je v literatuře zdůrazňován jako významný rizikový trombofilní faktor. Domníváme se, že u zemřelé pacientky hrála roli spíše pozdní diagnóza CVT než zvýšená hodnota faktoru VIII.
Závěr
Naše zkušenosti poukazují na možnost vzniku CVT u mladých žen užívajících hormonální antikoncepci, na kterou je nutno pomýšlet v případě vzniku intrakraniálních obtíží. CVT se nejčastěji projevuje bolestmi hlavy a poruchami rovnováhy. Při jejich náhlém vzniku u dosud zdravé ženy je třeba v diferenciální diagnostice pomýšlet i na tuto diagnózu. Iniciální CT resp. MRI vyšetření je proto nutno zaměřit na možnost postižení venózního intrakraniálního systému. MRI a MR-venografie či 3D-XR venografie významně zkracují diagnostický proces skupiny pacientek s postižením hlubokého žilního systému mozku a rychlým rozvojem symptomatologie. Přímá endovaskulární trombolýza s možností i mechanické revaskularizace může dramatickým způsobem zlepšit klinický průběh pacientů s trombózou mozkových žil a nedostatečným efektem antikoagulační terapie při rychle progredující poruše vědomí. Trombolytická terapie rovněž snižuje výskyt sekundárních komplikací po trombózách mozkových žil, jako jsou chronická intrakraniální hypertenze s poruchami vizu nebo vznik durálních arteriovenózních zkratů [24,25]. Vzhledem k výskytu těchto závažných komplikací považujeme, v souladu s doporučeními České gynekologicko–porodnické společnosti ČLS JEP, před zahájením podávání HAK za nezbytnou pečlivou analýzu osobní a rodinné anamnézy a v indikovaných případech podrobné vyšetření eventuální přítomnosti trombofilních stavů. Význam jednotlivých trombofilních mutací je nestejný. Absolutní kontraindikací nasazení HAK jsou deficit antitrombinu III, deficit proteinu C, homozygotní forma faktoru V Leiden. Screeningové vyšetřování žen před předpisem HAK na přítomnost trombofilních mutací není indikováno [26]. V našem souboru měly ovšem všechny pacientky i přes pečlivý retrospektivní rozbor negativní jak osobní tak rodinnou anamnézu. S ohledem na tuto skutečnost se nabízí otázka fakultativní možnosti vyšetření trombofilií hrazené ženou na její přání před nasazením HAK.
Přijato k recenzi: 8. 3. 2007
Přijato do tisku: 7. 5. 2007
Korespondující autor:
MUDr. Martin Procházka, Ph.D.
Porodnicko-gynekologická klinika LF UP a FN Olomouc
I.P.Pavlova 6, 775 20 Olomouc
e-mail: prochazka-martin@post.cz
Zdroje
1. Berenstein A, Lasjaunias P, Ter Brugge KG, Venous Occlusive Disease. In: Surgical Neuroangiography vol. 2.1 Clinical and Endovascular Treatment Aspects in Adults. 2nd ed. Berlin-Heidelberg: Springer-Verlag 2004 : 135-152.
2. Ferro JM, Canhao P, Stam J, Bousser MG, Barinagarrementeria F. For the ISCVT Investigators. Prognosis of cerebral vein and dural sinus thrombosis, results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT). Stroke 2004; 35 : 664-670.
3. Forbes PNK, Pipe JG, Heiserman JE. Evidence for cytotoxic edema in the pathogenesis of cerebral venous infarction. AJNR Am J Neuroradiology 2001; 22 : 450-455.
4. Peeters E, Stadnik T, Bissay F, Schmedding E, Osteaux M. Diffusion-weighted MR imaging of an acute venous stroke. AJNR Am J Neuroradiology 2001; 22 : 1949-1952.
5. Ducreux D, Oppenheim C, Vandamme X, Dormont D, Samson Y, Rancurel G et al. Diffusion-weighted imaging patterns of brain damage associated with cerebral venous thrombosis. AJNR Am J Neuroradiology 2001; 22 : 261-268.
6. Liang L, Korogi Y, Sugahara T, Onomichi M, Shigematsu Y, Yang D et al. Evaluation of the Intracranial Dural sinuses with a 3D contrast-enhanced MP-RAGE sequence: prospective comparison with 2D-TOF MR venography and digital subtraction angiography. AJNR Am J Neuroradiology 2001; 22 : 481-492.
7. Majoie CHB, van Straten M, Venema HW. Multisection CT Venography of the dural sinuses and cerebral veins by using matched mask bone elimination. AJNR Am J Neuroradiology 2004; 25 : 787-791.
8. Rael JR, Orrison WW Jr., Baldwin N, Sell J. Direct thrombolysis of superior sagittal sinus thrombosis with coexisting intracranial hemorrhage. AJNR Am J Neuroradiology 1997; 18 : 1238-1242.
9. Spearman MP, Jungreis ChA, Wehner JJ, Gerszten PC, Welch WC. Endovascular thrombolysis in deep cerebral venous thrombosis. AJNR Am J Neuroradiology 1997; 18 : 502-506.
10. Ciccone A, Canhao P, Falcao F, Ferro JM, Sterzi R. Thrombolysis for cerebral vein and dural sinus thrombosis. Cochrane Corner. Stroke 2004; 35 : 000-001.
11. Frey JL, Murro GJ, McDougall CG, Dean BL, Jahnke HK. Cerebral venous thrombosis-combined intrathrombus rtPA and intravenous heparin. Stroke 1999; 30 : 489-494.
12. Opatowsky MJ, Morris PP, Regan JD, Mewborne JD, Wilson JA. Rapid thrombectomy of superior sagittal sinus and transverse sinus thrombosis with a rheolytic catheter device. AJNR Am J Neuroradiology 1999; 20 : 414-417.
13. Dowd ChF, Malek AM, Phatouros CC, Hemphill JC III. Application of rheolytic thrombectomy device in the treatment od dural sinus thrombosis: A new technique. AJNR Am J Neuroradiology 1999; 20 : 568-570.
14. Provenzale JM, Barboriak DP, Allen NB, Ortel TL. Antiphospholipid Antibodies: Findings at Arteriography. AJNR Am J Neuroradiology 1998; 19 : 611-616.
15. Reuner KH, Ruf A, Grau A, Rickmann H, Stolz E, Jüttler E et al. Prothrombin Gene G20210→A transition is a risk factor for cerebral venous thrombosis. Stroke 1998; 29 : 1765-1769.
16. Lüdemann P, Nabavi DG, Junker R, Wolff E, Papke K, Buchner H et al. Factor V Leiden mutation is a risk factor for cerebral venous thrombosis. A Case – control study of 55 patients. Stroke 1998; 29 : 2507-2510.
17. Cantu C, Alonso E, Jara A, Martínez L, Rios C, Fernandez ML et al. Hyperhomocysteinemia, low folate and vitamin B12 concentrations and methylene tetrahydrofolate reductase mutation in cerebral venous thrombosis. Stroke 2004; 35 : 1790-94.
18. Rosendaal FR, Helmerhorst FM, Vandenbroucke JP. Oral contraceptives, hormone replacement therapy and thrombosis. Thromb Haemost 2001; 86 : 112–123.
19. Bloemenkamp KWM, Helmerhorst FM, Rosendaal FR, Vandenbroucke JP. Thrombophilias and gynaecology. Best Practice&Research Clinical Obsterics & Gynaecology 2003; 3 : 509-528.
20. Martinelli I, Battaglioli T, Pedotti P, Cattaneo M, Mannucci PM. Hyperhomocysteinemia in cerebral vein thrombosis. Blood 2003; 102 : 1363-1366.
21. Norris LA, Bonnar J. The effect of oestrogen dose and progesteron type on haemostatic changes in women taking oral contraceptives. Br J Obstet Gynaecol 1996; 103 : 261–267.
22. Kunz F, Pechlander C, Taberelli M, Solder E, Zwierzina WD. Influence of oral contraceptives on coagulation tests in native blood and plasma. Am J Obstet Gynaecol 1990; 163 : 417 – 420.
23. World Health Organization. Cardiovascular disease and steroid hormone contraception. Report of a WHO Scientific group. WHO Technical Report Series, no.877. Geneva: World Health Organization 1998.
24. Stolz E, Gerriets T, Bödeker RH, Penzel MH, Kaps M. Intracranial venous hemodynamics is a factor related to a favorable outcome in cerebral venous thrombosis. Stroke 2002; 33 : 1645-1650.
25. Phatouros C, Halbach VV, Dowd ChF, Lempert TE, Malek AM, Meyers PM et al. Acquired pial arteriovenous fistula following cerebral vein thrombosis. Stroke 1999; 30 : 2487-2490.
26. Čepický P, Cibula D, Dvořák K, Dvořák V, Fait T, Fanta M et al. Doporučení k předpisu kombinované hormonální kontracepce (CC). Aktualizace 2005. Čes Gynek 2005; 4 : 320-324.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 6- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Obrna lícního nervu
- Elektrofyziologické vyšetření lícního nervu
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- 5 let činnosti Národní referenční laboratoře lidských prionových onemocnění při Oddělení patologie a molekulární medicíny FTNsP: naše zkušenosti a přehled literatury
- Klinický pohled na výpočetní tomografii u akutní ischemie mozku
- Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
- Porovnání výsledků vyšetření zrakových evokovaných potenciálů u pacientů s roztroušenou sklerózou a neuroboreliózou
- Kognitívne evokované potenciály – vlna P300 u pacientov so sclerosis multiplex: vzťah k forme ochorenia, somatickému postihnutiu a kvalite života
- Relabující-remitující roztroušená skleróza a oligoklonální pruhy v průběhu léčby modifikující průběh choroby
- Mozková žilní trombóza u uživatelek hormonální antikoncepce
- Úspěšné použití jediné otázky pro screening syndromu neklidných nohou v České republice
- Závisí vývoj dysfunkce mikce u roztroušené sklerózy na typu neurologické léčby?
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Centrální neurocytom: kazuistika a přehled literatury
- Gelastické záchvaty u hypotalamického hamartomu: kazuistika
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
- Poúrazová porucha čichu: kazuistiky
- K šedesátinám doc. MUDr. Martina Bojara, CSc.
-
Směruje použití mediánu ke statistickým neparametrickým postupům zpracování dat?
Okénko statistika – Analýza dat v neurologii – III.
Nebojme se mediánu a robustních statistik - Webové okénko
-
Analýza dat v neurologii VI.
Přesnost, spolehlivost a reprodukovatelnost měření u diskrétních dat
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání