-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Desmoidní fibromatóza jako vzácný nádor mezenteria
Desmoid fibromatosis – a rare mesenteric tumor
In the following report, we present the case of a 31-year-old patient examined for a suspected small bowel tumour. Small bowel tumours are relatively rare and definitive diagnosis is often preceded by surgical resection. The same was true for our patient examined for a soft tissue lesion found with imaging techniques in close proximity to the small intestine. After ruling out hormonal activity, diagnostic laparotomy was performed. Desmoid fibromatosis, a rare tumour of the mesentery, was confirmed histopathologically. Although without metastatic potential, desmoid fibromatosis is a tumour with moderately malignant potential for aggressive growth into surrounding structures and organs and a large percentage of local recurrences.
Keywords:
desmoid fibromatosis – small intestine tumours – mesentery – sarcoma
Autoři: Grochol L. 1; Cibulková I. 1; Hrudka J. 2; Hajer J. 1
Působiště autorů: Divize gastroenterologie a hepatologie, Interní klinika 3. LF UK a FN Královské Vinohrady, Praha 1; Ústav patologie 3. LF UK a FN Královské Vinohrady, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2022; 76(1): 67-71
Kategorie: Gastrointestinální onkologie: kazuistika
doi: https://doi.org/10.48095/ccgh202267Souhrn
V následující kazuistice prezentujeme případ 31letého pacienta vyšetřovaného pro podezření na nádor tenkého střeva. Nádory tenkého střeva jsou samy o sobě relativně vzácné a k definitivní diagnóze mnohdy dochází až po chirurgické resekci. Stejně tomu bylo i u našeho pacienta vyšetřovaného pro nález měkkotkáňového útvaru v oblasti tenkého střeva dle zobrazovacích vyšetření. Po vyloučení hormonální aktivity byla provedena diagnostická laparotomie. Histopatologicky byl zjištěn vzácný nádor mezenteria – desmoidní fibromatóza. Jedná se o nádor bez metastatického potenciálu se středně maligním potenciálem pro agresivní růst do okolních struktur a orgánů a velké procento lokálních recidiv.
Klíčová slova:
desmoidní fibromatóza – nádory tenkého střeva – mezenterium – sarkom
Úvod
Desmoidní fibromatóza (DF) nebo také agresivní fibromatóza je relativně vzácný mezenchymální nádor charakteristický proliferací fibroblastů a myofibroblastů vycházejících z hluboké svalové fascie, aponeurózy, šlach nebo jizvové tkáně. Jedná se o klonální fibroblastickou proliferaci s benigní morfologií (zejména s absencí nekróz, jaderného polymorfizmu nebo atypických mitóz), bez metastatického potenciálu. Pro infiltrativní růst do okolních struktur a orgánů a vysokou tendenci k lokálním recidivám po radikální excizi se však řadí mezi nádory se středně maligním potenciálem. Řadí se mezi low-grade sarkomy [1,2].
Desmoidní fibromatóza bývá asociována s traumaty, endokrinními faktory nebo familiární adenomatózní polypózou (FAP, Gardnerův syndrom), ale etiologie je stále nejasná. Rozdělujeme ji buď podle mechanizmu vzniku na sporadickou a geneticky asociovanou, nebo podle anatomické lokalizace: extraabdominální fibromatóza (60 %) – hlava a krk, končetiny, trup; fibromatóza břišní stěny (25 %); intraabdominální fibromatóza (8–15 %) – nejčastěji mezenteria, dále retroperitonea nebo omenta. Intraabdominální nádory bývají nejvíce agresivní, zejména svou schopností infiltrovat okolní orgány [1].
Popis případu
Pacient, 31 let, bez interních komorbidit, pouze na terapii inhibitorem protonové pumpy (IPP) pro refluxní chorobu jícnu, byl v březnu 2021 opakovaně vyšetřen na ambulanci Chirurgické kliniky 3. LF UK a FNKV pro bolesti břicha v hypogastriu s iradiací do zad a nechutenství. Přechodně byly přítomny 2–3 řídké stolice denně a zvýšená plynatost, anamnéza stran abdominálního traumatu byla negativní. Při fyzikálním vyšetření dominovala palpační bolestivost v pravém mezo/hypogastriu. Výsledky základních laboratorních odběrů byly bez významných odchylek od normy.
Abdominální sonografie zobrazila ložisko v játrech charakteru hemangiomu, suspektní pravostrannou kaliko-nefrolitiázu bez městnání a ojedinělé lymfatické uzliny ve středním hypogastriu (podle popisu do 6 mm). Pro progresi obtíží a nález nejasného ložiska v pravém hypogastriu na kontrolní sonografii s odstupem 1 týdne bylo doplněno CT vyšetření břicha s nálezem měkkotkáňového útvaru o velikosti 43 × 42 × 39 mm v mezenteriu obsahujícího drobné tukové podíly. Dále byla zobrazena tři ložiska v játrech v.s. benigní etiologie. V diferenciální diagnostice byl iniciálně zvažován především karcinoid. K došetření byl pacient odeslán na gastroenterologii Interní kliniky 3. LF UK a FNKV.
K vyloučení karcinoidu bylo provedeno vyšetření 5-hydroxy-3-indoloctové kyseliny (5-HIO) ze sbírané moči za 24 hodin (dHIO). Pacient byl poučen o nutnosti dodržovat dietu s vynecháním potravin obsahujících serotonin 3 dny před vyšetřením (např. ananas, banány, rajčata, kiwi, švestky, pomeranče, avokádo, lilek, ořechy; dále nepít kofeinové nápoje včetně černého a aromatizovaného čaje, povzbuzující nápoje, ovocné šťávy a sirupy, minerální vody s příchutí nebo alkohol [3]). Týden před vyšetřením hladiny chromograninu A (CgA) byl IPP nahrazen antagonistou histaminového H2 receptoru. Výsledky byly negativní: hladina 5-HIO byla 18,9 μmol/l, dHIO 30,2 μmol/D, CgA 73,7 μg/l. Přítomnost tumoru se somatostatinovými receptory nebyla potvrzena při scintigrafii (99mTc-Tektrotyd). Neuron specifická enoláza nebyla vyšetřena.
Stav pacienta se v době probíhajících vyšetření zlepšil, byl obnoven plný perorální příjem, stolice byly pravidelné, formované, přetrvávaly jen intermitentní bolesti břicha neměnného charakteru.
Neuroendokrinní tumor s hormonální aktivitou nebyl prokázán, proto bylo multidisciplinárním týmem Gastrocentra FNKV a 3. LF UK indikováno doplnění pozitronové emisní tomografie (PET) před diagnostickou laparotomií. Nález na PET potvrdil v mezikličkové lokalizaci nepravidelný solidní útvar s okrajově patrným fokusem lehce zvýšené akumulace deoxyglukózy značené radioaktivním fluorem (FDG) bez známek lymfadenopatie či eventuální diseminace (obr. 1).
Obr. 1. CT vyšetření břicha s nálezem měkkotkáňového útvaru o velikosti 43 x 42 x 39 mm v mezenteriu (šipka) obsahujícího drobné tukové podíly. PET/CT rekonstrukce potvrdila v mezikličkové lokalizaci nepravidelný solidní útvar s okrajově patrným fokusem lehce zvýšené akumulace FDG, bez známek lymfadenopatie či eventuální diseminace.
Fig. 1. Abdominal CT scan showed 43 x 42 x 39 mm mesenteric soft tissue lesion containing small adipose areas. PET/CT reconstruction confirmed irregular solid interloop lesion with slightly higher FDG uptake in marginal area and no signs of lymphadenopathy or dissemination.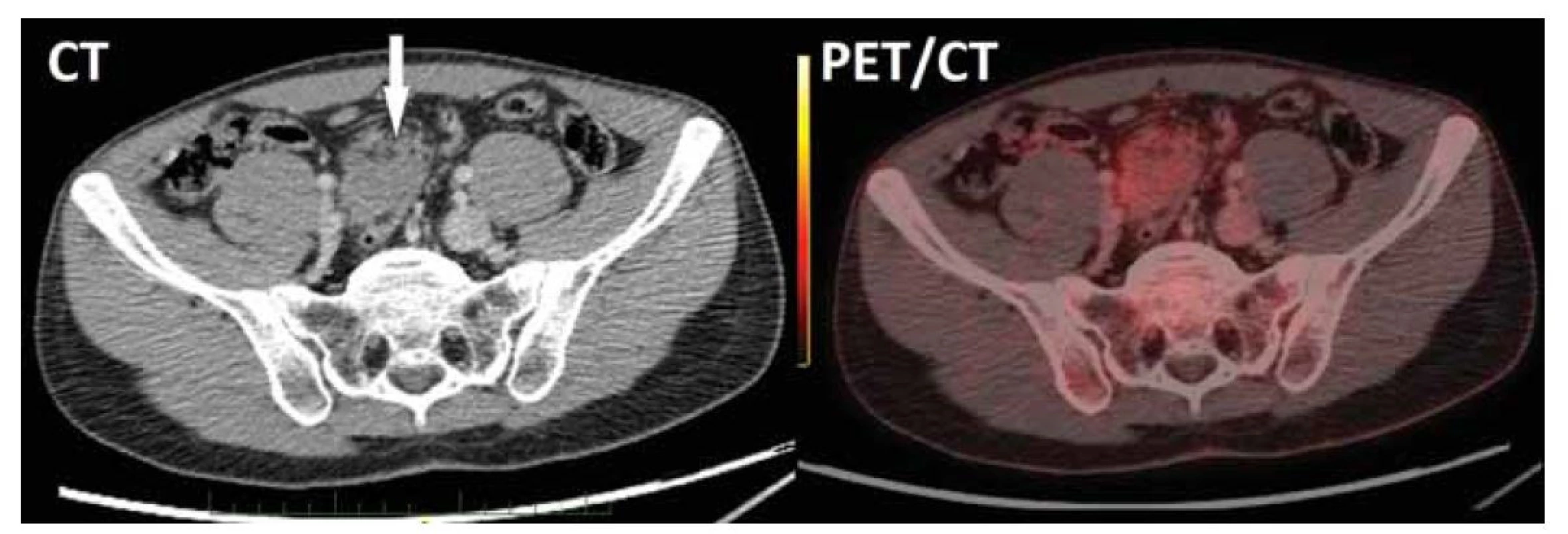
Peroperačně byl nalezen tuhý, hladce opouzdřený bělavý tumor v oblasti terminálního ilea velikosti 55 x 45 x 35 mm, místy infiltrující tenké střevo. Další tumor stejné charakteristiky velikosti 20 x 16 x 7 mm byl odstraněn z oblasti levého ureteru. Histopatologicky byl u obou ložisek popsán mezenchymální tumor s fascikulární stavbou z dlouhých svazků vřetenovitých buněk, část buněk je pozitivní v průkazu hladkosvalového aktinu. Proliferační aktivita nepřesahovala 5 % (obr. 2, 3). Popis nádoru odpovídá desmoidní fibromatóze.
Obr. 2. Histologické preparáty zachycující fibroblastickou/myofibroblastickou vřetenobuněčnou proliferaci vykazující fascikulární stavbu z dlouhých buněčných svazků tzv. long sweeping fascicles, kapiláry sledují směr svazků (A: hematoxylin eosin, 5x). Léze vykazuje infiltrativní okraje a vrůstá do hladkosvalové stěny tenkého střeva a tukové tkáně mezenteria (B: hematoxylin eosin, 5x). Léze vykazuje nízkou buněčnost, sestává ze štíhlých vřetenitých buněk charakteru (myo)fibroblastů (C: hematoxylin eosin, 10x). Některé buňky tvarově kopírují zvlněná kolagenní vlákna, bez cytonukleárních atypií (D: hematoxylin, 20x).
Fig. 2. Histology slides showcasing fibroblastic/myofibroblastic spindle cell proliferation exhibiting fascicular structure formed by long cell bundles, so-called long sweeping fascicles, and capillaries following the direction of the bundles (A: hematoxylin eosin, 5x). The tumour exhibits marginal infiltration of the small intestine smooth muscle wall and adjacent adipose mesentery tissue (B: hematoxylin-eosin, 5x). The tumor is of low cellularity, consisting of (myo) fibroblasts (C: hematoxylin-eosin, 10x). Some cells copy the wavy shape of collagen fibers, showing no nuclear atypia (D: hematoxylin, 20x).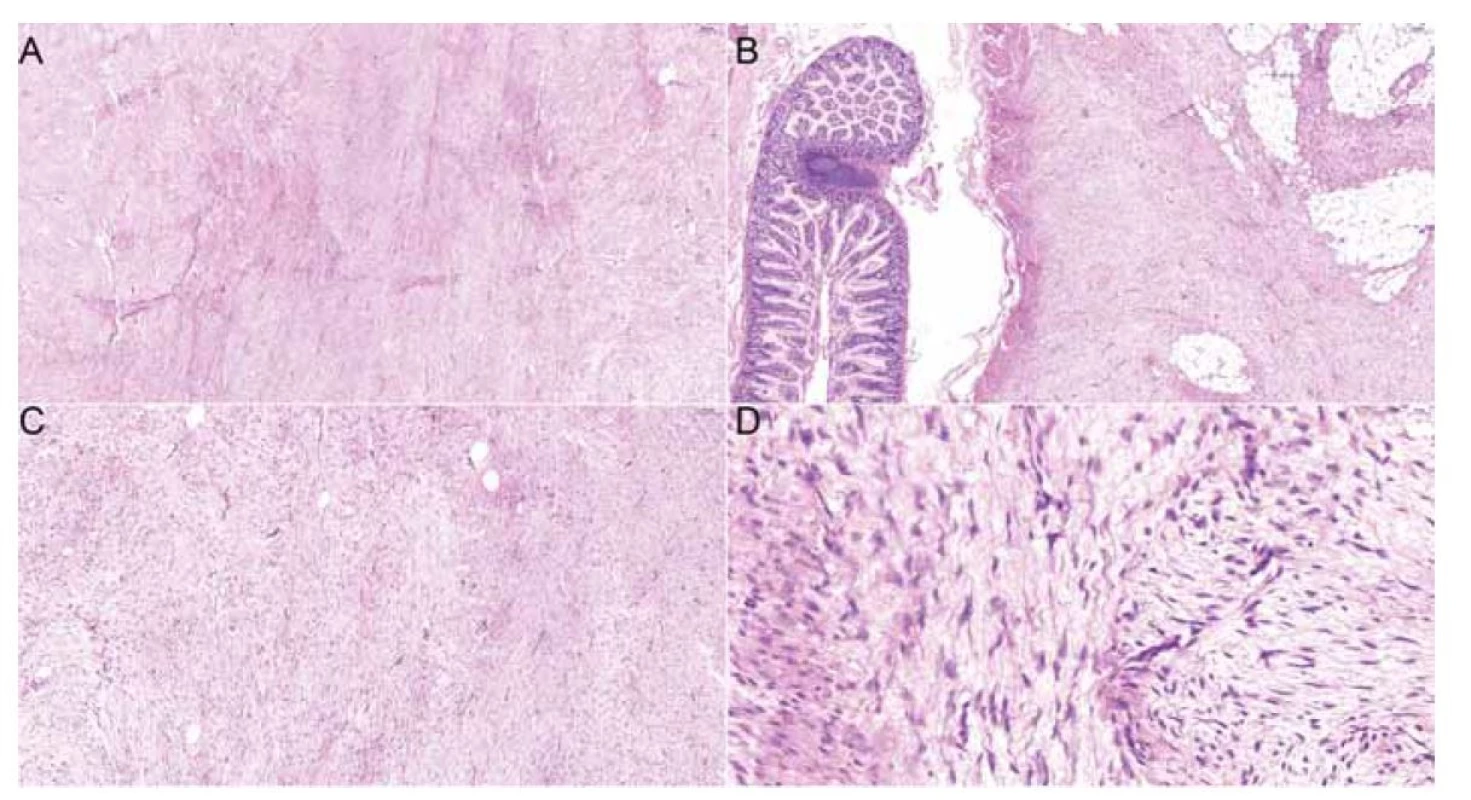
Obr. 3. Imunohistochemické preparáty (20x) dokumentující jadernou pozitivitu beta-cateninu a cytoplazmatickou pozitivitu hladkosvalového aktinu (SMA) ve významné části buněčnosti léze. CD117 (c-kit) je v buňkách léze negativní, je patrná membránová pozitivita žírných buněk coby vnitřní kontrola. Proliferační aktivita (Ki67) léze je nízká s pozitivitou nepřesahující 5 % buněk.
Fig. 3. Immunohistochemical slides (20x) showing beta-catenin nuclear positivity and cytoplasmic positivity of smooth muscle actin (SMA) in a signifi cant part of the cellular lesion. CD117 (c-kit) is negative in tumorous cells, membrane positivity of mast cells which was used as means of internal control is evident. The proliferative activity (Ki67) of the tumor is low with cellular positivity not exceeding 5%.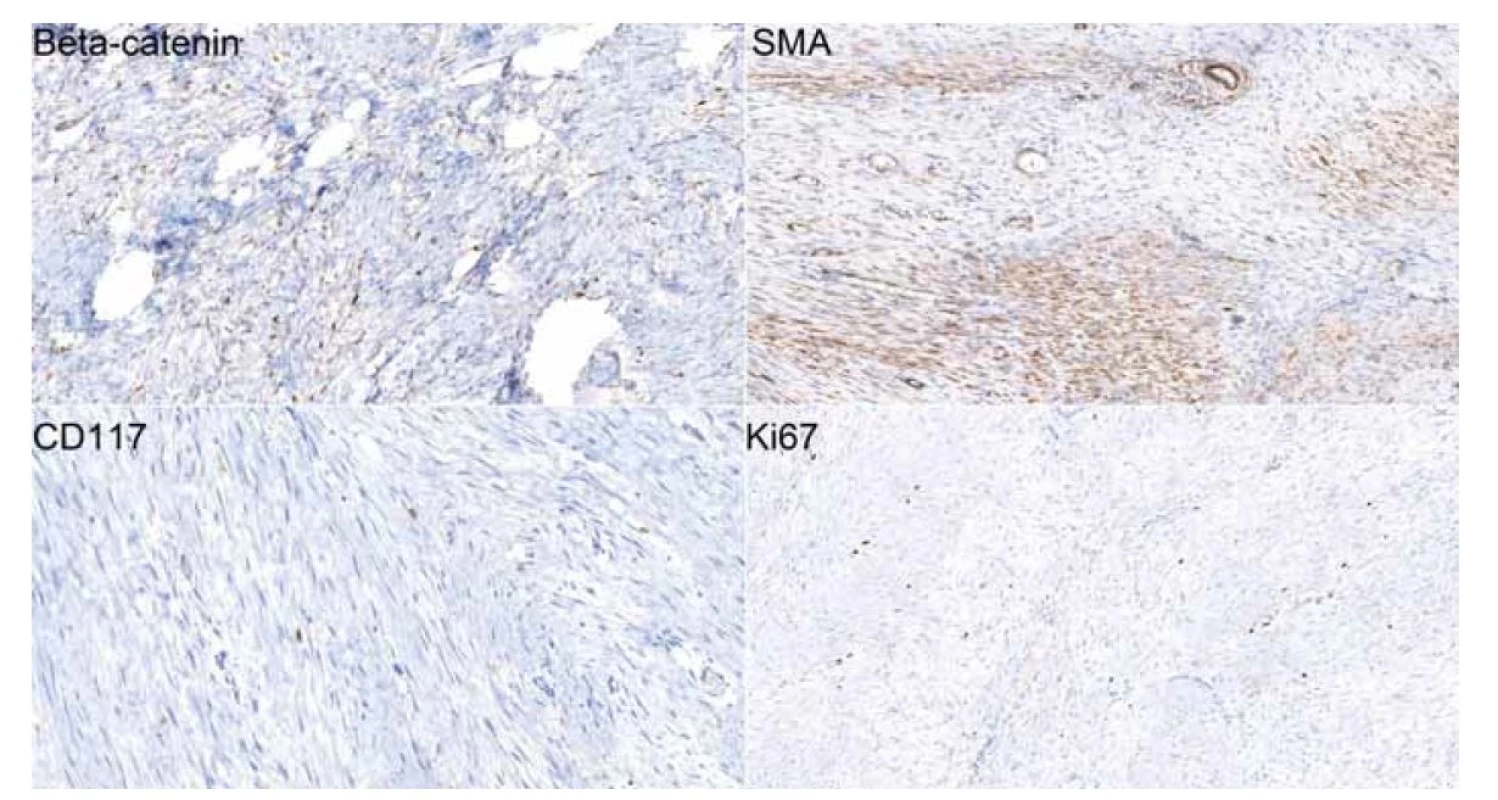
Operační výkon proběhl bez komplikací s příznivým pooperačním vývojem. Vzhledem k možné asociaci s FAP byla doplněna koloskopie s negativním nálezem. S odstupem 6 měsíců bylo provedeno kontrolní CT vyšetření hrudníku, břicha a malé pánve bez nálezu recidivy nádoru.
Jako vedlejší nález na PET/CT byl zobrazen hypodenzní útvar u dorzální stěny v lumen levé komory srdce 18 x 11 mm s vysokou akumulací FDG. Opakovaně byla provedena echokardiografie – v oblasti popisovaného útvaru byl detekován pouze papilární sval. Patologický útvar v levé komoře nebyl prokázán ani na MR vyšetření srdce.
Pacient zůstává v gastroenterologické a onkologické dispenzarizaci.
Diskuze
Maligní nádory tenkého střeva (NTS) představují asi 1–3 % zhoubných tumorů gastrointestinálního traktu (GIT). Incidence maligních NTS je přibližně 2,35 na 100 000 osob [4]. Maligní NTS bývají často asymptomatické a případné nespecifické symptomy jsou pak již projevem pokročilého onemocnění. Nejčastěji se projeví příznaky spojenými s obstrukcí střeva nebo v souvislosti s okultním krvácením [5]. Výpočetní tomografie (CT) břicha zachytí NTS asi v 80 %, v případě provedení enterografie pomocí MR nebo CT je záchyt asi v 85–95 % případů. PET/CT je přínosná u pacientů s adenokarcinomy nebo sarkomy; karcinoidy jsou oproti těmto již méně FDG-avidní [6]. V diferenciální diagnostice musíme na prvním místě zvážit maligní NTS – nejčastější bývají adenokarcinomy (30–40 %), neuroendokrinní tumory (35–44 %), lymfomy (10–20 %) a gastrointestinální stromální nádory (12–18 %) [7].
V diferenciální diagnostice bychom však neměli zapomenout na intraabdominální formu DF, která může na zobrazovacích vyšetřeních NTS připomínat.
Incidence DF je 2–5 případů na 1 milion osob ročně [1]. Představují < 3 % měkkotkáňových tumorů a přibližně 0,03 % všech nádorů. Tyto nádory se vyskytují ve všech věkových skupinách, nejvíce však ve třetím a čtvrtém decenniu [8]. DF bývá častěji popisována u žen (2 : 1 až 5 : 1) [9], v patogenezi onemocnění je proto zvažován podíl estrogenních hormonálních poruch. V největší studii zaměřené na DF uvedené v literatuře se 130 případy však bylo 55 % mužů [10].
Geneticky asociovaná DF se při FAP vyskytuje v 10–20 % případů, u Gardnerova syndromu je pak popisována ve 2–32 % případů [11]. Mutace genu adenomatózní polypózy tlustého střeva (APC) na dlouhém raménku 5. chromozomu byly popsány jak u FAP, tak u familiárních non-FAP tumorů. Somatické mutace APC genu byly popsány také v 80–90 % u sporadických případů. Dále byly popsány aktivační mutace genu CTNNB1 pro beta-catenin, které vedou k aktivaci fibroblastické proliferace v důsledku akumulace beta-cateninu [12].
Většina pacientů je po dlouhou dobu zcela asymptomatická z důvodu pomalého růstu tumoru. Klinické příznaky jsou pak velmi variabilní s ohledem na lokalizaci a velikost tumoru, nejčastěji se jedná o problémy s pasáží v důsledku mechanického útlaku, méně často pak dochází k útlaku ureteru nebo splenické žíly. V jiných případech může být dominantním příznakem enteroragie vedoucí případně až k perforaci střeva v důsledku ischemie submukózy. Vzácně může dojít k ruptuře aorty, vzniku intraabdominálního abscesu nebo výskyt plynu v portálním žilním řečišti [1,10].
Při diagnostice intraabdominálního tumoru lze použít v první řadě sonografické vyšetření, ale důraz je kladen zejména na CT nebo MR vyšetření k posouzení infiltrace okolních orgánů a vztahu k cévním svazkům. CT se pak využívá zejména ke stagingu. Role zobrazovacích vyšetření v diferenciální diagnostice je již méně významná. V diferenciální diagnostice DF zvažujeme zejména gastrointestinální stromální tumor (GIST), karcinoid, lymfom nebo sklerozující mezenteritidu [13]. MR se využívá zejména při alergii na jodovou kontrastní látku nebo jako metoda volby při extraabdominální DF. V případě intraabdominální DF se pak MR využívá primárně k posouzení případné recidivy [1,14].
Dle doporučených postupů NCCN (National Comprehensive Cancer Network) lze asymptomatické pacienty po bioptické verifikaci nálezu pravidelně sledovat [2]. S ohledem na možnou lokálně agresivní progresi onemocnění je v terapii intraabdominální DF stěžejní chirurgická resekce, nevýhodou je pak významná morbidita zejména při resekci velkého úseku tenkého střeva. Lokální recidiva nastává u 13–68 % nemocných i v případě biopticky negativních resekčních okrajů a v průměru nastane mezi 15 a 24 měsíci. V případě neresekabilního tumoru, nejasných resekčních okrajů nebo v případě recidivy je indikována radioterapie nebo chemoterapie. Odpověď desmoidu na ozáření je pomalá a obecně se u intraabdominální formy nedoporučuje [15]. Cytostatickou nebo cytotoxickou systémovou terapií tamoxifenem, interferonem alfa, imatinibem a nesteroidními antirevmatiky lze zpomalit lokální progresi onemocnění [1,2,15].
Prognóza onemocnění bývá příznivá, ale je ovlivněna zejména mírou recidivy a sekundární morbiditou spojenou s resekcí infiltrovaných orgánů.
Závěr
V diferenciální diagnostice vzácných intraabdominálních nádorů bychom neměli opomenout desmoidní fibromatózu. DF je charakteristická infiltrativním růstem do okolních struktur a orgánů a vysokou tendencí k lokálním recidivám bez metastatického potenciálu. Klinické příznaky jsou nespecifické a nejčastěji jsou spojeny s obstrukcí střeva nebo v souvislosti s okultním krvácením stejně jako nádory trávicí trubice. Etiologie je nejasná, ale DF bývá asociována s FAP, Gardnerovým syndromem, traumaty nebo endokrinními faktory. Tyto nádory se nejčastěji vyskytují ve třetím a čtvrtém decenniu a častěji u žen. V terapii je stěžejní chirurgická resekce, nevýhodou je pak významná morbidita zejména při resekci velkého úseku tenkého střeva.
ORCID autorů
L. Grochol ORCID 0000-0002-0646-1479,
I. Cibulková ORCID 0000-0002-1889-6023,
H. Hrudka ORCID 0000-0002-5649-4586,
J. Hajer ORCID 0000-0003-3780-3088.
Doručeno/Submitted: 12. 1. 2022
Přijato/Accepted: 4. 2. 2022
MUDr. Lukáš Grochol
Divize gastroenterologie a hepatologie
Interní klinika 3. LF UK a FN Královské Vinohrady
Šrobárova 1150
100 34 Praha 10
Zdroje
1. Li Destri G, Ferraro MJ, Calabrini M et al. Desmoid-type fibromatosis of the mesentery: report of a sporadic case with emphasis on differential diagnostic problems. Case Rep Med 2014; 2014 : 850180. doi: 10.1155/2014/850 180.
2. Efthimiopoulos GA, Chatzifotiou D, Drogouti M et al. Primary asymptomatic desmoid tumor of the mesentery. Am J Case Rep 2015; 16 : 160–163. doi: 10.12659/AJCR.892521.
3. Moncer F, Adhoum N, Catak D et al. Electrochemical sensor based on MIP for highly sensitive detection of 5-hydroxyindole-3-acetic acid carcinoid cancer biomarker in human biological fluids. Anal Chim Acta 2021; 1181 : 338925. doi: 10.1016/j.aca.2021.338925.
4. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Available from: http: //www.svod.cz.
5. Tang SJ, Haber GB. Capsule endoscopy in obscure gastrointestinal bleeding. Gastrointest Endosc Clin N Am 2004; 14 (1): 87–100. doi: 10.1016/j.giec.2003.10.011.
6. Pourmand K, Itzkowitz SH. Small bowel neoplasms and polyps. Curr Gastroenterol Rep 2016; 18 (5): 23. doi: 10.1007/s11894-016-0497-x.
7. Bilimoria KY, Bentrem DJ, Wayne JD et al. Small bowel cancer in the United States: changes in epidemiology, treatment, and survival over the last 20 years. Ann Surg 2009; 249 (1): 63–71. doi: 10.1097/SLA.0b013e31818e4641.
8. Venkat D, Levine E, Wise WE. Abdominal pain and colonic obstruction from an intra-abdominal desmoid tumor. Gastroenterol Hepatol (NY) 2010; 6 (10): 662–665.
9. Ferenc T, Sygut J, Kopczyński J et al. Aggressive fibromatosis (desmoid tumors): definition, occurrence, pathology, diagnostic problems, clinical behavior, genetic background. Pol J Pathol 2006; 57 (1): 5–15.
10. Burke AP, Sobin LH, Shekitka KM et al. Intra-abdominal fibromatosis. A pathologic analysis of 130 tumors with comparison of clinical subgroups. Am J Surg Pathol 1990; 14 (4): 335–341.
11. Clark SK, Neale KF, Landgrebe JC et al. Desmoid tumours complicating familial adenomatous polyposis. Br J Surg 1999; 86 (9): 1185–1189. doi: 10.1046/j.1365-2168.1999.01 222.x.
12. Cheon SS, Cheah AY, Turley S et al. beta-Catenin stabilization dysregulates mesenchymal cell proliferation, motility, and invasiveness and causes aggressive fibromatosis and hyperplastic cutaneous wounds. Proc Natl Acad Sci U S A 2002; 99 (10): 6973–6978. doi: 10.1073/pnas.102657399.
13. Chen CB, Chiou YY, Chen CH et al. Sonographic and computed tomography findings of intra-abdominal desmoid tumor. J Chin Med Assoc 2010; 73 (7): 393–395. doi: 10.1016/S1726-4901 (10) 70084-8.
14. Faria SC, Iyer RB, Rashid A et al. Desmoid tumor of the small bowel and the mesentery. AJR Am J Roentgenol 2004; 183 (1): 118. doi: 10.2214/ajr.183.1.1830118.
15. Howard JH, Pollock RE. Intra-abdominal and abdominal wall desmoid fibromatosis. Oncol Ther 2016; 4 (1): 57–72. doi: 10.1007/ s40487-016-0017-z.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Perspektivní rok 2022Článek Buďme optimisty!Článek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2022 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Kvíz z klinické praxe
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
- Perspektivní rok 2022
- Komplikovaný průběh Crohnovy nemoci tenkého střeva u nemocné v osmém decenniu
- Point-of-care metoda měření hladiny infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty na biologické léčbě
- Biosimilární léčba v dětské gastroenterologii – současný pohled
- Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie
- Buďme optimisty!
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Výběr z mezinárodních časopisů
- Odešla mimořádná osobnost české gastroenterologie – Ivo Skála (17. 12. 1933 – 10. 2. 2022)
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



