-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
Evolution of insulin resistance after liver transplantation – a prospective study
Introduction: Insulin resistance (IR) plays an important role in the pathogenesis of nonalcoholic fatty liver disease and other diseases. Data regarding the prevalence and evolution of IR in patients before and after liver transplantation (LT) are limited. This prospective study aimed to evaluate the prevalence and evolution of IR in patients before and within 2 years (Y) after LT.
Methods: In 77 patients listed for LT from May 2015 to April 2017, clinical, laboratory, and elastographic evaluations were performed before LT and 6 months (M), 1Y, and 2Y after LT. The liver fat content was also determined by 1H magnetic resonance (1H MR) spectroscopy. Liver graft biopsy was performed at 1Y and 2Y after LT.
Results: IR defined as HOMA-IR ≥ 3.0 was found in 26 patients (41.3%) before LT, 16 patients (25.4%) at 6M after LT, 22 patients (34.9%) at 1Y after LT, and 29 patients (46.0%) at 2Y after LT (P = 0.028 for 2Y vs. 6M). Pretransplant IR correlated with age, indication for LT, and the presence of metabolic syndrome. IR at 2Y after LT correlated with the presence of metabolic syndrome, hypertension, and diabetes mellitus, body mass index, the level of gamma-glutamyl transferase, the liver fat content estimated both histologically and by 1H MR spectroscopy, the grade of ballooning in liver biopsy, and the fibrosis stage estimated by shear wave elastography.
Conclusion: The prevalence of IR is high in patients both before and after LT, and increases significantly with time after LT. Great attention should be paid to posttransplant IR and associated factors.
Submitted: 23. 7. 2019
Accepted: 13. 8. 2019
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review.
The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: This work was fi nancially supported by grant No. 15-26906A of the Ministry of Health of the Czech Republic.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for bio medical papers.
Keywords:
nsulin resistance – magnetic resonance – NAFLD
Autoři: Irena Míková 1
; Erhartová D. 1; K. Dvořáková 1
; Šedivý P. 2; Drobný M. 2; M. Dezortová 2
; M. Hájek 2
; M. Cahová 3
; H. Daňková 3
; Sticová E. 4; V. Lánská 5
; Pavel Trunečka 1
Působiště autorů: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 2; Centrum experimentální medicíny, IKEM, Praha 3; Pracoviště klinické a experimentální patologie, IKEM, Praha 4; Oddělení lékařské statistiky, IKEM, Praha 5
Vyšlo v časopise: Gastroent Hepatol 2019; 73(4): 287-295
Kategorie: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2019287Souhrn
Úvod: Inzulinová rezistence (IR) má velký význam v patogenezi nealkoholové tukové nemoci jater a dalších onemocnění. Údaje o prevalenci a vývoji IR u pacientů před transplantací jater (LT – liver transplantation) a po ní jsou omezené. Cílem naší prospektivní studie bylo zhodnocení prevalence a vývoje IR u pacientů před LT a v prvních 2 letech po LT.
Metody: U 77 pacientů zařazených na čekací listinu k LT v období 5/2015–4/2017 bylo před LT, 6 měsíců (M), 1 rok (R) a 2R po LT provedeno klinické a laboratorní vyšetření a elastografie jater, 1H magnetickou rezonanční (1H MR) spektroskopií byl stanoven obsah tuku v játrech. V 1 a 2 letech po LT byla provedena necílená biopsie jater.
Výsledky: IR definovanou jako HOMA-IR (Homeostasis Assessment Model) ≥ 3,0 mělo 26 pacientů (41,3 %) před LT, 16 pacientů (25,4 %) v 6M po LT, 22 pacientů (34,9 %) v 1R po LT a 29 pacientů (46,0 %) ve 2R po LT (p = 0,028 pro 2R vs. 6M). Předtransplantační IR korelovala s věkem, indikací k LT a přítomností metabolického syndromu. IR hodnocená 2R po LT korelovala s přítomností metabolického syndromu, hypertenze, diabetu, body mass indexu, gamaglutamyltransferázy, s množstvím jaterního tuku hodnoceného histologicky i 1H MR spektroskopií, se stupněm balonové degenerace v biopsii a se stupněm fibrózy dle shear wave elastografie.
Závěr: Prevalence IR je vysoká u pacientů před i po LT, významně stoupá s rostoucí dobou od LT. Výskytu potransplantační IR a souvisejících faktorů je třeba věnovat maximální péči.
Klíčová slova:
inzulinová resistence – magnetická rezonance – NAFLD
Úvod
Inzulinová resistence (IR) je patologický stav charakterizovaný nedostatečnou odpovědí tkání na inzulinovou signalizaci. IR přispívá k patofyziologii diabetes mellitus (DM), nealkoholové tukové nemoci jater (NAFLD – non-alcoholic fatty liver disease), je základním znakem metabolického syndromu a je přítomna u obezity a mnoha kardiovaskulárních chorob [1]. IR je jedním z hlavních faktorů vzniku a rozvoje jaterní steatózy. Neschopnost inhibovat glukoneogenezi zvyšuje glykemii a ta stimuluje de novo lipogenezi, ta je navíc inzulinem stimulována i přímo. Pacienti s NAFLD vykazují IR i v tukové tkáni a kosterním svalstvu (periferní IR). Tuková tkáň se stane rezistentní na antilipolytický účinek inzulinu, což zvyšuje dodávku volných mastných kyselin do jater. V důsledku IR v kosterním svalstvu je omezeno vychytávání glukózy [2].
Kvantifikace inzulinové senzitivity/rezistence má význam jak pro epidemiologické studie, tak i v klinické praxi. Přímé metody měření inzulinové senzitivity in vivo zahrnují metodu hyperinzulinemického euglykemického glukózového clampu a inzulinový supresní test. Tyto metody přímo hodnotí utilizaci glukózy zprostředkovanou inzulinem za ustálených podmínek, obě jsou nákladné a časově i organizačně značně náročné [1]. Pro účely větších epidemiologických studií lze IR snadno hodnotit pomocí HOMA-IR (Homeostasis Assessment Model) nebo inzulinovou senzitivitu pomocí QUICKI indexu (Quantitative Inzulin Senzitivity Check Index), oba indexy vycházejí z hodnot lačné inzulinemie a lačné glykemie. Inzulinovou senzitivitu je možné hodnotit i pomocí indexů lačná glykemie/inzulinemie nebo 1/lačná inzulinemie [1,3]. Hodnota HOMA-IR, která definuje IR, není ustálená, za hranici IR je používána hodnota HOMA-IR ≥ 2,5 [4], HOMA-IR ≥ 2,7 [5–9] nebo HOMA-IR ≥ 3,0 [10–12], ale lze se setkat i s hodnotou HOMA-IR > 1,64 [13] nebo HOMA-IR ≥ 2,0 [14]. Pacienti s hodnotou QUICKI indexu < 0,357 představují pacienty s typickou manifestací metabolického syndromu [15]. HOMA i QUICKI index jsou jednoduché indexy spolehlivě hodnotící IR u pacientů před transplantací jater (LT – liver transplantation) i po ní [16].
Vliv IR na patogenezi jaterního onemocnění není specifická pro NAFLD a nealkoholovou steatohepatitidu (NASH) [13,17], ale vyskytuje se např. i u cirhózy asociované s virovou hepatitidou C (HCV) [10,18]. U pacientů s cirhózou byla popsána souvislost IR se zvýšeným portosystémovým tlakovým gradientem [19,20], přítomností jícnových varixů (HVPG – hepatic venous pressure gradient) [19,21,22] a vyšším rizikem krvácení z jícnových varixů [19].
V prvních měsících po LT dochází ke zvýšení inzulinové senzitivity [16,23,24], nicméně data o prevalenci a vývoji IR pacientů po LT jsou velmi omezená. Vysoká prevalence DM (až 30 %) [25] a NAFLD (18–56,4 %) [26–29] po LT nasvědčují, že se IR týká velkého množství příjemců jaterního štěpu.
Cílem naší prospektivní studie bylo zhodnotit prevalenci a vývoj IR a souvisejících klinických, laboratorních, magneticko rezonančních (MR) a histologických parametrů u příjemců jaterního štěpu před a po LT.
Soubor pacientů a metodika
Soubor pacientů
Tato prospektivní studie zahrnula pacienty starší 18 let zařazené na čekací listině k LT, kteří podepsali informovaný souhlas se studií a MR vyšetřením. Mezi exclusion kritéria patřilo akutní jaterní selhání, přítomnost jaterní encefalopatie znemožňující podepsání informovaného souhlasu a kontraindikace MR vyšetření. Celkem bylo v období 5/2015–4/2017 do studie zařazeno 123 pacientů, 77 pacientů absolvovalo všechny 4 plánované kontroly: před LT v době zařazení na čekací listinu (V0), 6 měsíců (M) po LT (V1), 1 rok (R) po LT (V2) a 2R po LT (V3), ti tvořili soubor pacientů v této práci.
Klinická a laboratorní vyšetření
Při každé kontrole byla zhodnocena klinická data: výška, hmotnost, obvod pasu, kouření, konzumace alkoholu, přítomnost hypertenze, DM, u V0 Child-Pugh a MELD skóre. V průběhu všech kontrol byla zaznamenána podávaná medikace (statiny, antidiabetika), u V1–3 imunosupresivní léčba. Pacientům byla po celonočním lačnění odebrána krev na stanovení celkového bilirubinu, aspartátaminotransferázy (AST), alaninaminotransferázy (ALT), alkalické fosfatázy, gamaglutamyltransferázy (GGT), triglyceridů, celkového, HDL a LDL cholesterolu, glykemie, glykovaného hemoglobinu, C-peptidu a inzulinemie. Z hodnot lačné glykemie a lačné inzulinemie byl vypočten HOMA-IR (lačný inzulin (μU/ml) × lačná glykemie (mmol/l) / 22,5), QUICKI index (1/log lačný inzulin (μU/ml) + log lačná glykemie (mg/dl)), poměr G/I ratio (glukóza (mg/dl) /inzulin (μU/ml)) a dále 1/lačná inzulinemie (μIU/ml) [1]. U pacientů, kteří nebyli léčeni inzulinem, byl po celonočním lačnění proveden orální glukózový toleranční test (OGTT) s podáním roztoku 75g glukózy a byla hodnocena glykemie po 120 min.
Hypertenze byla definována jako krevní tlak ≥ 130/85 mm Hg nebo antihyper-tenzní léčba. DM byl definován jako koncentrace glukózy v plazmě na lačno ≥ 7,0 mmol/l (alespoň 2× v posledních 6M) nebo koncentrace glukózy v plazmě při OGTT po 120 min ≥ 11,1 mmol/l nebo léčený DM. Metabolický syndrom byl definován jako přítomnost ≥ 3 z 5 následujících faktorů: obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen, hypertenze, glykemie na lačno ≥ 5,6 mmo/l nebo DM, hypertriglyceridemie ≥ 1,7 mmol/l, HDL cholesterol < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen.
MR vyšetření a elastografie
Při každé kontrole bylo po alespoň 3hod lačnění stanoveno metodou 1H magnetické rezonační (1H MR) spektroskopie procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo). Při každé kontrole byla pacientům provedena shear wave elastografie s měřením tuhosti jater (kPa).
Biopsie jater
V 1R a 2R po LT byla v rámci standardního protokolu programu LT v Institutu klinické a experimentální medicíny (IKEM) provedena necílená biopsie jater. Vzorek biopsie jater byl získán Menghiniho technikou a zpracován standardním způsobem v naší laboratoři. Biopsie byly klasifikovány dle Kleinera [30] a steatóza rozdělena dle procenta postižených hepatocytů na stupeň 0 u < 5 %, stupeň 1 u 5–33 %, stupeň 2 u 33,1–66 % a stupeň 3 u > 66 %. V biopsiích byly hodnoceny i další složky NAFLD aktivity skóre (NAS) a stadium fibrózy [30].
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Hodnocení vývoje spojitých proměnných v čase bylo provedeno pro gaussovské veličiny párovým t-testem, pro negaussovské veličiny Wilcoxonovým neparametrickým testem a pro kategoriální jsme použili Stuartův test. Následně byla na hladiny významnosti použita Bonferroniho korekce pro mnohonásobná srovnání. Vztah HOMA indexu ke kategorickým proměnným byl hodnocen Kruskalovým-Wallisovým testem a vztah ke spojitým proměnným byl popsán Spearmanovým korelačním koeficientem. K hodnocení vývoje daného parametru byli použiti pacienti, u kterých byly veličiny k dispozici ve všech čtyřech kontrolách. Za statisticky významnou byla použita hodnota p < 0,05, všechny testy byly oboustranné. Pro statistické hodnocení jsme použili JMP 10.0.0 statistický software, SAS Institute Inc. 2012.
Výsledky
Vstupní charakteristika souboru je popsána v tab. 1. Soubor pacientů zahrnoval 77 pacientů (44 mužů) průměrného věku 56,75 ± 10,13 let, průměrné Child-Pugh skóre bylo 8,70 ± 2,25, průměrné MELD skóre 14,13 ± 4,27. Indikací k LT byla nejčastěji alkoholická cirhóza (29,9 %), biliární cirhóza (20,8 %), NASH (13,0 %) a HCV (13,0 %). 37 pacientů (48,1 %) mělo DM před LT, 33 pacientů (42,9 %) mělo v anamnéze hypertenzi. Iniciální imunosupresí po LT byla u všech pacientů kombinace tacrolimus, mykofenolát mofetil a kortikoidy, 14 pacientů (18,2 %) navíc dostalo iniciálně basiliximab.
Tab. 1. Vstupní charakteristika souboru (n = 77) před transplantací jater.
Tab. 7. Input characteristics of the group (n = 77) before liver transplantation.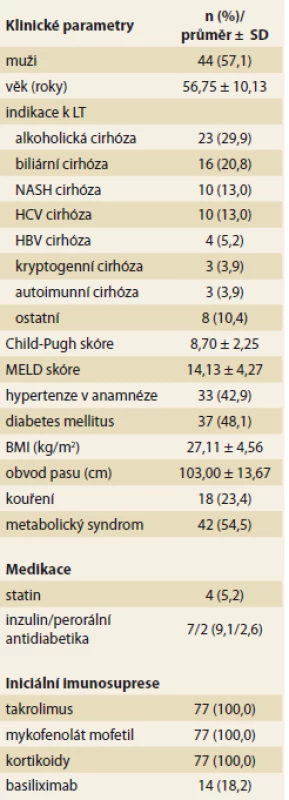
LT – transplantace jater, NASH – nealkoholová steatohepatitida, HCV – virus hepatitidy C, HBV – virus hepatitidy B, BMI – body mass index, SD – standardní odchylka Vývoj klinických a laboratorních parametrů v čase je uveden v tab. 2. Body mass index (BMI) a obvod pasu významně poklesly v prvních 6M po LT, do 2R po LT naopak významně stoupaly. Během prvních 6M po LT došlo k významnému nárůstu prevalence hypertenze (z 42,9 % před LT na 62,3 % 6M po LT), která dále byla stabilní. Prevalence DM byla stabilně vysoká (48,1 % před LT, 41,6 % 6M po LT, 44,2 % 1R po LT a 39,0 % 2R po LT). Prevalence metabolického syndromu byla vysoká před (54,5 %) i po LT (54,5 % v 6M; 64,9 % v 1R a 59,7 % ve 2R po LT). V prvních 6M po LT došlo v porovnání s obdobím před LT k významnému poklesu celkového bilirubinu, AST, GGT, lačné inzulinemie, naopak k významnému vzestupu došlo u hladiny celkového a LDL cholesterolu, triglyceridů, lačné glykemie a glykovaného hemoglobinu. Ve 2R po LT došlo v porovnání s obdobím 6M po LT k významnému poklesu ALT a GGT a k významnému vzestupu glykovaného hemoglobinu a lačné inzulinemie.
Z indexů IR (tab. 2) došlo v prvních 6M po LT k hraničně významnému poklesu průměrného HOMA-IR (p = 0,059). IR definovanou jako HOMA-IR ≥ 3,0 mělo 26 pacientů (41,3 %) před LT, 16 pacientů (25,4 %) v 6M po LT, 22 pacientů (34,9 %) v 1R po LT a 29 pacientů (46,0 %) v 2R po LT, vzestup mezi 6M a 2R po LT byl významný (p = 0,028). U QUICKI indexu inzulinové senzitivity jsme ve sledovaném období nezaznamenali významné změny, prevalence pacientů s nízkým QUICKI indexu (< 0,357) byla stabilně vysoká po celou dobu sledování. V souladu s poklesem HOMA-IR došlo v prvních 6M po LT ke vzestupu dalších indexů inzulinové senzitivity (lačná glykemie/inzulinemie a 1/lačná inzulinemie), které byly dále stabilní.
Tab. 2. Vývoj klinických a laboratorních parametrů a užívané medikace v čase (n = 77).
Tab. 2. Development of clinical and laboratory parameters and medication used over time (n = 77).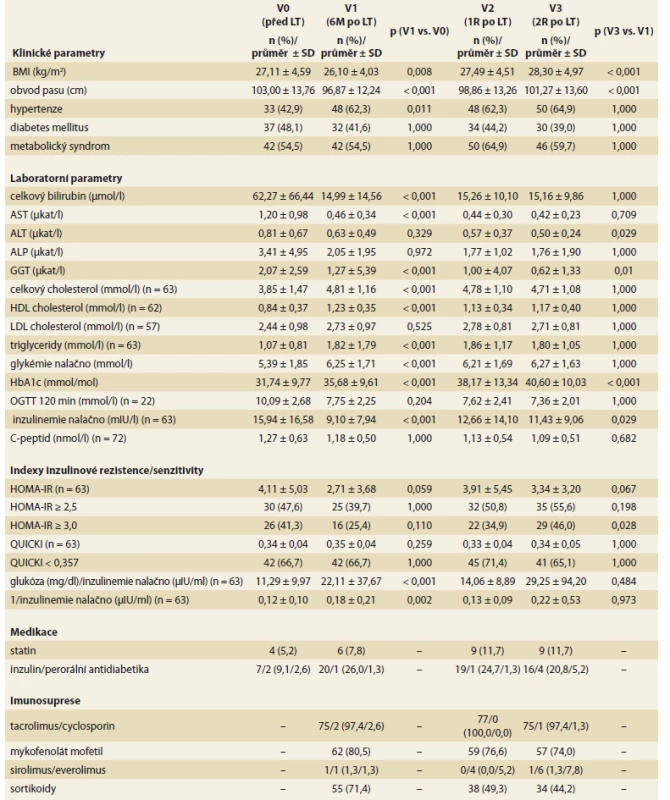
LT – transplantace jater, M – měsíc, R – rok, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, OGTT – orální glukózový toleranční test, HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, QUICKI – Quantitative Inzulin Senzitivity Check Index Procento objemu tuku v játrech stanovené 1H MR spektroskopií (tab. 3) se v čase významně zvyšovalo z průměrné hodnoty 1,25 % před LT, 1,88 % v 6M po LT, 2,61 % v 1R na 3,79 % ve 2R po LT. Tuhost jaterního štěpu hodnocená shear wave elastografií se v čase po LT neměnila. Steatózu jaterního štěpu (stupeň 1–3) stanovenou histologickým vyšetřením jaterního štěpu mělo 63,2 % pacientů v 1R po LT a 68,4 % pacientů ve 2R po LT, vývoj v čase nebyl signifikantní. Ostatní histologické znaky NAFLD konstituující aktivity skóre a stadium fibrózy rovněž nevykazovaly významné rozdíly mezi 1R a 2R po LT.
Tab. 3. Vývoj magnetické rezonance, elastografi ckých a histologických parametrů v čase.
Tab. 3. Evolution of magnetic resonance, elastographic and histological parameters over time.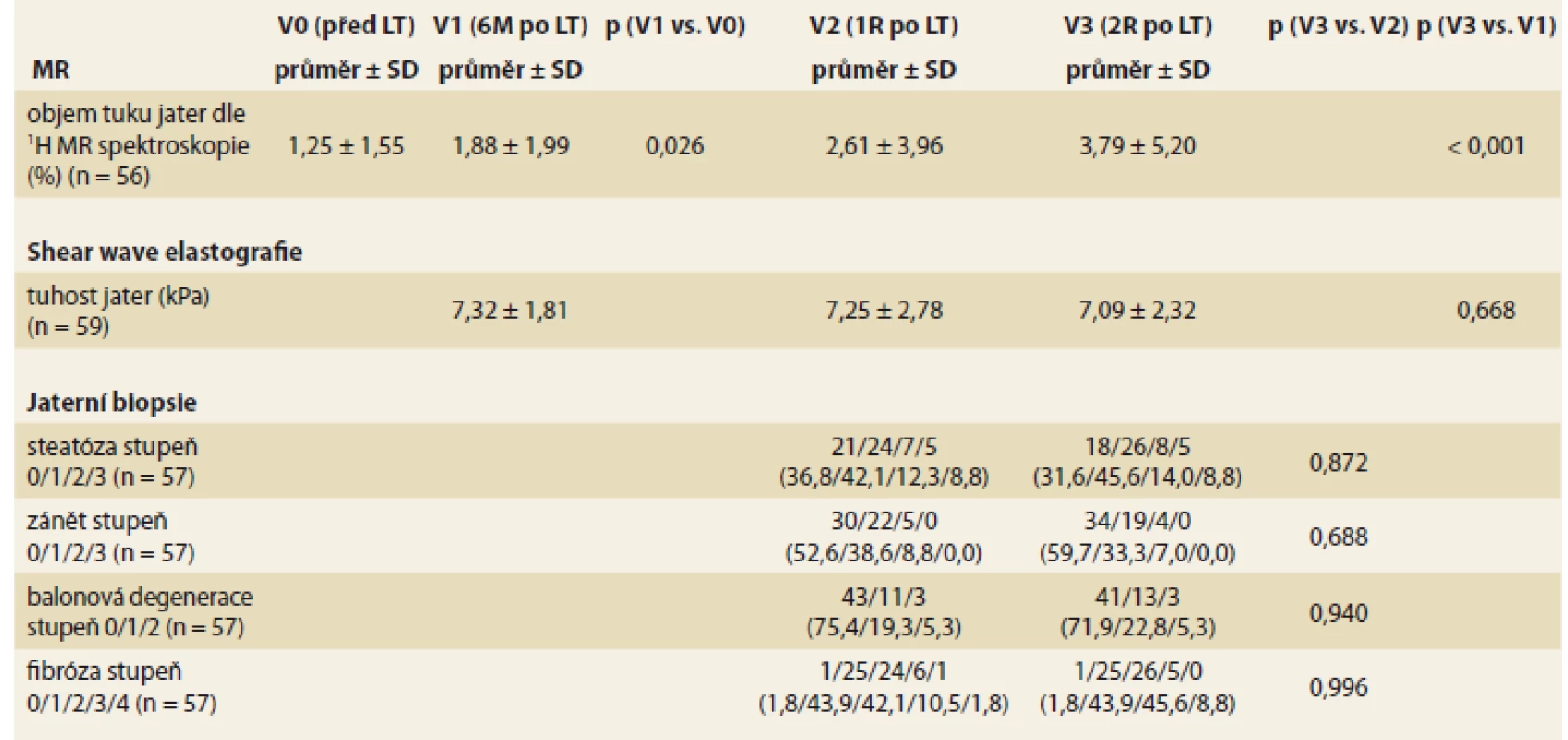
LT – transplantace jater, 1H MR – 1H magnetická rezonance, M – měsíc, R – rok, SD – směrodatná odchylka Předtransplantační HOMA-IR koreloval s věkem, přítomností metabolického syndromu a indikací k LT (tab. 4), přičemž nejvyšších průměrných hodnot HOMA-IR dosahovali pacienti s NASH a HCV cirhózou. HOMA-IR hodnocený 2R po LT (tab. 5) koreloval s přítomností hypertenze, diabetu, metabolického syndromu, BMI, GGT, stupněm steatózy a balonové degenerace v biopsii, tuhostí jater dle shear wave elastografie a objemem tuku v játrech dle 1H MR spektroskopie. Průměrné hodnoty HOMA-IR stoupaly s rostoucím stupněm fibrózy stanoveným histologickým vyšetřením (tab. 5), rozdíly však v našem souboru nebyly statisticky signifikantní.
Tab. 4. Korelace mezi HOMA-IR před transplantací jater s ostatními předtransplantačními faktory.
Tab. 4. Correlation between HOMA-IR before liver transplantation with other pre-transplant factors.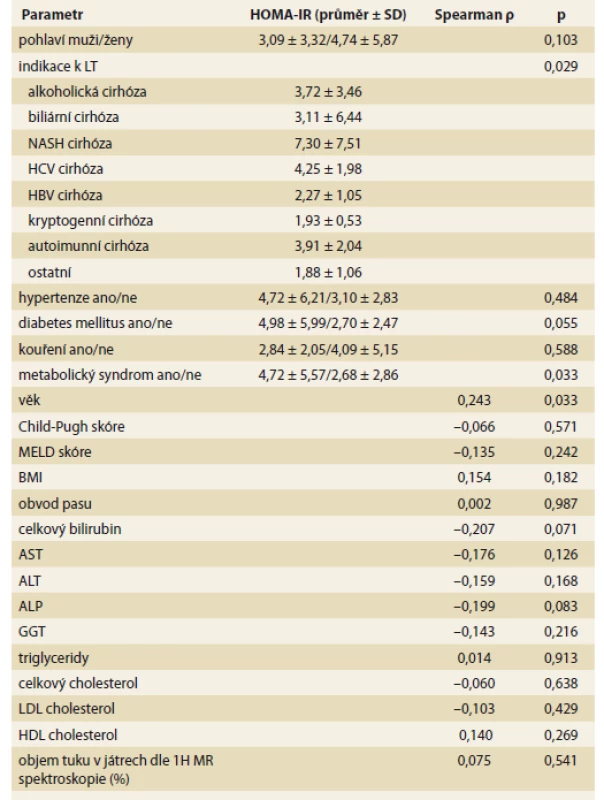
HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, SD – směrodatná odchylka, LT – transplantace jater, NASH – nealkoholová steatohepatitida, HCV – virus hepatitidy C, HBV – virus hepatitidy B, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferázy, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, 1H MR – 1H magnetická rezonance Tab. 5. Korelace mezi HOMA-IR 2R po transplantaci jater a s ostatními faktory 2 roky po transplantaci jater.
Tab. 5. Correlation between HOMA-IR 2Y after liver transplantation and other factors two years after liver transplantation.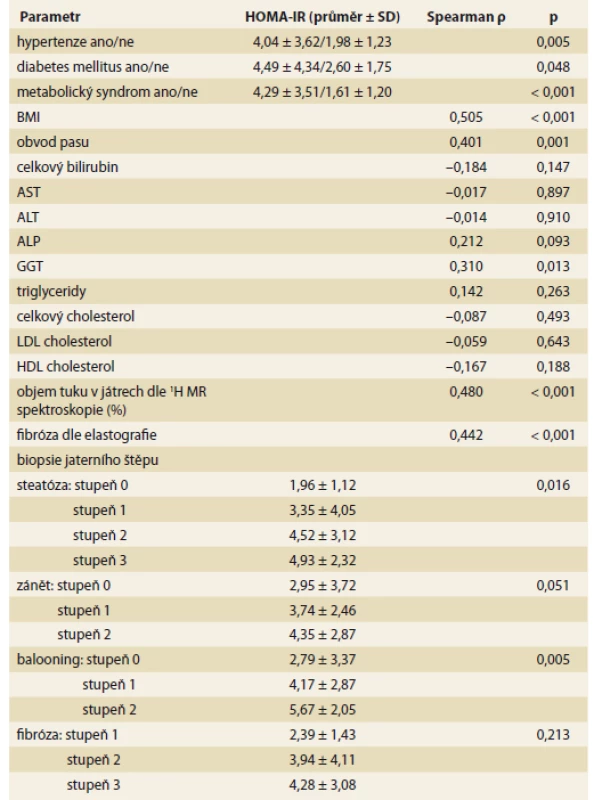
HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, 1H MR – 1H magnetická rezonance, SD – směrodatná odchylka, R – rok Diskuze
V naší práci jsme prospektivně sledovali příjemce jaterního štěpu před LT a 2R po LT a hodnotili prevalenci a vývoj IR a souvisejících klinických, laboratorních, MR a histologických parametrů. Zjistili jsme, že prevalence IR definované jako HOMA-IR ≥ 3,0 je před LT vysoká (41,3 %), během prvních 6M po LT vykazuje trend k poklesu na 25,4 % a po 2R od LT významně stoupne na 46,0 %.
Vysokou prevalenci IR definovanou jako HOMA-IR ≥ 3,0 u pacientů zařazených na čekací listinu k LT v naší studii (41,3 %) je obtížné srovnávat s literaturou, protože data o IR čekatelů na LT jsou velmi omezená, a navíc kritéria pro definici IR nejsou ustálená. Ve studii 53 pacientů s cirhózou a jícnovými varixy, která IR definovala jako HOMA-IR > 3,0, byla prevalence IR 56,6 % [11]. Ve studii s 280 pacienty s nově diagnostikovanou cirhózou bylo průměrné HOMA-IR skóre 5,8 [19]. Literární údaje svědčí o negativní prognostické hodnotě přítomnosti IR u pacientů s cirhózou. Ve studii 250 pacientů s kompenzovanou HCV cirhózou měli pacienti s HOMA-IR > 5,0 vyšší mortalitu a pacienti s HOMA-IR > 3,0 vyšší riziko jaterní dekompenzace [31]. V dalších studiích koreloval HOMA-IR s HVPG [19,20] a vyšším rizikem krvácení z jícnových varixů [19]. Jednou z příčin IR u pacientů s cirhózou je chronická hyperinzulinemie [32].
V naší skupině mělo před LT 48,1 % pacientů DM, přičemž k této vysoké prevalenci přispěla i systematická diagnostika DM s pomocí OGTT. Pacienti s tzv. hepatogenním diabetem, který je přímo vázán na ztrátu jaterní funkce, a vyvíjí se tedy až po rozvoji cirhózy, mají typicky normální hodnoty lačné glykemie a glykovaného hemoglobinu, ale abnormální odpověď na OGTT, který je nutný pro tuto diagnózu [33]. Je-li OGTT použit ke stanovení diagnózy DM u pacientů před LT, je prevalence DM vysoká (až 70,9 %) [23]. Vyšší hladiny glukózy pozorované u cirhotiků po perorálním podání glukózy jsou iniciálně způsobeny zvýšením množství požité glukózy, která se objeví v systémové cirkulaci a následně sníženým vychytáváním glukózy periferními tkáněmi v důsledku IR. Snížená suprese jaterní glukoneogeneze k orální glukózové intoleranci nepřispívá [34].
Pokles prevalence IR na 25,4 %, který jsme pozorovali v prvních 6M po LT, je v souladu s dalšími studiemi, které popsaly pokles IR po LT [16,23,24,35,36]. V naší práci i jiných studiích byl pozorován pokles inzulinemie [24,35], koncentrace C-peptidu [24] a normalizace nebo zlepšení glukózové tolerance [23,24]. Zlepšení glukózové tolerance a inzulinové senzitivity po LT je způsobeno zvýšenou jaterní clearance glukózy i zvýšenou utilizací glukózy periferními tkáněmi [24].
Významný nárůst prevalence IR s rostoucí dobou od LT (25,4 % v 6M, 34,9 % v 1R a 46,0 % ve 2R po LT) zjištěný v této studii byl doprovázen rostoucím objemem jaterního tuku stanovený 1H MR spektroskopií a je v souladu s naší předchozí studií, kde jsme pozorovali rostoucí prevalenci steatózy stanovené histologickým vyšetřením jaterního štěpu s rostoucí dobou od transplantace (30,3 % v 1R, 38,7 % v 5R a 47,6 % v 10R po LT) [29]. Jednou z příčin je pravděpodobně významný nárůst BMI v čase po LT pozorovaný v této studii. Ostatní klinické faktory související s IR (DM, hypertenze, metabolický syndrom) byly v průběhu potransplantačního sledování stabilní. Literární data o prevalenci IR pacientů po LT jsou omezená. Studie 119 pacientů z Brazílie průměrně 4R po LT udává prevalenci IR definovanou jako HOMA-IR ≥ 3,0 pouze 16 %, pacienti v této studii měli nižší BMI a nižší prevalenci DM, hypertenze a metabolického syndromu [12].
Předtransplantační IR korelovala s indikací k LT, přičemž nejvyšších hodnot HOMA-IR dosahovali dle očekávání pacienti s NASH a HCV cirhózou. IR je nezávislým prediktorem pokročilé fibrózy u pacientů s NASH [8,13,17] a HCV [8,10,37]. Dále v naší studii HOMA-IR koreloval s věkem a přítomností metabolického syndromu.
IR hodnocená 2R po LT korelovala s přítomností metabolického syndromu a jeho složek (hypertenze, DM, BMI). Dále výše IR korelovala s množstvím jaterního tuku hodnoceného jak histologicky, tak i 1H MR spektroskopií a dále i se stupněm balonové degenerace a hraničně i zánětlivých změn v biopsii štěpu, což potvrzuje vliv IR na rozvoj steatózy a NASH i u pacientů po LT, podobně jako tomu je u netransplantovaných pacientů [13]. Stupeň IR v naší studii koreloval se stupněm fibrózy dle shear wave elastografie, což je v souladu se studiemi u netransplantovaných pacientů, kde je IR prediktorem pokročilé fibrózy jater [8,10,13,17,37]. Pozorovali jsme i trend k vyššímu HOMA-IR v závislosti na stupni fibrózy stanoveném histologickým vyšetřením, rozdíly však v našem souboru nebyly statisticky signifikantní. Na rozdíl od biopsie jater, u které se hodnocení fibrózy provádí jen z malého vzorku jater a je jen semikvantitativní, je elastografické hodnocení prováděno z většího objemu jater a má charakter spojité veličiny, snáze tak může zaznamenat významné rozdíly v hodnocení fibrózy v relativně krátkém intervalu prvních 2R po transplantaci. Potransplantační IR navíc může být asociována s těžší rekurencí HCV, proto identifikace IR může pomoci identifikovat pacienty s rizikem rychlé progrese fibrózy po LT pro HCV [38].
V naší prospektivní studii jsme prokázali vysokou prevalenci IR u pacientů před i po LT a současně významný vzestup prevalence IR s rostoucí dobou od LT. Před LT koreloval HOMA-IR s věkem, indikací k LT a přítomností metabolického syndromu, po LT s přítomností metabolického syndromu a jeho složek (hypertenze, DM, BMI), GGT, s množstvím jaterního tuku hodnocené jak histologicky, tak i 1H MR spektroskopií, se stupněm nekroinflamatorních změn v biopsii a se stupněm fibrózy dle shear wave elastografie. Vzhledem k tomu, že literární údaje svědčí pro to, že může být potransplantační NASH/významná steatóza asociována s horším dlouhodobým přežíváním pacientů [29,39,40] a progredující fibrózou [39], je výskytu potransplantační IR a souvisejících faktorů (obezita, hypertenze, DM) třeba věnovat maximální péči ke zlepšení dlouhodobého přežívání pacientů i štěpů po LT.
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení.
Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Tato práce byla finančně podpořena grantem č. 15-26906A Ministerstva zdravotnictví České republiky.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 23. 7. 2019
Přijato: 13. 8. 2019
MUDr. Mgr. Irena Míková
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/9 140 21 Praha 4
Zdroje
1. Muniyappa R, Lee S, Chen H et al. Current approaches for assessing inzulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294 (1): E15–E26. doi: 10.1152/ajpendo.00645.2007.
2. Than NN, Newsome PN. A concise review of non-alcoholic fatty liver disease. Atherosclerosis 2015; 239 (1): 192–202. doi: 10.1016/j.atherosclerosis.2015.01.001.
3. Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19 (7): 527–534.
4. Magri CJ, Fava S, Galea J. Prediction of insulin resistance in type 2 diabetes mellitus using routinely available clinical parameters. Diabetes Metab Syndr 2016; 10 (2 Suppl 1): S96–S101. doi: 10.1016/j.dsx.2016.03.002.
5. Anastácio LR, Lima AS, Toulson Davisson Correia MI. Metabolic syndrome and its components after liver transplantation: incidence, prevalence, risk factors, and implications. Clin Nutr 2010; 29 (2): 175–179. doi: 10.1016/j.clnu.2009.08.008.
6. Petta S, Cammà C, Di Marco V et al. Insulin resistance and diabetes increase fibrosis in the liver of patients with genotype 1 HCV infection. Am J Gastroenterol 2008; 103 (5): 1136–1144. doi: 10.1111/j.1572-0241.2008.018 13.x.
7. Svegliati-Baroni G, Bugianesi E, Bouserhal T et al. Post-load insulin resistance is an independent predictor of hepatic fibrosis in virus C chronic hepatitis and in non-alcoholic fatty liver disease. Gut 2007; 56 (9): 1296–1301. doi: 10.1136/gut.2006.107946.
8. Bugianesi E, Marchesini G, Gentilcore E et al. Fibrosis in genotype 3 chronic hepatitis C and nonalcoholic fatty liver disease: role of insulin resistance and hepatic steatosis. Hepatology 2006; 44 (6): 1648–1655. doi: 10.1002/hep.21 429.
9. Pais R, Rusu E, Zilisteanu D et al. Prevalence of steatosis and insulin resistance in patients with chronic hepatitis B compared with chronic hepatitis C and non-alcoholic fatty liver disease. Eur J Intern Med 2015; 26 (1): 30–36. doi: 10.1016/j.ejim.2014.12.001.
10. Moucari R, Asselah T, Cazals-Hatem D et al. Insulin resistance in chronic hepatitis C: association with genotypes 1 and 4, serum HCV RNA level, and liver fibrosis. Gastroenterology 2008; 134 (2): 416–423. doi: 10.1053/j.gastro.2007.11.010.
11. Maruyama H, Kobayashi K, Kiyono S et al. Interrelationship between insulin resistance and portal haemodynamic abnormality in cirrhosis. Int J Med Sci 2017; 14 (3): 240–245. doi: 10.7150/ijms.17738.
12. Andrade AR, Bittencourt PL, Codes L et al. New Onset diabetes and non-alcoholic fatty liver disease after liver transplantation. Ann Hepatol 2017; 16 (6): 932–940. doi: 10.5604/01.3001.0010.5285.
13. Chitturi S, Abeygunasekera S, Farrell GC et al. NASH and insulin resistance: insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology 2002; 35 (2): 373–379. doi: 10.1053/jhep.2002.30 692.
14. Scalioni LP, da Silva AP, Miguel JC et al. Lack of association between hepatitis C virus core gene variation 70/91aa and insulin resistance. Int J Mol Sci 2017; 18 (7). doi: 10.3390/ijms18071 444.
15. Hrebicek J, Janout V, Malincikova J et al. Detection of insulin resistance by simple quantitative insulin sensitivity check index QUICKI for epidemiological assessment and prevention. J Clin Endocrinol Metab 2002; 87 (1): 144–147. doi: 10.1210/jcem.87.1.8292.
16. Perseghin G, Caumo A, Mazzaferro V et al. Assessment of insulin sensitivity based on a fasting blood sample in men with liver cirrhosis before and after liver transplantation. Transplantation 2003; 76 (4): 697–702. doi: 10.1097/ 01.TP.0000079252.94857.8D.
17. Bugianesi E, Manzini P, D’Antico S et al. Relative contribution of iron burden, HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty liver. Hepatology 2004; 39 (1): 179–187. doi: 10.1002/hep.20023.
18. Patel K, Thompson AJ, Chuang WL et al. Insulin resistance is independently associated with significant hepatic fibrosis in Asian chronic hepatitis C genotype 2 or 3 patients. J Gastroenterol Hepatol 2011; 26 (7): 1182–1188. doi: 10.1111/j.1440-1746.2011.06 722.x.
19. Eslam M, Ampuero J, Jover M et al. Predicting portal hypertension and variceal bleeding using non-invasive measurements of metabolic variables. Ann Hepatol 2013; 12 (4): 588–598.
20. Jeon HK, Kim MY, Baik SK et al. Hepatogenous diabetes in cirrhosis is related to portal pressure and variceal hemorrhage. Dig Dis Sci 2013; 58 (11): 3335–3341. doi: 10.1007/s10620-013-2802-y.
21. Cammà C, Petta S, Di Marco V et al. Insulin resistance is a risk factor for esophageal varices in hepatitis C virus cirrhosis. Hepatology 2009; 49 (1): 195–203. doi: 10.1002/hep.22 655.
22. Degré D, Gustot T, Gerkens A et al. Insulin resistance is associated with esophageal varices in alcoholic liver disease patients. Eur J Gastroenterol Hepatol 2016; 28 (7): 792–796. doi: 10.1097/MEG.0000000000000627.
23. Ramos-Prol A, Hervás-Marin D, Rodríguez-Medina B et al. Alterations in carbohydrate metabolism in cirrhotic patients before and after liver transplant. Diabetes Res Clin Pract 2015; 110 (2): 123–128. doi: 10.1016/j.diabres.2015.10.002.
24. Merli M, Leonetti F, Riggio O et al. Glucose intolerance and insulin resistance in cirrhosis are normalized after liver transplantation. Hepatology 1999; 30 (3): 649–654. doi: 10.1002/hep.510300306.
25. Peláez-Jaramillo MJ, Cárdenas-Mojica AA, Gaete PV et al. Post-liver transplantation diabetes mellitus: a review of relevance and approach to treatment. Diabetes Ther 2018; 9 (2): 521–543. doi: 10.1007/s13300-018-0374-8.
26. Seo S, Maganti K, Khehra M et al. De novo nonalcoholic fatty liver disease after liver transplantation. Liver Transpl 2007; 13 (6): 844–847. doi: 10.1002/lt.20932.
27. Lim LG, Cheng CL, Wee A et al. Prevalence and clinical associations of posttransplant fatty liver disease. Liver Int 2007; 27 (1): 76–80. doi: 10.1111/j.1478-3231.2006.0 1396.x.
28. Dumortier J, Giostra E, Belbouab S et al. Non-alcoholic fatty liver disease in liver transplant recipients: another story of seed and soil. Am J Gastroenterol 2010; 105 (3): 613–620. doi: 10.1038/ajg.2009.717.
29. Hejlova I, Honsova E, Sticova E et al. Prevalence and risk factors of steatosis after liver transplantation and patient outcomes. Liver Transplant 2016; 22 (5): 644–655. doi: 10.1002/lt.24393.
30. Kleiner DE, Brunt EM, Van Natta M et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41 (6): 1313–1321. doi: 10.1002/hep.20701.
31. Calzadilla-Bertot L, Vilar-Gomez E, Torres-Gonzalez A et al. Impaired glucose metabolism increases risk of hepatic decompensation and death in patients with compensated hepatitis C virus-related cirrhosis. Dig Liver Dis 2016; 48 (3): 283–290. doi: 10.1016/j.dld.2015.12. 002.
32. Petrides AS, Stanley T, Matthews DE et al. Insulin resistance in cirrhosis: prolonged reduction of hyperinzulinemia normalizes insulin sensitivity. Hepatology 1998; 28 (1): 141–149. doi: 10.1002/hep.510280119.
33. Orsi E, Grancini V, Menini S et al. Hepatogenous diabetes: is it time to separate it from type 2 diabetes? Liver Int 2017; 37 (7): 950–962. doi: 10.1111/liv.13337.
34. Kruszynska YT, Meyer-Alber A, Darakhshan F et al. Metabolic handling of orally administered glucose in cirrhosis. J Clin Invest 1993; 91 (3): 1057–1066. doi: 10.1172/JCI116263.
35. Tietge UJ, Selberg O, Kreter A et al. Alterations in glucose metabolism associated with liver cirrhosis persist in the clinically stable long-term course after liver transplantation. Liver Transp 2004; 10 (8): 1030–1040. doi: 10.1002/lt.20147.
36. Cabré E, Gassull MA. Nutritional and metabolic issues in cirrhosis and liver transplantation. Curr Opin Clin Nutr Metab Care 2000; 3 (5): 345–354.
37. Hui JM, Sud A, Farrell GC et al. Insulin resistance is associated with chronic hepatitis C virus infection and fibrosis progression [corrected]. Gastroenterology 2003; 125 (6): 1695–1704. doi: 10.1053/j.gastro.2003.08.032.
38. Veldt BJ, Poterucha JJ, Watt KD et al. Insulin resistance, serum adipokines and risk of fibrosis progression in patients trans-planted for hepatitis C. Am J Transplant 2009; 9 (6): 1406–1413. doi: 10.1111/j.1600-6143.2009.026 42.x.
39. Narayanan P, Mara K, Izzy M et al. Recurrent or de novo allograft steatosis and long-term outcomes after liver transplantation. Transplantation 2019; 103 (1): 14–21. doi: 10.1097/TP.0000000000002317.
40. Gitto S, De Maria N, di Benedetto F et al. De-novo nonalcoholic steatohepatitis is associated with long-term increased mortality in liver transplant recipients. Eur J Gastroenterol Hepatol 2018; 30 (7): 766–773. doi: 10.1097/MEG.0000000000001105.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
- Paměťové B lymfocyty v periferní krvi u celiakie – pilotní studie
- Cystická fibróza a exokrinní pankreatická insuficience
- Význam pH-metrie s impedanciou u pacientov s nadmernou supragastrickou eruktáciou
- Vizualizácia aktivity nervov bolesti z orgánov tráviaceho traktu
- Ovplyvňuje liečba inhibítormi protónovej pumpy riziko gastrointestinálneho krvácania u pacientov na liečbe novými orálnymi antitrombotikami?
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
- Neobvyklá manifestace tuberkulózy u pacienta s ulcerózní kolitidou léčeného infliximabem
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- OLOMOUC LIVE ENDOSCOPY 2019
- Dvě dekády endoskopické léčby časného karcinomu žaludku v České republice perspektivou kongresu IGCC 2019
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Tofacitinib – první JAK inhibitor v léčbě ulcerózní kolitidy. Začátek terapeutické éry „malých molekul“ u idiopatických střevních zánětů?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



