-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vizualizácia aktivity nervov bolesti z orgánov tráviaceho traktu
Imaging activity in nerves that mediate pain from gastrointestinal organs
Background: Visceral afferent nerves project from internal organs and provide information to the central nervous system. The role of afferent nerves in the pathogenesis and symptoms of gastrointestinal diseases is often underappreciated. Nonetheless, pain, heartburn, fullness, nausea, and vomiting are all mediated by visceral afferent nerves. Furthermore, stimulation of visceral afferent nerves by inflammation in diseases disrupts the normal regulation of gastrointestinal secretion and motility, thereby contributing to symptoms ranging from dysphagia to diarrhea and constipation. Thus, therapeutic targeting of visceral afferent nerves may aid the treatment of many gastrointestinal diseases. However, the development of novel drugs targeting visceral afferent nerves is hindered by the limited knowledge of these nerves. For example, the identities of the acid receptors in esophageal nerves that cause heartburn and the ion channels responsible for mechanical activation in nerves that mediate colic pain have not been fully elucidated. The limited knowledge of visceral afferent nerves is largely attributable to difficulties associated with their study; only one nerve fiber can typically be studied at a time by classical electrophysiology.
Purpose: Here, we report the adaptation of a cutting-edge high-throughput method to study gastrointestinal afferent nerves that allows the activity in hundreds of neurons to be imaged simultaneously. This method is based on genetic expression of the fluorescent calcium indicator GCaMP6 and multiphoton microscopy in transgenic mice. In addition to providing fundamental information about visceral afferent nerves, future iterations of this method are expected to enable studies of nerve activity in biopsies from patients with gastrointestinal diseases.
Submitted: 11. 6. 2019
Accepted: 27. 7. 2019
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and states that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: The article/manuscript has not been published or is currently being submitted to another review.
The authors agree to publish their name and e-mail in the published article/manuscript.
Dedication: The article/manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Keywords:
Pain – innervation – Gastrointestinal tract – Microscopy
Autoři: Lipták P. 1; Pavelková N. 2,3; Harsányiová J. 2,3; Bánovčin P. jr. 1; Kollárik M. 3
Působiště autorů: Interná klinika – gastroenterologická JLF UK a UN Martin, Slovenská republika 1; Ústav patologickej fyziológie, JLF UK v Bratislave, Slovenská republika 2; Department of Molecular Pharmacology & Physiology, Morsani College of Medicine, University of South Florida, USA 3
Vyšlo v časopise: Gastroent Hepatol 2019; 73(4): 313-318
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Východiska: Viscerálne aferentné nervy monitorujú vnútorné orgány a sprostredkujú informácie centrálnemu nervovému systému. Úloha aferentných nervov v patogenéze a symptómoch gastrointestinálnych ochorení je často podceňovaná. Preto treba zdôrazniť, že bolesť, pálenie záhy, plnosť, nevoľnosť a vracanie sú všetko symptómy sprostredkované viscerálnymi aferentnými nervami. Dôležité je tiež vyzdvihnúť, že stimulácia viscerálnych aferentných nervov zápalom pri chorobách narúša normálnu reguláciu sekrécie a motility, čím prispieva k symptómom od dysfágie po hnačku a zápchu. Z tohto výpočtu symptómov je zrejmé, že terapeutické ovplyvnenie viscerálnych aferentných nervov by mohlo pomôcť pri liečbe mnohých gastrointestinálnych ochorení. Vývoj nových liekov zameraných na viscerálne aferentné nervy však brzdí nedostatok informácií o týchto nervoch. Napríklad ani receptory pre kyselinu v pažerákových nervoch sprostredkujúcich pyrózu, ako ani iónové kanály zodpovedné za mechanickú aktiváciu v nervoch sprostredkujúcich koliku neboli celkom objasnené. Nedostatok informácií o viscerálnych aferentných nervoch možno vo veľkej miere pripísať ťažkostiam spojeným s ich štúdiom, typicky po jednom nervovom vlákne metódou klasickej elektrofyziológie.
Cieľ: V tomto článku prezentujeme adaptáciu špičkovej vysoko výkonnej metódy na štúdium gastrointestinálnych aferentných nervov, ktorá umožňuje súčasné zobrazovanie aktivity v stovkách neurónov. Táto metóda je založená na genetickej expresii fluorescenčného vápnikového indikátora GCaMP6 a multifotónovej mikroskopie v transgénnej myši. Očakáva sa, že okrem poskytovania základných informácií o viscerálnych aferentných nervoch budúce iterácie tejto metódy umožnia štúdium nervovej aktivity v biopsiách od pacientov s gastrointestinálnymi ochoreniami.
Klíčová slova:
inervácia – gastrointestinálny trakt – bolest – mikroskopia
Úvod
Viscerálne aferentné nervy monitorujú stav vnútorných orgánov a sprostredkujú tieto informácie centrálnemu nervovému systému. V tráviacom trakte sa aferentné nervy podieľajú na reflexnej regulácii fyziologickej motility a sekrécie a za patologických podmienok sprostredkujú informácie o zápale a poškodení tkaniva. Pri chorobách tráviaceho traktu zápalové mediátory a ďalšie signály z poškodených tkanív nadmerne stimulujú aferentné nervy, a preto sa aktivita týchto nervov zvyšuje. Zvýšená aktivita aferentných nervov spúšťa symptómy vrátane bolesti, pyrózy, plnosti, nauzey a zvracania. Zvýšená aktivita aferentných nervov tiež podstatne prispieva k patogenéze tráviacich chorôb, pretože narúša normálnu reguláciu motility a sekrécie. Toto vedie k celému spektru ďalších symptómov, ako napríklad dysfágia, nafukovanie, hnačky a zápcha. Z tohto zoznamu príznakov, ktorý zahŕňa veľkú časť symptómov z tráviaceho traktu, je zrejmé, že tlmenie zvýšenej aktivity aferentných nervov by pomohlo pri liečbe mnohých tráviacich chorôb. Spolu s liečbou základnej príčiny by inhibícia aktivity aferentných nervov zlepšila symptómy a prerušením niektorých patomechnizmov prispela ku kauzálnej liečbe.
Zatiaľ však na liečbu ochorení tráviaceho traktu nie sú k dispozícii žiadne lieky, ktoré by účinkovali priamo na viscerálne aferentné nervy (s výnimkou niekoľkých prevažne experimentálnych látok, ktoré ale často účinkujú aj na centrálny nervový systém). Vývoj nových liekov účinkujúcich na viscerálne aferentné nervy je v súčasnosti veľmi obmedzený pre nedostatok základných informácií o týchto nervoch. Pre odborníkov, ktorí v tejto oblasti nepracujú, je až prekvapivé, ako málo sa vie o viscerálnych aferentných nervoch. Ako príklad môže slúžiť pyróza, ktorá je spôsobená stimuláciou pažerákových nervov kyselinou. Napriek tomu, aká je pyróza častá, stále nie sú známe receptory na pažerákových nervoch, ktoré túto aktiváciu spôsobujú. Podobne, kŕčovité bolesti z distenzie čreva sú sprostredkované mechanickou aktiváciou viscerálnych nervov inervujúcich črevo. Napriek tomu, že distenzia je univerzálny mechanizmus vzniku bolesti v tráviacom trakte (sem patrí napr. aj žlčníková kolika), sa nevie, ktoré iónové kanály na viscerálnych nervoch sú zodpovedné za mechanickú aktiváciu. Keďže teda mnohé základné mechanizmy aktivácie a regulácie excitability viscerálnych nervov nie sú známe, nie je ani možné vyvíjať nové lieky zamerané na ich inhibíciu.
Prečo je známe len tak relatívne málo dôležitých informácií o viscerálnych aferentných nervoch v tráviacom systéme? Je to najmä preto, že štúdium týchto nervov je náročné. Po prvé, hustota viscerálnej aferentnej inervácie je podstatne nižšia ako v somatickom systéme, napr. v koži, čo sťažuje ich štúdium. Po druhé, klasickými elektrofyziologickými metódami sa dá obyčajne študovať naraz len jedno nervové vlákno, čo spomaľuje ich štúdium. Preto by veľmi pomohla metóda na štúdium viscerálnych nervov, ktorou by bolo možné naraz študovať celé populácie neurónov. Našťastie pokrok vo vývoji proteínových fluorescenčných indikátorov a v mikroskopických zobrazovacích metódach v posledných rokoch umožnil zavedenie nových metodických postupov, ktoré prekonávajú hlavné obmedzenia doterajších experimentálnych prístupov. V tomto texte prezentujeme adaptáciu špičkovej vysoko výkonnej metódy na štúdium gastrointestinálnych aferentných nervov, ktorá umožňuje zobrazovanie aktivity v stovkách neurónov súčasne. Táto metóda je založená na genetickej expresii fluorescenčného indikátora pre vápnik GCaMP6 v transgénnej myši a multifotónovej mikroskopii. Zameriavame sa hlavne na štúdium nervov, ktoré sprostredkujú bolesť. Očakávame, že okrem získania základných informácií o viscerálnych aferentných nervoch umožnia budúce iterácie tejto metódy aj štúdium nervovej aktivity v biopsiách od pacientov s gastrointestinálnymi ochoreniami.
Aferentná inervácia gastrointestinálneho traktu
Orgány gastointestinálneho systému majú duálnu vonkajšiu aferentnú inerváciu [1–5]. Časť aferentných neurónov inervujúcich gastrointestinálny trakt (GIT) pochádza z vágových nervov. Tieto neuróny sa nachádzajú vo vágových gangliách v oblasti karotíd a majú centrálne synaptické spojenia s centrami mozgového kmeňa pre autonómnu reguláciu ako aj bolesť z hlavových nervov. Vágové nervy sa podieľajú na fyziologickej regulácii, patologickej dysregulácii a ovplyvňujú vnímanie podnetov z tráviaceho traktu. Druhá časť aferentných neurónov inervujúcich GIT pochádza zo spinálneho systému. Tieto neuróny sa nachádzajú v gangliách zadných miechových rohov a majú centrálne synaptické spojenia najmä so spinálnymi dráhami vedúcimi bolesť. Napríklad pažerák, žalúdok, tenké črevo a proximálna časť hrubého čreva sú aferentne inervované z vágových nodóznych a jugulárnych ganglií a zároveň sú inervované torakolumbárnymi spinálnymi aferentnými neurónmi, ktorých axóny prebiehajú v splanchnických nervoch.
Aferentné nervy v tráviacom trakte sú stimulované najmä podráždením sliznice, distenziou lúmenu orgánov, zmenou pH alebo prítomnosťou zápalových a iných endogénnych mediátorov. V stimulácii zohrávajú dôležitú úlohu aj enteroendokrinné bunky v sliznici a imunitné bunky v stene tráviaceho traktu [6–7]. Na základe experimentálnych štúdií vieme, že v tráviacom trakte sa nachádza množstvo typov zakončení vágových a spinálnych nervov, ktoré charakterizujú ich štrukturálne a funkčné vlastnosti [5,8,9]. Podľa rýchlosti vedenia akčných potenciálov v ich axónoch je možné tiež periférne senzorické neuróny rozdeliť na vlákna s rýchlym vedením (typ A, myelinizované) a s pomalým vedením (typ C, nemyelinizované) [10]. Napriek tomu, že oba typy môžu reagovať na bolesť vyvolávajúce podnety, najväčšia pozornosť v štúdiu bolesti je venovaná neurónom s C-vláknami, ktoré reagujú na rôzne nociceptívne noxy, a sú preto nazývané polymodálne nociceptory [11]. Poznať presný mechanizmus aktivácie aferentných nervov v tráviacom trakte je nevyhnutné pre ďalší výskum v oblasti vývoja vhodnej terapie. Na Johns Hopkins University, School of Medicine v Baltimore, USA sa autori podieľali na adaptácii novej metódy štúdia aferentnej inervácie gastrointestinálneho systému. Z naších skúseností vieme, že súčasne môžeme v rámci jednej stimulácie zaznamenať aktivitu z niekoľkých stoviek neurónov z nodózneho ganglia nervus vagus u myši. Tento postup je v súčastnosti zavádzaný aj na Slovensku vďaka spolupráci s Ústavom patologickej fyziológie Jesseniovej lekárskej fakulty v Martine. Metóda je založená na princípe 2-fotonóvého mikroskopu [12] a detekcie excitácie špeciálnych flourescenčných proteínov [13].
2-fotonóvá mikroskopia
Zobrazovanie v 2-fotónovej mikroskopii, čo je druh fluorescenčnej mikroskopie, je založené na princípe excitácie fluorescenčných molekúl fotónmi laseru a následného zachytenia elektromagnetického žiarenia, ktoré je emitované tkanivom pri jeho prechode na predchádzajúcu pokojovú energetickú hladinu. K tomuto sa v rámci 2-fotónovej (multifonotóvej, nelineárnej) mikroskopie najčastejšie používa Ti-safírový laser [14]. Princíp 2-fotonóveho zobrazovania spočíva v absorbcii dvoch fotónov v danom mieste tkaniva v rovnakom čase (približne v intervale 10-18 s) [12]. To v praxi znamená, že sa používa laser s dvojnásobnou vlnovou dĺžkou fotónov potrebných pre excitáciu fluorescenčného nosiča [14]. Fluorescenčné molekuly sú excitované len v ohniskovej rovine, v ktorej je najvyššia hustota fotónov, pričom v rovinách nad ohniskovou rovinou a pod ňou k excitácii nedochádza. Ďalšou výhodou je nízka fototoxicita. Takto je teda možné zhotovovať trojdimenzionálne snímky živého tkaniva v dostatočne dlhom časovom okne potrebnom pre náročné neurofyziologické experimenty. Navyše, tradičné mikroskopické techniky, ktoré využívajú proces lineárnej (1-fotónovej) absorbcie, sú limitované na použitie len v blízkosti povrchu snímaného tkaniva (resp. max. do hĺbky 100 µm) [15]. Nelineárna 2-fotónová fluorescenčná mikroskopia rieši tento problém, umožňujúc výraznú hĺbku zobrazenia, pretože dokáže usporiadať aj viacnásobne rozptýlený signál [15]. Týmto spôsobom je umožnené snímkovanie do hĺbky niekoľko stoviek mikrometrov [16]. Vďaka nízkej záťaži pre tkanivo umožňuje 2-fotónová mikroskopia v kombinácii so špecifickými technikami značenia štúdium dynamických procesov komplexne v tkanivách vrátane centrálneho [17] a periférneho nervového systému [18].
Calcium imaging s použitím vápnikového indikátora GCaMP6
Calcium imaging (zobrazovanie vnútrobunkového vápnika) je založené na princípe zobrazovania zmien intracelulárneho vápnika a využíva skutočnosť, že akčné potenciály v neurónoch vedú k influxom vápnikových katiónov (Ca2+) do bunky [19]. V proteíne vápnikového indikátora GCaMP6 je fluorescenčný proteín naviazaný na kalmodulín, ktorý slúži v bunke ako univerzálny sekundárny messenger vo vápnikovej signalizácii vo vnútri bunky. Za pokojových podmienok nie je GCaMP6 fluorescenčný. Pri aktivácii neurónu (t.j. pri akčných potenciáloch) sa bunková membrána opakovane depolarizuje, čo vedie k vstupu iónov vápnika do bunky cez napäťovo riadené vápnikové kanály. Intracelulárny vápnik sa naviaže na GCaMP6, čím sa robustne zvyšuje jeho fluorescenčná excitabilita, ktorú je možné kvantifikovať vhodnými zobrazovacími technikami, ako je napr. multifotónová mikroskopia [13]. Na rozdiel od elektrofyziológie, ktorou je možné naraz snímať aktivitu len niekoľkých buniek, je mikroskopicky možné naraz snímať GCaMP6 fluorescenciu prakticky zo všetkých buniek v zornom poli. Pri vhodnej voľbe parametrov je možné naraz sledovať aktivitu stoviek neurónov v reálnom čase, čo predstavuje výrazný posun v možnostiach výskumu nervovej aktivácie a jej cieleného ovplyvnenia.
Efektívnymi metódami expresie GCaMP6 v neurónoch je cielené kríženie transgénnych pokusných zvierat alebo génový prenos pomocou adeno asociovaného vírusu, ktorý reverzne vpíše gén nutný pre expresiu fluorescenčného proteínu do deoxyribonukleovej kyseliny danej bunky [20]. V našich experimentoch sme využili transgénne myši Pirt-Cre; R26-GCaMP6 [21], u ktorých je expresia GCaMP6 reproducibilná počas mnohých generácií [13]. U týchto myší sa geneticky modifikované potomstvo získava použitím Cre-Lox rekombinantného systému [22]. Výhoda tohto postupu je, že pod nepriamou kontrolou Pirt promotora dochádza k expresii GCaMP6 prakticky vo všetkých aferentých neurónoch [23]. Veľmi dôležité je, že pritom nedochádza k jeho expresii v gliových, imunitných a väzivových bunkách, ktoré sú tiež súčasťou zobrazovaného aferetného nervového ganglia, a teda ich aktivita neinterferuje s meraním aktivity neurónov [24]. Keď sa pri kvantifikácii GCaMP6 fluorescencie využíva 2-fotótonová mikroskopia s vlnovou dĺžkou excitačného lasera 920 nm, nedochádza k tzv. photobleachingu GCaMP6, a preto je kvalita signálu stabilná aj pri opakovanej stimulácii [25]. GCaMP6 je veľmi vhodný pre sledovanie aktivity neurónov, lebo dokáže zachytiť už jeden akčný potenciál v nervus vagus [25]. Pirt-Cre; R26-GCaMP6 transgénne myši tak predstavujú ideálny nástroj na komplexné štúdium celej populácie aferentných neurónov.
Priebeh experimentu
Popísané postupy umožňujú štúdium mechanizmov aktivácie nervových zakončení v pažeráku v unikátnom izolovanom ex vivo systéme, ktorý nie je skreslený komplexnou aktivitou, motilitou a reflexnou reguláciou pažeráka prítomnou v živom organizme. Pažerák sa spolu so študovanými vágovými alebo spinálnymi nervami a ich gangliami izoluje pomocou jemnej disekcie okamžite po usmrtení myši a udržuje sa optimálne vitálny pomocou perfúzie zohrievaným (37 °C), okysličovaným roztokom obsahujúcim glukózu a fyziologické koncentrácie základných katiónov a aniónov počas niekoľkých hodín. Ako je ukázané na obrázkoch 1A–B (obr. 1), izolovaný pažerák sa umiestni do perfundovaného tkanivového kompartmentu, kde sa do pažeráka podávajú testované stimuly. Nervové gangliá s neurónmi exprimujúcimi vápnikový indikátor GCaMP6S spojené s pažerákom pomocou zachovaných vágových alebo spinálnych nervov sa umiestnia pod piezoelektrický, pohyblivý (v Z-osi) špeciálny objektív multifotónového mikroskopu. Typický pokus je zobrazený a popísaný na obrázkoch 1C–E (obr. 1).
Obr. 1. A–E. A – fotografia, B – schéma experimentu. Izolovaný pažerák spolu s vágovými nervami je umiestnený v tkanivovom kompartmente. Pravé alebo ľavé vágové nodózne ganglion obsahujúce neuróny, ktoré exprimujú fluorescenčný vápnikový indikátor GCaMP6S, je umiestnené pod objektívom multifotónového mikroskopu. Mechanické a chemické podnety aplikované do pažeráka aktivujú vágové nervové zakončenia v stene pažeráka a táto aktivácia sa prostredníctvom akčných potenciálov prenáša po axónoch do buniek neurónov v nodóznom gangliu. V aktivovaných vágových nodóznych neurónoch dochádza k vzostupu hladiny intracelulárneho vápnika, ktorá sa zobrazí pomocu fluorescencie GCaMP6S. Obr. C–E zobrazujú aktivácie neurónov vo vágovom nodóznom gangliu pri chemickej a mechanickej stimulácii pažeráka. Kvôli prehľadnosti je zobrazená iba 1 z 10 snímaných optických rovín, ktorá obsahuje približne 250 neurónov. C – za pokojových podmienok nie sú aktivované prakticky žiadne neuróny. D – chemická stimulácia nervových zakončení v pažeráku analógom extracelulárneho adenosintrifosfátu, ktoré sa pri zápale in vivo uvoľňuje z poškodeného tkaniva a spúšťa vnemy bolesti, aktivovala neuróny inervujúce pažerák. E – mechanická stimulácia pažeráka silnou distenziou, ktorá in vivo vyvoláva bolesť, aktivovala nielen neuróny aktivované chemickou stimuláciou, ale aj ďalšie neuróny. Relatívne malý počet neurónov aktivovaných stimuláciou pažeráka vzhľadom na celkový počet neurónov zobrazených v tejto optickej rovine je v súlade s faktom, že iba 5 % vágových neurónov inervuje pažerák, zatiaľ čo ostatné neuróny inervujú ďalšie orgány vrátane žalúdka a pľúc, ktoré v tomto experimente neboli stimulované. Podobným spôsobom sa sníma aj aktivita ganglií zadných miešnych rohov, ktoré sa pripájajú na dráhy v mieche.
Fig. 1A–E. A – photograph, B – scheme of the experiment. The isolated oesophagus along with the vagal nerves is located in the tis sue compartment. The right or left vagal nodose ganglion, containing neurons that express the fluorescent calcium indicator GCaMP6S, is located using the objective of a multiphoton microscope. The mechanical and chemical stimuli applied to the oesophagus activate the vagal nerve endings in the oesophagus wall, and this activation is transmitted through axons to the neuronal cells in the nodose ganglia via action potentials. In the activated vagal nodose neurons, there is an increase in intra cellular calcium levels, shown by GCaMP6S fluorescence. Fig. C–E show imaging of neuronal activation in the vagal nodose ganglia by chemical and mechanical oesophageal stimulation. For the sake of clarity, only one of the 10 studied optical planes containing approximately 250 neurons is shown. C – virtually no neurons are activated under non stimulated conditions. D – chemical stimulation of the nerve endings in the oesophagus with the extracellular adenosine triphosphate analogue, which is released from the damaged tissue in inflammation in vivo and triggers pain sensations, activated neurons that innervates oesophagus. E – mechanical stimulation of the oesophagus with strong distension, which causes pain in vivo, not only activated neurons sensitive to chemical stimulation but also other neurons. The relatively small number of oesophagus-activated neurons compared to the total number of neurons displayed at this optical plane is consistent with the fact that only 5% of vagal neurons innervate the oesophagus, while other neurons innervate other organs, including the stomach and lungs, and these have not been stimulated in this experiment. Similarly, the dorsal root ganglia activity that connects to the spinal cord pathways is also studied.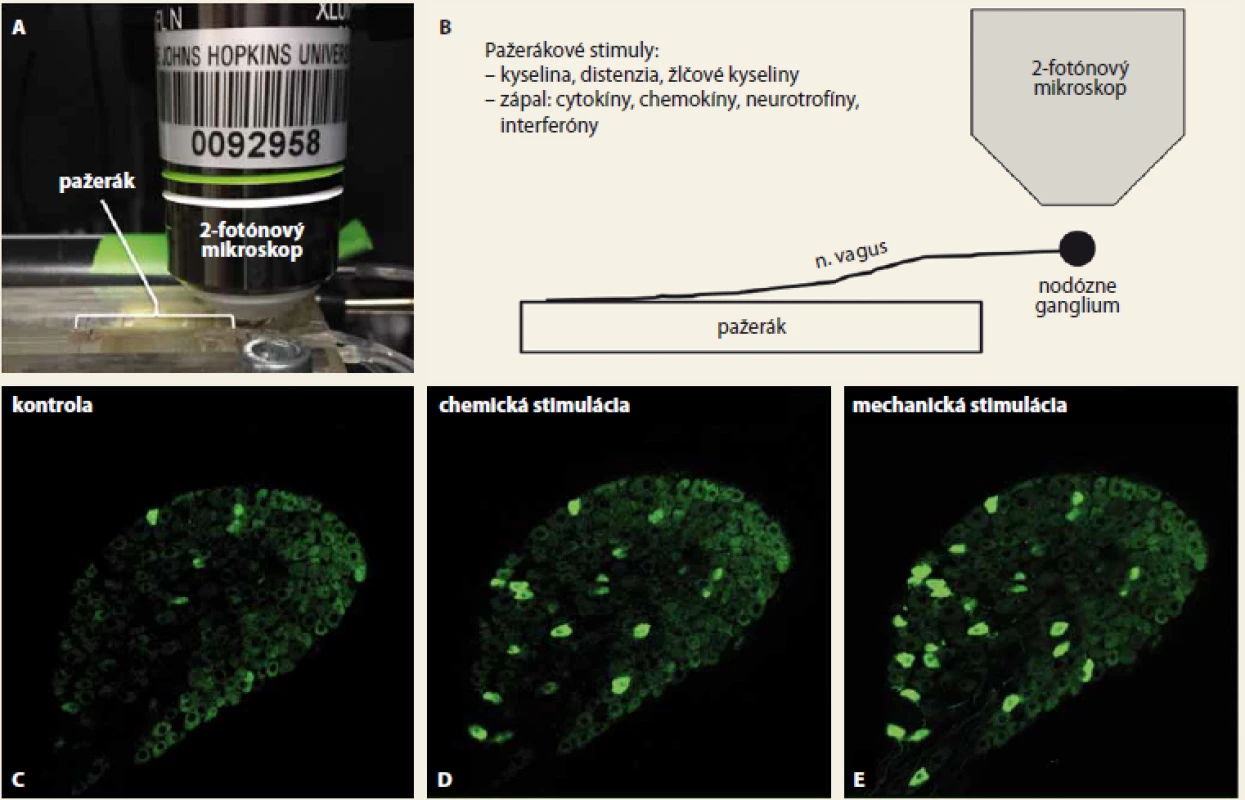
Autori doteraz študovali chemicky, mechanicky alebo elektricky vyvolanú aktiváciu vo viac ako 1 000 neurónoch v pokusoch zameraných na reguláciu viscerálnych nervov napäťovo riadenými sodíkovými kanálmi NaV1.1. V súčasnosti sa pripravujú pokusy, ktoré budú objasňovať receptory zodpovedné za aktiváciu nervov inervujúcich pažerák neurotrofínmi, chemokínmi, cytokinínmi, interferónmi a ďalšími mediátormi zápalu, ktoré ovplyvňujú nervovú reguláciu a vnímanie pyrózy a bolesti z pažeráka.
Záver
Detailné pochopenie neurofyziológie aferentnej signalizácie z tráviaceho traktu je dôležitý predpoklad pre vývoj nových účinných terapií pre ochorenia, u ktorých sa v patofyziológii ich vzniku uplatňuje nadmerná aktivita v dôsledku kombinácie zvýšenej stimulácie a/alebo zvýšenej citlivosti aferentných nervov. Hoci sa často stretávame s názorom, že aferentné nervy z GIT a dalších viscerálnych systémov sú už dostatočne známe, v mnohých prípadoch zatiaľ nepoznáme ani základné mechanizmy regulácie ich excitability za fyziologických podmienok a už vôbec nie ich zmeny pri chorobách. Popísaný vývoj nových experimentálnych postupov, ktoré sa budú dať v blízkej budúcnosti použiť aj na štúdium bioptických vzoriek z ľudských orgánov, umožní efektívne vyplniť tieto medzery v poznaní a bude motivovať a usmerňovať vývoj nových stratégií zameraných na tlmenie nadmernej aktivity viscerálnych aferetných nervov.
Doručené: 11. 6. 2019
Prijaté: 27. 7. 2019
MUDr. Peter Bánovčin Jr, PhD.
Interná klinika – gastroenterologická
JLF UK a UN Martin
Kollárova 2
036 59 Martin
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie.
Autori súhlasí s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Článok nie je podporený grantom ani nevznikol za podpory žiadnej spoločnosti.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Zdroje
1. Ray K. Neurogastroenterology: a tale of two neurons – distinct functions of vagal afferents of the gut. Nat Rev Gastroenterol Hepatol 2016; 13 (8): 435. doi: 10.1038/nrgastro.2016.100.
2. Bonaz B, Sinniger V, Pellissier S. Vagal tone: effects on sensitivity, motility, and inflammation. Neurogastroenterol Motil 2016; 28 (4): 455–462. doi: 10.1111/nmo.12817.
3. Bonaz B, Bazin T, Pellissier S. The vagus nerve at the interface of the microbiota-gut-brain axis. Front Neurosci 2018; 12 : 49. doi: 10.3389/fnins.2018.00049.
4. Vanner S, Greenwood-Van Meerveld B, Mawe G et al. Fundamentals of neurogastroenterology: basic science. Gastroenterology 2016; 150 (6): 1280–1291. doi: 10.1053/j.gastro.2016.02.018.
5. Brookes SJ, Spencer NJ, Costa M et al. Extrinsic primary afferent signalling in the gut. Nat Rev Gastroenterol Hepatol 2013; 10 (5): 286–296. doi: 10.1038/nrgastro.2013.29.
6. Rindi G, Leiter AB, Kopin AS et al. The „normal” endocrine cell of the gut: changing concepts and new evidences. Ann N Y Acad Sci 2004; 1014 : 1–12. doi: 10.1196/annals.1294.001.
7. Raybould HE. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Auton Neurosci 2010; 153 (1–2): 41–46. doi: 10.1016/j.autneu.2009.07.007.
8. Berthoud HR, Blackshaw LA, Brookes SJ. Neuroanatomy of extrinsic afferents supplying the gastrointestinal tract. Neurogastroenterol Motil 2004; 16 (Suppl 1): S28–S33. doi: 10.1111/j.1743-3150.2004.00471.x.
9. Brierley SM, Hibberd TJ, Spencer NJ. Spinal afferent innervation of the colon and rectum. Front Cell Neurosci 2018; 12 : 467. doi: 10.3389/fncel.2018.00467.
10. Yu S, Undem BJ, Kollarik M. Vagal afferent nerves with nociceptive properties in guinea-pig oesophagus. J Physiol 2005; 563 : 831–842. doi: 10.1113/jphysiol.2004.079574.
11. Emery EC, Luiz AP, Sikandar S et al. In vivo characterization of distinct modality-specific subsets of somatosensory neurons using GCaMP. Sci Adv 2016; 2 (11): e1600990–e1600990. doi: 10.1126/sciadv.1600990.
12. Denk W, Strickler JH, Webb WW. Two-photon laser scanning fluorescence microscopy. Science 1990; 248 (4951): 73–76. doi: 10.1126/science.2321027.
13. Anderson M, Zheng Q, Dong X. Investigation of pain mechanisms by calcium imaging approaches. Neuroscience Bull 2018; 34 (1): 194–199. doi: 10.1007/s12264-017-01 39-9.
14. Benninger RK, Piston DW. Two-photon excitation microscopy for the study of living cells and tissues. Curr Protoc Cell Biol 2013; 4 (4): 1–24. doi: 10.1002/0471143030.cb0411s59.
15. Helmchen F, Denk W. Deep tissue two-photon microscopy. Nat Methods 2005; 2 (12): 932–940. doi: 10.1038/nmeth818.
16. Mittmann W, Wallace DJ, Czubayko U et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nat Neurosci 2011; 14 (8): 1089–1093. doi: 10.1038/nn.2879.
17. Huber D, Gutnisky DA, Peron S et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature 2012; 484 (7395): 473–478. doi: 10.1038/nature11 039.
18. Miller RE, Kim YS, Tran PB et al. Visualization of peripheral neuron sensitization in a surgical mouse model of osteoarthritis by in vivo calcium imaging. Arthritis Rheumatol 2018; 70 (1): 88–97. doi: 10.1002/art.40342.
19. Tian L, Hires SA, Looger LL. Imaging neuronal activity with genetically encoded calcium indicators. Cold Spring Harb Protoc 2012; 6 : 647–656.
20. Kollarik M, Carr MJ, Ru F et al. Transgene expression and effective gene silencing in vagal afferent neurons in vivo using recombinant adeno-associated virus vectors. J Physiol 2010; 588 : 4303–4315. doi: 10.1113/jphysiol. 2010.192971.
21. Kim YS, Anderson M, Park K et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron 2016; 91 (5): 1085–1096. doi: 10.1016/j.neuron.2016.07.044.
22. Hoess RH, Abremski K. The Cre-lox recombination system. Nucleic Acids Mol Biol 1990; 4 : 99–109. doi: 10.1007/978-3-642-84150-7_6.
23. Kim YS, Chu Y, Han L et al. Central terminal sensitization of TRPV1 by descending serotonergic facilitation modulates chronic pain. Neuron 2014; 81 (4): 873–887. doi: 10.1016/j.neuron.2013.12.011.
24. Kim AY, Tang Z, Liu Q et al. Pirt, a phospho-inositide-binding protein, functions as a regulatory subunit of TRPV1. Cell 2008; 133 (3): 475–485. doi: 10.1016/j.cell.2008.02.053.
25. Chen TW, Wardill TJ, Sun Y et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature 2013; 499 (7458): 295–300. doi: 10.1038/nature12354.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
- Paměťové B lymfocyty v periferní krvi u celiakie – pilotní studie
- Cystická fibróza a exokrinní pankreatická insuficience
- Význam pH-metrie s impedanciou u pacientov s nadmernou supragastrickou eruktáciou
- Vizualizácia aktivity nervov bolesti z orgánov tráviaceho traktu
- Ovplyvňuje liečba inhibítormi protónovej pumpy riziko gastrointestinálneho krvácania u pacientov na liečbe novými orálnymi antitrombotikami?
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
- Neobvyklá manifestace tuberkulózy u pacienta s ulcerózní kolitidou léčeného infliximabem
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- OLOMOUC LIVE ENDOSCOPY 2019
- Dvě dekády endoskopické léčby časného karcinomu žaludku v České republice perspektivou kongresu IGCC 2019
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Tofacitinib – první JAK inhibitor v léčbě ulcerózní kolitidy. Začátek terapeutické éry „malých molekul“ u idiopatických střevních zánětů?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



