-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ursodeoxycholová kyselina
Autoři: J. Juřica
Působiště autorů: Farmakologický ústav, LF MU, Brno
Vyšlo v časopise: Gastroent Hepatol 2016; 70(5): 457-462
Kategorie: Lékový profil
doi: https://doi.org/10.14735/amgh2016457Úvod
Ursodeoxycholová kyselina (UDCA – ursodeoxycholic acid) byla objevena před cca 90 lety jako hlavní složka sušené žluči čínského černého medvěda, která byla používána v tradiční čínské medicíně již v dynastii Tang (618–907) [1,2], na základě Evidence-based medicine (EBM) se UDCA používá asi 30 let. UDCA je hydrofilní žlučová kyselina (ŽK) fyziologicky přítomná v malém množství i v lidské žluči, tvoří asi její 4 % [3]. Hlavními ŽK jsou kyselina cholová (CA – cholic acid), chenodeoxycholová (CDCA – chenodeoxycholic acid), v mnohem menší míře jsou pak ve žluči zastoupeny kyseliny glykocholová, taurocholová, litocholová, deoxycholová (DCA – deoxycholic acid) a UDCA (obr. 1). ŽK a oxysteroly jsou endogenními ligandy jaderných receptorů a některých membránových receptorů a podílejí se na regulaci metabolizmu lipidů, sacharidů a homeostáze [4]. UDCA je 7-epimer CDCA, je hydrofilnější, a proto tolik nepoškozuje biomembrány. Další odlišnosti spočívají v rozdílné schopnosti regulovat apoptózu, zánět, transport a metabolizmus ŽK, na molekulární úrovni mechanizmů působení pak rozdílná schopnost vazby a ovlivnění jaderných i membránových receptorů.
Obr. 1. Nekonjugovaná UDCA, primární a sekundární žlučové kyseliny. Fig. 1. Unconjugated UDCA, primary and secondary bile acids. 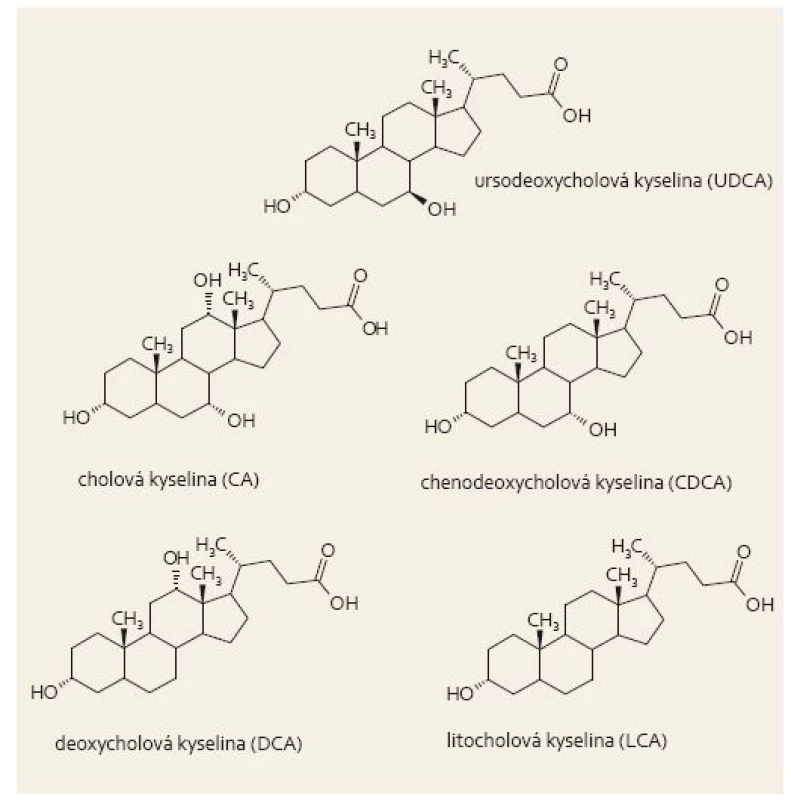
Použití UDCA
Schválené indikace jejího použití v ČR jsou disoluce nekalcifikovaných žlučových kamenů, primární biliární cirhóza (PBC) I. a II. stadia, primární sklerotizující cholangoitida (PSC), hepatitida různé etiologie s cholestatickým syndromem, reaktivní gastritida při duodenogastrickém refluxu a poruchy jater a žlučových cest u cystické fibrózy u dětí od 6 do 18 let [5].
UDCA je v současnosti jediným léčivem schváleným americkou FDA pro terapii PBC [3]. Včasná léčba poskytuje lepší prognózu a léčebný výsledek [6]. UDCA prodlužuje dobu progrese onemocnění do finálního stadia (jaterní transplantace), prodlužuje přežití a je dobře tolerována [6]. UDCA zlepšuje i sekundární endpointy ve většině studií, efekt je výraznější u pacientů v počátečních stadiích onemocnění – nižší bilirubin, γ-glutamyltransferáza (GGT), aspartátaminotransferáza (AST); terapie UDCA snižuje AST a ALT (alaninaminotransferáza), GGT, bilirubin, alkalickou fosfatázu [6].
Oproti PBC není pro prospěšnost UDCA v indikaci PSC tak silná evidence. Přesto se UDCA podává, protože zlepšuje biochemické parametry onemocnění a zmírňuje zánětlivou složku onemocnění. Celkové přežití, jaterní histologii ani čas do transplantace v dávce 10–15 mg/kg/den však nejspíše neovlivňuje [6,7]. Důvodem může být nízká dávka v dosud provedených studiích, avšak odborné společnosti jsou prozatím zdrženlivé v doporučení léčit pacienty s PSC vyššími dávkami.
Při disoluci nekalcifikovaných žlučových kamenů ≤ 20 mm (≤ 15 mm dle SPC) [5] se UDCA uplatňuje tam, kde je kontraindikován chirurgický přístup. Podmínkou úspěšnosti léčby je funkční žlučník a přítomnost čistých radiotransparentních cholesterolových kamenů. UDCA ve výsledku zvyšuje saturační index pro cholesterol [8–10]. Úspěšnost léčby v této indikaci je 40–90 %, v závislosti na typu kamenů, dávce UDCA, délce léčby a compliance pacienta [8]. Dávka se pohybuje od 10 do 14 mg/kg/den, terapie má být dlouhodobá, rychlost disoluce je cca 1 mm/měsíc.
Jednou z uvažovaných (prozatím off-label) indikací je jaterní poškození – ať už polékové, postalkoholické, cholestatické (po virové hepatitidě) nebo autoimunitní etiologie. Evidence účinku se pro jednotlivé stavy velmi liší. Při cholestáze při virové hepatitidě B a C snižuje UDCA prokazatelně sérové transaminázy, nemá vliv na detekovatelnost sérové RNA virů a je dobře tolerována [11]. Ojediněle jsou podobné výsledky zmiňovány i při cholestáze doprovázející hepatitidu A [12].
Někteří pacienti s polékovým jaterním poškozením (zejména při cholestatické hepatitidě s následným zvýšením transferáz), u kterých nedošlo k rychlému zlepšení biochemických známek po vysazení hepatotoxického léčiva, by mohli z UDCA profitovat [13,14]. Dokonce guidelines evropské EASL uvádějí studii, ve které u 2/3 pacientů došlo po UDCA v případě DILI (Drug-Induced Liver Injury) ke zlepšení [7]. UDCA zlepšuje biochemické parametry u pacientů s nealkoholovou steatohepatitidou (NASH), v širším kontextu i nealkoholovou steatózu jater, zvláště ve vyšších dávkách [15,16]. Některé studie neprokázaly vliv UDCA na histologii (fibrotické změny, steatóza) [17] a na základě dosud dostupných dat není dostatečná evidence pro rutinní použití UDCA při NASH [18], ani odborné společnosti tuto možnost nezmiňují. Obdobná je i situace u nespecifického hepatoprotektivního účinku – není dostatečná evidence, studií je málo a nejsou přesvědčivé.
V jiných zemích byla krom těchto indikací používána i jako profylaxe žlučových kamenů u obézních pacientů, kteří rychle snižují svoji hmotnost, při intrahepatální cholestáze u těhotných ve 2. a 3. trimestru, jaterních onemocnění při cystické fibróze a pediatrických onemocněních, jako je familiární intrahepatální cholestáza, Alagillův syndrom, biliární atrézie, dále při onemocněních jater při celkové parenterální výživě a také při graft vs. host disease [1].
Mechanizmy účinku
UDCA vykazuje celé spektrum účinků a nahlížení na její působení se za poslední desetiletí radikálně změnilo. Je tu patrný posun ve vnímání UDCA jako pouhé hydrofilní ŽK „ředící“ toxičtější ŽK směrem k využití jejích imunoregulačních účinků a účinků na apoptózu daných jejím specifickým působením na jaderné a membránové receptory.
Změna hydrofilního indexu žluči
Při podávání UDCA dochází k relativnímu zvýšení zastoupení z původních cca 4 % až na 19–64 % z celkového obsahu ŽK [19]. Dochází tak ke zvýšení hydrofility žluči vlivem „naředění“ primárních lipofilních a toxických ŽK (CDCA, CA, DCA). Tato změna přitom není provázena změnou v celkovém obsahu ŽK v séru.
Inhibice apoptózy a nekrózy
Cytotoxické primární ŽK indukují v závislosti na stupni cholestázy apoptózu a nekrózu. ŽK indukují apoptózu spouštěnou tzv. vnitřní mitochondriální cestou i zevní cestou [3]. UDCA inhibuje několika mechanizmy zevní i vnitřní cestu spouštění apoptózy a tvorbu BCL-2 i MPTP pórů v membráně mitochondrií (obr. 2).
Obr. 2. Aktivace apoptózy žlučových kyselin a inhibice apoptózy UDCA: 1. vnitřní cesta, 2. zevní cesta, 3. cesta stresu na úrovni endoplazmatického retikula. Upraveno podle [3] (se svolením autora). Fig. 2. Activation of apoptosis by bile acids and inhibition of apoptosis by UDCA: 1. intrinsic pathway, 2. extrinsic pathway, 3. pathway of stress in the endoplasmic reticulum. Adapted from [3] (with permission of the author). ![Aktivace apoptózy žlučových kyselin a inhibice apoptózy UDCA: 1. vnitřní cesta, 2. zevní cesta, 3. cesta stresu na úrovni endoplazmatického retikula. Upraveno podle [3] (se svolením autora).
Fig. 2. Activation of apoptosis by bile acids and inhibition of apoptosis by UDCA: 1. intrinsic pathway, 2. extrinsic pathway, 3. pathway of stress in the endoplasmic reticulum. Adapted from [3] (with permission of the author).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c2969dc2a26023fca7ca93293f7bc453.jpg)
UDCA – ursodeoxycholová kyselina; EGFR – receptor pro epidermální růstový faktor; PI3K – fosfatidylinositol-3-kináza; Akt – serin/ threoninová kináza; Bad, Bax, Bak, Bid – proapoptotické proteiny; Bcl – rodina proapoptotických proteinů; TCF, SRT – transkripční faktory antiapoptotické dráhy ERK; APAF – transkripční faktor aktivující apoptózu; MPTP – mitochondriální pór přechodné propustnosti; ROS – reaktivní kyslíkové radikály; NADPH – ikotinadenindinukleotid fosfát; DISC – signalizační komplex spouštěcí buněčnou smrt; FADD – doména smrti asociovaná s proteinem FAS; TRAILR – proapoptotický membránový receptor pro ligand prodobný TNF; Ca – vápník Modulace exprese jaterních transportérů a enzymů zapojených do syntézy ŽK
Terapeutické účinky UDCA jsou mimo jiné založeny na snížení obsahu nebo toxicity ŽK cestou inhibice jejich syntézy nebo stimulace jejich exkrece (obr. 3):
- a) inhibice transportu ŽK do hepatocytů (OATP1 – organic anion transporting polypeptide 1) [3,20];
- b) up-regulace efluxních transportérů MRP3 a MRP4 na bazolaterální straně [21,22];
- c) up-regulace hepatocelulárních kanalikulárních transportérů BSEP (bile salt export pump) a MRP2 [3,20,23];
- d) změna exprese transportérů v ledvinách – UDCA zvyšuje expresi efluxních transportérů MRP2 a MRP4 a zároveň snižuje expresi ASBT (apical sodium dependent bile acid transporter) (obr. 3). Celkově tak dochází ke zvýšení sérových ŽK (zejména UDCA při terapii) a ke zvýšení renální exkrece ŽK [3,21];
- e) inhibice syntézy ŽK, podpora jejich hydroxylace na méně toxické ŽK – UDCA snižuje expresi CYP7A1, limitující krok v syntéze ŽK. Navíc UDCA zvyšuje expresi CYP3A11, CYP2B10 a CYP3A4 – enzymů katalyzujících hydroxylace primárních ŽK na hydrofilnější (méně toxické) ŽK [3,24].
Obr. 3. Zjednodušené schéma transportu žlučových kyselin hepatocyty. Upraveno podle [3,41]. Fig. 3. Simplified schema of bile acids transportation in the hepatocytes. Adapted from [3,41]. ![Zjednodušené schéma transportu žlučových kyselin hepatocyty. Upraveno podle [3,41].
Fig. 3. Simplified schema of bile acids transportation in the hepatocytes. Adapted from [3,41].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4600ff8e54e253c788aef802b6071413.jpg)
UDCA – ursodeoxycholová kyselina; BSEP – bile salt export pump; OATP1B1 – organic anion-transporting polypeptide 1B1; NTCP – membránový transportér pro sodík a taurocholovou kyselinu; ASBT – apikální transportér pro žlučové kyseliny závislý na sodíku; ŽK – žlučová kyselina; Na – sodík; OA – organický anion; MRP – multidrug resistance-associated protein, refluxní transportní protein; Pgp – P-glykoprotein, produkt genu MDR1 (multidrug resistance, též ABCB1); OST – organic solute transporter; OC – organický kationt; ABCB4 – gen rodiny ABC (ATP binding cassette), transkriptem je MDR3 (Multidrug resistance protein 3) Výše uvedené efekty a–e jsou zprostředkovány zejména interakcí UDCA s jadernými receptory pro glukokortikoidy (GR), vitamin D (VDR) a farnesoid X receptorem (FXR). Otázkou je, zda i prostřednictvím pregnanového X receptoru (PXR), jehož je jen velmi slabým ligandem.
„Bikarbonátový deštník“ a zlepšení transportu ŽK v cholangiocytech
UDCA stimuluje sekreci bikarbonátu jednak zvýšením exprese a současně i posttranskripční stimulací transportéru AE2 (anion exchanger 2). Bikarbonát, secernovaný do lumen žlučovodu, udržuje alkaličtější pH, což udržuje ŽK v deprotonované formě, neprostupující zpět z lumen do hepatocytu [25].
Protizánětlivé a imunoregulační účinky UDCA
Cholestatická onemocnění, PBC i PSC bývají označována za autoimunitní nebo přinejmenším s výraznou autoimunitní složkou, kdy dochází k tvorbě antimitochondriálních protilátek a autoprotilátek proti jaderným strukturám [6]. Obě onemocnění jsou také spojována s přítomností antigenů HLA-B8, HLA-DR3 a HLA-DR4, které jsou ovšem spojovány i s řadou jiných autoimunitních chorob [6]. Základem imunologických změn je ztráta tolerance k autoantigenům a zvýšená produkce antigenů třídy MHC-I i MHC-II [3]. UDCA má imunomodulační účinky jednak na úrovni exprese antigenů MHC („imunosupresivní účinek“) a adhezních molekul ICAM 1 (intracellular adhesion molecule 1) a LFA-1 (lymphocyte function associate antigen 1) a dále také snižuje produkci prozánětlivých cytokinů TGF-β1, TNF-α [26] a Fas-L [27], uvolňování cytokinů IL2, IL4, IFN-γ mononukleáry a také zánětlivého proteinu makrofágů [28].
Tyto prozánětlivé cytokiny se podílejí na apoptóze cholangiocytů i hepatocytů nejen u cholestatických onemocnění, ale i u polékového poškození jater, hepatitidy a alkoholické steatohepatitidy i NASH [3]. Protizánětlivé účinky UDCA mohou být také spouštěny aktivací receptoru pro vitamin D v cholangiocytech [28].
Protizánětlivé působení může částečně vysvětlit příznivé účinky na potlačení fibrotických změn u pacientů s PBC [3,29]. UDCA se jeví jako prospěšná i v případě profylaxe jiných autoimunitních jaterních chorob (venookluzivní choroba jater/graft vs. host disease po transplantaci krvetvorných kmenových buněk nebo u rejekce transplantátu jater) [30].
Farmakokinetické vlastnosti
Po p. o. podání je biologická dostupnost cca 90 % [31], při Tmax mezi 30 a 50 min [1,32]. Poté podléhá efektu prvního průchodu játry (cca 50 %) [32]. Množství UDCA extrahované játry s mírou poškození jater klesá, a tak mají pacienti s cholestatickým onemocněním jater vyšší hladiny UDCA v séru a nižší koncentrace ve žluči [1,31]. Přesto při doporučeném dávkování tvoří UDCA cca 30–50 % obsahu žluči. Nekonjugovaná UDCA se váže asi ze 70 % na proteiny plazmy [31]. Eliminace probíhá převážně cestou konjugace s glycinem a taurinem a podléhá enterohepatální cirkulaci [1]. Střevními bakteriemi dochází k 7-dehydroxylaci na kyselinu litocholovou. UDCA je vylučována převážně stolicí, i zde dochází u pacientů ke snížené extrakci a vylučování játry a žlučí do stolice, a tak je u pacientů s cholestatickým poškozením jater více UDCA vylučováno močí [1,33]. Eliminační poločas je z důvodu účinné recirkulace poměrně dlouhý (4–6 dní) [31].
Nežádoucí účinky a toxicita
Bezpečnost UDCA se v terapeutickém dávkování (do 25 mg/kg/den) jeví jako velmi dobrá a v klinických studiích se neobjevují případy závažných nežádoucích účinků nebo jsou vzácné.
Gastrointestinální nežádoucí účinky
UDCA je považována za hepatoprotektivní látku, na rozdíl od hepatotoxické CDCA, která byla v minulosti používána. Nejčastějším nežádoucím účinkem je řidší stolice, u pacientů se žlučovými kameny se vyskytovala s frekvencí 2–9 % [1,34]. Tento nežádoucí účinek mnohdy záhy spontánně ustupuje. Mezi další nežádoucí účinky patří nauzea, flatulence a bolest v pravém nadbřišku. Vzestup transamináz po UDCA je nevýznamný. Vzácně byly hlášeny případy kalcifikace žlučových kamenů, dekompenzace jaterní cirhózy, nicméně kauzalita není jasná [1].
Nádorová onemocnění
Přímé důkazy o mutagenním nebo kancerogenním účinku UDCA u lidí nejsou známy. V preklinickém pokusu však UDCA v dietě stimulovala proliferaci hepatocytů a růst nádorů u transgenních myší s genem viru hepatitidy B. U pacientů s PSC a současně ulcerózní kolitidou, kteří mají obecně vyšší riziko rozvoje karcinomu tlustého střeva, může naopak UDCA, zvláště v nižší dávce, snížit rizika neoplazie, dysplazie nebo nádoru [1,35].
Reprodukční toxicita, embryotoxicita, těhotenství a kojení
UDCA se off-label používá v terapii intrahepatální cholestázy u těhotných, nicméně pouze ve 2. a 3. trimestru gravidity po pečlivém zvážení rizika pro plod. Podání UDCA v této indikaci je při dodržení dávkování 10–20 mg/kg bezpečné [1,5,36]. Z pohledu embryotoxicity je klasifikována stupněm B. UDCA se nedoporučuje užívat během kojení, nicméně plazmatické koncentrace jsou poměrně nízké a v mateřském mléce nebyla UDCA detekována [1,37]. Data o reprodukční toxicitě nejsou známa.
Kontraindikace
Mezi kontraindikace UDCA patří hypersenzitivita, intolerance UDCA nebo obecně ŽK, akutní zánět žlučníku a žlučových cest, obstrukce vývodných žlučových cest (ductus choledochus, ductus cysticus), rentgenologicky nekontrastní žlučník, kalcifikované žlučové konkrementy, porušená kontraktilita žlučníku, časté biliární koliky, pokročilé stadium primární biliární cirhózy – vzhledem k možnosti nedostatečného terapeutického účinku, závažné poruchy ledvinných a jaterních funkcí [5,31].
Závěr
UDCA je minoritní ŽK používaná v klinické praxi již několik dekád. V poslední době dochází k posunu jejího vnímání. Tento posun je zčásti zapříčiněn novými objevy na poli jejích mechanizmů účinků na molekulární úrovni, a její chápání se tak posouvá od pouhé hydrofilní „ředící“ ŽK k zajímavé imunomodulační látce a vpravdě signální molekule ovlivňující mnohé jaderné receptory. Evidence její účinnosti u řady cholestatických onemocnění a u rozpouštění žlučových kamenů je vcelku přesvědčivá. Zajímavé jsou závěry studií zaměřených na možné protektivní působení UDCA u poškození jater (ať už polékového, při hepatitidě nebo jiného) a také závěry (pilotních) studií dokládající chemopreventivní působení i protektivní působení před veno - okluzivním poškozením po transplantaci krvetvorných buněk. Čas a dobře designované randomizované klinické studie ukáží, zda UDCA tato očekávání naplní.
doc. PharmDr. Jan Juřica, Ph.D.
Farmakologický ústav, LF MU
Kamenice 5
625 00 Brno
jurica@med.muni.cz
Zdroje
1. Hempfling W, Dilger K, Beuers U. Ursodeoxycholic acid – adverse effects and drug interactions. Aliment Pharmacol Ther 2003; 18 (10): 963–972.
2. Beuers U, Trauner M, Jansen P et al. New paradigms in the treatment of hepatic cholestasis. From UDCA to FXR, PXR and beyond. J Hepatol 2015; 62 (Suppl 1): S25–S37. doi: 10.1016/j.jhep.2015.02.023.
3. Roma MG, Toledo FD, Boaglio AC et al. Ursodeoxycholic acid in cholestasis: linking action mechanisms to therapeutic applications. Clin Sci (Lond) 2011; 121 (12): 523–544. doi: 10.1042/CS20110184.
4. Chiang JY. Bile acids: regulation of synthesis. J Lipid Res 2009; 50 (10): 1955–1966. doi: 10.1194/jlr.R900010-JLR200.
5. Státní ústav pro kontrolu léčiv. Souhrn údajů o přípravku Ursosan 2014. [online]. Dostupné z: www.sukl.cz/modules/medication/detail.php?code=00138 08&tab=texts.
6. Doporučený postup České hepatologické společnosti ČLS JEP. PBC (primární biliární cirhóza) a PSC (primární sklerozující cholangoitida). Česká hepatologická společnost 2010 : 1–19. [online]. Dostupné z: www.ces-hep.cz/file/325/doporuceny-postup-chs-pbc-a-psc.pdf.
7. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol 2009; 51 (2): 237–267. doi: 10.1016/j.jhep.2009.04.009.
8. Nunes D. Dissolution therapy for the treatment of gallstones. UpToDate. [online]. Available from: www.uptodate.com/contents/dissolution-therapy-for-the-treat-ment-of-gallstones.
9. Guarino M, Cocca S, Altomare A et al. Ursodeoxycholic acid therapy in gallbladder disease, a story not yet completed. World J Gastroenterol 2013, 19 (31): 5029–5034. doi: 10.3748/wjg.v19.i31.5029.
10. Shah H, Mandukhal S, Gilani A et al. Effect of ursodeoxycholic acid (UDCA) therapy on gallbladder motility in cholesterol gallstone patients. Am J Gastroenterol 2012; 107 (Suppl 1): S73.
11. Chen W, Liu J, Gluud C. Bile acids for viral hepatitis. Cochrane Database Syst Rev 2007; 4: CD003181.
12. Wijaya I. The Role of ursodeoxycholic acid in acute viral hepatitis: an evidence-based case report. Acta Med Indones 2015, 47 (4): 352–357.
13. Verma S, Kaplowitz N. Diagnosis, management and prevention of drug-induced liver injury. Gut 2009, 58 (11): 1555–1564. doi: 10.1136/gut.2008.163675.
14. Sabariah NH, Siti MS, Nor AC et al. Cholestatic hepatitis secondary to carbamazepine treatment with ursodeoxycholic acid – a case report. Trop J Pharm Res 2014; 13 (10): 1745–1747.
15. Xiang Z, Chen YP, Ma KF et al. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol 2013; 13 : 140. doi: 10.1186/1471-230X-13-140.
16. Carr RM, Reid AE. FXR agonists as therapeutic agents for non-alcoholic fatty liver disease. Curr Atheroscler Rep 2015, 17 (4): 500. doi: 10.1007/s11883-015-0500-2.
17. Georgescu EF, Georgescu M. Therapeutic options in non-alcoholic steatohepatitis (NASH). Are all agents alike? Results of a preliminary study. J Gastrointestin Liver Dis 2007; 16 (1): 39–46.
18. Ratziu V. Treatment of NASH with ursodeoxycholic acid: pro. Clin Res Hepatol Gastroenterol 2012; 36 (Suppl 1): S41–S45. doi: 10.1016/S2210-7401 (12) 70020-7.
19. Lazaridis KN, Gores GJ, Lindor KD. Ursodeoxycholic acid ‚mechanisms of action and clinical use in hepatobiliary disorders‘. J Hepatol 2001; 35 (1): 134–146.
20. Fickert P, Zollner G, Fuchsbichler A et al. Effects of ursodeoxycholic and cholic acid feeding on hepatocellular transporter expression in mouse liver. Gastroenterol 2001; 121 (1): 170–183.
21. Zollner G, Wagner M, Moustafa T et al. Coordinated induction of bile acid detoxification and alternative elimination in mice: role of FXR-regulated organic solute transporter-alpha/beta in the adaptive response to bile acids. Am J Physiol Gastrointest Liver Physiol 2006; 290 (5): G923–G932.
22. Zollner G, Wagner M, Trauner M. Nuclear receptors as drug targets in cholestasis and drug-induced hepatotoxicity. Pharmacol Ther 2010; 126 (3): 228–243. doi: 10.1016/j.pharmthera.2010.03.005.
23. Micheline D, Emmanuel J, Serge E. Effect of ursodeoxycholic acid on the expression of the hepatocellular bile acid transporters (Ntcp and bsep) in rats with estrogen-induced cholestasis. J Pediatr Gastroenterol Nutr 2002; 35 (2): 185–191.
24. Schuetz EG, Strom S, Yasuda K et al. Disrupted bile acid homeostasis reveals an unexpected interaction among nuclear hormone receptors, transporters, and cytochrome p450. J Biol Chem 2001; 276 (42): 39411–39418.
25. Concepcion AR, Lopez M, Ardura-Fabregat A et al. Role of AE2 for pH (i) regulation in biliary epithelial cells. Front Physiol 2014; 4 : 413. doi: 10.3389/fphys.2013.00413.
26. Buryova H, Chalupsky K, Zbodakova O et al. Liver protective effect of ursodeoxy - cholic acid includes regulation of ADAM17 activity. BMC Gastroenteroly 2013, 13 : 155. doi: 10.1186/1471-230X - 13-155
27. Azzaroli F, Mehal W, Soroka CJ et al. Ursodeoxycholic acid diminishes Fas-ligand-induced apoptosis in mouse hepatocytes. Hepatology 2002; 36 (1): 49–54.
28. Poupon R. Ursodeoxycholic acid and bile-acid mimetics as therapeutic agents for cholestatic liver diseases: an overview of their mechanisms of action. Clin Res Hepatol Gastroenterol 2012, 36 (Suppl 1): S3–S12. doi: 10.1016/S2210-7401 (12) 70015-3.
29. Corpechot C, Carrat F, Bonnand AM et al.The effect of ursodeoxycholic acid therapy on liver fibrosis progression in primary biliary cirrhosis. Hepatology 2000; 32 (6): 1196–1199.
30. Tay J, Tinmouth A, Fergusson D et al. Systematic review of controlled clinical trials on the use of ursodeoxycholic acid for the prevention of hepatic veno-occlusive disease in hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2007; 13 (2): 206–217.
31. Dynamed. Ursodiol. In: EBSCO 2016. [online]. Available from: http: //web.a.ebs cohost.com/dynamed/detail?vid=2&sid=f26b9687-6f75-4976-afcd-e8f705 da8691%40sessionmgr4009&hid=4206& bdata=JnNpdGU9ZHluYW1lZC1saXZlJnNjb3BlPXNpdGU%3d#AN=526120&db=dme.
32. Crosignani A, Setchell KD, Invernizzi P et al. Clinical pharmacokinetics of therapeutic bile acids. Clin Pharmacokinet 1996; 30 (5): 333–358.
33. Stiehl A, Rudolph G, Sauer P et al. Billiary secretion of bile acids and lipids in primary sclerosing cholangitis – influence of cholestasis and effect of ursodeoxycholic acid treatment. J Hepatol 1995, 23 (3): 283–289.
34. Sackmann M, Pauletzki J, Aydemir U et al. Efficacy and safety of ursodeoxycholic acid for dissolution of gallstone fragments – comparison with the combination of ursodeoxycholic acid and chenodeoxycholic acid. Hepatology 1991; 14 (6): 1136–1141.
35. Singh S, Khanna S, Pardi DS et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease. A systematic review and meta-analysis. Inflamm Bowel Dis 2013; 19 (8): 1631–1638. doi: 10.1097/MIB. 0b013e318286fa61.
36. Gabzdyl E, Schlaeger JM. Intrahepatic cholestasis of pregnancy a critical clinical review. J Perinat Neonatal Nurs 2015; 29 (1): 41–50. doi: 10.1097/JPN.0000000000000077.
37. Rudi J, Schönig T, Stremmel W. Therapy with ursodeoxycholic acid in primary biliary cirrhosis during pregnancy. Z Gastroenterol 1996; 34 (3): 188–191.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2016 Číslo 5- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Gastrointestinální onkologie
- Vzácná komplikace ulcerózní kolitidy
- Současné principy screeningu kolorektálního karcinomu – od oportunního k populačnímu screeningovému programu
-
Mezioborová spolupráce ve screeningu kolorektálního karcinomu
Čekací doba na kolonoskopii - „Full-thickness“ endoskopická resekce lokální reziduální neoplazie v hepatální flexuře – videokazuistika
- Dlouhodobé výsledky po radikálních resekcích pro adenokarcinom žaludku
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Metastazující maligní melanom do trávicího traktu bez známého primárního ložiska
- „Watermelon stomach” jako první příznak cirhózy jater
- Vzácná komplikace koloskopie – cholelitiáza s komplikacemi
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- 48th Annual Meeting of the European Pancreatic Club in Liverpool, 6–9th July 2016
- Zpráva z odborné stáže
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Ursodeoxycholová kyselina
- Správná odpověď na kvíz
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



