-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
Standard diagnostic and therapeutic procedure for chronic infection of hepatitis C virus
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
17. 11. 2014Accepted:
29. 11. 2014
Autoři: P. Urbánek; P. Husa; J. Šperl
; S. Plíšek; L. Rožnovský; P. Kümpel
Působiště autorů: Pracovní skupina pro virové hepatitidy České hepatologické společnosti ČLS JEP Pracovní skupina pro virové hepatitidy Společnosti infekčního lékařství ČLS JEP
Vyšlo v časopise: Gastroent Hepatol 2014; 68(6): 499-512
Kategorie: Hepatologie: doporučené postupy
doi: https://doi.org/10.14735/amgh2014499Souhrn
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
17. 11. 2014Accepted:
29. 11. 2014Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy C (hepatitis C virus) byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti ČLS JEP a Společnosti infekčního lékařství ČLS JEP. Jsou založena především na doporučeních vydaných Evropskou asociací pro studium jater (EASL) v dubnu 2014. Doporučení definují preferovaný přístup k řešení problematiky HCV infekce. V oblasti léčby chronické HCV infekce je vždy zmíněno několik variant postupu. Tato skutečnost je dána rychlým vývojem nových protivirových preparátů a jejich nerovnoměrným zaváděním do rutinní praxe v jednotlivých zemích. Dostupnost preparátů proto může být v konkrétním případě faktorem limitujícím užití optimálního postupu.
Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou C v celostátním měřítku [1–25]. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
1. Epidemiologie HCV
Celosvětová prevalence infekce HCV se pohybuje v běžné populaci kolem 3 %. V roce 2001 bylo pomocí sérologického přehledu zjištěno, že prevalence protilátek anti-HCV v běžné populaci ČR je 0,2 %. HCV infekce je nejčastější příčinou jaterních onemocnění ve vyspělých zemích světa.
Infekce HCV patří mezi krví přenosné infekce. Hlavními cestami šíření HCV infekce jsou:
- přenos krevními deriváty,
- injekční aplikace drog,
- tetování a piercing neprováděné za aseptických podmínek (zejména amatérsky),
- pravidelné dialyzační léčení (PDL),
- profesionální riziko expozice HCV,
- sexuální kontakt s osobou HCV pozitivní (častější mezi muži, kteří mají styk s muži),
- rodinný kontakt s osobou HCV pozitivní,
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos),
- iatrogenní přenos,
- přenos orgánovým štěpem před rokem 1992.
Recentní studie ukazují na to, že až v 90 % se podaří některý z rizikových faktorů u infikované osoby identifikovat, nicméně je zapotřebí velmi podrobného a aktivního dotazování. Od zahájení rutinního testování krevních dárců na přítomnost infekce HCV (v roce 1992) je hlavní cestou šíření infekce sdílení infikovaného injekčního instrumentária při injekční aplikaci drog.
1.1. Prevence přenosu HCV
HCV pozitivní osoba musí být poučena, jak zabránit přenosu HCV na další osoby, zejména:
- HCV pozitivní osoba nesmí darovat krev, orgány, tkáně či sperma,
- HCV pozitivní osoba by si měla řádně ošetřit každou otevřenou ránu tak, aby nedošlo k jakékoli expozici jiné osoby infikovanou krví,
- HCV pozitivní injekční uživatelé drog by měli být zařazeni do programu kontrolované výměny injekčního instrumentária a všech dalších potřeb, pokud nejsou indikováni k odvykací léčbě,
- HCV pozitivní osoba by měla být poučena, že riziko přenosu HCV sexuální cestou je malé a infekce sama o sobě není indikací k používání bariérové antikoncepce v dlouhodobém monogamním vztahu; doporučení použití bariérové antikoncepce při náhodném sexu není tím dotčeno; metody bezpečného sexu jsou dostatečnou prevencí přenosu,
- HCV pozitivní osoba by měla bránit i náhodnému použití svého zubního kartáčku, holicích potřeb apod. další osobou.
2. Přirozený průběh HCV infekce
Studie o přirozeném průběhu HCV infekce ukazují, že 55–85 % pacientů, kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat, a infekce u nich tudíž přejde do chronického stadia. U 5–20 % osob z tohoto počtu dojde během 20–25 let k rozvoji jaterní cirhózy. Osoby s jaterní cirhózou při chronické HCV infekci mají riziko rozvoje end-stage-liver disease (cca 30 % během 10 let) a riziko vzniku hepatocelulárního karcinomu (HCC, 1–2 % ročně). Faktory asociované s progresí jaterního postižení při chronické HCV infekci jsou:
- přenos infekce ve vyšším věku (riziko narůstá po 40.–45. roce věku),
- konzumace alkoholu ≥ 50 g denně,
- obezita a jaterní steatóza z jakéhokoli jiného důvodu,
- koinfekce HCV/HBV a HCV/HIV,
- vyšší stupeň jaterního postižení nežli portální fibróza v iniciální jaterní biopsii (METAVIR ≥ 2 a Ishak ≥ 3).
Chronická HCV infekce je rovněž asociována s celou řadou tzv. extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinemie. Symptomatická smíšená kryoglobulinemie je indikací k protivirové léčbě bez ohledu na stupeň jaterního postižení.
3. Laboratorní vyšetřovací metody
3.1. Sérologické detekční metody
Jedná se o sérologickou detekci anti-HCV protilátek. Protilátky jsou markerem expozice – kontaktu dané osoby s virem hepatitidy C. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organizmu. Přetrvávají ve značném titru i u pacientů úspěšně vyléčených. Technicky se jedná o detekci protilátek metodou EIA či některých jejích variant. V současné době se používají metody III. generace, které mají senzitivitu 97 % a specificitu až 99 %.
3.1.1. Indikace k vyšetření protilátek anti-HCV
Vyšetření anti-HCV protilátek je možno chápat jako vyšetření screeningové u všech osob, u kterých je podezření, že byly někdy v průběhu života viru exponovány.
Na základě znalostí o možnostech přenosu je doporučováno testování HCV infekce zejména u těchto skupin osob:
- osoby s anamnézou injekční aplikace drog, a to i v případě jediné aplikace před více lety,
- osoby ve skupinách s vysokou prevalencí HCV infekce:
- příjemci krevních derivátů či příjemci orgánových transplantátů před rokem 1992,
- HIV pozitivní osoby,
- hemofilici léčení před rokem 1987,
- osoby s anamnézou hemodialýzy (i akutní a krátkodobé),
- osoby s nevysvětlitelnou elevací aminotransferáz,
- děti narozené HCV pozitivním matkám (testování až po 18. měsíci věku),
- zdravotničtí pracovníci a další osoby s anamnézou poranění injekční jehlou (bez ohledu na sérologický stav event. zdroje) nebo osoby se slizniční expozicí krvi HCV pozitivní osoby,
- sexuální partneři HCV pozitivní osoby.
3.2. Molekulárně genetické metody
Molekulárně genetické metody prokazují přítomnost virové nukleové kyseliny (HCV RNA) v séru či tkáních infikovaného jedince. Největšího rozšíření v současné době dosáhla metoda polymerázové řetězové reakce v reálném čase (RT-PCR). Dostupná je kvalitativní varianta, většinou se však používá ve variantě kvantitativní. Hladina HCV RNA se udává v IU/ml.
Za standardní detekční limit je považována citlivost použité techniky (polymerázové řetězové reakce) 15 IU/ml HCV RNA a méně. Protože řada laboratoří používá metody na stanovení HCV RNA, jejichž citlivost nedosahuje požadovaného standardního detekčního limitu, je třeba, aby lékař zadávající vyšetření v souvislosti s hodnocením terapie dle těchto standardních postupů požadoval na laboratoři informaci, že citlivost jejich stanovení splňuje uvedený limit.
Součástí molekulárního vyšetření by mělo být i stanovení genotypu a subtypu HCV. Genotypizace je důležitá z pohledu rozdílných léčebných postupů a rozdílné účinnosti léčby u jednotlivých genotypů HCV. Určení subtypu, zejména genotypu 1, je významné pro určení rizika vzniku virologické rezistence v případě podání simepreviru (viz dále).
3.3. Genetické vyšetření infikované osoby
Stanovení genotypu IL28B infikované osoby ztratilo s nástupem režimů používajících vysoce účinná přímá antivirotika (direct-acting antivirals – DAA) svou prediktivní hodnotu. Toto vyšetření má smysl pouze v případech, kdy v důsledku ekonomických omezení je nutno používat stále varianty protivirové léčby založené na dvojkombinaci PEG-IFN + + ribavirin. Rovněž v případech, kdy protivirová léčba spočívá v podání trojkombinace PEG-IFN + ribavirin + boceprevir//telaprevir, je prediktivní hodnota stanovení genotypu IL28B minimální.
4. Diagnostická kritéria
4.1. Akutní HCV infekce
Akutní HCV infekce je diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu HCV infekce.
Spolehlivě lze stanovit diagnózu akutní HCV infekce pouze tehdy, je-li dokumentována sérokonverze na anti-HCV reaktivitu. Příčinou je skutečnost, že neexistuje sérologický marker akutní infekce HCV. O akutní HCV infekci lze také hovořit v případech, kdy jsou klinické příznaky v souladu s obrazem akutní hepatitidy. Jde především o tyto příznaky:
- sérová hladina ALT > 10× horní hranice normy,
- ikterus,
- nejsou známky chronického jaterního onemocnění nebo jiné možné příčiny akutní hepatitidy.
Pozitivním momentem může být i identifikace možného rizikového faktoru přenosu infekce HCV. Ve fázi akutní infekce je pozitivní sérová HCV RNA, nicméně během akutní fáze infekce byla popsána krátká období negativity sérové HCV RNA. Jedno negativní vyšetření sérové HCV RNA tedy diagnózu HCV infekce nevylučuje a také nemusí znamenat v konkrétním případě spontánní eliminaci viru. Stanovení HCV RNA je třeba opakovat. Vhodný interval mezi vyšetřeními HCV RNA k potvrzení eliminace viru je 12 týdnů.
4.2. Chronická HCV infekce
Diagnóza chronické HCV infekce je založena na pozitivním průkazu sérové HCV RNA i anti-HCV protilátek v přítomnosti známek chronické hepatitidy, tj. elevaci sérové hladiny ALT nebo histologických známek chronické hepatitidy. V případech akutní HCV infekce prakticky nedochází k eliminaci viru po více než 4–6 měsících od přenosu, proto může být pro definici chronické HCV infekce užit i tento časový parametr.
4.3. Hodnocení léčebné odpovědi
Terminologii pro hodnocení virologické odpovědi uvádí tab. 1.
Tab. 1. Definice virologické odpovědi v průběhu protivirové terapie a po jejím skončení. Tab. 1. Definition of virological response during antiviral therapyand after its completion. 
SVR12 i SVR24 jsou akceptovaná kritéria vyléčení HCV infekce, jejich shoda je kolem 99 %. Dlouhodobé studie rovněž ukázaly, že SVR skutečně znamená trvalou eliminaci HCV infekce ve více než 99 % případů. 5. Stanovení pokročilosti jaterního onemocnění
Před zahájením protivirové léčby by měla být stanovena pokročilost jaterního onemocnění. Důvodem je především snaha identifikovat osoby s jaterní cirhózou či pokročilou (přemosťující) fibrózou, protože prognóza osob po protivirové léčbě je definována stadiem postižení jater před zahájením léčby. Znalost stadia jaterního poškození je rovněž důležitá pro načasování zahájení protivirové léčby. Tento moment se jeví v současné době rychlého rozvoje možností léčby jako velmi důležitý.
I pacienti s trvale normální aktivitou ALT mohou mít významnou fibrózu, i u těchto osob je proto indikováno vyšetření pokročilosti postižení.
Referenční metodou pro stanovení pokročilosti stále zůstává jaterní biopsie. Umožňuje hodnocení zánětlivé aktivity (grading) i stupně fibrózy (staging).
5.1. Jaterní biopsie a neinvazivní metody stanovení pokročilosti
Hlavním přínosem jaterní biopsie provedené před léčbou je poskytnutí informací o stadiu fibrózy a aktivitě zánětu jaterní tkáně. Oba tyto parametry jsou významnou informací jak pro lékaře, tak i samotného pacienta. Znalost histologického nálezu umožňuje s vysokou pravděpodobností identifikovat pacienty s vysokým rizikem progrese jaterního onemocnění, případně s již rozvinutou jaterní cirhózou, kteří nemusejí mít jedinou laboratorní či klinickou známku takto pokročilého jaterního onemocnění.
Jaterní biopsie je indikována u pacientů s trvale normální aktivitou ALT při chronické HCV infekci. Tito pacienti mají ve 14–40 % případů významnou fibrózu. Osoby s takto pokročilou fibrózou jsou ve vysokém riziku progrese fibrózy bez ohledu na trvale normální biochemickou aktivitu. Riziko závažných komplikací po správně provedené necílené jaterní biopsii je 1/4 000–1/10 000.
V poslední době narůstá množství údajů o použití neinvazivních metod k určení pokročilosti jaterní léze. Nejširšího uplatnění na tomto poli dosáhly metody měření jaterní elasticity, které mají v případech chronické HCV infekce akceptovatelnou výpovědní hodnotu. Je nicméně třeba určité zkušenosti při jejich použití, existuje řada faktorů, které mohou jejich výsledky negativně ovlivnit, např. obezita.
Ke stanovení pokročilosti lze užít i některé tzv. krevní biomarkery jaterní fibrózy. Tato vyšetření jsou však spolehlivá pouze v diskriminaci jaterní cirhózy vs non-cirhózy. K hodnocení jednotlivých stadií jaterní fibrózy se nehodí.
Kombinace vyšetření jaterní elasticity a krevních biomarkerů jaterní fibrózy zvyšuje přesnost hodnocení pokročilosti jaterního procesu a snižuje potřebnost provedení jaterní biopsie.
Kromě zmíněných metod lze v indikovaných případech použít transjugulární techniku provedení jaterní biopsie (s výhodou měření portosystémového gradientu). Jaterní biopsie je také považována za metodu vhodnou k použití v případě rozporných výsledků neinvazivních metod či v případech suspekce na kombinované příčiny jaterního onemocnění (abúzus alkoholu, koinfekce HCV/HBV, metabolický syndrom, autoimunitní postižení).
6. Indikace zahájení terapie chronické infekce virem hepatitidy C
Všichni pacienti s chronickou HCV infekcí dosud protivirově neléčení, v minulosti léčení neúspěšně (tj. bez dosažení SVR), kteří léčeni chtějí být a nemají žádnou kontraindikaci léčby, jsou kandidáty protivirové terapie.
Léčba by měla být upřednostněna u pacientů s pokročilou fibrózou (METAVIR F3–F4) a u pacientů s vážnými projevy mimojaterního postižení (symptomatická kryoglobulinemie nebo HCV-asociovaná imunokomplexová nefropatie). Léčba je indikována i u pacientů s méně pokročilou fibrózou (METAVIR F2). Léčba pacientů s minimální fibrózou (METAVIR F0–F1) může být odložena. Odložení léčby by nicméně mělo být s pacientem diskutováno a finální rozhodnutí by mělo jeho názor zohlednit. Pacienti s odloženou léčbou by měli být sledováni v pravidelných intervalech za účelem včasného zachycení významné progrese onemocnění a mělo by být diskutováno zahájení léčby s ohledem na rychlý vývoj a rozšiřování terapeutických možností.
U pacientů s dekompenzovanou jaterní cirhózou lze v současné době uvažovat o zahájení protivirové léčby některým z bezinterferonových režimů, ideálně i režimů bez ribavirinu. Přestože jsou literární data o účinnosti a bezpečnosti protivirové léčby u těchto pacientů velmi limitovaná, představují tito pacienti skupinu osob, u kterých je v případě dosažení SVR efekt léčby patrný ve velmi krátké době. Léčba těchto pokročilých pacientů by měla být přísně centralizována a měla by u nich být zvážena indikace k transplantaci jater.
7. Cíle terapie chronické infekce virem hepatitidy C
Cílem terapie je zabránit rozvoji jaterních i mimojaterních komplikací HCV infekce, včetně pokročilé jaterní fibrózy, cirhózy, dekompenzované cirhózy a hepatocelulárního karcinomu – HCC, což je podmíněno dosažením eradikace infekce. Eradikací infekce je myšleno dosažení SVR ve smyslu výše uvedené definice (tab. 1). U osob se SVR dochází k významnému snížení jaterní morbidity i mortality. Pacienti s jaterní cirhózou, u nichž bylo dosaženo eradikace HCV infekce, mají významně snížené riziko dekompenzace cirhózy a HCC. Minimální riziko rozvoje HCC však trvá, proto je u těchto osob indikována standardní surveillance HCC.
8. Kontraindikace protivirové léčby
8.1. IFNα a ribavirin
Protivirová léčba založená na podání pegylovaného IFNα v kombinaci s ribavirinem je absolutně kontraindikována v následujících případech:
- osoby s nekontrolovanou depresí, epilepsií či s nekontrolovaným psychotickým onemocněním,
- těhotné ženy,
- osoby s nekontrolovaným autoimunitním onemocněním štítné žlázy, sítnice,
- osoby s dekompenzovanou jaterní cirhózou,
- osoby po orgánových transplantacích kromě jater.
Použití pegylovaného IFNα není doporučováno dále u osob s počtem trombocytů ≤ 90 000/ml a/nebo s absolutním počtem neutrofilů < 1 500/ml.
8.2. Přímo působící virostatika
Podle současných znalostí o DAA nejsou absolutní kontraindikace podání léků z této skupiny.
9. Protivirová léčiva
9.1. Úvod
V posledních 10–12 letech byla standardní terapie chronické infekce HCV založena na podání kombinace pegylovaných interferonů α (PEG-IFN) s ribavirinem (RBV). V roce 2011 vstoupila léčba virové hepatitidy C do zcela nového období, které je charakterizováno rychlým průnikem DAA do terapeutických kombinací HCV infekce. Přímo působící virostatika mají svůj název odvozen od mechanizmu účinku. Látky této skupiny přímo inhibují některý z enzymů uplatňujících se v průběhu replikačního cyklu HCV. V rámci replikace HCV dochází k syntéze jediného prekurzorového proteinu, který je translačním produktem celého virového genomu. Jeho následné štěpení zahajuje virová proteáza, která postupně uvolňuje jednotlivé strukturální i nestrukturální proteiny. Posledním krokem procesu je uvolnění RNA polymerázy, která je klíčovým enzymem celé replikace. DAA jsou látky inhibující nejčastěji buď právě proteázu (produkt NS3/4 oblasti virového genomu), či RNA polymerázu (produkt NS5B).
Prvními preparáty skupiny DAA, které se dostaly do běžné praxe, byly boceprevir a telaprevir. Boceprevir a telaprevir představují první generaci virostatik nebo také tzv. „první vlnu první generace“. Používají se pouze a zásadně v kombinaci s pegylovaným interferonem a ribavirinem. Tato první virostatika mají účinek pouze u HCV genotypu 1, u ostatních genotypů mají efekt buď nulový, nebo velice slabý s vysokým rizikem vzniku virologické rezistence. Jejich účinnost (% dosažení SVR) v trojkombinaci s pegylovaným interferonem a ribavirinem se u genotypu HCV 1 pohybuje kolem 65–70 %.
V průběhu roku 2013 a 2014 byly schváleny k užití u chronické HCV infekce i další preparáty, především sofosbuvir, simeprevir a daclatasvir. U řady dalších probíhají schvalovací procedury na úrovni FDA a EMA v současné době. Jejich ukončení je plánováno na druhou polovinu roku 2014.
Předkládané standardy se podrobně věnují použití preparátů registrovaných k použití u HCV infekce ke 30. 6. 2014. V ČR jsou v době vydání těchto doporučení ze skupiny DAA v běžném užití pouze boceprevir a telaprevir. U sofosbuviru, simepreviru a daclatasviru byla zahájena správní řízení. Vzhledem k této situaci, rychlému vývoji a obtížně odhadnutelnému okamžiku ukončení správních řízení je v předkládaných doporučeních (stejně jako v doporučeních EASL) uvedeno vždy několik racionálních variant léčby v daných podskupinách pacientů s chronickou HCV infekcí. Při rozhodování o optimálním léčebném postupu je třeba individuálně zohlednit především skutečně dostupné preparáty a načasování zahájení léčby.
Jednoznačným trendem léčby chronické HCV infekce je preference tzv. bezinterferonových režimů, ideálně i režimů bez podání ribavirinu. Tyto režimy však v současné době představují ekonomicky nejnáročnější variantu terapie. Právě pro svou ekonomickou náročnost si starší léčebné varianty postavené na podání pegylovaných interferonů, ribavirinu, bocepreviru a telapreviru ponechávají v ČR své určité postavení i v současnosti, a to i přes jednoznačně dokázanou skutečnost, že nové varianty léčby jsou účinnější a bezpečnější.
Zástupci České hepatologické společnosti a Společnosti infekčního lékařství se ve spolupráci s účastníky každého jednotlivého správního řízení snaží o nalezení optimálního řešení této složité situace, které by zpřístupnilo moderní varianty léčby i pacientům v ČR.
9.2. Pegylované interferony, ribavirin
Účinnost kombinační terapie pegylovaných inteferonů s ribavirinem (setrvalá virologická odpověď – SVR) u genotypu 1 je 40–60 %, u genotypu 2 a 3 kolem 80 %. Dávkování těchto preparátů ukazuje tab. 2.
Tab. 2. Dávkování pegylovaných interferonů a ribavirinu. Tab. 2. The dose of pegylated interferon and ribavirin. 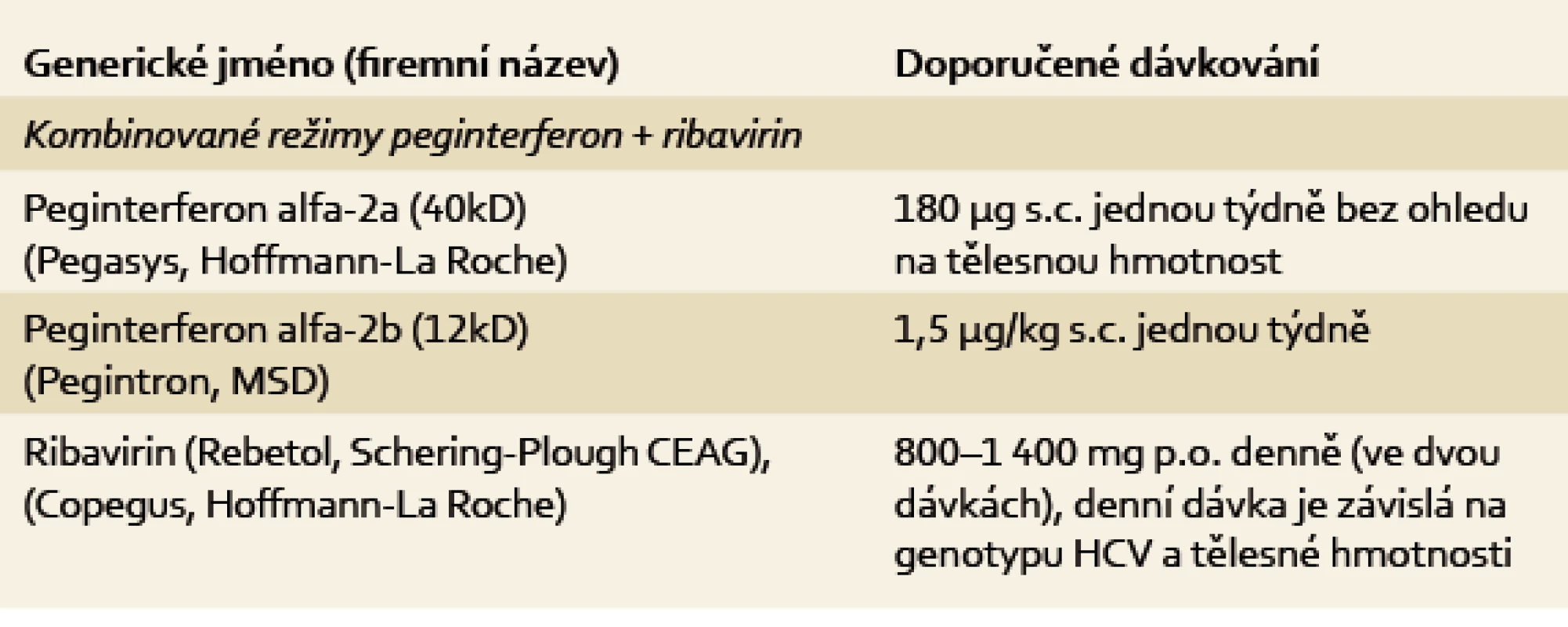
9.3. Sofosbuvir
Sofosbuvir (SOF) je syntetický nukleotidový inhibitor (analog uridinu) virové RNA dependentní RNA polymerázy (RdRp, produkt NS5B oblasti virové genomu). Sofosbuvir je prodrug, který je intracelulárně trifosforylován a následně je pomocí RdRp inkorporován do HCV RNA. Mechanizmem účinku je tzv. ukončení řetězce, kdy po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. SOF je účinný u všech hlavních nejrozšířenějších genotypů HCV (1–6), neinterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy.
SOF není metabolizován systémem cytochromu, potenciál lékových interakcí je tedy mnohem omezenější než u virostatik nižších generací. SOF je substrátem lékového transportéru P-gp a „breast cancer resistance protein“ (BCRP), jeho aktivní metabolit však nikoli. Potentní induktory P-gp ve střevě (rifampicin, karbamazepin a fenytoin) snižují plazmatickou hladinu SOF, snižuje se tedy i intracelulární přítomnost aktivního metabolitu a dochází ke snížení protivirové účinnosti SOF. Naopak inhibitory P-gp/BCRP zvyšují plazmatickou hladinu SOF avšak nikoli hladinu aktivního metabolitu, takže SOF může být s inhibitory podáván současně.
SOF (Sovaldi, výrobce Gilead Sciences, USA) je dostupný ve formě potahované tablety obsahující 400 mg účinné látky. Celková denní dávka je 400 mg, tj. jedna tableta denně.
9.4. Simeprevir
Simeprevir (SMV) je specifický inhibitor virové NS3/4A serinové proteázy. Někdy bývá označován jako virostatikum „druhé vlny první generace“ DAA. SMV je transformován pomocí systému CYP3A4, a proto může jeho podání podléhat interakcím s inhibitory či induktory tohoto systému. Inhibitory CYP3A4 hladinu SMV zvyšují, hrozí proto vzrůst jeho sérové hladiny, který vede k vyššímu výskytu závažnějších NÚ. Podání induktorů CYP3A4 naopak zvyšuje odbourávání SMV, plazmatické hladiny klesají a důsledkem je ztráta protivirové účinnosti. Z důvodu tohoto potenciálu lékových interakcí je proto potřeba v rizikových případech zkontrolovat podávanou medikaci se seznamem kontraindikovaných a rizikových látek, který je součástí SPC SMV. SMV (Olysio, výrobce Janssen-Cilag, Belgie) je dostupný ve formě tobolky obsahující 150 mg účinné látky. Celková denní dávka je 150 mg, tj. jedna tobolka denně.
9.5. Daclatasvir
Daclatasvir je inhibitor replikačního komplexu NS5A. Blokuje dvě fáze virového replikačního cyklu, a to sice syntézu RNA, ale také kompletaci virionu a pravděpodobně i proces jeho uvolnění z hepatocytu. Daclatasvir je metabolizován pomocí CYP34A, je inhibitorem P-gp. Má proto rovněž potenciál lékových interakcí, nicméně do této chvíle nebyly uvolněny relevantní informace na toto téma. Je proto třeba vyčkat zveřejnění SPC.
Daclatasvir (výrobce BristolMyers-Squibb, USA) je dostupný ve formě tablety obsahující 60 mg účinné látky. Celková denní dávka je 60 mg, tj. jedna tableta denně.
10. Terapie HCV infekce
Počínaje rokem 2014 je pro pacienty s chronickou HCV infekcí dostupná celá řada léčebných kombinací, ze kterých budou mít užitek jak pacienti dosud neléčení, tak osoby s neúspěšnou léčbou v minulosti. Indikace a podání jednotlivých léčebných variant jsou závislé na genotypu HCV, případně i subtypu HCV, stupni pokročilosti jaterního postižení, výsledku předchozí léčby a výsledku detekce substitučních mutací virového genomu vedoucích k virologické rezistenci na některá známá DAA. Indikace jsou stejné pro HCV monoinfikované pacienty i pro pacienty s HCV/HIV koinfekcí.
V následujícím textu budou popsány u každého genotypu všechny dostupné možnosti protivirové léčby se stručným přehledem dostupných klinických dat ke každé variantě.
10.1. Genotyp HCV 1
10.1.1. Léčebná varianta 1: PEG-IFN + RBV + sofosbuvir
Dávkování PEG-IFN a RBV uvádí tab. 2. Sofosbuvir je podáván v dávce 400 mg denně. Délka léčby je 12 týdnů.
Tato varianta se jeví jako nejúčinnější a nejjednodušší u pacientů, kteří mohou být léčeni režimem obsahujícím PEG-IFN. Tento postup nemá riziko selekce rezistentních variant viru. Účinnost kombinace zkoumala studie NEUTRINO. SVR bylo dosaženo celkem v 89 % případů, u subtypu 1a v 92 % a u subtypu 1b v 82 % případů. Pacienti s jaterní cirhózou měli SVR v 80 %, pacienti bez jaterní cirhózy v 92 % případů. Žádné selhání léčby nebylo spojeno se vznikem rezistence na sofosbuvir. Do této chvíle nebyla publikována data u pacientů s neúspěšnou protivirovou léčbou v minulosti ani u pacientů s HCV/HIV koinfekcí.
10.1.2. Léčebná varianta 2: PEG-IFN + RBV + simeprevir
Dávkování PEG-IFN a RBV uvádí tab. 2. Simeprevir je podáván v dávce 150 mg denně.
Simeprevir v kombinaci s dalšími dvěma preparáty by měl být podáván po dobu 12 týdnů. Další pokračování léčby se liší podle stupně jaterního postižení a efektu případné předchozí léčby:
- Dosud neléčené osoby a osoby s relapsem po předchozí terapii (včetně cirhotiků) by měly být léčeny kombinací PEG-IFN + RBV po dobu dalších 12 týdnů. Celková doba léčby je tedy 24 týdnů.
- Osoby s částečnou odpovědí a předchozí null-respondéři (včetně cirhotiků) by měli být léčeni kombinací PEG-IFN + RBV po dobu dalších 36 týdnů. Celková doba léčby je tedy 48 týdnů.
Ve všech případech by měla být léčba ukončena, pokud je v týdnech 4, 12 nebo 24 sérová HCV RNA ≥ 25 IU/ml. Tato varianta léčby není doporučována u pacientů infikovaných subtypem HCV 1a s prokazatelnou rezistentní variantou Q80K ve struktuře NS3 proteázy před zahájením léčby.
Kombinace se simeprevirem byla u dosud neléčených pacientů zkoumána ve studiích QUEST-1 a QUEST-2, celková SVR byla 80 % a 81 %. Kumulovaná data z obou studií ukázala, že u subtypu 1b byla SVR 85 %. U subtypu 1a bez varianty Q80K byla SVR 84 %, v případě pozitivního průkazu pouze 58 %. Při hodnocení podle stupně jaterního postižení bylo dosaženo těchto výsledků:
- METAVIR F0–F2 – SVR 84 %,
- METAVIR F3 – SVR 73 %,
- METAVIR F4 (cirhóza) – SVR 60 %.
U dosud neléčených pacientů s koinfekcí HCV/HIV byla SVR 79 %.
U pacientů s monoinfekcí HCV, kteří relabovali po předchozí léčbě IFNα + + RBV, bylo SVR dosaženo v 86 % případů u subtypu 1b a v 70 % u subtypu 1a (bez Q80K 78 %, při pozitivitě Q80K ve 47 %). Ve studii ATTAIN bylo SVR dosaženo u 70 % parciálních respondérů a u 43 % null-respondérů na předchozí terapii kombinací IFNα + RBV. Tato úspěšnost byla v přímém srovnání významně vyšší než účinnost kombinace s telaprevirem ve stejných skupinách osob.
10.1.3. Léčebná varianta 3: PEG-IFN + RBV + daclatasvir
Dávkování PEG-IFN a RBV uvádí tab. 2. Daclatasvir je podáván v dávce 60 mg denně.
Základní trojkombinace by měla být podávána ve všech případech 12 týdnů. U pacientů, kteří nedosáhli hladiny HCV RNA ≤ 25 IU/ml ve 4. týdnu léčby a nedetekovatelné HCV RNA v 10. týdnu, by měla trojkombinace pokračovat dalších 12 týdnů, celkem tedy 24 týdnů. U pacientů, kteří tato kritéria splní, by měla být léčba daclatasvirem ukončena ve 12. týdnu a do 24. týdne by měla pokračovat léčba kombinací PEG-IFN + + RBV.
Tato léčebná varianta může být podle dostupných výsledků nabídnuta pouze pacientům infikovaným subtypem 1b. SVR bylo v této skupině dosaženo v 87 % případů, u subtypu 1a pouze v 58 % případů. O daclatasviru bylo nicméně do současné doby zveřejněno relativně málo klinických výsledků.
10.1.4. Léčebná varianta 4: RBV + sofosbuvir
Dávkování RBV uvádí tab. 2, sofosbuvir je podáván v dávce 400 mg denně. Délka léčby je 24 týdnů.
Tato léčebná varianta může být nabídnuta pouze osobám, které nemohou být léčeny pegylovaným interferonem a jejich léčba přitom nesnese odkladu. Její účinnost není optimální, měla by být proto užita pouze v případech, kdy není jiná varianta bezinterferonového režimu dostupná. U dosud neléčených pacientů byla tato kombinace zkoumána ve studii ELECTRON. SVR bylo dosaženo v 84 % případů. U osob v minulosti neúspěšně léčených byla SVR pouze 10 %.
10.1.5. Léčebná varianta 5: sofosbuvir + simeprevir
Sofosbuvir je podáván v dávce 400 mg denně a simeprevir v dávce 150 mg denně. Délka léčby je 12 týdnů.
Dostupná data do této chvíle nesvědčí pro výhodu doplnění ribavirinu v obvyklém dávkování k této kombinaci. Nicméně jeho přidání k léčbě může být uváženo v případech pacientů s výskytem negativních prediktorů efektu léčby, zejména u pacientů s neúspěchem předchozí léčby a u pacientů s jaterní cirhózou.
Data pro toto doporučení poskytla studie COSMOS. Ve skupině null-respondérů na terapii PEG-IFN + RBV a postižením charakteru METAVIR F0–F2 bylo SVR dosaženo v 96 % u osob léčených po dobu 12 týdnů s ribavirinem a 93 % při léčbě 12 týdnů bez ribavirinu. Prodloužení léčby na 24 týdnů nevedlo k navýšení SVR.
10.1.6. Léčebná varianta 6: sofosbuvir + daclatasvir
Sofosbuvir je podáván v dávce 400 mg denně a daclatasvir v dávce 60 mg denně.
Délka léčby:
- dosud neléčené osoby 12 týdnů,
- opakovaně léčené osoby 24 týdnů (včetně osob po neúspěšné léčbě trojkombinací s boceprevirem nebo telaprevirem).*
Dostupná data do této chvíle nesvědčí pro výhodu doplnění ribavirinu v obvyklém dávkování k této kombinaci. Nicméně jeho přidání k léčbě může být uváženo v případech pacientů s výskytem negativních prediktorů efektu léčby, zejména u pacientů s neúspěchem předchozí léčby a u pacientů s jaterní cirhózou.
U dosud neléčených pacientů vedla 24týdenní léčba k SVR ve 100 %. U pacientů neúspěšně léčených kombinací PEG: IFN + RBV + boceprevir byla SVR 100 %, v případě telapreviru 95 %. Dosud neléčené osoby dosáhly po 12 týdnech léčby SVR v 98 % případů (bez RBV). Publikované a citované výsledky však byly dosaženy na malých počtech pacientů.
*Jde o jedinou variantu, pro kterou existují první informace o použití u pacientů neúspěšně léčených kombinacemi PEG-IFN + RBV + boceprevir/telaprevir.
10.1.7. Léčebná varianta 7: PEG-IFN ++ RBV + boceprevir/telaprevir
Podle současných znalostí a dostupných dat se jedná v dané indikaci o léčebnou variantu použitelnou pouze v případě, že ostatní varianty výše uvedené nejsou ve zdravotním systému dostupné.
10.1.7.1. Dosud neléčení pacienti
10.1.7.1.1. Pravidla léčby s použitím bocepreviru
- Doporučená dávka bocepreviru je 800 mg třikrát denně, užití je nutné kombinovat s požitím alespoň menšího množství jídla. Podání bocepreviru je indikováno po čtyřech týdnech terapie kombinací PEG-IFN + RBV (tzv. lead in fáze). Délka trojkombinační léčby má být 24 nebo 44 týdnů.
- Pacienti bez jaterní cirhózy léčení trojkombinací PEG-IFN, RBV + boceprevir se čtyřtýdenní lead in fází, kteří jsou HCV RNA negativní v týdnu 8 a 24, mohou být léčeni po dobu 28 týdnů celkově (tj. čtyři týdny lead in a 24 týdnů trojkombinace).
- Pacienti s jaterní cirhózou by měli být léčeni po dobu 48 týdnů, čtyři týdny PEG-IFN + RBV a poté 44 týdnů PEG-IFN + RBV + BOC.
- Je-li sérová HCV RNA > 1 000 IU/ml v 8. týdnu nebo ve 12. týdnu >> 100 IU/ml, musí být léčba trojkombinací ukončena. Léčbu je nutno ukončit rovněž v případě, že ve 24. týdnu je HCV RNA detekovatelná (tj. nad detekčním limitem použité metody).
10.1.7.1.2. Pravidla léčby s použitím telapreviru
- Doporučená dávka telapreviru je 750 mg třikrát denně spolu s jídlem, nejlépe tučným. Celková denní dávka může být rozdělena jen do dvou dílčích dávek po 1 125 mg. Doporučený interval požití je v tomto případě 12 hodin. Telaprevir se podává od počátku léčby v trojkombinaci (není lead in fáze) po dobu 12 týdnů a následuje 12 nebo 36 týdnů dvojkombinační léčby PEG-IFN + RBV.
- Pacienti bez jaterní cirhózy léčení trojkombinací PEG-IFN + RBV + telaprevir, kteří jsou HCV RNA negativní v týdnu 4 a 12, mohou být léčeni po dobu jen 24 týdnů.
- Pacienti s jaterní cirhózou by měli být léčeni po dobu 48 týdnů.
- Trojkombinace obsahující telaprevir by měla být ukončena, pokud je HCV RNA > 1 000 IU/ml ve 4. nebo 12. týdnu léčby nebo detekovatelná ve 24. týdnu léčby.
10.1.7.2. Opakovaná léčba
10.1.7.2.1. Pravidla léčby s použitím bocepreviru
- Pacienti s null-response na předchozí protivirovou léčbu a pacienti s jaterní cirhózou (bez ohledu na typ odpovědi na předchozí léčbu). Léčba trvá celkově 48 týdnů. V týdnech 1–4 je léčba vedená kombinací PEG-IFN + RBV (lead in fáze), poté následuje 44 týdnů léčby trojkombinací PEG-IFN + RBV + BOC.
- Pacienti relabující po přechozí léčbě nebo pacienti s částečnou odpovědí na předchozí léčbu. Léčba trvá celkově 48 týdnů. V týdnech 1–4 je léčba vedená kombinací PEG-IFN + RBV, následuje léčba trojkombinací PEG-IFN + RBV ++ BOC do týdne 36 a poté následuje 12 týdnů léčba kombinací PEG-IFN ++ RBV.
Pro obě skupiny pacientů platí toto pravidlo pro předčasné ukončení:
Je-li sérová HCV RNA > 1 000 IU/ml v 8. nebo ve 12. týdnu > 100 IU/ml, musí být léčba ukončena. Léčbu je nutno ukončit rovněž v případě, že ve 24. týdnu je HCV RNA detekovatelná (tj. nad detekčním limitem použité metody).
10.1.7.2.2. Pravidla léčby s použitím telapreviru
- Pacienti relabující po přechozí léčbě. Léčba v tomto případě trvá 24 týdnů. V týdnech 1–12 je léčba vedena trojkombinací PEG-IFN + RBV + TVR a poté následuje 12 týdnů léčby dvojkombinací PEG-IFN + RBV.
- Pacienti s částečnou nebo nulovou odpovědí na předchozí léčbu a všichni pacienti s jaterní cirhózou. Léčba v tomto případě trvá 48 týdnů. V týdnech 1–12 je léčba vedena trojkombinací PEG-IFN + RBV + TVR a poté následuje 36 týdnů léčby dvojkombinací PEG-IFN + RBV.
Pro obě skupiny pacientů platí toto pravidlo pro předčasné ukončení:
Léčba by měla být ukončena, pokud je sérová HCV RNA ve 4. nebo 12. týdnu léčby > 1 000 IU/ml. Důvodem je opět vysoké riziko vzniku virové rezistence.
10.1.8. Léčebná varianta 8: PEG-IFN + RBV
Dávkování PEG-IFN a RBV uvádí tab. 2. Jedná se o způsob léčby, který v roce 2014 zdaleka nelze považovat za optimální. Tuto variantu léčby lze použít v současné době pouze pro dosud neléčené pacienty a při splnění všech následujících předpokladů:
- v systému zdravotní péče nejsou dostupná virostatika druhé generace (simeprevir),
- pravděpodobnost dosažení SVR při kombinaci PEG-IFN + RBV je vysoká, srovnatelná s použitím kombinace PEG-IFN + RBV + BOC/TVR (cca 80–85 %).
Mezi faktory, které lze použít k predikci léčebné odpovědi, patří především genotyp IL28B a věk pacienta, výchozí viremie, pokročilost jaterního onemocnění (stupeň jaterní fibrózy) a přidružená onemocnění. Posouzení těchto faktorů a zhodnocení pravděpodobnosti dosažení SVR je přísně individuální, rozhodnutí o podání tohoto režimu činí ošetřující lékař za souhlasu pacienta.
10.2. Genotyp HCV 2
Ideální léčebnou variantou se jeví kombinace sofosbuviru s ribavirinem. Tam, kde tato možnost není dostupná, je akceptovatelnou variantou kombinace PEG-IFN + RBV.
10.2.1. Léčebná varianta 1: sofosbuvir + RBV
Sofosbuvir je podáván v dávce 400 mg denně a ribavirin ve standardním dávkování (tab. 2). Délka léčby je 12 týdnů.
Při použití této kombinace bylo dosaženo po 12 týdnech léčby SVR v 95 % případů. Léčba byla účinnější u pacientů bez jaterní cirhózy (97 vs 83 %). Pacienti s jaterní cirhózou mohou dle dosavadních znalostí profitovat z léčby prodloužené na 16 týdnů (studie FUSION). Navýšení SVR při takto vedené léčbě bylo proti 12 týdnům o 18 % (60 vs 78 %). Vysoké účinnosti léčby (kolem 90 %) bylo dosaženo i ve skupině pacientů s předchozí neúspěšnou protivirovou léčbou PEG-IFN + RBV. Jde však většinou o výsledky na početně malých pacientských skupinách.
10.2.2. Léčebná varianta 2: PEG-IFN + RBV + sofosbuvir
Dávkování PEG-IFN a RBV uvádí tab. 2. Sofosbuvir je podáván v dávce 400 mg denně, délka léčby je 12 týdnů.
Tato varianta může být užita u pacientů s jaterní cirhózou a/nebo neúspěšnou léčbou v minulosti. Tato kombinace byla studována ve studii LONESTAR-2, kde bylo ve skupině cirhotiků dosaženo SVR v 96 % případů.
10.2.3. Léčebná varianta 3: PEG-IFN + RBV
Dávkování PEG-IFN a RBV uvádí tab. 2. Tuto variantu léčby lze použít v současné době pouze, pokud v systému zdravotní péče nejsou dostupná virostatika výše zmíněná.
10.3. Genotyp HCV 3
10.3.1. Léčebná varianta 1: PEG-IFN + RBV + sofosbuvir
Dávkování PEG-IFN a RBV je uvedeno v tab. 2. Sofosbuvir je podáván v dávce 400 mg denně, délka léčby je 12 týdnů.
Tato kombinace se jeví jako nejúčinnější varianta při nejkratší délce trvání terapie. Znalosti o účinnosti této léčby pocházejí ze studie LONESTAR-2, kde bylo dosaženo SVR u 83 % pacientů (20/24 pacientů). Do studie vstoupilo 12 cirhotiků a 10 z nich dosáhlo SVR.
10.3.2. Léčebná varianta 2: RBV + sofosbuvir
Dávkování RBV je uvedeno v tab. 2. Sofosbuvir je podáván v dávce 400 mg denně, délka léčby je 24 týdnů. Tato terapie je považována za suboptimální u pacientů neúspěšně léčených v minulosti s jaterní cirhózou.
Účinnost této varianty léčby ve studii VALENCE (24 týdnů) byla následující:
- pacienti dosud neléčení bez jaterní cirhózy – SVR 94 %,
- pacienti dosud neléčení s jaterní cirhózou – SVR 92 %,
- pacienti opakovaně léčení bez jaterní cirhózy – SVR 87 %,
- pacienti opakovaně léčení s jaterní cirhózou – SVR 60 %.
10.3.3. Léčebná varianta 3: sofosbuvir + daclatasvir
Sofosbuvir je podáván v dávce 400 mg denně, daclatasvir 60 mg denně. Délka léčby je u pacientů neléčených 12 týdnů, u pacientů neúspěšně léčených v minulosti 24 týdnů.
Dostupná data do této chvíle nesvědčí pro výhodu doplnění ribavirinu v obvyklém dávkování k této kombinaci. Nicméně jeho přidání k léčbě může být uváženo v případech pacientů s výskytem negativních prediktorů efektu léčby, zejména u pacientů s neúspěchem předchozí léčby a u pacientů s jaterní cirhózou.
O této léčebné variantě je dostupné do této chvíle minimum informací. U pacientů dosud neléčených bez jaterní cirhózy bylo dosaženo SVR v 89 % případů (16/18 pacientů). Ribavirin v této skupině neměl žádný pozitivní přínos.
10.3.4. Léčebná varianta 3: PEG-IFN + RBV
Dávkování PEG-IFN a RBV uvádí tab. 2. Tuto variantu léčby lze použít v současné době pouze pro dosud neléčené pacienty, pokud nespadají do léčebné varianty 10.3.1. až 10.3.3. U ostatních pacientů je možno tuto variantu použít pouze tehdy, pokud v systému zdravotní péče nejsou dostupná virostatika výše zmíněná.
Opakovanou léčbu PEG-INF + RBV v délce 48 týdnů je možno použít jen u pacientů, kteří nedosáhli SVR po úvodní léčbě trvající jen 24 týdnů, a pokud nejsou v systému zdravotní péče dostupná virostatika výše zmíněná.
10.4. Genotypy HCV 4–6
Tyto genotypy se v ČR prakticky nevyskytují, léčebné varianty proto nebudou rozebírány. V případě nutnosti lze všechny léčebné možnosti nalézt v textu standardních doporučení vydaných Evropskou asociací pro studium jater na www.easl.eu.
11. Monitorování účinnosti léčby HCV infekce
Monitorování účinnosti léčby je založeno na opakovaném sledování sérových hladin HCV RNA. K tomuto účelu je třeba užívat metody o standardní citlivosti ≤ 15 IU/ml. Nutné je dbát na to, aby při sledování jednoho konkrétního pacienta byla využívána stejná metoda, ideálně stejná laboratoř. Pro účely monitorování účinnosti léčby a pro kvalifikované rozhodování o pokračování či naopak o ukončení protivirové léčby je třeba respektovat definované časové body, kdy je vyšetření HCV RNA indikováno. Časové body, kdy je vhodné vyšetření HCV RNA, se mohou u jednotlivých léčebných variant lišit, vždy byly však určeny tak, aby znalost HCV RNA v daném okamžiku měla vliv na předepsaný léčebný režim. Obecně jde o tyto indikace:
- ověření adherence pacienta k léčbě (týden 2 léčby),
- rozhodnutí o ukončení či pokračování léčby, tzv. futility rules,
- rozhodnutí o případném zkrácení protivirové léčby, tzv. léčba vedená podle odpovědi (response guided therapy – RGT),
- rozhodnutí o úspěchu léčby, tj. v okamžiku ukončení léčby a ve 12. a/nebo 24. týdnu po skončení léčby (SVR).
11.1. Monitorování léčby u jednotlivých léčebných variant
PEG-IFN + RBV + sofosbuvir
- zahájení léčby, týdny 4, 12 během léčby,
- týdny 12 a/nebo 24 po skončení léčby.
PEG-IFN + RBV + simeprevir
- zahájení léčby, týdny 4, 12, 24 (konec léčby u dosud neléčených a přechozích relapsérů) + týden 48 (konec léčby u předchozích parciálních respondérů a null-respondérů),
- týdny 12 a/nebo 24 po skončení léčby.
PEG-IFN + RBV + daclatasvir
- zahájení léčby, týdny 4, 10, 24 (konec léčby),
- týdny 12 a/nebo 24 po skončení léčby.
Bezinterferonové režimy
(SOF + SMV +/ - RBV 12 týdnů, SOF ++ DCV +/ - RBV 12/24 týdnů, SOF + RBV 12/24 týdnů)
- zahájení léčby, týdny 4, 12, 24,
- týdny 12 a/nebo 24 po skončení léčby.
Pravidla předčasného ukončení (futility rules) z důvodu minimální/nulové pravděpodobnosti dosažení SVR byla definována pouze pro trojkombinaci PEG-IFN + RBV + SMV:
léčba tímto režimem by měla být ukončena, pokud je HCV RNA ≥ 25 IU/ml v týdnu 4, 12 nebo 24.
Pro žádný jiný léčebný režim s novými DAA nebyla podobná pravidla definována.
Pravidla pro zkrácení léčby (léčba vedená podle odpovědi) byla definována pouze pro kombinaci PEG-IFN + RBV + + daclatasvir:
- pacienti, kteří nedosáhnou HCV RNA < 25 IU/ml v týdnu 4 a mají detekovatelnou HCV RNA v týdnu 10, by měli být léčeni kompletní trojkombinací celkem 24 týdnů,
- pacienti, kteří dosáhnou HCV RNA << 25 IU/ml v týdnu 4 a mají nedetekovatelnou HCV RNA v týdnu 10, by měli ukončit léčbu daclatasvirem v týdnu 12 a měli by pokračovat v terapii kombinací PEG-IFN + RBV do 24. týdne.
12. Metody zvýšení adherence pacientů k léčbě
Plná adherence ke všem podávaným a výše diskutovaným preparátům je základní podmínkou dosažení vysoké úspěšnosti léčby, tj. vysoké SVR. Není-li tato podmínka splněna, je vysoké riziko selhání léčby, ať už ve formě breakthrough fenoménu či relapsu HCV po skončení protivirové léčby, v případě podání DAA se dále zvyšuje také riziko vzniku virologické rezistence. Existuje několik základních opatření, jak adherenci zvýšit:
- Před zahájením léčby je nutno s pacienty diskutovat veškeré možné a očekávané vedlejší účinky léčby. Je potřeba pacientům vysvětlit, že řadě z nich lze účinně zabránit či je terapeuticky ovlivnit v případě jejich rozvoje během protivirové léčby.
- Klíčovým opatřením je přístup pacientů ke specialistům multidisciplinárního týmu s maximem zkušeností s terapií HCV infekce a se zvládáním všech nežádoucích účinků, s monitoringem účinnosti a bezpečnosti protivirové léčby.
- Alkohol negativně ovlivňuje výsledky protivirové léčby. Během léčby by proto měla být pacientům doporučována abstinence či maximální možná redukce jeho příjmu. Pacientům s pokračující konzumací alkoholu během protivirové léčby by měla být poskytnuta veškerá další dostupná péče.
13. Péče o pacienty s dosaženou SVR
Pacienti bez jaterní cirhózy, kteří dosáhli SVR, by měli být znovu testováni ve 48. týdnu po skončení léčby. Pokud je v tomto okamžiku sérová HCV RNA nedetekovatelná, je možno považovat HCV infekci za vyléčenou v daném případě a HCV RNA již dále nemusí být vyšetřována. V období jednoho a dvou let po skončení protivirové léčby s režimy obsahujícími PEG-IFN je třeba kontrolovat funkci štítné žlázy. Pacienti se SVR, u nichž ale byly před zahájením protivirové léčby přítomny ještě jiné možné příčiny jaterního onemocnění (diabetes mellitus – DM, zvýšený příjem alkoholu), by měli být dále sledováni v odborných poradnách. Interval sledování nebyl stanoven.
Pacienti s jaterní cirhózou, kteří dosáhnou SVR, by měli být zařazeni do programů surveillance HCC a měla by být u nich monitorována možná progrese portální hypertenze. U této skupiny nemocných je proto indikována abdominální sonografie v intervalu šesti měsíců, a pokud byly přítomny jícnové varixy před zahájením léčby, je třeba provádět endoskopické vyšetření v intervalu jednoho roku. Další faktory, DM typu 2 či anamnéza abúzu alkoholu, může tento navrhovaný postup modifikovat.
U osob s vysokým rizikem infekce, jako jsou např. intravenózní uživatelé drog či homosexuálové, je třeba uvažovat i o riziku reinfekce. Riziko reinfekce je nicméně malé, publikovaná data se pohybují v rozmezí 1–5 % ročně.
14. Opakovaná léčba pacientů bez dosažení SVR
U pacientů infikovaných genotypem HCV 1, kteří byli léčeni kombinací PEG-IFN + RBV + telaprevir či boceprevir, lze zvážit podání kombinace sofosbuviru a daclatasviru. Účinnost tohoto režimu (SVR) byla 100 % s ribavirinem a 95 % bez ribavirinu. V této populaci dosud nebyla zkoušena kombinace PEG-IFN + SOF + RBV.
Dosud nebyla publikována ani data o opakované léčbě pacientů s neúspěšnou léčbou SOF + simeprevir a/nebo daclatasvir. U této skupiny je třeba vyčkat výsledků dalších studií, protože sofosbuvir sice nevede ke vzniku rezistenčních variant HCV, nicméně tyto byly popsány jako hlavní příčina selhání léčby se simeprevirem i daclatasvirem.
15. Léčba pacientů s pokročilým jaterním onemocněním
15.1. Kompenzovaná jaterní cirhóza
Pacienti s kompenzovanou jaterní cirhózou představují skupinu osob, u kterých by měla být protivirová léčba zahájena co nejdříve. Všechny komplikace jaterní cirhózy, dekompenzace, rozvoj HCC, se v této skupině může objevit v krátkém časovém horizontu. Snížení incidence dekompenzace a HCC v případech úspěšné léčby bylo prokázáno opakovaně metaanalýzami. Na druhou stranu je léčba těchto pokročilých stadií onemocnění spojena s nižší pravděpodobností dosažení SVR, a to i při použití režimů s DAA. Tito pokročilí pacienti rovněž vyžadují zvláštní péči ve smyslu prevence a včasné léčby závažných nebo potenciálně závažných nežádoucích účinků léčby. Jde většinou o pacienty, kteří jsou ve srovnání s pacienty bez cirhózy starší, mají řadu souběžné medikace, a tudíž také léčbu hůře snášejí. Preferovanými režimy v této skupině jsou v současné době bezinterferonové režimy. Použití režimů založených na interferonu se v současné době jeví jako racionální pouze v situaci, že bezinterferonové režimy nejsou dostupné.
15.2. Pacienti indikovaní k transplantaci jater
Transplantace jater (Tx) je postupem volby u pacientů s konečným stadiem jaterního onemocnění. Rekurence HCV infekce s reinfekcí štěpu po Tx je prakticky 100 %, životnost štěpu je také u pacientů s rekurentní HCV infekcí zkrácena. U pacientů čekajících na Tx jater je protivirová léčba jednoznačně indikována, protože v případech, kdy je HCV RNA nedetekovatelná alespoň 30 dnů před vlastní Tx, nedochází k rekurenci infekce po Tx jater.
Pro pacienty před Tx jater platí následující doporučení:
- pacienti s jaterní cirhózou, funkční klasifikace Child-Pugh A, u nichž je indikací k Tx průkaz HCC
- varianta léčby A – ribavirin ve standardním dávkování (tab. 2) v kombinaci se sofosbuvirem 400 mg denně, a to až do provedení Tx,
- varianta léčby B – PEG-IFN + ribavirin ve standardním dávkování (tab. 2) v kombinaci se sofosbuvirem 400 mg denně, délka léčby je 12 týdnů,
- varianta léčby C – protože přidání dalšího DAA pravděpodobně vede k ještě účinnější prevenci potransplantační rekurence HCV, je další alternativou ve stejné indikaci podání ribavirinu v kombinaci se sofosbuvirem a daclatasvirem nebo v kombinaci se sofosbuvirem a simeprevirem – vše ve stejném dávkování jako v ostatních situacích.
- 2. pacienti s jaterní cirhózou funkční klasifikace Child-Pugh B a C
- varianta léčby A – ribavirin ve standardním dávkování (tab. 2) v kombinaci se sofosbuvirem 400 mg denně, a to až do provedení Tx, interferon je v této skupině kontra-indikován,
- varianta léčby B – protože přidání dalšího DAA pravděpodobně vede k ještě účinnější prevenci potransplantační rekurence HCV, je další alternativou ve stejné indikaci podání ribavirinu v kombinaci se sofosbuvirem a daclatasvirem – vše ve stejném dávkování jako v ostatních situacích.
Pacienti s dekompenzovanou cirhózou, kteří nejsou zařazeni na čekací listinu k Tx jater, by měli být léčeni pouze bezinterferonovými režimy v rámci klinických studií různých typů, a to preferenčně ve specializovaných centrech, protože účinnost ani bezpečnost léčby v této indikaci nebyla dosud stanovena.
15.3. Pacienti po transplantaci jater
Rekurence HCV infekce po Tx jater postihuje téměř všechny pacienty. Průběh infekce po Tx je akcelerován a přibližně v 1/3 pacientů se rozvine jaterní cirhóza během pěti let po Tx. V posledních letech se podařilo prokázat, že úspěšná protivirová léčba má velmi pozitivní vliv na přežití štěpu i pacienta.
Pacienti s potransplantační rekurencí infekce jsou proto kandidáty protivirové léčby. Dostupná data o účinnosti léčby v této skupině jsou omezená. Kombinace sofosbuvir + ribavirin po dobu 24 týdnů vedla k dosažení SVR (resp. HCV RNA negativita ve 4. týdnu po skončení léčby) v 77 % případů s lehčí formou rekurence. Kombinace sofosbuviru a simepreviru byla účinná i u pacientů s těžkou rekurentní cholestatickou hepatitidou po Tx jater. Těžká forma rekurence byla úspěšně léčena i kombinací sofosbuviru s daclatasvirem.
15.3.1. Léčebné varianty po transplantaci jater
- Pacienti s infekcí vyvolanou HCV genotypem 2 musí být léčeni kombinací ribavirinu ve standardním dávkování se sofosbuvirem 400 mg denně po dobu 12–24 týdnů.
- Pacienti s infekcí vyvolanou HCV genotypy 1 a 3–6 mohou být léčeni kombinací sofosbuviru 400 mg denně a daclatasviru 60 mg denně po dobu 12–24 týdnů. K této kombinaci může být doplněn ribavirin v obvyklém dávkování.
- Pacienti s HCV genotypem 1 nebo 4 mohou být léčeni kombinací sofosbuvir 400 mg denně, simeprevir 150 mg denně po dobu 12–24 týdnů. K této kombinaci může být doplněn ribavirin v obvyklém dávkování.
U žádné z těchto kombinací není třeba změna dávkování tacrolimu či cyklosporinu. Na místě je však pečlivé sledování těchto pacientů.
16. Léčba pacientů s komorbiditami
16.1. Koinfekce HBV/HCV
Zatím neexistují žádná obecně platná doporučení pro léčbu pacientů s koinfekcí HBV/HCV. Nutný je individuální přístup a postupné uplatňování nových zkušeností s léčbou těchto pacientů. U naprosté většiny těchto pacientů tlumí replikace HCV replikaci HBV, proto lze zpravidla v séru prokázat HCV RNA, zatímco sérová hladina HBV DNA je pod hranicí detekovatelnosti. HCV je pak hlavním nositelem a příčinou jaterního postižení. Z uvedeného vyplývá, že u těchto osob je zapotřebí stanovit replikační aktivitu obou virů, tj. stanovit sérové hladiny HBV DNA i HCV RNA. Indikováno je i vyšetření sérologie HDV (případně i HEV RNA). Pokud je hlavním patogenetickým činitelem HCV, je třeba v případech koinfekce postupovat stejně jako u monoinfekce HCV. Po dosažení eliminace HCV je určité riziko reaktivace HBV. Pokud k této situaci dojde a objeví se významná replikace HBV, je indikováno zahájení léčby nukleotidovými analogy. Nukleotidová analoga jsou indikována jako součást protivirové léčby i v případě, že je významná replikace HBV přítomna i před zahájením protivirové léčby HCV infekce.
16.2. Pacienti v pravidelném dialyzačním léčení
Pacienti zařazení do pravidelného dialyzačního léčení (PDL) představují velmi speciální skupinu nemocných s chronickou HCV infekcí. Základním kritériem pro zahájení protivirové léčby pacienta v PDL je perspektiva transplantace ledviny. V ostatních případech je třeba zcela individuální přístup, zvážení závažnosti jaterního postižení, celkové prognózy nemocného a především možných rizik vyplývajících z podání protivirové léčby. Léčba pacientů v PDL by měla být vedena na pracovišti majícím s touto skupinou nemocných zkušenosti.
HCV infekce je u pacientů v PDL asociována s vyšší všeobecnou i jaterní mortalitou. Hlavním faktorem limitujícím přežití těchto nemocných však zůstává kardiovaskulární morbidita.
Použití ribavirinu u této populace je limitováno, dávkování je třeba individualizovat. Zprávy jsou o podávání ribavirinu 200 mg denně, 200 mg obden nebo 200 mg třikrát týdně (vždy po hemodialýze). Do této chvíle nebyla publikována žádná data o použití nových bezinterferonových režimů u HD pacientů v této indikaci, proto je stále volbou kombinace PEG-IFN a ribavirinu v redukované dávce, event. v kombinaci s boceprevirem nebo telaprevirem, pokud nemocný nemá kontraindikaci.
16.3. Příjemci orgánových štěpů**
HCV infikovaní příjemci transplantované ledviny jsou ohroženi rychlým průběhem jaterní fibrózy. HCV přitom negativně ovlivňuje přežití štěpu i pacienta. Přežití pacienta je ovlivněno i dalšími faktory asociovanými s HCV (HCV asociovanou glomerulonefritidou), ale i faktory bez vztahu k HCV. I v této skupině nemocných je hlavním limitujícím faktorem kardiovaskulární morbidita. Přítomnost jaterní cirhózy v okamžiku Tx ledviny je jedním z nejvýznamnějších negativních faktorů asociovaných se špatnou prognózou po Tx. Z tohoto důvodu by u všech HCV RNA pozitivních kandidátů Tx ledviny měl být určen stupeň jaterní fibrózy před provedením Tx. U pacientů s jaterní cirhózou a portální hypertenzí, u kterých je léčba založená na podání PEG-IFN považována za kontraindikovanou, je možno považovat za kontraindikovanou i izolovanou Tx ledviny. Zvážena by měla být kombinovaná Tx jater a ledviny. Podání PEG-IFN po Tx ledviny je kontraindikováno pro riziko rejekce štěpu, proto existuje urgentní potřeba získat data o použití bezinterferonových režimů v této indikaci. Tato data nejsou dosud dostupná. Odmítnutí protivirové terapie pacientem není absolutní kontraindikací první transplantace ledviny. Podmínkou je nepřítomnost pokročilé fibrózy jater a nízká zánětlivá aktivita.
Data o HCV infekci u pacientů před transplantací nebo po transplantaci srdce jsou kontroverzní. Z možností protivirové léčby by měly být preferovány bezinterferonové režimy, zvážení rizik a přínosu je přísně individuální.
HCV infekce je považována v řadě center za kontraindikaci transplantace plic, perspektiva bezinterferonové léčby po transplantaci ale takovou kontraindikaci činí jen relativní.
** s výjimkou jater
16.4. Hemofilici
Charakteristiky HCV infekce u pacientů s různými typy hemofilií se nijak neliší od pacientů HCV pozitivních bez hemofilie. Metodou volby pro určení stadia jaterního postižení jsou v této skupině neinvazivní metody, v případech, kdy je indikováno měření portosystémového gradientu, lze provést současně i jaterní biopsii transjugulárním přístupem. Úmrtí z jaterních příčin patří v této skupině pacientů mezi nejčastější příčiny úmrtí. S výjimkou omezení pro jaterní biopsii je péče o HCV pozitivní hemofiliky stejná jako pro ostatní populaci. Nová DAA lze proto u této skupiny použít podle stejných pravidel.
16.5. Aktivní uživatelé drog
Drogová závislost je uvedena v Mezinárodní statistické klasifikaci nemocí a přidružených zdravotních problémů. Na pacienta drogově závislého je proto nutné pohlížet jako na člověka nemocného. Ani medicínsky ani eticky není tedy odůvodnitelné odmítnutí jakékoli léčby uživatelům drog. Rozhodující je vždy zvážení přínosu a rizika pro individuálního pacienta. U této skupiny nemocných nebyla dosud publikována data o použití nových DAA. Za standardní léčbu lze proto v tuto chvíli nadále považovat postupy založené na podání PEG-IFN a ribavirinu.
Aktivní abúzus alkoholu a drog negativně ovlivňuje adherenci k léčbě. Drogově závislí mají častější výskyt poruch mentálního zdraví, častější psychiatrické onemocnění. Obojí dále zhoršuje adherenci k terapii. Studie léčených pacientů s aktivní drogovou závislostí ukazují srovnatelný efekt terapie chronické HCV infekce s jinými skupinami infikovaných osob. Rychlá inhibice replikace viru hepatitidy C (již během 8 hod po aplikaci interferonu) zabraňuje dalšímu šíření infekce.
Zcela zásadní podmínkou pro zahájení terapie je motivace pacienta a jeho adherence k terapii. Předčasné ukončení terapie na základě špatné adherence je častější v prvních 12 týdnech. Kontrolou pomůcek a další intervencí u uživatelů drog lze snížit riziko reinfekce.
K léčbě musí být pacient motivován a musí spolupracovat, aby bylo možno snížit riziko rozvoje závažných nežádoucích účinků terapie. Tyto často souvisejí se současným užívání drog a kombinované protivirové terapie. Léčba drogově závislých je multifaktoriální a multioborová. Předpokládá zajištění psychiatrické intervence, sociálního šetření. Drogově závislý musí být před léčbou vyšetřen psychiatrem nebo lékařem pro léčbu závislostí. Často se jeví jako výhodné zahájení terapie antidepresivy (SSRI) nejméně 14 dnů před zahájením terapie PEG-IFN a RBV. K uživatelům drog musí být vždy individuální přístup. V případě léčby vedené s použitím bocepreviru či telapreviru je třeba uvažovat i možné lékové interakce, a tyto proto monitorovat.
Pacienti na substituční léčbě jsou považováni za pacienty s kontrolovaným psychiatrickým onemocněním. Postup, diagnostika a terapie virové hepatitidy C u spolupracujícího pacienta, u pacienta s aktivní drogovou závislostí (nebo na substituční terapii), je shodný s doporučeným postupem u pacientů bez závislosti.
16.6. Akutní HCV infekce
Průběh akutní HCV infekce je ve většině případů asymptomatický, ale ke chronickému průběhu onemocnění dochází v 50–90 % případů. Symptomatický průběh, ženské pohlaví, nižší věk a genotyp IL28B CC jsou faktory asociované se spontánní eliminací viru. Žádný z těchto parametrů však nemá dostatečnou individuální prediktivní hodnotu. Pacienti s diagnostikovanou akutní hepatitidou C by měli být považováni za kandidáty protivirové léčby. V této skupině pacientů bylo dosaženo SVR > 90 % při podání monoterapie PEG-IFN. Doplnění ribavirinu do kombinace v této indikaci nijak nenavyšuje SVR. Data s novými DAA v indikaci akutní HCV infekce nebyla dosud publikována.
Ideální okamžik zahájení protivirové léčby nebyl u akutní HCV infekce definován. Někteří autoři považují za ideální dobu k zahájení léčby okamžik vzniku elevace ALT, a to bez ohledu na přítomnost, či absenci dalších klinických příznaků. Alternativou postupu je vyčkat do 12. týdne od vzniku příznaků a léčbu zahájit pouze u osob, které jsou i v tomto okamžiku HCV RNA pozitivní. Tento postup se jeví racionální především v symptomatických případech u osob s genotypem CC lokusu rs12979860 genu IL28B.
16.7. Pacienti s koinfekcí HCV + HIV
16.7.1. Základní fakta
HIV negativně ovlivňuje průběh akutní i chronické HCV infekce. Pacienti HIV pozitivní s chronickou infekcí HCV mají třikrát vyšší riziko rozvoje jaterní cirhózy než osoby HIV negativní. Vyšší riziko je i pro rozvoj hepatocelulárního karcinomu.
Jaterní choroby, zejména vzniklé v souvislosti s chronickou HCV infekcí, jsou v současnosti nejčastější příčinou úmrtí mezi HIV pozitivními pacienty.
HIV/HCV koinfikované osoby mají významně vyšší viremii než osoby infikované jen HCV. Počet CD4 pozitivních T-buněk je nejspolehlivějším prediktorem progrese jaterního postižení u osob HIV/HCV pozitivních. Dalšími predikčními faktory jsou: pohlaví, trvání HCV infekce a konzumace alkoholu.
Přes možné hepatotoxické vlivy kombinované antiretrovirové terapie (cART) se zdá, že její podání výrazně zpomaluje progresi jaterního postižení u HCV/HIV osob. Všem koinfikovaným osobám by proto některý z režimů cART měl být podán.
Data o průběhu HIV infekce u koinfikovaných osob, tj. jak je průběh HIV ovlivněn HCV infekcí, nejsou dosud jednoznačná a nelze z nich dělat žádné závěry.
16.7.2. Diagnóza HCV/HIV koinfekce
Všechny osoby HIV pozitivní by měly být vyšetřeny na HCV infekci. Zde je třeba myslet na skutečnost, že část osob s HIV infekcí (a především s nízkým počtem CD4 buněk) je anti-HCV negativní, nebo že titr anti-HCV je minimální a je proto neprokazatelný. U všech HIV pozitivních osob je tedy správné uvažovat vždy o vyšetření sérové HCV RNA metodou PCR. Všechny osoby HIV pozitivní, u kterých je sérová HCV RNA negativní (zejména u těch, které jsou přitom anti-HCV pozitivní), je třeba vyšetření několikrát opakovat.
Jaterní biopsie se týkají stejná doporučení jako u HIV negativních osob (kapitola 5). Vzhledem k vyššímu riziku závažnějšího jaterního postižení je u koinfikovaných osob jaterní biopsie jednoznačně indikována. Všem osobám HIV pozitivním by měla být doporučena vakcinace proti HBV (pokud jsou HBsAg a anti-HBs negativní) a vakcinace proti viru hepatitidy A (HAV). Samozřejmostí je minimalizace expozice všem ostatním hepatotoxickým vlivům (zejména alkoholu).
16.7.3. Terapie
Pravidla a varianty protivirové léčby chronické HCV infekce u HIV koinfikovaných osob se neliší od pacientů bez HIV koinfekce (kapitola 10).
Ribavirin je inhibitorem IMPDH (inozin monofosfát dehydrogenázy), proto je kontraindikovaná kombinace s purinovým analogem didanosinem. Současná terapie ribavirinem a didanosinem zvyšuje mitochondriální toxicitu, může vést k pankreatitidě, k laktátové acidóze a k dekompenzaci jaterní cirhózy.
Terapie stavudinem (d4T) také zvyšuje toxicitu. Současná terapie se zidovudinem zvyšuje riziko dřeňového útlumu (kombinace interferonu, zidovudinu a samotného HIV). Opatrnost musí být i při podání nenukleosidového inhibitoru RT efavirenzu, který zhoršuje neuropsychický efekt interferonu. U koinfekce HIV a HCV by měla být zahájena včasná cART, jež je pozitivním prediktivním faktorem úspěšnosti terapie chronické HCV infekce. Někteří experti doporučují zahájení cART u sníženého počtu CD4 T lymfocytů pod 500/µl. Ve stávajícím doporučeném postupu je zahájení cART při absolutním počtu CD4 T lymfocytů < 350/µl. Zahájení cART závisí nejen na počtu CD4 T lymfocytů, ale i na virové náloži HIV RNA a klinickém stavu pacienta.
Zhodnocení histologického nálezu z jaterní biopsie je důležité v rozhodovacím procesu terapie. Pokud je chronická virová hepatitida zjištěna v iniciálních stadiích HIV infekce, je zahájena nejdříve terapie chronické virové hepatitidy. Při absolutním počtu CD4 T lymfocytů < 200/µl je nutná nejdříve restaurace pomocí cART a následné rozhodnutí o terapii HCV infekce. U akutní virové hepatitidy by měla být pro velké riziko rozvoje chronické HCV infekce zahájena terapie HCV vždy, a to buď monoterapií interferonem α nebo kombinací PEG-INF + RBV. Nejpříznivějším predikčním faktorem efektu terapie je genotyp jiný než 1, nízká virová nálož a dobrá adherence k terapii.
Terapie HCV infekce má pozitivní efekt i pro pacienty bez dosažení SVR: > 30 % osob bez dosažení virologické odpovědi během léčby vykázalo významné histologické zlepšení. Zdá se tedy, že u pacientů HCV/HIV koinfikovaných s pokročilou fibrózou či již rozvinutou jaterní cirhózou představuje udržovací terapie racionální postup. Pokles CD4 T lymfocytů, ke kterému obligatorně dochází, je ve většině případů reverzibilní po skončení léčby. Snížení virové nálože HIV během terapie (anti-HIV aktivitou IFN-α) se po ukončení terapie vrací k původním hodnotám.
U osob, u kterých i přes výše uvedené postupy dojde k progresi jaterní cirhózy, lze uvažovat o provedení jaterní transplantace. V ČR tuto indikaci nelze zatím považovat za standardní.
17. Sledování pacientů neléčených a pacientů s neúspěšnou léčbou
Pacienti neléčení a pacienti s prodělanou neúspěšnou terapií (tj. bez SVR) by měli být dál pravidelně sledováni. Základním pravidlem má být zdokumentování důvodu nepodání protivirové léčby v daném okamžiku a případně typu protivirové odpovědi a pravděpodobného důvodu selhání léčby (zejména při suspekci na špatnou adherenci k léčbě). Neléčení pacienti by měli podstoupit kompletní vyšetření každých 12–24 měsíců, v intervalu dvou let může být provedeno i neinvazivní měření stadia jaterní fibrózy. Pacienti s jaterní cirhózou by měli absolvovat program surveillance HCC, tj. abdominální ultrasonografii každých šest měsíců.
18. Vakcinace proti ostatním virovým infekcím jater
Všichni pacienti s chronickou HCV infekcí by měli být očkováni proti virové hepatitidě A. Séronegativní pacienti (tj. HBsAg a anti-HBs negativní) by měli být očkováni i proti virové hepatitidě B.
19. Literatura
1. European Association for Study of Liver. EASL clinical practice guidelines: management of hepatitis C virus infection. J Hepatol 2014; 60(2): 392–420. doi: 10.1016/j.jhep.2013.11.003.
2. Bacon BR, Gordon SC, Lawitz E et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011; 364(13): 1207–1217. doi: 10.1056/NEJMoa1009482.
3. Jacobson IM, McHutchison JG, Dusheiko G et al. Telaprevir for previously untreat-ed chronic hepatitis C virus infection. N Engl J Med 2011; 364(25): 2405–2416. doi: 10.1056/NEJMoa1012912.
4. Poordad F, McCone J Jr, Bacon BR et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364(13): 1195–1206. doi: 10.1056/NEJMoa1010494.
5. Zeuzem S, Andreone P, Pol S et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011; 364(25): 2417–2428. doi: 10.1056/NEJMoa1013086.
6. Castéra L, Sebastiani G, Le Bail B et al. Prospective comparison of two algorithms combining non-invasive methods for staging liver fibrosis in chronic hepatitis C. J Hepatol 2010; 52(2): 191–198. doi: 10.1016/j.jhep.2009.11.008.
7. Castéra L, Vergniol J, Foucher J et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128(2): 343–350.
8. Lawitz E, Mangia A, Wyles D et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 368(20): 1878–1887. doi: 10.1056//NEJMoa1214853.
9. Jacobson I, Dore GJ, Foster GR et al. Simeprevir (TMC435) with peginterferon//ribavirin for chronic HCV genotype-1 infection in treatment-naive patients: results from QUEST-1, a phase III trial. J Hepatol 2013; 58 (Suppl 1): S574.
10. Manns M, Marcellin P, Poordad F et al. Simeprevir (TMC435) with peginterferon//ribavirin for treatment of chronic HCV genotype-1 infection in treatment-naive patients: results from QUEST-2, a Phase III trial. J Hepatol 2013; 58 (Suppl 1): S568.
11. Poordad F, Manns MP, Marcellin P et al. Simeprevir (TMC435) with peginterferon//ribavirin for treatment of chronic HCV genotype-1 infection in treatment-naive patients: results from QUEST-2, a phase III trial. Gastroenterology 2013; 144: S151.
12. Lawitz E, Forns X, Zeuzem S et al. Simeprevir (TMC435) with peginterferon/ribavirin for treatment of chronic HCV genotype 1 infection in patients who relapsed after previous interferonbased therapy: results from PROMISE, a phase III trial. Gastroenterology 2013; 144: S151.
13. Hezode C, Hirschfield GM, Ghesquiere W et al. Daclatasvir, an NS5A replication complex inhibitor, combined with peginterferon alfa-2a and ribavirin in treatment--naive HCV-genotype 1 or 4 subjects: phase 2b COMMAND-1 SVR12 results. Hepatology 2012; 56 (Suppl 1): 553A–554A.
14. Gane EJ, Stedman CA, Hyland RH et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med 2013; 368(1): 34–44. doi: 10.1056/NEJMoa1208953.
15. Lalezari JP, Nelson DR, Hyland RH et al. Once daily sofosbuvir plus ribavirin for 12 and 24 weeks in treatment-naive pa-tients with HCV infection: the QUANTUM study. J Hepatol 2013; 58 (Suppl 1): S346.
16. Sulkowski MS, Rodriguez-Torres M, Lalezari JP et al. All-oral therapy with sofosbuvir plus ribavirin for the treatment of HCV genotype 1, 2, and 3 infection in patients co-infected with HIV (PHOTON-1). Hepatology 2013; 58 (Suppl 1): 313A–314A.
17. Jacobson I, Ghalib RH, Rodriguez--Torres M et al. SVR results of a once-daily regimen of simeprevir (TMC435) plus sofosbuvir (GS-7977) with or without ribavirin in cirrhotic and non-cirrhotic HCV genotype 1 treatment-naive and prior null responders patients: the COSMOS study. Hepatology 2013; 58 (Suppl 1): 1379A.
18. Sulkowski MS, Gardiner DF, Rodriguez-Torres M et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med 2014; 370(3): 211–221. doi: 10.1056/NEJMoa1306218.
19. Fontana RJ, Hughes EA, Bifano M et al. Sofosbuvir and daclatasvir combination therapy in a liver transplant recipient with severe recurrent cholestatic hepatitis C. Am J Transplant 2013; 13(6): 1601–1605. doi: 10.1111/ajt.12209.
20. Jacobson IM, Gordon SC, Kowdley KV et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med 2013; 368(20): 1867–1877. doi: 10.1056/NEJMoa1214854.
21. Zeuzem S, Dusheiko G, Salupere R et al. Sofosbuvir plus ribavirin for 12 or 24 weeks for patients with HCV genotype 2 or 3: the VALENCE trial. Hepatology 2013; 58 (Suppl 1): 733A.
22. Lawitz E, Poordad F, Brainard DM et al. Sofosbuvir in combination with PegIFN and ribavirin for 12 weeks provides high SVR rates in HCV-infected genotype 2 or 3 treatment-experienced patients with and without compensated cirrhosis: results from the LONESTAR-2 study. Hepatology 2013; 58 (Suppl 1): 1380A.
23. Lawitz E, Lalezari JP, Hassanein T et al. Sofosbuvir in combination with peginterferon alfa-2a and ribavirin for non-cirrhotic, treatment-naive patients with genotypes 1, 2, and 3 hepatitis C infection: a randomised, double-blind, phase 2 trial. Lancet Infect Dis 2013; 13(5): 401–408. doi: 10.1016/S1473-3099(13)70033-1.
24. Strader DB, Wright T, Thomas DL et al. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004; 39(4): 1147–1171.
25. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control and Prevention. MMWR Recomm Rep 1998; 47 (RR-19): 1–39.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 17. 11. 2014
Přijato: 29. 11. 2014
doc. MUDr. Petr Urbánek, CSc.
Oddělení gastroenterologie, hepatologie
a metabolismu, ÚVN – VFN Praha
U Vojenské nemocnice 1200, 169 02 Praha
petr.urbanek@uvn.cz
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Zimní mix...Článek KvízČlánek Správná odpověď na kvízČlánek DR. BARES AWARDČlánek Poděkování recenzentům
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2014 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Zimní mix...
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Kvíz
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
- OVESCO klip jako řešení komplikace ERCP
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Problematika diferenciální diagnostiky autoimunitní formy pankreatitidy a pankreatického adenokarcinomu
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Doporučený postup diagnostiky a léčby chronické hepatitidy B
- Správná odpověď na kvíz
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Zpráva o celorepublikovém mezilaboratorním porovnání vyšetření fekálního kalprotektinu
- Podzimní pracovní den České hepatologické společnosti
- Karlovy Vary gastroenterologické – letos už potřinácté
- DR. BARES AWARD
- International professional competition Dr. Bares Award lived to see the 20th anniversary
- Poděkování recenzentům
- Anketa spokojenosti čtenářů časopisu Gastroenterologie a hepatologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- OVESCO klip jako řešení komplikace ERCP
- Perorálna endoskopická myotómia (POEM) v liečbe achalázie na Slovensku
- Neobvyklý zdroj krvácení do gastrointestinálního traktu
- Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



