-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endoskopická submukózní disekce časného karcinomu žaludku
Endoscopic submucosal dissection of early gastric cancer
We present the treatment of a female patient suffering from early-stage carcinoma of the stomach with the aid of endoscopic submucosal dissection using a FlushKnife device. We will devote particular attention to the technical aspects of the procedure. The case history is supplemented by a video record.
Key words:
early gastric cancer – endoscopic submucosal dissection – endoscopic mucosal resection – video case study
Autoři: O. Urban 1,4; P. Fojtík 1; M. Kliment 1; Přemysl Falt 1
; O. Mikolájek 1; V. Zoundjiekpon 1; M. Hanousek 1; I. Sušilová 2; I. Ferák 3
Působiště autorů: Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava 1; Gastroenterologická ambulance, Karviná 2; Oddělení patologie, Nemocnice v Novém Jičíně 3; Lékařská fakulta Ostravské univerzity, Ostrava 4
Vyšlo v časopise: Gastroent Hepatol 2012; 66(1): 54-56
Kategorie: Digestivní endoskopie: videokazuistika
Souhrn
Souhrn:
Prezentujeme léčbu nemocné s časným karcinomem žaludku metodou endoskopická submukózní disekce pomocí nástroje FlushKnife. Pozornost věnujeme především technickým aspektům výkonu. Kazuistické sdělení je doplněno videozáznamem.Klíčová slova:
časný karcinom žaludku – endoskopická submukózní disekce – endoskopická slizniční resekce – videokazuistikaČasný karcinom žaludku (Early Gastric Cancer, EGC) neinvaduje do lamina muscularis propria. EGC lze léčit chirurgicky nebo v některých případech endoskopicky. Chirurgická léčba je zlatým standardem. Endoskopické metody léčby jsou endoskopická mukózní resekce (Endoscopic Mucosal Resection, EMR) a endoskopická submukózní disekce (Endoscopic Submucosal Dissection, ESD). Dlouhodobé výsledky japonských endoskopistů jsou z onkologického aspektu srovnatelné s chirurgickými. Endoskopický přístup je limitován nemožností disekovat lymfatické uzliny. Z tohoto důvodu lze endoskopicky léčit pouze neoplazie se zanedbatelně nízkým rizikem lymfatické diseminace. V naší zemi nejsou endoskopické možnosti léčby EGC optimálně využívány. Jednou z příčin může být nedůvěra v technickou proveditelnost metody.
Kazuistika
V listopadu 2011 byla na endoskopické pracoviště Centra péče o zažívací trakt Vítkovické nemocnice a. s., v Ostravě odeslána ke konzultaci 76letá nemocná s nálezem maligního polypu žaludku.
Pacientku vyšetřujeme standardním high-resolution endoskopem (Olympus GIF-H180, Hamburg, Germany). V aborální třetině žaludečního těla na velkém zakřivení nacházíme povrchovou neoplastickou lézi typu 0-IIc + Is o průměru 20 mm (obr. 1). Okraj léze definujeme chromodiagnostikou pomocí 0,2% roztoku indigokarminu.
Obr. 1. Povrchová neoplastická léze typu 0-IIc + Is v žaludku. Fig. 1. Type 0-IIc + Is superficial neoplastic lesion in the stomach. 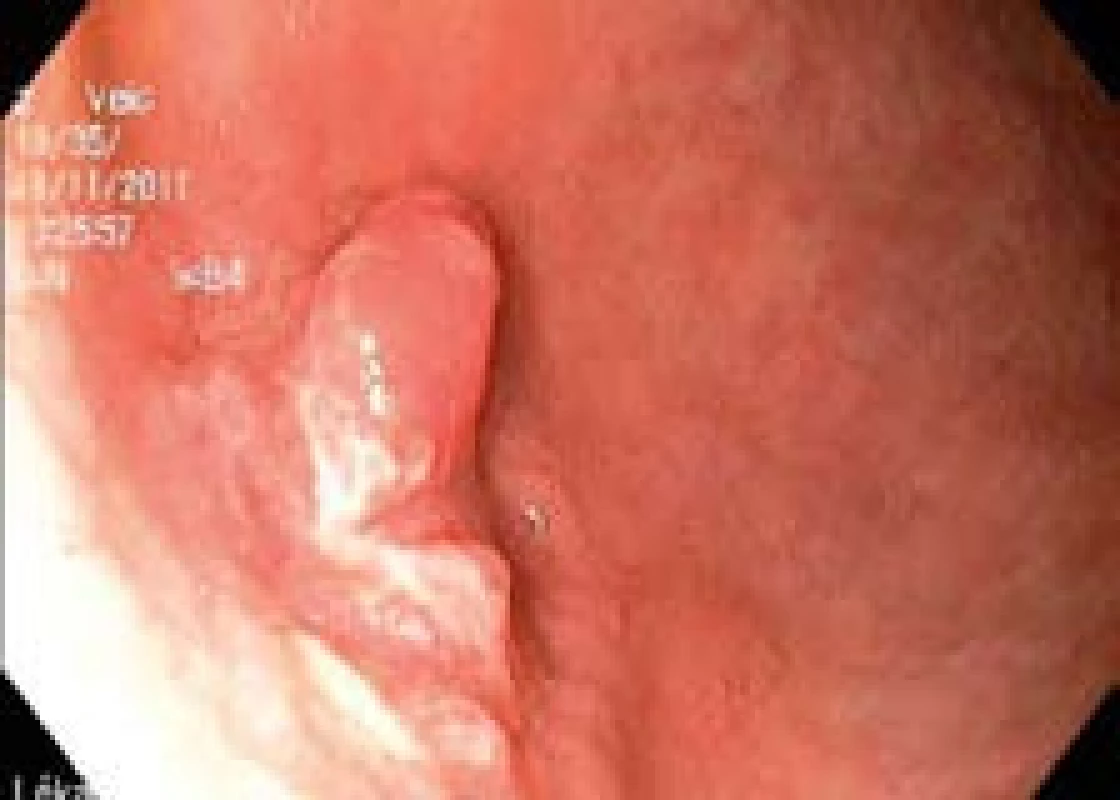
Následuje vyšetření pomocí radiální endosonografie (Olympus GF-UE160, Hamburg, Germany), které vylučuje přítomnost hluboké submukózní invaze a zvětšených spádových lymfatických uzlin (obr. 2).
Obr. 2. Radiální endosonografie. Stejná léze jako na obr. 1. Fig. 2. Radial endosonography. Same lesion as in Fig. 1. 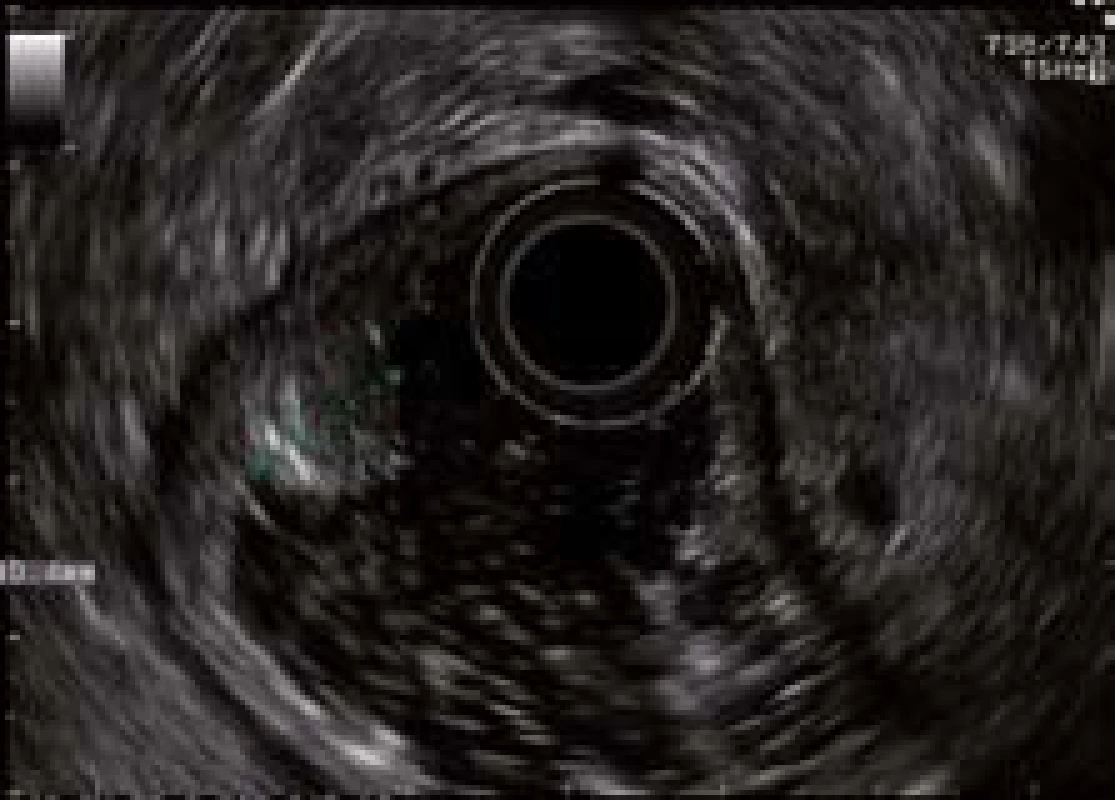
Po konzultaci možností léčby s nemocnou a získání informovaného souhlasu přistupujeme k ESD. Pacientku ošetřujeme v obvyklé poloze vleže na levém boku. K analgosedaci aplikujeme frakcionovaně midazolam a k omezení peristaltiky buscolyzin. V průběhu výkonu dodržujeme zásady bezpečné digestivní endoskopie. K insuflaci používáme oxid uhličitý.
Na distální konec endoskopu fixujeme lepicí páskou průhledný cylindrický nástavec délky 4 mm s bočním sacím otvorem (disposable distal attachment, Olympus, katalogové číslo D-201-11804). Výkon provádíme pomocí nástroje FlushKnife (FK) (FlushKnife, Diatermic Slitter, Fujifilm, katalogové číslo DK 2618J) délky 2 mm, který zavádíme pracovním kanálem endoskopu (obr. 3). Tento nástroj kombinuje vlastnosti diatermického nože a oplachové kanyly a je k dispozici v délkách 0,5 mm, 1 mm, 1,5 mm, 2 mm a 2,5 mm a v modifikaci s ostrým a tupým (balled-tip) zakončením.
Obr. 3. Detail nástroje FlushKnife. Fig. 3. Detail of FlushKnife device. 
ESD zahajujeme označením léze koagulačními značkami pomocí FK na zdravé sliznici ve vzdálenosti 2 mm od okraje. Poté injektorem délky 5 mm aplikujeme do submukózy ve vzdálenosti 7 mm od okraje z několika vpichů celkem 20 ml roztoku Voluven s příměsí adrenalinu 40 000 : 1. Pro zlepšení orientace v průběhu výkonu je roztok zbarven metylénovou modří. Pokračujeme incizí sliznice a submukózy, kterou vedeme po obvodu léze vně koagulačních značek. Nastavení elektrochirurgické jednotky (ERBE ICC 200) je „Endocut“, 85 W, effect 3. Kontrolujeme hloubku řezu tak, aby nepřesahoval za modře zbarvenou submukózu do tmavě červené lamina muscularis propria. Krvácení ze submukózních cév ihned lokalizujeme oplachem a ošetřujeme pomocí FK koagulačním proudem. Následuje submukózní disekce, nejobtížnější fáze výkonu. Do submukózy pod lézi aplikujeme několika vpichy roztok Voluven v celkovém množství 10 ml. Po dosažení kompletní elevace (liftingu) neoplazie přerušujeme submukózu pod lézí v úrovni střední třetiny. Nastavení elektrochirurgické jednotky je „forced coagulation“, 35 W. Snažíme se o tangenciální pozici FK. Ke stabilizaci distálního konce endoskopu využíváme průhledného nástavce (capu). Operační pole oplachujeme pomocí FK, kterým také ošetřujeme drobná krvácení. Krvácení z cév většího kalibru zastavujeme kleštěmi pro horkou biopsii (hot biopsy forceps, Olympus, katalogové číslo FD-1U-1). Pravidelným odsáváním tekutého žaludečního obsahu předcházíme aspiraci. Po dokončení disekce submukózy protínáme ponechaný slizniční můstek polypektomickou kličkou a resekát vybavujeme. Po znovuzavedení endoskopu prohlížíme spodinu po ESD a vylučujeme mikroperforaci. Krvácení z větší submukózní cévy zastavujeme pomocí hemoklipů (EZCLIP, OLYMPUS, katalogové číslo HX-610-135) (obr. 4). Terapeutickou fázi výkonu ukončujeme po 61 minutách připíchnutím resekátu na korkovou podložku a fixací v 10% roztoku formalínu.
Obr. 4. Spodina po ESD. Krvácení ošetřeno klipy. Fig. 4. Undersurface following ESD. Bleeding stemmed through use of clips. 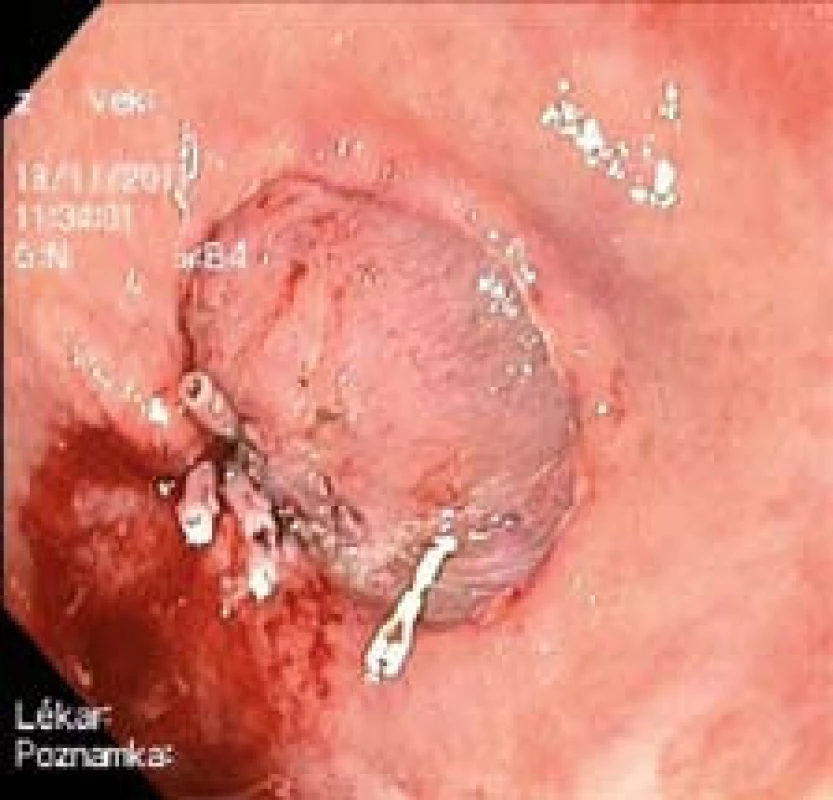
Nemocnou po výkonu sledujeme na gastroenterologickém oddělení po dobu 72 hodin. V den výkonu nepovolujeme perorální příjem. Aplikujeme intravenózně omeprazol v denní dávce 80 mg, krystaloidy a roztok glukózy. První pooperační den povolujeme tekutiny, druhý kašovitou stravu a třetí den propouštíme pacientku do domácího léčení na terapii omeprazol tbl 2 × 20 mg. Plánujeme kontrolní gastroskopii za 8 týdnů.
Histologické vyšetření resekátu prokazuje dobře diferencovaný adenokarcinom s fokální submukózní invazí nepřesahující 500 um, měřeno od lamina muscularis mucoase. Nebyla prokázána invaze do resekčního okraje, krevních a lymfatických cév.
Diskuze
Pokročilý karcinom žaludku má špatnou prognózu. Naději na dlouhodobé přežití významně zvyšuje záchyt onemocnění ve stadiu EGC. Zatímco v Japonsku je v tomto stadiu diagnostikováno více než 50 %, v zemích EU je to pouze 10–15 % případů [1]. Zlepšení diagnostiky přináší nové terapeutické možnosti.
Některé EGC mají zanedbatelně nízké (0–4%) riziko lymfatické diseminace. Endoskopická resekce je v těchto případech racionální alternativou chirurgické léčby.
Riziko lymfatické diseminace lze odhadnout pomocí kritérií publikovaných Gotodou [2]. Na základě vyšetření 5 255 chirurgických resekátů karcinomu žaludku definoval tyto rizikové faktory: velikost neoplazie, morfologický typ, přítomnost ulcerace, hloubka invaze, histologický typ, přítomnost lymfatické a krevní vaskulární invaze. Endoskopická léčba je indikována v případech splňujících každé z následujících kritérií: typ 0–IIa velikosti ≤ 20 mm nebo typ 0–IIc velikosti ≤ 10 mm, diferencovaný adenokarcinom, hloubka submukózní invaze ≤ 500 um a nepřítomnost lymfatické a krevní vaskulární invaze.
S rozvojem metody ESD byla tato tzv. standardní kritéria modifikována. Většina japonských endoskopistů dnes nepovažuje velikost neoplazie za omezující podmínku léčby a objevují se dokonce zprávy o léčbě nediferencovaných karcinomů. Naopak někteří evropští autoři zůstávají konzervativní a doporučují k endoskopické léčbě pouze intramukózní karcinomy velikosti do 20 mm [3].
Podmínkou kurativní léčby EGC je R0 resekce, kdy jsou resekční okraje při histologickém vyšetření prosty nádorové tkáně. R0 resekci lze provést chirurgicky a v některých případech endoskopicky. K histologickému posouzení radikality je vyžadována resekce en bloc. Léze velikosti ≤ 20 mm lze endoskopicky resekovat en bloc metodou EMR, která je ve srovnání s ESD jednodušší a zatížená menším rizikem komplikací. Metoda ESD je využívána pro en bloc resekci neoplazií velikosti > 20 mm. K ESD je používána celá řada nástrojů, které jsou nejčastěji různými modifikacemi diatermického nože.
První zprávu o provedení ESD publikoval Ohkuwa v roce 2001 [4]. První ESD v ČR byla provedena naší skupinou v roce 2006 [5]. Největší publikované soubory nemocných léčených ESD pocházejí z Japonska. Například Oda léčil celkem 303 nemocných [5]. Dosáhl en bloc resekce u 92,7 % a kurativní resekce u 73,6 % nemocných. Následující tři roky bez recidivy karcinomu přežilo 97,6 % pacientů. Mortalita ESD byla 0 % a perforace komplikovala výkon ve 3,6 % [6]. Naše výsledky léčby nelze s výsledky japonských autorů smysluplně srovnávat. Dosud největší publikovaný soubor 22 endoskopicky léčených časných karcinomů žaludku v naší zemi zahrnuje šest nemocných léčených metodou ESD [7]. Podobně nedávno publikované evropské zkušenosti ukazují, že metoda ESD v tomto geografickém prostrou ještě nezdomácněla [8]. Autoři citované práce označují ESD za metodu „ve vývoji“.
Z tohoto a dalších důvodů považujeme za důležité o možnostech endoskopické léčby diskutovat napříč obory, které se na léčbě pacientů s rakovinou žaludku podílí. Jedná se především o gastroenterologii, chirurgii, onkologii, patologii a radiologii. Názorový průnik lékařů těchto odborností je pro volbu správné léčebné modality pro konkrétního nemocného nezbytný.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 10. 1. 2012
Přijato/Accepted: 8. 2. 2012
MUDr. Ondřej Urban, Ph.D.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s., Ostrava
Zalužanského 1192/15
703 84 Ostrava-Vítkovice
ondrej.urban@nemvitkovice.cz
Zdroje
1. Inoue M, Tsugane S. Epidemiology of gastric cancer in Japan. Postgraduate Med J 2005; 81(957): 419–424.
2. Gotoda T, Yanagisawa A, Sasako M. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large center. Gastric Cancer 2000; 3(4): 219–225.
3. Hölscher AH, Drebber U, Mönig SP et al. Early gastric cancer: lymph node metastasis starts with deep mucosal infiltration. Ann Surg 2009; 250(5): 791–797.
4. Ohkuwa M, Hosokawa K, Boku N et al. New endoscopic treatment for intramucosal gastric tumors using an insulated-tip diathermic knife. Endoscopy 2001; 33(3): 221–226.
5. Urban O, Vítek P, Fojtík P et al. Endoscopic submucosal dissection: Initial experience in the Czech Republice. Folia Gastroenterol Hepatol 2006; 4(1): 4–10.
6. Oda I, Saito D, Tada M et al. A multicenter retrospective study of endoscopic resection for early gastric cancer. Gastric Cancer 2006; 9(4): 262–270.
7. Urban O, Fojtík P, Kliment M et al. Endoskopická léčba časného karcinomu žaludku: Vlastní výsledky v období let 2000–2009. Endoskopie 2009; 18(4): 156–161.
8. Farhat S, Chaussade S, Ponchon T et al. Endoscopic submucosal dissection in a European setting. A multi-institutional report of a technique in development. Endoscopy 2011; 43(8): 664–670.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Gastrokolická fistulaČlánek Novinky ze světa IBDČlánek Ohlédnutí za Václavem HavlemČlánek Správná odpověď na kvízČlánek Obzretie sa za Gastrofórom
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2012 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
-
Kvíz – případ z klinické praxe
Selhání biologické léčby u nemocného s ulcerózní kolitidou - Slovo k novým předplatitelům časopisu – členům České hepatologické společnosti ČLS JEP
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases: 2nd edition
- Nízká aktivita sérové deoxyribonukleázy-I je u nemocných s idiopatickými střevními záněty spojena se vznikem kožních nežádoucích účinků při antiTNF-alfa léčbě
- Sérové hladiny infliximabu a protilátok proti infliximabu, prínos pre prax
- Význam vitamínu D pri nešpecifických črevných zápalových ochoreniach
- Matrixové metaloproteinázy a jejich tkáňové inhibitory v korelaci s proliferativními a klasickými nádorovými markery během chirurgické léčby jaterních metastáz
- Gastrokolická fistula
- Endoskopická submukózní disekce časného karcinomu žaludku
- Příprava střeva ke kolonoskopii
- Ohlédnutí za Václavem Havlem
- Co udělal Václav Havel pro nás a co my můžeme udělat pro jeho odkaz?
-
Jak důležitá je multidisciplinární péče o pacienty s kolorektálním karcinomem?
Zpráva z 1. národního kongresu o kolorektálním karcinomu/1. postgraduálního kurzu SGO - Správná odpověď na kvíz
- Nové standardy v léčbě Crohnovy nemoci
- Journal at the beginning of 66th annual volume: the current state and perspectives
- Obzretie sa za Gastrofórom
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Novinky ze světa IBD
-
Kvíz – případ z klinické praxe
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Příprava střeva ke kolonoskopii
- Gastrokolická fistula
- Sérové hladiny infliximabu a protilátok proti infliximabu, prínos pre prax
- Význam vitamínu D pri nešpecifických črevných zápalových ochoreniach
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



