-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Blokáda interleukinu-1 v léčbĕ systémové juvenilní idiopatické artritidy a Stillovy nemoci se začátkem v dospĕlosti
. IL-1 inhibition in the treatment of systemic juvenile arthritis and adult-onset Still's disease
Polygenic autoinflammatory diseases (AIDs) typically include systemic juvenile idiopathic arthritis (sJIA) and adult-onset Still’s disease (AOSD). These diseases are characterized by the dysregulation of the innate immune responses with an excessive and uncontrolled overproduction of IL-1β in particular. Administration of the IL-1 blockers leads to a rapid improvement of the clinical symptoms, disease activity reduction, normalization of the laboratory parameters, and the possibility of reducing or even discontinuing glucocorticoid use. Most of the current data are focused on the therapeutic use of anakinra – an IL-1 receptor antagonist, canakinumab – an anti-IL-1β monoclonal antibody, and rilonacept – a soluble decoy receptor. However, other promising agents, such as gevokizumab – IL-1β blocking monoclonal antibody, tadekinig alfa – a human recombinant IL-18-binding protein, and tranilast – an analog of a tryptophan metabolite, are currently being tested. In this review article, the authors focus on the role of IL-1 and related cytokines in the regulation of the inflammatory responses in AIDs and provide a detailed review of clinical trials with IL-1 blockade in sJIA and AOSD, focusing on the efficacy and safety data.
Keywords:
canakinumab – anakinra – rilonacept – adult onset Still's disease (AOSD) – autoinflammatory diseases – interleukin-1 (IL-1) – systemic juvenile idiopathic arthritis (sJIA)
Autoři: H. Malcová 1; T. Milota 1,2; Z. Střížová 2; D. Cebecauerová 1; R. Horváth 1,2
Působiště autorů: Oddělení revmatologie dětí a dospělých 2. LF UK a FN Motol, Praha 1; Ústav imunologie 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes. Revmatol., 29, 2021, No. 4, p. 209-227.
Kategorie: Přehledový článek
Souhrn
Mezi polygenně podmíněná autoinflamatorní onemocnění (AID) se typicky řadí systémová juvenilní artritida (sJIA) a Stillova nemoc se začátkem v dospělosti (AOSD). Charakteristickým rysem těchto chorob je dysregulace vrozené imunitní odpovědi s excesivní a nekontrolovanou nadprodukcí především IL-1β. Právě specifická inhibice tohoto cytokinu se ukázala jako vysoce efektivní léčebná modalita, která vede k rychlé kontrole zánětlivých symptomů, snížení aktivity onemocnění, normalizaci laboratorních parametrů a k možnosti redukovat až vysadit glukokortikoidy. V klinické praxi se používají především dva blokátory IL-1, antagonista receptoru pro IL-1 – anakinra a monoklonální protilátka anti-IL-1β – canakinumab. Ve Spojených státech amerických je navíc registrován solubilní receptor IL-1 – rilonacept. Kromě zmíněných existují i další slibné molekuly – gevokizumab (monoklonální protilátka blokující IL-1β), tadekinig alfa (rekombinantní protein vázající IL-18) a tranilast (analog metabolismu tryptofanu), které jsou ve fázi klinických zkoušek. Autoři se v tomto přehledovém článku zaměřili na úlohu IL-1 a příbuzných cytokinů v regulaci zánětlivé odpovědi u polygenních AID a přinášejí podrobný přehled klinických studií s blokádou IL-1 v indikacích sJIA a AOSD se zaměřením na efektivitu a bezpečnost podávaných preparátů.
Klíčová slova:
anakinra – rilonacept – autoinflamatorní onemocnění (AID) – canakinumab, interleukin-1 (IL-1) – systémová juvenilní idiopatická artritida (sJIA) – Stillova choroba se začátkem v dospělosti (AOSD)
ÚVOD
Autoinhamatorní onemocnění (AID) jsou heterogenní skupinou chorob, do které patří monogenně i polygenně podmíněné jednotky. Klinicky jsou charakterizované rekurentním nebo chronicky probíhajícím systémovým zánětem způsobeným dysregulací vrozené imunitní odpovědi s nadměrnou expresí genů spojených s funkcí inhamasomu. Mezi typické polygenní AID řadíme systémovou juvenilní idiopatickou artritidu (sJIA) a Stillovu nemoc se začátkem v dospělosti (AOSD), nicméně zásadní úloha IL-1 a příbuzných cytokinů byla také prokázána u Behçetovy choroby (BD), Kawasakiho nemoci (KD), idiopatických rekurentních perikarditid (IRP) a také krystalických artropatií (1–3). Klinické projevy polygenních AID jsou v mnohém podobné monogenním, včetně symptomů v podobě rekurentních horeček, zánětlivých změn kůže, muskuloskeletálních projevů a serositid. Pacienti jsou také v riziku rozvoje život ohrožujících komplikací, jako je například syndrom aktivovaných makrofágů (MAS) nebo sekundární amyloidóza orgánů (4, 5). Společným imunologickým rysem AID je nadměrná aktivace inhamasomu s nadprodukcí cytokinů z rodiny interleukinu (IL)-1. Role těchto cytokinů je diskutována také v patogenezi mnoha dalších, zdánlivě nesouvisejících onemocnění, jako jsou například ateroskleróza, srdeční selhání, kardiomyopatie nebo diabetes mellitus typu 2 (6–8).
Cytokiny z rodiny IL-1 hrají zásadní roli ve fungování imunitního systému a iniciaci systémové zánětlivé odpovědi. V současné době je popsaných jedenáct strukturálně a funkčně odlišných molekul patřících do této skupiny. Většina z nich je produkována ve formě inaktivních prekurzorů, které se intracelulárně aktivují procesem štěpení. Ten je zprostředkován především kaspázami – 1, 3 a 7 (9–11), ale také dalšími proteázami, jako je calpain, elastáza nebo chymáza, produkovanými buňkami vrozené imunity (12). Samotné kaspázy jsou aktivovány různými podněty a vedou buď k indukci imunitní odpovědi (kaspáza 1), nebo k apoptóze buněk (kaspáza 3 a 7) (obr. 1). Alernativním scénářem je iniciace zánětlivé odpovědi již aktivovanými a intracelulárně skladovanými cytokiny (IL-1a -1a IL-33), které se uvolňují z poškozených buněk, a plní tedy funkci alarminů. IL-1a může za určitých okolností sloužit také jako membránově vázaný cytokin, který je exprimován na epiteliálních a endotelových buňkách, a přispívá tak k indukci a amplifikaci lokální zánětlivé reakce (13). Aktivní formy cytokinů z rodiny IL-1 se následně vážou na svůj specifický receptor a slouží buď jako agonisté s indukcí (IL-1a, IL-1β, IL-18, IL-33, IL-36a, IL-36β, IL-36y), nebo antagonisté s potlačením zánětlivé odpovědi (IL-1Ra, IL-36Ra, IL-38) (14, 15) (obr. 2). Na molekulární úrovni vazba prozánětlivých cytokinů spustí signalizační kaskádu s aktivací transkripčního faktoru nuclear faktor kappa B (NF-«B) a s produkcí prozánětlivých cytokinů (IL-1, IL-2, IL-6, IL-8, IL-12 atd.) a chemokinů (CCL2, CCL5, CXCL2, CXCL1, CXCL8, CXCL10). Funkce NF-«B je také spojena s expresí regulátorů buněčného cyklu (cyklinů), pro-apoptotickými proteiny (Bcl-2, IAP) a adhezními molekulami (ICAM-1, VCAM-1) (16). Společně s NF-«B je významným regulátorem buněčné proliferace, diferenciace a transformace také transkripční faktor AP-1 (17, 18) (obr. 3). Některé cytokiny jako např. IL-1a a IL-33 mají svou vlastní transkripční aktivitu, a jsou tedy přímo schopné vstoupit do buněčného jádra a vázat se na DNA (19). Proces aktivace imunitní odpovědi IL-1 a příbuznými cytokiny je potenciálně nebezpečný, mohl by vést až k život ohrožující reakci, a proto je každý krok aktivace přísně kontrolován celou řadou negativních regulačních mechanismů. Patří sem membránové receptory, které postrádají intracelulární TIR doménu a inhibují interakce cytokin-receptor (IL1-R2), antagonisté receptoru IL-1RA, IL-36RA, IL-38), solubilní receptory (IL1-R2, ST2, receptorové komplexy ST2/IL-1RAcP nebo IL1-R2/IL-1RAcP bez vazby na IL-1a a IL-1 p, IL-33) nebo vazebné proteiny (IL-18BP). Mezi další inhibiční molekuly se řadí atypický receptor TIR8. Přímý protizánětlivý účinek má také IL-37 prostřednictvím kontroly exprese transformujícího růstového faktoru β (TGFβ) (viz obr. 2).
Obr. 1. Schéma aktivace kaspázy 1, 3 a 7 inflamazomem a apoptozomem: 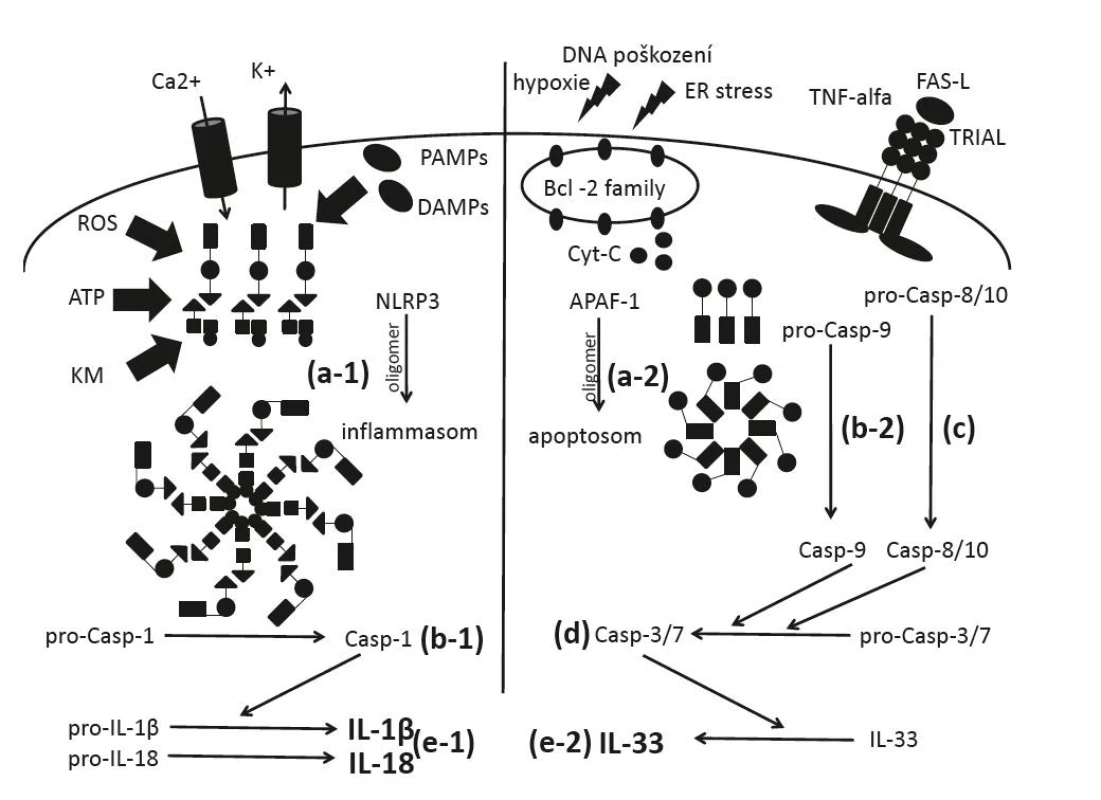
(a-1) iniciace oligomerizace molekul NLRP3 (iniciace DAMPs, PAMPs, ROS, KM, eflux K+, influx Ca2+), (a-2) iniciace oligomerizace APAF-1 (po aktivaci vnitřní cesty apoptózy poškozením DNA, hypoxií, stresem ER), (b-1) štĕpení N-terminálního konce pro-kaspázy 1 (inaktivní forma) molekulárním komplexem inflamazomu, (b-2) štĕpení pro-kaspázy 9 apoptozomem, (c) aktivace kaspázy 8 a 10 vnĕjší cestou apoptózy (zprostředkovaná např. TNF, TRIAL, FAS), (d) aktivace efektorových kaspáz 3 a 7, (e-1) aktivace IL-1β z prekurzoru pro-IL1β (inaktivní forma) a IL-18 z prekurzoru pro-IL18 působením kaspázy 1, (e-2) aktivace zralé formy IL-33 působením kaspáz 3 a 7
NLRP3 – nucleotide-binding oligomerization domain, leucine rich repeat and pyrin domain containing, DAMPs – damage-associa- ted molecular patterns, PAMPs – pathogen-associated molecular patterns, ROS – reactive oxygen species, KM – kyselina močová, APAF-1 – apoptotic protease activating factor-1, ER – endoplasmatické retikulum, TNF – tumor necrosis factor, TRIAL – TNF-related apoptosis-inducing ligandObr. 2. Schéma struktury receptorů IL-1 rodiny a mechanismy regulace: 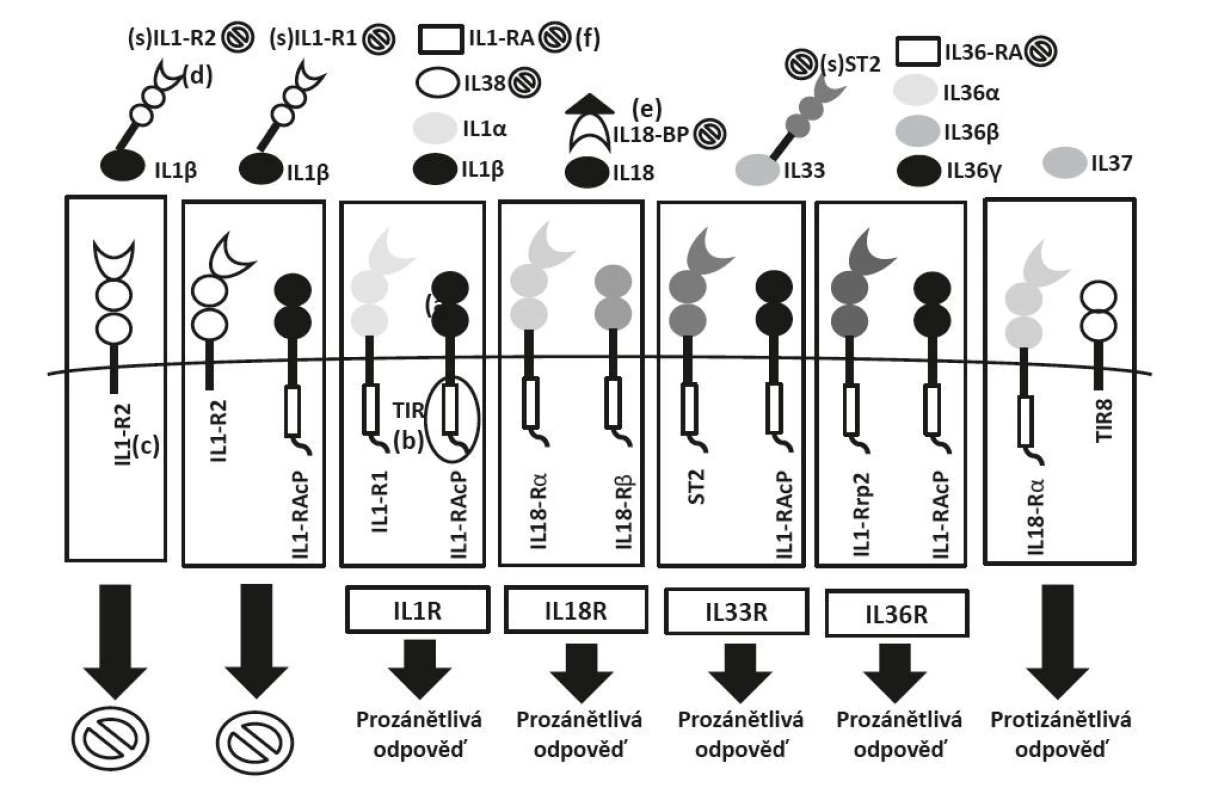
(a) membránové receptory mají strukturu binárních komplexů- primární (IL1-R1, IL18-Ra, ST2, IL1-Rrp2) a akcesorní receptor (IL1-RAcP, IL18-Rβ), (b) pro přenos signálu je nezbytná přítomnost TIR domény u obou receptorů, (c) receptory bez TIR domény (IL1-R2) mají regulační úlohu – vážou volné cytokiny bez přenosu signálu do buňky a tím inhibují jejich funkci, (d) obdobnou regulační funkci mají také solubilní receptory (IL1-R1, IL1-R2, ST2) a (e) vázající proteiny (IL18-BP), (f) inhibiční funkci mají i antagonisté receptorů (IL-1Ra, IL-36Ra, IL-38) Obr. 3. Schéma signalizace receptorů IL-1 rodiny: 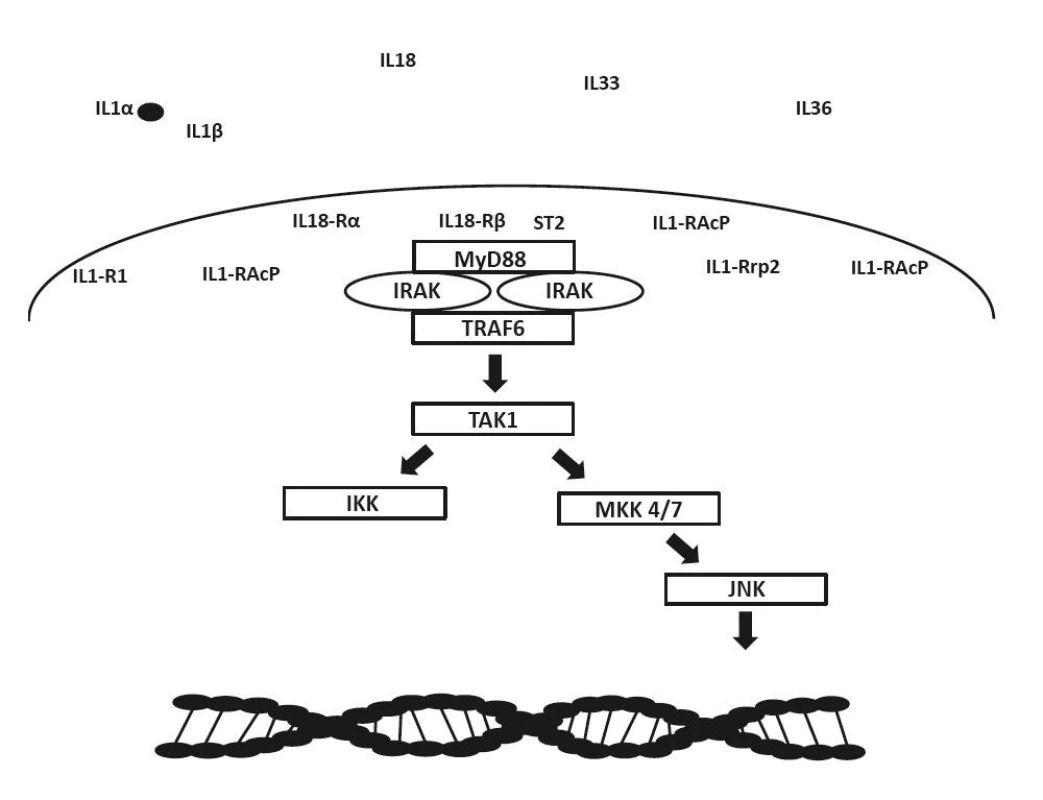
(a) po navázání cytokinu na odpovídající primární receptor dochází ke strukturálním zmĕnám zahrnujícím rekrutování akcesorního receptoru, který je nezbytný pro přenos signálu do buňky, (b) aktivace kinázy IRAK přes adaptorový protein MyD88, (c) aktivace TRAF6 s ubikvitin-ligázovou aktivitou, (d) ubikvitin mediované aktivaci TAK1, (e-1) aktivace NFkB přes IKK (fosforylací IkB dochází k uvolnĕní transkripčního faktoru NFkB a jeho vstupu do bunĕčného jádra) a (e-2) transkripčního faktoru AP-1 cestou MAP kináz (MKK 4 a 7) a JNK TIR – Toll/interleukin-1 receptor domain, MyD88 – Myeloid differentiation primary response 88, IRAK – interleukin-1 receptor asso- ciated kinase, TRAF9 – TNF receptor associated factor 6, TAK1 – transforming growth factor beta-activated kinase 1, I«K – I«B kinase, I«B – NF-«B inhibitor, NF-«B – nuclear factor kappa B, MAP – mitogen activated protein kinase, JNK – c-Jun N-terminal kinase, AP1 – activator protein 1 Cytokiny z rodiny IL-1 a jejich receptory jsou exprimovány ve variabilním množství v různých tkáních. Jejich nadměrná exprese tedy může vést k rozvoji lokálního i systémového zánětu (20, 21) (obr. 4). Právě identifikace silného zapojení této rodiny poukázala na velký léčebný potenciál cílené blokády IL-1 a příbuzných cytokinů u AID (22). Navíc signifikantní terapeutický efekt blokády IL-1 jen dále podpořil význam IL-1 v patogenezi zmiňovaných chorob (23, 24). Nejčastěji používané blokátory IL-1 u AID jsou anakinra – rekombinantní antagonista IL-1 receptoru (IL1-RA), canakinumab – humánní monoklonální protilátka blokující interakci mezi IL-1β a receptorem IL-1 a rilonacept – solubilní receptor blokující převážně IL-1β (25, 26). Anakinra a canakinumab jsou schválené pro klinické použití v Evropě, zatímco rilonacept je k dispozici zatím pouze v USA. Dalšími slibnými molekulami z řad inhibitorů IL-1 jsou gevokizumab – monoklonální protilátka neutralizující IL-1β (27), tadekinig alfa – humánní rekombinantní vazebný protein IL-18 (28), tranilast – analog tryptofanového metabolitu (29) nebo dapansutril – přímý selektivní inhibitor NLRP3 inhammasomu (30). V další části tohoto přehledového článku přinášíme detailní přehled klinických studií s blokádou IL-1 v indikacích sJIA a AOSD se zaměřením na efektivitu a bezpečnost léčby (tab. 1).
Obr. 4. Vliv koncentrace IL-1 na charakter zánĕtlivé odpovĕdi − nižší koncentrace vedoucí k lokální zánĕtlivé odpovĕdi a aktivaci mechanismů vrozené a získané imunity; vyšší koncentrace spojené se systémovou zánĕtlivou odpovĕdí (aktivace osy hypothalamus − hypofýza − nadledviny, rozvoj horečky, produkce proteinů akutní fáze, aktivace endotelií produkující chemokiny a exprimující adhezivní molekuly) 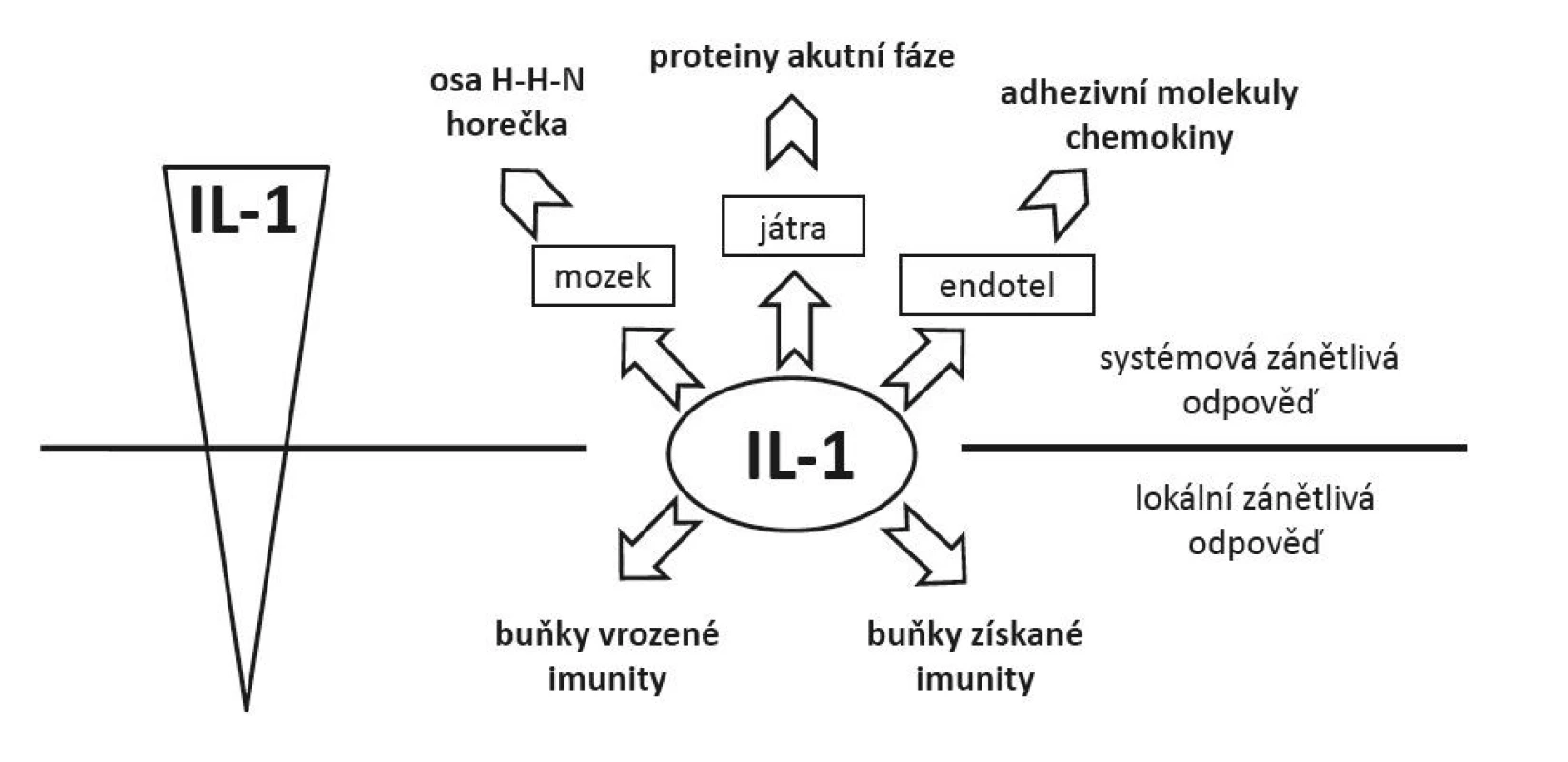
Tab. 1. Seznam klinických studií observačních, otevřených, randomizovaných, placebem kontrolovaných a založených na registru s použitím IL-1 inhibitoru v léčbĕ sJIA a AOSD 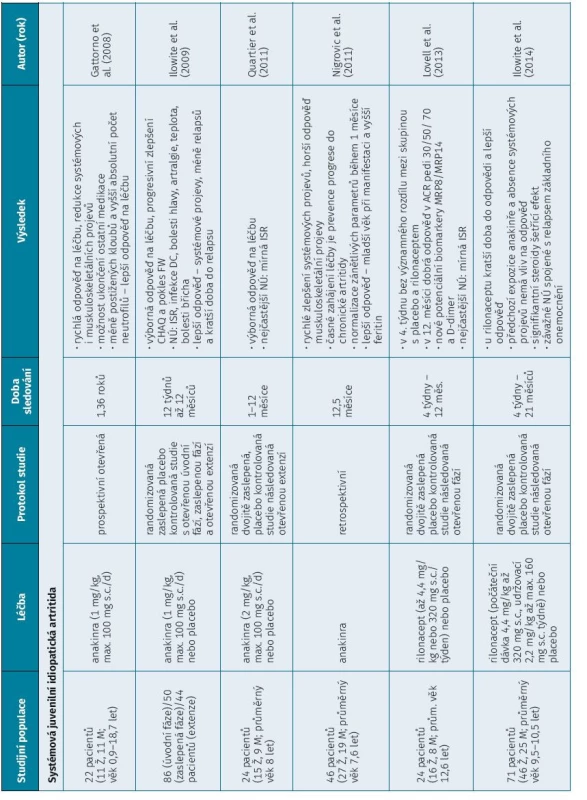
Tab. 2. Tab. 1 pokračování 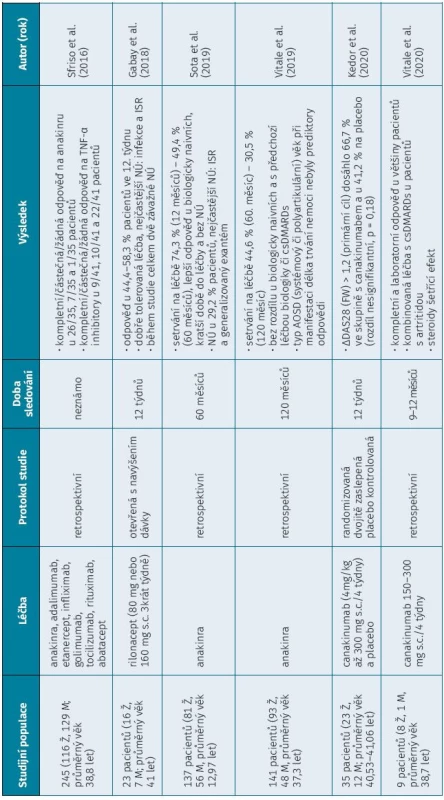
b DMARDs – biologické chorobu modifikující léky, csDMARDs – konvenční syntetické chorobu modifikující léky, DC – dýchací cesty, ISR – reakce v místĕ vpichu, FW – sedimentace, M – muž, mužské pohlaví, Ž – žena, ženské pohlaví METODY
Sestavili jsme komplexní přehled recentní literatury o účinnosti a bezpečnosti léčby inhibitory IL-1. Jako klíčová slova k vyhledávání byla použita hesla anakinra, rilonacept a canakinumab, v kombinaci s názvy sJIA a AOSD. Pro přehled byly použity pouze články psané anglicky, recenzované, publikované v indexovaných mezinárodních časopisech do konce roku 2020. Pro vyhledávání byly použity databáze Medline/PubMed a Web of Science. Autoři se řídili pokyny pro přípravu biomedicínského průzkumu (31).
SYSTÉMOVÁ JUVENILNÍ IDIOPATICKÁ ARTRITIDA
Je řazena jako jeden z podtypů juvenilní idiopatické ar - tritidy, nicméně od ostatních forem JIA se některými rysy významně odlišuje. Je to především autoinhamatorní charakter s typicky časným nástupem v kojeneckém a raném batolecím věku a převahou systémových klinických projevů, jako jsou vysoké horečky, prchavý exantém a serositida (32, 33). Mezi komplikace sJIA patří rozvoj syndromu aktivovaných makrofágů (MAS), který může být život ohrožujícím stavem s rizikem úmrtí. MAS je charakterizován typickými klinickými projevy a laboratorními nálezy, zahrnujícími zejména kontinuální horečku, splenomegalii, hepatopatii, koagulopatii, encefalopatii, pancytopenii a vysoké hladiny feritinu. Nedostatečně kontrolovaná sJIA může vést k rozvoji sekundární amyloidózy jako dalšího významného faktoru vyšší morbidity a mortality (34). V minulosti byla léčba sJIA založena především na dlouhodobém podávání vysokodávkovaných kortikosteroidů a byla spojena s řadou vedlejších účinků devastujících vyvíjející se organismus dětského pacienta. V současné době máme řadu důkazů pro to, že cytokiny IL-1 a IL-6 hrají klíčovou roli v patogenezi sJIA, a proto se biologické léky blokující funkce IL-1 staly jednou z důležitých terapeutických modalit (33). Účinnost inhibitorů IL-1 anakinra, rilonacept a canakinumab u pacientů se sJIA byla hodnocena v několika klinických a observačních studiích.
Blokáda interleukinu-1 při léčbĕ sJIA
Jako první popsal zásadní roli inhibitorů IL-1 u sJIA Pascual et al. (35), který prokázal zvýšenou genovou expresi IL-1 u pacientů se sJIA. Na základě toho bylo devět dětí s aktivním onemocněním rezistentním ke konvenční terapii léčeno anakinrou. Sedm z nich dosáhlo úplné remise a další dva pacienti měli částečnou odpověď s významným zlepšením klinických projevů a laboratorních parametrů. Během prvního týdne terapie došlo ke zlepšení systémových (ústup teploty) stejně jako kloubních příznaků (vymizení aktivní artritidy). Zajímavým faktem bylo, že hladiny cytokinů v séru nekorelovaly s aktivitou onemocnění (35). Podobné výsledky popsal i Gattorno et al. (36), ačkoliv zde byly během prvního týdne terapie pozorovány dva rozdílné vzorce odpovědi na léčbu. První skupina pacientů zaznamenala okamžité zlepšení systémových i kloubních projevů s poklesem zánětlivých parametrů. Ve druhé skupině došlo v úvodu, po zahájení terapie také ke zlepšení, nicméně následně měli pacienti tendenci k relapsu především kloubních projevů. Pacienti v první skupině s úplnou odpovědí na léčbu měli před zahájením terapie menší počet postižených kloubů a vyšší absolutní počet neutrofilů ve srovnání s pacienty ve druhé skupině. Podobně jako ve studii Pascual et al. i zde sekrece IL-1β a IL-18 (spontánní a indukovaná lipopolysacharidem – LPS) in vitro nekorelovala s aktivitou nemoci a nebyla ovlivněna podáváním léčby (36). Poněkud odlišné nálezy popsala prospektivní studie Vastert et al. (37), kde autoři demonstrovali vynikající odpověď téměř u všech pacientů, u nichž byla anakinra podána jako léčba první linie. Do 3 dnů od zahájení terapie došlo u 80 % subjektů k normalizaci teploty a k poklesu zánětlivých parametrů (CRP, sedimentace, feritin). Osmdesát procent pacientů dosáhlo odpovědi ACR Pedi 90 během 30 dnů od zahájení a tato odpověď přetrvala po dobu až 3 let. Přibližně 1/3 léčených vyžadovala k udržení remise podávání souběžné medikace. Tato studie také identifikovala potenciální biomarkery, IL-18 a/nebo S100A12 nebo S100A8/9, které by mohly v budoucnu fungovat jako nástroje pro rozhodování o ukončení léčby (37). Nedostatkem zmíněných hodnocení bylo jejich nezaslepené provedení.
Jedna z prvních randomizovaných dvojitě zaslepených a placebem kontrolovaných studií Ilowite et al. (38) byla primárně zaměřena na bezpečnost. Popsané komplikace spojené s léčbou spočívaly hlavně v reakcích v místě vpichu (injection site reactions – ISR), které se postupně v průběhu času zmírňovaly, a tak autoři potvrdili příznivý bezpečnostní profil anakinry. Většina dokumentovaných nežádoucích účinků byla mírná nebo středně závažná, pouze jedna nežádoucí příhoda byla považována za závažnou. Předběžné výsledky navíc prokázaly, že více než polovina pacientů reagovala na terapii zlepšením (definováno jako zlepšení › 30 % podle kritérií JRA Core Set). Více pacientů s odpovědí na léčbu bylo ve skupině pacientů se systémovými projevy, ve srovnání se skupinou s muskuloskeletálními symptomy (73 % vs. 67 %). Ve skupině léčené anakinrou bylo pozorováno menší procento relapsů, s kratší dobou trvání a progresivním zlepšováním hodnot CHAQu a sedimentace erytrocytů (38). Slibné výsledky této studie byly později potvrzeny Quartierem et al. (39) ve studii ANAJIS. Po 1 měsíci léčby dosáhlo úplné odpovědi (ACR Pedi 30, absence teplot, snížení sedimentace a/nebo CRP) 67 % pacientů léčených anakinrou a pouze jeden pacient dostávající placebo. Vysokou míru účinnosti zaznamenala rovněž skupina pacientů po přechodu z placeba na aktivní medikaci, přičemž 90 % z nich odpovědělo do 2 měsíců. Zajímavé bylo, že po zahájení anakinry byla pozorována zvýšená exprese genů indukovatelných interferonem typu I, která nebyla závislá na klinické odpovědi na léčbu (39).
Další skupinou studií hodnotících efekt anakinry u sJIA byly studie retrospektivní a studie vycházející z pacientských registrů. V retrospektivním hodnocení Nigrovice et al. (40) dosáhlo téměř 60 % pacientů remise po podávání anakinry v monoterapii jako léčby první linie. Většina pacientů odpovídajících na terapii vykazovala rychlé zlepšení systémových projevů – teplot, erytému a normalizaci zánětlivých parametrů již během prvního měsíce léčby, zatímco artritida reagovala pomaleji. Závěry této práce vedly k návrhu časného zahájení léčby anakinrou v rámci tzv. konceptu „okna příležitostí", který může zabránit rozvoji perzistující synovitidy.
Pacienti s úplnou odpovědí na léčbu se lišili od pacientů s odpovědí částečnou, a to zejména mladším věkem při manifestaci onemocnění (průměrný věk 5,2 roku vs. 10,2 roku, p = 0,004) a vyšší hladinou feritinu (3008 ng/ml vs. 1329 ng/ml) (40). Tyto výsledky naznačovaly, že pacienti s větší aktivací monocyto-makrofágového systému lépe reagují na inhibici IL-1. Podobná pozorování popsaly také další skupiny (41–48). Srovnatelné výsledky byly získány i v retrospektivní studii Pardeo et al. (44).
Neméně důležitým aspektem úspěšnosti léčby je doba setrvání na terapii (DRR – drug retention rate). V retrospektivní studii Sota et al. (49) se autoři pokusili identifikovat faktory ovlivňující DRR pro anakinru nebo canakinumab. Kumulativní hodnota DRR se pohybovala od 79,9 % ve 12. měsíci po 53,5 % ve 48. měsíci terapie a zůstala nezměněna až do 60. měsíce. Nebyly zjištěny žádné rozdíly mezi anakinrou a canakinumabem a mezi pacienty léčenými monoterapií nebo kombinací s csDMARDs (konvenčními syntetickými chorobu modifikujícími léky). Významné rozdíly však byly pozorovány mezi skupinou dosud biologicky neléčených ve srovnání s pacienty již dříve exponovanými biologikem. Navíc medián trvání nemoci byl významně delší u pacientů, kteří léčbu IL-1 blokátory přerušili ve srovnání s pacienty pokračujícími v léčbě (5,88 vs. 3,17 let). Doba mezi manifestací a zahájením léčby anti IL-1 byla také výrazně delší u pacientů, kteří později léčbu IL-1 inhibitory ukončili (3,71 vs. 1,18 let), čímž se opět potvrdil koncept „okna příležitosti" a jeho význam v kontextu dlouhodo - bé prognózy pacienta (49).
Multicentrická prospektivní observační studie vycházející z registru CARRA (Childhood Arthritis and Rheumatology Research Alliance) Kimura et al. (50) se pokusila o srovnání různých léčebných strategií u 30 dosud neléčených pacientů s nově diagnostikovanou nemocí. Jednotlivé strategie zahrnovaly samotné glukokortikoidy nebo kombinaci glukokortikoidů s csDMARDs, IL-6 nebo IL-1 inhibitory (anakinra s možným přechodem na canakinumab). Obecně podávání IL-1 inhibitorů vedlo k dosažení klinicky neaktivního onemocnění u 41,7 % pacientů (bez aktivní artritidy, VAS lékař 0, normální sedimentace a/nebo CRP, bez systémových projevů JIA) (50).
Srovnáváním různých terapeutických strategií se zabývala také studie Woerner et al. (51), kde autoři analyzovali data z registru CEMARA (Center des MAladies RAres). Inaktivního stavu (absence systémových příznaků, aktivních kloubů a ranní ztuhlosti, VAS lékaře ≤ 10 mm) dosáhlo 48,1 % pacientů na různých typech biologické léčby bez potřeby změny léku. Remise byla pozorována u 33 z 61 pacientů léčených anti-IL-1, u 2/2 pacientů na léčbě tocilizumabem a u 1/1 pacienta s abataceptem, ale pouze u jednoho z 13 pacientů, kteří dostávali anti-TNF-a jako léčbu v první linii. U 44,2 % pacientů došlo k změně léčby na druhé biologikum, u 23,4 % na třetí lék a u 5,2 % na léčbu čtvrté linie. Nejčastějšími důvody pro změnu terapie byly nedostatečná účinnost (58,9 %), ztráta odpovědi na léčbu (21,4 %) a nežádoucí účinky (12,5 %). Procento pacientů, kteří dosáhli klinicky inaktivního onemocnění, bylo 44,1 % ve skupině s anakinrou, 41,9 % na canakinumabu, 45 % na tocilizumabu a pouze v 5,9 % v rameni s etanerceptem. Léčba inhibitory TNF-a vedla k částečnému zlepšení kloubních obtíží (ACR Pedi 30). Odpověď na léčbu anakinrou se významně lišila u pacientů biologicky naivních a u pacientů již léčených. Setrvání na anakinře jako léku druhé/třetí volby bylo pouze 43 % po 12 měsících léčby, ve srovnání s 63 % na canakinumabu a 82 % na tocilizumabu (51).
Účinnost léčby u pacientů dosud biologicky neléčených byla hodnocena také ve studii založené na jiném pacientském registru (BCRD – Biologics for Children with rheumatic diseases) Kearsley-Fleet et al. (47). Pacienti byli léčeni tocilizumabem (54/76) nebo anakinrou (22/76). Ve 12. měsíci dosáhlo 51 % všech léčených minimální aktivitu onemocnění (celkové hodnocení lékařem < 3,4 cm, celkové hodnocení pacientem < 2,1 cm, aktivních kloubů ≤ 1), 42 % odpověď dle ACR Pedi 90 a 39 % klinicky neaktivního onemocnění (absence aktivních kloubů, systémových projevů a uveitidy, celkové hodnocení lékařem 0 a normální sedimentace). Rozdíly mezi skupinou léčenou tocilizumabem a anakinrou nebyly statisticky významné, nicméně delší setrvání na terapii favorizovalo tocilizumab (89 % vs. 59 %, p = 0,002) (47).
Údaje o účinnosti a bezpečnosti léčby canakinumabem analyzovala studie Feista et al. (22) pomocí integrované analýzy čtyř klinických hodnocení se sJIA (NCT00426218, NCT00886769, NCT00889863 a NCT00891046) v různých věkových skupinách. U všech skupin pacientů bylo dosaženo významného zlepšení v klinických i v laboratorních parametrech během 15 dnů léčby a minimálně 50 % pacientů v každé věkové skupině dosáhlo poklesu teploty a odpovědi dle ACR Pedi 70 (52). Ruperto et al. (53) poté publikoval výsledky navazujícího pětiletého sledování. Na konci tohoto hodnocení dosáhlo nízké aktivity onemocnění dle JADAS 48,6 % pacientů (44,6 % již během prvních 6 měsíců). Výraznější pokles aktivity nemoci byl zjištěn u biologicky naivních pacientů a nebyl pozorován žádný rozdíl mezi pacienty na monoterapii nebo kombinované léčbě s MTX. Klinické zlepšení bylo doprovázeno poklesem CRP a sérových hladin fibrinogenu (53).
Quartier et al. (54) ve své studii řešili otázku, zda snížení dávky, prodloužení intervalu nebo vysazení canakinumabu může mít vliv na dobu trvání klinické remise (absence aktivní artritidy, teplot, exantému, serositidy, splenomegalie, hepatomegalie a generalizované lymfadenopatie; normální hladiny CRP v séru, celkové hodnocení lékařem ≤ 10 mm). Ve 24. týdnu udrželo klinickou remisi 71 % pacientů i na snížené dávce canakinumabu 2 mg/kg každé 4 týdny a 84 % pacientů s prodlouženým intervalem podávání 8 týdnů. Nicméně pouze u 33 % pacientů přetrvalo inaktivní onemocnění i po ukončení léčby canakinumabem (54).
V nedávno zveřejněné studii Brunner et al. (55) byla srovnávaná účinnost léčby canakinumabem u pacientů s teplotou a bez teploty při zahájení léčby. Na začátku hodnocení byli pacienti s teplotou starší a měli vyšší CRP. Ve výsledku nebyl zaznamenán rozdíl v odpovědi na terapii mezi skupinou s teplotou a bez teploty. Klinické remise dosáhlo v 6. měsíci 30,9 % pacientů dle hodnocení JADAS a 41,5 % pacientů dle ACR kritérií. Medián do dosažení remise dle JADAS byl 57 dnů u pacientů s teplotou vs. 58 dnů u pacientů bez teploty. Jako nejspolehlivější prediktor dosažení klinické remise podle JADAS kritérií či ukončení léčby glukokortikoidy bylo dosažení odpovědi ACR 50 v 15. dni sledování. Pokud byl pacient na počátku léčen MTX bez glukokortikoidů, měl vyšší pravděpodobnost dosažení odpovědi podle ACR nikoliv však v dosažení klinické remise dle JADAS skóre (55).
Ačkoliv nejvíce důkazů o účinnosti a bezpečnosti IL-1 inhibitorů v léčbě sJIA je pro anakinru a canakinumab, také rilonacept prokázal svůj potenciál v léčbě tohoto onemocnění. Účinnost a bezpečnost rilonaceptu u sJIA byla hodnocena ve dvou studiích. První, multicentrická, randomizovaná, placebem kontrolovaná studie Lovella et al. (56) zahrnovala pacienty, kteří měli aktivní artritidu a nejméně jeden den systémové příznaky (horečka a/nebo vyrážka). Ve 4. týdnu nebyl zaznamenán rozdíl v ACR Pedi 30, 50 nebo 70 mezi skupinou s placebem a rilonaceptem, nicméně došlo ke snížení zánětlivých parametrů a významné redukci systémových projevů (65 % u rilonaceptu vs. 43 % u placeba). Největší pokles v ACR Pedi 30, 50 a 70 byl pozorován ve 12. měsíci léčby u 23 pacientů, kteří setrvali ve studii, a míra odpovědi byla 91,3 %, 87 %, resp. 82,6 %. Dva pacienti dosáhli úplné remise (56).
Druhou multicentrickou studii s rilonaceptem RAPPORT provedl Ilowite et al. (57). Studie byla zaměřena na pacienty s aktivním kloubním postižením. Výsledky hodnocení prokázaly, že doba do dosažení odpovědi (ACR Pedi 30, absence horečky, snížení kortikosteroidů) byla významně kratší u pacientů léčených rilonaceptem ve srovnání s pacienty na placebu – 4 vs. 8 týdnů. Navíc ve skupině s rilonaceptem byla zaznamenána výrazně vyšší míra odpovědi vs. placebo (57 % vs. 27 %) a také více pacientů na aktivní léčbě dosáhlo ACR 30/50/70 ve 4. týdnu. Ve 12. týdnu dosáhlo odpovědi 77 % pacientů léčených rilonaceptem a 59 % pacientů na placebo. V odpovědi na léčbu nehrála roli předchozí expozice anakinrou či absence systémových projevů (57).
STILLOVA NEMOC SE ZAČÁTKEM V DOSPĚLOSTI (AOSD)
Stillova choroba se začátkem v dospělosti (AOSD) je systémové zánětlivé onemocnění nejasné etiologie rozvíjející se na podkladě dysregulace mechanismů vrozené imunity. Klinicky je charakterizované recidivujícími každodenními horečkami nad 39 ºC, které může doprovázet vyrážka, bolesti svalů a kloubů, lymfadenopatie a hepato-splenomegalie (58). Průběh onemocnění může být monocyklický, polycyklický či chronický s dominujícím kloubním postižením. Mezi nejvýznamnější komplikace patří progredující polyartritida vedoucí až k ankylóze (nejčastěji zápěstí), amyloidóza a život ohrožující MAS. K terapii AOSD patří v první linii NSA a glukokortikoidy. Ve druhé se pak používá zejména MTX, který umožňuje snížení dávek až vysazení systémových glukokortikoidů, a redukuje tak riziko rozvoje závažných komplikací spojených s jejich užíváním. I přesto, že terapie léky první a druhé linie je velmi efektivní, nevede k dosažení remise nebo nízké aktivity onemocnění u všech pacientů. Tyto pacienty můžeme rozdělit do dvou skupin – AOSD s převažujícími systémovými rysy, nebo s dominantním kloubním postižením. V těchto případech je pak indikovaná biologická léčba, která je cílena na klíčové cytokiny z rodiny IL-1 podílející se na patogenezi nemoci – IL-1, I-L6 a IL-18 (4, 52).
Blokáda interleukinu-1 při léčbĕ AOSD
Jednu z prvních studií zaměřených na ověření efektivity anakinry v léčbě AOSD publikovala skupina Lequerre et al. (41). Autoři popsali promptní zlepšení klinických a laboratorních parametrů u více než 70 % pacientů. Součástí studie byli i pacienti se sJIA. Ve 3. měsíci léčby dosáhlo 60 % pacientů úplné odpovědi (definováno jako zlepšení ACR Pedi skóre o 50 % nebo více), která přetrvala až do konce sledování (41). Ještě lepší výsledky přinesla případová studie autorů Laskari et al. (59). Kompletní odpovědi, tj. vymizení všech příznaků souvisejících s onemocněním, vyjma kloubních erozí, dosáhlo na konci sledování 80 % pacientů. Léčba však neměla efekt na proteinurii u pacientů s podezřením na amyloidózu ledvin (59). Příznivé nálezy byly potvrzeny i v dalších retrospektivních hodnoceních (60, 61).
Na druhou stranu Ortiz-Sanjuan et al. (62) popsali vcelku limitovaný efekt anakinry na kloubní symptomy. Zatímco se frekvence kožních projevů po jednom roce terapie snížila z 58,5 % na 7,5 %, teplota ze 78 % na 14,6 % a lymfadenopatie z 26,8 % na 4,9 %, frekvence artritidy klesla z 87,8 % pouze na 41,5 %. Lepší odpověď v kloubní doméně byla popsána u pacientů, kteří současně užíva-li MTX (62). Podobné výsledky na ovlivnění kloubní domény přinesla také retrospektivní studie Cavalliho et al. (63). V tomto hodnocení byla biologická léčba zahájena po selhání glukokortikoidů nebo csDMARDs. Anakinra vedla k úplné odpovědi v případě systémových projevů u 92 % pacientů (normalizace CRP a FW, redukce dávek kortikosteroidů nejméně o 50 % po dobu minimálně 2 měsíců), ale jen u 37 % pacientů s chronickými kloubními příznaky. Částečné remise dosáhlo 25 % pacientů s chronickou artritidou a 25 % nereagovalo na léčbu vůbec. Tito nemocní pak měli zlepšení artikulárních projevů po zahájení léčby tocilizumabem ve druhé linii. Autoři studie také dospěli k závěru, že blokátory TNF-a nepředstavují u AOSD dostatečně efektivní alternativu (63). Insuficientní efekt anti-TNF-α léčby byl později potvrzen i v retrospektivní studii zahrnující velkou kohortu AOSD od autorů Sfriso et al. (64). Ve skupině s anakinrou dosáhlo úplné odpovědi 74 %, částečnou odpověď pak mělo 20 % léčených a žádná odpověď byla u 2 % pacientů. To bylo v kontrastu se skupinou pacientů léčenou TNF-a inhibitory, kde kompletní odpovědi dosáhlo 22 % pacientů, částečnou bylo možné zaznamenat u 24 % pacientů, ale až u 54 % léčených nebyl reportován vůbec žádný efekt (64). Zajímavé pozorování ve vztahu k IL-1 blokádě popsala skupina Dall'Ara et al. (65). Autoři identifikovali přítomnost perikarditidy jako významný prediktor potřeby bDMARDs u AOSD (OR = 3,62, 95% CI = 1,22–10,7, p = 0,028) (65).
Jedna z prvních randomizovaných studií zaměřených na efektivitu anakinry u pacientů s refrakterní AOSD byla provedena skupinou Nordströma et al. (66). Autoři popsali příznivý účinek u pacientů s obtížně léčitelnou formou nemoci ve srovnání s csDMARDs. Efekt léčby byl hodnocen ve 4., 8. a 24. týdnu. Kompletní remise ve 4. týdnu (normalizace teploty, CRP, feritinu, absence užívání NSA, absence artritidy) bylo dosaženo u 50 % pacientů na anakinře vs. 30 % pacientů na csDMARDs, u 58 % vs. 50 % v 8. týdnu a 50 % vs. 20 % v 24. týdnu léčby. K normalizaci hodnot CRP došlo v 8. týdnu bez signifikance u obou skupin (66). Tato zjištění by měla být konfirmována randomizovanou, dvojitě zaslepenou a placebem kontrolovanou studií, která v současné době stále probíhá (NCT03265132). Předběžné výsledky se zdají být velmi slibné, studii dokončili všichni zahrnutí pacienti a nebyl hlášen ani jeden případ selhání léčby nebo nežádoucí účinek terapie (67). Ačkoliv definitivní výsledky zatím nejsou k dispozici, podávání anakinry pacientům s AODS již bylo schváleno Evropskou agenturou pro léčivé přípravky (EMA) v roce 2018.
Pozitivní výsledky ve vztahu k perzistenci na léčbě anakinrou byly popsané ve studii Sota et al. (68). Kumulativní hodnota DRR se pohybovala od 74,3 % ve 12. po 49,4 % ve 48. měsíci léčby. Autoři nepozorovali statisticky významné rozdíly mezi skupinami AOSD a sJIA. Také nebyly rozdíly v monoterapii nebo v kombinaci anakinry s csDMARD. Na druhou stranu byla perzistence na terapii významně nižší u pacientů již dříve léčených jinými biologiky a byla negativně ovlivněna zpožděním terapie (4 roky u pacientů s ukončením léčby vs. 0,66 let u pacientů zůstávajících na léčbě) a výskytem nežádoucích účinků (68). Perzistenci na léčbě hodnotila také recentní studie Vitale et al. (69), kde autoři popsali dobrou DRR: 44,6 % v 60. měsíci a 30,5 %, ve 120. měsíci léčby. Na rozdíl od předchozí studie Sota et al. (68) se celková DRR nelišila u pacientů biologicky neléčených a s předchozí expozicí biologickou léčbou, podobně jako u pacientů léčených csDMARDs. Navíc odpověď na léčbu anakinrou nebyla ovlivněna typem AOSD (systémový nebo polyartikulární), délkou trvání nemoci nebo věkem při první manifestaci (69).
Otázkou „okna příležitostí" u AOSD a vlivem časné terapeutické intervence na průběh nemoci se opět zabývala skupina Vitale et al. (69). Pacienti, kteří zahájili léčbu anakinrou do 6–12 měsíců od manifestace onemocnění, měli významně rychlejší pokles CRP a FW ve srovnání s pacienty s pozdějším zahájením terapie. Pacienti se zahájením anakinry před 6. měsícem od manifestace měli rychlejší pokles počtu postižených kloubů do 3 měsíců od zahájení terapie. Také iniciace anakinry během prvních 12 měsíců od manifestace nemoci vedla k výrazně rychlejšímu poklesu FW a CRP, nicméně rozdíl mezi skupinami vymizel v měsíci léčby 6. a 12. Zdá se tedy, že časné zahájení léčby vede k rychlejší odpovědi, ale celkový výsledek nebyl na časném zahájení léčby anakinrou dependentní (70).
Další inhibitor IL-1 – canakinumab je alternativou terapie AOSD, a to především v případě nedostatečné účinnosti nebo selhání léčby anakinrou. Před zveřejněním studie CONSIDER Kedora a kol. (76) byly k dispozici pouze omezené důkazy o jeho efektivitě v této indikaci (71–75). Přesto, že poněkud nešťastně volený primární cíl tohoto hodnocení zaměřený na artikulární doménu pacientů (zlepšení DAS28 (FW) o více než 1,2 v týdnu 12) nebyl splněn, EMA schválila použití canakinumabu u AOSD (76). Na rozdíl od výsledků předchozí studie byla klinická účinnost canakinumabu v reálné praxi potvrzena např. v retrospektivní studii autorů Vitale et al. (69). Terapie canakinumabem vedla k dosažení úplné kontroly nad onemocněním během 3 měsíců v téměř 90 % případů, přičemž dobrá odpověď přetrvávala až do konce sledování (12 měsíců). Došlo ke zlepšení ve všech systémových aspektech choroby (skóre systémové aktivity), muskuloskeletálních projevech (TJC, SJC a DAS28-CRP) stejně jako k normalizaci laboratorních parametrů zánětu (leukocytóza, hladina feritinu v séru, CRP a FW). Nebyly pozorovány rozdíly mezi monoterapií a kombinovanou léčbou s csDMARDs (77).
Rilonacept je nejnovějším dostupným inhibitorem IL-1. Junge et al. (25) při hodnocení systematického přehledu literatury s blokátory IL-1 u AOSD identifikoval jedenáct subjektů léčených rilonaceptem refrakterních na léčbu NSA, csDMARDs nebo dokonce anakinrou. Úplnou remisi v těchto studiích dosáhlo 65 % pacientů, částečnou zbývajících 45 %. Jednotlivá hodnocení se významně lišila v dávkovacím režimu. Obvyklá dávka se pohybovala od 160 mg do 320 mg jednou týdně nebo podle potřeby, ovlivnění kloubních příznaků však vyžadovalo vyšší dávky (až 360 mg) (25).
Inhibice IL-18, dalšího člena z rodiny IL-1, představu - je další slibný terapeutický přístup u pacientů s AOSD. V současné době jsou k dispozici pouze data z otevřené studie od Gabaye et al. (28). V tomto hodnocení byli pacienti léčeni postupně 80 mg nebo 160 mg tadekiniIem alfa třikrát týdně po dobu 12 týdnů. Léčba byla celkově dobře snášena a nejčastějšími nežádoucími účinky byly převážně lokální reakce v místě vpichu, následované infekcemi. Celkem byly hlášeny tři závažné nežádoucí reakce během celého trvání studie. Sekundární cíle se věnovaly ovlivnění počtu bolestivých a oteklých kloubů (hodnoceno TJC44, respektive SJC44) a redukci zánětlivých parametrů zahrnující CRP a feritin. Za terapeutickou odpověď bylo považováno snížení TJC a SJC minimálně o 20 %, redukce CRP o 70 % nebo normalizace hladin feritinu. V hodnocených časových intervalech, tj. ve 3. a 12. týdnu, bylo terapeutické odpovědi dosaženo u 44,4–58,3 % pacientů (28). K potvrzení těchto výsledků je však třeba dalších klinických studií.
BEZPEČNOSTNÍ ASPEKTY BLOKÁDY IL-1
Obecně je inhibice IL-1 spojena s příznivým bezpečnostním profilem. Výskyt nežádoucích účinků se napříč různými studiemi pohyboval v širokém rozmezí od 5 % až po 88 % (28, 52, 53, 57, 67, 78–88). Nejčastěji popsanými nežádoucími účinky byly reakce v místě vpichu, a to zejména u pacientů léčenými anakinrou a rilonaceptem. Na druhou stranu je vhodné zmínit, že anakinra měla uspokojivý bezpečnostní profil i u kriticky nemocných hospitalizovaných pacientů ohrožených infekcemi. Druhým nejčastějším nežádoucím účinkem byly infekce a vyskytovaly se častěji ve skupinách užívajících canakinumab (89, 90). Mezi ostatní méně časté nežádoucí účinky patřily komplikace spojené s gastrointestinálním a muskuloskeletálním systémem nebo abnormity hematologických a jaterních parametrů. Většina nežádoucích účinků byla mírná nebo středně závažná a vyskytla se během prvních měsíců léčby. Závažné nežádoucí účinky byly spojeny především s aktivitou základní choroby nebo infekcí. Jak běžné, tak i závažné nežádoucí účinky vedly ke snížení doby perzistence na terapii. Infekční komplikace byly popsány hlavně u pacientů užívajících kombinaci blokátorů IL-1 s csDMARD nebo NSA. Tato zjištění byla podpořena komplexní retrospektivní studií autorů Sota et al. (49), která analyzovala záznamy 475 pacientů (280 žen, 195 mužů, průměrný věk 36 let) se širokým spektrem polygenních/monogenních AID a dalších onemocnění, u nichž byla indikována inhibice IL-1. Kumulativně bylo hlášeno 89 nežádoucích událostí během průměrné doby sledování 24 let, z toho 14,61 % závažných. Nejčastěji hlášené byly reakce v místě aplikace a nespecifické erytémy. Závažné nežádoucí události zahrnovaly čtyři případy anafylaxe a tři případy závažné bakteriální infekce, dvě z nich vedly k úmrtí. Další z příčin úmrtí byly MAS, myokarditida a závažná neutropenie. Většina nežádoucích událostí se objevila během prvních 12 měsíců od zahájení léčby. Vyšší incidence byla pozorována u starších pa - cientů (≤ 65 let) a u pacientů s AOSD. Nebyl popsán rozdíl ve frekvenci mezi pacienty léčenými v monoterapii nebo kombinaci s csDMARDs. Také nebyly pozorovány rozdíly mezi pacienty biologicky neléčenými a pacienty již dříve exponovanými biologickými léky. Celkově se nežádoucí události vyskytly u 18,8 % pacientů a byly jedním z hlav - ních důvodů přerušení léčby (8,2 % pacientů) (25, 53, 57, 66, 68, 81, 91).
BLOKÁDA IL-1 A GLUKOKORTIKOIDY ŠETŘÍCÍ EFEKT
Důležitým fenoménem reportovaným ve většině klinických hodnocení s inhibitory IL-1 byl jejich glukokortikoidy šetřící efekt (92). Ve velkých studiích léčba IL-1 blokátory umožnila kompletní ukončení systémových glukokortikoidů u přibližně 30–40 % pacientů (25, 48, 53, 57, 66, 68). Vyšší podíl úspěšné redukce dávky glukokortikoidů byl pozorován zejména u pacientů s časným zahájením IL-1 blokády. Navíc glukokortikoidy šetřící efekt IL-1 blokády byl významně vyšší ve srovnání s csDMARDs. Ve studiích mohla být u významného procenta pacientů redukována i další komedikace (csDMARDs nebo NSA). Na rozdíl od inhibitorů TNF-a byly blokátory IL-1 účinné i v monoterapii (93), přičemž kombinace s csDMARDs, např. s MTX byla potřebná především u pacientů s kloubními projevy nemoci.
ZÁVĚR
Společným rysem polygenních AID včetně sJIA a AOSD je dysregulace vrozené imunitní odpovědi s centrální imunopatogenetickou úlohou prozánětlivých cytokinů z rodiny IL-1. Základním terapeutickým přístupem je tedy jejich inhibice, která je v současné době možná pomocí několika léků lišících se strukturou, mechanismem působení, efektivitou u jednotlivých diagnóz a spektrem nežádoucích účinků. Nejvíce dostupných důkazů máme pro bezpečnost a účinnost anakinry, canakinumabu a rilonaceptu. U dalších nadějných přípravků, jako jsou gevokizumab, tadekinig alfa, tranilast nebo dapansutril, klinická hodnocení aktuálně probíhají. Studie s blokátory IL-1 u sJIA a AOSD opakovaně prokázaly jejich efektivitu vedoucí k rychlému vymizení klinických symptomů a normalizaci laboratorních parametrů u většiny pacientů. Po podání inhibitorů IL-1 obvykle dochází k redukci systémových projevů ve velmi krátké době (hodin až dnů). Kloubní symptomy zpravidla vyžadují prolongovanou aplikaci, ovlivnění je méně výrazné, a většina pacientů tak vyžaduje konkomitantní léčbu csDMARDs, zejména MTX. Proto v případech, kdy u sJIA nebo AOSD dominuje kloubní symptomatologie nad systémovými projevy, zdá být účinnější podání biologických léků s jiným mechanismem účinku, např. inhibice IL-6 pomocí monoklonální protilátky anti-IL6R – tocilizumab. Ke zlepšení kloubních projevů může vést i léčba inhibitory TNF-α. Jejich limitace však spočívá v nedostatečném efektu na systémové projevy, a proto je jejich používání u sJIA a AOSD značně omezeno. Důležitou výhodou blokátorů IL-1 je jejich glukokortikoidy šetřící efekt, který je významnější než v případě csDMARDs.
Klíčovým faktorem pro prognózu pacientů se zdá být časné zahájení léčby ve vztahu k tzv. konceptu „okna příležitostí". Časné zahájení terapie podle dosavadních poznatků může významně ovlivnit průběh nemoci, a předejít tak strukturálnímu poškození. V současné době se ověření tohoto konceptu zdá být zásadní, zejména v dětské revmatologii (94). Otevřenou otázkou zůstává redukce až vysazování terapie, která není jednoznačně zodpovězena. Bezpečností aspekty blokády IL-1 jsou velmi příznivé.
Léčba inhibitory IL-1 je obecně velmi dobře tolerována. Hlavními vedlejšími účinky reportovanými ve studiích byly většinou lokální reakce v místě vpichu. Vysoká míra incidence těchto příhod však může být, a to především u pediatrických pacientů, důvodem k ukončení léčby. Ze závažnějších nežádoucích účinků bylo popsáno mírně vyšší procento nezávažných infekcí horních cest dýchacích. Jednou z nevýhod léčby blokátory IL-1 je jejich vysoká cena.
Adresa pro korespondenci:
MUDr. Hana Malcová, Ph.D.
Oddĕlení revmatologie dĕtí a dospĕlých
2. LF UK a FN Motol V Úvalu 84
150 06 Praha 5
e-mail: hana.malcova@fnmotol.cz
Autoři prohlašují, že nejsou v konfliktu zájmů.
Do redakce doručeno: 22. 6. 2021
Čes. Revmatol. 2021; 29(4): 209−227
Zdroje
- Cantarini L, Lopalco G, Selmi C, Napodano S, Rosa G de, Caso F et al. Autoimmunity and autoinflammation as the yin and yang of idiopathic recurrent acute pericarditis. Autoimmunity reviews 2015; 14(2): 90–97.
- Patel RM, Shulman ST. Kawasaki disease: a comprehensive review of treatment options. Journal of clinical pharmacy and therapeutics 2015; 40(6): 620–625.
- Rigante D. The Broad-Ranging Panorama of Systemic Autoinflammatory Disorders with Specific Focus on Acute Painful Symptoms and Hematologic Manifestations in Children. Mediterranean journal of hematology and infectious diseases 2018; 10(1): e2018067.
- Giacomelli R, Ruscitti P, Shoenfeld Y. A comprehensive review on adult onset Still's disease. Journal of Autoimmunity 2018; 93 : 24–36.
- Shenoi S. Juvenile Idiopathic Arthritis – Changing Times, Changing Terms, Changing Treatments. Pediatrics in review 2017; 38(5): 221–32.
- Cavalli G, Dinarello CA. Anakinra Therapy for Non-cancer Inflammatory Diseases. Frontiers in pharmacology 2018; 9 : 1157.
- Gram H. The long and winding road in pharmaceutical development of canakinumab from rare genetic autoinflammatory syndromes to myocardial infarction and cancer. Pharmacological research 2020; 154 : 104139.
- Szekely Y, Arbel Y. A Review of Interleukin-1 in Heart Disease: Where Do We Stand Today? Cardiology and therapy 2018; 7(1): 25–44.
- Kelley N, Jeltema D, Duan Y, He Y. The NLRP3 Inflammasome: An Overview of Mechanisms of Activation and Regulation. International journal of molecular sciences 2019; 20(13).
- Yuan S, Akey CW. Apoptosome structure, assembly, and procaspase activation. Structure 2013; 21(4): 501–515.
- Yang Y, Wang H, Kouadir M, Song H, Shi F. Recent advances in the mechanisms of NLRP3 inflammasome activation and its inhibitors. Cell death & disease 2019; 10(2): 128.
- Clancy DM, Sullivan GP, Moran HBT, Henry CM, Reeves EP, McElvaney NG et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell reports 2018; 22(11): 2937–2950.
- di Paolo NC, Shayakhmetov DM. Interleukin 1alpha and the inflammatory process. Nature immunology 2016; 17(8): 906–913.
- Fields JK, Gunther S, Sundberg EJ. Structural Basis of IL-1 Family Cytokine Signaling. Frontiers in immunology 2019; 10 : 1412.
- Boraschi D, Italiani P, Weil S, Martin MU. The family of the interleukin-1 receptors. Immunological reviews 2018; 281(1): 197–232.
- Liu T, Zhang L, Joo D, Sun SC. NF-kappaB signaling in inflammation. Signal transduction and targeted therapy 2017; 2.
- Hess J, Angel P, Schorpp-Kistner M. AP-1 subunits: quarrel and harmony among siblings. Journal of cell science 2004; 117(Pt 25): 5965–5973.
- Zhang J, Macartney T, Peggie M, Cohen P. Interleukin-1 and TRAF6-dependent activation of TAK1 in the absence of TAB2 and TAB3. The Biochemical journal 2017; 474(13): 2235–2248.
- Werman A, Werman-Venkert R, White R, Lee JK, Werman B, Krelin Y, et al. The precursor form of IL-1alpha is an intracrine proinflammatory activator of transcription. Proceedings of the National Academy of Sciences of the United States of America 2004; 101(8): 2434–2439.
- Mantovani A, Dinarello CA, Molgora M, Garlanda C. Interleukin-1 and Related Cytokines in the Regulation of Inflammation and Immunity. Immunity 2019; 50(4): 778–795.
- +Garlanda C, Dinarello CA, Mantovani A. The interleukin-1 family: back to the future. Immunity 2013; 39(6): 1003–1018.
- Feist E, Mitrovic S, Fautrel B. Mechanisms, biomarkers and targets for adult-onset Still's disease. Nature reviews. Rheumatology 2018; 14(10): 603–618.
- Dinarello CA. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases. Blood 2011; 117(14): 3720–3732.
- Dinarello CA. The IL-1 family of cytokines and receptors in rheumatic diseases. Nature reviews. Rheumatology 2019; 15(10): 612–632.
- Junge G, Mason J, Feist E. Adult onset Still's disease-The evi - dence that anti-interleukin-1 treatment is effective and well-to - lerated (a comprehensive literature review). Seminars in arthritis and rheumatism 2017; 47(2): 295–302.
- Tarp S, Amarilyo G, Foeldvari I, Christensen R, Woo JM, Cohen N, et al. Efficacy and safety of biological agents for systemic ju - venile idiopathic arthritis: a systematic review and meta-analysis of randomized trials. Rheumatology 2016; 55(4): 669–679.
- Owyang AM, Issafras H, Corbin J, Ahluwalia K, Larsen P, Pongo E, et al. XOMA 052, a potent, high-affinity monoclonal antibody for the treatment of IL-1beta-mediated diseases. mAbs 2011; 3(1): 49–60.
- Gabay C, Fautrel B, Rech J, Spertini F, Feist E, Kotter I, et al. Open - label, multicentre, dose-escalating phase II clinical trial on the safety and efficacy of tadekinig alfa (IL-18BP) in adult-onset Still's disease. Annals of the rheumatic diseases 2018; 77(6): 840–847.
- Huang Y, Jiang H, Chen Y, Wang X, Yang Y, Tao J et al. Tranilast directly targets NLRP3 to treat inflammasome-driven diseases. EMBO molecular medicine 2018; 10(4).
- Kluck V, Jansen T, Janssen M, Comarniceanu A, Efde M, Tengesdal IW, et al. Dapansutrile, an oral selective NLRP3 inflammasome inhibitor, for treatment of gout flares: an open-label, dose-adaptive, proof-of-concept, phase 2a trial. The Lancet Rheumatology 2020; 2(5): e270–e280.
- Gasparyan AY, Ayvazyan L, Blackmore H, Kitas GD. Writing a narrative biomedical review: considerations for authors, peer reviewers, and editors. Rheumatology international 2011; 31(11): 1409–1417.
- Lee JJY, Schneider R. Systemic Juvenile Idiopathic Arthritis. Pediatric clinics of North America 2018; 65(4): 691–709.
- Cimaz R. Systemic-onset juvenile idiopathic arthritis. Autoimmunity reviews 2016; 15(9): 931–934.
- Shenoi S, Wallace CA. Diagnosis and Treatment of Systemic Juvenile Idiopathic Arthritis. The Journal of pediatrics 2016; 177 : 19–26.
- Pascual V, Allantaz F, Arce E, Punaro M, Banchereau J. Role of interleukin-1 (IL-1) in the pathogenesis of systemic onset juveni - le idiopathic arthritis and clinical response to IL-1 blockade. The Journal of experimental medicine 2005; 201(9): 1479–1486.
- Gattorno M, Piccini A, Lasiglie D, Tassi S, Brisca G, Carta S, et al. The pattern of response to anti-interleukin-1 treatment distinguishes two subsets of patients with systemic-onset juve - nile idiopathic arthritis. Arthritis and rheumatism 2008; 58(5): 1505–1515.
- Vastert SJ, Jager W de, Noordman BJ, Holzinger D, Kuis W, Prakken BJ, et al. Effectiveness of first-line treatment with recombinant interleukin-1 receptor antagonist in steroid-naive patients with new-onset systemic juvenile idiopathic arthritis: results of a prospective cohort study. Arthritis & rheumatology 2014; 66(4): 1034–1043.
- Ilowite N, Porras O, Reiff A, Rudge S, Punaro M, Martin A, et al. Anakinra in the treatment of polyarticular-course juvenile rheumatoid arthritis: safety and preliminary efficacy results of a randomized multicenter study. Clinical rheumatology 2009; 28(2): 129–137.
- Quartier P, Allantaz F, Cimaz R, Pillet P, Messiaen C, Bardin C, et al. A multicentre, randomised, double-blind, placebo-controlled trial with the interleukin-1 receptor antagonist anakinra in patients with systemic-onset juvenile idiopathic arthritis (ANAJIS trial). Annals of the rheumatic diseases 2011; 70(5): 747–754.
- Nigrovic PA, Mannion M, Prince FH, Zeft A, Rabinovich CE, van Rossum MA, et al. Anakinra as first-line disease-modifying therapy in systemic juvenile idiopathic arthritis: report of forty-six patients from an international multicenter series. Arthritis and rheumatism 2011; 63(2): 545–555.
- Lequerre T, Quartier P, Rosellini D, Alaoui F, Bandt M de, Mejjad O, et al. Interleukin-1 receptor antagonist (anakinra) treatment in patients with systemic-onset juvenile idiopathic arthritis or adult onset Still disease: preliminary experience in France. Annals of the rheumatic diseases 2008; 67(3): 302–308.
- Hedrich CM, Bruck N, Fiebig B, Gahr M. Anakinra: a safe and effective first-line treatment in systemic onset juvenile idiopathic arthritis (SoJIA). Rheumatology international 2012; 32(11): 3525–3530.
- Romano M, Pontikaki I, Gattinara M, Ardoino I, Donati C, Boracchi P, et al. Drug survival and reasons for discontinuation of the first course of biological therapy in 301 juvenile idiopathic arthritis patients. Reumatismo 2014; 65(6): 278–285.
- Pardeo M, Pires Marafon D, Insalaco A, Bracaglia C, Nicolai R, Messia V, et al. Anakinra in Systemic Juvenile Idiopathic Arthritis: A Single-center Experience. The Journal of rheumatology 2015; 42(8): 1523–1527.
- Grom AA, Ilowite NT, Pascual V, Brunner HI, Martini A, Lovell D, et al. Rate and Clinical Presentation of Macrophage Activation Syndrome in Patients With Systemic Juvenile Idiopathic Arthritis Treated With Canakinumab. Arthritis & Rheumatology 2016; 68(1): 218–228.
- Horneff G, Schulz AC, Klotsche J, Hospach A, Minden K, Foeldvari I, et al. Experience with etanercept, tocilizumab and interleukin-1 inhibitors in systemic onset juvenile idiopathic arthritis patients from the BIKER registry. Arthritis Research & Therapy 2017; 19(1): 256.
- Kearsley-Fleet L, Beresford MW, Davies R, Cock D de, Baildam E, Foster HE, et al. Short-term outcomes in patients with systemic juvenile idiopathic arthritis treated with either tocilizumab or anakinra. Rheumatology 2019; 58(1): 94–102.
- Vastert SJ, Jamilloux Y, Quartier P, Ohlman S, Osterling Koskinen L, Kullenberg T, et al. Anakinra in children and adults with Still's disease. Rheumatology 2019; 58(Suppl 6): vi9–vi22.
- Sota J, Insalaco A, Cimaz R, Alessio M, Cattalini M, Gallizzi R, et al. Drug Retention Rate and Predictive Factors of Drug Survival for Interleukin-1 Inhibitors in Systemic Juvenile Idiopathic Arthritis. Frontiers in pharmacology 2018; 9 : 1526.
- Kimura Y, Grevich S, Beukelman T, Morgan E, Nigrovic PA, Mieszkalski K, et al. Pilot study comparing the Childhood Arthritis & Rheumatology Research Alliance (CARRA) systemic Juvenile Idiopathic Arthritis Consensus Treatment Plans. Pediatric rheumatology online journal 2017; 15(1): 23.
- Woerner A, Uettwiller F, Melki I, Mouy R, Wouters C, Bader - Meunier B, et al. Biological treatment in systemic juvenile idiopathic arthritis: achievement of inactive disease or clinical remission on a first, second or third biological agent. RMD open 2015; 1(1): e000036.
- Feist E, Quartier P, Fautrel B, Schneider R, Sfriso P, Efthimiou P, et al. Efficacy and safety of canakinumab in patients with Still's disease: exposure-response analysis of pooled systemic juvenile idiopathic arthritis data by age groups. Clinical and experimental rheumatology 2018; 36(4): 668–675.
- Ruperto N, Brunner HI, Quartier P, Constantin T, Wulffraat NM, Horneff G, et al. Canakinumab in patients with systemic juvenile idiopathic arthritis and active systemic features: results from the 5-year long-term extension of the phase III pivotal trials. Annals of the rheumatic diseases 2018; 77(12): 1710–1719.
- Quartier P, Alexeeva E, Tamas C, Chasnyk V, Wulffraat N, Palmblad K, et al. Tapering Canakinumab Monotherapy in Patients with Systemic Juvenile Idiopathic Arthritis in Clinical Remission: Results from an Open-label, Randomized Phase IIIb/ IV Study. Arthritis & rheumatology 2020.
- Brunner HI, Quartier P, Alexeeva E, Constantin T, Kone-Paut I, Marzan K, et al. Efficacy and Safety of Canakinumab in sJIA Patients with and without Fever at Baseline: Results from an Openlabel, Active Treatment Extension Study. Arthritis & rheumatology 2020.
- Lovell DJ, Giannini EH, Reiff AO, Kimura Y, Li S, Hashkes PJ, et al. Long-term safety and efficacy of rilonacept in patients with systemic juvenile idiopathic arthritis. Arthritis & rheumatism 2013; 65(9): 2486–2496.
- Ilowite NT, Prather K, Lokhnygina Y, Schanberg LE, Elder M, Milojevic D, et al. Randomized, double-blind, placebo-controlled trial of the efficacy and safety of rilonacept in the treatment of systemic juvenile idiopathic arthritis. Arthritis & rheumatology 2014; 66(9): 2570–2579.
- Efthimiou P, Paik PK, Bielory L. Diagnosis and management of adult onset Still's disease. Ann Rheum Dis. 2006; 65(5): 564–572.
- Laskari K, Tzioufas AG, Moutsopoulos HM. Efficacy and long-term follow-up of IL-1R inhibitor anakinra in adults with Still's disease: a case-series study. Arthritis research & therapy 2011; 13(3): R91.
- Iliou C, Papagoras C, Tsifetaki N, Voulgari PV, Drosos AA. Adult-onset Still's disease: clinical, serological and therapeutic considerations. Clinical and experimental rheumatology 2013; 31(1): 47–52.
- Giampietro C, Ridene M, Lequerre T, Costedoat Chalumeau N, Amoura Z, Sellam J, et al. Anakinra in adult-onset Still's disease: long-term treatment in patients resistant to conventio - nal therapy. Arthritis care & research 2013; 65(5): 822–826.
- Ortiz-Sanjuan F, Blanco R, Riancho-Zarrabeitia L, Castaneda S, Olive A, Riveros A, et al. Efficacy of Anakinra in Refractory Adult-Onset Still's Disease: Multicenter Study of 41 Patients and Literature Review. Medicine 2015; 94(39): e1554.
- Cavalli G, Franchini S, Aiello P, Guglielmi B, Berti A, Campochiaro C, et al. Efficacy and safety of biological agents in adult-onset Still's disease. Scandinavian journal of rheumatology 2015; 44(4): 309–314.
- Sfriso P, Priori R, Valesini G, Rossi S, Montecucco CM, D'Ascanio A, et al. Adult-onset Still's disease: an Italian multicentre retrospective observational study of manifestations and treatments in 245 patients. Clinical rheumatology 2016; 35(7): 1683–1689.
- Dall'Ara F, Frassi M, Tincani A, Airo P. A retrospective study of patients with adult-onset Still's disease: is pericarditis a possible predictor for biological disease-modifying antirheumatic drugs need? Clinical rheumatology 2016; 35(8): 2117–2123.
- Nordstrom D, Knight A, Luukkainen R, van Vollenhoven R, Rantalaiho V, Kajalainen A, et al. Beneficial effect of interleukin 1 inhibition with anakinra in adult-onset Still's disease. An open, randomized, multicenter study. The Journal of rheumatology 2012; 39(10): 2008–2011.
- ClinicalTrials. U.S. National Library of Medicine https://cli - nicaltrials.gov.
- Sota J, Rigante D, Ruscitti P, Insalaco A, Sfriso P, Vita S de, et al. Anakinra Drug Retention Rate and Predictive Factors of Long-Term Response in Systemic Juvenile Idiopathic Arthritis and Adult Onset Still Disease. Frontiers in pharmacology 2019; 10 : 918.
- Vitale A, Cavalli G, Colafrancesco S, Priori R, Valesini G, Argolini LM, et al. Long-Term Retention Rate of Anakinra in Adult Onset Still's Disease and Predictive Factors for Treatment Response. Frontiers in pharmacology 2019; 10 : 296.
- Vitale A, Berlengiero V, Sota J, Ciarcia L, Ricco N, Barneschi S, et al. Real-Life Data on the Efficacy of Canakinumab in Patients with Adult-Onset Still's Disease. Mediators of inflammation 2020; 2020 : 8054961.
- Kontzias A, Efthimiou P. The use of Canakinumab, a novel IL - 1beta long-acting inhibitor, in refractory adult-onset Still's disease. Seminars in arthritis and rheumatism 2012; 42(2): 201–205.
- Banse C, Vittecoq O, Benhamou Y, Gauthier-Prieur M, Lequerre T, Levesque H. Reactive macrophage activation syndrome possibly triggered by canakinumab in a patient with adult-onset Still's disease. Joint bone spine 2013; 80(6): 653–655.
- Barsotti S, Neri R, Iacopetti V, D'Ascanio A, Talarico R, Tripoli A, et al. Successful treatment of refractory adult-onset still disease with canakinumab: a case report. Journal of clinical rheumatology : practical reports on rheumatic & musculoskeletal diseases 2014; 20(2): 121.
- Lo Gullo A, Caruso A, Pipitone N, Macchioni P, Pazzola G, Salvarani C. Canakinumab in a case of adult onset still's disease: efficacy only on systemic manifestations. Joint bone spine 2014; 81(4): 376–377.
- Rossi-Semerano L, Fautrel B, Wendling D, Hachulla E, Galeotti C, Semerano L, et al. Tolerance and efficacy of off-label anti-interleukin-1 treatments in France: a nationwide survey. Orphanet journal of rare diseases 2015; 10 : 19.
- Kedor C, Listing J, Zernicke J, Weiss A, Behrens F, Blank N, et al. Canakinumab for Treatment of Adult-Onset Still's Disease to Achieve Reduction of Arthritic Manifestation (CONSIDER): phase II, randomised, double-blind, placebo-controlled, multicentre, investigator-initiated trial. Annals of the rheumatic diseases 2020.
- Vitale A, Cavalli G, Ruscitti P, Sota J, Colafrancesco S, Priori R, et al. Comparison of Early vs. Delayed Anakinra Treatment in Patients With Adult Onset Still's Disease and Effect on Clinical and Laboratory Outcomes. Frontiers in medicine 2020; 7 : 42.
- So A, Meulemeester M de, Pikhlak A, Yucel AE, Richard D, Murphy V, et al. Canakinumab for the treatment of acute fla - res in difficult-to-treat gouty arthritis: Results of a multicenter, phase II, dose-ranging study. Arthritis and rheumatism 2010; 62(10): 3064–3076.
- Schlesinger N, Mysler E, Lin HY, Meulemeester M de, Rovensky J, Arulmani U, et al. Canakinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: results of a double-blind, randomised study. Annals of the rheumatic diseases 2011; 70(7): 1264–1271.
- Schlesinger N, Alten RE, Bardin T, Schumacher HR, Bloch M, Gimona A, et al. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randmised, multicentre, active-controlled, double-blind trials and their initial extensions. Annals of the rheumatic diseases 2012; 71(11): 1839–1848.
- Terkeltaub RA, Schumacher HR, Carter JD, Baraf HS, Evans RR, Wang J, et al. Rilonacept in the treatment of acute gouty arthritis: a randomized, controlled clinical trial using indo - methacin as the active comparator. Arthritis research & therapy 2013; 15(1): R25.
- Ottaviani S, Molto A, Ea HK, Neveu S, Gill G, Brunier L, et al. Efficacy of anakinra in gouty arthritis: a retrospective study of 40 cases. Arthritis research & therapy 2013; 15(5): R123.
- Emmi G, Talarico R, Lopalco G, Cimaz R, Cantini F, Viapiana O et al. Efficacy and safety profile of anti-interleukin-1 tre - atment in Behcet's disease: a multicenter retrospective study. Clinical rheumatology 2016; 35(5): 1281–1286.
- Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. The New England journal of medici - ne 2017; 377(12): 1119–1131.
- Janssen CA, Voshaar MAHO, Vonkeman HE, Jansen T, Janssen M, Kok MR, et al. Anakinra for the treatment of acute gout flares: a randomized, double-blind, placebo-controlled, active-comparator, non-inferiority trial. Rheumatology 2019. doi: 10.1093/ rheumatology/key402
- Fabiani C, Vitale A, Rigante D, Emmi G, Lopalco G, Di Scala G, et al. The Presence of Uveitis Is Associated with a Sustained Response to the Interleukin (IL)-1 Inhibitors Anakinra and Canakinumab in Behcet's Disease. Ocular immunology and in-flammation 2020; 28(2): 298–304.
- Imazio M, Andreis A, Ferrari GM de, Cremer PC, Mardigyan V, Maestroni S, et al. Anakinra for corticosteroid-dependent and colchicine-resistant pericarditis: The IRAP (International Registry of Anakinra for Pericarditis) study. European journal of preventive cardiology 2020; 27(9): 956–964.
- Kone-Paut I, Tellier S, Belot A, Brochard K, Guitton C, Marie I, et al. Open Label, Phase II Study with Anakinra in Intravenous Immunoglobulin-Resistant Kawasaki Disease. Arthritis & rheumatology 2020.
- Thueringer JT, Doll NK, Gertner E. Anakinra for the treatment of acute severe gout in critically ill patients. Seminars in arthritis and rheumatism 2015; 45(1): 81–85.
- Liew JW, Gardner GC. Use of Anakinra in Hospitalized Patients with Crystal-associated Arthritis. The Journal of rheumatology 2019; 46(10): 1345–1349.
- Sota J, Vitale A, Insalaco A, Sfriso P, Lopalco G, Emmi G, et al. Safety profile of the interleukin-1 inhibitors anakinra and canakinumab in real-life clinical practice: a nationwide multicenter retrospective observational study. Clinical rheumatology 2018; 37(8): 2233–2240.
- Poetker DM, Reh DD. A comprehensive review of the adverse effects of systemic corticosteroids. Otolaryngologic clinics of North America 2010; 43(4): 753–768.
- Kalden JR, Schulze-Koops H. Immunogenicity and loss of response to TNF inhibitors: implications for rheumatoid arthritis treatment. Nature reviews. Rheumatology 2017; 13(12): 707–718.
- Nigrovic PA. Review: is there a window of opportunity for treatment of systemic juvenile idiopathic arthritis? Arthritis & rheumatology 2014; 66(6): 1405–1413.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2021 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Etiketa pro lékaře, zdravotníky a pomáhající profese
- Vliv pohlaví na závažnost onemocnění a terapeutickou odpověď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatrickou artrididou léčených cílenými chorobu - modifikujícími léky v České republice
- Vliv pohlaví na závažnost onemocnĕní a terapeutickou odpovĕď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatickou artritidou léčených jeden rok certolizumab peIolem - analýza z národního registru biologické léčby ATTRA
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u mužů
- Blokáda interleukinu-1 v léčbĕ systémové juvenilní idiopatické artritidy a Stillovy nemoci se začátkem v dospĕlosti
- ANCA asociovaná vaskulitida s ulceracemi kůže bérců, klinicky odpovídající pyoderma gangrenosum
- KALENDÁŘ AKCÍ ČRS V ROCE 2022
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- ANCA asociovaná vaskulitida s ulceracemi kůže bérců, klinicky odpovídající pyoderma gangrenosum
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u mužů
- Blokáda interleukinu-1 v léčbĕ systémové juvenilní idiopatické artritidy a Stillovy nemoci se začátkem v dospĕlosti
- Vliv pohlaví na závažnost onemocnění a terapeutickou odpověď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatrickou artrididou léčených cílenými chorobu - modifikujícími léky v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





