-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ANCA asociovaná vaskulitida s ulceracemi kůže bérců, klinicky odpovídající pyoderma gangrenosum
ANCA associated vasculitis with skin ulcers of the cald, clinically manifested as pyoderma gangrenosum
ANCA (antineutrophil cytoplasmic antibody) – associated vasculitis (AAV) is one of the chronic systemic inflammatory diseases of small and medium caliber vessels. The most commonly affected are the airways, where necrotizing granulomas form, and the kidneys in the form of focal segmental necrotizing glomerulonephritis with crescent formation. Diagnosis is based on clinical symptoms, detection of ANCA antibodies, and biopsy of the affected organ tissue. Pyoderma gangrenosum (PG) is a very rare chronic inflammatory skin disease with the formation of painful ulcers. The etiopathogenesis is not fully understood; it is probably immunopathology with neutrophil dysfunction. We determine the diagnosis on the basis of diagnostic criteria, which are based primarily on histopathological findings, a clinical picture with a rapid response to immunosuppressive therapy. In ⅔ of cases, it is associated with other systemic autoimmune diseases (inflammatory bowel diseases, arthritis, hematological malignancies, etc.)
We describe a case of a hitherto healthy 53-year-old woman who developed painful ulcerative defects of the right calf, followed by the development of phlegmon. Defects developed after a minor injury. Doppler ultrasonography of the arteries excluded the ischemic basis of the resulting defect, and the culture excluded the infectious etiology of the disease. Subsequent skin biopsy from a defect with numerous neutrophilic granulocytes found a diagnosis of PG. The diagnosis of ANCA vasculitis was made on the basis of positive ANCA antibodies (against type 3proteinase) and histological findings from a kidney biopsy.
The diagnosis of PG is rare, so it is necessary to think about it in non-healing ulcers. If the diagnosis is made, it is important to look for possible associated diseases. As in most cases, an association with other serious conditions has been demonstrated; in our case, ANCA necrotizing small-vessel vasculitis was found.
Keywords:
ANCA associated vasculitis – pyoderma gangrenosum – shin ulcers
Autoři: B. Průchová 1; H. Štilcová 2; M. Podhola 3; D. Kacerovská 4; T. Soukup 2
Působiště autorů: Oblastní nemocnice Náchod a. s., Interní oddělení Nemocnice Rychnov nad Kněžnou 1; Subkatedra revmatologie, II. interní gastroenterologická klinika LF UK a FN, Hradec Králové 2; Fingerlandův ústav patologie LF a FN, Hradec Králové 3; Šiklův ústav patologie LF a FN, Plzeň 4
Vyšlo v časopise: Čes. Revmatol., 29, 2021, No. 4, p. 228-236.
Kategorie: Kazuistika
Souhrn
ANCA (antineutrophil cytoplasmic antibody) – asociované vaskulitidy (AAV) patří mezi chronická systémová zánětlivá onemocnění cév malého a středního kalibru. Nejčastěji postižené jsou dýchací cesty, kde dochází k tvorbě nekrotizujících granulomů, a ledviny ve formě fokálně segmentální nekrotizující glomerulonefritidy s tvorbou srpků. Diagnostika je založena na klinické symptomatice, detekci ANCA protilátek a biopsii tkáně postiženého orgánu.
Pyoderma gangrenosum (PG) je velmi vzácné chronické zánětlivé onemocnění kůže s tvorbou bolestivých ulcerací. Etiopatogeneze není zcela objasněna, pravděpodobně se jedná o imunopatologii s dysfunkcí neutrofilů. Diagnózu stanovíme na základě diagnostických kritérií, která jsou založena především na histopatologickém nálezu, klinickém obrazu s rychlou odezvou na imunosupresivní terapii. Ve ⅔ případů je asociována s jiným systémovým autoimunitním onemocněním (nespecifické střevní záněty, artritidy, hematologické malignity atd.)
Popisujeme případ doposud zdravé 53leté ženy, u které se objevily bolestivé ulcerující defekty pravého lýtka, následovány rozvojem flegmóny. Defekty se rozvinuly po drobném poranění. Dopplerovskou ultrasonografií arterií byl vyloučen ischemický podklad vzniklého defektu a kultivačně infekční etiologie onemocnění. Doplněná kožní biopsie z defektu s nálezem četných neutrofilních granulocytů podporovala diagnózu PG.
Diagnóza ANCA vaskulitidy byla stanovena na základě pozitivy ANCA protilátek (proti proteináze typu 3) a histologického nálezu z biopsie ledviny. Diagnóza PG je vzácná, proto je nutné na ni pomýšlet u nehojících se ulcerací. Pokud diagnózu stanovíme, je důležité hledat možná přidružená onemocnění, jelikož byla prokázána ve většině případů asociace s dalšími závažnými stavy, v našem případě byla zjištěna ANCA nekrotizující vaskulitida malých cév.
Klíčová slova:
pyoderma gangrenosum – ANCA asociovaná vaskulitida – bércové ulcerace
ÚVOD
ANCA asociované vaskulitidy (AAV) s přítomností protilátek proti cytoplazmě neutrofilních leukocytů (antineutrophil cytoplasmic antibody – ANCA) patří mezi chronická systémová zánětlivá onemocnění cév malého a středního kalibru. Mezi AAV řadíme granulomatózu s polyangiitidou (GPA), mikroskopickou polyangiitidu a eozinofilní granulomatózu s polyangiitidou (EGP) (1).
GPA je vzácné systémové onemocnění (incidence tři až šest pacientů na 100 000 obyvatel za rok) se stoupající incidencí, nejasné etiologie, charakterizované nekrózami, tvorbou granulomů, velmi často s projevy vaskulitidy horních a dolních dýchacích cest (v 90 %), dále nekrotizující glomerulonefritidou (v 75–80 %) a systémovou vaskulitidou postihující kterýkoli orgán. Je typické chybění ukládání imunokomplexů do stěny cév (je tzv. pauciimunitní). Postihuje výhradně kavkazskou populaci, častější výskyt je u mužů ve středním věku (1,3 : 1) (2, 3). Diagnostika se opírá o klasifikační kritéria z roku 1990 (tab. 1). K diagnóze stačí přítomnost dvou ze čtyř kritérií se senzitivitou 88,2 % a specificitou 92 %. Diagnostika je založena na klinické symptomatice, laboratorních nálezech (CRP – C-reaktivní protein, sedimentace, leukocytóza, anemie, trombocytóza, erytrocyturie a mírná až střední proteinurie) včetně detekce ANCA protilátek v 90 % (tzv. podtyp c – cytoplazmatická imunohuorescence, namířená proti proteináze 3) a v biopsii tkáně postiženého orgánu, nejčastěji bývá provedena renální biopsie s nálezem fokálně segmentální nekrotizující glomerulonefritidy se srpky. Terapie je založena na podávání glukortikoidů v kombinaci s cyklofosfamidem, což navodí remisi až v 90 % případů, u některých pacientů je nutná hemodialýza. U pacientů refrakterních na cyklofosfamid se podávají vysoké dávky intravenózních imunoglobulinů nebo se provádějí plazmaferézy. Je nutné dlouhodobé podávání terapie vzhledem k častým relapsům onemocnění, k udržovací léčbě se řadí azathioprin, methotrexát, lehunomid a nízké dávky glukokortikoidů. Další léčebnou modalitou je deplece B-lymfocytů navozená monoklonální protilátkou proti antigenu CD20 (rituximab). Pětileté přežití se stále pohybuje okolo 75 % (4–7).
Tab. 1. Klasifikační kritéria granulomatózy s polyanIiitidou podle ACR (Americká revmatoloIická společnost) z roku 1990 (7) 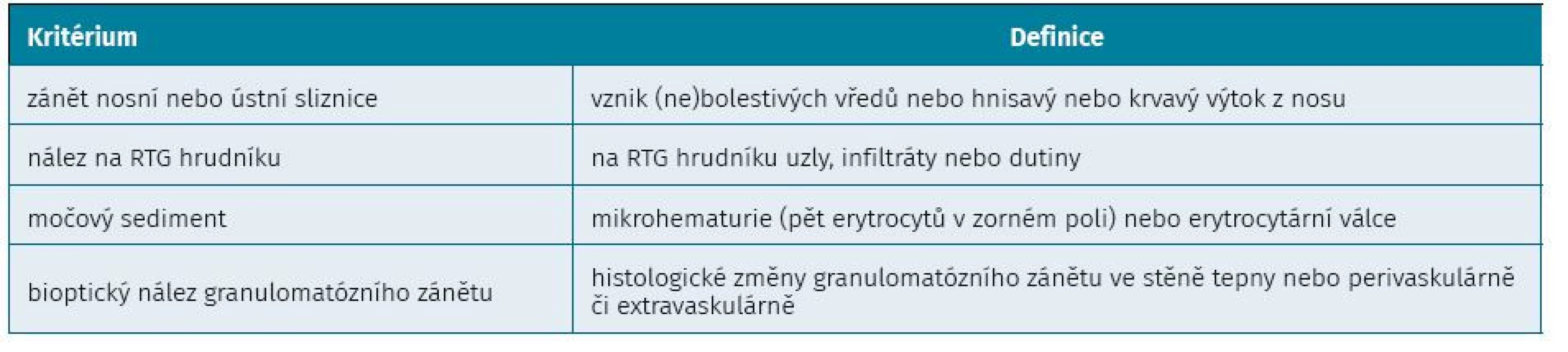
Pyoderma gangrenosum (PG) je velmi vzácné chronické autoimunitní onemocnění kůže s tvorbou bolestivých ulcerací (četnost tři až deset případů/1 milion/ rok). V 85 % se jedná o klasickou ulcerózní formu PG, kdy jsou přítomny extrémně bolestivé erytematózní léze v oblasti dolních končetin, které velmi rychle progredují do nekrotického vředu. Etiopatogeneze není zcela objasněna, pravděpodobně se jedná o imunopatologii s dysfunkcí neutrofilů. Téměř u 3/4 případů se vyskytuje ve spojitosti s jiným systémovým onemocněním, například nespecifickým střevním zánětem, revmatologickými onemocněními (převážně s artritidou, ojediněle s vasku - litidou) nebo hematomalignitami (8). Diagnózu stanovíme na základě diagnostických kritérií podle Maverakise z roku 2018, k potvrzení diagnózy je potřeba mít jedno hlavní a čtyři vedlejší kritéria (tab. 2). Jsou založena především na histopatologickém nálezu, klinickém obrazu, který je často spojen s patergií (zánětlivá odpověď na vnější inzult, např. bodnutí hmyzem, subkutánní injekce) a též velmi rychlou odpovědí na imunosupresivní terapii. Terapie se dělí na lokální a systémovou, přičemž strategie léčby je variabilní a odvislá od tíže onemocnění. Základem jsou převazy s glukokortikoidy a takrolimovou mastí, v případě vyloučení tepenné nedostatečnosti je vhodná komprese. Dále je nutná analgetická terapie. Ze systémové léčby jsou na prvním místě glukokortikoidy, z imunosupresivní léčby (cyklosporin, methotrexát, cyklofosfamid, azathioprin a další). Pokud i přes veškerou snahu terapie selže, je nutné přistoupit k zahájení biolo - gické léčby (inhiximab, adalimumab). Léčba je svízelná, dlouhá, v některých případech dochází ke zhojení ulcerací až po několika letech a není vyloučena recidiva one - mocnění. Proto je u těchto pacientů důležitá prevence vzniku poranění (9–12).
Tab. 2. Klasifikační kritéria pyoderma gangrenosum dle Maverakise et al. z roku 2018 (12) 
Asi 50–80 % případů PG je sdruženo s jiným onemoc - něním. Z toho 1/3 se sdružuje s idiopatickým zánětlivým onemocněním střev, nejčastěji jako pustulózní nebo ulcerózní forma PG. Stejný výskyt se udává u artritid, monoklonální gamapatie jsou zastoupeny asi v 10 % případů a asi v 7 % jsou to maligní nádory (13).
POPIS PŘÍPADU
Popisujeme případ 53leté dosud zdravé pacientky, bez alergických projevů v anamnéze. Nemocná kouří 20 cigaret za den. Zaměstnáním je pekařka. Rodinná anamnéza je zatížena výskytem chorob spojených s aterosklerózou, u otce ischemická choroba dolních končetin, u matky cévní ischemická mozková příhoda.
V srpnu 2020 si po chůzi travou po několika dnech všimla dvou drobných červených teček v oblasti plosky pravé dolní končetiny (myslela si, že šlo o bodnutí od hmyzu). Následně došlo k otoku nártu. Pro zhoršující se lokální nález navštívila pacientka praktického lékaře, kterým byla ordinována antibiotická léčba (amoxicilinum/klavulanát). I přes antibiotickou terapii se na pravém bérci objevila dvě bolestivá ložiska o velikosti cca 2 x 2 cm s krustou na povrchu, následně se stav komplikoval horečkou a pacientka byla hospitalizována na spádovém okresním chirurgickém pracovišti s diagnózou hegmóny pravé dolní končetiny. Laboratorně byly vysoké zánětlivé parametry (CRP 235 mg/l), leukocytóza (19 x 109/l), kultivace z rány byla negativní. Dopplerovské vyšetření tepen bez významného nálezu uzávěru (popsána stenóza v průběhu arterie tibialis posterior). Byla nasazena dvojkombinace antibiotik (amoxicilinum/klavulanát i.v. a gentamicin-sulfát i.v.), opět nedošlo k poklesu zánětlivých známek.
Pro progredující ulcerace na pravém bérci (mediálně nad vnitřním kotníkem a distálně na bérci, místy s nekrózami) byla pacientka přeložena na kožní oddělení krajské nemocnice. Zde pokračovali v zahájené antibiotické terapii, provedli kontrolní stěry z rány, které byly negativní (včetně hemokultur). Po týdnu antibiotické terapie byly opět provedeny stěry z defektu, kde byl zjištěn masivní výskyt Pseudomonas aeruginosa a Enterobacter cloacae. Následně byla změněna antibiotická terapie na dvojkombinaci (klindamycin-fosfát 2,4 g/den i.v. a oxacilin 8 g/den i.v.). Zánětlivé parametry přetrvávaly nadále vysoké, prokalcitonin v normě. I přes upravenou antibiotickou terapii došlo k progresi lokálního nálezu – nově se objevily defekty i v oblasti zevního kotníku. Klinicky bylo vysloveno podezření na PG, případně polyarteritis nodosa či granulomatózu s polyangiitidou. Byla doplněna biopsie z rány, kde byla popsána přítomnost četných neutrofilních granulocytů s fokální příměsí eozinofilních granulocytů, v zasaženém materiálu nebyla nalezena fibrinoidní nekróza cévní stěny, která by svědčila pro leukocytoklastickou vaskulitidu, nález tedy připouští možnou diagnózu PG (obr. 1).
Obr. 1. Kožní biopsie, kde pod mírnĕ akantoticky rozšířeným povrchovým epitelem nacházíme difuznĕ splývající smíšený zánĕtlivý infiltrát s převahou neutrofilních a eozinfolních granulocytů. Místy je patrné, že zánĕtlivý infiltrát se nachází i perifolikulárnĕ (hematoxylin-eosin, zvĕtšení 200x) (s laskavostí prof. Kacerovské z FN Plzeň) 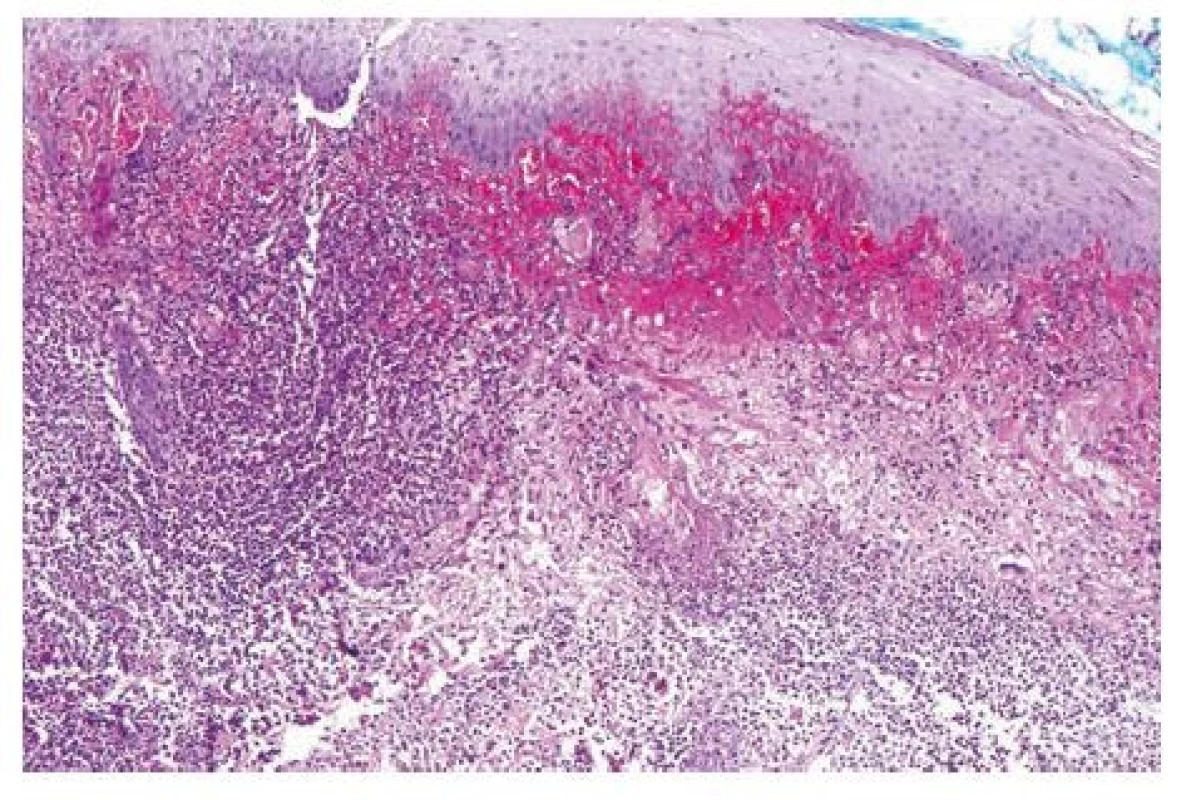
Po 3 týdnech léčby byla zahájena kortikoterapie prednisonem v dávce 50 mg/den. Pacientka byla nadále subfebrilní, laboratorně pokles CRP (80 mg/l), lokální nález stále progredující. V rámci vyloučení další infekce byla doplněna sonografie břicha, RTG hrudníku a výtěr z krku a nosu. Zlomem v případu bylo zjištění pozitivity ANCA protilátek (proteináza 3 (PR3) 2416 IU/ml) ELISA metodou.
Proto byla pacientka přijata k dovyšetření a další terapii na lůžkové revmatologické oddělení II. interní gastroenterologické kliniky Fakultní nemocnice v Hradci Králové. Defekty pokrývaly téměř celý obvod pravého bérce, spodina byla pokryta zapáchajícími zelenožlutými povlaky s navalitými okraji (obr. 2a,b).
Obr. 2. a, b Defekty na pravé dolní končetině v čase přijetí na revmatologické pracoviště (archiv autorů) 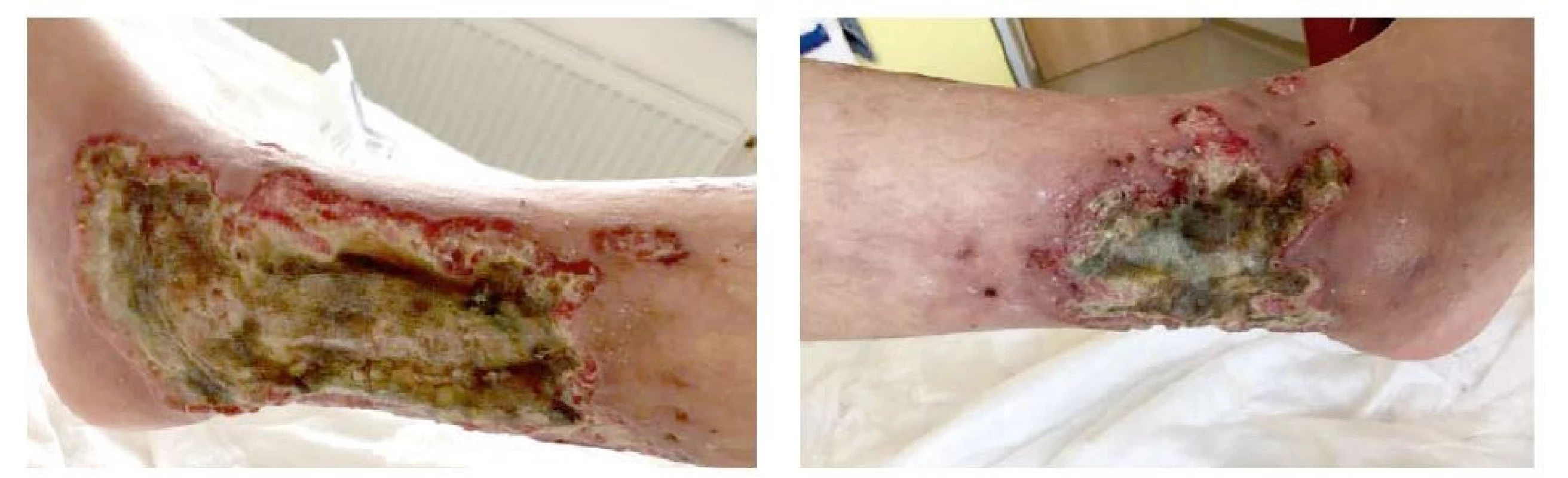
Za hospitalizace pokračováno v antibiotické terapii a kortikoterapii. Provedeno angiologické vyšetření, které vyloučilo postižení tepen (duplexní sonografie tepen dolních končetin, index kotník–paže). V rámci revmatologického vyšetření bylo provedeno ORL vyšetření, HRCT plic a UZ srdce, vše bez průkazu vaskulitidy. V moči nález erytrocyturie glomerulárního typu, proteinurie 0,36 g/ den, doplněna biopsie pravé ledviny, kde byl v jednom z jedenácti glomerulů zachycen nález kompatibilní s diagnózou ANCA vaskulitidy – jednalo se o čerstvou segmentární nekrózu s výronem fibrinu a počínajícím celulárním srpkem (obr. 3).
Obr. 3. Biopsie ledviny se zastiženým glomerulem, ve kterém je čerstvá segmentální nekróza organizující se bunĕčným srpkem (hematoxylin-eosin, zvĕtšení 200x) (archiv FinIerlandova ústavu patologie Hradec Králové) 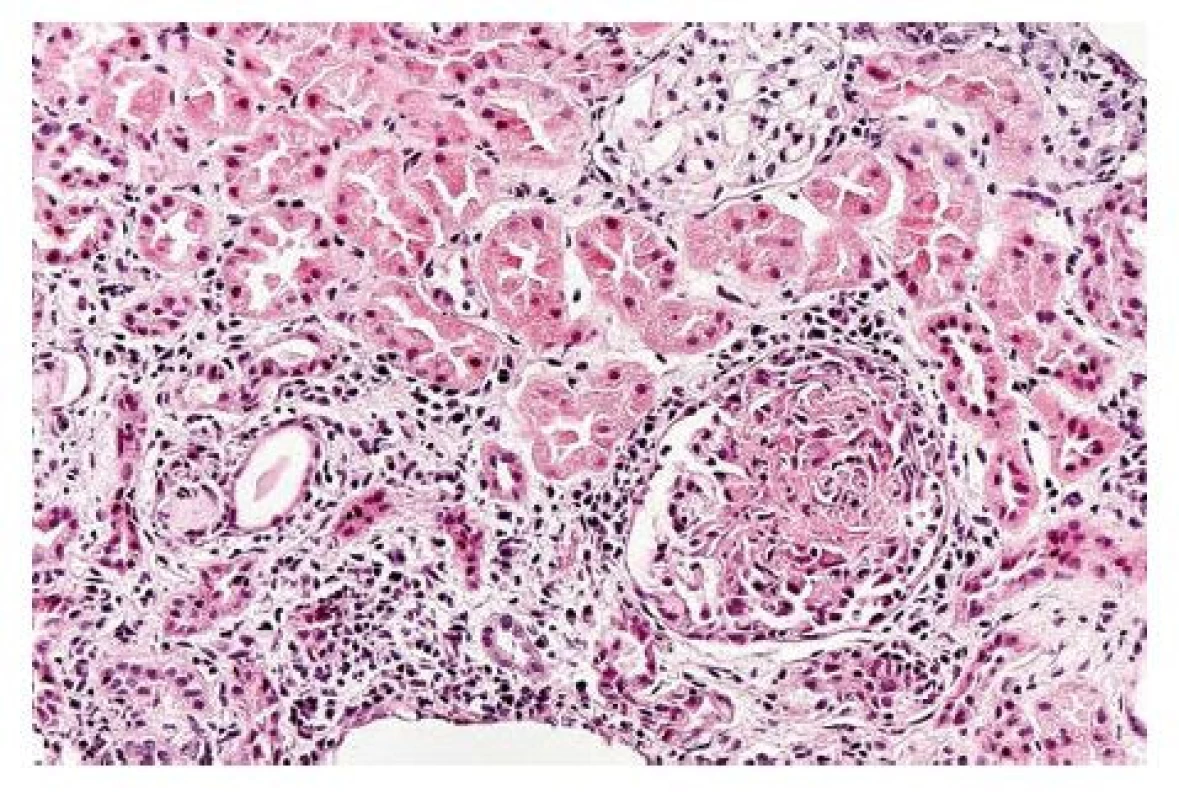
Zopakována kultivace z defektu a z moči, kde byl potvrzen masivní výskyt Pseudomonas aeruginosa a nově vykultivován vankomycin rezistentní Enterococcus faecium. Defekty byly denně ošetřovány a převazovány (obr. 4a,b).
Obr. 4. a, b Defekty na pravé dolní končetině – začátek imunosupresivní terapie (archiv autorů) 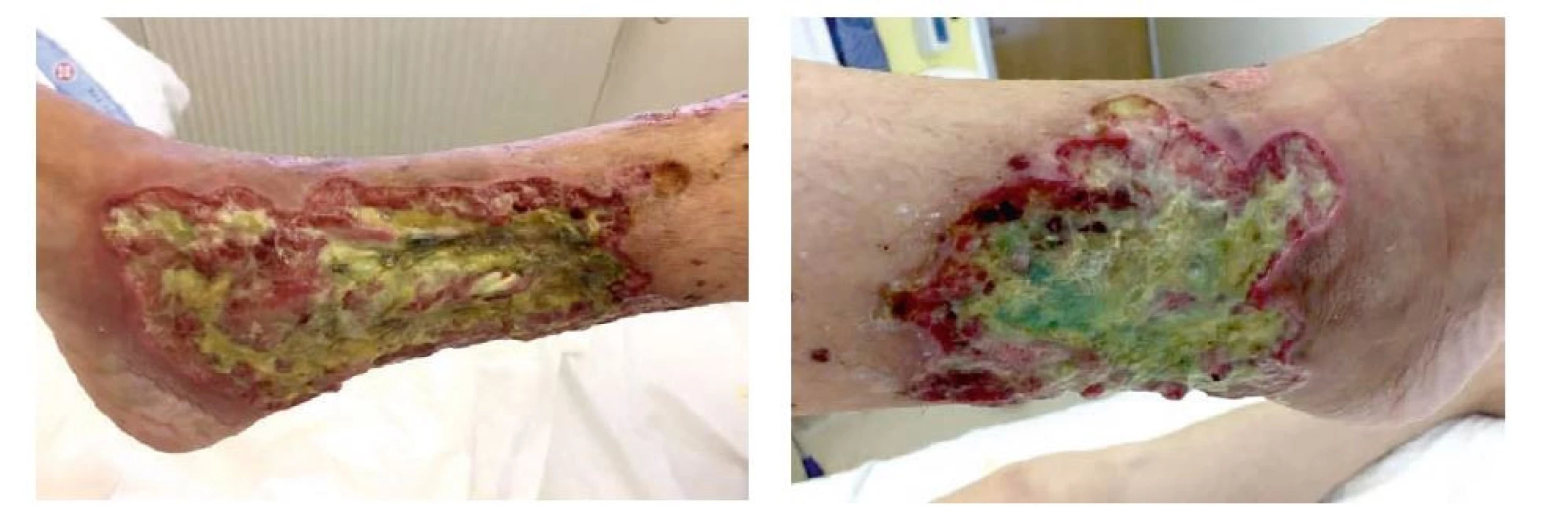
Před zahájením imunosupresivní terapie byl proveden odběr Quantiferonu a sérologie virových hepatitid – vše negativní. Terapie byla zahájena podáním pěti pulzů metylprednisolonu (500 mg i.v. obden), následně probíhalo sedm plazmaferéz prokládaných dvěma intravenózními pulzy cyklofosfamidu (v redukovaných dávkách – první 5,3 mg/kg a druhá 8,9 mg/kg). K redukci dávek jsme se přiklonili z důvodu rizika infekce v ulceraci pravého bérce. Klinicky došlo ke zlepšení stavu pacientky, která již byla nadále afebrilní, udávala mírnější bolestivost pravého bérce (VAS 1/4). Defekt pokrýval asi cirkumference pravého bérce s fokusy žlutavých povlaků (obr. 5a,b).
Obr. 5. a, b Defekty na pravé dolní končetinĕ − při propuštĕní, 9 týdnů po zahájení imunosupresivní léčby (archiv autorů) 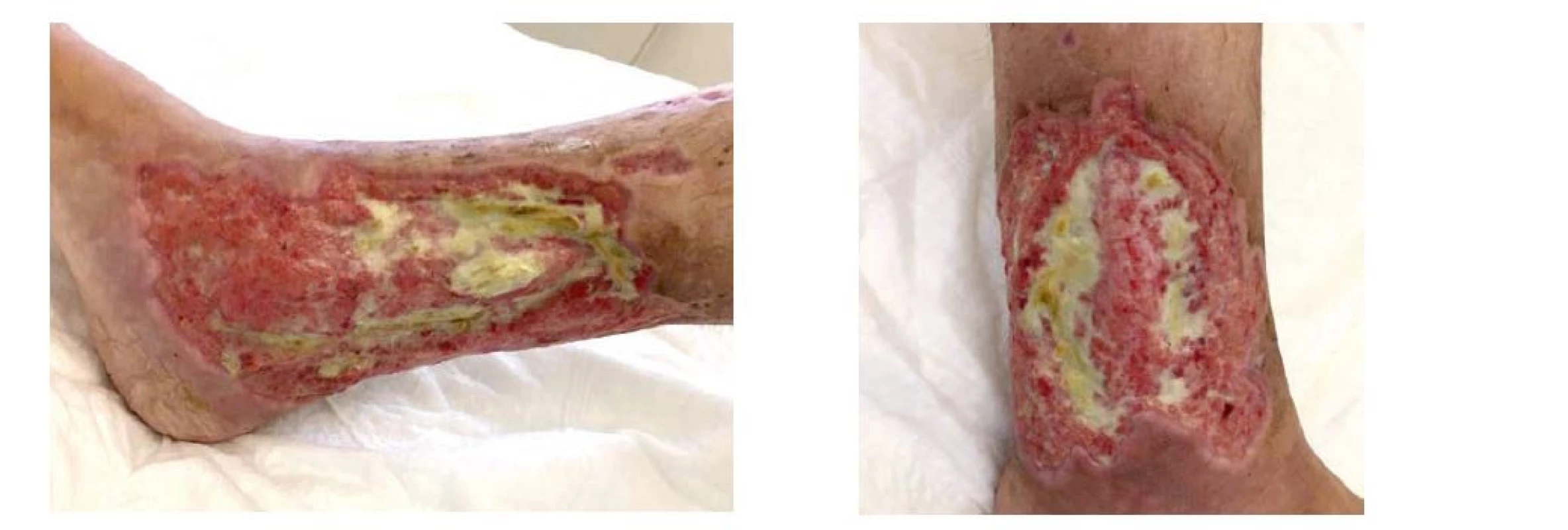
Laboratorně došlo k poklesu ANCA protilátek (z 2416 IU/ml na 95,35 IU/ml), dále došlo k normalizaci hodnot CRP, snížena leukocytóza (14 x 109/l) a trombocytóza (z 807 x 109/l na 758 x 109/l). Pacientka byla předána do ambulantní péče revmatologa a ambulance léčby chronických ran. Po 2 měsících od propuštění do domácí péče se pacientka cítí dobře, defekty se zdárně hojí (obr. 6a,b). Poslední fotodokumentace hojení defektu po 6 měsících od propuštění (obr. 7).
Obr. 6. a, b Defekty na pravé dolní končetině – 2 měsíce od propuštění (archiv autorů) 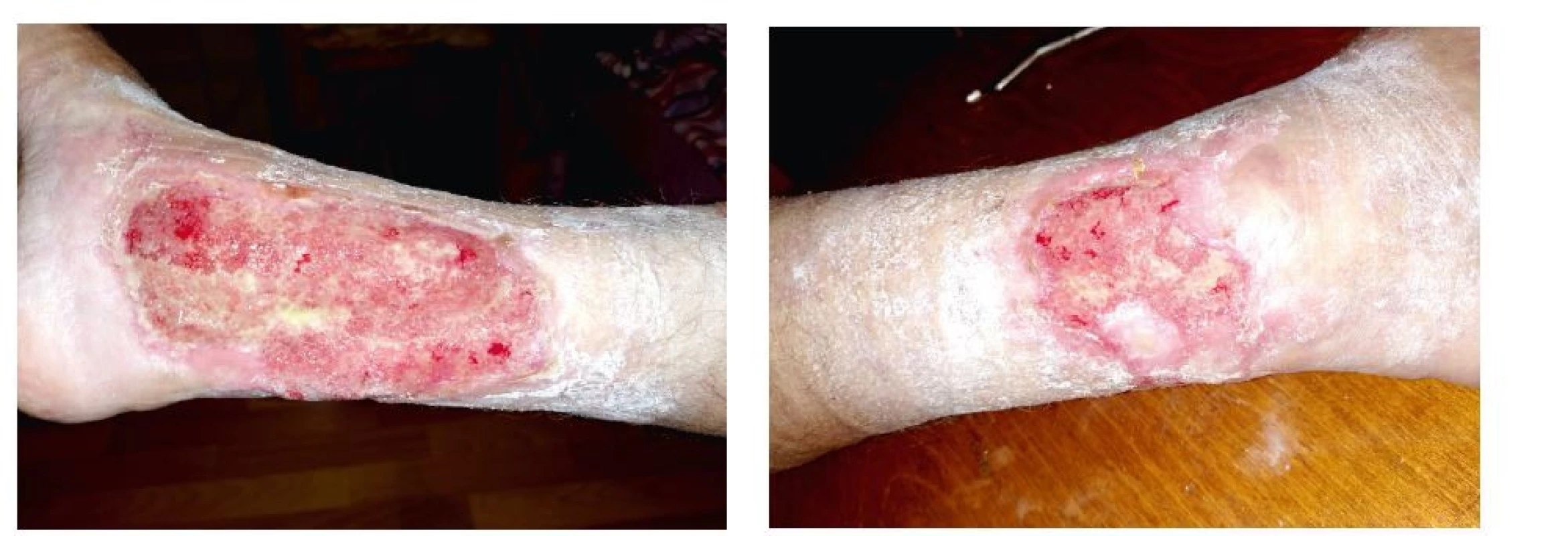
Obr. 7. Defekt na pravé dolní končetinĕ − 6 mĕsíců od propuštĕní (archiv autorů) 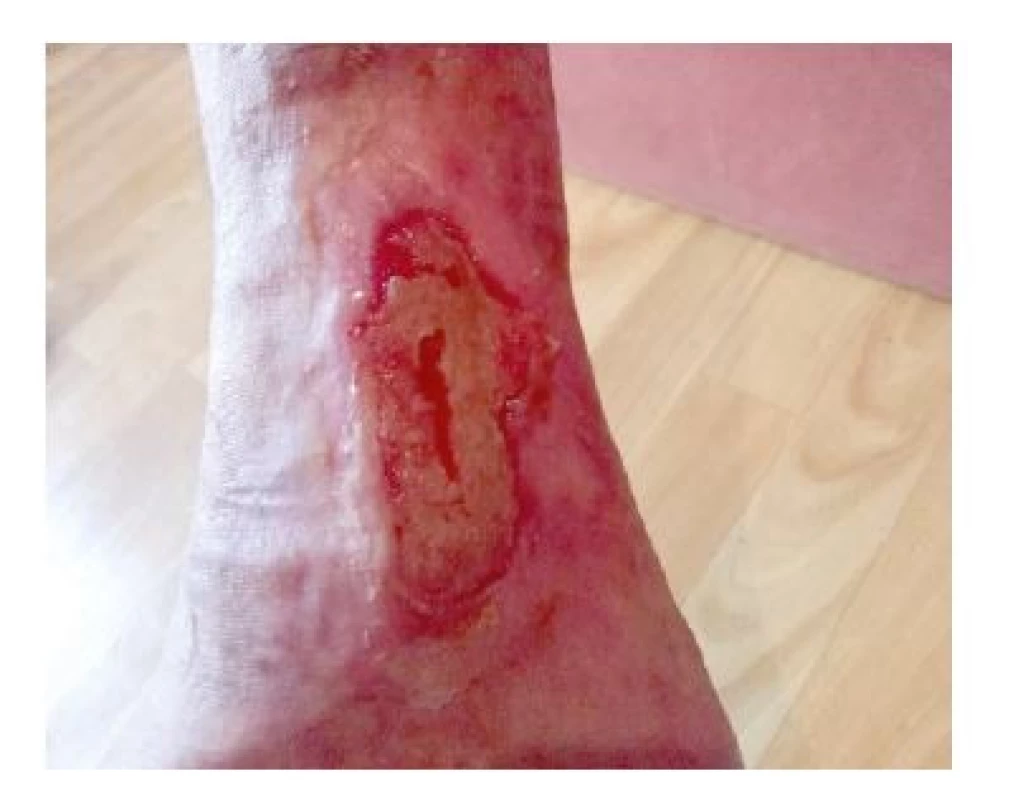
DISKUZE
Jedná se v naší kazuistice skutečně o diagnózu PG nebo jsou ulcerace přidružené k ANCA vaskulitidě?
Abychom mohli stanovit diagnózu PG, která je především diagnózou klinickou, musíme na toto vzácné onemocnění vůbec pomyslet. V našem případě nás k tomu vedla rychlost vzniku a lokalizace defektů, spojitost s malým zevním poraněním (test na patergii nebyl proveden), vyloučení ischemické a infekční příčiny (tři negativní stěry), chybějící odpověď na antibiotickou terapii a následně potvrzení histologickým vyšetřením z biopsie defektu. Pacientka tedy splnila jedno hlavní kritérium (biopsie byla provedena z okraje vředu a prokázala přítomnost neutrofilního infiltrátu) a pět vedlejších diagnostických kritérií dle nejnovější Maverakisovi klasifikace z roku 2018 (viz tab. 2).
Co se týče diagnostiky námi zjištěné přidružené ANCA nekrotizující vaskulitidy – typu granulomatózy s polyangiitidou, pacientka splnila přítomnost dvou ze čtyř diagnostických kritérií dle klasifikace z roku 1990 (viz tab. 1).
Biopsie z bércových defektů nepodpořila vaskulitickou etiologii. Ve vyšetřovaném vzorku nebyla nalezena fibrinoidní nekróza cévní stěny. Okraje rány nejevily známky vaskulitidy.
Terapie PG je vždy dlouhá a komplikovaná. Lokální ošetřování defektů bývá kontraproduktivní. Po invazivním zákroku bývá tendence ke zhoršení defektu. Již ve spádu byla zahájena kortikoterapie. Teprve po definitivním stanovení diagnózy ANCA nekrotizující vaskulitidy jsme zahájili terapii podáním pěti pulzů metylprednisolonu obden. Vzhledem k vysokému titru ANCA protilátek – proti proteináze 3 a zjištění superinfekce vankomycin rezistentním enterokokem, který byl vykultivován v moči a ze stěru z defektu, jsme terapii následně es - kalovali plazmaferézami. Celkem pacientka absolvovala sedm cyklů plazmaferéz, při kterých došlo k výraznému poklesu ANCA protilátek. Zároveň jsme aplikovali dva cykly cyklofosfamidu v redukovaných dávkách, ty jsme ambulantně postupně navyšovali. Aktuálně z naší medikace pacientka užívá denně azathioprin v dávce 100 mg a prednison v dávce 10 mg.
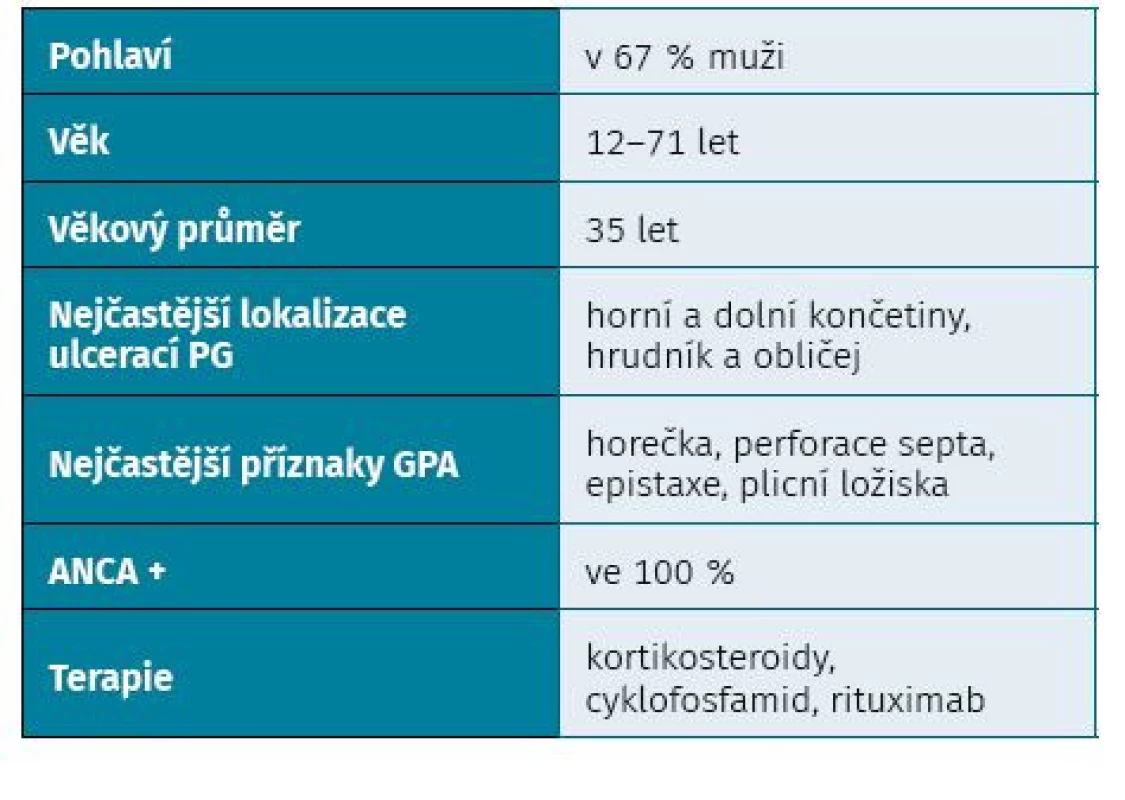
V databázi PubMed jsme dohledali případy PG asociované s nekrotizující ANCA vaskulitidou. Od roku 2000 bylo popsáno pouze 18 případů. Základní informace o pacientech jsme sepsali do přehledové tabulky (tab. 3). Jednalo se v 67 % o muže s průměrným stářím 35 let, laboratorně ve 100 % s ANCA pozitivitou a nejčastější lokalizace ulcerací byla na končetinách, hrudníku a na hlavě. V léčbě převládala kortikoterapie, terapie cyklofosfamidem a monoklonální protilátkou – rituximabem (tab. 4). Také proto jsme se rozhodli naši kazuistiku zpracovat a připomenout si vzácné a velmi závažné onemocnění, na které musíme v diferenciální diagnostice nehojících se ulcerací pomýšlet.
Tab. 3. Přehled pacientů s pyoderma gangrenosum asociovaných s ANCA vaskulitidou od roku 2000 podle databáze PubMed (1Ł−30) 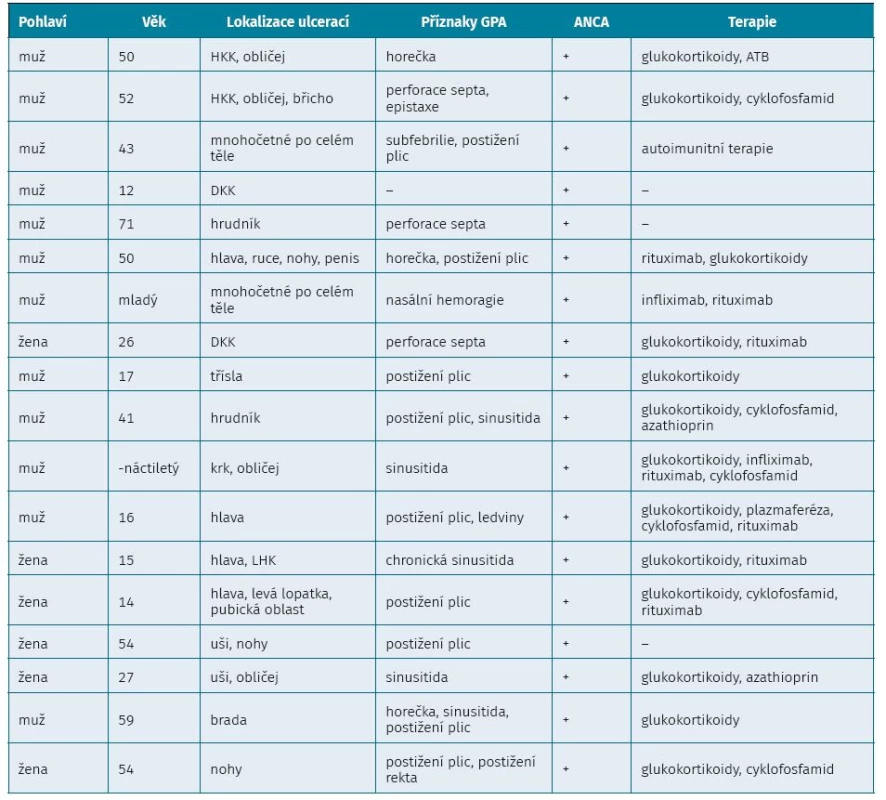
PG – pyoderma gangrenosum, GPA – granulomatóza s polyangiitidou ZÁVĚR
V naší kazuistice bylo primárně diagnostikováno PG a následně zjištěna přidružená ANCA vaskulitida typu granulomatózy s polyangiitidou, která byla u pacientky zatím bez klinických příznaků. Pyoderma gangrenosum je vzácné onemocnění, až 3/4 případů asociované s jiným systémovým onemocněním, proto je velmi důležité v rámci diferenciální diagnostiky na něj nezapomenout. Vzhledem k zahájení včasné terapie PG a GPA nedošlo u naší pacientky k postižení funkce ledvin. Je nutné neopomínat diagnózu PG i v opačných případech, a to u pacientů léčených s revmatologickým onemocněním, u kterých se objeví bolestivé nehojící se ulcerace. Dále je nutné upozornit na chirurgické ošetřování ulcerací, které se nesmí provádět, jelikož onemocnění zhoršuje. PG může probíhat velmi rychle a agresivně, to byl případ i naší pacientky, která byla ve spádu informována i o možnosti amputace postižené končetiny.
Adresa pro korespondenci:
doc. MUDr. Tomáš Soukup, Ph.D.
II. interní gastroenterologická klinikaLF UK a FNSokolská 581500 05 Hradec Královée-mail: : tomas.soukup@fnhk.czAutoři prohlašují, že nejsou v konfliktu zájmů.Do redakce doručeno: 20. 9. 2021PoděkováníDěkuji především zdravotním sestrám a lékařskému kolektivu, který se podílel na péči o pacientku. Dále kolegům jiných odborností účastnících se na tomto případu a také pacientce za pořízenou fotodokumentaci.
Čes. Revmatol. 2021; 29(3): 228−236
Zdroje
1. Pavelka K. Klinická revmatologie. Praha: Galén 2018; 412–415.
2. Pavelka K. Klinická revmatologie. Praha: Galén 2018; 636.
3. Bečvář R, Tesař V. Vaskulitidy v klinické praxi – diagnostika a terapie. Praha: Medprint 1994; 94–103.
4. Martinková K, Valkovský I, Handlos P. Granulomatóza s polyangiitidou. Interní Med 2014; 16 : 199–201.
5. Yates M, Watts A, Bajema IM, Cid MC, Crestani B, Hauser T, et al. Eular/ERA-EDTA recommendations for the management of ANCA associated vaskulitis. Ann Rheum Dis 2016; 75 : 1583–1594.
6. Bečvář R. Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid. Vnitř. Lék. 2018; 64 : 164–168.
7. Leavitt RY, Fauci AS, Bloch DA, Michel BA, Hunder GG, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener's granulomatosis. Arthritis Rheum 1990; 33(8): 1101–1107.
8. Hrnčíř Zb, Sobotka L, Pospíšil M, Prášil P, Brtková J, Laco J. Pyoderma gangrenosum a nekrotizující arteritida u pozdně začí - nající revmatoidní artritidy. Čes. Revmatol. 2018; 26 : 59–63.
9. Stefflová E. Pyoderma gangraenosum. Prakt. Lék. 2003; 9 : 522 – 523.
10. Jarčušková D, Benečová K, Ficová M, Jautová J. Pyoderma gangraenosum – klinické aspekty, liečba. Čes-slov. Derm. 2002; 80–83.
11. Zarraga M, Swenson N, Glick B. Pyoderma Gangrenosum - associated granulomatosis with Polyangitis: A Case Report and Literature Review. J Clin Aesthet Dermatol 2017; 10(10): 40–42.
12. Oakley A. Pyoderma gangrenosum. 2015, https://dermnetnz. org/topics/pyoderma-gangrenosum/
13. Gastman B, Hashem AM, Djohan R, Bernard S, Hendrickson M, Schwarz G, et al. Malignant pyoderma associated with granulomatosis with polyangiitis (Wegener granulomatosis) as a unique indication for facial vascularized composite allotransplantation. Plastic Reconstructive Surgery 2016; 137(6): 1007e–1015e.
14. Genovese G, Tavecchio S, Berti E, Rongioletti F, Marzano AV. Pyoderma gangrenosum-like ulcerations in granulomatosis with polyangiitis: two cases and literature Review. Rheumatol Int 2018; 38 : 1139–1151.
15. Tashtoush B, Memarpour R, Johnston Y, Ramirez J. Large pyoderma gangrenosum-like ulcers: a rare presentation of granulomatosis with polyangiitis. Case Rep Rheumatol 2014; 14 : 850364.
16. Jorgaqi E, Fida M, Janushaj E, Mala R, Vasili E. A rare case of granulomatous Wegener with multiple pyoderma gangrenosum-like ulcers. Dermatol Ther 2020; 33(2): e13255.
17. Moen BH, Nystad TW, Barrett TM, Sandvik LF. A boy in his teens with large ulcerations of the head and neck. Tidsskr Nor Laegeforen 2019; 8 : 139.
18. Kass A, Fagan JD, Long P. Granulomatosis with Polyangiitis Presenting with Pyoderma Gangrenosum-Like Ulceration and Negative Cytoplasmic Antineutrophilic Cytoplasmic Antibodies in a Child. Pediatr Dermatol 2017; 34(5): e231–e234.
19. McConnell B, Said MS, Ramakrishnan VR. Nasal septal perforation associated with pyoderma gangrenosum. Allergy Rhinol (Providence) 2015; 6(2): 122–124.
20. Oz RS, Onajin O, Harel L, Tal R, Dallos T, Rosenblatt A, et al. Pyoderma gangrenosum-like ulceration as a presenting feature of pediatric granulomatosis with polyangiitis. Pediatr Rheumatol Online J 2021; 19(1): 81.
21. Donmez S, Pamuk ON, Gedik M, Recep AK, Bulut G. A case of granulomatosis with polyangiitis and pyoderma gangrenosum successfully treated with infliximab and rituximab. Int J Rheum Dis 2014; 17(4): 471–475.
22. Murthy RK, Jackson J, Chatham WW, Sami N. Extensive Pyoderma Gangrenosum Associated With Granulomatosis With Polyangiitis With Both Responsive to Rituximab. J Clin Rheumatol 2016; 22(7): 393–395.
23. Kindle SA, Camilleri MJ, Gibson LE, Davis MDP. Granulomatosis with polyangiitis mimicking classic inflammatory bowel disease-associated pyoderma gangrenosum. Int J Dermatol 2017; 56(1): e1–e3.
24. Gallo DJ, Planelles CA, Barrios ML, Hernández CR, Rodríguez AM, Moreno EG, et al. Pyoderma gangrenosum and Wegener granulomatosis-like syndrome induced by cocaine. Clin Exp Dermatol 2013; 38(8): 878–882.
25. Bittencourt MJS, Soares LFB, Lobato LS, Mançano AD, Leandro HSC, Fonseca DMD. Multiple cavitary pulmonary nodules in association with pyoderma gangrenosum: case report. An Bras Dermatol 2012; 87(2): 301–304.
26. Sinovich V, Snow J. Protracted superficial Wegener's granulomatosis. Australas J Dermatol 2003; 44(3): 207–214.
27. Hello CL, Bonte I, Mora JJ, Verneuil L, Noël LH, Guillevin L. Pyoderma gangrenosum associated with Wegener's granulomatosis: partial response to mycophenolate mofetil. Rheumatology (Oxford) 2002; 41(2): 236–237.
28. Szõcs HI, Torma K, Petrovicz E, Hársing J, Fekete G, Karpati S, et al. Wegener's granulomatosis presenting as pyoderma gangrenosum. Int J Dermatol 2003; 42(11): 898–902.
29. Kishore S, Mittal V, Ahuja S, Majithia V. When a wound is the harbinger of a serious underlying systemic illness. BMJ Case Rep 2018; 31: bcr2017222491.
30. Haun P, Wanchu A, Korcheva V, Fett N. A Preauricular Ulcer in a Patient With Conjunctival Injection and Persistent Lacrimation: Challenge. Am J Dermatopathol 2016; 38(3): 211, 244–245.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2021 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Etiketa pro lékaře, zdravotníky a pomáhající profese
- Vliv pohlaví na závažnost onemocnění a terapeutickou odpověď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatrickou artrididou léčených cílenými chorobu - modifikujícími léky v České republice
- Vliv pohlaví na závažnost onemocnĕní a terapeutickou odpovĕď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatickou artritidou léčených jeden rok certolizumab peIolem - analýza z národního registru biologické léčby ATTRA
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u mužů
- Blokáda interleukinu-1 v léčbĕ systémové juvenilní idiopatické artritidy a Stillovy nemoci se začátkem v dospĕlosti
- ANCA asociovaná vaskulitida s ulceracemi kůže bérců, klinicky odpovídající pyoderma gangrenosum
- KALENDÁŘ AKCÍ ČRS V ROCE 2022
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- ANCA asociovaná vaskulitida s ulceracemi kůže bérců, klinicky odpovídající pyoderma gangrenosum
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u mužů
- Blokáda interleukinu-1 v léčbĕ systémové juvenilní idiopatické artritidy a Stillovy nemoci se začátkem v dospĕlosti
- Vliv pohlaví na závažnost onemocnění a terapeutickou odpověď u pacientů s revmatoidní artritidou, axiální spondyloartritidou a psoriatrickou artrididou léčených cílenými chorobu - modifikujícími léky v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání