-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVybrané patologické stavy ovlivňující receptivitu endometria
Selected pathological conditions affecting endometrial receptivity
Objective: A summary of new knowledge on embryo implantation in dependence on quality of the endometrium. Methods: Literature review from August 2022 of the relevant publications in Web of Science, Scopus and PubMed/Medline databases, focused on “endometrial receptivity”, “polycystic ovary syndrome”, “endometriosis”, “SARS-CoV-2”. Results: The receptive state of the endometrium is a result of physiological remodeling and immune system activity modulated by the microbiome. This balance can be disturbed by myomas, polyps, sactosalpings, adenomyosis, endometriosis, polycystic ovary syndrome, infections. The effect of SARS-CoV-2 infection is being discussed. For a successful implantation, timing of transfer is crucial. The ultrasound examination is used conventionally. In specific cases, hysteroscopy and endometrium biopsy are recommended. Histological and immunohistochemical evaluation is performed together with examination of microbiome or transcriptome. To support the implantation, gestagenes are used, or metformin in the patients with polycystic ovary syndrome. In cases of a repeated implantation failure, the intrauterine infusion of mononuclear cells or platelet rich plasma is used, subcutaneous application of granulocyte colony stimulating growth factor, intravenous application of atosiban or intrauterine application of human chorionic gonadotropin. Conclusion: Recent research in the field of transcriptomics, proteomics and reproductive immunology uncovers the process of implantation more deeply and opens a new stage of the assisted reproduction.
Keywords:
Endometriosis – adenomyosis – SARS-CoV-2 – proteome – implantation – receptivity of endometrium – polycystic ovaries – secretome
Autoři: Lenka Mekiňová 1
; Michal Ješeta 1
; I. Crha 1,2
; K. Crha 1
; Jan Vodička 3
; Robert Hudeček 1
; Kateřina Remundová 1
; E. Matušková 1
; Radovan Pilka 3
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Ústav zdravotnických věd, LF MU Brno 2; Porodnicko-gynekologická klinika LF UP a FN Olomouc 3
Vyšlo v časopise: Ceska Gynekol 2022; 87(6): 416-422
Kategorie: Přehledový článek
doi: https://doi.org/10.48095/cccg2022416Souhrn
Cíl: Shrnutí nových poznatků v oblasti implantace embrya v závislosti na kvalitě endometria. Metodika: Rešerše literatury publikované do srpna 2022 v databázích WoS, Scopus, PubMed/Medline se zaměřením na „endometrial receptivity“, „polycystic ovary syndrome“, „endometriosis“, „SARS-CoV-2“. Výsledky: Receptivní stav endometria je výsledkem fyziologické remodelace, činnosti imunity modulované mikrobiomem. Tuto rovnováhu narušují myomy, polypy, saktosalpingy, adenomyóza, endometrióza, syndrom polycystických vaječníků, infekce. Diskutuje se dopad infekce SARS-CoV-2. Pro úspěšnou implantaci je klíčové časování embryotransferu. Konvenčně se pro tyto účely využívá ultrazvuk. Ve specifických případech hysteroskopie a biopsie endometria. Vzorek se hodnotí histologicky, imunohistochemicky, vyšetřuje se mikrobiom anebo transkriptom. Jako podpora implantace jsou využívány gestageny, u syndromu polycystických ovarií metformin. U opakovaného selhání implantace intrauterinní infuze mononukleárů, plazmy bohaté na destičky, subkutánní aplikace granulocyty stimulujícího růstového faktoru, intravenózní podání atosibanu, intrauterinní aplikace choriogonadotropinu. Závěr: Nejnovější výzkumy na poli transkriptomiky, proteomiky a reprodukční imunologie hlouběji odkrývají implantaci a otvírají novou etapu asistované reprodukce.
Klíčová slova:
Endometrióza – receptivita endometria – adenomyóza – SARS-CoV-2 – proteom – implantace – polycystické vaječníky – sekretom
Úvod
Porucha implantace embrya patří k významným faktorům, které omezují úspěšnost léčby metodami asistované reprodukce. Správná funkce děložní sliznice může být nepříznivě ovlivněna endometriózou, syndromem polycystických ovarií, zánětem nebo jinými patologiemi. Lze říct, že až 2/3 neúspěchu jsou připisovány na stranu receptivity endometria [1]. Intenzivní výzkum s využitím molekulární genetiky přinesl v této oblasti důležité poznatky o jednotlivých fázích implantace, jejich řízení a možné implementaci do klinické praxe. Cílem této práce je uvést stručný přehled současných poznatků o receptivitě endometria, implantaci embrya, nových metodách stanovení faktorů receptivity a možnostech léčby.
Definice – receptivita endometria, implantační okno
Receptivita je schopnost endometria umožnit embryu úspěšnou implantaci. Je to vícekrokový děj řízený signály vycházejícími jak z embrya, tak z dělohy [2]. Když je transferováno euploidní embryo, receptivita endometria je poslední překážkou úspěchu IVF (in vitro fertilizace). Přechod mezi nereceptivní a receptivní fází je dynamický děj [3]. Průměrně v 28denním ovulačním cyklu by mělo být endometrium receptivní přibližně kolem 7. dne od vrcholu LH píku (LH – luteinizační hormon), v hormonálně substituovaném cyklu 120 hod od první dávky progesteronu [4–6]. Délka otevření implantačního okna ale není u všech žen identická a embryo (endometriální asynchronie) může být důvodem implantačního selhání [3].
Receptivní stav endometria je výsledkem fyziologické remodelace, koordinované činnosti imunitního systému a děložního mikrobiomu (obr. 1) [2,7,8].
Obr. 1. Receptivní stav endometria je výsledkem fyziologické remodelace, koordinované činnosti imunitního systému a děložního mikrobiomu.
Fig. 1. The receptive state of the endometrium is the result of physiological remodeling, coordinated activity of the immune system and the uterine microbiome.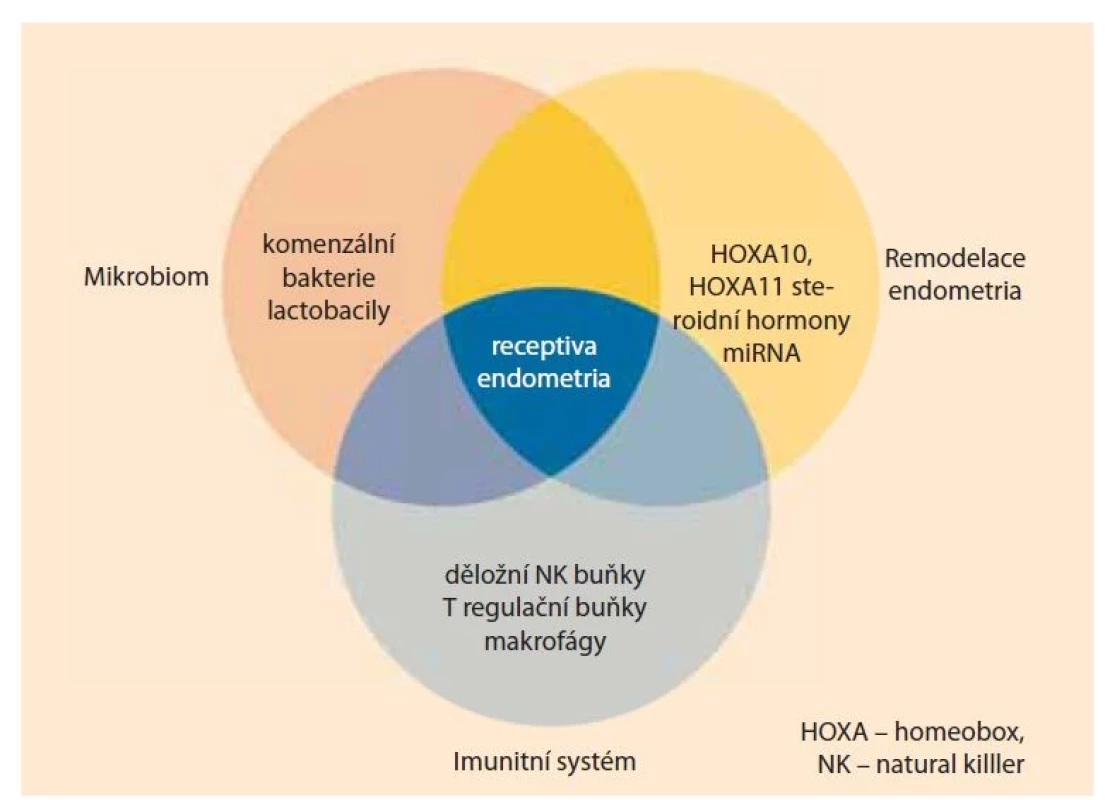
Remodelace endometria
V průběhu menstruačního cyklu dochází vlivem kaskádové aktivace a inaktivace specifických genů ze skupiny homeobox – HOXA 10 a 11 k morfologické přestavbě endometria [2,9]. Tento proces je regulován cyklickými změnami ovariálních steroidů [10], které ovlivňují signální dráhy prostřednictvím proteinů a cytokinů [9].
Steroidní hormony jsou esenciální jak ve vztahu k implantaci, tak k probíhajícímu těhotenství [8]. Cyklus startuje menstruace a následně přes fázi regenerace vlivem estrogenu dochází k proliferaci buněčné komponenty (proliferační fáze). Po ovulaci v sekreční fázi se působením progesteronu endometrium transformuje [10]. Tato fáze je charakteristická edémem stromatu, zvýšenou sekrecí, prodlužováním spirálních arteriol, diferenciací fibroblastů [11]. Mění se koncentrace adhezivních molekul (intergrinů, selektinů, osteopontinu, kadherinů, opolipoproteinu D a mucinu, např. Mucin 1 (MUC-1) [2,9] a dochází ke změnám ve složení glykokalyxu [8].
Morfologické znaky fyziologického endometria
Pinopodie
Na apikální straně epitelových buněk endometria se v sekreční fázi objevují pinopodie – drobné hormondependentní organely, jejichž funkce je stále předmětem zkoumání. Zdá se, že zvětšením povrchu buňky usnadňují adhezi embrya [8]. Existuje přímá korelace mezi počtem pinopodií, hustotou progesteronových receptorů a hladinami progesteronu. Změny hladin estrogenů pak souvisí s jejich degenerací [12]. Recentní data ukazují, že počet a hlavně zralost pinopodií by mohly odrážet stupeň receptivity endometria a pozitivně korelovat s úspěšnou implantací [13].
Nucleolar channel system
Kromě pinopodií se jeví jako další morfologický znak, který má slibný potenciál jako marker receptivity endometria, nucleolar channel system (NCS). Je to systém několika vrstev cisteren a kanálků v buněčném jádře charakteristický pro postovulační endometrium. Tato drobná mikrostruktura pomáhá synchronizovat vývoj endometria a má roli v otvírání implantačního okna. Analýza buněk endometriálního sekretu ukazuje vyšší koncentraci NCS u těhotných žen v porovnání s netěhotnými. To navozuje myšlenku, že by detekce NCS mohla být použita k určení optimálního období pro implantaci [12].
Mucin 1
Vlivem progesteronu ve střední luteální fázi dochází ke změnám aktivity adhezivních molekul. MUC-1 pokrývá místa nevhodná pro hnízdění embrya a působí zde jako bariéra. Působením hormonálních změn dochází ke snížení koncentrace MUC-1 v místě implantace a zvýšení množství integrinů avb3, které mimo jiné zabezpečují adhezi embrya k epitelovým buňkám endometria [2,8].
Molekulárně biologické znaky fyziologického endometria
Matrix metaloproteinázy
Hlavní roli v cyklické remodelaci endometria a implantaci mají proteolytické enzymy – matrix metaloproteinázy (MMP) a jejich inhibitory [12]. Podílejí se na regulaci růstu tkáně, novotvorbě cév, apoptóze buněk. Mezi nejdůležitější enzymy patří stromální MMP-2, který udržuje architektoniku endometria. Vlivem estrogenů stoupá koncentrace MMP-2 až do pozdní sekreční fáze, kdy se působením progesteronu jeho exprese sníží, což nastartuje menstruaci. Nedílnou součástí procesu implantace je enzym MMP-9, který se podílí na štěpení kolagenu extracelulární matrix. Je aktivován přes MMP-26, jeho exprese je regulována homebox geny [9].
MikroRNA
Regulace genové exprese je klíčová pro funkční transformaci endometria. Tuto úlohu zajišťují mikroRNA (miRNA). Jsou to malé RNA, které nekódují proteiny, ale ovlivňují expresi genů. Tento proces je dobře prostudován u nádorových onemocnění, nicméně jejich role u implantace embrya je zatím předmětem zkoumání [4,12,14]. Chen et al [15] reportovali tři miRNA získané biopsií endometria, které s 90% přesností predikovaly neúspěšnou implantaci.
Kromě přímého působení miRNA v buňce studie naznačují, že endometriální buňky secernují miRNA i do krve, a tak je transportují na určené místo. Detekování miRNA z plazmy by mohlo sloužit jako nový neinvazivní biomarker receptivity endometria [14,15]. Zeng et al [14] popsali 13 kandidátních miRNA, které se v krvi lišily u pacientek s neúspěšnou implantací. Jak autor uvádí, jsou to pilotní data, nicméně naznačují rozdílný miRNA profil u žen s neúspěšnou implantací jak v endometriu, tak i v plazmě a mají slibný potenciál k dalšímu zkoumání [14].
Imunitní systém endometria a implantace
V endometriu se mění vlivem cyklických hormonálních změn kromě morfologie i složení buněk imunitního systému, které jsou součástí populace endometria. Nachází se rozptýleně mezi epitelovými buňkami zona functionalis nebo v lymfoidních formacích v zona basalis. Ve zdravém endometriu dominují v proliferační fázi T lymfocyty, následované děložními NK buňkami (NK – natural killer) a makrofágy. V sekreční fázi naopak v 70–80 % převládají u NK buňky, v menší míře makrofágy a T lymfocyty, což odráží jejich rozdílnou roli v závislosti na cyklu. Populace makrofágů a dendritických buněk stoupá v perimenstruačním období a podílí se na odklízení odstranění apoptotických buněk a podporuje regeneraci [11].
Přirození zabíječi (NK buňky) patří mezi klíčovou složku imunitního systému, stojící v první linii obrany proti virovým patogenům a nádorovému růstu. Ve zdravém endometriu převažují NK buňky s nízkou cytotoxickou aktivitou nesoucí znaky CD9+CD3−CD56HighCD16Low [7,8]. Hrají zde důležitou roli v procesu migrace trofoblastu a remodelace spirálních arterií, produkují ochranné cytokiny (IL-10 a TNF a) VEGF a angiotensin 2, a tím se účastní angiogeneze [11].
T regulační lymfocyty modulují imunitní systém směrem k embryu a pomáhají nastolit imunologickou toleranci. Přirozeně jejich počet dosahuje vrcholu v pozdní proliferační fázi a klesá v průběhu sekrece, což je důležité pro nastavení vhodných podmínek pro implantaci [11].
Mikrobiom
Komenzální mikroorganizmy modulují fyziologické funkce mnoha orgánů. Původní idea sterilního prostředí v dutině děložní byla již opakovaně zpochybněna. Nové diagnostické přístupy zahrnující využití analýzy ribozomální RNA (16SrRNA) podporují teorie o možném vlivu mikrobiální flóry horního genitálního traktu na implantaci [2]. I když diskutující nedokáží zcela vyloučit „mrtvé“ buňky a kontaminaci při RNA sekvenaci, zdá se být modulační efekt na imunitní odpověď logickou úvahou. Právě ovlivnění imunity se zdá být klíčovým faktorem úspěšné nidace. Neméně důležitá je pak pomoc při odbourávání škodlivin a přímá blokace množení patologických mikroorganizmů soutěžením o živiny [16].
Fyziologická implantace
Fyziologicky je v průběhu apozice blastocysta naváděna do místa nidace svým embryonálním pólem. Ve fázi adheze dochází k přímému kontaktu s endometriem prostřednictvím specifických adhezivních molekul [8,9]. Dalším krokem je destrukce epitelových buněk sliznice a enzymatické narušení endometriálního stromatu. V průběhu implantace vysoké hladiny progesteronu urychlí proces decidualizace a remodelace spirálních arterií [12]. Nakonec implantující se embryo proniká deciduou a dosahuje až k cévám [9,11]. Zde formuje vlastní mikrocirkulaci na fetomaternálním rozhraní v kooperaci s imunitními buňkami a deciduálními buňkami ve stromatu [12].
Patologické procesy se vztahem k receptivitě endometria
Úspěšná implantace je výsledkem křehké rovnováhy mezi embryem a receptivním endometriem, kterou mohou narušit četné patologické stavy (obr. 2). Potenciálně negativní vliv mají anatomické odchylky – vrozené vady dělohy, submukózní myomy, endometriální polypy, saktosalpingy [3], adenomyóza [17], systémové onemocnění – endometrióza [11], syndrom polycystických vaječníků [12], narušený mikrobiom s převahou ne-laktobacilových druhů či infekce sexuálně přenosnými nemocemi [8,16]. Nově se v diskutuje i možný negativní dopad po prodělání infekce virem SARS-CoV-2 [18–21].
Obr. 2. Faktory ovlivňující receptivitu endometria.
Fig. 2. Factors affecting endometrial receptivity.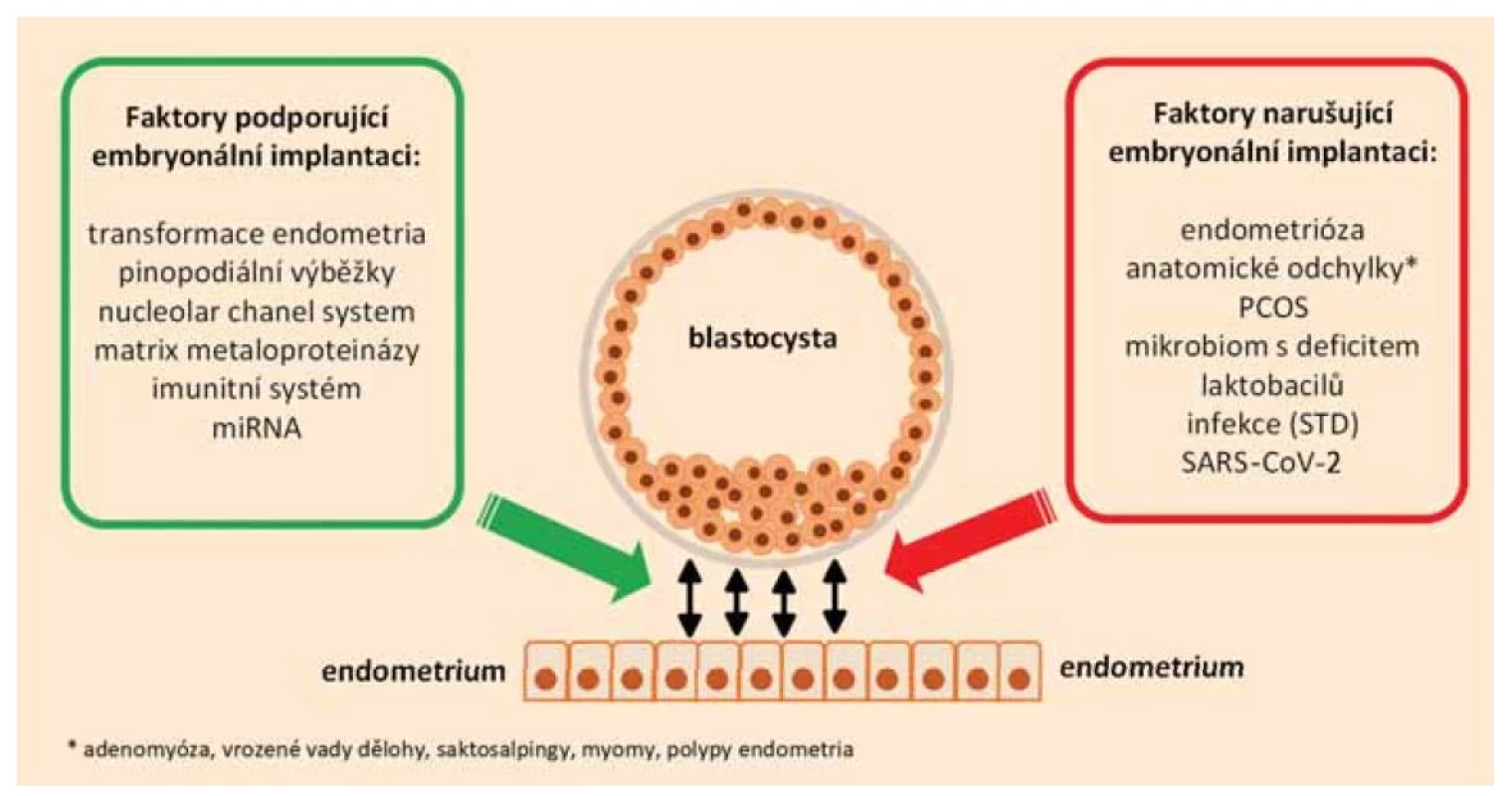
V další části příspěvku budou podrobněji rozebrány vybrané patologie s eventuální možností jejich ovlivnění.
Endometrióza a implantace
Endometrióza je estrogen-dependentní zánětlivé onemocnění postihující přibližně 30–40 % žen s poruchou plodnosti. Vliv endometriózy na reprodukci je komplexní. Dochází k poškození anatomických struktur jizevnatým procesem, lokální a systémový zánět zhoršuje kvalitu oocytů a moduluje pochody v procesu implantace [11]. Bylo zjištěno, že u endometriózy může docházet k modifikaci transkripčního faktoru HOXA10 přes SUMO1. To má za následek narušení exprese proteinu MMP-26, který aktivuje metaloproteinázu MMP-9 důležitou pro štěpení kolagenu [9]. Dále je z důvodů down regulace progesteronových receptorů, a tím vzniklé progesteronové rezistence, narušeno optimální složení adhezivních molekul [8,20]. Selhávání implantace pak nastává v důsledku nedostatečné enzymatické aktivity na straně endometria [9].
Recentní práce dokazují, že průběh implantace je úzce spjat se specifickými imunitními pochody [7–9]. U endometriózy dochází k neadekvátní imunitní odpovědi jak přímo v děloze, tak na periferii. V endometriu v premenstruačním období nestoupá počet makrofágů a dendritických buněk, což se zdá být jeden z důležitých mechanizmů podílejících se na patogenezi nemoci. V době menstruace nejsou efektivně detekovány a odstraňovány poškozené buňky, které následně mohou migrovat do okolních tkání a vytvářet zde lokální ložiska [22].
U žen s endometriózou trpících opakovaným potrácením byla v endometriu popsána převaha cytotoxické aktivity NK buněk a přetrvávající vyšší hladiny T regulačních buněk v sekreční fázi cyklu. Tato imunitní nerovnováha může přispívat k neúspěchům při implantaci a k šíření endometriotických ložisek [11].
Není zatím jasné, zda poškozený imunitní systém přispívá k vzniku nemoci nebo je jeho následek. Zřejmé ale je, že ovlivnění imunity by mohlo hrát klíčovou roli v léčbě endometriózy a využití tohoto nehormonálního přístupu je příslibem pro efektivní terapii infertility u žen s endometriózou [11].
Syndrom polycystických ovarií
Syndrom polycystických ovarií (PCOS) je heterogenní neuroendokrinní onemocnění, vyskytující se u žen ve fertilním věku. Onemocnění výrazně zhoršuje kvalitu života, fyzické a psychické zdraví pacientek [23]. Klinická manifestace zahrnuje poruchy menstruačního cyklu, kožní projevy hyperandrogenemie a poruchy plodnosti. Část pacientek trpí obezitou, je popsán vyšší výskyt kardiovaskulárních onemocnění, diabetu 2. typu [12,23].
V současnosti je PCOS považován za chronické zánětlivé onemocnění. Pacientky vykazují oxidativní stres a zvýšené hladiny C-reaktivního proteinu (CRP). V proliferačním endometriu jsou u těchto pacientek detekovány nadměrné hladiny prozánětlivých cytokinů jako např. TNFa, IL-6. V sekreční fázi jsou v endometriu výrazně snížené hladiny NK buněk. Popsané faktory narušují rovnováhu imunitního systému endometria, což může být příčinou rejekce embrya. Etiopatogeneze tohoto typu chronického zánětu není zcela objasněna [12]. Nejčastěji bývají zvažovány genetické predispozice, nezdravý životní styl a dle recentních studií vliv vysokých hladin endogenních disruptorů, které narušují střevní bariéru [12,24]. Různé prozánětlivé molekuly (TNFa, Il-6, zonulin, lipopolysacharidy) produkované střevními bakteriemi proniknou přes poškozené buněčné spoje do krve, vzniklá endotoxemie pak spustí zánětlivou imunologickou kaskádu [12].
Při procesu implantace endometrium spotřebovává velké množství energie, kterou v hlavní míře získává utilizací glukózy. Cytokiny TNFa a Il-6 nepříznivě ovlivňují inzulinovou signální dráhu, což vede ke vzniku inzulinové rezistence (IR). Inzulinová rezistence spolu s hyperandrogenemií vstupují do děje a narušují fyziologický příjem glukózy buňkami endometria. Kromě toho vlivem inzulinové rezistence dochází k poklesu jednoho z klíčových vazebních proteinů (IGFBP-1), který se podílí na decidualizaci. To vše vede k nedostatečné přípravě endometria na implantaci.
Na rozdíl od zdravých žen dochází u pacientek s PCOS vlivem patologických hormonálních hladin k poruše buněčné přestavby, u žen s poruchou ovulace jsou detekovány výrazně nižší hladiny matrix metaloproteináz (MMP-2 a MMP-9) a nedostatečná maturace pinopodií. To vše se jeví jako důležitý faktor přispívající k redukci receptivity endometria u pacientek s PCOS [12].
Virus SARS-CoV-2 a implantace
Virus SARS-CoV-2 pomocí různých cytokinů spouští zánětlivou reakci v plicní tkáni. Dochází k interakci s receptorem pro angiotenzin – konvertující enzym 2 (ACE2) – a membránovými seriny (TMPRSS2) [25].
Receptor pro ACE2 se ve vysokých koncentracích vyskytuje v placentě, je rozhodující pro decidualizaci, účastní se steroidogeneze a oocytární maturace. Z toho důvodu lze teoreticky předpokládat negativní vliv infekce SARS-CoV-2 na reprodukci, obzvláště u pacientek s přidruženými komorbiditami [18,20,26]. Bylo prokázáno, že virus SARS-CoV-2 dokáže napadnout membránu folikulu a buňky granulózy, objevují se i práce o účinku viru na epitelové buňky endometria [10].
Kromě přímého vlivu infekce SARS-CoV-2 přes ACE2 receptor recentní data zachycují zvýšené hladiny antifosfolipidových protilátek (APA) u infertilních pacientek po prodělání infekce SARS-CoV-2 [18].
Fosfolipidy jsou součástí buněčných membrán a vzniklé protilátky aktivují koagulační kaskádu se všemi negativními důsledky. Přítomnost APA (IgA, IgM, IgG) má souvislost s mikrotrombotizací cévního řečiště nejen v plicích, ale i v placentě [18,20]. V oblasti reprodukce tento stav zvyšuje riziko placentárních příhod, poruch implantace a potratů. Největší význam mají protilátky proti fosfatidylserinu a b2 glykoproteinu [27].
Histopatologové stále častěji v souvislosti s infekcí virem SARS-CoV-2 popisují tzv. SARS-CoV-2 placentitidu. Jedná se o soubor placentárních změn (chronická histiocytární intervilozitida, ukládání fibrinoidu do perivilózního prostoru a nekrózy ve vilózní části trofoblastu). Vznik SARS-CoV-2 placentitidy není prozatím plně prostudován, diskutuje se mimo jiné přímé poškození proteiny viru a aktivací imunitní reakce nebo nepřímo přes protilátky [18,19].
V rámci menstruačního cyklu je endometrium nejvíc vnímavé k infekci virem SARS-CoV-2 v sekreční fázi v období implantačního okna a tato citlivost stoupá s věkem. Lze z toho odvodit, že by virus SARS-CoV-2 mohl mít negativní vliv na výsledky IVF u starších pacientek [28]. Z dostupných údajů ale nelze zatím dělat definitivní závěry ohledně infekce virem SARS-CoV-2, protože se publikované výsledky významně rozcházejí [21,25].
Testování receptivity endometria
Správné načasování transferu je alfou a omegou asistované reprodukce. Klinicky se nejvíc využívá datace endometria pomocí ultrazvuku. Hodnocena je výška sliznice a její charakteristický obraz, endometriální kontrakce, dopplerovské indexy. Za fyziologické rozmezí je považována výška mezi 6 a 14 mm, „triple line“ obraz a zvýšení prokrvení endometria v den podání choriogonadotropinu (IVF, IUI) nebo přidání progesteronu (kryoembryotransfer) a nízká frekvence endometriálních kontrakcí v čase transferu [1]. V ovulačním cyklu lze teoreticky predikovat receptivní endometrium stanovením hladin luteinizačního hormonu a progesteronu. Ve specifických případech jsou indikovány invazivní testy – hysteroskopie a biopsie endometria. Bioptický vzorek lze zhodnotit histologicky dle Noyese et al [8], může být stanoven imunologický profil (u NK buňky, T regulační buňky a plazmatické buňky), složení mikrobiomu (test Endometrial Microbioma Metagenonic Analysis, Analysis of Infectious Chronic Endometritis) [8] anebo endometriální transkriptom (Endometrial Receptivity Analysis [5], WIN test [6]).
• ERA test – zaveden do praxe již roku 2011 [5], vyvolává v odborné společnosti dosud rozporuplné reakce. Je mu vytýkána invazivita a hlavně variabilita genové exprese vzhledem k malému vyšetřovacímu vzorku z lokální oblasti [9]. V testu je analyzováno 238 genů, které mají vztah k receptivitě endometria. Liu v recentní metaanalýze z roku 2022 uvádí, že pacientky s dobrou prognózou bez anamnézy opakovaného implantačního selhání neprofitují z využití ERA testu. Sám autor dále uvádí, že výsledky metaanalýzy jsou limitující vzhledem k faktu, že v některých studiích nebylo provedeno PGT-A (testování aneuploidií) embryí, což může výrazně zkreslit výsledky. Naproti tomu u pacientek s opakovaným selháním implantace se zdá, že mají mírně vyšší šanci na úspěch při využití personalizovaného transferu [29].
• Win test – kvantitativně analyzuje 11 genů pomocí RT-qPCR, které jsou upregulovány v receptivní fázi implantačního okna [30]. Jeho využití představila odborné veřejnosti Haouzi et al [6]. Ve své recentní publikaci uvádí signifikantní zlepšení výsledků personalizovaného transferu s datací receptivity endometria pomocí Win testu. Až 78 % testovaných mělo délku receptivní fáze mezi 24 a 48 hod. Kontroverzně zní, že dle Win testu mělo až 80 % žen s opakovaným selháním implantace receptivní fázi posunutou o 1–3 dny později (LH+8/LH+9) než dle tradičně používané datace (LH+6/LH+7) [6].
Vzhledem ke komplexnosti procesu implantace nelze očekávat, že testování jedné složky nám dá očekávanou odpověď. Všechny dostupné metody vykazují nedostatečnou prediktivní hodnotu ve vztahu k úspěšnosti transferu, a na ideální test se tak zatím stále čeká.
Podpora procesu implantace
Podávání gestagenů je v klinické praxi běžně zavedenou metodou ovlivnění implantace. Gestageny podporují sekreční transformaci endometria, snižují děložní kontraktilitu a modulují imunitní reakce směrem k implantujícímu se embryu [31,32].
U pacientek s PCOS je jedním z doporučených terapeutických přístupů užívání metforminu [12,23]. Jeho efekt na periferní transport glukózy ovlivněním exprese GLUT4 by měl zvýšit její utilizaci, a tím zlepšit receptivitu endometria [12].
Slibnými modalitami v léčbě opakovaného selhání implantace jsou intrauterinní infuze mononukleárních buněk (PBMC – periferal blood mononuclear cells) a plazmy bohaté na destičky (PRP – plateled-rich plasma), subkutánní aplikace granulocyty stimulujícího růstového faktoru (G-CSF), intravenózní podání atosibanu (antagonista oxytocinových receptorů) anebo intrauterinní aplikace choriogonadotropinu (hCG) před transferem embrya [3]. Gao et al ve své recentní metaanalýze uvádějí zvýšení počtu zralých pinopodií po aplikaci hCG do dutiny děložní, a tím zlepšení receptivity a zvýšení úspěšnosti IVF [33]
Závěr
Úspěšná nidace je výsledkem synchronizované komunikace mezi zdravým embryem a receptivním endometriem. Selhání může být způsobeno jak nesprávným načasováním transferu u žen s posunem implantačního okna, tak i patologickými procesy na buněčné či molekulární úrovni. I když zůstává v pochopení implantace ještě mnoho otazníků, nejnovější výzkumy na poli transkriptomiky, proteomiky a reprodukční imunologie stále hlouběji odkrývají tento děj, a tím pomalu otvírají novou etapu asistované reprodukce. Cílem je pochopení cyklických změn endometria, a tím určení ideálního času embryotransferu. To by mělo vést ke zlepšení výsledků léčby poruch plodnosti.
ORCID autorů
L. Mekiňová 0000-0002-1839-2802
M. Ješeta 0000-0003-1778-3454
I. Crha 0000-0002-7217-4902
K. Crha 0000-0002-8043-5543
J. Vodička 0000-0003-0446-4454
R. Hudeček 0000-0003-0617-0126
K. Remundová 0000-0002-7938-8233
E. Matušková 0000-0002-5223-5544
R. Pilka 0000-0001-8797-1894
Doručeno/Submitted: 14. 9. 2022
Přijato/Accepted: 22. 9. 2022
MUDr. Lenka Mekiňová
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
602 00 Brno
Zdroje
1. Craciunas L, Gallos I, Chu J et al. Conventional and modern markers of endometrial receptivity: a systematic review and meta-analysis. Hum Reprod Update 2019; 25 (2): 202–223. doi: 10.1093/humupd/dmy044.
2. Crha I, Ventruba P, Ješeta M et al. Děložní mikrobiom jako faktor receptivy endometria. Ceska Gynekol 2019; 84 (1): 49–54.
3. Busnelli A, Somigliana E, Cirillo F et al. Efficacy of therapies and interventions for repeated embryo implantation failure: a systematic review and meta analysis. Sci Rep 2021; 11 (1): 1747. doi: 10.1038/s41598-021-81439-6.
4. He A, Zou Y, Wan C et al. The role of transcriptomic biomarkers of endometrial receptivity in personalized embryo transfer for patients with repeated implantation failure. J Transl Med 2021; 19 (1): 176. doi: 10.1186/s12967-021-02837-y.
5. Díaz-Gimeno P, Horcajadas JA, Martínez--Conejero JA et al. A genomic diagnostic tool for human endometrial receptivity based on the transcriptomic signature. Fertil Steril 2011; 95 (1): 50–60. doi: 10.1016/j.fertnstert.2010.04.063.
6. Haouzi D, Entezami F, Torre A et al. Customized frozen embryo transfer after identification of the receptivity window with a transcriptomic approach improves the implantation and live birth rates in patients with repeated implantation failure. Reprod Sci 2021; 28 (1): 69–78. doi: 10.1007/s43032-020-00252-0.
7. Ulčová-Gallová Z, Pešek M, Chaloupka P et al. Screeningové vyšetření endometriálních NK buněk u vybraných infertilních pacientek 1. část – metodika a průběžné výsledky. Ceska Gynekol 2017; 82 (5): 366–371.
8. Sehring J, Beltsos A, Jeelani R. Human implantation: the complex interplay between endometrial receptivity, inflammation, and the microbiome. Placenta 2022; 117 : 179–186. doi: 10.1016/j.placenta.2021.12.015.
9. Dvořan M, Vodička J, Dostál J et al. Implantace a diagnostika receptivity endometria. Ceska Gynekol 2018; 83 (4): 291–299.
10. Liu A, Raja Xavier J, Singh Y et al. Molecular and physiological aspects of SARS-CoV-2 infection in women and pregnancy. Front Glob Womens Health 2022; 3 : 756362. doi: 10.3389/ fgwh.2022.756362.
11. Vallvé-Juanico J, Houshdaran S, Giudice LC. The endometrial immune environment of women with endometriosis. Hum Reprod Update 2019; 25 (5): 564–591. doi: 10.1093/ humupd/ dmz018.
12. Bai X, Zheng L, Li D et al. Research progress of endometrial receptivity in patients with polycystic ovary syndrome: a systematic review. Reprod Biol Endocrinol 2021; 19 (1): 122. doi: 10.1186/s12958-021-00802-4.
13. Qiong Z, Jie H, Yonggang W et al. Clinical validation of pinopode as a marker of endometrial receptivity: a randomized controlled trial. Fertil Steril 2017; 108 (3): 513.e2–517.e2. doi: 10.1016/j.fertnstert.2017.07.006.
14. Zeng H, Fu Y, Shen L et al. MicroRNA signatures in plasma and plasma exosome during window of implantation for implantation failure following in-vitro fertilization and embryo transfer. Reprod Biol Endocrinol 2021; 19 (1): 180. doi: 10.1186/s12958-021-00855-5.
15. Chen CH, Lu F, Yang WJ et al. A novel platform for discovery of differentially expressed microRNAs in patients with repeated implantation failure. Fertil Steril 2021; 116 (1): 181–188. doi: 10.1016/j.fertnstert.2021.01.055.
16. Benner M, Ferwerda G, Jossten I et al. How uterine microbiota might be responsible for a receptive, fertile endometrium. Hum Reprod Update 2018; 24 (4): 393–415. doi: 10.1093/humupd/ dmy012.
17. Crha K, Ješeta M, Pilka R et al. Adenomyóza – možný vliv na funkci a receptivitu endometria. Ceska Gynekol 2021; 86 (3): 205–209. doi: 10.48095/cccg2021205.
18. Ulčová-Gallová Z, Cibulka J, Lošan P. Antifosfolipidové protilátky a infekce covidem-19 u žen se sníženou plodností. Ceska Gynekol 2021; 86 (3): 210–213. doi: 10.48095/cccg2021210.
19. Daumová M, Hadravská Š, Straková Peteříková A et al. SARS-CoV-2 placentitida – popis dvou případů a přehled literatury. Ceska Gynekol 2022; 87 (2): 111–117. doi: 10.48095/ cccg2022111.
20. Jafari M, Pormohammad A, Sheikh Neshin SA et al. Clinical characteristics and outcomes of pregnant women with COVID‐19 and comparison with control patients: a systematic review and meta‐analysis. Rev Med Virol 2021; 31 (5): 1–16. doi: 10.1002/rmv.2208.
21. Balachandren N, Davies MC, Hall JA et al. SARS-CoV-2 infection in the first trimester and the risk of early miscarriage: a UK population-based prospective cohort study of 3,041 pregnancies conceived during the pandemic. Hum Reprod 2022; 37 (6): 1126–1133. doi: 10.1093/ humrep/deac062.
22. Hudecek R, Kohlova B, Siskova I et al. Blocking of EphA2 on endometrial tumor cells reduces susceptibility to Vd1 gamma-deltaT-cell-mediated killing. Front Immunol 2021; 12 : 752646. doi: 10.3389/fimmu.2021.752646.
23. Teede HJ, Misso ML, Costello MF at al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Hum Reprod 2018; 33 (9): 1602–1618. doi: 10.1093/humrep/dey256.
24. Palioura E, Diamanti-Kandarakis E. Polycystic ovary syndrome (PCOS) and endocrine disrupting chemicals (EDCs). Rev Endocr Metab Disord 2015; 16 (4): 365–371. doi: 10.1007/s11154 - 016-9326-7.
25. Youngster M, Avraham S, Yaakov O et al. IVF under COVID-19: treatment outcomes of fresh ART cycles. Hum Reprod 2022; 37 (5): 947–953. doi: 10.1093/humrep/deac043.
26. Salem D, Katranji F, Bakdash T et al. COVID-19 infection in pregnant women: review of maternal and fetal outcomes. Int J Gynecol Obstet 2021; 152 (3): 291–298. doi: 10.1002/ijgo.13533.
27. Madar J, Ulčová-Gallová Z et al. Imunologie a imunopatologie lidské reprodukce: vybrané kapitoly. 2nd ed. Praha: Mladá fronta 2020 : 1–152.
28. Henarejos-Castillo I, Sebastian-Leon P, Devesa-Peiro A et al. SARS-CoV-2 infection risk assessment in the endometrium: viral infection-related gene expression across the menstrual cycle. Fertil Steril 2020; 114 (2): 223–232. doi: 10.1016/j.fertnstert.2020.06.026.
29. Liu Z, Liu X, Wang M et al. The clinical efficacy of personalized embryo transfer guided by the endometrial receptivity array/analysis on IVF/ICSI outcomes: a systematic review and meta-analysis. Front Physiol 2022; 13 : 841437. doi: 10.3389/fphys.2022.841437.
30. Messaoudi S, EL Kasmi I, Bourdiec A et al. 15 years of transcriptomic analysis on endometrial receptivity: what have we learnt? Fertil Res Pract 2019; 5 : 9. doi: 10.1186/s40738-019-0059-7.
31. Mizrachi Y, Weissman A, Rozen G et al. Timing of progesterone luteal support in natural cryopreserved embryo transfer cycles: back to basics. Reprod Biomed Online 2022; 45 (1): 63–68. doi: 10.1016/j.rbmo.2022.03.021.
32. Vodička J, Dvořan M, Smékalová K et al. Možnosti přípravy endometria ke kryoembryotransferu. Ceska Gynekol 2018; 83 (1): 24–28.
33. Gao MX, Jiang XY, Li B et al. Intrauterine injection of humanchorionic gonadotropin before embryo transfer can improve in vitro fertilization-embryo transfer outcomes: a meta-analysis of randomized controlled trials. Fertil Steril 2019; 112 (1): 89–97. doi: 10.1016/j.fertnstert.2019.02.027.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Intersticiální graviditaČlánek Endometrióza v postmenopauze
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2022 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Epidemiologie a význam chirurgických okrajů v managementu HPV asociovaných vulvárních prekanceróz (HSIL) – analýza vlastního souboru
- Intra-amniální zánět u předčasného odtoku plodové vody před termínem porodu je spojen se zvýšením hladin sCD93 v plodové vodě
- Osteogenesis imperfecta/ Ehlers-Danlosův syndrom (COL1-asociované onemocnění) v těhotenství
- Karcinom vulvy a jeho recidivy – zásady operační léčby
- Intersticiální gravidita
- Pánevní tamponáda při léčbě závažného poporodního krvácení po hysterektomii
- Vybrané patologické stavy ovlivňující receptivitu endometria
- Odložený podvaz pupečníku – přínosy a rizika
- Endometrióza v postmenopauze
- Co přinesla nová 11. revize Mezinárodní klasifikace nemocí v kategorizaci ženských sexuálních dysfunkcí?
- Nová kombinovaná perorální antikoncepce obsahující estetrol: přehledový článek evropského panelu odborníků
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nová kombinovaná perorální antikoncepce obsahující estetrol: přehledový článek evropského panelu odborníků
- Endometrióza v postmenopauze
- Vybrané patologické stavy ovlivňující receptivitu endometria
- Karcinom vulvy a jeho recidivy – zásady operační léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



