-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBarvení indocyaninovou zelení jako nový trend detekce sentinelových uzlin v onkogynekologii
Indocyanine green as a new trend in sentinel lymphatic node detection in oncogynecology
In oncological surgery the importance of the sentinel node concept is increasing, as we are capable of reducing the surgical burden of patients and its associated morbidity and preserving adequate oncological safety at the same time. Recently, there has been development of lymph node mapping techniques, where the most promising method appears to be the immunofluorescent one using indocyanine green dye. This technique provides high sensitivity in sentinel node detection in comparison with other existing methods using a dye in combination with a radionuclide. The indocyanine green technique has several advantages, and at the same time, we can use this method in non-oncological indications in gynecological surgery.
Keywords:
indocyanine green – oncogynecology – sentinel lymphatic node
Autoři: Novák O.; Bartoš P.; Bučko R.
Působiště autorů: Gynekologicko-porodnická klinika Nemocnice Nový Jičín AGEL a. s.
Vyšlo v časopise: Ceska Gynekol 2022; 87(1): 54-61
Kategorie: Přehledový článek
doi: https://doi.org/10.48095/cccg202254Souhrn
Koncept sentinelové uzliny hraje v onkologické chirurgii čím dál důležitější roli, díky níž jsme schopni snížit operační zátěž pacientů a s ní spojenou morbiditu při zachování adekvátní onkologické bezpečnosti. V poslední době také dochází k rozvoji technik lymfatického mapování, z nichž nejslibnější výsledky přináší imunofluorescenční metoda s indocyaninovou zelení. Tato technika dosahuje v onkogynekologii vysoké senzitivity v detekci sentinelové uzliny a mohla by nahradit stávající metody s využitím barviva v kombinaci s radionuklidem, oproti kterým má barvení pomocí indocyaninovou zelení několik výhod. Zároveň lze tuto metodu použít i u neonkologických indikací v gynekologické operativě.
Klíčová slova:
onkogynekologie – sentinelová lymfatická uzlina – indocyaninové zelené barvivo
Koncept sentinelové uzliny
Status lymfatických uzlin (ať již zasažených metastázami, anebo uzlin nepostižených) hraje významnou úlohu v predikci přežití pacienta a je i hlavním kritériem indikace k adjuvantní léčbě. U většiny zhoubných gynekologických nádorů je chirurgická léčba metodou volby, která kromě samotné resekce postiženého orgánu zahrnuje dnes již standardně i disekci lymfatických uzlin spádové oblasti. Tato regionální lymfadenektomie přinesla zlepšení onkologických výsledků, ale také zvýšenou pooperační morbiditu se zhoršením kvality života pacientů. U některých zhoubných nádorů má metastázy v regionálních lymfatických uzlinách jen menšina pacientek indikovaných k operační terapii a u těchto pacientek je pak provedení systematické lymfadenektomie tzv. overtreatment se zbytečnou zátěží [1].
Koncept sentinelové uzliny (SLN – sentinel lymphatic node) předpokládá, že její stav odráží také stav regionálních mízních uzlin, tzn. že pokud je SLN bez metastázy, je tím vyloučeno lymfogenní šíření nádoru, a naopak v případě pozitivity je prokázáno. Prof. Morton et al jako první rozvinuli a zpopularizovali koncept lymfatického mapování u melanomu již v roce 1992 [2] a brzy poté se tato technika začala používat i u zhoubného nádoru prsu [3]. Postupem času byla tato teorie uvedena do praxe a četnými studiemi byla potvrzena vysoká senzitivita, specificita a negativní prediktivní hodnota lymfatického mapování (93 %, 100 %, 96 %) [1]. Resekce a následné imunohistochemické vyšetření sentinelové uzliny se proto staly standardním postupem u těchto druhů nádorů. Dále se koncept resekce a biopsie SLN začal rozšiřovat i na další typy nádorů, v roce 1995 to byl karcinom vulvy [4] a o několik let později také karcinom děložního hrdla [5].
Biopsie SLN si postupně našla místo v onkogynekologii jako minimálně invazivní operační technika výrazně snižující morbiditu pacientek. V porovnání s klasickou regionální lymfadenektomií se zkracuje operační čas a délka hospitalizace, snižuje se invazivita výkonu a s ní spojené peroperační komplikace. Rovněž je prokázáno snížení pooperační morbidity, která nejčastěji zahrnuje infekce operační rány, četnost lymfocyst a lymfedém dolních končetin po operacích zhoubných nádorů genitálu či horních končetin po operacích zhoubných nádorů prsu [6–8]. Se snížením množství odebraných uzlin je technicky a organizačně možné podrobnější histologické vyšetření SLN (tzv. ultrastaging), kdy je možno pomocí imunohistochemických metod zachytit i časné a malé metastázy – mikrometastázy, či dokonce jednotlivé nádorové buňky [9]. Mikrometastázy představují mikroskopické klastry nádorových buněk nebo jednotlivé buňky velikosti od 0,2 do 2 mm, ve kterých se vyskytuje obvykle kolem 200–1 000 nádorových buněk, zatímco nízkoobjemové metastázy, tzv. izolované nádorové buňky (ITC – isolated tumor cells), představují velikost do 0,2 mm, zde je obvykle přítomno přibližně 1–200 nádorových buněk [10]. Detekce SLN zvyšuje také detekci metastáz v uzlinách s atypickou lokalizací, tedy mimo standardní místa pánevní a aortokavální lymfadenektomie [11]. Onkologický význam mikrometastáz či izolovaných nádorových buněk je zatím u většiny nádorů předmětem studií [7] s tím, že mikrometastázy jsou stále častěji řazeny na úroveň metastáz [12].
Detekce sentinelových uzlin
Koncept biopsie SLN by se nemohl plně rozvinout bez rozšiřování možností a techniky lymfatického mapování a detekce lymfatických uzlin. Tyto procedury se snaží napodobit migraci nádorových buněk lymfatickými cestami a jejich metastazování v lymfatických uzlinách pomocí aplikace značených látek do oblasti tumoru. Zde platí předpoklad, že první uzlina, která se nachází v lymfatické cestě od nádoru, je uzlina sentinelová – tzv. strážná. Nemusí to tak ale platit v případě, že je lymfatická cesta již obstruována přítomností metastázy v lymfatickém kanále či uzlině, kdy si lymfatický oběh může vytvořit kolaterály, a tato původně sentinelová uzlina je již nahrazena jinou uzlinou. Proto koncept sentinelové uzliny a její detekce může při vyšších stadiích onemocnění selhávat, a vést tak k nižší senzitivitě metody. Způsob cestování detekční látky lymfatickými cestami je ovlivněn četnými faktory, mezi něž patří zejména molekulární velikost látky, její chemické vlastnosti a stav lymfatických cest v dané oblasti. Ideální látka je proto taková, která se snadno aplikuje do požadované oblasti, je rychle vychytávána lymfatickou drenáží, nešíří se mezibuněčnými prostory, a tudíž nekontaminuje okolní tkáň, koncentruje se nejvíce v sentinelové uzlině a zde je detekovatelná dostatečně dlouhou dobu [6].
Postupem času se k detekci SLN užívaly dvě hlavní metody – podle použité detekční látky. První je značení barvivem, které je viditelné pouhým okem a nevyžaduje speciální vybavení ani zázemí, kdy studie prokázaly jako nejvhodnější barvivo izosulfanovou modř či její izomer patentní modř. Průnik barviva do SLN je ovlivněn velikostí tumoru (čím větší nádor, tím menší pravděpodobnost správné detekce), jeho lokalizací a event. přítomností zánětlivé reakce v okolí nádoru. Průměrně, u patentní modři, se udává doba putování k nádoru okolo 5 min a zbarvení SLN přetrvává po dobu 30–45 min. Aplikace se proto provádí těsně před chirurgickým výkonem v celkové anestezii. Jako druhá technika se používá radiokoloidem značená látka, která se rovněž aplikuje do okolí tumoru a je pak detekována na dynamických či statických scanech předoperačně nebo v onkogynekologii nejčastěji přímo peroperačně ruční kolimační gama sondou. V Evropě se nejčastěji používá lidský sérový albumin značený radionuklidem technecia (99mTc). Doba cestování radiokoloidu do SLN je při peroperační detekci 15–30 min (tento čas je ovlivněn stejnými faktory jako u standardního barviva) a v SLN je následně možné detekovat radiokoloid po dobu 24 hod. Nevýhodou oproti použití barviva jsou mnohem vyšší finanční náklady, nutnost zázemí nukleární medicíny na pracovišti a potenciálně nebezpečná manipulace s radioaktivní látkou [1,6]. Radiokoloid však vykazuje výrazně vyšší záchyt SLN oproti klasickému barvivu (DR – detection rate až 90 % vs. 70–80 %) [13]. Nejvyšší DR je dosahováno při kombinaci obou metod, a to až 95 % [14].
Fluorescenční metoda detekce SLN pomocí indocyaninového zeleného barviva (ICG – indocyanine green)
Obecně jsou fluorescenční techniky v chirurgických oborech založeny na principu vylepšeného zobrazení klasického operačního pole, čímž pomáhají k rozlišení důležitých struktur, které jsou normálně lidskému oku skryty nebo jsou obtížně rozeznatelné. Do tkáně, kterou chceme identifikovat, se aplikuje fluorescenční látka (fluorofor), která je po ozáření světlem o příslušné vlnové délce excitována. Fluorofor následně při navrácení do klidového stavu emituje světlo o odlišné vlnové délce, které po zachycení speciální kamerou tvoří fluorescenční obraz.
V medicíně se pro své ideální vlastnosti začaly rozšiřovat techniky s fluorofory v oblasti blízkého infračerveného spektra elektromagnetického záření (NIR – near infrared). Záření o vlnové délce 750–900 nm, které je normálně lidskému oku skryto, dobře proniká biologickými tkáněmi pro svou nízkou absorpci chemickými sloučeninami, které živá tkáň obsahuje. V největším zastoupení jsou v těchto tkáních právě voda a hemoglobin, které s NIR zářením interferuje nejméně [15]. Pro tyto vlastnosti je možné bezpečně identifikovat struktury i hluboko, tj. několik centimetrů pod povrchem. Dané schopnosti fluorescence jsou dále ovlivněny faktory, jako je koncentrace fluoroforu ve tkáni, jeho agregací nebo naopak navázání na okolní látky a také stavem samotné okolní tkáně, kdy hraje důležitou roli především obsah vody, fibrotizace apod.
Fluorescenční videoobraz vytváří kombinace těchto tří prvků:
- fluorofor, kterým požadovanou strukturu označujeme;
- zdroj excitačního záření;
- detektor, jenž je schopen zachytit emitované záření.
Finální obraz je pak tvořen spojením fluorescenčního snímku s obrazem operačního pole snímaným obrazovým čipem (dnes moderní typy 1–3 CMOS – complementary metal oxide semiconductor). Tento zdánlivě jednoduchý princip má však několik úskalí. S rozšiřováním techniky fluorescenčního zobrazování a jeho klinických aplikací je kladen velký nárok na vysoké rozlišení obrazu při minimálním zkreslení pozadí vč. dostatečného kontrastu a nastavitelnosti jasu, široký záběr operačního pole, schopnost detekce koncentrace fluoroforu a také schopnost „real time“ zobrazení s dostatečnou frekvencí obrazových snímků. K vytvoření tak kvalitního obrazu je nutné excitovat příslušný fluorofor světlem o ideální vlnové délce. Toho lze docílit použitím multispektrálních zdrojů s následnou filtrací požadované vlnové délky, jako byly zpočátku technologického vývoje např. halogenové lampy či LED (laser emitting diode) zdroje, jejichž hlavní výhodou je cena. Další možností je použití monochromatické laser-emitující diody, která je sice výrazně dražší, ale minimálně interferuje s obrazem snímaným čipem s vázanými náboji (CCD – charge couple device) při dostatečné excitaci fluoroforu na vrcholu excitační křivky pro ICG. Kvalitní obraz zajišťují moderní CMOS čipy s vysokým rozlišením, nízkým šumem a kvalitním digitálním převodníkem. Finální obraz je pak zpracován výkonnou výpočetní technikou. Algoritmy vytvářející výsledný obraz musí mimo jiné při kvantifikování koncentrace fluoroforu počítat s proměnnými, jako jsou vzdálenost kamery od značené struktury či její pozice na obrazovém poli [15]. Jen tak lze získat nezávislý obraz poskytující výpovědní hodnotu s žádanou kvalitou. V současnosti nejmodernější laparoskopické sestavy a videořetězce tedy provádějí fluorescenční zobrazení tkání na základě identického světelného zdroje a videoprocesoru. Tyto sestavy poslední generace používají k excitaci světlo emitující diodu laserového zdroje (mají tedy zabudovaný výkonný laser) na vlnové délce 808–810 nm, což je ideální a přesná vlnová délka pro excitaci ICG. Jedná se obvykle o lasery kategorie 3R dle IEC (International Electrotechnical Commission). Tento technologický fakt je zásadně důležitý, neboť starší systémy založené na LED excitaci nedokážou provedení excitace na výše uvedené vlnové délce a korigují tento fakt softwarově, což s sebou může přinášet zobrazovací nepřesnosti. Od moderního přístroje je tedy třeba vyžadovat simultánní zobrazení bílého světla v plných barvách ve FULL HD nebo 4K rozlišení a fluorescenční zobrazení umožňující kontinuální překrývání během operace. Výhodné je barevné rozlišení na čtyřbarevné škále s důležitým modem s automatickým a plynulým přechodem dle dané intenzity signálu bez nutnosti dalších regulací, změn intenzity nebo změn NIR spektra softwarově. Je nutné se též zmínit o kamerovém systému pro klasické operace, kdy moderní typ kamery je schopen pracovat ve vzdálenostech 10–40 cm od tkání, kamery jsou odlehčené, plně mobilní, ovládané rukou asistenta.
K fluorescenčnímu zobrazování jsou v medicíně schváleny tři látky. Nejrozšířenější je ICG, dále lze použít methylenovou modř (MB – methylene blue) a kyselinu 5-amino-levulenovou (5-ALA) [16]. ICG jako ve vodě rozpustná látka velikosti 1,2 nm s amfifilními vlastnostmi a negativním nábojem [17] byla vyvinuta již v roce 1955 pro nemedicínské účely výzkumnou laboratoří Kodak a až v roce 1959 byla schválena k medicínskému použití při angiografii retiny. Dále se ICG používala k určování srdečního výdeje či k hodnocení funkce jater. Postupem času se začal tento fluorofor používat také k mnoha různým chirurgickým výkonům, kterým dominuje onkologická chirurgie. Umožnily to právě ideální vlastnosti ICG, která má maximum absorpčního spektra v lidském séru okolo 800 nm a excitační 808–840 nm (maximum 808–810 nm) NIR spektra, které je schopno být detekováno přes tloušťku 5–10 mm tkáně [17], jak bylo vysvětleno výše. ICG má výbornou akumulaci v intravaskulárním kompartmentu díky rychlé vazbě na lipoproteiny a díky svému zápornému náboji. Tyto vlastnosti jsou využívány právě v angiografii krevních a také lymfatických cév. ICG je bez jakékoli metabolizace rychle eliminována játry z krevního oběhu přímo do žluči.
Mezi hlavní přednosti ICG při detekci SLN patří její prakticky nulové nežádoucí účinky po aplikaci, dosud bylo zaznamenáno jen několik případů závažných reakcí. Ty se mohou vyskytnout, a to vč. anafylaktické reakce u 0,04–0,05 % pacientů. Nebylo však zaznamenáno žádné úmrtí [17,18]. Taktéž nebyla pozorována žádná toxicita ICG při použití ve schváleném množství 5–25 mg. Anafylaxe či vážné reakce jsou naproti tomu u izosulfánové modři udávány v rozmezí 0,7–1,1 %. Dále oproti detekci radiokoloidem, kde sice radiační zátěž nebyla shledána jako nebezpečná, je v případě fluoroforů expozice záření nulová. ICG si rovněž zachovává vysoký stupeň detekce (DR – detection rate) u většiny gynekologických nádorů i vzhledem k možnosti opětovné aplikace. Nelze opomenout zrychlení operačního času díky snadné přípravě, jednoduché aplikaci a rychlému vychytávání barviva lymfatickým systémem.
Mezi relativní nevýhody patří kvůli malé velikosti molekuly rychlá eliminace látky z organizmu játry a rychlý postup lymfatickými cévami a uzlinami. Velmi rychle je tak zmapován celý lymfatický region a při rychlém barvení lymfatických uzlin vyšších etáží je znesnadněna identifikace první sentinelové uzliny. Tento problém měl být vyřešen pomocí navázání ICG na lidský sérový albumin, a prodloužit tak retenční čas, zvýšení DR při této modifkované metodě detekce SLN se však nepodařilo prokázat [19]. Ke zvýšení DR by měla pomoci možnost kvantifikace množství ICG ve fluoresecenčních systémech, kdy se předpokládá nejvyšší koncentrace právě v sentinelové uzlině. To spolu s anatomickou lokalizací uzliny zvyšuje senzitivitu detekce SLN. Jako budoucnost této metody se jeví možnost navázání ICG na nanočástice, které se budou cíleně vázat v lymfatických uzlinách nebo přímo na nádorové buňky [20].
Použití ICG detekce SLN v onkogynekologii
Gynekologické nádory se po melanomu a karcinomu prsu jako první zařadily mezi ty, kde je stav SLN nedílnou součástí diagnosticko-léčebného procesu. S rozvojem detekčních metod SNL si své místo nachází také využití ICG.
Vulva
Zhoubné nádory vulvy byly pro příznivou anatomickou dostupnost své lymfatické drenáže jako první zařazeny do studií k detekci a biopsii SLN. V České republice byla v roce 2018 incidence zhoubného nádoru vulvy 224, z čehož měla přibližně třetina pacientek v době diagnózy metastázy v lymfatických uzlinách [21]. Standardem chirurgické léčby je široká excize s dostatečným resekčním okrajem a peroperační staging lymfatických uzlin, kde narůstá trend méně invazivních výkonů. Tento trend zákonitě vedl k využívání možnosti stagingu lymfatických uzlin pomocí detekce SLN. Hlavní příčinou vysoké pooperační morbidity pacientek s nádorem vulvy je totiž právě systematická inguinofemorální lymfadenektomie. Postižení lymfatických uzlin je navíc nejrelevantnější prognostický faktor pro celkové přežívání [22]. Kombinace barvení modří a peroperační radiolokalizace pomocí gama sondy se rychle stala nejlepší metodou k detekci a extirpaci SLN, jak potvrdila studie GOG-173 [23] a následné metaanalýzy. Biopsie SLN se tak stala součástí léčby u skupiny pacientek stadií Ib–II do velikosti tumoru < 4 cm, kdy je dosahováno DR 95 % a senzitivity rovněž 95 % [24,25]. Negativní SLN jsou tak pro celkové přežití obdobně validní jako negativní inguinofemorální lymfadenektomie [8]. Jelikož fluorescenční metody detekce SLN zažily rozvoj primárně v laparoskopických technikách, vyšly první studie s detekcí pomocí ICG u karcinomů vulvy až v roce 2010. DR při užití NIR techniky se v následujících studiích pohyboval v rozmezí 95,7–100 % [15]. Při zachování indikačních kritérií pacientek k biopsii SLN je DR vyšší při zachování dostatečné senzitivity než doposud zavedené detekční metody pomocí radiokoloidu [26] či modrých barviv [27], a je proto zřejmé, že je ICG bude postupně nahrazovat. Potvrdit tuto hypotézu by měly prospektivní studie, které již běží nebo jsou plánovány [28,29].
Cervix
Nádor děložního hrdla byl u žen v České republice v roce 2018 diagnostikován u 734 pacientek, z nichž asi 70 % bylo diagnostikováno ve stadiu T1 a T2 [21]. Dle stadia FIGO klasifikace (International Federation of Gynecology and Obstetrics / Mezinárodní federace gynekologů a porodníků) je léčba buď chirurgická, nebo kombinací chemo - a radioterapie. Součástí chirurgického stagingu je pánevní lymfadenektomie, kdy je postižení uzlin jedním z hlavních prognostických faktorů. Pravděpodobnost metastáz v pánevních uzlinách je < 20 % v časném stadiu (FIGO IA), zvyšuje se na 22–31 % u větších nádorů FIGO stadia IB a ve stadiu IIB je až to 43 % [9,30]. Kromě klinického stadia zvyšuje pravděpodobnost metastáz přítomnost lymfangioinvaze a závisí rovněž na hloubce infiltrace stromatu, vzdálenosti od pericervikální fascie či infiltraci parametrií. Postižení aortokaválních uzlin je až sekundární, kdy se při postižení pánevních uzlin zvyšuje pravděpodobnost aortokavální metastázy o 25 % [31]. Bezpečnost a spolehlivost konceptu biopsie SLN u zhoubného nádoru hrdla byla ověřena AGO multicentrickou studií [32] a francouzskou SENTICOL studií [33], kdy se při použití kombinace methylenové modři a radiokoloidu dosáhlo DR 98 % se senzitivitou 96 % s negativní prediktivní hodnotou 98 %. Bylo však zdůrazněno, že je potřeba:
1. odstranit jakoukoli suspektní uzlinu (i když není modrá či „hot“),
2. provést systematickou lymfadenektomii, pokud se na dané straně žádná uzlina nezobrazí,
3. provést ultrastagingové vyšetření každé sentinelové uzliny, která je negativní při klasickém vyšetření hematoxylin-eosinem.
Příznivé výsledky detekce SLN u pokročilejších stadií nádoru hrdla jsou srovnatelné s časnými stadii a byly také prezentovány českými autory [34]. Další prospektivní i retrospektivní studie, metaanalýzy a reviews ukazují, že biopsie SLN má vysokou výpovědní hodnotu a senzitivitu srovnatelnou se systematickou pánevní lymfadenektomií a je bezpečná u zhoubného nádoru hrdla stadia I u nádoru do velikosti 4 cm. SLN je tak zakomponována do standardu léčby karcinomu hrdla děložního [35]. Potvrzení a pevné zařazení do standardů by měla umožnit běžící SENTICOL-3 studie.
I přes vysoké DR pomocí kombinace radiokoloidu s modří byla oboustranná detekce SLN průměrně 72 %. Ve studii FILM vykazovala imunofluorescenční technika s ICG slibné výsledky. V této studii byla u žen s nádorem dělohy a hrdla děložního identifikována SLN u 96 % a oboustranná DR u 78 % [36]. Srovnání bylo však jen s methylenovou modří, navíc ve studii tvořily pacientky se zhoubným nádorem či karcinomem hrdla děložního jen 4 %. U karcinomu hrdla děložního vykazovaly studie s ICG vysoké DR, a to vč. oboustranné detekce, kdy se hodnoty pohybovaly kolem 95–100 %, resp. 87–95 % bilaterálně [37,38]. Tyto studie potvrzují zlepšení detekce SLN oproti klasickým metodám (modř s radiokoloidem), byly však prováděny laparoskopicky či roboticky a není možné je paušálně aplikovat na otevřenou techniku operační léčby. V důsledku předčasně ukončené studie LACC, kdy minimálně invazivní postupy neprokázaly dostatečnou onkologickou bezpečnost [39], se nyní gynekologové většinou vrací ke klasické otevřené radikální hysterektomii. Slibné výsledky ICG v detekci SLN v „uzavřených“ laparoskopických systémech proto musí být ověřeny v dalších studiích. Je navíc nutné upravit a vyvinout spolehlivou modifikaci imunofluorescenčního detekčního systému právě pro otevřenou operativu. Dosavadní systémy pro klasickou chirurgii mají zatím vedle praktických problémů také omezenou možnost kvantifikace koncentrace ICG či detekce u nízkých koncentrací barviva. Jak bylo popsáno výše, nároky na detekční systém zvyšuje u otevřené chirurgie mnohem vyšší proměnlivost vzdálenosti NIR kamery od operačního pole, které je navíc osvětleno externími operačními světly vysoké intenzity. Technika ICG to již umožňuje (obr. 1).
Obr. 1. Ukázka laparoskopické detekce indocyaninového zeleného barviva pomocí systému Novadaq. Obrázek vlevo s klasickým laparoskopickým obrazem, uprostřed v real-time detekčním módu, vpravo v real-time kvantifikačním módu.
(Zdroj: Gynekologicko-porodnické oddělení, Nemocnice Nový Jičín AGEL a.s.).
Fig. 1. Demonstration of laparoscopic detection of indocyanine green dye using the Novadaq system. Image on the left with a classic laparoscopic image, in the middle in real-time detection mode, and on the right in real-time quantification mode.
(Source: Department of Gynecology and Obstetrics, Hospital Nový Jičín AGEL a.s.).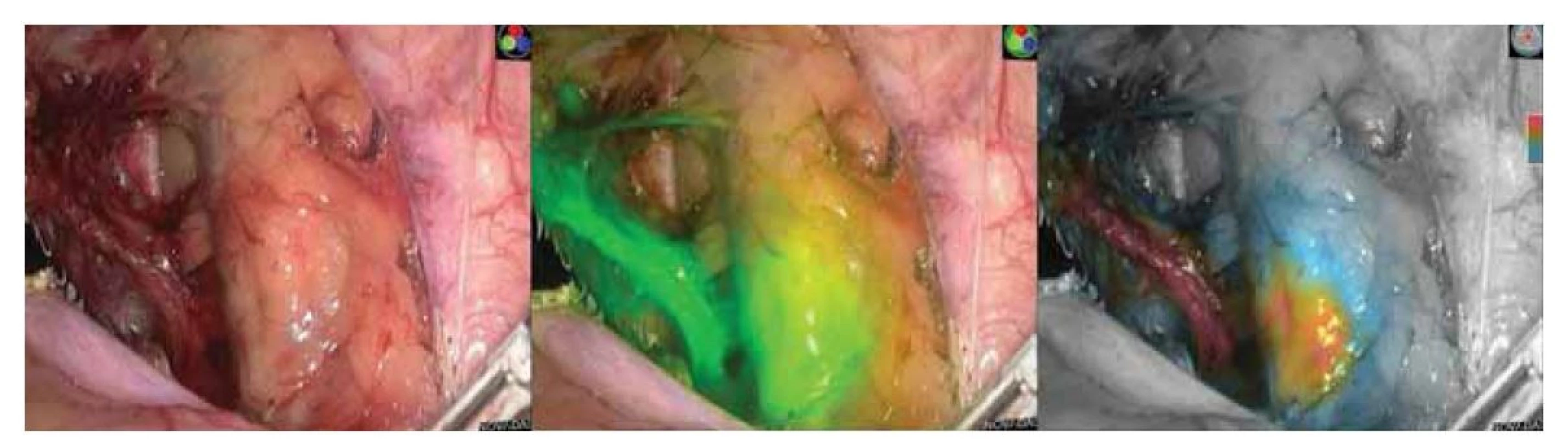
Karcinom endometria
Po karcinomu prsu druhý nejčastější gynekologický nádor byl v roce 2018 v Česku diagnostikován u 1 883 žen [21]. Postižení lymfatických uzlin je rovněž jedním z důležitých prognostických faktorů [40]. Pánevní a aortokavální lymfadenektomie je nejlepší způsob detekce uzlinových metastáz, avšak klinický význam je kontroverzní, jelikož stále nebyl potvrzen benefit v celkovém přežití pacientů [11,41]. Pravděpodobnost metastáz v uzlinách se zvyšuje s gradingem nádoru a s hloubkou myometrální invaze, kdy u grade 1 je 0 %, u grade 2 je dle myometrální invaze 10 % a 17 % resp. a u grade 3 je 7 % a 28 % [42]. Je zřejmé, že u časných stadií převažuje komplikace samotné lymfadenektomie nad přínosem pro pacienta, avšak za cenu neidentifikování případných metastáz v uzlině, u kterých by adjuvantní léčba měla potenciální přínos [43]. Biopsie sentinelové uzliny se nabízí jako řešení, kdy za cenu zlomku invazivity, kterou přináší systematická lymfadenektomie, získáme validní informaci o pravděpodobnosti metastáz v regionálních lymfatických uzlinách. Právě detekce sentinelových lymfatických uzlin pomocí ICG podstatně změnila chirurgický přístup u pacientek s karcinomem endometria. ICG se pro svou dostupnost a jednoduchost aplikace jeví jako nejefektivnější metoda [44]. Klasická peritumorózní aplikace detekční látky, která je u endometriálního karcinomu obtížná, může být nahrazena cervikální aplikací s vynikajícím záchytem sentinelových uzlin [9,45,46]. Studie FIRES, kdy byla porovnávána biopsie SLN pomocí ICG se systematickou lymfadenektomií u karcinomu endometria stadia I, dosáhlo DR 97 % s negativní prediktivní hodnotou 99,6 % [47]. Obdobnou studií byla u „high risk“ karcinomu endometria opakovanou aplikací ICG dosažena bilaterální detekce SLN v 95 %, DR 98 % a negativní prediktivní hodnota 99,5 % [48]. Tyto studie umožnily zařazení biopsie SLN do managementu endometriálního karcinomu. Další výzkum je však nutný na poli detekce SLN v paraaortální oblasti, její význam ale zatím nemá zcela jasnou pozici. Výsledky studií neodpovídají předchozím předpokladům o četnosti izolovaných aortokaválních metastáz, dle kterých by měly být metastázy v této oblasti častější [49]. Stejně jako u hrdla děložního je nutné odstranit všechny suspektní uzliny či provést systematickou lymfadenektomii při nezobrazení sentinelové uzliny.
Ostatní aplikace
Z gynekologických malignit zbývá k prozkoumání význam detekce SLN u karcinomu ovaria, kde se první práce s danou problematikou objevila v roce 2004. Od té doby byla publikována řada prací, ve kterých je však většinou zahrnuto málo pacientek s mnoha rozdílnými technikami detekce a operačními přístupy. Byly rovněž publikovány i práce s využitím ICG s vysokou DR sentinelových uzlin [15,50,51]. Práce potvrzují, že časný ovariální nádor se jeví jako příhodný k detekci sentinelových uzlin, kdy je již pravděpodobnost postižení uzlin 10–15 % [52]. Klasickým a doporučovaným přístupem je i u časných nádorů laparotomický přístup [53], přestože dosud nikdy nebylo toto doporučení dokázáno randomizovanými studiemi. Proto mapování SLN u ovariálního nádoru zatím znevýhodňuje ICG detekci, která je primárně ověřena jako laparoskopická metoda a je zde nutné čelit obdobné výzvě jako u karcinomu hrdla děložního. Modifikací biopsie SLN je kompartmentová ICG navigovaná lymfadenektomie, kde je kromě postiženého orgánu a sentinelové uzliny odstraněn také embryologicky definovaný prostor, kde se může nádor šířit [54].
Další možností použití ICG v chirurgických oborech je např. její využití k ověření dostatečné perfuze anastomózy střeva nebo perfuze střeva proktosigmoideoskopicky z hlediska sliznice [55] použitelné zejména při debulkingových operacích u pokročilého ovariálního nádoru. Anebo k ověření perfuze derivační anastomózy močových cest u předních a totálních exenterací nebo v plastické a popáleninové chirurgii k ověření výživy laloků či operační léčby lymfedému [56]. Velmi významná je detekce metastáz jater, perfuze u gastroezofageální anastomózy a její využití při operačních zákrocích na plicích. Budoucnost mají ICG značené nanočástice, které jsou schopny – aktivně, či pasivně – cíleně vyhledávat nádorové buňky, a zlepšit tak přesnost chirurgické léčby [20]. Z aplikací při terapii neonkologických onemocnění je nadějné použití ICG k detekci ložisek endometriózy či ke kontrole dostatečné perfuze tkáně při operaci na střevě nebo ureteru, a tím ke snížení počtu možných vážných pooperačních komplikací [57,58]. Neméně důležité je také zlepšení delineace hranic tumoru v souvislosti s debulkingovou operací, tj. dosažení R0 resekce tumoru.
Závěr
Biopsie sentinelové uzliny hraje stále větší roli u většiny zhoubných gynekologických nádorů v časných stadiích, kdy je při zachování onkologické bezpečnosti výrazně snížena morbidita pacientek. Fluorescenční metoda detekce ICG značených sentinelových uzlin pomocí infračervené kamery v gynekologické onkologii je nadějí ke zlepšení detekce sentinelových uzlin bez nutnosti manipulace s radioaktivními látkami, a to se zkrácením operačního času při přiměřených finančních nákladech. Stejně jako u ostatních detekčních metod je významným faktorem zkušenost operačního týmu s aplikací detekční látky a s vyhledáváním lymfatických uzlin.
Závěrem lze konstatovat, že dvěma hlavními výhodami jsou:
1. peroperační identifikace relevantních lymfatických uzlin specializovaným chirurgem a
2. možnost odlišení tzv. primárních a sekundárních sentinelových uzlin pomocí objektivní kvantifikace nasycení ICG (kdy tato objektivní kvantifikace není založena na nepřesných morfologických kritériích v současnosti běžně používaných – magnetická rezonance či počítačová tomografie).
Technika ICG je objektivní a standardizovaná, umožňující operovat jak v klasickém, tak i ve fluorescenčním modu, a to laparoskopicky i laparotomicky. Výhodou také je, že operatér provádí rozhodnutí během operace krok za krokem („step by step“), a tím je chirurgický zákrok individualizován, tj. „ušit pacientovi na míru“. Díky efektivnímu lymfatickému ICG mappingu jsme také schopni snížit frekvenci recidiv. Oproti systematické lymfadenektomii odstraňujeme pouze spádové uzliny, a nedochází tak k ponechání potenciálních metastatických uzlin. Slibně se do budoucna jeví použití ICG jak u dalších maligních, tak i benigních onemocnění.
Doručeno/Submitted: 6. 8. 2021
Přijato/Accepted: 15. 12. 2021
MUDr. Ondřej Novák
Gynekologicko-porodnická klinika
Nemocnice Nový Jičín AGEL a. s.
Purkyňova 2138/16
741 01 Nový Jičín
Zdroje
1. Cibula D, Petružela L. Onkogynekologie. Praha: Grada 2009.
2. Morton DL, Wen DR, Wong JH et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127 (4): 392–399. doi: 10.1001/archsurg. 1992.01420040034005.
3. Veronesi U, Paganelli G, Viale G et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med 2003; 349 (6): 546–553. doi: 10.1056/NEJMoa012782.
4. Levenback C, Burke TW, Morris M et al. Potential applications of intraoperative lymphatic mapping in vulvar cancer. Gynecol Oncol 1995; 59 (2): 216–220. doi: 10.1006/gyno.1995.0011.
5. Echt ML, Finan MA, Hoffman MS et al. Detection of sentinel lymph nodes with lymphazurin in cervical, uterine, and vulvar malignancies. South Med J 1999; 92 (2): 204–208. doi: 10.1097/00007611-199902000-00008.
6. Moncayo VM, Alazraki AL, Alazraki NP et al. Sentinel lymph node biopsy procedures. Semin Nucl Med 2017; 47 (6): 595–617. doi: 10.1053/j.semnuclmed.2017.06.004.
7. Nica A, Gien LT, Ferguson SE et al. Does small volume metastatic lymph node disease affect long-term prognosis in early cervical cancer? Int J Gynecol Cancer 2020; 30 (3): 285–290. doi: 10.1136/ijgc-2019-000928.
8. Van der Zee AG, Oonk MH, De Hullu JA et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol 2008; 26 (6): 884–889. doi: 10.1200/JCO.2007.14.0566.
9. Euscher ED, Malpica A, Atkinson EN et al. Ultrastaging improves detection of metastases in sentinel lymph nodes of uterine cervix squamous cell carcinoma. Am J Surg Pathol 2008; 32 (9): 1336–1343. doi: 10.1097/PAS.0b013e31816ec fe4.
10. Apple SK. Sentinel lymph node in breast cancer: review article from a pathologist’s point of view. J Pathol Transl Med 2016; 50 (2): 83–95. doi: 10.4132/jptm.2015.11.23.
11. ASTEC study group, Kitchener H, Swart AM et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet 2009; 373 (9658): 125–136. doi: 10.1016/S0140-6736 (08) 61766-3.
12. de Boer M, van Deurzen CH, van Dijck JA et al. Micrometastases or isolated tumor cells and the outcome of breast cancer. N Engl J Med 2009; 361 (7): 653–663. doi: 10.1056/NEJMoa0904832.
13. The sentinel node concept in cancers of the female genitalia. In: Schauer AJ, Becker W, Reiser M et al (eds). The sentinel lymph node concept. Berlin: Heidelberg, Springer 2005 : 431–438. doi: 10.1007/3-540-26393-4_28.
14. Hassanzade M, Attaran M, Treglia G et al. Lymphatic mapping and sentinel node biopsy in squamous cell carcinoma of the vulva: systematic review and meta-analysis of the literature. Gynecol Oncol 2013; 130 (1): 237–245. doi: 10.1016/j.ygyno.2013.04.023.
15. Abu-Rustum NR, Angiolo R, Bailey AE et al. IGCS intraoperative technology taskforce. Update on near infrared imaging technology: beyond white light and the naked eye, indocyanine green and near infrared technology in the treatment of gynecologic cancers. Int J Gynecol Cancer 2020; 30 (5): 670–683. doi: 10.1136/ijgc-2019-001127.
16. Cwalinski T, Polom W, Marano L et al. Methylene blue-current knowledge, fluorescent properties, and its future use. J Clin Med 2020; 9 (11): 3538. doi: 10.3390/jcm9113538.
17. Polom K, Murawa D, Rho YS et al. Current trends and emerging future of indocyanine green usage in surgery and oncology: a literature review. Cancer 2011; 117 (21): 4812–4822. doi: 10.1002/cncr.26087.
18. Papadia A, Gasparri ML, Mueller MD. Are allergic reactions to indocyanine green really that uncommon? A single institution experiences. Obstet Gynecol Rep 2017; 1 (2): 1–2. doi: 10.15761/OGR.1000111.
19. Hutteman M, Mieog JS, van der Vorst JR et al. Randomized, double-blind comparison of indocyanine green with or without albumin premixing for near-infrared fluorescence imaging of sentinel lymph nodes in breast cancer patients. Breast Cancer Res Treat 2011; 127 (1): 163–170. doi: 10.1007/s10549-011-1419-0.
20. Egloff-Juras C, Bezdetnaya L, Dolivet G et al. NIR fluorescence-guided tumor surgery: new strategies for the use of indocyanine green. Int J Nanomedicine 2019; 14 : 7823–7838. doi: 10.2147/IJN.S207486.
21. SVOD analýza. 2022 [online]. Dostupné z: https: //www.svod.cz/analyse.php?modul= incmor#.
22. Mahner S, Jueckstock J, Hilpert F et al. Adjuvant therapy in lymph node-positive vulvar cancer: the AGO-CaRE-1 study. J Natl Cancer Inst 2015; 107 (3): dju426. doi: 10.1093/jnci/dju426.
23. Levenback CF, Ali S, Coleman RL et al. Lymphatic mapping and sentinel lymph node biopsy in women with squamous cell carcinoma of the vulva: a gynecologic oncology group study. J Clin Oncol 2012; 30 (31): 3786–3791. doi: 10.1200/JCO.2011.41.2528.
24. Oonk MH, van Os MA, de Bock GH et al. A comparison of quality of life between vulvar cancer patients after sentinel lymph node procedure only and inguinofemoral lymphadenectomy. Gynecol Oncol 2009; 113 (3): 301–305. doi: 10.1016/j.ygyno.2008.12.006.
25. Rob L, Robova H, Pluta M et al. Further data on sentinel lymph node mapping in vulvar cancer by blue dye and radiocolloid Tc99. Int J Gynecolo Cancer 2007; 17 (1): 147–153. doi: 10.1111/j.1525-1438.2007.00806.x.
26. Soergel P, Hertel H, Nacke AK et al. Sentinel lymphadenectomy in vulvar cancer using near-infrared fluorescence from indocyanine green compared with technetium 99m nanocolloid. Int J Gynecol Cancer 2017; 27 (4): 805–812. doi: 10.1097/IGC.0000000000000996.
27. Schaafsma BE, Verbeek FP, Peters AA et al. Near-infrared fluorescence sentinel lymph node biopsy in vulvar cancer: a randomized comparison of lymphatic tracers. BJOG 2013; 120 (6): 758–764. doi: 10.1111/1471-0528.12173.
28. Institut de Cancérologie de Lorraine. Reliability of indocyanine green use in sentinel lymph node identification in cancer surgery. 2021 [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02997553.
29. Scollo P. Indocyanine green fluorescence imaging, sentinel lymph node mapping in patients with vulvar cancer: peritumoral injection dosage and waiting times in our experience. 2020 [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT04663412.
30. Sakuragi N. Up-to-date management of lymph node metastasis and the role of tailored lymphadenectomy in cervical cancer. Int J Clin Oncol 2007; 12 (3): 165–175. doi: 10.1007/s101 47-007-0661-2.
31. Benedetti Panici P, Basile S, Angioli R. Pelvic and aortic lymphadenectomy in cervical cancer: the standardization of surgical procedure and its clinical impact. Gynecol Oncol 2009; 113 (2): 284–290. doi: 10.1016/j.ygyno.2008.12.014.
32. Altgassen C, Hertel H, Brandstädt A et al. Multicenter validation study of the sentinel lymph node concept in cervical cancer: AGO Study Group. J Clin Oncol 2008; 26 (18): 2943–2951. doi: 10.1200/JCO.2007.13.8933.
33. Mathevet P, Dorez M, Lecuru F et al. Sentinel lymph node biopsy for early cervical cancer: five years follow-up of a diagnostic, prospective, multicenter study (Senticol 1). Gynecol Oncolog 2017; 145 (Suppl 1): 92–93. doi: 10.1016/j.ygyno.2017.03.217.
34. Sláma J, Zikán M, Fischerová D et al. Přínos biopsie sentinelových uzlin pro léčbu lokálně pokročilých stadií karcinomu děložního hrdla. Ceska Gynekol 2016; 81 (3): 165–170.
35. Kocián R. Význam sentinelové uzliny u pacientek s časným karcinomem děložního hrdla. Ceska Gynekol 2020; 85 (): 344–351.
36. Frumovitz M, Plante M, Lee PS et al. Near-infrared fluorescence in the detection of sentinel lymph nodes in women with cervical and uterine cancers (FILM): a randomised, phase 3, multicentre, non-inferiority trial. Lancet Oncol 2018; 19 (10): 1394–1403. doi: 10.1016/S1470-2045 (18) 30448-0.
37. Buda A, Papadia A, Di Martino G et al. Real-time fluorescent sentinel lymph node mapping with indocyanine green in women with previous conization undergoing laparoscopic surgery for early invasive cervical cancer: comparison with radiotracer ± blue dye. J Minim Invasive Gynecol 2018; 25 (3): 455–460. doi: 10.1016/j.jmig.2017.10.002.
38. Jewell EL, Huang JJ, Abu-Rustum NR et al. Detection of sentinel lymph nodes in minimally invasive surgery using indocyanine green and near-infrared fluorescence imaging for uterine and cervical malignancies. Gynecol Oncol 2014; 133 (2): 274–277. doi: 10.1016/j.ygyno.2014.02. 028.
39. Ramirez PT, Frumovitz M, Pareja R et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. N Engl J Med 2018; 379 (20): 1895–1904. doi: 10.1056/ NEJMoa1806395.
40. Pelikan HM, Trum JW, Bakers FC et al. Diagnostic accuracy of preoperative tests for lymph node status in endometrial cancer: a systematic review. Cancer Imaging 2013; 13 (3): 314–322. doi: 10.1102/1470-7330.2013.0032.
41. Seamon LG, Fowler JM, Cohn DE. Lymphadenectomy for endometrial cancer: the controversy. Gynecol Oncol 2010; 117 (1): 6–8. doi: 10.1016/j.ygyno.2009.12.025.
42. Chi DS, Barakat RR, Palayekar MJ et al. The incidence of pelvic lymph node metastasis by FIGO staging for patients with adequately surgically staged endometrial adenocarcinoma of endometrioid histology. Int J Gynecol Cancer 2008; 18 (2): 269–273. doi: 10.1111/j.1525-1438.2007.00996.x.
43. Emons G, Vordermark D. Adjuvant treatment for endometrial cancer. Curr Opin Oncol 2019; 31 (5): 404–410. doi: 10.1097/CCO. 0000000000000558.
44. Frumovitz M, Plante M, Lee PS et al. Near-infrared fluorescence for detection of sentinel lymph nodes in women with cervical and uterine cancers (FILM): a randomised, phase 3, multicentre, non-inferiority trial. Lancet Oncol 2018; 19 (10): 1394–1403. doi: 10.1016/S1470 - 2045 (18) 30448-0.
45. Bodurtha Smith AJ, Fader AN, Tanner EJ. Sentinel lymph node assessment in endometrial cancer: a systematic review and meta-analysis. Am J Obstet Gynecol 2017; 216 (5): 459.e10–476.e10. doi: 10.1016/j.ajog.2016.11.1033.
46. Geppert B, Lönnerfors C, Bollino M et al. A study on uterine lymphatic anatomy for standardization of pelvic sentinel lymph node detection in endometrial cancer. Gynecol Oncol 2017; 145 (2): 256–261. doi: 10.1016/j.ygyno.2017.02.018.
47. Rossi EC, Kowalski LD, Scalici J et al. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. Lancet Oncol 2017; 18 (3): 384–392. doi: 10.1016/S1470-2045 (17) 30068-2.
48. Persson J, Salehi S, Bollino M et al. Pelvic Sentinel lymph node detection in High-Risk Endometrial Cancer (SHREC-trial) – the final step towards a paradigm shift in surgical staging. Eur J Cancer 2019; 116 : 77–85. doi: 10.1016/j.ejca.2019.04.025.
49. Salehi S, Åvall-Lundqvist E, Legerstam B et al. Robot-assisted laparoscopy versus laparotomy for infrarenal paraaortic lymphadenectomy in women with high-risk endometrial cancer: a randomised controlled trial. Eur J Cancer 2017; 79 : 81–89. doi: 10.1016/j.ejca.2017.03.038.
50. Kleppe M, Kraima AC, Kruitwagen RF et al. Understanding lymphatic drainage pathways of the ovaries to predict sites for sentinel nodes in ovarian cancer. Int J Gynecol Cancer 2015; 25 (8): 1405–1414. doi: 10.1097/IGC. 0000000000000514.
51. Lago V, Bello P, Montero B et al. Sentinel lymph node technique in early-stage ovarian cancer (SENTOV): a phase II clinical trial. Int J Gynecol Cancer 2020; 30 (9): 1390–1396. doi: 10.1136/ijgc-2020-001289.
52. Benedetti Panici P, Angioli R. Role of lymphadenectomy in ovarian cancer. Best Pract Res Clin Obstet Gynaecol 2002; 16 (4): 529–551. doi: 10.1053/beog.2002.0301.
53. Querleu D, Planchamp F, Chiva L et al. European Society of Gynaecological Oncology (ESGO) guidelines for ovarian cancer surgery. Int J Gynecol Cancer 2017; 27 (7): 1534–1542. doi: 10.1097/IGC.0000000000001041.
54. Kimmig R, Buderath P, Rusch P et al. Early ovarian cancer surgery with indocyanine-green-guided targeted compartmental lymphadenectomy (TCL, pelvic part). J Gynecol Oncol 2017; 28 (5): e68. doi: 10.3802/jgo.2017.28.e68.
55. Blanco-Colino R, Espin-Basany E. Intraoperative use of ICG fluorescence imaging to reduce the risk of anastomotic leakage in colorectal surgery: a systematic review and meta-analysis. Tech Coloproctol 2018; 22 (1): 15–23. doi: 10.1007/s10151-017-1731-8.
56. Burnier P, Niddam J, Bosc R et al. Indocyanine green applications in plastic surgery: a review of the literature. J Plast Reconstr Aesthet Surg 2017; 70 (6): 814–827. doi: 10.1016/j.bjps.2017.01.020.
57. Ianieri MM, Della Corte L, Campolo F et al. Indocyanine green in the surgical management of endometriosis: a systematic review. Acta Obstet Gynecol Scand 2021; 100 (2): 189–199. doi: 10.1111/aogs.13971.
58. Jayakumaran J, Pavlovic Z, Fuhrich D et al. Robotic single-site endometriosis resection using near-infrared fluorescence imaging with indocyanine green: a prospective case series and review of literature. J Robot Surg 2020; 14 (1): 145–154. doi: 10.1007/s11701-019-00 951-0.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2022 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Přínos ultrazvukového vyšetření v detekci nepředpokládaných děložních a adnexálních nálezů u rekonstrukční operace pro prolaps pánevních orgánů
- Přesnost Edinburské škály poporodní deprese ve screeningu těžké depresivní poruchy a dalších psychických poruch u žen ke konci šestinedělí
- Předběžné modelování odchylky nákladů pro porovnání autologní intraovariální plazmy bohaté na trombocyty a standardní hormonální substituční terapie při menopauze
- Intramyometrální gravidita po hysteroskopické resekci reziduí – kazuistika
- Predikcia výsledku gravidity po embryotransfere na základe sérových koncentrácií choriového gonadotropínu
- Fluidothorax jako atypický pozdní hyperstimulační syndrom
- Obrovský hemangióm krku plodu spojený s postnatálnym Kasabach-Merrittovým syndrómom
- Syndrom ruka-noha-ústa v šestinedělí
- Absces mozku jako vzácná komplikace pánevní zánětlivé nemoci
- Barvení indocyaninovou zelení jako nový trend detekce sentinelových uzlin v onkogynekologii
- Domácí násilí v klinické praxi gynekologů a porodníků
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Predikcia výsledku gravidity po embryotransfere na základe sérových koncentrácií choriového gonadotropínu
- Přesnost Edinburské škály poporodní deprese ve screeningu těžké depresivní poruchy a dalších psychických poruch u žen ke konci šestinedělí
- Syndrom ruka-noha-ústa v šestinedělí
- Barvení indocyaninovou zelení jako nový trend detekce sentinelových uzlin v onkogynekologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




