-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cirkulujúca HPV DNA u pacientok s cervikálnymi prekancerózami a rakovinou krčka maternice
Circulating HPV DNA in patients with cervical precancerous lesions and cervical cancer
Objective: In our review article we focused on the circulating HPV DNA and its potential role in the pathogenesis of cervical cancer and in the evaluation of patients´ prognosis with cervical cancer
Design: The article is a systematic review study analyzing available scientific articles focused on the circulating HPV DNA.
Setting: Clinic of Obstetrics and Gynecology, Jesenius faculty of Medicine in Martin, Comenius University in Bratislava, Slovakia.
Methods: In our study we searched the medical database PubMed with the key words: circulating HPV DNA, cervical cancer, cervical precanceroses. The core of our work is focused on the scientific articles published in English language since year 1995.
Results: We identified 13 studies in PubMed database analyzing the circulating HPV DNA in the process of cervical carcinogenesis. It is clear from the results that circulating HPV DNA is a significant prognostic marker of cervical malignant diseases including the early stages.
Conclusion: The results focused on circulating HPV DNA show the significance of molecular biology in assessing the prognosis of cervical cancer. This idea has to be supported by further relevant studies. The uniformity of studies and use of the most sophisticated methods could help to answer the question about the real role of circulating HPV DNA in the process of cervical carcinogenesis and disease progression.
Keywords:
cervical cancer – HPV – circulating HPV DNA
Autoři: Š. Krivuš; E. Kúdela; S. Meršáková; V. Holubeková; Z. Laučeková; E. Gabonová; M. Ňachajová; P. Žúbor; K. Biringer
Působiště autorů: Gynekologicko-pôrodnícka klinika JLF UK, Martin, Slovenská republika, prednosta prof. MUDr. P. Žúbor, PhD, DrSc., MBA, FRSM
Vyšlo v časopise: Ceska Gynekol 2020; 85(3): 214-219
Kategorie: Přehledový článek
Souhrn
Cíl studie: V našom prehľadovom článku sme sa zamerali na cirkulujúcu HPV DNA a jej potenciálnu úlohu v patogenéze karcinómu krčka maternice a pri odhade prognózy pacientok s daným zhubným ochorením.
Typ studie: Článok predstavuje systematickú prehľadovú štúdiu analyzujúcu dostupné odborné a vedecké publikácie zamerané na cirkulujúcu HPV DNA.
Název a sídlo pracoviště: Gynekologicko-pôrodnícka klinika, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Martin, Slovensko. Metodika: V našej štúdii sme prehľadávali medicínsku databázu PubMed s kľúčovými slovami circulating HPV DNA, cervical cancer, cervical precanceroses. Jadro práce tvoria vedecké štúdie uverejnené v anglickom jazyku od roku 1995.
Výsledky: V medicínskej databáze PubMed sme identifikovali 13 štúdií analyzujúcich úlohu cirkulujúcej HPV DNA v procese cervikálnej karcinogenézy. Z výsledkov dostupných štúdií vyplýva, že cirkulujúca HPV DNA predstavuje významný prognostický marker onkologických ochorení krčka maternice, a to aj v skorých štádiách.
Závěr: Výsledky ohľadom cirkulujúcej HPV DNA poukazujú na význam molekulárnej biológie v stanovení prognózy rakoviny krčka maternice. Daná skutočnosť musí byť ďalej podporená relevantnými štúdiami. Uniformnosť štúdií a využitie najmodernejších metód by mohli napomôcť presne odpovedať na otázku o reálnej úlohe cirkulujúcej HPV DNA v procese cervikálnej karcinogenézy a progresie ochorenia.
Klíčová slova:
rakovina krčka maternice – HPV – cirkulujúca HPV DNA
ÚVOD
V roku 2012 bolo na celom svete identifikovaných 527 624 nových prípadov rakoviny krčka maternice, ktoré predstavujú 29,5 % všetkých malignít spojených s infekčným ochorením. Rakovina krčka maternice je štvrté najčastejšie zhubné ochorenie u žien a druhé najčastejšie zhubné ochorenie u žien vo veku 15–44 rokov [7]. Ukázalo sa, že infekcia vysoko rizikovým typom ľudského papillomavírusu (HPV) je kauzálne spojená s rakovinou krčka maternice v 99,7 % prípadov [25]. V súčasnosti je považovaných za karcinogénne alebo vysoko rizikové HPV vírusy 12 typov (HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV56, HPV58 a HPV59) [2].
HPV infekcia vedúca k rozvoju cervikálnych prekanceróz postihuje špecifické oblasti prechodných epitelových buniek cervixu (napr. bunky skvamokolumnárnej junkcie) so zložitými regulačnými vzormi, ktoré ich môžu robiť náchylné voči transfomujúcej vírusovej infekcii [10]. Prirodzený prenos kožnej infekcie zahŕňa fyzický kontakt keratinizovanej vrstvy bradavice so zdravou pokožkou s mikroabráziami, ktoré umožňujú prenos exfoliovaných buniek obsahujúcich vírus do rany. Uvoľňovanie vírusov z postihnutých skvamóznych buniek by mohlo byť založené na rozklade keratínových vláken pod vplyvom vírusového proteínu E4 a mikrobiálnych/hostiteľských proteáz [20]. Slizničné HPV lézie sa vyvíjajú na základe mechanického poškodenia pri pohlavnom styku alebo ako následok vaginálnej a análnej infekcie. Otázkou je, či by virióny mohli dosiahnuť bazálne bunky cez obrátený transport v oblasti epiteliálneho konfliktu (transformačná zóna) [28]. Bunkové experimenty ukázali, že virióny sa môžu viazať na bunkové filopódie a tak byť reverzne transportované ďalej na významné vzdialenosti (prenos z bunky do bunky alebo z bunky do extracelulárnej matrix), čím bola vynechaná klasická dráha poškodenia epitelu [21].
CIRKULUJÚCA HPV DNA
HPV mRNA a DNA boli detegované v periférnej krvi u pacientov s pokročilou rakovinou krčka maternice, zhubným ochorením hlavy a krku, pričom korelovali so zlou prognózou [3,16,24]. Hypotéza týkajúca sa úlohy HPV DNA v metastatickom procese je však stále nevyriešená. Plazma od pacientov so zhubným ochorením použitá ako kultivačné médium má schopnosť transformácie buniek, preto Wischwendter a kol. predpokladali, že cirkulujúca HPV DNA (cHPV-DNA) hrá možnú úlohu v tvorbe metastáz [27]. Prítomnosť danej DNA v krvi je však skôr markerom nádorovej záťaže (tumor load), nie markerom životaschopných nádorových buniek. Presný mechanizmus uvoľnovania HPV DNA do cirkulácie je stále neznámy, hoci vieme, že odráža rozsah nádorového ochorenia, a preto má dôležitú prognostickú hodnotu. Cirkulujúca DNA je vo všeobecnosti lepší marker ako RNA, keďže je podstatne stabilnejšia [8].
DNA vysokorizikových HPV vírusov sa našla aj na viacerých exotických miestach vrátane prsníkov, pľúc, hrubého čreva a pažeráka. Vírusové nukleové kyseliny boli detegované dokonca aj v spermatických bunkách, placentárnom tkanive alebo PBMCS [5].
Presný mechanizmus, ktorý dáva odpoveď na tak rozšírenú infekciu HPV DNA, zostáva nevyriešený. Prítomnosť HPV DNA v plazme môže byť spôsobená rôznymi faktormi. Prvá možnosť zahŕňa myšlienku vírusových častíc pochádzajúcich priamo z krvi, aj keď sa v obehu priama prítomnosť viriónov nepreukázala [24]. Druhá možnosť zahŕňa nekrózu primárneho nádoru a jeho rozpad [23]. Tento scenár je tiež otázny z dôvodu zachytenia plazmatickej HPV DNA aj v skorých štádiách rakoviny krčka maternice a znížených hladín HPV DNA po primárnej liečbe, ktorá by logicky viedla k roztrúseniu DNA do cirkulácie [17]. Tretia možnosť je založená na apoptickom procese straty bunkovej membrány a uvoľnení viriónov do cirkulácie. Táto možnosť je tiež nejasná, vzhľadom na fakt, že apoptotický proces je počas procesu karcinogenézy downregulovaný prostredníctvom inhibície p53 proteínom HPV E6. Ďalšia premenná, ktorá ovplyvňuje metastatický proces, je imunitný systém, ktorý by mohol vysvetlovať rozdiel medzi pozitívnymi hodnotami cirkulujúcej HPV DNA a chýbajúcim dôkazom aktívnej infekcie [3].
MATERIÁL A METODIKA
V našej prehľadovej práci sme sa zamerali na cirkulujúcu HPV DNA a jej potenciálnu úlohu v patogenéze karcinómu krčka maternice a pri odhade prognózy pacientov s daným zhubným ochorením. V medicínskej databáze PubMed sme identifikovali 13 štúdií analyzujúcich úlohu cirkulujúcej HPV DNA v procese cervikálnej karcinogenézy. Zhrnutie dostupných prác s dôrazom na typy analyzovaných vzoriek, typy cirkulujúcej HPV DNA a percento pozitívnych vzoriek na prítomnosť cirkulujúcej HPV DNA je znázornené v tabuľkách 1 a 2.
Tab. 1. Štúdie hodnotiace cirkulujúcu HPV DNA u pacientok s cervikálnymi prekancerózami a rakovinou krčka maternice 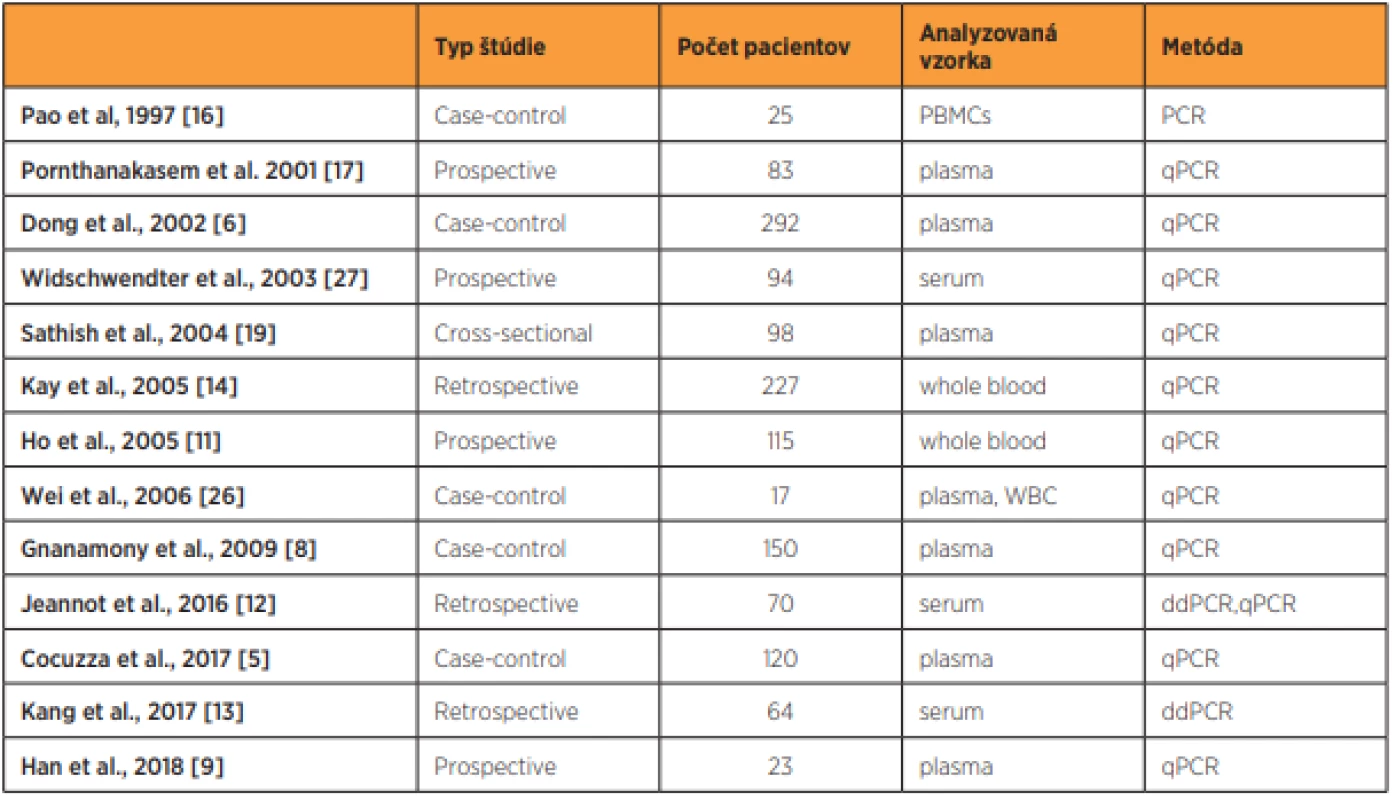
HPV – ľudský papillomavírus, ddPCR – angl, digital droplet polymerase chain reaction, qPCR – angl. quantitative polymerase chain reaction, PBMC – mononukleárne bunky periférnej krvi, WBC – biele krvinky Tab. 2. Percentuálne hodnoty pozitívnych vzoriek s cirkulujúcou HPV DNA u pacientok s rakovinou krčka maternice, cervikálnymi prekancerózami a negatívnou cytológiou 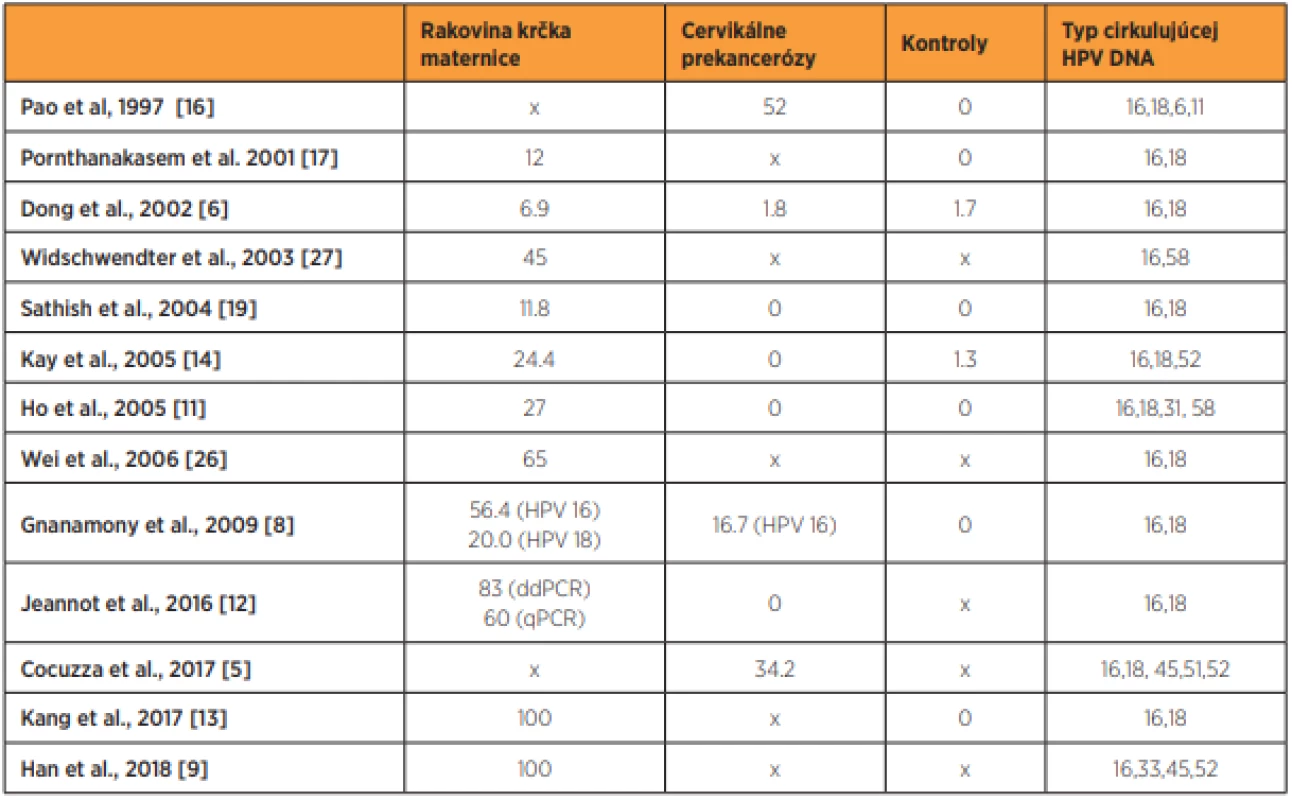
HPV – ľudský papillomavírus, ddPCR – angl. digital droplet polymerase chain reaction, qPCR – angl. quantitative polymerase chain reaction, x – štúdia nezahŕňala danú kategóriu HPV DNA NACHÁDZAJÚCA SA V PERIFÉRNYCH MONONUKLEÁRNYCH BUNKÁCH (PBMCS)
HPV DNA je detegovateľná v mononukleárnych bunkách periférnej krvi (PBMC), v plazme alebo v sére pacientov s rakovinou krčka maternice a rakovinou orofaryngu. Aj keď nie je pozorovaná žiadna viremická fáza počas HPV infekcie, je i naďalej potrebné zamerať výskum na mononukleárne bunky (PMBC) ako nosiče HPV DNA. Úspešný prenos bovínneho papilomavírusu typu 2 z periférnej krvi medzi jedincami poukázal na istú pravdepodobnosť hematogénnej cesty šírenia infekcie [22].
HPV DNA detegovaná v periférnej krvi bola pôvodne chápaná ako dôsledok metastazujúcich buniek a bunkových zvyškov uvoľnených do cirkulácie. Teraz sa naskytá otázka ohľadom možného šírenia ochorenia prostredníctvom PBMCs. PBMC migrujú do miesta zápalu a absorbujú mikroorganizmy z tkanív a krvi. Je možné, že PBMC vykonávajú tento druh obranného mechanizmu známeho pri iných vírusových infekciách aj pri infekcii HPV [1].
Prvá štúdia hodnotiaca prítomnosť HPV DNA v mononukleárnych krvných bunkách u pacientov s urogenitálnymi infekciami bola publikovaná autormi Pao et al. v roku 1990 [16]. Hoci autori identifikovali iba fragmenty HPV DNA zodpovedajúce fragmentu DNA (ORF E6), je to stále prvá štúdia analyzujúca spojitosť HPV infekcie a PBMC. Bola vyslovená hypotéza, že súčasné pozorovanie HPV DNA v PBMC môže predstavovať interakciu HPVPBMC a môže hrať úlohu v imunitnej odpovedi na HPV infekciu [16]. Prítomnosť HPV genómu v PBMC bola takisto analyzovaná u pediatrických pacientov s HIV infekciou. PBMC HPV DNA pozitivita bola diagnostikovaná u 8 pacientov (14 %), ktorí boli infikovaní, v 7 prípadoch krvnou transfúziou. Všetci pacienti boli bez anamnézy pohlavného styku, takže HPV infekcia mohla byť získaná práve prostredníctvom krvných produktov. Tento fakt podporuje myšlienku možného prenosu krvou, hoci pozitivita HPV 16 DNA u týchto pacientov bola len prechodná [1]. Na druhej strane Bodaghi a kol. neboli schopní dokázať HPV transkripty z HPV pozitívnych PBMC alebo definovať presnú subpopuláciu buniek (monocyty, lymfocyty), čo naznačuje, že PBMC neumožňujú množenie vírusu.
Počas integrácie HPV vírusu dochádza k porušeniu E2 génu, čo umožňuje expresiu proteínov E6 a E7. E2 proteín bol dokázaný vo všetkých prípadoch pozitívnych na HPV, čo dokazuje prítomnosť HPV DNA v PBMC v epizomálnej forme [35].
V krvi boli doteraz detegované iba slizničné typy HPV bez aktívnej replikácie [4]. Chen a kol. izolovali HPV DNA z PBMC u 15 zo 180 zdravých mužských darcov krvi (8,3 %), v 3 prípadoch boli zistené vírusy HPV 16 a HPV 18 (1,7 %). Ostatné HPV vírusy patrili do rodov Alfa (HPV 27, HPV 32, HPV 70, HPV 97 a HPV 102), Beta (HPV 12, HPV 15 a HPV 47) a Gamma (HPV 48, HPV 65, HPV FA31 a HPV FA55). HPV DNA bola dokázaná v krvi iba bez ošetrenia trypsínom. Preto sa zdá, že HPV je pripojený k PBMC ako povrchový proteín [4]. Táto štúdia poskytuje dôkaz, že HPV sa nemusí šíriť iba pohlavným stykom, odreninami kože alebo priamym kontaktom [4].
PROGNOSTICKÁ HODNOTA CIRKULUJÚCEJ HPV DNA
Detekcia cirkulujúcej HPV DNA sa výrazne líši medzi štúdiami v závislosti od metodiky a pohybuje sa medzi 6,9 až 100 %. Dostupné štúdie použili rôzne biologické materiály (sérum/plazma), rôzne DNA extrakčné metódy a techniky detekcie, takže porovnanie hladín HPV DNA je obmedzené. Vyššie koncentrácie genómovej HPV DNA (20krát ) sa našli v sére s tzv. cell-free DNA [15].
V prípade diagnostických metód sa tzv. double droplet PCR (ddPCR) zdá byť najpresnejšou technikou na detekciu cirkulujúcej HPV DNA. V porovnaní s klasikcou PCR bol pozorovaný signifikantný rozdiel v záchyte DNA (83 % vs 60 %). Množstvo HPV DNA záviselo hlavne od štádia ochorenia a veľkosti tumoru [12].
Percento pozitívnych prípadov v prípade HPV 16 rastie so štádiom ochorenia (I:25 % – II: 61,3 % – III: 74,3 % – IV: 100 %). Stredová hodnota tzv. vírusovej nálože (viral load) v prípadoch cervikálneho karcinómu dosahuje pre HPV 16 174–699 kópií/ml a pre HPV 18 200–2590 kópií/ml [8]. Vírusová DNA pochádza zo samotného nádoru, ktorý je charakterizovaný rovnakým typom HPV vírusu detegovaným v plazme a samotnom nádore [17]. Štúdia Widschwendter detegovala HPV DNA v plazme v 45 % prípadov rakoviny krčka maternice, pričom pri dvoch prípadoch boli zistené odlišné typy vírusov v nádore a plazme (HPV 18-16 a HPV 33-16). Štyri pacientky s pozitívnou plazmatickou HPV DNA neboli onkologickí pacienti. Bol pozorovaný trend k vyššej miere detekcie séra hlavne v pokročilom štádiu nádoru (52 % a 50 % v štádiu III a IV). Dva prípady s rôznymi typmi HPV v sére a tkanivách môžu byť spôsobené nezistenou dvojitou infekciou. Obe pacientky boli v skorom štádiu rakoviny krčka maternice [27]. Štúdia autorov Sathish a kol. na druhej strane dosiahla 100% zhodu typov HPV v krvi a samotnom nádore [19].
Prípady bez dokázanej cirkulujúcej HPV DNA neboli v čase trvania štúdie Ho et al. spojené s rekurenciou ochorenia. Na druhej strane pacientky s vysokou vírusovou záťažou HPV52 DNA mali veľmi zlú prognózu a zomreli do 8 mesiacov [11]. Podobne bola pozorovaná aj asociácia cirkulujúcej HPV DNA a vzdialených metastáz. Polovica pacientov s cirkulujúcou HPV DNA sa prezentovalo s metastatickým rozsevom s relatívnym rizikom (RR) 15.67. Detegovaná vírusová DNA pochádza zo samotného tumoru, čo dokazuje aj rovnaký typ HPV DNA prítomnej v plazme [17]. Identifikovateľná plazmatická HPV DNA na konci chemoterapie predbiehala klinickú diagnózu metastatického rozsevu a bola spojená s horším prežívaním. Cirkulujúca HPV DNA je dokonca presnejšia v diagnostike reziduálneho ochorenia ako FDG-PET [9]. Autorský kolektív Kang et al. ďalej publikoval, že cirkulujúca HPV DNA môže byť použitá pri T-bunkovej imunoterapii a môže slúžiť ako marker efektivity v liečbe cervikálneho karcinómu počas follow-up.
Prognostická hodnota cirkulujúcej HPV DNA môže hrať významnú úlohu aj v prípade skorých štádií rakoviny krčka [19]. Kay et al. dokázali cirkulujúcu HPV DNA u 24,4 % prípadov karcinómu, pričom prekancerózne lézie neboli spojené s HPV DNA ani v jednom z pozorovaných prípadov. Miera detekcie cirkulujúcej HPV DNA v štádiu I a II bola relatívne vysoká a dosahovala 52,9 % [26]. c-HPV DNA bola dokázaná aj v prípadoch s minimalistickými rozmermi nádoru; konkrétne išlo o nádory s priemerom iba 1 mm [12]. Cirkulujúca HPV DNA bola zachytená aj v jednom prípade karcinómu in situ a jednej zdravej kontrole [5]. Príčinou mohla byť aj kontaminácia vzorky alebo skrytá malignita v tele pacientky.
Iba niekoľko štúdií analyzovalo cirkulujúcu HPV DNA v plazme pacientok s prekancerózami krčka maternice. Cocuzza a kol. dokázali 38,9% pozitivitu cHPV DNA v léziách HSIL a 15,4% v iných prípadoch zmenenej cytológie. Najbežnejšími typmi vírusov boli HPV 45 (46,3 %), HPV 51 (29,6 %) a HPV 16 (18,5 %). Najvyššia hodnota vírusovej nálože v plazme bola pozorovaná pri víruse HPV 16 (1099 kópií na ml). Zhoda v detekcii danej HPV DNA medzi vzorkami plazmy a krčka maternice bola iba 44 % [5]. Mohlo by to byť dôsledkom vírusového clearance a prítomnosti HPV vírusovej infekcie mimo genitálu [1, 12, 18].
ZÁVER
Náš prehľadový článok dostupných publikácií v medicínskych databázach poukázal na možnú prognostickú úlohu cirkulujúcej HPV-DNA nielen v prípadoch pokročilých štádií rakoviny krčka maternice, ale aj v lokalizovaných léziách. Táto skutočnosť vyvoláva otázku, či cHPV-DNA môže slúžiť ako nepriaznivý prediktor prežívania pacientok s potrebou radikálnejšej liečby. Podobne môže byť cHPV-DNA použitá v budúcnosti aj na sledovanie po chirurgickom výkone a adjuvantnej terapii. Pozitivita cHPV-DNA v prípadoch prekanceróz ostáva diskutovaným výsledkom s možným využitím ako triage testu. Daná skutočnosť musí byť ďalej podporená relevantnými štúdiami. Uniformnosť štúdií a využitie najmodernejších metód molekulovej biológie by mohli napomôcť presne odpovedať na otázku o reálnej úlohe cHPV-DNA v procese cervikálnej karcinogenézy a progresie ochorenia.
Táto publikácia je podporená projektom: Molekulárna diagnostika rakoviny krčka maternice, ITMS: 26220220113.
MUDr. Štefan Krivuš, CSc.
Gynekologicko-pôrodnícka klinika JLF UK
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: stefan.krivus@uniba.sk
Zdroje
1. Bodaghi, S., Wood, LV., Roby, G., et al. Could human papillomaviruses be spread through blood? J Clin Microbiol, 2005, 43(11), p. 5428–5434.
2. Bouvard, R., Baan, K., Straif, Y., Grosse, B., et al. A review of human carcinogens-part B: biological agents. Lancet Oncol, 2009, 10(4), p. 321–322.
3. Capone, RB., Pai, SI., Koch, WM., et al. Detection and quantitation of human papillomavirus (HPV) DNA in the sera of patients with HPV-associated head and neck squamous cell carcinoma. Clin Cancer Res, 2000, 6, p. 4171–4175.
4. Chen, ACH., Keleher, A., Kedda, MA., et al. Human papillomavirus DNA detected in peripheral blood samples from healthy Australian male blood donors. J Medic Virol, 2009, 81, p. 1792 – 1796.
5. Cocuzza, CE., Martinelli, M., Sina, F., et al. Human papillomavirus DNA detection in plasma and cervical samples of women with recent history of low-grade or precancerous cervical dysplasia. PLoS One, 2017, 12(11), p. e0188592.
6. Dong, SM., Pai, SI., Rha, SH., et al. Detection and quantitation of human papillomavirus DNA in the plasma of patients with cervical carcinoma. Cancer Epidemiol Biomarkers Prev, 2002, 11(1), p. 3–6.
7. Ferlay, J., Soerjomataram, I., Ervik, M., et al. GLOBOCAN 2012 v1.0, Cancer incidence and mortality worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013. Available online: http://globocan. iarc.fr.
8. Gnanamony, M., Peedicayil, A., Subhashini, J., et al. Detection and quantitation of HPV 16 and 18 in plasma of Indian women with cervical cancer. Gynecol Oncol, 2010, 116, 447–451.
9. Han, K. Circulating human papillomavirus DNA as a biomarker of response in patients with locally advanced cervical cancer treated with definitive chemoradiation. JCO Precision Oncology, 2, 2018, doi:10.1200/PO.18.00152.
10. Herfs, M., Yomamoto, Y., Laury, A., et al. A discrete population of squamocolumnar junction cells implicated in the pathogenesis of cervical cancer. Proc Natl Acad Sci, 2012, 109, p. 10516–10521.
11. Ho, CM., Yang, SS., Chien, TY., et al. Detection and quantitation of human papillomavirus type 16, 18 and 52 DNA in the peripheral blood of cervical cancer patients. Gynecol Oncol, 2005, 99(3), p. 615–621.
12. Jeannot, E., Becette, V., Campitelli, M., et al. Circulating human papillomavirus DNA detected using droplet digital PCR in the serum of patients diagnosed with early stage human papillomavirus-associated invasive carcinoma. J Pathol Clin Res, 2016, 2(4), p. 201–209.
13. Kang, Z. Circulating cell-free DNA for metastatic cervical cancer detection, genotyping, and monitoring. Clin Cancer Res, 23, 2017, p. 6856–6862.
14. Kay, P., Allan, B., Denny, L., et al. Detection of HPV 16 and HPV 18 DNA in the blood of patients with cervical cancer. J Med Virol, 2005, 75(3), p. 435–439.
15. Lee, TH., Montalvo, L., Chrebtow, V., Busch, MP. Quantitation of genomic DNA in plasma and serum samples: higher concentrations of genomic DNA found in serum than in plasma. Transfusion, 2001, 41, p. 276–228.
16. Pao, CC., Hor, JJ., Yang, FP., et al. Detection of human papillomavirus mRNA and cervical cancer cells in peripheral blood of cervical cancer patients with metastasis. J Clin Oncol, 1997, 15, p. 1008–1012.
17. Pornthanakasem, W., Shotelersuk, K., Termrungruanglert, W.,et al. Human papillomavirus DNA in plasma of patients with cervical cancer. BMC Cancer, 2001, 1, p. 2.
18. Roperto, S., Comazzi, S., Ciusani, E., et al. PBMCs are additional sites of productive infection of bovine papillomavirus type 2. J Gen Virol, 2011, 92(Pt 8), p. 1787–1794.
19. Sathish, N., Abraham, P., Peedicayil, A., et al. HPV DNA in plasma of patients with cervical carcinoma. J Clin Virol, 2004, 31(3), p. 204–209.
20. Singh, B., Fleury, C., Jalalvand, F., Riesbeck, K. Human pathogens utilize host extracellular matrix proteins laminin and collagen for adhesion and invasion of the host. FEMS Microbiol Rev, 2012, 36(6), p. 1122–1180.
21. Smith, JL., Lidke, DS., Ozbun, MA. Virus activated filopodia promote human papillomavirus type 31 uptake from the extracellular matrix. Virology, 2008, 381(1), p. 16–21.
22. Stocco dos Santos. RC., Lindsey, CJ., Ferraz, OP., et al. Bovine papillomavirus transmission and chromosomal aberrations: an experimental model. J Gen Virol, 1998, 79, p. 2127–2135.
23. Stroun, M., Maurice, P., Vasioukhin, V., et al. The origin and mechanism of circulating DNA. Ann NY Acad Sci, 2000, 906, p. 161–168.
24. Tseng, CJ., Pao, CC., Lin, JD., et al. Detection of human papillomavirus types 16 and 18 mRNA in peripheral blood of advanced cervical cancer patients and its association with prognosis. J Clin Oncol, 1999, 17, p. 1391–1396.
25. Walboomers, JM., Jacobs, MV., Manos, MM., et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1991, 189(1), p. 12–19.
26. Wei, YC., Chou, YS., Chu, TY. Detection and typing of minimal human papillomavirus DNA in plasma. Int J Gynaecol Obstet, 2007, 96(2), p. 112–116.
27. Widschwendter, A., Blassnig, A., Wiedemair, A., et al. Human papillomavirus DNA in sera of cervical cancer patients as tumor marker. Cancer Lett, 2003, 202, p. 231–239.
28. Yang, EJ., Quick, MC., Hanamornroongruang, S., et al. Microanatomy of the cervical and anorectal squamocolumnar junctions: a proposed model for anatomical differences in HPVrelated cancer risk. Mod Pathol, 2015, 28(7), p. 994–1000.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2020 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Screening RHD genotypu plodu u RhD negativních žen
- Efektivita stanovení KEL a RHCE genotypu plodu u aloimunizovaných žen minisekvenací
- miRNA profil luminálnych podtypov karcinómu prsníka v súbore slovenských žien
- Dotazníková studie prevalence inkontinence moči v těhotenství a v raném šestinedělí
- Koincidence obrovské děložní myomatózy a prvozáchytu dvou pokročilých malignit u 77leté pacientky
- Náhodný nález pánevní splenózy při gynekologické operaci
- Prodloužená gravidita: nezvyklý případ
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Role neutrofilů u preeklampsie
- Cirkulujúca HPV DNA u pacientok s cervikálnymi prekancerózami a rakovinou krčka maternice
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Prof. MUDr. Adolf Štafl, Ph.D. (1931–2020)
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Prodloužená gravidita: nezvyklý případ
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



