-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti diagnostiky prekanceróz a karcinomu děložního hrdla
Dysplasia and cervical cancer: current diagnostic possibilities
Objective:
To review current methods in the diagnosis of dysplasia and cervical cancer.Design:
Review article.Setting:
Reprofit International Ltd., Brno; Department of Gynecology and Obstetrics, University Hospital and Faculty of Medicine, Masaryk University, Brno; Biopticka laborator Ltd., Pilsen.Methods and results:
Nowadays, there are non-invasive methods for more accurate and timely detection of uterine cervix lesions. Digital images of the uterine cervix can be analysed by a computer for characteristic features and colour patterns, which may enhance the objectivity of the colposcopic examination. Digital image processing technology and biomarkers detection (p16/Ki-67) are useful in liquid based cytology (LBC). At the molecular genetic level different tests are used to detect deoxy - or ribonucleic acid (DNA, RNA) of high-risk types of human papillomavirus (HR HPV). The introduction of HPV testing in screening procedures in the Czech Republic will further in-crease the sensitivity of screening. However, the most specific identification of cervical high-grade lesions appears to be an mRNA detection of oncogenes E6 and E7. The advanced method for the assessment of cervical lesion progress in HR HPV positive women is to determine the methylation of tumor supressor genes that normally prevents the cancer growth.Conclusion:
Screening programs, inviting women to direct preventive gynecological examinations by health insurance, but also efficient utilization of available methods could lead to early detections of cervical dysplasias.Keywords:
cervical dysplasia and cancer, SIL, colposcopy, LBC, HPV, methylation, mRNA
Autoři: L. Rotter 1,2; P. Rotterová 3; I. Kinkorová Luňáčková 3; J. Kašpírková 3; M. Michal 3; R. Hudeček 2
Působiště autorů: Reprofit International s. r. o., Brno 1; Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA 2; Bioptická laboratoř, s. r. o., Plzeň 3
Vyšlo v časopise: Ceska Gynekol 2014; 79(4): 314-320
Souhrn
Cíl studie:
Přehled současných metod v diagnostice prekanceróz a karcinomů děložního hrdla.Typ studie:
Literární přehled.Název a sídlo pracoviště:
Reprofit International s.r.o., Brno; Gynekologicko-porodnická klinika Fakultní nemocnice a Lékařské fakulty Masarykovy univerzity, Brno; Bioptická laboratoř s.r.o., Plzeň.Předmět a metoda studie:
V současné době je pro včasnou detekci lézí děložního hrdla k dispozici celá skupina neinvazivních prebioptických metod, která zaznamenala dynamický rozvoj. Zavedení digitalizace kolposkopického obrazu a použití spektroskopických technik umožní vytvoření barevného mapování slizničních změn děložního hrdla. V oblasti onkologické cytologie nastupuje využití biomarkerů (např. p16/Ki-67) a počítačové analýzy obrazu v tekutých cytologiích (Liquid Based Cytology – LBC). Na molekulárně genetické úrovni se používají různé typy testů k detekci deoxy - nebo ribonukleové kyseliny (DNA, RNA) vysoce rizikových typů lidských papilomavirů (High Risk Human Papillomavirus – HR HPV). Zavedení HPV testace do screeningových postupů v ČR dále zvýší citlivost screeningu. Přesnější se k identifikaci lézí vysokého stupně na děložním hrdle jeví detekce onkogenů E6 a E7, resp. jejich mRNA. Dalším upřesněním vývoje cervikální léze u HR HPV pozitivních žen je stanovení metylace tumorsupresorových genů, které normálně brání rozvoji rakovinného bujení, a jsou v případě metylace deaktivovány.Závěr:
Screeningové programy, adresné zvaní žen k preventivním gynekologickým prohlídkám zdravotními pojišťovnami a také účelné využití prebioptických a bioptických metod by mělo vést k včasnému záchytu prekanceróz děložního hrdla a následně ke snížení incidence karcinomu děložního hrdla.Klíčová slova:
prekancerózy a karcinomy děložního hrdla, SIL, kolposkopie, LBC, HPV, metylace, mRNAÚVOD
Karcinom děložního hrdla, především dlaždicobuněčný (spinocelulární) karcinom, je jedním z nejčastějších zhoubných nádorů u žen v celosvětovém měřítku. V roce 2012 bylo ve světě diagnostikováno více než 527 000 nových případů a přibližně 265 000 žen zemřelo v souvislosti s tímto onemocněním [36]. Podle údajů Systému pro vizualizaci onkologických dat (SVOD) z roku 2010 byla incidence invazivního karcinomu děložního hrdla v České republice (ČR) 18,53 případů na 100 000 žen a mortalita byla v tomto období 7,16 úmrtí na 100 000 žen. To bylo v absolutních počtech 994 nově diagnostikovaných nádorů a 384 žen v roce 2010 na toto onemocnění zemřelo [35]. Prekancerózy a karcinomy děložního hrdla jsou sdruženy s infekcí vysoce rizikovými lidskými papillomaviry (high risk human papilloma virus – HR HPV). Prekancerózy se dělí na dlaždicové (skvamózní) a žlázové (glandulární). Skvamózní intraepite-liální léze (SIL) rozdělujeme na léze nízkého stupně („low grade“ – LG SIL, LSIL, dříve cervikální intraepiteliální neoplazie I = CIN I) a léze vysokého stupně („high grade“ – HG SIL, HSIL, dříve CIN II, III a karcinom in situ = CIS) [22]. Druhou skupinou jsou glandulární intraepiteliální léze zastoupené adenokarcinomem in situ (AIS). Z maligních epitelových nádorů je nejvíce zastoupen dlaždicobuněčný (spinocelulární) karcinom (60 až80 %). Adenokarcinomy tvoří 10–15 %. Ostatní typy karcinomů jsou vzácné.
Metody, které jsou používány k diagnostice prekanceróz a karcinomu děložního hrdla, je možné rozdělit na dvě hlavní skupiny – metody prebioptické a bioptické. Prebioptické metody jsou neinvazivní techniky signalizující možný přednádorový stav. K nim patří kolposkopické vyšetření, spektroskopie, onkologická cytologie a HPV testace. Diagnóza by měla být potvrzena odběrem tkáně – biopsií.
Se zavedením preventivních programů, především cytologického screeningu (onkologické exfoliativní cytologie), incidence cervikálního karcinomu ve vyspělých zemích klesá. Výsledky onkologické cytologie upřesňuje zavedení HPV testace do screeningových programů [37]. Na začátku roku 2008 zahájilo také Ministerstvo zdravotnictví ČR celorepublikový screeningový program zaměřený na včasný záchyt karcinomu děložního hrdla. Zdravotní pojišťovny v ČR od 1. ledna 2014 zavedly adresné zvaní občanů k preventivním vyšetřením na rakovinu děložního hrdla, prsu, tlustého střeva a konečníku.
S probíhající vakcinací proti lidským papillomavirům (HPV) se očekává další pokles výskytu prekanceróz a karcinomu děložního hrdla [16].
KOLPOSKOPIE
Kolposkopické vyšetření
Dělí se na nativní a rozšířenou kolposkopii. Při nativní kolposkopii je vyšetřovaná oblast pozorována bez podání jakéhokoli roztoku nebo jen po setření tamponem napuštěným ve fyziologickém roztoku. Kolposkopie rozšířená využívá k eliminaci faktorů zhoršujících přehlednost (zejména hlen a krev) aplikaci roztoků, které současně zvýrazní případné změny ve tkáni. Nejčastěji se používá 5% roztok kyseliny octové nebo Lugolův roztok. Kolposkopem jsou patrné povrchové změny sliznice a změny ve tvaru a uspořádání cév. Pro jednotlivé nálezy je zavedeno odborné názvosloví, jehož cílem je popisné vyjádření závažnosti pozorovaných změn [10]. Pro provádění specializovaných kolposkopických vyšetření je nutná funkční licence pro expertní kolposkopii F017. Jejím cílem je definování minimálních standardů pro výkon kolposkopie (např. minimální počet diagnostikovaných HG lézí za rok, požadované technické vybavení apod.).
Cervikografie
Zaznamenání obrazu děložního hrdla fotoaparátem bylo publikováno prof. Štaflem v roce 1981 [29]. Snímky mohla pořídit i školená obsluha, která je předala expertům k vyšetření. Limitací byla nutnost pořízené snímky vyvolávat. Nyní je možné obrazy v reálném čase snímat digitální kamerou, elektronicky distribuovat a archivovat. Studie ukázaly, že senzitivita cervikografie je nižší než senzitivita konvenční onkologické cytologie, specificita je vyšší [29]. Etherington metodu modifikoval na přenos celé pořízené videosekvence [9].
Digitální kolposkopie
Obraz je již při pořízení zpracován a převeden do počítačové podoby stejně jako např. v digitálním fotoaparátu. Kvalitní snímače standardně nabízejí vysoké rozlišení obrazu, které umožní prohlédnout i drobné detaily. Snímky je možné dále zpracovávat (úpravy barev, jasu, kontrastu, digitální korekce obrazu) a zasílat (e-mail, FTP transfer, digitální úložiště, cloudové služby, speciální programy a aplikace) [18]. Telemedicína je elektronický přenos lékařských informací od pacienta k lékaři. Využívá telekomunikačních a informačních technologií. Dálkové datové přenosy se dnes nejčastěji dějí celosvětovou sítí internet s možností šifrování přenosu dat. Pro archivace biomedicínských obrazových informací byl vypracován standard Picture Archiving and Communication System (PACS). Používají ho systémy, které vytváří digitální obrazy (např. ultrazvuky, CT, magnetická rezonance, digitální kolposkopie apod.). Komunikace s těmito archivy informací obvykle probíhá podle protokolu Digital Imaging and Communications in Medicine (DICOM).
SPEKTROSKOPIE
Techniky využívající možností elektromagnetického spektra – infračerveného (700–900 μm), viditelného (400–700 μm) a ultrafialového (315 až 400 μm). Jsou to neinvazivní metody, které pomocí elektromagnetického spektra různých délek studují vlastnosti tkáně [33].
Dynamic Spectral Imaging System (DySIS)
Je to kolposkopické vyšetření s dynamickým spektrálním zobrazením (Dynamic Spectral Imaging = DSI). Zaznamenávají se povrchové změny děložního hrdla po aplikaci kyseliny octové v reálném čase, počítač vytvoří barevné mapování a škála barev vyjadřuje riziko HG léze. Jednotlivé barvy odpovídají rychlosti zbělení po aplikaci kyseliny octové. Podle literárních údajů je senzitivita metody DSI pro detekci HG lézí 79 % a pro konvenční kolsposkopii 55 % [19, 40]. DSI je v detekci HG lézí děložního hrdla citlivější než kolposkopie. Citlivost narůstá, je-li barevné mapování kombinované se standardním kolposkopickým vyšetřením [18, 28] (obr. 1, 2).
Obr. 1. Digitální kolposkopie – nález na porci za 20 sekund po aplikaci 5% roztoku kyseliny octové (biopticky byla potvrzena HG léze) 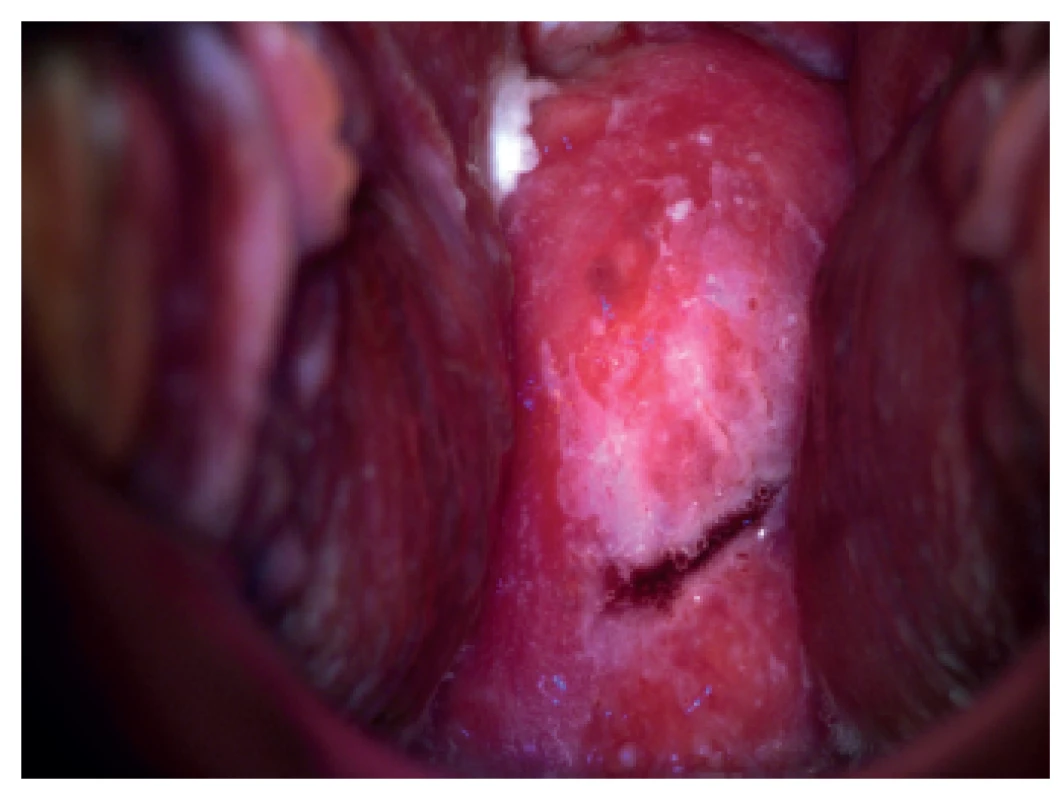
Obr. 2. Počítačová analýza obrazu u pacientky z obrázku č. 1 systémem DySIS. V místech s bílou, žlutou a červenou barvou je nejrychlejší nástup zbělení po aplikaci 5% kyseliny octové (zde se předpokládá HG léze a zde by měla být cílena klíšťková biopsie) 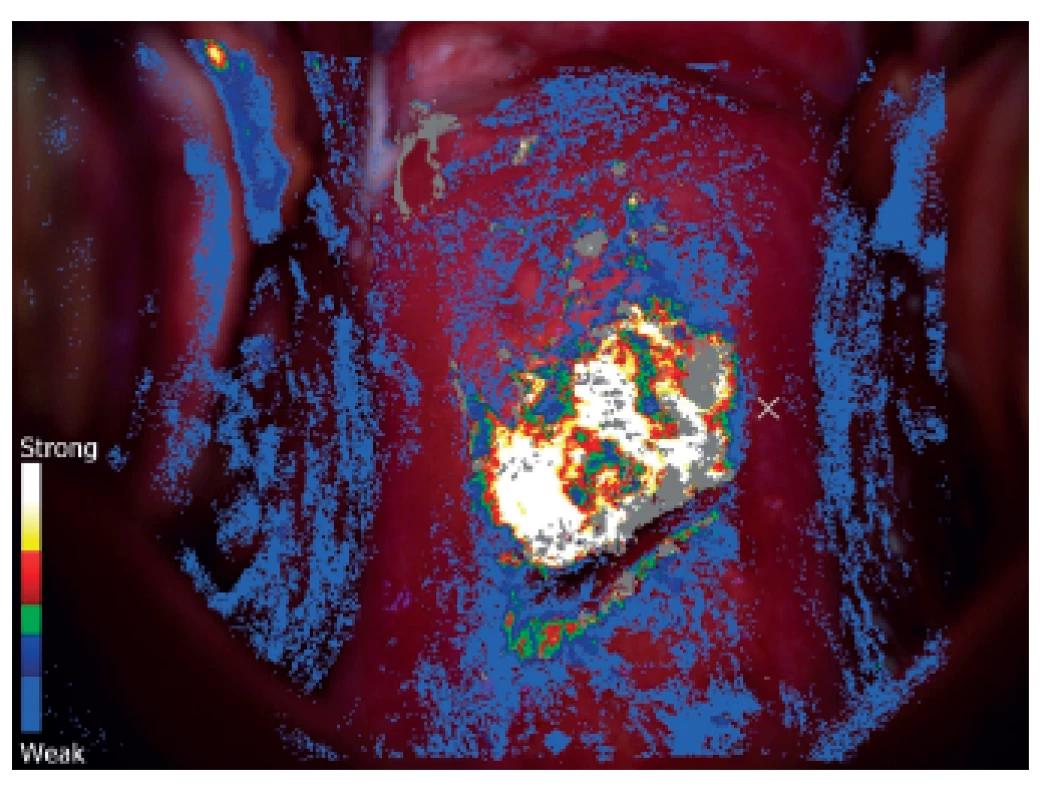
LuViva Advanced Cervical Scan
Metoda využívající světlo pro detekci fyzikálních a chemických změn ve tkáních, které mohou být přítomny u cervikálních abnormalit. Systém nevyžaduje vzorek tkáně a nečeká se na laboratorní analýzu [34].
LUMA cervical imaging system
Systém používá vlastností spektroskopie v tkáních in vivo. Účinnost LUMA (MediSpectra, Inc, MA, USA) pro detekce cervikálních lézí, byla prokázána ve dvou prospektivních, randomizovaných studiích. Jeho použití zvýšilo detekci HG lézí o 25 % z cílené biopsie. Americká FDA schválila tento přístroj v březnu 2006 pro zvýšení citlivosti kolposkopických vyšetření u žen s abnormální cervikální cytologií [1, 2, 13].
Optical Coherence Tomography (OCT)
Neinvazivní technika využívající infračerveného světla ke studiu vlastností tkáně (metabolických a strukturálních). Používá se sterilní sonda, která vysílá infračervené světlo a přikládá se na zkoumanou tkáň. Světlo se odráží od mikrostruktur tkání, je zpracováno a vyhodnoceno počítačem. Ten vytvoří dvojrozměrný obraz, analogický jako B-mod ultrazvuků [5, 18].
ONKOLOGICKÁ CYTOLOGIE
Onkologická cytologie zůstává stále základní screeningovou metodou. Cytologické vyšetření je metoda pomocná, nelze z ní určit přesnou diagnózu, pouze ukazuje míru podezření na přednádorové stavy. Může být jak falešně nadhodnocena, tak i podhodnocena. Nynější platná klasifikace k hodnocení onkologické cytologie je The Bethesda systém 2001. Cytolog může navrhnout kontrolu, která by měla být v souladu s aktuálními doporučeními Světové zdravotnické organizace, ale plnou zodpovědnost za další diagnostické či léčebné postupy nese gynekolog [23].
Klasická onkologická cytologie (PAP test, konvenční, exfoliativní cytologie)
Buněčný materiál setřený z děložního hrdla je přenesen na sklo a fixován, označen a spolu s průvodkou je odeslán do cytologické laboratoře k dalšímu zpracování. V laboratoři je stěr dále obarven a následně hodnocen v optickém mikroskopu. První prohlédnutí preparátu provádí cytotechnolog a každý podezřelý nález předá ke zhodnocení lékaři [24, 32].
Cytologie z tekutého média (Liquid Based Cytology – LBC)
LBC je novější technika umožňující odběr vyšetřovaných buněk do tekutého média, které je uvnitř malé nádobky. Preparáty zhotovené metodou LBC jsou přehlednější, s menším počtem artefaktů a buňky jsou na skle rozprostřeny v jedné tenké vrstvě. Díky okamžité a dokonalé fixaci jsou oproti konvenční cytologii lépe zachovány jaderné charakteristiky buněk nezbytné pro exaktní diagnostiku. Největší výhodou je možnost v případě potřeby provést další vyšetření ze stejného vzorku (např. na HPV test, cytoimunohistochemie p16, Ki-67 atd.). Nevýhodou je pak vyšší cena metody. V detekci závažných přednádorových změn je LBC s klasickou cytologií podobná [3, 8, 15].
Počítačová analýza obrazu LBC – ThinPrep Pap test, SurePath Pap
Novinkou v onkologické cytologii je počítačová image analýza LBC stěrů. Počítač naskenuje celé mikroskopické sklo připravené technikou LBC a současně ho hodnotí. U technologie Imaging system (ThinPrep Pap test) jsou označena suspektní zorná pole na sklech (souřadnice x–y) a tato skla jsou dále prohlížena v automatickém mikroskopu cytologem. U metody Focal point processor (SurePath Pap) je použit jiný algoritmus, který vybere skla s negativními nálezy, ostatní jsou předána cytologovi ke klasickému manuálnímu screeningu. Tento systém suspektní buňky na sklech neoznačuje [39].
Biomarkery v onkologické cytologii
K dalšímu zpřesnění prediktivní hodnoty onkologické cytologie se používá detekce biomarkerů pomocí imunocytochemických technik. Využití biomarkerů usnadňuje detekci abnormálních buněk ve stěru. Abnormální buňky jsou zvýrazněny na pozadí normálních, reaktivních nebo jiných nemaligních buněk, prostřednictvím imunocytochemického barvení. Používané biomarkery jsou [7]:
Ki-67 - jaderný marker, detekuje zvýšenou proliferaci buněk, která nastává i při HPV infekci.
p16 INK4a – antionkogen, regulátor buněčného cyklu, jeho hladina výrazně narůstá v HR HPV infikovaných buňkách. Je vysoce senzitivní a specifický marker dysplastických buněk hrdla děložního.
HPV L1 kapsidový protein – je detekovatelný v LG lézích a mizí v HG lézích.
BD ProEx C – je vysoce citlivé a specifické činidlo pro detekci HPV transformovaných buněk, obsahuje protilátky proti jaderným proteinům – minichromosome maintenance protein 2 (MCM 2) a topoisomerase II alpha (TOP2A).
Duální p16/Ki-67 imunocytochemický test je v současnosti k dispozici jako přídatný test ve screeningu karcinomu děložního hrdla (např. CINtec Plus) [7].
HPV TESTACE
Molekulárně genetická detekce lidských papilomavirů identifikuje virovou deoxynukleovou nebo ribonukleovou kyselinu (DNA, RNA). Sleduje se přítomnost 13–14 nejčastějších karcinogenních HR HPV typů (high risk – HR) karcinogenních typů HPV (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 a 68) [27, 31]. Odběr vzorku pro HPV test se provádí pomocí speciálního odběrového setu nebo je možno použít již odebraný materiál z LBC. Zajímavou novinkou je set pro samovyšetření HPV (self test) umožňující jednoduchý odběr vzorku samotnou ženou [14]. Ten je následně zaslán do laboratoře ke stanovení DNA HPV.
HPV testace ve screeningu karcinomu děložního hrdla
K preventivním programům se používají screeningové sety s odpovídající klinickou citlivostí, jejichž charakteristiky byly ověřeny dostatečným počtem studií [21]. V současné době lze využít několik testů – Hybrid Capture 2, Cobas 4800 HPV test, Aptima HPV Assay, EIA kit HPV CP HR, Cervista HPV HR Test, Abbott Real Time High Risk HPV. Liší se použitou metodikou a také částečnou genotypizací nejrizikovějších typů.
Detekce mRNA
Detekce aktivně přepisovaných onkogenů E6 a E7, resp. jejich mRNA má eliminovat přítomnost přechodné, netransformující HPV infekce, kterou často zachytí DNA HPV test [25, 30].
Genotypizace HPV
Je přesné stanovení jednotlivých HPV typů ve vyšetřovaném vzorku. Liší se použitou technologií a spektrem HPV, jež detekují. Velmi často je používána metoda amplifikace Polymerase chain reaction (PCR) – např. LinearArray HPV Genotyping Test, Inno LiPA HPV Genotyping Extra. Další testy používají technologii mikroarray čipů – např. PapilloCheck HPV-Screening Test. Používají se v epidemiologických studiích, v patologických laboratořích u fixovaných i čerstvých bioptických vzorků a k detekci HPV typů nezastoupených ve screeningovém testu.
Metylace tumorsupresorových genů
Dalším upřesněním u HR HPV pozitivních žen se jeví stanovení metylace tumorsupresorových genů [12]. Tyto geny, které normálně brání rozvoji rakovinného bujení, jsou v případě metylace deaktivovány a jejich funkce je potlačena [6, 11]. Identifikuje pacientky s vysokým rizikem dalšího rozvoje prekanceróz a karcinomu děložního hrdla.
BIOPSIE
Vzorek klíšťkové biopsie děložního hrdla by měl být odebírán vždy cíleně pod kolposkopickou kontrolou. U nálezů lokalizovaných endocervikálně je adekvátní metodou odběru k histologické verifikaci diagnostická konizace. Zlatým standardem histologie pak nadále zůstává hematoxylin-eozinový preparát. Použití imunohistochemických technik umožňuje patologům upřesnit a potvrdit diagnózu. Často je diferenciálně diagnosticky rozhodující použití imunohistochemie (např. protein p16, karcinom embryonální antigen (CEA), estrogenové a progesteronové receptory) a molekulárních metod (např. PCR, in situ hybridizace apod.) [21] (obr. 3).
Obr. 3. Imunohistologie p16 v HG lézi – těžce dysplastický epitel (vpravo) je pozitivní, zatímco cylindrický epitel endocervixu (vlevo) je negativní, včetně hyperplastických rezervních buněk (šipka) 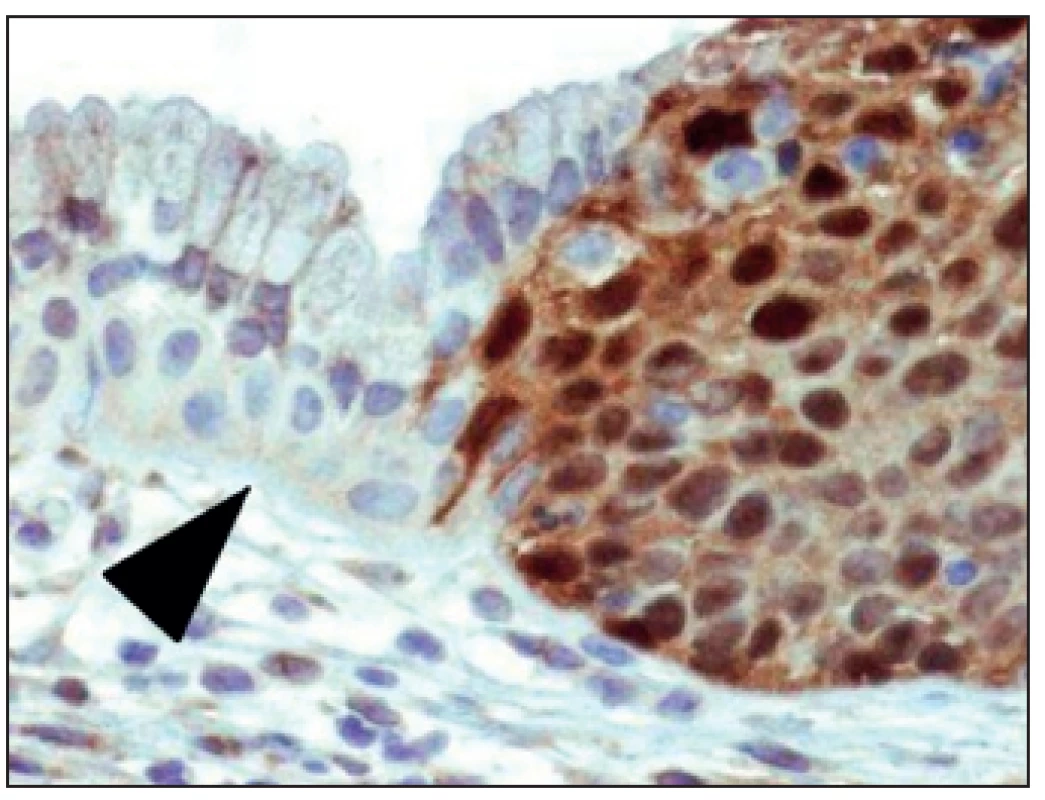
DISKUSE
Kolposkopické vyšetření je jedna z prebioptických technik a používá se pro došetření nálezu při abnormálním výsledku onkologické cytologie. Panel odborníků definoval doporučené postupy pro řešení abnormálních nálezů v ČR ve screeningu cervikálních karcinomů na 12. Bauerově dni v roce 2008 [10]. Kolposkopie není využitelná jako screeningová metoda. Pro provádění specializovaných kolposkopických vyšetření je potřebná funkční licence F017 pro expertní kolposkopii. V zahraničí jsou kolposkopická vyšetření považována za expertní. Digitální kolposkopie má srovnatelné výsledky jako optické kolposkopické vyšetření [13, 26]. Výhodou digitálních snímků uložených v databázi je dostupnost minulých nálezů a možnost tak porovnávat a hodnotit vývoj změn na děložním hrdle v čase. Rozšíření nových spektroskopických technik ve vyspělých zemích bude závislé na cenové dostupnosti jiných, specifičtějších metod (HPV mRNA, metylace, biomarkery). Trend směřuje spíše k využití diagnostiky na molekulární urovni. Naopak v rozvojových zemích, kde jsou možnosti „západního“ screeningu velkým problémem, mohou tyto metody zlepšit jeho dostupnost a snížit incidenci karcinomu děložního hrdla.
Senzitivita klasické cytologie pro diagnostiku HG lézí a karcinomů je v rozmezí 60–90 % v nejlépe organizovaných laboratořích [38]. V detekci závažných přednádorových změn jsou si ale LBC s klasickou cytologií podobné [3, 8, 15]. Při použití LBC je možné doplnit další vyšetření ze stejného vzorku (např. HPV test, cytoimunohistochemie p16, ostatní biomarkery apod.). Nevýhodou je pak vyšší cena metody. Novinkou v cytologii je počítačová analýza obrazu LBC (Imaging system u ThinPrep Pap testu a Focal point processor u SurePath Pap). Podle některých studií mají vyšší senzitivitu v detekci HG lézí než klasická nebo LBC cytologie [20]. Nevýhodou je opět vysoká cena celého systému.
Zavedení HPV testace do screeningových postupů v ČR dále zvýší citlivost screeningu a umožní prodloužit interval kontrol u HR HPV negativních žen s negativní cytologií na minimálně 3 roky. Ve vyspělých zemích je HPV testace již nyní součástí doporučených postupů ve screeningu karcinomu děložního hrdla (Anglie, Finsko, Norsko, USA a jiné). Senzitivita u žen nad 30 let ve spojení s HPV testací stoupá nad 95 % [23, 37].
Specifita detekce mRNA HPV je signifikantně vyšší ve srovnání s DNA HPV testy, např. Aptima HPV Assay má pro identifikaci lézí vysokého stupně u žen s abnormálním cytologickým nálezem citlivost 35,3 % a specifitu 28,8 % [25, 30]. Citlivost genotypizačních testů je vysoká, proto nejsou doporučovány pro preventivní programy [17]. Stanovení metylace tumorsupresorových genů u HR HPV pozitivních žen predikuje reálné riziko rozvoje neoplastických změn, a tím může omezit nadbytečné invazivní výkony u pacientek s perzistentní infekcí [12].
ZÁVĚR
Incidence invazivního karcinomu děložního hrdla v ČR v porovnání s ostatními vyspělými zeměmi EU je nadále vysoká. Velkým pokrokem v posledních letech bylo zavedení screeningových programů, akreditace cytologických laboratoří a od roku 2014 i dlouho očekávané adresné zvaní žen k preventivním gynekologickým prohlídkám zdravotními pojišťovnami. Další možností, jak snižovat výskyt těchto chorob, je plošná profylaktická vakcinace dívek proti HPV. Z možností jak dále zvýšit senzitivitu screeningu je zavedení HR HPV testace nebo duální p16/Ki-67 imunocytochemický test v onkologické cytologii. Účelné využití prebioptických a bioptických metod by mělo vést k včasnému záchytu prekanceróz děložního hrdla a následně i ke snížení incidence karcinomu děložního hrdla.
MUDr. Leopold Rotter
Reprofit International s.r.o.
Hlinky 122/48
602 00 Brno
e-mail.: leopold.rotter@reprofit.cz
Zdroje
1. Alvarez, RD., Wright, TC. Effective cervical neoplasia detection with a novel optical detection system: a randomized trial. Gynecol Oncol, 2007, 104, 2, p. 281–289.
2. Alvarez, RD., Wright, TC. Jr. Increased detection of high-grade cervical intraepithelial neoplasia utilizing an optical detection system as an adjunct to colposcopy. Gynecol Oncol, 2007, 106, 1, p. 23–28.
3. Arbyn, M., Bergeron, C., Klinkhamer, P., et al. Liquid compared with conventional cervical cytology: a systematic review and meta-analysis. Obstet Gynecol, 2008, 111, p. 167–177.
4. Bekker-Grob, EW., de Kok, IM., Bulten, J., et al. Liquid-based cervical cytology using ThinPrep technology: weighing the pros and cons in a cost-effectiveness analysis. Cancer Causes Control, 2012, 23, 8, p. 1323–1331.
5. Belinson, SE., Ledford, K., Rasool, N., et al. Cervical epithelial brightness by optical coherence tomography can determine histological grades of cervical neoplasia. J Low Genit Tract Dis, 2013, 17, 2, p. 160–166.
6. Bierkens, M., Hesselink, AT., Meijer, CJ., et al. CADM1 and MAL promoter methylation levels in hrHPV-positive cervical scrapes increase proportional to degree and duration of underlying cervical disease. Int J Cancer, 2013, 15, 133, p. 1293–1299.
7. Brown, CA., Bogers, J., Sahebali, S., et al. Role of protein biomarkers in the detection of high-grade disease in cervical cancer screening programs. J Oncol, 2012, Article ID 289315, 11 pages.
8. Cox, JT. Liquid-based cytology: evaluation of effectiveness, cost-effectiveness, and application to present practice. J Natl Compr Canc Netw, 2004, 2, 6, p. 597–611.
9. Etherington, IJ. Telecolposcopy – a feasibility study in primary care. J Telemed Telecare, 2002, 8, 2, p. 22–24.
10. Herbeck, G., Ondruš, J., Dvořák, V., Mortakis, A. Atlas kolposkopie. Praha: Maxdorf, 2011, s. 57–259.
11. Hesselink, AT., Heideman, DA., Steenbergen, RD., et al. Combined promoter methylation analysis of CADM1 and MAL: an objective triage tool for high-risk human papillomavirus DNA-positive women. Clin Cancer Res, 2011, 15, 17, 8, p. 2459–2465.
12. Hublarová, P., Hrstka, R., Rotterová, P., et al. Prediction of human papillomavirus 16 e6 gene expression and cervical intraepithelial neoplasia progression by methylation status. Int J Gynecol Cancer, 2009, 19, p. 321–325.
13. Huh, WK., Cestero, RM., Garcia, FA., et al. Optical detection of high-grade cervical intraepithelial neoplasia in vivo: results of a 604-patient study. Am J Obstet Gynecol, 2004, 190, 5, p. 1249–1257.
14. Igidbashian, S., Boveri, S., Spolti, N., et al. Self-collected human papillomavirus testing acceptability: comparison of two self-sampling modalities. J Womens Health (Larchmt), 2011, 20, p. 397–402.
15. Karnon, J., Peters, J., Platt, J., et al. Liquid-based cytology in cervical screening: an updated rapid and systematic review and economic analysis. Health Technol Assess, 2004, 8, p. 1–78.
16. Koutsky, LA., Ault, KA., Wheeler, CM., et al. Proof of Principle Study Investigators: A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med, 2002, 347, p. 1645–1651.
17. Laudadio, J. Human papillomavirus detection: testing methodologies and their clinical utility in cervical cancer screening. Adv Anat Pathol, 2013, 20, 3, p. 158–167.
18. Louwers, JA., Kocken, M., ter Harmsel, WA., et al. Digital colposcopy: ready for use? An overview of literature. BJOG, 2009, 116, 2, p. 220–229.
19. Louwers, JA., Zaal, A., Kocken, M., et al. Dynamic spectral imaging colposcopy: higher sensitivity for detection of premalignant cervical lesions. BJOG, 2011, 118, 3, p. 309–318.
20. Lozano, R. Comparison of computer-assisted and manual screening of cervical cytology. Gynec Oncol, 2007, 104, 1, p 134–138.
21. Meijer, CJ., Berkhof, J., Castle, PE., et al. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer, 2009, 124, 3, p. 516–520.
22. Nucci, MR., Crum, CP. Redefining early cervical neoplasia: recent progress. Adv Anat Pathol, 2007, 14, 1, p. 1–10.
23. Rotterová, P., Nenutil, R., Hanzelková, Z., et al. Exprese P16INK4A v dysplaziích a nádorech děložního čípku. Klin Onkol, 2003, 16, s. 249–251.
24. Rotterová, P., Nenutil, R., Rotter, L., et al. The detection of p16 protein in uterine cervix lesions. Čes Gynek, 2005, 70, 4, s. 295–298.
25. Saslow, D., Solomon, D., Lawson, HW., et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer. CA Cancer J Clin, 2012, 62, 3, p. 147–172.
26. Schadel, D., Coumbos, A., Willrodt, RG., et al. The role of digital colposcopy for diagnosis of cervical lesions – A pilot study to access the value of telematics. Geburtshilfe Frauenheilkd, 2004, 64, 11, S. 1205–1212.
27. Schiffman, M., Clifford, G., Buonaguro, FM. Classification of weakly carcinogenic human papillomavirus types: addressing the limits of epidemiology at the borderline. Infect Agent Cancer, 2009 1, 4, p. 8.
28. Soutter, WP., Diakomanolis, E., Lyons, D., et al. Dynamic spectral imaging: improving colposcopy. Clin Cancer Res, 2009, 15, 5, p. 1814–1820.
29. Stafl, A. Cervicography: a new method for cervical cancer detection. Am J Obstet Gynec, 1981, 139, 7, p. 815–825.
30. Szarewski, A., Mesher, D., Cadman, L., et al. Comparison of seven tests for high-grade cervical intraepithelial neoplasia in women with abnormal smears: the Predictors 2 study. J Clin Microbiol, 2012, 50, 6, p. 1867–1873.
31. Tachezy, R., Smahelova, J., Salakova, M., et al. Human papillomavirus genotype distribution in Czech women and men with diseases etiologically linked to HPV. PLoS One, 2011, p. 6–7.
32. Troxel, DB. Trends in pathology malpractice claims. Amer J Surg Pathol, 2012, 36, 1, p. 1–5.
33. Twiggs, LB., Chakhtoura, NA., Ferris, DG., et al. Multimodal hyperspectroscopy as a triage test for cervical neoplasia: pivotal clinical trial results. Gynecol Oncol, 2013, 130, 1, p. 147–151.
34. Wade, R., Spackman, E., Corbett, M., et al. Adjunctive colposcopy technologies for examination of the uterine cervix – DySIS, LuViva Advanced Cervical Scan and Niris Imaging System: a systematic review and economic evaluation. Health Technol Assess, 2013, 17, 8, p. 1–240.
35. Webový portál Systému pro Vizualizaci Onkologických Dat (www.svod.cz).
36. Webový portál Globocan (http://www.globocan.iarc.fr).
37. Webový portál Cervix.cz (http://www.cervix.cz).
38. Yim, EK., Park., JS. Biomarkers in cervical cancer. Biomarker Insights, 2006, 2, p. 215–225.
39. Wright, PK., Marshall, J., Desai, M. Comparison of SurePath® and ThinPrep® liquid-based cervical cytology using positive predictive value, atypical predictive value and total predictive value as performance indicators. Cytopathology, 2010, 21, 6, p. 374–378.
40. Zaal, A., Louwers, JA., Berkhof, J., et al. Agreement between colposcopic impression and histological diagnosis among human papillomavirus type 16-positive women: a clinical trial using dynamic spectral imaging colposcopy. BJOG, 2012, 119, 5, p. 537–544.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Shuteho paralelní forceps
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2014 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Embolie plodovou vodou – přehledový článek
- Prebioptické metody při screeningu karcinomu děložního hrdla
- Nejvýznamnější markery receptivity endometria
- Prenatální růstové křivky české populace
- Korelácia výskytu PIK3CA mutácií v karcinóme prsníka s histologickými vlastnosťami nádoru
- Charakteristiky pohlavného dospievania dievčat v Bratislavskom regióne
- Vliv šesti antiretrovirotik (delavirdinu, stavudinu, lamivudinu, nelfinaviru, amprenaviru a lopinaviru/ritonaviru v kombinaci) na březí bílé krysy (Rattus norvegicus Albinus, Rodentia, Mammalia): biologický test
- Tuberkulóza v těhotenství: jak ji diferenciálně diagnosticky odlišit od střevních zánětů?
- Gravidita a porod u pacientek s implantovaným shuntem pro hydrocefalus
- Současné možnosti diagnostiky prekanceróz a karcinomu děložního hrdla
- Intraindividuální variabilita uroflowmetrického vyšetření u žen
- Princípy a limity klinických metód diagnostiky fetálnej hypoxie
- Shuteho paralelní forceps
- Primář MUDr. Ladislav Hanousek - sedmdesátiletý
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Embolie plodovou vodou – přehledový článek
- Prenatální růstové křivky české populace
- Současné možnosti diagnostiky prekanceróz a karcinomu děložního hrdla
- Prebioptické metody při screeningu karcinomu děložního hrdla
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



