-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inhibitory protonové pumpy v praxi klinického farmaceuta
Proton pump inhibitors from clinical pharmacist’s point of view
Proton pump inhibitors (PPIs) are very effective drugs in treatment and prevention of acid-related disorders. They are widely used in gastroesophageal reflux disease, gastroduodenal ulcers, Zollinger-Ellison syndrome or prevention and treatment of NSAIDs induced gastric lesions. They are also used in many other indications, although not always is their use appropriate.
PPIs are generally well tolerated and overall benefits outweigh potential harm in most of the patients. However, their long-term use is not without a risk of adverse effects and drug-drug interactions and contributes to medical expenses and polypharmacy.
As PPIs belong to most prescribed drugs, we should carefully consider the length of therapy and appropriateness of their use and regularly reevaluate the need for chronic therapy.
Keywords:
Safety – gastric toxicity – proton pump inhibitors – efficacy
Autoři: PharmDr. Alena Pilková
Vyšlo v časopise: Čas. Lék. čes. 2019; 158: 282-288
Kategorie: Přehledový článek
Souhrn
Inhibitory protonové pumpy (PPIs) jsou velmi efektivními léčivy v prevenci a léčbě onemocnění spojených s poruchou acidity. Jsou široce užívány u gastroezofageální refluxní choroby, vředové choroby gastroduodena, Zollingerova-Ellisonova syndromu nebo v prevenci a léčbě gastropatie navozené NSAIDs. Používají se také v mnoha dalších indikacích, ačkoli ne vždy je jejich podání oprávněné.
PPIs jsou všeobecně dobře tolerované a celkový prospěch z nich u většiny pacientů převažuje potenciální riziko jejich užívání. Chronické podávání však není bez rizika nežádoucích účinků a lékových interakcí a přispívá ke zvyšování nákladů a polypragmazii.
Jelikož PPIs patří k nejpředepisovanějším léčivům, měli bychom pečlivě posoudit délku terapie a oprávněnost jejich užití a potřebu chronické terapie pravidelně přehodnocovat.
Klíčová slova:
gastrotoxicita – inhibitory protonové pumpy – účinnost – bezpečnost
CHARAKTERISTIKA INHIBITORŮ PROTONOVÉ PUMPY
Inhibitory protonové pumpy (PPIs) jsou léčiva blokující produkci žaludeční kyseliny prostřednictvím ireverzibilní blokády H+/K+-ATPázy parietálních buněk žaludku. Od uvedení omeprazolu do praxe v roce 1989 se staly efektivní součástí léčby onemocnění a stavů vyžadujících supresi tvorby žaludeční kyseliny a patří mezi léčiva velmi často užívaná jak u hospitalizovaných pacientů, tak v ambulantní péči.
V klinické praxi je v Česku v současné době dostupných 5 PPIs: omeprazol, esomeprazol, lansoprazol, pantoprazol a rabeprazol. Jedná se o látky slabě bazické povahy, které je nutné podat ve vhodné lékové formě, aby nedošlo k jejich předčasné aktivaci v kyselém žaludečním prostředí. Tato ochrana je zajištěna formou enterosolventních tablet, kapslí obsahujících mikropelety s acidorezistentní úpravou nebo perorálního roztoku obsahujícího hydrogenuhličitan sodný pro dočasnou neutralizaci žaludečního obsahu (v ČR pouze ve formě IPLP – individuálně připravovaných léčivých přípravků), případně intravenózním podáním.
Po perorálním podání dochází ke vstřebání PPI v proximální části tenkého střeva a ze systémové cirkulace se PPI dostává do parietálních buněk žaludku, kde dochází k jeho aktivaci za vzniku sulfonamidové vazby, která se kovalentně váže na cysteinové SH skupiny H+/K+-ATPázy. Tím dochází ke změně konformace protonové pumpy, jež vede k inhibici produkce žaludeční kyseliny. Účinnost PPI je závislá na přítomnosti aktivních protonových pump, proto je vhodné podávání preprandiálně. Uvádí se, že během jednoho podání PPI zablokuje asi dvě třetiny protonových pump, efektivita léčiva tak vzrůstá na maximum po vícedenním podávání (1). K aktivaci PPI dochází v prostředí, kde je pH nižší než pKa daného léčiva, přičemž rabeprazol se v kyselém prostředí aktivuje nejsnáze (pKa 4,53), pantoprazol nejobtížněji (pKa 3,83) (2). Ireverzibilní působení je příčinou toho, že doba účinku PPI není závislá na plazmatickém poločasu léčiva, ale na době do vytvoření nových protonových pump (až 36 hod); v praxi se udává, že efekt podání PPI přetrvá 15–21 hod (1). Z tohoto důvodu některým pacientům nepostačuje podání v 1 denní dávce a nutnost zmírnění nočních obtíží spojených s opětovným vzestupem žaludeční acidity může vyžadovat podání PPI 2× denně.
Plazmatický poločas PPIs je krátký (0,5–2 hod.) a jsou primárně eliminovány hepatální cestou, prostřednictvím cytochromu P450. Hlavním izoenzymem podílejícím se na jejich metabolismu je CYP2C19, jeho podíl na celkovém metabolismu však není u všech PPIs totožný, což může mít dopad na případné lékové interakce nebo individuální odpověď na konkrétní PPI, jelikož CYP2C19 patří mezi enzymy vyznačující se genetickým polymorfismem. Nejvíce závisejí na metabolismu CYP2C19 omeprazol a esomeprazol, které působí na tento enzym také jako inhibitory (2). Lansoprazol (a dexlansoprazol) mají výraznou afinitu také k CYP3A4. Pantoprazol je sice metabolizován cestou CYP2C19, ale má nižší potenciál k lékovým interakcím, protože nepůsobí jako inhibitor tohoto enzymu (1, 2). Rabeprazol je metabolizován většinově cestou nezávislou na cytochromu P450, proto jeho potenciál k lékovým interakcím nebo citlivost vůči genetickému polymorfismu nejsou klinicky významné (3). Finální exkrece metabolitů PPIs je renální, v případě lansoprazolu a dexlansoprazolu také biliární (1).
S rozdíly v metabolických cestách a jejich ovlivnění genetickým polymorfismem souvisí i nejednoznačné určení ekvipotentní dávky mezi jednotlivými PPIs. V literatuře se můžeme setkat s rozdílným vyjádřením ekvipotence (tab. 1), přičemž dávka potřebná pro dosažení cílového pH > 4,0 je ovlivněna i dalšími faktory – dle Kirchheinerové et al. (4) pacienti s gastroezofageálním refluxem (GERD) potřebují pro dosažení cílových hodnot dávku 1,9× vyšší a pacienti s pozitivitou na Helicobacter pylori naopak dávku pouze pětinovou. Je tedy zřejmé, že při podání standardní dávky PPI dle Souhrnu údajů o přípravku (SPC) u různých pacientů v závislosti na jejich onemocnění, genetické výbavě a konkomitantní farmakoterapii můžeme mnohdy očekávat rozdílnou terapeutickou odpověď.
Tab. 1. Ekvipotentní dávky jednotlivých PPI podle doporučení WHO a FDA pro léčbu GERD a farmakokinetického modelu odrážejícího dosažení 24hodinového pH > 4 u zdravých dobrovolníků (upraveno podle: 4) 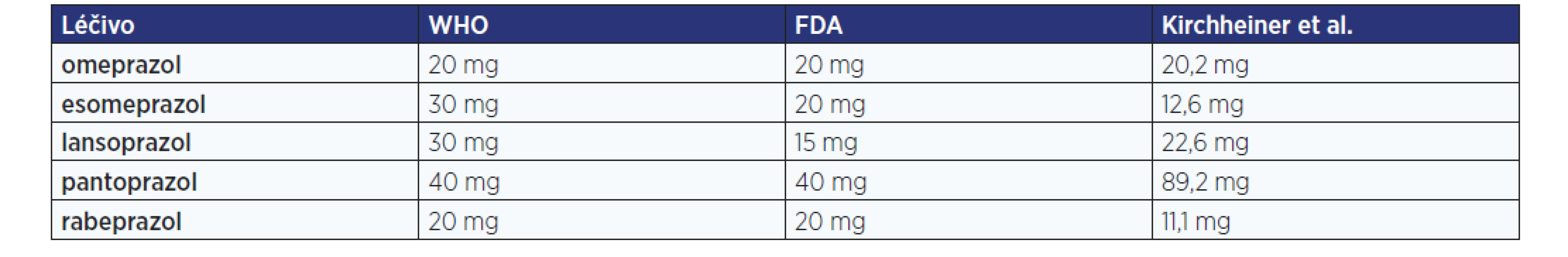
Vývoj nových léčiv ovlivňujících protonové pumpy pokračuje především ve snaze zajistit účinnější blokádu tvorby žaludeční kyseliny po celou dobu 24 hodin. To je možné jednak úpravou lékové formy – příkladem je dexlansoprazol používaný v USA ve formě tablet s duálním uvolňováním. Další cestou je vývoj nových PPIs s prodlouženým plazmatickým poločasem – příkladem je v Asii registrovaný ilaprazol s poločasem 3,6 hod, případně látky procházející klinickým zkoušením (tenatoprazol, azeloprazol, anaprazol nebo acidorezistentní proléčivo omeprazolu Durasec). Odlišným přístupem je pak blokáda H+/K+-ATPázy na úrovni kompetice o vazebné místo pro draselné ionty. Léčiva působící tímto mechanismem se označují jako P-CABs (potassium-competitive acid blockers) a od PPI se liší rychlým nástupem účinku bez nutnosti aktivace a acidorezistentní ochrany, plným efektem od první dávky a reverzibilní blokádou protonové pumpy s trváním účinku závislém na poločasu léčiva. V současné době jsou na trhu v Asii 2 léčiva z této skupiny: vonoprazan a revaprazan (5).
INDIKACE PRO PODÁNÍ PPI
Hlavními indikacemi pro podávání PPIs jsou onemocnění spojená s poruchou acidity – léčba a prevence relapsu žaludečních či duodenálních vředů, léčba refluxní esofagitidy a následná léčba pacientů se zhojenou refluxní ezofagitidou, léčba symptomatické refluxní choroby jícnu a léčba Zollingerova-Ellisonova syndromu. Dále jsou PPIs v kombinaci s vhodnými antibiotiky součástí eradikační léčby infekce H. pylori a jsou také indikovány k prevenci vzniku žaludečních či duodenálních vředů v souvislosti s podáváním nesteroidních protizánětlivých léčiv (NSAIDs) u rizikových pacientů, případně k léčbě vředů, které již v souvislosti s podáváním NSAIDs vznikly.
Léčivé přípravky (LP) obsahující jednotlivé PPIs nejsou v ČR registrovány dle SPC (6) v celé šíři výše uvedených indikací (tab. 2), i když v terapii refluxní choroby a vředové choroby jsou efektivní všechny (1). U omeprazolu je schváleno nejširší použití v pediatrii, při jeho podávání lze kromě vysypávání mikropelet z tobolek pro snadnější polknutí s výhodou využít také možnosti přípravy suspenze v lékárně, jelikož je v ČR dostupný též jako surovina k přípravě IPLP a k dispozici jsou receptury s ověřenou stabilitou až 15 dní při teplotě 2–8 °C, v případě suspenzního základu SyrSpend SK ALKA až 60 dní (7). Omeprazol je rovněž preferovaným PPI v případě nutnosti podání u těhotných žen, jelikož jsou s ním největší zkušenosti a možnost podání těhotným ženám je uvedena v SPC (6, 36).
Tab. 2. Přehled indikací PPI dle SPC (6) 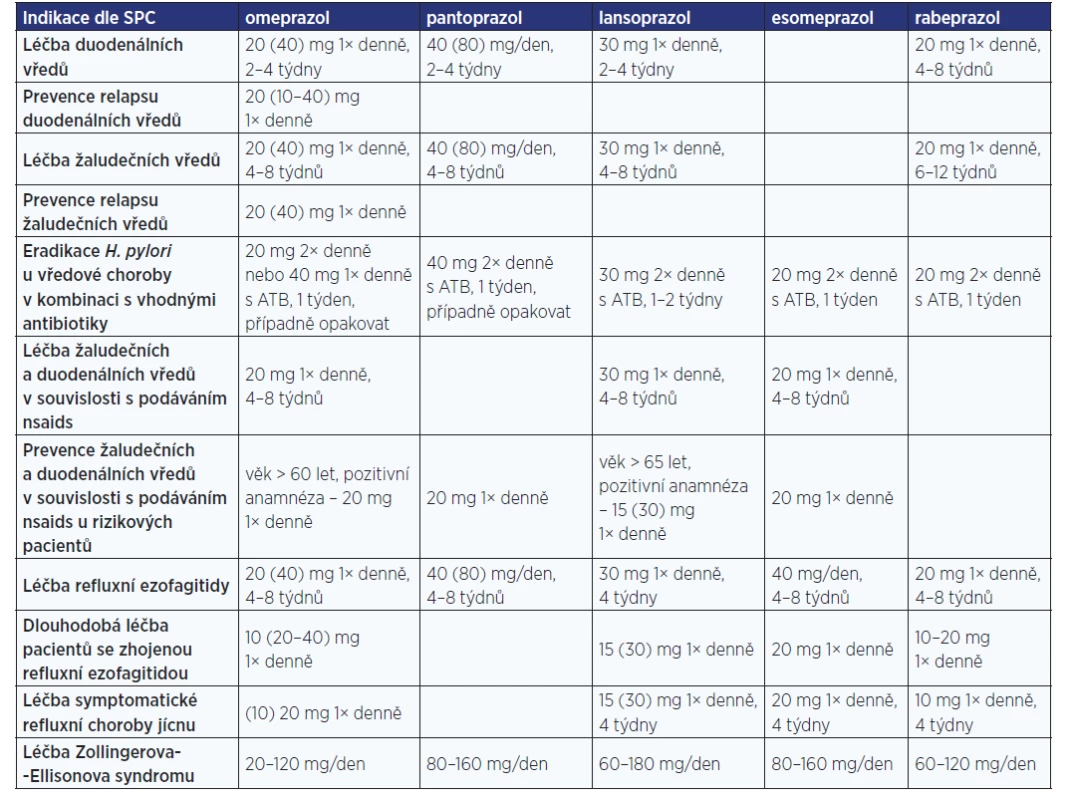
Z důvodu primární hepatální eliminace není třeba upravovat dávku u pacientů s renálním poškozením, naopak u pacientů s jaterním poškozením může být redukce dávky vhodná, dochází u nich totiž ke zpomalení clearance a vzestupu plazmatického poločasu. Pro pacienty, kteří nemohou užívat PPI perorálně, je v ČR k dispozici i. v. omeprazol nebo pantoprazol. Při podání perorálních forem do výživové sondy je potřeba zachovat acidorezistentní úpravu, v žádném případě tedy není vhodné drtit enterosolventní tablety, ale vhodnějším postupem je vysypání mikropelet z kapslí (přičemž u LP obsahujících esomeprazol jde o postup schválený v SPC), případně lze využít IPLP suspenzi s omeprazolem (7).
INDIKACE NEUVEDENÉ V SPC
Kromě výše uvedených indikací v prevenci a léčbě vředové a refluxní choroby a eradikace H. pylori se PPIs používají v mnoha indikacích neuvedených v SPC a vzrůstající spotřeba těchto léčiv v posledních letech vyvolává otázku, zda je v některých klinických situacích jejich použití oprávněné. Především při dlouhodobém užívání by měla být indikace k jejich podání pravidelně přehodnocována. V následujícím textu bude zmíněno několik indikací, se kterými se v rámci klinickofarmaceutické péče u pacientů setkáváme.
Aktivní krvácení v horní části gastrointestinálního traktu
Podání PPI pacientů s aktivním krvácením z horní části gastrointestinálního traktu (GIT) je součástí komplexní přístupu k tomuto život ohrožujícímu stavu. Doporučeno je podávání vysokých dávek intravenózního PPI s iniciálním bolusem (omeprazol 80 mg) následovaným podáním kontinuální infuze (8 mg/hod) pokračující 72 hodin po endoskopickém ošetření (8); kontinuální infuzi lze nahradit podáváním intermitentních bolusů 2× denně s nejméně stejnou efektivitou (11). PPIs signifikantně snižují výskyt opětovného krvácení, zvýšení pH přispívá ke stabilizaci koagulační zátky (10). Po uplynutí 72 hodin je vhodné potřebu další acidosupresní terapie znovu zhodnotit (8, 10).
Zatímco u nevarikózního krvácení byl pozitivní efekt PPIs prokázán (9), pokud jde o léčbu krvácení v důsledku portální hypertenze, není prokázáno, že by PPIs měly být součástí primární nebo sekundární prevence. Doporučeno je pouze jejich krátkodobé podání při endoskopické ligaci varixů, kde dochází ke krátkodobému narušení gastrointestinální (GI) motility (20, 21).
Prevence stresového vředu
Stresově navozené poškození žaludeční sliznice (označované jako stresový vřed) je častou komplikací kriticky nemocných pacientů a může být endoskopicky detekováno až u 75–100 % pacientů hospitalizovaných na JIP (13). GI krvácení se vyskytuje u 1,5–8,5 % pacientů na JIP a udává se, že bez gastroprotekce jeho incidence vzrůstá až na 15 % (12). Příčiny a hlavní rizikové faktory pro vznik stresového vředu shrnuje tab. 3.
Tab. 3. Stresově navozené poškození žaludeční sliznice (podle: 12) 
Za preventivní faktor je považováno udržení enterální výživy, která neutralizuje žaludeční obsah (12). PPIs nebo H2-antihistaminika jsou efektivními léčivy v prevenci rozvoje stresového vředu, měla by však být indikována pouze v oprávněných případech, protože benefit jejich podání pacientům mimo JIP a bez přítomnosti rizikových faktorů není podepřen dostupnými důkazy (13), naopak může být spojen s nežádoucími efekty vyplývajícími z jejich dlouhodobé aplikace.
Prevence GI krvácení při antiagregační a antikoagulační léčbě
Antiagregační léčba je důležitou součástí terapie kardiovaskulárních onemocnění a uplatňuje se především v sekundární prevenci ischemické choroby srdeční, periferní arteriální choroby nebo ischemické cévní mozkové příhody, kde jsou antiagregační léčiva používána dlouhodobě. Hlavními nežádoucími účinky chronické antiagregační léčby jsou krvácivé komplikace, především krvácení do GIT. American College of Cardiology Foundation (ACCF), American College of Gastroenterology (ACG) a American Heart Association (AHA) vydaly v roce 2008 společné stanovisko k minimalizaci GI rizika protidestičkové léčby a terapie NSAIDs (14), ve kterém doporučily, aby byla gastroprotektivní léčba podána pacientům s přítomností rizikových faktorů (tab. 4).
Tab. 4. Rizikové faktory rozvoje gastrointestinálních komplikací protidestičkové léčby, při kterých je vhodné podání PPI (podle: 14) 
Gastrotoxicita kyseliny acetylsalicylové (ASA) je na dávce závislá, proto jsou preferovány nízké denní dávky (v USA 81 mg, v ČR 100 mg denně), a je způsobena systémovým účinkem (inhibicí cyklooxygenázy v žaludeční sliznici). Enterosolventní nebo pufrované lékové formy tedy riziko gastrotoxicity nesnižují. Klopidogrel a ostatní léčiva ze skupiny inhibitorů P2Y12 sice nemají přímé gastrotoxické působení, ale zpomalují hojení žaludečních erozí vzniklých z jiných příčin. I když je riziko gastrotoxicity mírně nižší, podání klopidogrelu bez gastroprotekce není pro rizikové pacienty bezpečnější než podání ASA s gastroprotekcí. Pro volbu gastroprotektivního léčiva jsou pro vyšší účinnost preferovány PPIs před H2-antihistaminiky (14).
European Society of Cardiology (ESC) a European Association for Cardio-Thoracic Surgery (EACTS) v doporučeních z roku 2017 uvádějí, že PPIs mají být součástí farmakoterapie u pacientů s duální antiagregační léčbou, přičemž, je-li její součástí klopidogrel, je pro minimální interakční potenciál doporučeno z PPIs zvolit přednostně pantoprazol či rabeprazol (15).
Potřeba gastroprotekce při užívání antikoagulačních léčiv není v doporučeních ESC a EACTS pro léčbu fibrilace síní z roku 2016 zmíněna (16), v doporučeních European Heart Rhythm Association (EHRA) z roku 2018 k používání nových perorálních antikoagulancií (NOACs) u pacientů s fibrilací síní (17) je uvedeno, že u některých by nasazení PPIs mělo být zváženo. Zatímco gastroprotektivní účinek PPIs byl pozorován u pacientů užívajících antiagregační terapii nebo warfarin, data o preventivním účinku PPIs u pacientů léčených NOACs jsou zatím omezená. Absorpce dabigatranu závislá na kyselém žaludečním pH může být při acidosupresní terapii H2-antihistaminiky nebo PPIs snížena o 12–30 %, tato interakce je však hodnocena jako klinicky nevýznamná (17).
Prevence GI krvácení při kortikoterapii
Na rozdíl od NSAIDs nezpůsobují kortikosteroidy přímé poškození žaludeční sliznice a asociace mezi užíváním kortikosteroidů a GI nežádoucími účinky je nejednoznačná (13). Systematické přehledy a metaanalýzy jsou zatíženy velkou heterogenitou, ať už jde o typ GIT poškození, typ pacientů nebo podávané dávky kortikosteroidů. Systematické review a metaanalýza z roku 2014 (18) například uvádí, že terapie kortikosteroidy vede ke zvýšení rizika GI krvácení o 43 %, ale pouze u hospitalizovaných pacientů. Pro rutinní gastroprotekci u pacientů na kortikoterapii není v současné době dostatek důkazů (13). Zařazení PPIs do terapie je však na místě u pacientů s vředovou chorobou v anamnéze nebo u pacientů na souběžné terapii NSAIDs (19), případně u pacientů s antiagregační léčbou a dalšími rizikovými faktory, jak bylo uvedeno výše.
Gastroprotekce u onkologických pacientů
Onkologičtí pacienti jsou ve zvýšeném riziku poškození žaludeční sliznice z důvodu probíhající chemoterapie či radioterapie. Slizniční výstelka GIT se rychle obnovuje a citlivě reaguje na cytotoxické působení. Při endoskopickém vyšetření je nález slizničního poškození častý, závažné následky jsou však pozorovány zřídka a po ukončení chemoterapie pravděpodobně dochází ke spontánnímu zlepšení.
Podání gastroprotekce jako součásti chemoterapeutických režimů má předejít výskytu poškození žaludeční sliznice a zmírnit případné symptomy spojené s poškozením. Podání PPIs (nebo H2-antihistaminik) je zmíněno jako možná součást profylaxe nevolnosti a zvracení při podání chemoterapie v Modré knize České onkologické společnosti ČLS JEP (23), antiemetické působení však PPIs nevykazují a zpomalené vyprazdňování žaludku spojené s jejich podáním může v některých případech k nevolnosti naopak přispět (13). Jejich podání není rutinně vyžadováno, má být krátkodobé a ukončené s chemoterapií.
Při podání PPIs u pacientů léčených perorálními protinádorovými léčivy je také potřeba vzít v úvahu ovlivnění absorpce těchto léčiv změnou pH navozenou PPIs. Souběžné podání PPIs snižuje plochu pod křivkou (AUC) řady inhibitorů tyrosinkinázy (25), stejně tak snižuje biodostupnost kapecitabinu (24). Klinický dopad těchto interakcí je nejasný, i když některé retrospektivní práce poukázaly na zkrácení remise u pacientů léčených erlotinibem či kapecitabinem, a proto by při užívání perorálních protinádorových léčiv měla být nutnost acidosupresní terapie důkladně zvážena (22). V případě nezbytnosti by měly být PPIs podávány 1× denně a protinádorová léčiva podávána v oknu nejnižší efektivity PPIs (25), případně je možné místo PPIs podat H2-antihistaminika (38).
Prevence postoperační nauzey a zvracení
Dostupná data s esomeprazolem neprokázala, že by PPIs byly efektivní ve snížení výskytu postoperační nauzey a zvracení (26). V jedné studii bylo prokázáno pouze snížení celkového objemu vomitu, což může být protektivním faktorem u pacientů se zvýšeným rizikem aspirace do plic (27).
Gastropatie u pacientů s cirhózou
PPIs jsou v klinické praxi často používány u pacientů s cirhózou, ačkoli u nich často dochází ke snížení tvorby žaludeční kyseliny a PPIs nepředcházejí výskytu krvácení z jícnových varixů (13). Dlouhodobé podání PPIs je spojeno se změnou mikrobiomu v tenkém střevě, a může tak být rizikovým faktorem pro vznik spontánní bakteriální peritonitidy (SBP).
V systematickém přehledu a metaanalýze z roku 2015 (28) autoři dospěli k závěru, že u pacientů s cirhózou a ascitem je podávání PPIs spojeno se zhruba dvojnásobně zvýšeným rizikem rozvoje SBP. Předmětem zájmu je i souvislost mezi podáváním PPIs a rozvojem jaterní encefalopatie – ve studii případů a kontrol z roku 2017 bylo podávání PPIs spojeno se zvýšeným rizikem rozvoje jaterní encefalopatie, přičemž toto riziko bylo na dávce závislé (29). U cirhotických pacientů je vhodné vyhnout se neopodstatněnému chronickému podávání PPIs, vzít v úvahu jejich zpomalený metabolismus související s jaterním poškozením a případně přehodnotit dávku.
Onemocnění pankreatu
Podání acidosupresní terapie vychází z předpokladu, že snížená acidita v duodenu přispěje ke snížení sekrece pankreatických enzymů. Jediná dosud dostupná klinická studie s pantoprazolem neprokázala, že by podání PPI ovlivnilo klinický průběh akutní pankreatitidy z hlediska délky hospitalizace, schopnosti obnovení perorálního příjmu nebo úlevy od bolesti. PPIs tedy nejsou rutinní součástí léčby akutní pankreatitidy, i když mohou být individuálně zváženy, například při podání NSAIDs, vředové chorobě nebo krvácení do GIT (13).
Podání PPIs může být naopak vhodné u pacientů vyžadujících exogenní podávání pankreatických enzymů. Tato léčiva jsou v kyselém prostředí žaludku inaktivována a zvýšení žaludečního pH může zlepšit jejich biodostupnost. British National Formulary (BNF) například uvádí podávání pankreatických enzymů u pacientů s cystickou fibrózou jako jednu z indikací pro podání PPIs (30). PPIs mohou zlepšit odpověď na léčbu exogenními pankreatickými enzymy i v případě, že je substituce enzymy zajišťována ve formě enterosolventních tablet, jelikož u části pacientů dochází k nedostatečné odpovědi na léčbu pravděpodobně z důvodu normální či zvýšené žaludeční sekrece a současně nedostatečné produkce bikarbonátu pankreatem. Zatímco u pacientů s nedostatečnou odpovědí na podání samotných pankreatických enzymů přidání PPIs efekt exogenně podávaných enzymů zlepšuje, u pacientů s dobrou odpovědí na enzymatickou substituci podání PPIs další benefit nepřináší (31).
RIZIKA PODÁVÁNÍ PPI
PPIs jsou léčiva všeobecně dobře snášená, s malou akutní toxicitou. Jelikož se však v současné době řadí mezi nejčastěji užívaná, je potřeba uvažovat při jejich podání o případných rizicích, která jsou spojena jednak s lékovými interakcemi PPIs, jednak s nežádoucími účinky při jejich dlouhodobém podávání.
Lékové interakce
Lékové interakce PPIs vznikají několika mechanismy – jedná se buď o změnu vstřebávání léčiva navozenou změnou žaludečního pH, nebo o změnu v metabolismu léčiva ovlivněním systému cytochromu P450, zejména izoenzymu CYP2C19, případně jiné příčiny. Následující stať uvádí některé příklady interakcí a jistě není vyčerpávajícím přehledem této problematiky.
Mezi léčiva, jejichž biodostupnost je snížena při zvýšení pH, patří například antivirotikum atazanavir, výše zmíněné inhibitory tyrosinkinázy, mykofenolát mofetil (nikoli mykofenolát sodný ve formě enterosolventních tablet) nebo antimykotikum posakonazol. Změny v absorpci těchto léčiv mohou vést ke snížení účinnosti terapie a vzhledem k indikacím pro jejich užití se jedná o potenciálně závažné interakce (24).
V praxi se často setkáváme také s interakcí při souběžném podávání PPIs a levothyroxinu. Tato interakce je hodnocena jako středně závažná, ve studii s pacienty užívajícími lansoprazol s levothyroxinem došlo při souběžném užívání po dobu 2–6 měsíců ke zvýšení TSH s nutností úpravy dávky levothyroxinu u 19 % z nich (průměrně o 20 µg). Při chronickém souběžném užívání PPIs s levothyroxinem je tedy vhodné monitorovat hladinu TSH, zejména při nasazení, vysazení nebo změně dávky PPI. Potenciál k interakci a změna biodostupnosti levothyroxinu při zvýšeném pH mohou být různě vyjádřeny u jednotlivých komerčně dostupných HVLP (33).
Mezi potenciálně závažné interakce PPIs navozené změnou v metabolismu prostřednictvím ovlivnění cytochromu P450 patří například často zmiňované riziko snížení aktivace, a tím i účinnosti klopidogrelu interakcí na CYP2C19, kde z tohoto důvodu upřednostňujeme podání pantoprazolu či rabeprazolu. Popsáno je i zpomalení metabolismu takrolimu omeprazolem zprostředkované inhibicí CYP3A4. Interakce mezi warfarinem a omeprazolem přes CYP2C19 je středně významná, dochází při ní k inhibici metabolismu méně potentního R-warfarinu, ale nikoli S-warfarinu a souběžné podání obou léčiv u zdravých dobrovolníků vyústilo jen v mírnou změnu koagulačních parametrů, která pravděpodobně není klinicky významná (24). Při podání silných inhibitorů nebo induktorů cytochromu P450 (např. flukonazolu či rifampicinu) je třeba počítat také se změnami plazmatických hladin PPIs. Z důvodu polymorfního metabolismu CYP2C19 bude stupeň závažnosti interakcí s PPIs záviset také na genotypu pacienta.
PPIs mohou zpomalovat renální vylučování methotrexátu, pravděpodobně ovlivněním renální H+/K+-ATPázy. U vysokodávkových režimů s methotrexátem je vhodné podávání PPIs dočasně přerušit, případně je nahradit H2-antihistaminiky (24).
Některé z dalších popsaných interakcí nemají zcela objasněný mechanismus vzniku, jedná se například o zvýšení hladiny fenytoinu, sachinaviru nebo snížení hladiny nelfinaviru při souběžném podání s PPIs (24).
Podání PPIs interferuje s vyšetřením neuroendokrinních tumorů z důvodu zvýšené hladiny chromograninu A (CgA), léčba PPIs se tedy před měřením CgA musí přerušit s předstihem alespoň 5 dní (6).
Nežádoucí účinky
Mezi nejčastější krátkodobé nežádoucí reakce na PPIs patří vyrážka, bolest břicha, zácpa, průjem, flatulence, nauzea, zvracení, slabost, závratě a bolest hlavy. Nejzávažnějšími projevy mohou být subakutní lupus erythematodes, multiformní erytém, Stevensův-Johnsonův syndrom, toxická epidermální nekrolýza, hypomagnezemie, atrofická gastritida, klostridiový průjem, funkční polypóza ze žlázek fundu žaludku, hemolytická anemie, selhání jater, jaterní encefalopatie, anafylaxe, fraktury, rabdomyolýza, akutní intersticiální nefritida a angioedém (24).
Mezi diskutované nežádoucí účinky dlouhodobého užívání PPIs patří zejména hypomagnezemie, snížení hladiny vitaminu B12, zvýšení rizika GI a respiračních infekcí, zvýšené riziko zlomenin a dlouhodobý vliv na renální funkce.
Hypomagnezemie byla pozorována u pacientů s užíváním PPIs delším než 1 rok. Po jejich vysazení došlo k normalizaci magnezemie. Metaanalýza 9 observačních studií popisuje zvýšení rizika hypomagnezemie u pacientů užívajících PPIs o 43 %, faktory dále zvyšující toto riziko mohou být například malabsorpce nebo užití kličkových diuretik (32). Dle SPC přípravku Helicid je doporučeno opakovaně v průběhu léčby vyšetřit hladinu hořčíku (6), frekvence vyšetření však není uvedena; racionální může být změření hladiny u symptomatických pacientů (32).
Žaludeční kyselina je nutná k uvolnění vitaminu B12 z potravy a u pacientů užívajících PPIs bylo pozorováno zvýšení rizika deficitu tohoto vitaminu o 65 %; rizikovými faktory jsou užívání více než 1,5násobku základní denní dávky a věk > 50 let (32). Výrobce uvádí, že tuto okolnost je třeba mít na paměti, bez upřesnění potřeby pravidelného monitorování hladiny vitaminu B12 (6). PPIs navozená hypochlorhydrie může mít také nepříznivý vliv na vstřebávání železa a při chronickém užívání PPIs vést k rozvoji anemie (39).
Metaanalýza 11 studií nalezla zvýšené riziko přerůstání bakterií v tenkém střevě u uživatelů PPIs (poměr šancí [OR] 2,28; 95% interval spolehlivosti [CI] 1,24–4,21). Ze studií využívajících k diagnostice duodenální/jejunální aspirát dokonce vyplynulo riziko zvýšené 7,5násobně. Klinický dopad tohoto efektu je nejasný, může však být důvodem k opatrnosti například u cirhotických pacientů, jak bylo zmíněno výše. S alterací střevního mikrobiomu, k níž dochází po 4–8 týdnech terapie PPI, a přežívání bakterií v alkaličtějším pH souvisí také zvýšené riziko incidence klostridiových infekcí; z observačních studií vyplývá vzestup jejich rizika o 65 %. Nebylo však prokázáno, že by v souvislosti s PPIs docházelo ke vzestupu v závažnosti klostridiové infekce, selhání terapie nebo rekurence onemocnění. Data ze studií jsou zatížena velkou heterogenitou a kvalita důkazů velmi nízká (32).
Užívání PPIs bylo v několika studiích asociováno s výskytem komunitní pneumonie, tato souvislost se však nepotvrdila (32).
V metaanalýze 18 observačních studií bylo zjištěno, že užívání PPIs je spojeno se zvýšeným rizikem jakékoli zlomeniny (relativní riziko [RR] 1,33; 95% CI 1,15–1,54), zlomeniny kyčle (RR 1,26; 95% CI 1,16–1,36) a zlomeniny obratle (RR 1,8; 95% CI 1,38–1,82), přičemž souvislost s užíváním PPIs byla pozorována jak u léčby kratší než 1 rok, tak u terapie dlouhodobé. Za hlavní mechanismus tohoto nežádoucího účinku je považována snížená absorpce vápníku. K dispozici však není jasný důkaz o souvislosti užívání PPIs s rozvojem osteoporózy; diskutován je efekt PPIs na osteoklasty i osteoblasty ovlivněním vakuolární H+-ATPázy s nejasným výsledným efektem (34). Pro užívání PPIs u pacientů s rizikem osteoporózy není specifické doporučení, kromě standardní léčby a dostatečného přísunu vitaminu D a kalcia (33).
Pokud jde o vliv PPIs na renální funkce, v porovnání s pacienty užívajícími H2-antihistaminika došlo u uživatelů PPIs v 5letém sledování ke zvýšení rizika rozvoje chronického renálního onemocnění (CHRI) o 28 % a zdvojnásobení hodnot sérového kreatininu s rizikem > 30 %. V populační studii pacientů starších 65 let bylo pozorováno 2,5násobně zvýšené riziko rozvoje akutního renálního selhání a 3násobně vyšší riziko akutní intersticiální nefritidy po zahájení léčby PPIs. Rozvoj CHRI může být následkem subklinicky probíhající akutní intersticiální nefritidy, která je popsaným nežádoucím účinkem PPIs. V souvislosti s terapií PPIs však nejsou dána žádná doporučení pro monitorování renálních funkcí (32).
Pokud pacienti užívají PPIs dlouhodobě, může dojít v některých případech po jejich náhlém vysazení ke zhoršení symptomů spojených s hyperaciditou (v důsledku PPIs navozené hypergastrinemie a rebound efektu). Vhodnou strategií může být postupné snížení jejich dávky namísto náhlého vysazení (37).
ZÁVĚR
PPIs jsou vysoce efektivními a relativně bezpečnými léčivy v řadě indikací, kde je vyžadována suprese tvorby žaludeční kyseliny. Mnohé studie však nasvědčují tomu, že jsou na jedné straně nadužívány v situacích, kdy jejich podání nemá jasné opodstatnění (13, 37), a mnohdy užívány déle, než je nezbytné, ovšem na druhou stranu rovněž nedostatečně užívány v situacích, kdy přinášejí jednoznačný prospěch (35).
Přestože je akutní toxicita PPIs nízká, není jejich dlouhodobé užívání bez rizika, proto bychom se při kontrole farmakoterapie vždy měli zaměřit na to, aby podání PPIs bylo terapeuticky opodstatněné, pokud možno časově jasně ohraničené, s výběrem vhodné dávky a vhodného léčiva s ohledem na potenciální lékové interakce. Kromě terapeutického přínosu můžeme dále revizí farmakoterapie přispět k úspoře nákladů a vyvarovat se zbytného podávání, které může být zatěžující zejména pro pacienty s polypragmazií.
Seznam zkratek
- aPTT aktivovaný parciální tromboplastinový čas
- ASA kyselina acetylsalicylová
- AUC plocha pod křivkou plazmatické koncentrace léčiva
- EGFR receptor pro endotelový růstový faktor
- FDA Úřad pro kontrolu léčiv a potravin (USA)
- GERD gastroezofageální refluxní choroba
- GI gastrointestinální
- GIT gastrointestinální trakt
- H2 histaminové receptory 2. typu
- CHRI chronická renální insuficience
- i. v. intravenózní
- INR mezinárodní normalizovaný poměr
- IPLP individuálně připravovaný léčivý přípravek
- JIP jednotka intenzivní péče
- LP léčivý přípravek
- mRNA messenger ribonukleová kyselina
- NOACs nová perorální antikoagulancia
- NSAIDs nesteroidní protizánětlivá léčiva
- pKa disociační konstanta
- PPIs inhibitory protonové pumpy
- SPC souhrn údajů o přípravku
- VCHGD vředová choroba gastroduodena
- WHO Světová zdravotnická organizace
Adresa pro korespondenci:
PharmDr. Alena Pilková
Oddělení klinické farmakologie a farmacie, VFN v Praze
Na Bojišti 1, 128 80 Praha 2
Tel.: 224 964 145, 224 964 135
e-mail: alena.pilkova@vfn.cz
Zdroje
- Strand DS, Kim D, Peura DA. 25 years of proton pump inhibitors: a comprehensive review. Gut Liver 2017; 11(1): 27–37.
- Cash BD. The science of acid control – therapeutic implications. Medscape, 2009 May 14. Dostupné na: www.medscape.org/viewarticle/702505_4
- Shi S, Klotz U. Proton pump inhibitors: an update of their clinical use and pharmacokinetics. Eur J Clin Pharmacol 2008; 64(10): 935–951.
- Kirchheiner J, Glatt S, Fuhr U et al. Relative potency of proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65(1): 19–31.
- Hunt, RH, Scarpignato C. Potent acid suppression with PPIs and P-CABs: what’s new? Curr Treat Options Gastroenterol 2018; 16(4): 570–590.
- Databáze léků. Státní ústav pro kontrolu léčiv, Praha. Dostupné na: www.sukl.cz/modules/medication/search.php
- Petrželová M, Horák P, Hordějčuková A a kol. Omeprazolová suspenze 2 mg/ml – nová léková forma pro pediatrii. Praktické lékárenství 2017; 13(1): 18–20.
- Gralnek IM, Dumonceau JM, Kuipers EJ et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47(10): a1–a46.
- Konečný M, Procházka V. Racionální diagnostický a terapeutický postup u akutního krvácení do horní části trávicího traktu. Interní medicína 2009; 11(10): 446–448.
- Saltzman JR. Approach to acute upper gastrointestinal bleeding in adults. UpToDate, 2019 Nov 26. Dostupné na: www.uptodate.com/contents/approach-to-acute-upper-gastrointestinal-bleeding-in-adults
- Saltzman JR. Overview of the treatment of bleeding peptic ulcers. UpToDate, 2019 Nov 20. Dostupné na: www.uptodate.com/contents/overview-of-the-treatment-of-bleeding-peptic-ulcers
- Weinhouse GL. Stress ulcers in the intensive care unit: Diagnosis, management, and prevention. UpToDate, 2019 Oct 20. Dostupné na: www.uptodate.com/contents/stress-ulcer-prophylaxis-in-the-intensive-care-unit
- Scarpignato C, Gatta L, Zullo A et al. Effective and safe proton pump inhibitor therapy in acid-related diseases – A position paper addressing benefits and potential harmas of acid suppression. BMC Med 2016; 14(1): 179.
- Bhatt DL, Scheiman J, Abraham NS et al. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2008; 52(18): 1502–1517.
- Valgimigli M, Bueno H, Byrne RA et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developer in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018; 39(3): 213–260.
- Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developer in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893–2962.
- Steffel J, Verhamme P, Potpara TS et al. The 2018 European Heart Rhythm Association Practical Guide in the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018; 39(16): 1330–1393.
- Narum S, Westergren T, Klemp M. Corticosteroids and risk of gastrointestinal bleeding: a systematic review and meta-analysis. BMJ Open 2014; 4(5): e004587.
- Masclee GM, Valkhoff VE, Coloma PM et al. Risk of upper gastrointestinal bleeding from different drug combinations. Gastroenterology 2014; 147(4): 784–792.
- Fejfar T, Vaňásek T, Brůha R a kol. Léčba krvácení v důsledku portální hypertenze při jaterní cirhóze – aktualizace doporučených postupů ČHS ČLS JEP. Gastroenterologie a hepatologie 2017; 71(2): 105–116.
- Garcia-Tsao G, Sanyal AJ, Grace ND et al. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46(3): 922–938.
- Numico G, Fusco V, Franco P et al. Proton pump inhibitors in cancer patients: how useful they are? A review of most common indications for their use. Crit Rev Oncol Hematol 2017; 111 : 144–151.
- Vyzula R a kol. Modrá kniha České onkologické společnosti. Masarykův onkologický ústav, Brno, 2019.
- IBM Corporation. Micromedex: Drug Interactions. Platné znění databáze k září 2019.
- van Leeuwen RWF, Jansman FGA, HUnfeld NG et al. Tyrosine kinase inhibitors and proton pump inhibitors: an evaluation of treatment options. Clin Pharmacokinet 2017; 56(7): 683–688.
- Gan TJ, Diemunsch P, Habib AS et al. Consensus guidelines for the management of postoperative nauzea and vomiting. Anesth Analg 2014; 118(1): 85–113.
- Raeder J, Dahl V, Bjoernestad E et al. Does esomeprazole prevent post-operative nausea and vomiting? Acta Anaesthesiol Scand 2007; 51(2): 217–25.
- XU HB, Wang HD, Li CH et al. Proton pump inhibitor use and risk of spontaneous bacterial peritonitis in cirrhotic patients: a systematic review and meta-analysis. Genet Mol Res 2015; 14(3): 7490–7501.
- Tsai CF, Chen MH, Wang YP et al. Proton pump inhibitors increase risk for hepatic encephalopathy in patients with cirrhosis in a population study. Gastroenterology 2017; 152(1): 134–141.
- Joint Formulary Committee. BNF 76: September 2018 – March 2019. Pharmaceutical Press, London, 2018.
- Domínguez-Muñoz JE, Iglesias-García J, Iglesias-Rey M et al. Optimising the therapy of exocrine pancreatic insufficiency by the association of a proton pump inhibitor to enteric coated pancreatic extracts. Gut 2006; 55(7): 1056–1057.
- Nehra AK, Alexander JA, Loftus CG et al. Proton pump inhibitors: review of emerging concerns. Mayo Clin Proc 2018; 93(2): 240–246.
- Pabla D, Akhlaghi F, Zia H. A comparative pH-dissolution profile study of selected commercial levothyroxine products using inductively coupled plasma mass spektrometry. Eur J Pharm Biopharm 2009; 72(1): 105–110.
- Costa-Rodrigues J, Reis S, Teixeira S et al. Dose-dependent inhibitory effects of proton pump inhibitors on human ostaoclastic and osteoblastic cell activity. FEBS J 2013; 280(20): 5052–5064.
- Schepisi R, Fusco S, Sganga F et al. Inappropriate use of proton pump inhibitors in elderly patients discharged from acute care hospitals. J Nutr Health Aging 2016; 20(6): 665–670.
- Vachek J, Tesař V, Zakiyanov O et al. Farmakoterapie v těhotenství a při kojení. Maxdorf, Praha, 2016.
- Haastrup P, Paulsen MS, Begtrup LM et al. Strategies for discontinuation of proton pump inhibitors: a systematic review. Fam Pract 2014; 31(6): 625–630.
- Tesař V. Biologická a cílená léčba. Mladá fronta, Praha, 2018.
- Tran-Duy A, Connell NJ, Vanmolkot FH et al. Use of proton pump inhibitors and risk of iron deficiency: a population-based case-control study. J Intern Med 2019; 285(2): 205–214.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Úvodem
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Klinická farmacie v České republice
- Vyplatí se bezpečná farmakoterapie?
- Specializační a kontinuální vzdělávání v oboru klinická farmacie
- Klinický farmaceut v pediatrii: možný přínos?
- Podání léčiv nutričními sondami: příklady, pracovní skupina
- Inhibitory protonové pumpy v praxi klinického farmaceuta
- Klinicky významné lékové interakce antiretrovirotik
- Altepláza v intrapleurální terapii: Co víme a nevíme?
- Management metabolických nežádoucích účinků everolimu u pacientů s renálním karcinomem
- Možnosti farmakologického ovlivnění singultu u pacientů v paliativní péči
- Kombinace mirtazapinu a paroxetinu: možná klinicky projevená interakce?
- Přednáškové večery spolku českých lékařů v Praze (BŘEZEN 2020)
- Fatální Stevensův-Johnsonův syndrom: komplikace při hospitalizaci pacienta na gerontopsychiatrii a prostor pro multioborovou spolupráci
- Spánek a jeho poruchy v neurologii
- Specifika spánku u žen a jeho poruch
- Význam spánkové medicíny v pediatrii
- Precizní psychiatrie – reálná možnost?
- Za docentem Václavem Jiráskem
- Princip posuzování a uznávání nemocí z povolání v České republice
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti farmakologického ovlivnění singultu u pacientů v paliativní péči
- Altepláza v intrapleurální terapii: Co víme a nevíme?
- Spánek a jeho poruchy v neurologii
- Inhibitory protonové pumpy v praxi klinického farmaceuta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



