-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam cytogenetické a molekulárně cytogenetické analýzy v diagnostice hematologických malignit v době nových sekvenačních technik
Implication of cytogenetic and molecular cytogenetic analysis in diagnosis of hematological malignancies in the era of the new sequencing techniques
In patients with hematological malignancies one of the most substantial findings is the karyotype of bone marrow cells at the time of diagnosis. The detection of clonal chromosome aberrations in diagnostic samples not only confirms a neoplastic or premalignant process but also provides important diagnostic and prognostic information essential for precise disease classification and choice of suitable therapy. Karyotype analysis during the disease course also allows monitoring of the treatment success reflected as well in the revised WHO classification where patients are often classified into the different diagnostic subtypes based on the finding of specific chromosome and/or genetic changes. Recently, also increases the number of advanced treatment approaches that directly or indirectly target the genetic aberrations present in tumor cells. Despite the large development of new sequencing technologies in recent years, cytogenetic analysis supplemented by the molecular cytogenetic methods still remains a very important part of diagnostics of hematological malignancies.
Keywords:
conventional cytogenetic analysis – molecular cytogenetic analysis – karyotype – chromosome aberrations – clonal heterogeneity
Autoři: Zuzana Zemanová 1; Kyra Michalová 1; Jana Březinová 2
Působiště autorů: Centrum nádorové cytogenetiky, Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze 1; Ústav hematologie a krevní transfuze, Praha 2
Vyšlo v časopise: Čas. Lék. čes. 2019; 158: 22-27
Kategorie: Přehledový článek
Souhrn
U nemocných s hematologickými malignitami je jedním z nejdůležitějších nálezů karyotyp buněk kostní dřeně v době stanovení diagnózy. Detekce klonálních chromosomových aberací v diagnostických vzorcích nejen potvrzuje neoplastický nebo premaligní proces, ale také poskytuje diagnostické a prognostické informace, které jsou důležité pro přesnou klasifikaci onemocnění a výběr vhodné terapie. Analýza karyoytypu v průběhu onemocnění slouží rovněž k monitorování úspěšnosti léčby. Tyto skutečnosti se odrážejí i v revidované klasifikaci WHO, v níž jsou pacienti často řazeni do různých diagnostických subtypů právě na základě nálezu specifických chromosomových a/nebo genetických změn. V posledních letech dále vzrůstá počet moderních léčebných přístupů, jež přímo či nepřímo cílí na genetické aberace přítomné v nádorových buňkách. Cytogenetická analýza doplněná o výsledky molekulárně cytogenetických metod tak i přes velký rozvoj nových sekvenačních technologií v posledních letech stále zůstává velmi důležitou součástí diagnostiky hematologických malignit.
Klíčová slova:
konvenční cytogenetická analýza – molekulárně cytogenetické analýza – karyotyp – chromosomové aberace – klonální heterogenita
ÚVOD
Karyotyp je jedním z nejdůležitějších nezávislých prognostických faktorů u nemocných s různými typy hematologických malignit. U většiny těchto onemocnění byly popsány získané rekurentní chromosomové aberace, které jsou často specifické pro konkrétní subtyp onemocnění a u řady z nich dnes i přesně známe jejich prognostický význam (1, 2). Díky tomu se již některé konkrétní chromosomové aberace staly přímo součástí klasifikace WHO, podle které jsou nemocní řazeni do příslušných diagnostických skupin. Například pacienti se známými rekurentními přestavbami t(8;21)(q22;q22), inv(16)(p13q22)/t(16;16)(p13;q22) a t(15;17)(q22;q12) jsou podle WHO klasifikování jako akutní myeloidní leukémie (AML) bez ohledu na počet blastů (3). Často jsou také cytogenetické nálezy v kombinaci s cytomorfologickými zahrnuty v mezinárodních prognostických skórovacích systémech (IPSS), jako je tomu například v případě myelodysplastických syndromů (MDS) (4) nebo myeloproliferativních neoplazií (MPN). Příklad cytogenetického IPSS u nemocných s MDS uvádí tab. 1.
Tab. 1. Revidovaný cytogenetický prognostický skórovací systém u nemocných s myelodysplastickými syndromy (MDS IPSS-R) (dle Greenberg et al., 2012) 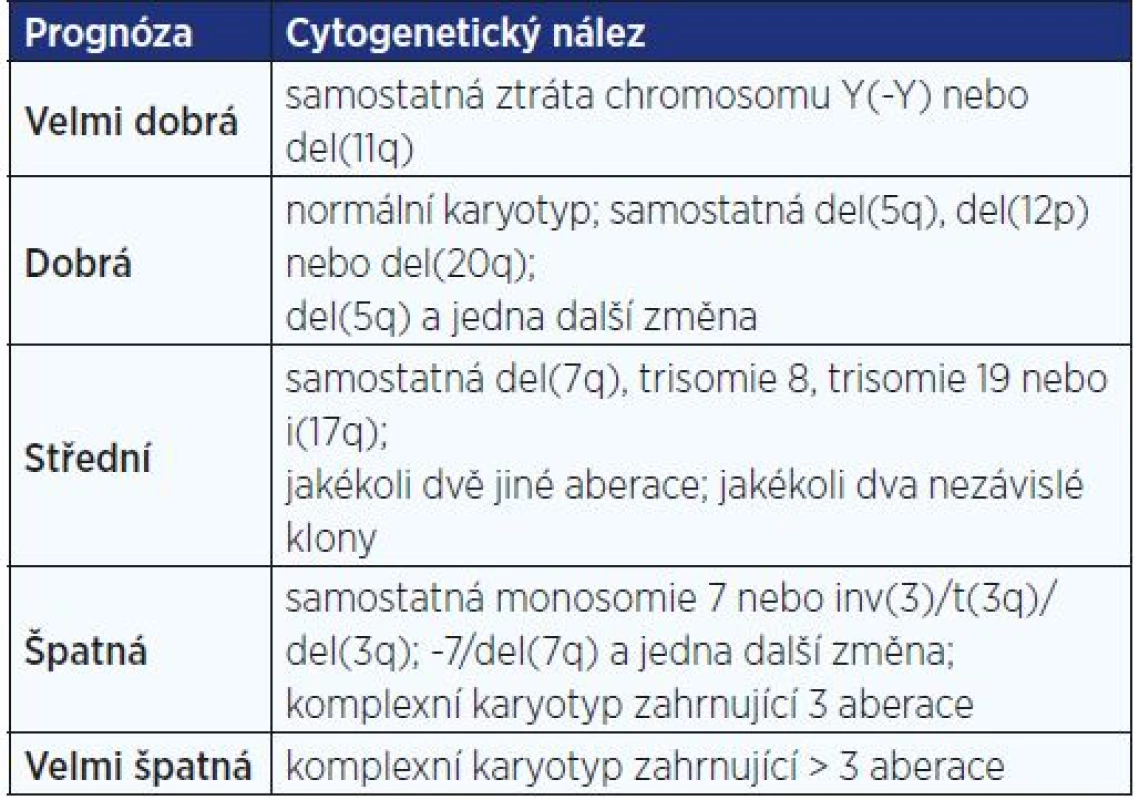
Cytogenetická analýza karyotypu leukemických a preleukemických buněk je proto v současné době jedním ze základních laboratorních vyšetření a přispívá nejen ke stanovení diagnózy a upřesnění prognózy, ale i k potvrzení tzv. klonality, určení velikosti patologického klonu, výběru vhodné léčby, monitorování její úspěšnosti a časnému záchytu relapsu. Moderní léčebné přístupy jsou v dnešní době často přímo nebo nepřímo cílené na geneticky definované subtypy nádorových onemocnění.
Typickým rysem všech typů nádorů je tzv. klonální heterogenita. Vysoká míra genomové nestability nádorových buněk je spojená se zvýšeným rizikem kumulace dalších genetických aberací a vznikem různých heterogenních subklonů. Tyto subklony mohou být odvozeny od jednoho základního klonu (pak se jedná o geneticky příbuzné klony) nebo mohou být geneticky nezávislé (nepříbuzné klony). Některé z těchto subklonů mohou následně v průběhu onemocnění vymizet, jiné mohou naopak získat proliferační výhodu, a může tak dojít k jejich klonální expanzi. Tento jev je považován za jeden ze spouštěcích mechanismů vzniku a progrese nádoru a zároveň je také pravděpodobně jednou z příčin rezistence na léčbu a relapsu nádorových onemocnění.
Existence klonální heterogenity byla dokumentována u různých typů solidních nádorů a hematologických malignit. Cytogenetická klonální heterogenita je obvykle spojena s komplexními karyotypy, agresivnějším onemocněním a špatnou prognózou. Genetická diverzita leukemických buněk v době stanovení diagnózy zároveň představuje zásadní terapeutický problém. Ani cílená terapie totiž nemůže být efektivní, pokud se nepodaří odstranit všechny patologické klony s leukemickým potenciálem (5). Pokud některý (byť původně třeba i velmi malý) klon je z nějakého důvodu k takové léčbě rezistentní (například je nositelem genetické změny, která je příčinou rezistence), může po určité době dojít k jeho další expanzi nebo klonální evoluci, a dochází tak k relapsu nádorového onemocnění (obr. 1).
Obr. 1. Klonální heterogenita a genetická diverzita leukemických buněk může být příčinou rezistence na léčbu, klonální evoluce a relapsu onemocnění 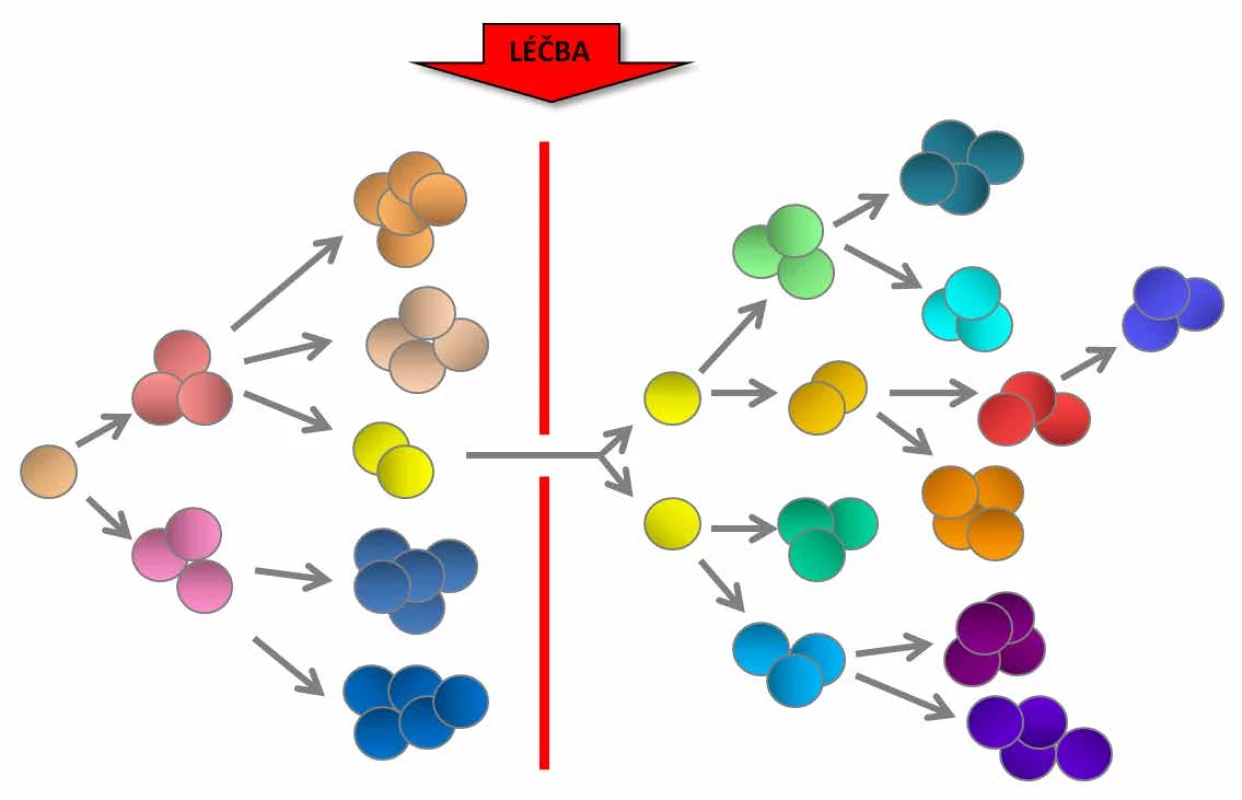
Lepší znalosti o dynamice a architektuře leukemických klonů tak mohou přispět k úspěšnější léčbě nemocných. Pokud například u pacienta s MDS najdeme pomocí některé z cílených technik tři chromosomové aberace (obr. 2a), je velmi důležité vědět, zda jsou všechny tyto změny přítomné v jednom nebo ve více buněčných klonech. Jestliže jsou totiž tyto aberace přítomné ve dvou cytogeneticky nezávislých klonech (například dvě aberace v jednom klonu a jedna aberace ve druhém) (obr. 2b), spadá pacient podle cytogenetického skórovacího systému do skupiny se střední prognózou (viz MDS IPSS-R, tab. 1). Pokud jsou však všechny detekované aberace přítomné v jednom klonu (třeba i v kombinaci s dalšími změnami), jedná se o komplexní karyotyp (obr. 2c) – pacient je klasifikován do skupiny se špatnou nebo velmi špatnou prognózou podle celkového počtu aberací a vyžaduje zcela jiný léčebný přístup (4).
Obr. 2a Vyšetření pacientky s MDS metodou I-FISH se specifickým panelem DNA sond (Abbott) pro detekci 4 nejčastějších a prognosticky nejvýznamnějších chromosomových aberací popisovaných u nemocných s touto diagnózou: delece 5q, monosomie 7, trisomie 8 a delece 20q. Nález potvrdil přítomnost tří aberací – del(5q), trisomie 8 a del(20q). 
Obr. 2b Analýza karyotypu konvenční pruhovací technikou prokázala, že aberace se u této pacientky vyskytují ve dvou cytogeneticky nezávislých klonech. Zatímco první klon obsahuje del(5q) současně s del(20q), ve druhém klonu je samostatná trisomie chromosomu 8. Podle IPSS-R je pacientka s tímto nálezem, tj. se dvěma nezávislými klony, řazena do skupiny se střední prognózou (viz tab. 1). 
Obr. 2c Jiná pacientka měla při vyšetření metodou I-FISH se specifickým MDS panelem stejný nález, tj. del(5q), trisomii 8 a del (20q). Detailní analýza karyotypu metodami mFISH a mBAND však prokázala, že u této pacientky jsou všechny tři aberace přítomné ve stejném klonu, který navíc obsahuje i další nebalancované chromosomové přestavby. Jedná se tedy o komplexní karyotyp s více než třemi aberacemi, což podle IPSS-R tuto nemocnou řadí do skupiny s velmi špatnou prognózou (viz tab. 1). 
K ověření přítomnosti aberací v nezávislých klonech je proto velmi důležité vybrat takovou vyšetřovací metodu, která umožňuje analyzovat karyotyp jednotlivých buněk a současně detekovat všechny heterogenní buněčné klony.
DIAGNOSTIKA HEMATOLOGICKÝCH MALIGNIT
V současnosti máme k dispozici řadu cytogenetických, molekulárně cytogenetických a molekulárně genetických metod, jež jsou využívány k diagnostice hematologických malignit. Tyto metody jsou v poslední době stále častěji označovány souhrnným názvem cytogenomické. Kromě konvenční cytogenetické analýzy k nim patří například hybridizační techniky (tj. metody založené na hybridizaci nukleových kyselin), zejména různé modifikace flurescenční in situ hybridizace (FISH), ale také tzv. mikročipové technologie (array-CGH, SNP array). Kromě cytogenomických metod došlo v posledních letech k obrovskému rozvoji rovněž v oblasti molekulární genetiky. Vyvinuty byly moderní sekvenační technologie, jež přinesly nové možnosti v diagnostice hematologických malignit a nádorových onemocnění vůbec.
K základním požadavkům pro správnou diagnostiku hematologických malignit patří možnost analýzy celého genomu, možnost identifikace balancovaných přestaveb, při kterých vznikají fúzní geny, ale i nebalancovaných aberací, při nichž dochází k zisku či ztrátě chromosomového materiálu (onkogeny, tumor-supresorové geny), možnost sledování klonálního vývoje a možnost identifikace a analýzy heterogenních buněčných klonů.
Každá z výše uvedených metod přináší informace důležité pro přesnou diagnostiku leukémií a preleukémií a každá z nich má také má své nesporné výhody, ale i nevýhody. Při volbě vhodné vyšetřovací techniky je proto důležité si vždy uvědomit, které informace může daná metoda poskytnout pro přesnou diagnostiku konkrétního onemocnění a/nebo při vyšetření konkrétního pacienta a jaké jsou naopak její limity (srovnání genetických vyšetřovacích metod uvádí tab. 2). V neposlední řadě patří k významným kritériím pro volbu vhodné vyšetřovací metody rovněž výše nákladů na dané vyšetření, doba nutná k získání relevantních výsledků a také klinická využitelnost získaných dat (tj. zda zjištěné nálezy skutečně ovlivní léčebné přístupy a výsledky tak mohou být přímo využity v rutinní klinické praxi).
Tab. 2. Srovnání genetických vyšetřovacích metod 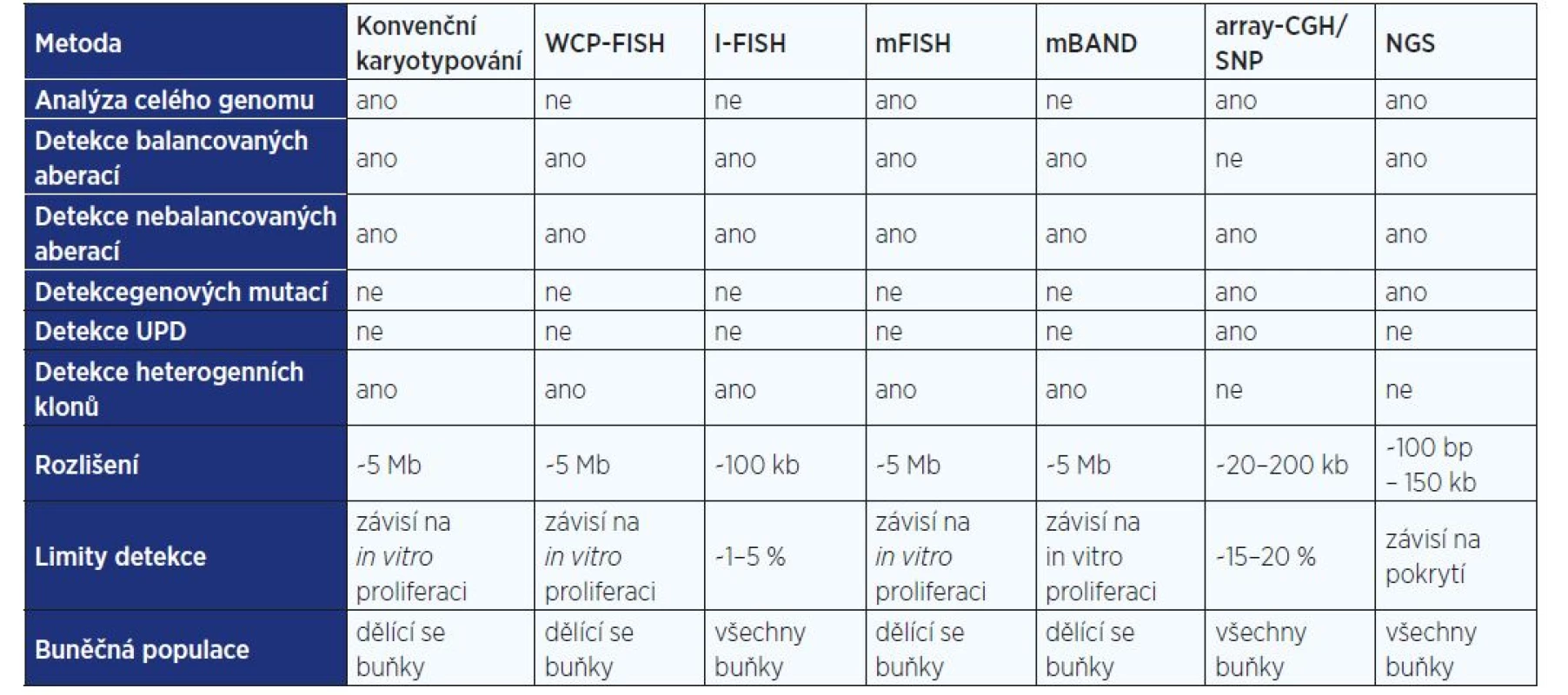
CYTOGENOMICKÉ METODY
Základní cytogenomickou metodou je tzv. konvenční cytogenetická analýza založená na kultivaci vyšetřovaných buněk (např. buněk kostní dřeně, lymfocytů periferní krve či buněk solidních nádorů), přípravě a barvení cytogenetických preparátů některou z pruhovacích technik a následné mikroskopické analýze struktury a počtu chromosomů, jež jsou na těchto preparátech fixované. Výsledný karyotyp je pak popsán podle mezinárodní nomenklatury ISCN (6).
Nespornou výhodou této metody je, že poskytuje během jediného experimentu komplexní informace o celém genomu nádorové buňky a umožňuje detekovat a analyzovat i heterogenní buněčné klony. Analýza chromosomů rovněž přispěla k identifikaci většiny genů zahrnutých ve specifických chromosomových aberacích. Díky tomu konvenční cytogenetická analýza v dnešní době stále patří k základním vyšetřovacím metodám v rámci diagnostiky hematologických malignit a je považována za zlatý standard v detekci chromosomových aberací.
Tato metoda má ale samozřejmě i svá omezení, ke kterým patří zejména poměrně nízká rozlišovací schopnost (~5 Mb), která neumožňuje záchyt kryptických aberací. Relativně častým problémem je dále nízký nebo nulový mitotický index studovaných buněk (tj. počet dělících se buněk ve stádiu metafáze, které jsou vhodné pro cytogenetickou analýzu). Např. u leukémií pozorujeme cca 80–90% úspěšnost kultivace; ve zbývajících 10–20 % případů je cytogenetická analýza neúspěšná, protože se nepodaří získat žádné dělící se buňky ve stadiu metafáze. Zejména u nádorových onemocnění se rovněž často setkáváme s nízkou kvalitou chromosomů. Kromě toho mohou být chromosomové přestavby v nádorových buňkách někdy velmi složité a komplexní, a nelze je proto jenom na základě konvenčního pruhování přesně analyzovat. V neposlední řadě se u některých konkrétních subtypů hematologických malignit (např. u chronické B-lymfocytární leukémie či mnohočetného myelomu) setkáváme s omezenou proliferační aktivitou patologických buněčných klonů. V buněčné kultuře se tak dělí pouze buňky s normálním karyotypem, zatímco patologické buňky bez přidání mitogenu in vitro neproliferují, a konvenční cytogenetická analýza je tak obvykle neinformativní.
V těchto případech se proto uplatňuje cílené využití některé z molekulárně cytogenetických metod, zejména nejrůznějších modifikací fluorescenční in situ hybridizace (FISH) – např. interfázní FISH (I-FISH), FISH s malovacími sondami pro celé chromosomy (WCP-FISH), mnohobarevné FISH (mFISH) a mnohobarevné pruhování s vysokou rezolucí (mBAND) (7). Tyto metody přinášejí důležité doplňující informace o genomu vyšetřovaných buněk a upřesňují tak výsledky konvenční cytogenetické analýzy.
Také molekulárně cytogenetické metody však mají své výhody a nevýhody, které je nutné zvažovat při výběru vhodného vyšetřovacího postupu. Například hlavní výhodou metody I-FISH je, že umožňuje detekovat chromosomové aberace nejen v dělících se buňkách ve stádiu metafáze, ale i v nedělících se interfázních jádrech, takže poskytuje informativní výsledky i v případech s nízkým nebo nulovým mitotickým indexem. Tato metoda se využívá k rychlé cílené detekci známých prognosticky významných aberací (při využití panelů specifických DNA sond), k přesné identifikaci zlomových míst a genů zahrnutých v chromosomových přestavbách (fúzních genů, genové amplifikace a delece), k určení velikosti patologického klonu a k monitorování léčebné odpovědi. Metoda I-FISH však umožňuje sledovat jen omezený počet cílových sekvencí fixovaných na cytogenetickém preparátu, a neposkytuje tak informace o celém genomu a eventuální přítomnosti dalších aberací, jež mohou významným způsobem ovlivnit průběh a prognózu onemocnění.
Metoda mFISH umožňuje v jediném hybridizačním experimentu barevně odlišit všechny chromosomy a detekovat tak současně všechny chromosomové aberace přítomné v karyotypu včetně složitých komplexních přestaveb. Neumožňuje však přesně určit zlomová místa na přestavěných chromosomech, což naopak umožňuje metoda mBAND, a to s vyšší přesností než konvenční pruhovací techniky. Tato metoda však opět umožňuje sledovat pouze omezený počet cílových sekvencí, který závisí na použité sondě a neposkytuje informace o celém genomu nádorové buňky.
Kromě metod FISH můžeme využít i některou z mikročipových technik (array-CGH, SNP array), jejichž výhodou je, že jsou založeny na analýze celogenomové DNA, takže nejsou nutné mitózy. Tyto metody jsou vysoce citlivé (~20–200 kb), poskytují informace o celém genomu studovaných buněk, umožňují velmi přesnou detekci změn spojených se ziskem či ztrátami genetického materiálu (amplifikací/delecí) a přesné určení zlomových míst a detekci uniparentálních disomií (UPD). Pokud použijeme RNA čipy, můžeme sledovat rovněž genovou expresi. Tyto metody však neumožňují detekci balancovaných strukturních aberací (translokace, fúzní geny atd.), které u hematologických malignit často patří ke specifickým prognosticky významným aberacím; dále neumožňují sledovat zastoupení aberací v různých klonech (klonální heterogenitu) a detekci malých buněčných klonů zastoupených u < 15–20 % buněk, které však mohou významně ovlivňovat prognózu nemocných.
Výsledný karyotyp je tak vždy založen na nálezech na základě vhodně zvolené a uvážené (klinicky užitečné) kombinace dostupných metod. Výběr vyšetřovací metody závisí jednak na subtypu hematologické malignity a také na léčebných možnostech a vstupních požadavcích příslušného léčebného protokolu. Čím více bude dostupná léčba cílená na konkrétní aberace, tím vyšší budou požadavky na co nejpřesnější laboratorní diagnostiku. V časopisu Evropské cytogenetické asociace (ECA) byly v roce 2013 publikovány doporučené vyšetřovací postupy pro diagnostiku získaných chromosomových aberací u nemocných s různými subtypy hematologických malignit (8). V letošním roce byla v časopisu Leukemia zveřejněna jejich nová aktualizovaná verze (9).
MASIVNÍ PARALELNÍ SEKVENOVÁNÍ
V relativně nedávné době došlo k prudkému rozvoji vysoce výkonných sekvenačních technologií, které umožňují jak cílené sekvenování vybraných úseků lidského genomu (targetted sequencing), tak také kompletní sekvenování celého genomu (WGS) nebo exomu (WES).
Metody masivního paralelního sekvenování, označované též jako sekvenování nové generace (NGS), umožňují kromě celogenomové analýzy rovněž detekci balancovaných translokací, které vedou ke vzniku fúzních genů i aberací spojených se ztrátami nebo ziskem chromosomového materiálu podobně jako konvenční cytogenetická analýza. Kromě toho jsou tyto techniky mnohem citlivější než konvenční cytogenetické metody – umožňují tak detekci vrozených či získaných genových mutací a poskytují také informace o genetické predispozici k nádorovým onemocněním, které pravděpodobně přispějí k rozvoji tzv. personalizované medicíny (tj. k individuálnímu přístupu k jednotlivým pacientům). U některých diagnóz (např. u AML) již byly vyvinuty silné prognostické modely, které jsou založeny pouze na detekci genových mutací (10). Prognosticky významné mutace jsou dnes již také zahrnuty v aktualizované klasifikaci WHO (3). U jiných hematologických onemocnění (např. MDS) jsou v současné době intenzivně připravovány nové prognostické skórovací systémy, které budou kromě cytogenetických změn zahrnovat i informace o přítomnosti prognosticky významných mutací.
Nevýhodou metod NGS však je, že zatím neumožňují detekci malých klonů, které, jak bylo řečeno výše, mohou významným způsobem ovlivnit průběh a prognózu onemocnění. Dalším zásadním problémem je, že vzhledem k tomu, že tato technika neumožňuje analýzu jednotlivých buněk, nelze přesně identifikovat nezávislé buněčné klony (klonální heterogenitu). Zastoupení jednotlivých buněčných klonů lze metodami NGS odhadnout pouze nepřímo (10). Rovněž náklady na jejich zavedení a využití v rutinní diagnostické praxi jsou pro většinu pracovišť zatím příliš vysoké, přestože se neustále snižují. Velmi náročná je i bioinformatická analýza velkého množství získaných dat a problematická je často také klinická interpretace a využitelnost dosažených výsledků.
Metoda NGS tak v současnosti představuje další z technik, které doplňují výsledky konvenčních analýz a přinášejí řadu nových informací důležitých pro zpřesnění diagnostiky nádorových onemocnění. Do budoucna má však tato metoda určitě velký potenciál a nelze ani vyloučit, že některá její další modifikace možná v budoucnu zcela nahradí stávající cytogenomické metody v diagnostice nádorových onemocnění. Než se však stane běžnou součástí rutinní diagnostické praxe, budou nutné následující kroky:
- snížit náklady na WGS analýzy;
- prokázat vysokou technickou reprodukovatelnost těchto metod za rutinních diagnostických podmínek;
- vyvinout/optimalizovat algoritmy pro analýzy nádorových buněk;
- vyškolit laboratorní pracovníky v analýze a interpretaci dat;
- vyškolit lékaře jak správně chápat zprávy o výsledcích;
- provést rozsáhlé studie, které potvrdí, že WGS spolehlivě identifikuje všechny genetické informace nezbytné pro klasifikaci, prognózu a rozhodnutí o léčbě;
- prokázat skutečný diagnostický přínos pro různé subtypy maligních onemocnění;
- vytvořit závazná pravidla přesně stanovující, které informace mají být poskytovány pacientům a které nejsou spojeny s primární diagnostickou otázkou. S ohledem na obrovský dopad celogenomového sekvenování je také nezbytné vybudovat infrastrukturu poskytující poradenství pro pacienty.
ZÁVĚR
Konvenční cytogenetická analýza má v diagnostice hematologických malignit stále svůj nezastupitelný význam, protože dosud nebyly vyvinuty jiné techniky, které by poskytovaly všechny potřebné diagnostické a prognostické informace. Metody FISH a array CGH/SNP významným způsobem doplňují výsledky klasického karyotypování, ale nemají potenciál tuto metodu nahradit. Konvenční analýza G-pruhovaných chromosomů doplněná FISH a dalšími molekulárně cytogenetickými technikami tak zůstává jedním ze základních laboratorních vyšetření a pravděpodobně se na tom nic nezmění ani v nejbližších letech.
Vhodně zvolená kombinace cytogenomických technik poskytuje komplexní informace o genomu nádorových buněk a umožňuje záchyt kryptických strukturních aberací a heterogenních klonů, jež mohou hrát významnou úlohu v patogenezi onemocnění. Nové techniky celogenomového sekvenování kombinované s transkriptomovým sekvenováním, případně nějaká jejich nová modifikace by pravděpodobně v budoucnu mohly mít potenciál nahradit konvenční cytogenomické techniky, ale pouze v případě, že budou splněny tyto základní podmínky: bude prokázána jejich reprodukovatelnost a validita v diagnostice konkrétních onemocnění, bude vyhodnocen diagnostický a prognostický dopad u velkých souborů pacientů a budou vypracována jednotná pravidla (mezinárodní guidelines) pro reportování výsledků.
Čestné prohlášení
Autorky práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena projekty RVO-VFN64165, GACRP302/12/G157, ProgresQ28/LF1 a RVO-UHKT00023736.
Seznam použitých zkratek
AML akutní myeloidní leukémie
array-CGH komparativní genomová hybridizace na čipech (array comparative genomic hybridization)
ECA European Cytogeneticists Association
FISH fluorescenční in situ hybridizace
I-FISH interfázní FISH
IPSS International Prognostic Scoring System
mBAND mnohobarevné pruhování s vysokou resolucí (multicolor banding)
MDS myelodysplastické syndromy
mFISH mnohobarevná FISH
NGS sekvenování nové generace (next genenaration sequencing)
SNP jednonukleotidový polymorfismus (single nucleotide polymorphism)
UPD uniparentální disomie (uniparental disomy)
WCP-FISH FISH s malovacími sondami pro celé chromosomy (whole chromosome painting FISH)
WES celoexomové sekvenování (whole exome sequencing)
WGS celogenomové sekvenování (whole genome sequencing)
WHO Světová zdravotnická organizace (World Health Organization)
Adresa pro korespondenci:
doc. RNDr. Zuzana Zemanová, CSc.
Centrum nádorové cytogenetiky
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze
Tel.: 224 952 935
e-mail: zuze@vfn.cz
Zdroje
- Huret JL (ed.). Atlas of Genetics and Cytogenetics in Oncology and Hematology. Dostupné na: http://AtlasGeneticsOncology.org
- Heim S, Mitelman F (eds.). Cancer Cytogenetics: Chromosomal and Molecular Genetic Aberrations of Tumor Cells (4th ed.). Wiley-Blackwell, Chichester, 2015.
- Swerdlow SH, Campo E, Harris NL et al. (eds). WHO classification of tumours of haematopoietic and lymphoid tissue (revised 4th ed.). IARC, Lyon, 2017.
- Greenberg PL, Tuechler H, Schanz J et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120(12): 2454–2465.
- Bochtler T, Stölzel F, Heilig CHE et al. Clonal heterogeneity as detected by metaphase karyotyping is an indicator of poor prognosis in acute myeloid leukemia. J Clin Oncol 2013; 31(31): 3898–3905.
- MCGOWAN-JORDAN A, SIMONS A, SCHMID M (eds.). ISCN (2016). An international system for human cytogenomic nomenclature. Karger, Basel, 2016.
- Michalová K, Zemanová K. Molekulární cytogenetika v diagnostice nádorových onemocnění. Čas Lék Čes 2006; 145 : 532–537.
- Hastings R, Howell R, Betts D et al. Guidelines and quality assurance for acquired cytogenetics: a common European framework for quality assessment for banded chromosome studies and molecular cytogenetic investigations of acquired abnormalities. E.C.A. Newsletter 2013; 31 : 7–21.
- Rack KA, van den Berg E, Haferlach C et al. European recommendation and quality assurance for cytogenomic analysis of haematological neoplasms. Leukemia 2019 Jan 29, doi: 10.1038/s41375-019-0378-z.
- Béné MC, Grimwade D, Haferflach C et al. European LeukemiaNet. Leukemia diagnosis: today and tomorrow. Eur J Haematol 2015; 95(4): 365–373.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2019 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Dědičné nádorové syndromy, jejich testování a prevence
- Přednáškové večery spolku českých lékařů v Praze (DUBEN 2019)
- Význam cytogenetické a molekulárně cytogenetické analýzy v diagnostice hematologických malignit v době nových sekvenačních technik
- Vyhledávání genetických variant u trombofilních stavů
- Vzácná onemocnění a jejich domácí a mezinárodní kontext v roce 2019
- Specifika informovaného souhlasu v klinické genetice a genetickém poradenství
- Úvodem
- Clinical genetics in the 21st century
- Problematika výjimečné úhrady podle § 16 zákona o veřejném zdravotním pojištění
- Editorial
- Vrozené vady u narozených dětí v České republice v období 1994–2015
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné nádorové syndromy, jejich testování a prevence
- Vrozené vady u narozených dětí v České republice v období 1994–2015
- Význam cytogenetické a molekulárně cytogenetické analýzy v diagnostice hematologických malignit v době nových sekvenačních technik
- Specifika informovaného souhlasu v klinické genetice a genetickém poradenství
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



