-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých
Lymph node syndrome associated with cat scratch disease in children and adults
A retrospective evaluation of a group of patients with cat-scratch disease which is focused on epidemiological context, clinical picture, serological diagnosis and treatment in children and adults. Seventy-three patients with catch-scratch disease (CSD) were diagnosed at the Clinic of infectious medicine in 2008–2017, the group consisted of 37 children and 36 adults. Injury, or at least contact with cat, localization of lymph node syndrome and other clinical signs were investigated. Serological diagnosis was based on detection of IgM and IgG antibodies against Bartonella henselae. Duration of lymph node syndrome and antibodies against B. henselae were observed. Findings of granulomatous inflammation in extirpated lymph node supported suspicion of CSD.
66 of 73 patients had contact with cat, only 22 patients reported injury caused by cat. Cervical lymph nodes were affected the most often, in 32 patients. Extirpation of lymph node was performed in 19 patients. Positive IgM antibodies were detected in 47 patients. Between the group of children and adults important differences in any followed parameters were not observed.
In the group of 73 patients with cat-scratch disease cervical lymph nodes were affected the most often. Positive IgM antibodies were detected in 47 patients, lymph node extirpation was performed in 19 patients. Considerable differences in course of disease in children and adults were not found out.
Keywords:
cat-scratch disease, lymph node syndrome, serology, extirpation
Autoři: Lubomíra Hozáková 1,2; Luděk Rožnovský 2; Fádi Fakhouri 3; Jana Doležílková 4; Vladimír Janout 5
Působiště autorů: Ústav epidemiologie a ochrany veřejného zdraví LF OU, Ostrava 1; Klinika infekčního lékařství LF OU a FN Ostrava 2; Ústav patologie LF OU a FN Ostrava 3; Oddělení parazitologie a lékařské zoologie, Zdravotní ústav se sídlem v Ostravě 4; Fakulta zdravotnických věd UP Olomouc 5
Vyšlo v časopise: Čas. Lék. čes. 2018; 157: 146-151
Kategorie: Původní práce
Souhrn
Jedná se o retrospektivní hodnocení souboru pacientů s nemocí z kočičího škrábnutí (felinózou) se zaměřením na epidemiologické souvislosti, klinický obraz, sérologickou diagnostiku a léčbu u dětí a dospělých. V letech 2008–2017 bylo na Klinice infekčního lékařství Fakultní nemocnice Ostrava diagnostikováno 73 pacientů s nemocí z kočičího škrábnutí, v souboru bylo 37 dětí a 36 dospělých pacientů. Zjišťovalo se poranění nebo alespoň kontakt s kočkou, lokalizace uzlinového syndromu a další klinické příznaky. Sérologická diagnostika spočívala v průkazu IgG a IgM protilátek proti Bartonella henselae. Sledovala se délka přetrvávání uzlinového syndromu a perzistence protilátek proti B. henselae. Nález granulomatózního zánětu při případné exstirpaci uzliny podporoval podezření na felinózu.
Kontakt s kočkou uvádělo 66 z 73 pacientů, poranění kočkou jen 22 pacientů. Nejčastěji byly přítomny zvětšené krční uzliny – celkem u 32 pacientů. U devatenácti pacientů byla provedena exstirpace uzliny. Pozitivita IgM protilátek byla prokázána u 47 pacientů. Mezi souborem dětí a dospělých nebyly zaznamenány větší rozdíly téměř v žádném ze sledovaných parametrů.
V souboru 73 pacientů s nemocí z kočičího škrábnutí převládalo postižení krčních uzlin. Pozitivita IgM protilátek byla zjištěna u 47 pacientů, u 19 pacientů byla provedena exstirpace uzliny. Nebyl zjištěn zásadní rozdíl v průběhu nemoci u dětí a dospělých.
Klíčová slova:
nemoc z kočičího škrábnutí, uzlinový syndrom, sérologie, exstirpaceÚvod
Nemoc z kočičího škrábnutí (felinóza) je způsobená malou gramnegativní fakultativně aerobní a fakultativně intracelulární bakterií Bartonella henselae (B. henselae), vzácně bakterií Bartonella claridgeae (1–3). Z dosud známých 25 druhů bartonel je 14 patogenních pro člověka. Rezervoárem B. henselae jsou kočky, vzácně psi a hlodavci (4). Přenašečem je blecha kočičí Ctenocephalides felis, vzácně klíště (5). V riziku získání nemoci jsou zejména majitelé koček a veterináři (2). Blecha kočičí saje krev na kočkách, pro infikování blech je nezbytná bakteriémie u kočky, kterou mají zejména koťata a mladé kočky do 1 roku věku, většina z nich nemá známky nemoci (6). B. henselae se v zažívacím traktu blechy množí. Blecha při dalším sání krve na kočce vylučuje trus s bartonelami, které kontaminují srst kočky. Při úpravě srsti si kočka zanese bartonely na drápky a při lízání srsti se jí bartonely dostanou na zuby a do slin (1).
Člověk se nejčastěji nakazí po poškrábání nebo pokousání kočkou, ale B. henselae může také proniknout z trusu blechy kočičí přes porušený kožní kryt i bez poranění kočkou (7). B. henselae zůstává životaschopná v trusu blechy minimálně 15 dnů, proto pro infikování člověka stačí pobyt v prostředí infikovaných blech kočičích (7). Vzácněji se bartonely přenášejí kousnutím infikovaným klíštětem (5). U imunokompetentních pacientů felinóza většinou probíhá inaparentně nebo jako uzlinový syndrom. V místě vstupu infekce se za 3–10 dnů může objevit 1 nebo více erytémových papul, které se mění přes vezikuly a pustuly v krusty a přetrvávají od 3 týdnů až do několika měsíců (8,9). Za 1–3 týdny po inokulaci patogenu se rozvíjí regionální lymfadenitida, která může přetrvávat 1–4 i více měsíců (8,9,10). Kůže nad uzlinami může být barevně změněná, zarudlá až nafialovělá (8).
Někdy se mohou objevit systémové příznaky jako horečka, únava, nauzea či bolesti hlavy, laboratorně může být zvýšený C-reaktivní protein (CRP) (11). U 5–24 % pacientů může onemocnění probíhat atypicky, může se manifestovat postižením různých orgánů, např. postižením oka, jater, srdce, nervového systému, hnisavým zánětem kostí, přitom periferní uzliny nemusí být zvětšené (12). Vzácné manifestace zahrnují trombocytopenickou purpuru nebo erythema nodosum (13,14). U dětí může onemocnění probíhat jako horečka neznámého původu (15). U imunokompromitovaných pacientů může probíhat jako diseminovaná infekce s patologickou proliferací cév. Pro bacilární angiomatózu je typické postižení kůže a lymfatických uzlin, vzácně vnitřních orgánů, u peliózy bývá postižení jater a sleziny (16).
Metodika
Na nemoc z kočičího škrábnutí bylo pomýšleno u pacientů v rámci diferenciální diagnostiky uzlinového syndromu. U pacientů s krčním uzlinovým syndromem byla felinóza zvažována až po vyloučení infekční mononukleózy a tonzilitidy, které jsou nejčastější příčinou krčního uzlinového syndromu. U většiny pacientů byly vyloučeny další infekční příčiny uzlinového syndromu, a to zejména toxoplazmóza a tularémie.
Byla sledována lokalizace a velikost uzlin palpačně a ultrasonograficky, přítomnost dalších klinických projevů, např. teplot, kožních změn v místě poranění, změny barvy kůže nad uzlinami.
Dále se zjišťoval věk pacientů a jejich pohlaví, kontakt s kočkou a poranění kočkou a také odbornost lékaře, který odeslal pacienta na kliniku. Sérologicky byly vyšetřovány protilátky proti B. henselae třídy IgG a IgM metodou nepřímé imunofluorescence. Pro vyšetření byl použit test Bartonella IFA IgG a IgM firmy FOCUS Diagnostics. Vyšetření byla prováděna ve Zdravotním ústavu v Ostravě. Za pozitivní výsledek pro diagnózu uzlinového syndromu při felinóze byla považována jakákoliv pozitivita IgM protilátek (1 : 20 a vyšší) nebo titr IgG minimálně 1 : 256. Při hodnotě IgG 1 : 64 nebo 1 : 128 byla pro diagnózu felinózy nezbytná současná pozitivita IgM protilátek.
Pokud byla provedena exstirpace uzliny, hodnotilo se, zda byla provedena z diagnostického, nebo terapeutického důvodu. Diagnózu felinózy podporoval nález granulomatózního, granulomatózně-nekrotického nebo granulomatózně-abscedujícího zánětu. Při zjištění granulomatózního zánětu v rámci diferenciální diagnostiky byla vyloučena mykobakteriální, jiná bakteriální a mykotická infekce barvením podle Ziehla a Neelsena, Grama a Groccota.
Histopatologickým vyšetřením se vylučovalo hematologické maligní onemocnění s granulomatózní reakcí. K histologickému průkazu bartonely byla použita dvakrát metoda imunohistochemického vyšetření speciální protilátkou a jednou metoda impregnace stříbrem podle Warthina a Starryho.
Diagnóza nemoci z kočičího škrábnutí byla poté prokázána sérologicky. Dále byla sledována výše titru protilátek, délka jejich přetrvávání, délka přetrvávání uzlinového syndromu, výběr antibiotika, trvání antibiotické léčby a výsledek léčby.
Výsledky
V letech 2008–2017 bylo na Klinice infekčního lékařství LF OU a FN Ostrava ošetřeno 73 pacientů s nemocí z kočičího škrábnutí, soubor zahrnoval 37 dětí a 36 dospělých pacientů. Pacienti byli ve věku 1–74 let, jejich průměrný věk byl 24 let, medián věku pak 18 let. Onemocnění se vyskytlo častěji u mužů (41) než u žen (32). Počet pacientů s felinózou v jednotlivých letech sledovaného období postupně narůstal, od 2–3 pacientů ročně v prvních letech sledování do 24 pacientů v roce 2017. Onemocnění se vyskytovalo častěji na podzim a v zimě, nejvyšší výskyt byl pravidelně od října do ledna následujícího roku. Kontakt s kočkou uvedlo 66 pacientů, 34 dětí a 32 dospělých pacientů. Poškrábání nebo pokousání uvedlo jen 22 pacientů, z toho 13 dětí a 9 dospělých, ale u 7 pacientů tento údaj nebyl zjištěn. Ostatní pacienti si nebyli vědomi poranění kočkou, přesto 11 pacientů uvádělo poranění na prstě ruky, jedno dítě s krční lymfadenitidou mělo poškrábání na bradě a další dítě za uchem, což mohlo být vstupní branou infekce. U jednoho pacienta předcházelo rozvoji krční lymfadenitidy přisátí klíštěte ve kštici, ale tento pacient byl také v kontaktu s kočkou a ranka po přisátí klíštěte mohla být vstupní branou infekce. Rodinný výskyt byl zaznamenán 4×, u 53leté ženy, její matky a přítele, u matky a její šestileté dcery, otce a 14letého syna a u 2 sourozenců ve věku 4 a 12 let. Praktičtí lékaři k nám odeslali 41 pacientů, hematologové 18, otorinolaryngologové 7, chirurgové 5 a stomatochirurg 1 pacienta, pouze 1 pacient byl vyšetřen poprvé až lékařem na naší klinice. Ambulantně bylo ošetřeno 46 pacientů, onemocnění si vyžádalo hospitalizaci u 27 pacientů (19 dětí a 8 dospělých) z důvodu diagnostiky či terapie uzlinového syndromu, z toho u 19 pacientů (26 %) byla provedena exstirpace uzliny.
Postižení jen krčních uzlin bylo zjištěno u 32 pacientů (44 %), z toho u 17 dětí a 15 dospělých, axilárních u 24 pacientů (33 %), z toho u 11 dětí a 13 dospělých, postižení tříselných uzlin u 9 pacientů (12 %), z toho u 5 dětí a 4 dospělých, a u jedné pacientky atypicky nad levou lopatkou po poškrábání kočkou na zádech. U zbylých 7 pacientů (9 %) byly postiženy uzliny ve více oblastech. V rámci postižení krčních uzlin byly postiženy uzliny intraparotické u 4 pacientů, supraklavikulární u 6 pacientů a submentální u jedné pacientky. Uzliny na obou stranách krku byly zvětšeny u 13 z 32 pacientů. Postižení axilárních uzlin bylo vždy jednostranné, přičemž současné postižení i nadloketní uzliny bylo u 10 z 24 pacientů (obr. 1). Postižení tříselných uzlin bylo šestkrát jednostranné, u dvou pacientů byly současně postiženy i uzliny pod tříslem. Postižení uzlin ve více oblastech bylo zjištěno u 7 pacientů, z toho u 4 dětí a 3 dospělých. U 1 dítěte byly postiženy krční uzliny oboustranně a axilární na jedné straně, u 2 dětí byly postiženy krční bilaterálně, supraklavikulární, subklavikulární a axilární na jedné straně a u 12leté dívky byly hmatné uzliny v pravém hypogastriu a současně na pravém stehně. U 2 dospělých pacientů byly zvětšeny krční a tříselné uzliny oboustranně, u třetího dospělého pacienta uzliny krční oboustranně, uzliny axilární a uzlina nad loktem na jedné straně.
Obr. 1. Výrazně zvětšená axilární uzlina vlevo u 71letého pacienta 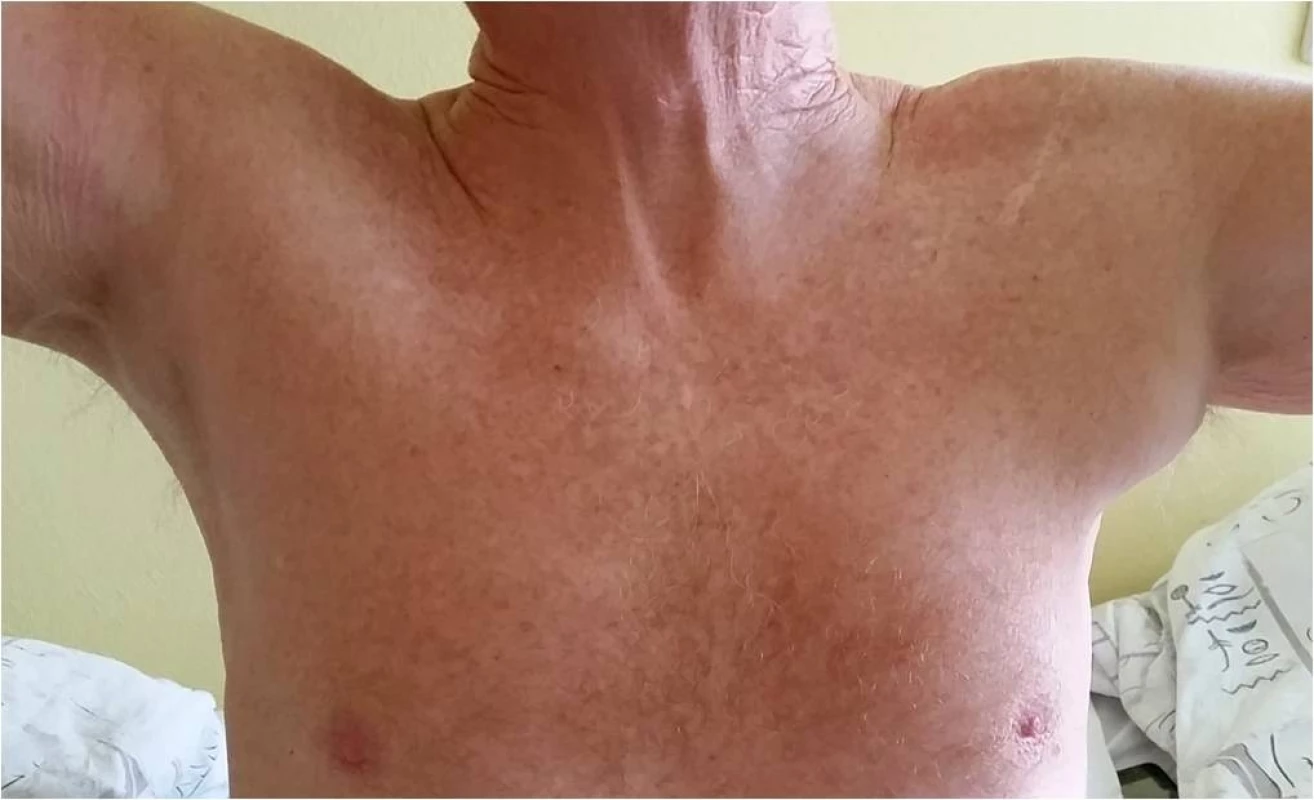
Ultrasonografické vyšetření uzlin bylo provedeno u všech pacientů. Největší uzlina velikosti 52 × 36 × 27 mm byla nalezena u 47letého pacienta s axilární lymfadenitidou. Největší paket uzlin byl zjištěn u 13letého chlapce, u kterého byly popsány sonograficky splývavé multilokulární patologické hmoty rozsahu 90 × 40 × 30 mm v levé axile. U 12leté dívky byla hmatná rezistence v pravém hypogastriu v rozsahu 60 × 30 mm, u které byly ultrasonograficky zaznamenány četné uzliny do 33 × 25 mm, částečně nekrotické s okolním prosáknutím tuku. Někdy měly uzliny laločnatý vzhled nebo byly lymfatické uzliny popisovány jako bizarní. Kolem uzlin v pravém třísle u jednoho pacienta bylo sonograficky popsáno prosáknutí okolních měkkých tkání do šířky 30 mm.
Hodnocena byla i doba přetrvávání uzlinového syndromu. Regrese uzlin byla patrna dříve při palpačním vyšetření pro odeznívání otoku kolem uzliny, regrese uzlin ultrasonograficky byla pomalejší. Uzliny u 43 pacientů výrazně regredovaly během 4 měsíců. U dalších 6 pacientů došlo k výrazné regresi uzlinového syndromu do 8 měsíců, u 1 pacienta do 12 měsíců. U dalšího 15letého chlapce s přetrvávající tříselnou uzlinou 20 × 20 mm po roce sledování byla provedena exstirpace uzliny k vyloučení malignity. U 54letého pacienta přetrvával pomalu odeznívající pravostranný tříselný uzlinový syndrom 24 měsíců. U 61leté pacientky s abscedující axilární lymfadenitidou velikosti 48 × 31 mm došlo před plánovanou exstirpací uzliny k její spontánní perforaci. U 12letého děvčete s uzlinami v pravém hypogastriu ještě nebylo sledování ukončeno. U této pacientky nebyla exstirpace uzliny možná k histologickému vyšetření pro blízkost velkých cév, uzliny nekrotizovaly a postupně regredují. Diagnóza felinózy byla stanovena sérologicky. U 19 pacientů byla provedena exstirpace uzliny, a to u 8 dětí a 11 dospělých pacientů, z diagnostického důvodu u 16 pacientů (8 dětí a 8 dospělých) a z terapeutického důvodu u 3 dospělých pacientů pro abscedující lymfadenitidu. U exstirpovaných uzlin byl zjištěn granulomatózní zánět u 3 pacientů, granulomatózně-abscedující zánět u 5 pacientů, granulomatózně-nekrotický zánět u 4 pacientů, granulomatózně-nekroticko-abscedující zánět u 3 pacientů, u 3 dospělých pacientů se jednalo o zcela zabscedovanou uzlinu. U 13letého chlapce se jednalo o Hodgkinův lymfom.
Z kožních projevů byly vezikulopustulózní morfy v místě poškrábání kočkou zaznamenány jen u jedné dospělé pacientky a makulózní morfy v místě poškrábání na předloktí u další dospělé pacientky (obr. 2). Jedenáct pacientů mělo nehojící se poranění na prstě ruky, 1 dítě morf za uchem a 1 dítě na bradě. Tyto morfy přetrvávaly maximálně 8 týdnů. Zarudlá až nafialovělá kůže nad zvětšenou uzlinou byla zaznamenána u 9 pacientů (12 %), z toho u 2 dětí a 7 dospělých, erythema nodosum bylo zjištěno u jedné dospělé pacientky. U dvou dětí a jednoho dospělého pacienta byla diagnostikována splenomegalie, ale sonografické vyšetření břicha bylo provedeno jen u 33 pacientů.
Obr. 2. Makulózní morfy na předloktí po poškrábání kočkou 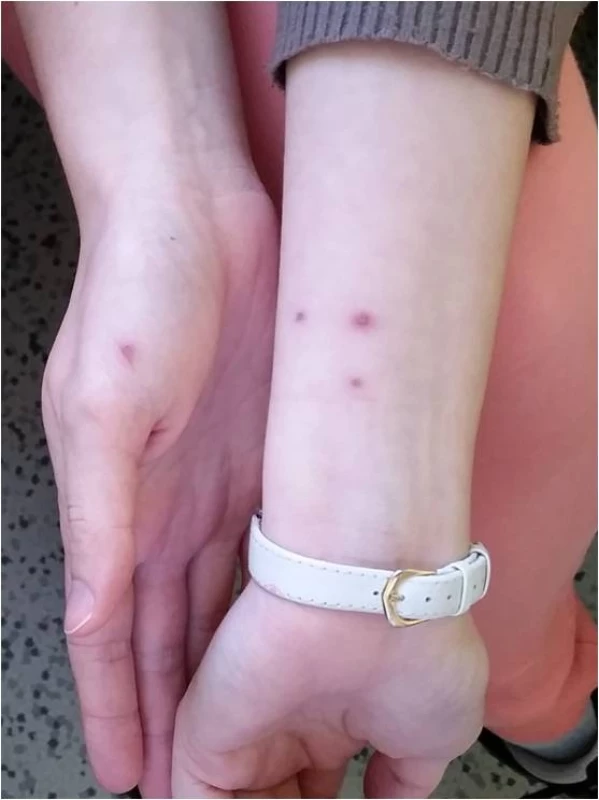
Teploty byly naměřeny u 30 pacientů (41 %), z toho u 18 dětí a 12 dospělých pacientů, horečku nad 38 °C z nich mělo 18 pacientů. U 18 pacientů trvaly teploty 1–5 dnů, u 12 pacientů 1–3 týdny. CRP byl zvýšen u 14 dětí (11–89 mg/l) a 5 dospělých (23–88 mg/l), leukocyty byly zvýšeny pouze u 1 dítěte (19 × 109/l). ALT bylo zvýšeno u 1 dítěte a 2 dospělých pacientů (1,22–2,5 µkat/l). Bolesti hlavy udávali 2 dospělí pacienti, únavu 1 dítě.
Felinóza byla prokázána sérologicky u všech 73 pacientů. Protilátky třídy IgM byly pozitivní u 47 pacientů (64 %), a to u 25 dětí a 22 dospělých (graf 1). Nejvyšší hodnota IgM protilátek byla 1 : 320 a pozitivita IgM protilátek přetrvávala 1 měsíc. Jen u jednoho pacienta přetrvávala pozitivita IgM protilátek 3 měsíce, přitom jejich nejvyšší hodnota byla 1 : 80. U dětí byla hladina protilátek IgG v rozmezí 1 : 64–1 : 4096. Sedm dětí s nízkou hladinou protilátek IgG 1 : 64 a 1 : 128 mělo pozitivitu IgM protilátek. U dospělých pacientů byla hladina protilátek třídy IgG v rozmezí 1 : 256–1 : 8192 (graf 2).
Graf 1. Protilátky třídy IgM proti Bartonella henselae 
Graf 2. Protilátky třídy IgG proti Bartonella henselae 
Sledována byla také délka přetrvávání IgG protilátek. Pokles protilátek třídy IgG na hodnotu 1 : 64 až 1 : 128 byl zaznamenán u 19 pacientů (26 %) do 4 měsíců, u 12 pacientů (16 %) do 8 měsíců, u 7 pacientů (10 %) do 12 měsíců, u 2 pacientů (3 %) do 36 měsíců. U zbývajících 33 pacientů (45 %) s vyšším titrem skončilo sledování dříve, např. pro odeznělý uzlinový syndrom, nebo se pacienti ke kontrole již nedostavili a u 24 pacientů s diagnostikovanou felinózou v roce 2017 nebylo sledování ještě ukončeno. U 2 pacientů došlo k vzestupu protilátek třídy IgG i po exstirpaci uzlin pro abscedující lymfadenitidu. Za zmínku stojí 54letý pacient s pozitivní hodnotou IgM protilátek 1 : 320 a hodnotou IgG protilátek 1 : 2048 s následným vzestupem na 1 : 8192, titr 1 : 1024 přetrvával ještě po 15 měsících a hraniční hodnota IgG po 36 měsících. Tento pacient měl paket uzlin v oblasti pravého třísla na ploše 50 × 100 mm tvořen uzlinami do 25 × 10 mm se zarudlou kůží nad dvěma z nich. Uzliny postupně regredovaly při sonografickém vyšetření na velikost 23 mm s tukovou degenerací hilu za 2 roky.
Antibiotika byla nasazena empiricky u 53 pacientů (25 dětí a 28 dospělých). Empiricky byly použity 31× makrolidy, 5× doxycyklin, 3× klindamycin, 11× cefuroxim, 11× koamoxicilin, 3× penicilin, 3× chinolony. U 12 pacientů byla použita 2–4 antibiotika v různých kombinacích z výše uvedených antibiotik. Až po stanovení diagnózy bylo léčeno 16 pacientů makrolidy či doxycyklinem. Makrolidy i doxycyklin byly podávány 2–3 týdny. Neléčeni byli 2 děti a 2 dospělí pacienti pro regredující uzlinový syndrom. Průměrná délka antibiotické léčby byla 20 dnů u dětí a 24 dnů u dospělých (2–8 týdnů). Antibiotická léčba nezabránila rozvoji abscedující lymfadenitidy s nutností exstirpace u 5 pacientů. Jen u jediného 13letého pacienta přes částečnou kolikvaci axilární uzliny došlo během antibiotické terapie k regresi nálezu, chlapec byl léčen zpočátku koamoxicilinem, po stanovení diagnózy 2 týdny doxycyklinem a následně 3 týdny klarithromycinem.
Tab. 1. Přetrvávání uzlinového syndromu (nejsou zahrnuti pacienti po exstirpaci uzliny) a doba, za kterou došlo k poklesu protilátek třídy IgG proti B. henselae na nejnižší pozitivní hodnotu 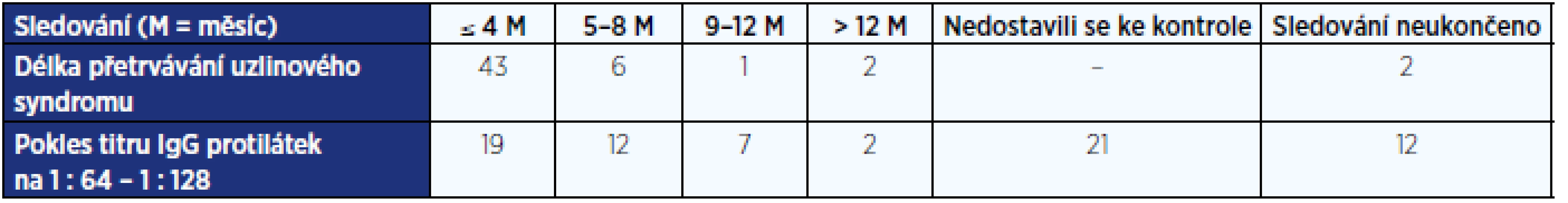
Tab. 2. Další klinické projevy a patologické hodnoty laboratorních vyšetření u pacientů s nemocí z kočičího škrábnutí 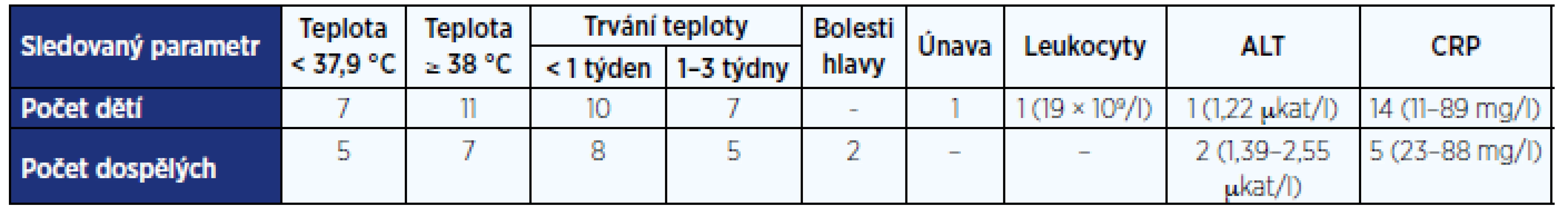
Diskuse
Nemoc z kočičího škrábnutí se vyskytuje častěji v teplých a vlhkých oblastech světa (9). V USA je felinóza jednou z nejčastějších zoonóz, roční incidence se uvádí 3,7–9,3/100 000 obyvatel (3,17). Nelson poukazuje, že každoročně je 12 tisíc pacientů ošetřeno ambulantně a 500 pacientů vyžaduje hospitalizaci (3). Tento počet může být podhodnocen, protože onemocnění nepodléhá povinnému hlášení (18). V České republice felinóza také není povinně hlášena do systému Epidat. V USA se více než polovina případů objeví od září do ledna, což je v souladu s naším zjištěním (17). Narůstající počet pacientů s felinózou v našem souboru svědčí spíše o tom, že se na onemocnění myslí častěji než v minulosti. Dříve se uvádělo, že se onemocnění vyskytuje převážně u dětí, ale podle novějších údajů se felinóza vyskytuje častěji u dospělých (19). Tento údaj podporovalo i naše sledování, ale v roce 2017 byla výrazná převaha dětských pacientů s felinózou, takže se počet dětí s felinózou prakticky vyrovnal počtu onemocnění u dospělých. Medián věku 18 let svědčí také pro to, že onemocní častěji mladší lidé, pravděpodobně pro bližší kontakt s kočkami.
Oray et al. uvádějí, že přes 90 % pacientů má kontakt s kočkou, z toho 50–87 % je kočkou poraněno (20, 21). V našem souboru uvádělo kontakt s kočkou 66 pacientů (90 %), což odpovídá literárním údajům, ale poranění kočkou bylo jen u 22 pacientů (30 %). Onemocnění se projevuje změnami na kůži v místě pokousání nebo poškrábání kočkou, např. Uluğ ho uvádí u 16,6 % (22). Tento kožní projev jsme zaznamenali jen u dvou pacientů, ale dalších 11 pacientů mělo nehojící se ranku na prstě ruky, jedno dítě na bradě a jedno dítě za uchem. V typickém případě se rozvíjí regionální lymfadenitida během 1–3 týdnů a přetrvává několik týdnů až měsíců (9,16). Asymetrická lymfadenopatie se nejčastěji objeví v axile (46 %), pak na krku (26 %) a v tříslech (18 %) (9). V našem souboru byly nejčastěji zvětšené krční uzliny, pak axilární a tříselné uzliny. Zahraniční autoři uvádí, že jen jedna uzlina bývá postižena téměř u poloviny pacientů, u dalších 20 % pacientů bývá postiženo více uzlin v jedné regionální oblasti, u zbývajících 30 % pacientů bývají postiženy uzliny v několika regionech (11,13). V našem souboru převažovalo postižení více uzlin v jedné regionální oblasti. Slater a Welch uvádějí, že uzliny bývají postiženy jednostranně, což potvrzují i naše výsledky, i když oboustranné postižení krčních uzlin bylo u 13 z 32 pacientů. King uvádí, že uzlinový syndrom odezní za několik týdnů až měsíců, vzácně může perzistovat až 2 roky (9). U většiny našich pacientů došlo k výrazné regresi během 4 měsíců, u dalších pacientů do jednoho roku, jen u jednoho pacienta došlo k pomalé regresi během 2 let. Pro zjištění velikosti a charakteru uzlin se nejčastěji používá sonografické vyšetření. Uzliny jsou většinou četnější, hypoechogenní a značně vaskularizované se zvýšenou echogenitou okolní měkké tkáně (9). Protože nejdříve odeznívá otok měkkých tkání kolem uzliny, je regrese uzlinového syndromu nejdříve patrna palpačně a se zpožděním i sonograficky. Barevné změny kůže nad uzlinou ve smyslu zarudnutí nebo nafialovělé barvy byly pozorovány jen u 9 z 73 našich pacientů (12 %), z toho jen 2 z 37 dětí. Přitom Lindeboom uvádí, že až 92 % z 53 dětí mělo nad uzlinou změněnou barvu kůže (11). Slater a Welch uvádějí, že přibližně u šestiny pacientů dochází k supuraci v uzlině, v našem souboru se jednalo o 9 pacientů (12 %), což je méně, než uvádí zahraniční autoři (16).
K typickému průběhu felinózy patří i lehké systémové příznaky, horečka se vyskytuje u 30–60 % pacientů, únava a nauzea u 25 % a bolesti hlavy u 10 % pacientů (16). V našem souboru mělo teploty 30 pacientů (41 %), což je ve shodě s literárními údaji, ale bolesti hlavy byly jen u 2 pacientů (3 %).
Diagnostika nemoci z kočičího škrábnutí je založena na sérologickém vyšetření se stanovením IgG a IgM protilátek proti B. henselae metodou nepřímé imunofluorescence (IF) nebo enzymovou imunoanalýzou (ELISA). V naší laboratoři bylo použito vyšetření metodou IF. Pozitivita IgM protilátek svědčí pro akutní onemocnění, ale IgM protilátky přetrvávají krátkou dobu, takže u 50 % pacientů nebývají zachyceny (23). V našem souboru byla pozitivita IgM protilátek zachycena u 47 pacientů (64 %), což je více, než odpovídá literárním údajům. Gradidge et al. uvádějí, že IgG protilátky přetrvávají většinou 22–28 týdnů, jen u 25 % pacientů přetrvávají přes rok (23). V našem souboru byli pacienti sledováni do poklesu titru IgG protilátek na 1 : 64 až 1 : 128. Tento titr přetrvával přes rok jen u 2 našich pacientů, z toho u jednoho pacienta 3 roky, ale u jednoho pacienta protilátky IgG vymizely po 9 měsících. Právě dlouhodobé přetrvávání protilátek třídy IgG proti B. henselae limituje klinickou hodnotu tohoto testu. U několika našich pacientů jsme také zaznamenali opožděnou tvorbu protilátek třídy IgG z hraniční hodnoty na pozitivní hodnoty až během léčby antibiotiky nebo po provedené exstirpaci uzliny, přitom pozitivitu IgM protilátek jsme u nich nezachytili (24). Další možnosti diagnostiky felinózy jsou omezené. Vyšetření PCR v plné krvi není většinou přínosné, protože bakteriémie je krátkodobá (25). Kultivace pomalu rostoucí B. henselae a její izolace je málo úspěšná (9).
Pokud výsledky sérologie nejsou pro felinózu jednoznačné (nízký titr IgG a negativita IgM protilátek proti B. henselae) a je vyloučena jiná infekční etiologie lymfadenitidy, je vhodné přistoupit k exstirpaci uzliny a histologickému vyšetření. K diagnostice bartonel v histologickém preparátu se používá barvení stříbrem podle Steinera nebo Warthina a Starryho s nízkou specificitou a senzitivitou nebo imunohistochemické vyšetření, jehož senzitivita je také nízká (25–39 %) (26). V našem souboru byl histologický nález granulomatózního, granulomatózně-nekrotického, granulomatózně-nekroticko-abscedujícího či granulomatózně-abscedujícího zánětu u 15 pacientů. Jen u dvou z nich bylo použito imunohistochemické vyšetření s negativním nálezem a u jednoho pacienta barvení podle Warthina a Starryho s pozitivním nálezem tyčinkovitých bakterií zvyšujících podezření na felinózu. U všech pacientů byla diagnóza felinózy potvrzena sérologicky.
Jabcuga et al. uvádějí, že typický mikroskopický nález nekrotizujícího gramulomatózního zánětu s hvězdicovitými mikroabscesy bývá pozorován jen u 57 % pacientů. Proto se jeví došetření histologického preparátu metodou PCR se specificitou téměř 100 % a senzitivitou 43–76 % jako přínosnější. Sendi et al. uvádějí, že u pacientky s transverzální myelitidou stanovili diagnózu felinózy až pomocí PCR z punktovaného materiálu z defektu na prstě po poškrábání kočkou (27). Tato kožní léze přetrvávala i za 6 týdnů po poranění a k rozvoji neurologické symptomatologie došlo za 4 týdny po vzniku axilární lymfadenopatie (27). Metoda PCR se v ČR provádí jen na některých pracovištích (např. v Bioptické laboratoři s.r.o. v Plzni, v SZÚ v Praze). U 13letého chlapce se sérologicky prokázanou felinózou byla pro neustupující krční uzlinový syndrom vlevo provedena exstirpace uzliny s histologickým průkazem Hodgkinova lymfomu.
V literatuře se uvádí, že nemoc z kočičího škrábnutí spontánně odezní i bez antibiotické léčby, přesto většina autorů vzhledem k výraznému uzlinovému syndromu antibiotickou léčbu indikuje. Například Americká pediatrická společnost doporučuje pětidenní léčbu azithromycinem (28). Citlivost bartonel in vitro je rozdílná od citlivosti in vivo (16). In vitro je B. henselae citlivá na řadu antibiotik, např. makrolidy, aminoglykosidy, tetracykliny, fluorochinolony, beta-laktamová antibiotika, kotrimoxazol, rifampicin (16). Většina antibiotik má však na B. henselae pouze bakteriostatický účinek, jen aminoglykosidy mají baktericidní účinek. Rovněž však nebylo prokázáno, že by antibiotická léčba zabránila kolikvaci a rozvoji abscesu v uzlině, což jsme pozorovali u našich dvou dětských a tří dospělých pacientů (23,24). Přes sporný efekt antibiotické léčby uzlinový syndrom odezní za dva až čtyři i více měsíců (23). V našem souboru odezněl uzlinový syndrom do 4 měsíců u většiny pacientů, ale např. u našeho patnáctiletého pacienta byla provedena exstirpace uzliny pro rok trvající uzlinový syndrom v pravém třísle k vyloučení nádorového postižení uzliny.
Při srovnání skupiny dětí a dospělých, kteří tvořili početně prakticky stejné skupiny, nebyl zaznamenán rozdíl v údaji o kontaktu s kočkou a lokalizaci postižených uzlin. Rozdíly jsme nezaznamenali ani ve výši titrů protilátek proti B. henselae ani v léčbě, u obou skupin byla léčba nasazena již empiricky a léčeni byli téměř všichni pacienti. Děti však měly častěji horečku, vyšší hodnotu CRP a byli častěji hospitalizovány k diagnostice uzlinového syndromu. U dětí byla také častěji provedena exstirpace uzliny z diagnostického důvodu, u dospělých z terapeutického důvodu. Atypický průběh byl zaznamenán jen u jedné dospělé pacientky s erythema nodosum a u jednoho dítěte atypická lokalizace výrazně zvětšených hmatných uzlin v pravém hypogastriu.
Vzhledem k relativní nezávažnosti felinózy nemusí imunokompetentní osoby omezit kontakt s kočkou. Imunokompromitovaní pacienti by se však měli vyhýbat kontaktu s kočkami, zejména s koťaty, která se pohybují venku. Pokud vlastní kočku, je nutné dbát o její pravidelnou dezinsekci (7). Po kontaktu s kočkou, nebo v případě poranění kočkou se doporučuje omýt ruce vodou k odstranění potenciálně infekčního blešího trusu, který by mohl proniknout přes drobnou ranku v kůži (29).
Závěr
Na nemoc z kočičího škrábnutí je nutno pomýšlet u pacientů s akutní či subakutní lymfadenitidou, zejména na krku, v axilách a tříslech. Podezření podporuje údaj o kontaktu, případně o poranění kočkou. Diagnostika spočívá v sérologickém vyšetření protilátek třídy IgG a IgM proti B. henselae, např. metodou nepřímé imunofluorescence. Ultrasonografické vyšetření umožnuje sledovat velikost a regresi uzlinového syndromu a odhalit kolikvaci uzliny. V případě nejasné etiologie je vhodná exstirpace uzliny s histologickým vyšetřením, granulomatózní zánět podporuje diagnózu felinózy. Felinóza u pacientů bez imunodeficitu může spontánně odeznít, přesto se většinou doporučuje léčba makrolidy nebo doxycyklinem. Průběh onemocnění u dětí a dospělých je podobný téměř ve všech sledovaných parametrech.
Seznam použitých zkratek
ALT - alaninaminotransferáza
ELISA - enzymová imunoanalýza
IF - nepřímá imunofluorescence
PCR - polymerázová řetězová reakce
Adresa pro korespondenci:
MUDr. Lubomíra Hozáková
Ústav epidemiologie a ochrany veřejného zdraví,
Klinika infekčního lékařství LF OU a FN Ostrava
17. listopadu 1790, 708 52 Ostrava
Tel.: 603 162 320
e-mail: lubomira.hozakova@fno.cz
Zdroje
1. Pennisi MG, Marsilio F, Hartmann K et al. Bartonella species infection in cats. ABCD guidelines on prevention and management. J Feline Med Surg 2013; 15(7): 563–569.
2. Oteo JA, Maggi R et al. Prevalence of Bartonella spp. By culture, PCR and serology, in veterinary personnel from Spain. Parasit Vectors 2017; 10(1): 553.
3. Nelson CA, Moore AR et al. Cat scratch disease: U. S. clinicians’ experience and knowledge. Zoonoses Public Health 2018; 65(1): 67–73.
4. Melter O. Novinky v problematice bartonelových infekcí. Klinická mikrobiologie a infekční lékařství 2013; 9 (2): 36–44.
5. Herčík K, Hásová V, Janeček J et al. Molecular evidence of Bartonella DNA in ixodid ticks in Czechia. Folia Microbiol 2007; 52 (5): 503–509.
6. Bergmann M, Englert T et al. Prevalence of Bartonella species infections in cats in Southern Germany. Vet Rec 2017; 180 (13): 325.
7. Day MJ. Pet-related infections. Am Fam Physician 2016; 94 (10): 794–802.
8. Baranowski K, Huang B. Cat scratch disease. StatPearls, Treasure Island, 2018. Dostupné na: www.ncbi.nlm.nih.gov/books/NBK482139
9. Chen Y, Fu YB, Xu XF et al. Lymphadenitis associated with cat-scratch disease simulating a neoplasm: Imaging findings with histopathological associations. Oncol Lett 2018; 15 (1): 195–204.
10. Illman JE, Terra SB et al. Granulomatous diseases of the breast and axilla: radiological findings with pathological correlation. Insights Imaging 2018; 9 (1): 59–71.
11. Lindeboom JA. Pediatric cervicofacial lymphadenitis caused by Bartonella henselae. Oral Surg Oral Med Oral Patho Oral Radiol 2015; 120 (4): 469–473.
12. Shasha D, Gilon D, Vernea F et al. Visceral Cat Scratch Disease with Endocarditis in an Immunocompetent Adult: A Case Report and Review of the Literature. Vector Borne Zoonotis Dis 2014; 14 (3): 175–181.
13. Melewska KM, Mania A et al. Cat-scratch disease: a wide spectrum of clinical pictures. Postepy Dermatol Alergol 2015; 32 (3): 216–220.
14. Schattner A, Uliel L, Dubin I. The cat did it: erythema nodosum and additional atypical presentations of Bartonella henselae infection in immunocompetent hosts. BMJ Case Rep 2018, pii: bcr-2017-222511.
15. Burzo ML, Antonelli M, Pecorini G. Fever of unknown origin and splenomegaly. Medicine (Baltimore) 2017; 96 (50): e9197.
16. Slater LN, Welch DF. Bartonella, including Cat-Scratch Disease. In: Mandell, Douglas, and Bennett (eds.). Principles and Practice of Infectious diseases (6th ed.). Elsevier, Philadelphia, 2005. 2733–2748.
17. Kwon HY, Im JH Lee SM. The seroprevalence of Bartonella henselae in healthy adults in Korea. Korea J Intern Med 2017; 32 (3): 530–535.
18. High K, Van Meter J. An 8-year-old Boy with altered mental status. Air Med J 2015; 34 (3): 149–151.
19. Zenone T. Systemic Bartonella henselae Infection in Immunocompetent Adult Presenting as Fever of Unknown Origin. Case Rep Med 2011; 2011 : 183937.
20. Oray M, Önal S, Koç Akbay A, Tuğal Tutkun İ. Diverse clinical signs of ocular involvement in cat scratch disease. Turk J Ophtalmo 2017; 47(1): 9–17.
21. Barson WJ, Honegger JR, Texter K. Acute myopericarditis associated with cat scratch disease in an adolescent. Pediatr Infect Dis J 2014; 33(9): 982–984.
22. Ulug M. Evaluation of cat scratch disease reported from Turkey between 1996 and 2013 and review of the literature of the literature. Centr Eur J Public Health 2015; 23(2): 170–175.
23. Gradidge E, Chauhan A, Stelle RW et al. Fever, lymphadenopathy, and splenomegaly: did the cat do it? Clin Pediatr (Phila) 2013; 52 (11): 1072–1074.
24. Hozáková L, Rožnovský L, Franková H. Felinóza – stále aktuální zoonóza. Klinická mikrobiologie a infekční lékařství 2014; 20 (1): 4–10.
25. Kimura A, Hasegawa S, Yanagihara M et al. Cat-scratch disease with severe pleuritis in a 6-year-old girl. Pediatr Int 2015; 57 (3): 501–503.
26. Jabcuga CE, Jin L, Macon WR et al. Broadening the morphologic spectrum of Bartonela henselae lymphadenitis. Analysis of 100 molecularly characterized cases. Am J Surg Pathol 2016; 40 (3): 342–347.
27. Sendi P, Hirzel C, Cloch A. Bartonella-associated transverse myelitis. Emerg Infect Dis 2017; 23(4): 712–713.
28. King KY, Hicks MJ, Mazziotti MV et al. Persistent cat scratch disease requiring surgical excision in a patient with MPGN. Pediatrics 2015; 135 (6): e 1514-7.
29. Nelson CA, Saha S, Mead PS. Cat-scratch disease in the United States, 2005–2013. Emerg Infect Dis 2016; 22 (10): 1841–1846.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Děti a digitální média
- Pohled do historie zdravotní péče o děti v Praze
- Celiakie dětí a dospívajících
- Periodické horečky a jiná autoinflamatorní onemocnění
- Diagnostika a léčba dětí s akutními křečemi na pediatrické jednotce intenzivní péče
- Moderní metody v diagnostice a výzkumu genetických příčin vzácných onemocnění
- Prenatální diagnostika chromosomových aberací v České republice: Aktuální data a významné trendy
- Horizontální přenos genetické informace a jeho význam pro vznik antibiotické rezistence
- Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých
- Elektronické vyvolávací systémy nejsou nezbytným opatřením k ochraně osobních údajů ve zdravotnictví
- Čeští lékaři a manifest 2000 slov
- Georges Jean Franz Köhler (1946–1995)
- Významné životní jubileum prof. MUDr. Zbyňka Hrnčíře, DrSc.
- K životnímu jubileu prof. MUDr. Lidky Lisé, DrSc.
- Prof. MUDr. Jindřich Mourek, DrSc., devadesátiletý
- Cena J. E. Purkyně pro profesora Pavla Pafka
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periodické horečky a jiná autoinflamatorní onemocnění
- Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých
- Celiakie dětí a dospívajících
- Horizontální přenos genetické informace a jeho význam pro vznik antibiotické rezistence
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



