-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyperlipoproteinemie a (nejen) ateroskleróza: střípky z historie i současnosti
Hyperlipoprotienemias and (not only) atherosclerosis: fragments from history and present
The examples from the history, as well as the recent view, clearly demonstrate a great change in the perception of hyperlipoprotienemias and dyslipidemias (HLP and DLP) at the end of 20th and at the beginning of 21st century. Our aim is not a complex overview about HLP and DLP. We just want to describe the changing position and importance of these diseases in clinical medicine. We will touch cardiology, angiology, but also diabetology, hepatology and gastroenterology (pancreas).
HLP and DLP, which started as a research topic in laboratory became clinically interesting as risk factors of atherosclerosis. They are understood as epidemic occurrence diseases, also in connection with metabolic syndrome. However, some of them, e.g. familial chylomicronemia or homozygous familial hypercholesterolemia fulfill criteria of rare diseases.Keywords:
hyperlipoproteinemia, dyslipidemia, atherosclerosis, statins, PCSK9-inhibitors, familial hypercholesterolemia, familial chylomicronemia
Autoři: Richard Češka
Působiště autorů: Centrum preventivní kardiologie, 3. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 303-307
Kategorie: Přehledové články
Souhrn
Příklady z historie i současnosti ukazují, jak se měnil pohled na hyperlipoproteinemie a dyslipidemie (HLP a DLP) ve druhé polovině 20. a na počátku 21. století. Cílem není podat komplexní přehled, naopak, na dílčích problémech dokumentujeme měnící se postavení a význam těchto poruch tukového metabolismu v klinické medicíně. Pozornost je věnována projevům v kardiologii a angiologii (v souvislosti s aterosklerózou), ale i v dalších oborech, jako je diabetologie, hepatologie či gastroenterologie (se zaměřením na pankreas). HLP a DLP se z oblasti výzkumu a biochemických laboratoří dostaly do centra zájmu především jako rizikové faktory aterosklerózy (AT). HLP a DLP jsou vnímány jako onemocnění masového výskytu, např. také ve spojení se složkami metabolického syndromu. Na druhé straně lze najít poruchy tukového metabolismu, jež splňují kritéria vzácných onemocnění – třeba familiární chylomikronemie (FCS) nebo homozygotní familiární hypercholesterolemie.
Klíčová slova:
hyperlipoproteinemie, dyslipidemie, ateroskleróza, statiny, inhibitory PCSK9, familiární hypercholesterolemie, familiární chylomikronemieÚVOD
Není tomu tak dávno, řekněme několik desítek let, kdy byly HLP a DLP doménou klinické biochemie, epidemiologické studie prokazovaly rizikovost cholesterolu z hlediska předčasné manifestace aterosklerózy a kardiovaskulárních onemocnění (KVO) a klinici k této problematice zůstávali zcela chladní. Snad někteří doporučili svým pacientům omezení konzumace vajec, případně másla. Vědecké poznání v tomto směru se opíralo o více než sto let staré experimenty Aničkova, který vyvolával aterosklerózu u králíků cholesterolovým žírem. Málo se ovšem ví, že tento objev byl náhodný, respektive vznikl metodou pokus – omyl. Aničkov se domníval, že aterosklerózu způsobují bílkoviny, jen nevěděl které. A při pokusech s vajíčky (především kvůli bílku) zjistil, že skutečné riziko představuje cholesterol obsažený ve žloutku. U člověka potom popsal souvislost hypercholesterolemie a anginy pectoris Carl Müller ve 30. letech 20. století.
Skutečný zájem o problematiku lipidů v klinické praxi přinesly až první studie, které prokazovaly možnost ovlivnění aterosklerotického procesu hypolipidemickou léčbou (9, 10). Menší studie s pryskyřicemi (kolestipol a cholestyramin) prokázaly regresi aterosklerózy periferní a posléze i koronární. Zlomový byl ovšem rok 1984 a publikace „cholestyraminové studie“, jejíž výsledky plně odpovídají i současným názorům na nezbytnost snižování LDL-c a která ostatně potvrdila i hypotézu „čím níže – tím lépe“ (alespoň pokud jde o hladiny LDL-c) (obr. 1). Pozitivní výsledky však byly zastíněny opravdu velmi špatnou tolerancí pryskyřic (často blížící se nule).
Obr. 1. Výsledky Lipid Research Clinics Coronary Primary Prevention Trial (LRC – CPPT) (29) 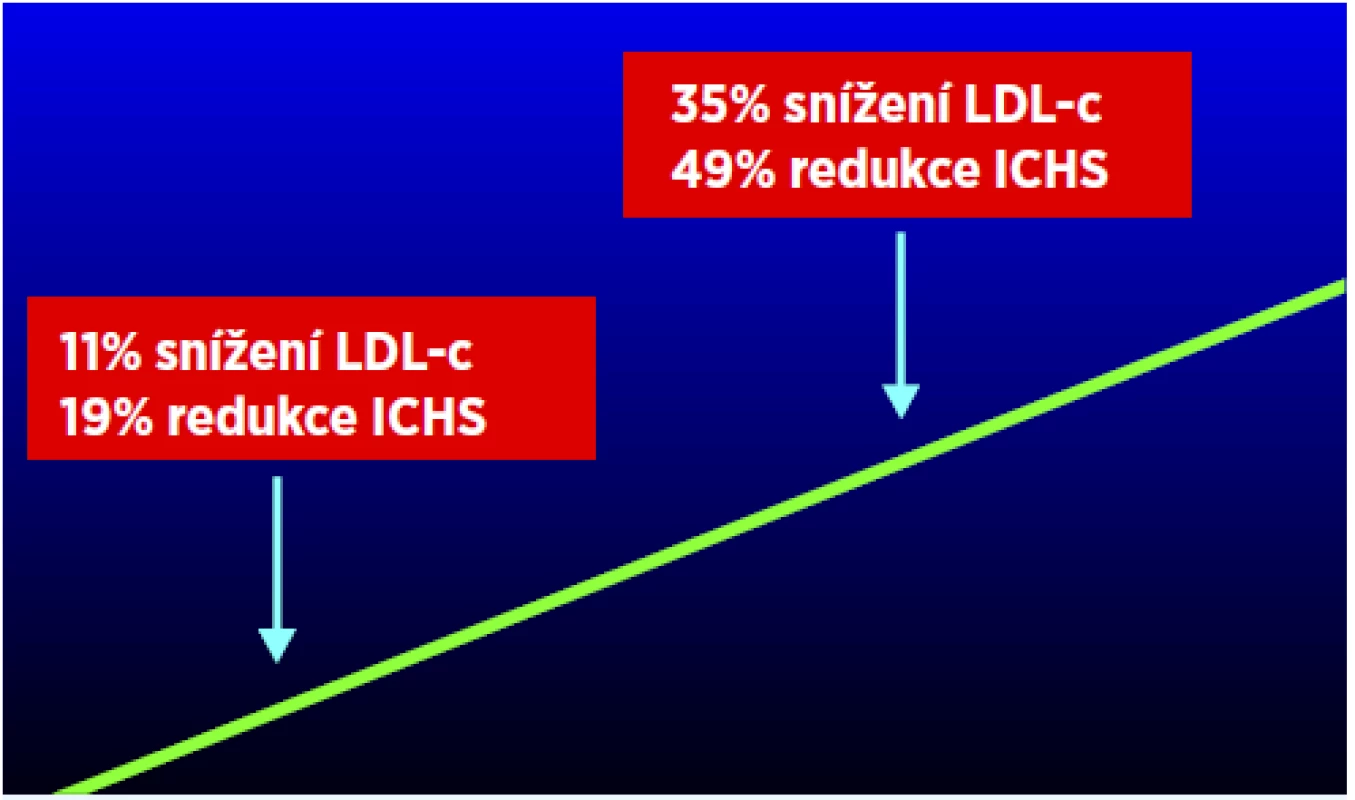
Opravdovým přelomem pak byla o deset let později publikovaná simvastatinová studie 4S (18). Ta prokázala, že statinem lze nejen snížit výskyt KVO, ale i mortalitu na tato onemocnění, a dokonce i mortalitu celkovou (–30 %). Pokles koronární mortality o 42 % dokumentuje obr. 2. Od té doby se statiny staly základním stavebním kamenem léčby HLP a DLP a další léky je v zásadě jen více či méně úspěšně doplňovaly (16, 17).
To, jak komplexně jsou HLP a DLP vsazeny do intermediárního metabolismu, dokumentuje metabolický syndrom spojující inzulinovou rezistenci, diabetes mellitus 2. typu, hypertenzi, DLP, centrální obezitu, ale i nealkoholickou steatohepatitidu (NASH). Význam genetiky v problematice HLP/DLP můžeme dokumentovat třeba na FH, na FCS, ale také na studiu celé řady genů, které se podílejí na polygenních formách HLP a DLP.
Současnost pak patří opravdu dramatickému snižování koncentrace LDL-c a optimalizaci lipidového spektra novými léky – z hlediska mechanismu účinku dominují pokusy o ovlivnění pacientova stavu biologickou léčbou (inhibitory PCSK9) a antisense terapií.
Obr. 2. Pokles koronární mortality ve studii 4S se simvastatinem (18) 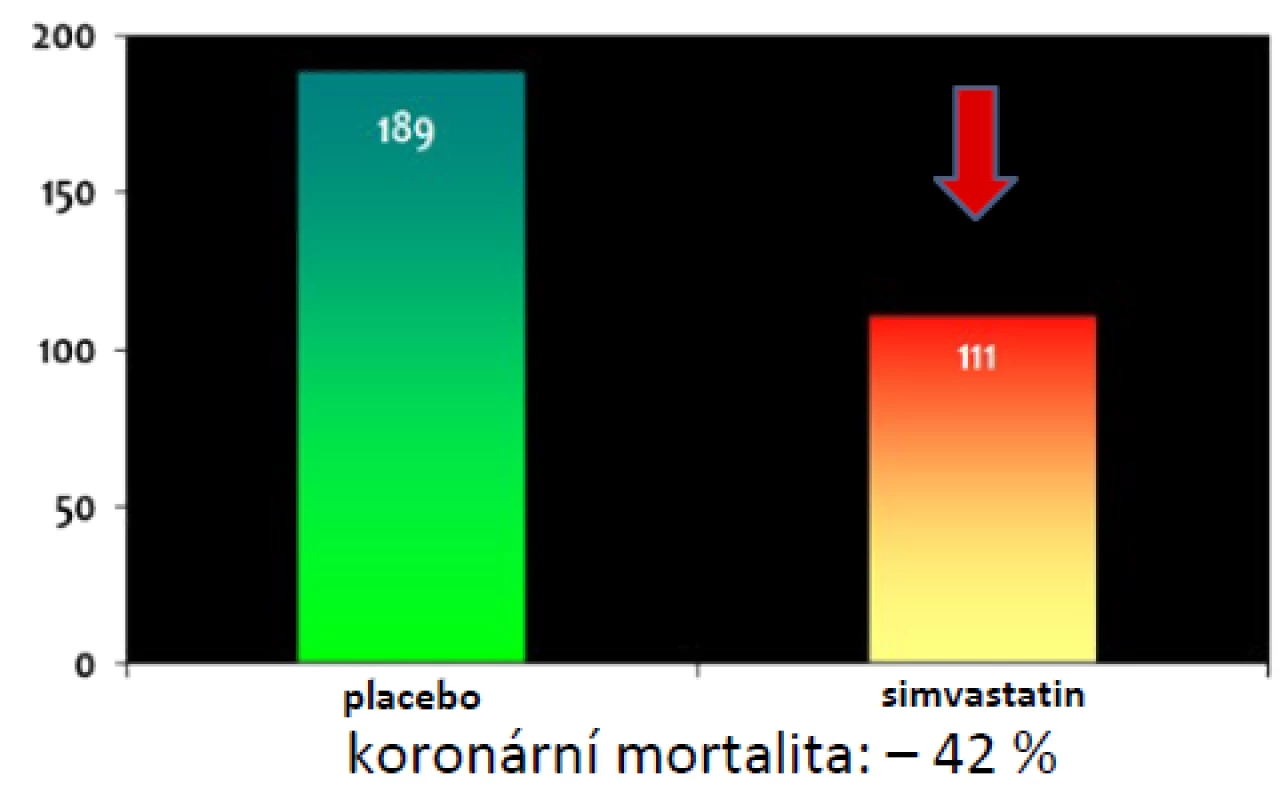
FAMILIÁRNÍ HYPERCHOLESTEROLEMIE
Familiární hypercholesterolemie (FH) je na jedné straně příkladem, který nám poskytla sama příroda ke studiu vztahů lipidového metabolismu, především LDL-c k ateroskleróze a předčasné manifestaci kardiovaskulárních onemocnění. Je však bohužel také – a to především – nejvýznamnějším klinickým syndromem, který vede k rozvoji ischemické choroby srdeční prostřednictvím vrozeně zvýšené koncentrace LDL-c (1, 2).
FH je autosomálně dominantně přenášené onemocnění, jehož příčinou je porucha funkce (snížení počtu) LDL receptorů. Ke klinickému obrazu FH vede i mutace v genu pro apolipoprotein B100, tzv. FDB (familiárně defektní apolipoprotein B100) (3). Nově byla jako příčina FH popsána mutace v genu pro proproteinkonvertázu subtilisin/kexin 9 (PCSK9) (4, 26, 27). FH se vyskytuje raritně jako homozygotní (s frekvencí 1/1 000 000), nebo heterozygotní, která je samozřejmě častější, s frekvencí 1/500; práce z poslední doby uvádějí dokonce hodnoty 1/200 až 1/300.
Typickým laboratorním nálezem při FH je izolované zvýšení koncentrace cholesterolu (CH) v plazmě při normální nebo jen hraničně zvýšené koncentraci TG. Průměrné koncentrace CH činí u dospělých heterozygotů 7–10 mmol/l, výjimkou však není ani nález hodnot 15 mmol/l nebo vyšší! Hladiny CH u homozygotů se obvykle pohybují v rozmezí 15–30 mmol/l.
ICHS se u homozygotů manifestuje v útlém dětství a většina z nich umírá na akutní infarkt myokardu do 20 let. Typické jsou i kožní a především šlachové xantomy již v dětském věku. Pacienti s heterozygotní FH manifestují ICHS ve věku 30–50 let. Šlachová i kožní xantomatóza je relativně vzácná, nicméně je diagnostickým kritériem FH.
Terapie FH je obtížná. Pacienti reagují na dietní opatření poklesem CH pouze o 5 %, nejvýše o 10 %, V léčbě používáme maximální tolerované dávky statinů, často v kombinaci s ezetimibem (13, 14). Pro terapii heterozygotů máme oprávněná očekávání od léčby inhibitory PCSK9 alirocumabem (Praluent) a evolocumabem (Repatha) (5, 6).
Z praktického hlediska je velmi důležité vyhledávání vysoce rizikových nemocných s FH. Existují relativně komplexní diagnostická kritéria pro potvrzení diagnózy FH, ale pro každodenní praxi je snad můžeme zjednodušit a vyslovit podezření na FH u pacientů s LDL-c > 6 mmol/l a celkovým cholesterolem > 8 mmol/l. Vyšetření rodinných příslušníků je pak imperativem.
METABOLICKÝ SYNDROM
Metabolický syndrom (MS) je možno posuzovat z mnoha úhlů pohledu. Je to jistě nesmírně zajímavá mozaika různorodých, nicméně vzájemně se ovlivňujících onemocnění. Zahrnuje inzulinovou rezistenci, diabetes mellitus 2. typu (DM2), HLP/DLP, hypertenzi, centrální obezitu, nealkoholickou steatohepatitidu, hyperurikemii… Také jej lze vnímat jako epidemii postihující vyspělé země (v České republice se týká třetiny dospělé populace). Dnes se trochu více zaměříme na diabetickou neboli aterogenní HLP/DLP.
ATEROGENNÍ DLP
V nedávné době byla značná pozornost věnována problematice tzv. reziduálního rizika. To je z hlediska lipidů a lipoproteinů spojováno především u diabetiků a nemocných s MS s vysokou hladinou triglyceridů, nízkou koncentrací HDL-c a změnou zastoupení LDL subpopulací ve prospěch tzv. malých denzních LDL částic. V tomto kontextu byly zmiňovány zejména pozitivní výsledky subanalýz některých fibrátových studií stejně jako fakt, že fibráty v těchto studiích pozitivně ovlivňovaly rozvoj nejen makro-, ale především mikroangiopatie.
LDL-c není sice u nemocných s DM2 obvykle zvýšen dramaticky, přesto jeho zvýšení představuje významné kardiovaskulární riziko. U nemocných s DM2 a s MS jde – pokud se jedná o LDL-c – o problém nejen kvantity, ale i kvality částic. U aterogenní diabetické DLP se typicky projevuje vysoké zastoupení vysoce aterogenních malých denzních LDL částic. I když je tedy celková koncentrace LDL zvýšená jen mírně, nebo je dokonce normální, aterogenní potenciál LDL je vysoký. Není však v žádném případě sporu o tom, že pro snižování LDL-c platí i u diabetiků LDL princip: „Čím níže, tím lépe.“
Jak budeme léčit DLP u nemocných s DM2 a s MS? Samozřejmě kombinací. Základem je statin, ke kterému přidáme ezetimib či fibrát (7). U těžkých DLP a u nemocných v nejvyšším KV riziku se používá i trojkombinace hypolipidemik (11, 12). Asi je správné na tomto místě uvést, že i nejnovější léky ovlivňující plazmatické lipidy, tedy inhibitory PCSK9, byly s dobrým efektem ověřovány též u diabetiků.
FAMILIÁRNÍ CHYLOMIKRONEMIE
Familiární chylomikronemie (hyperlipoproteinemie typu I) vzniká jako deficit lipoproteinové lipázy nebo deficit apolipoproteinu C2, který je kofaktorem nutným k aktivaci tohoto enzymu. Často užívanou zkratkou pro toto onemocnění je LPLD nebo LLD (z anglického lipoprotein lipase deficiency).
Jedná se o vzácné onemocnění (1/1 000 000), charakterizované hyperchylomikronemií a extrémně vysokými hladinami TG. CH je zvýšen, ale jen mírně, může být i zcela normální. Jen pro orientaci uveďme, že hladiny TG se pohybují mezi 10 a 50 mmol/l (ale mohou být ještě vyšší). Sérum má skutečně bez přehánění mléčný až smetanový vzhled (obr. 3).
Obr. 3. Sérum nemocného s HLP typu I 
V klinickém obrazu dominuje výskyt abdominálních kolik, u vysokého procenta nemocných lze prokázat pankreatitidu, která může být i fatální. Léčba je svízelná, jedinou možností byla po dlouhá léta velmi přísná dieta. Kazuistická sdělení nyní nově uvádějí možnost využití lomitapidu. Ten snižuje syntézu chylomikronů ve střevě a současně i produkci VLDL v játrech. Problémem této účinné léčby je riziko hepatopatie, která se může rozvinout po letech léčby (steatofibróza až cirhóza).
Zcela zásadní změnu v terapii pro léčbu by mohla přinést genová terapie. Několik pacientů již genovou terapii (Glybera) podstoupilo. Výsledky jsou krátkodobě (v řádu měsíců) výborné z hlediska dosažených hladin lipidů a lipoproteinů, posléze mají hodnoty lipidů tendenci ke vzestupu. Pro nemocné je však podstatné, že ani po tomto vzestupu nedochází k recidivám pankreatitid. Genová terapie byla zatím soustředěna do několika center ve světě. (centrum pro střední Evropu bylo akreditováno na našem pracovišti). Bohužel spíše z ekonomických než medicínských důvodů byl další vývoj této terapie v Evropě ukončen.
Novou nadějí pro nemocné s deficitem LPL je volanesorsen. Tento antisense lék snižuje koncentraci apolipoproteinu C3, který zvyšuje triglyceridy. Ve studiích fáze II a III snižoval koncentraci triglyceridů o > 70 % u nemocných s těžkou hypertriglyceridemií, včetně pacientů s familiární chylomikronemií.
V každém případě je třeba vnímat LLD jako onemocnění, které může být pro nemocného fatální. Nechci na tomto místě porovnávat význam infarktu myokardu a akutní pankreatitidu. Je ovšem pravdou, že v současné době je akutní pankreatitida minimálně stejně závažná (možná s ještě horšími následky i mortalitou) jako infarkt myokardu, který je komplikací hypercholesterolemie. Právě proto, že akutní pankreatitida je někdy prvním projevem LLD, je třeba po LLD aktivně pátrat.
SOUČASNÁ LÉČBA
Základem terapie HLP/DLP je vždy nefarmakologická léčba. Ta zahrnuje dietu, další režimová opatření (především zvýšení fyzické aktivity) a také opatření k zanechání kouření.
Základním pilířem farmakoterapie HLP a DLP jsou statiny. Další léky se používají převážně v kombinaci s nimi. Ke snížení LDL-c používáme ezetimib a pryskyřice (19, 24). K léčbě hypertriglyceridemických forem HLP a/nebo u nemocných s DLP charakterizovanou nízkým HDL-c využíváme fibráty v kombinaci se statiny.
NOVINKY V LÉČBĚ A VZÁCNĚ UŽÍVANÁ HYPOLIPIDEMIKA
Po dlouhá léta jsme v oblasti hypolipidemik žili v líných vodách a nezdálo se, že se v této skupině objeví nějaký nový lék. V současné době je tomu úplně jinak. Nové léky si můžeme rozdělit do několika skupin:
Největší perspektivu mají protilátky (nebo inhibitory) PCSK9 (proproteinkonvertázy subtilisin/kexin 9). Ty zabraňují degradaci receptorů LDL, zvyšují jejich počet a v důsledku se zvyšuje vychytávání částic LDL z plasmy (20–23). V současné době se ve většině zemí Evropy užívají evolocumab a alirocumab, u nás dlouho doufáme, že se ke státům jako Slovensko, Německo a další připojí i naše země. Ta má s léčbou prostřednictvím PCSK9-i velké zkušenosti, v klinických studiích byla nasazena s vynikajícími výsledky u značného množství pacientů (odhadem okolo 6 tisíc).
Neschválení této léčby (i když jistě jen pro poměrně úzkou a přesně definovanou skupinu vysoce rizikových nemocných ve specializovaných centrech) v České republice je o to méně pochopitelné, že v současné době jsou již k dispozici výsledky velké dvojitě slepé kontrolované studie s téměř 30 tisíci nemocných (studie FOURIER), která prokázala na to, že snížení LDL-c evolocumabem vede k redukci KV příhod (obr. 4, 5).
Obr. 4. Studie FOURIER s evolocumabem: fatální či nefatální IM a CMP po 12 a po 36 měsících (zdroj: Sabatine MS et al. 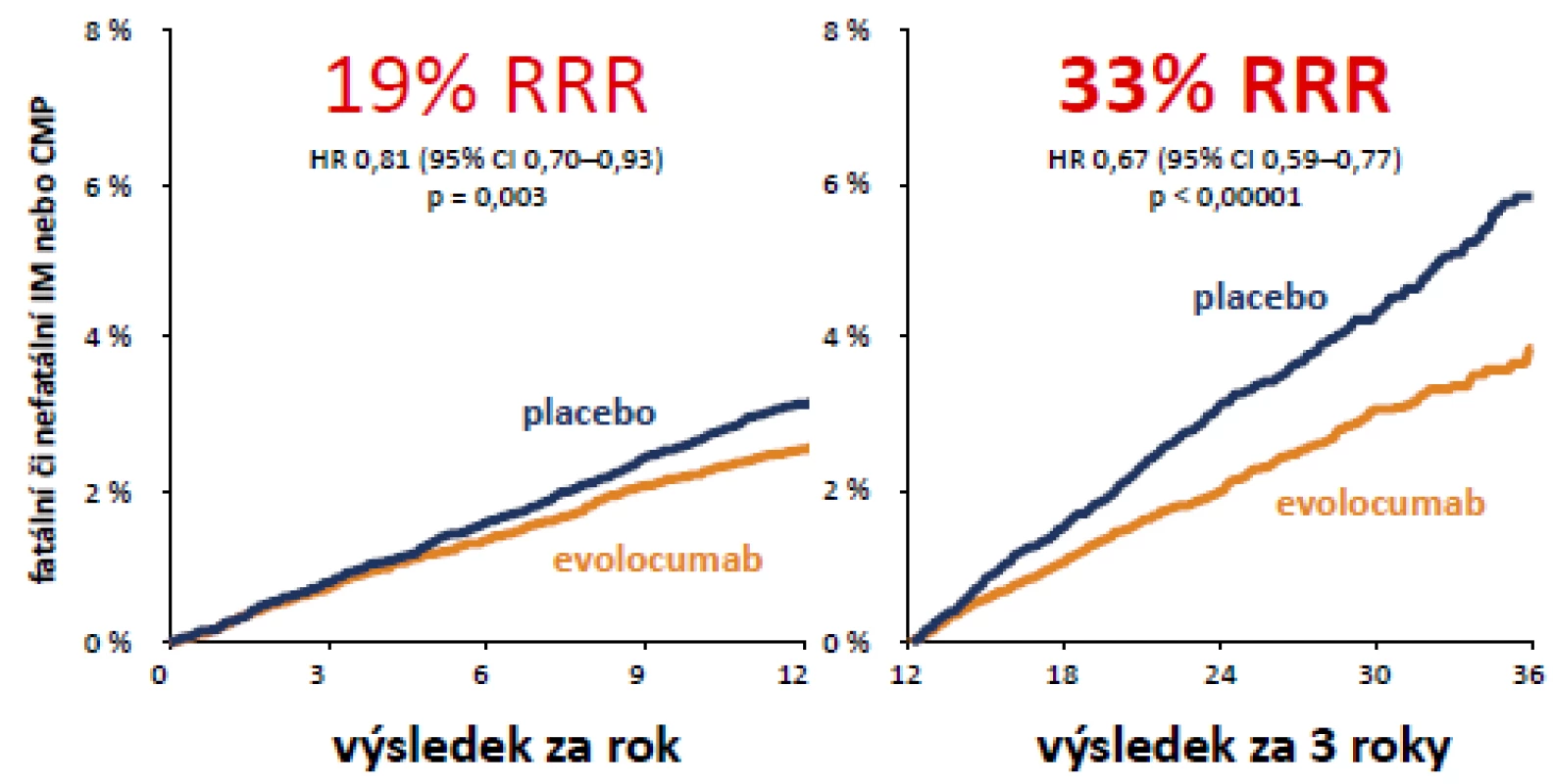
American College of Cardiology – 66th Annual Scientific Session Late-Breaking Clinical Trial. Washington, D.C., 2017) Obr. 5. Studie FOURIER závislost rizika kardiovaskulárních příhod na koncentraci LDL cholesterolu 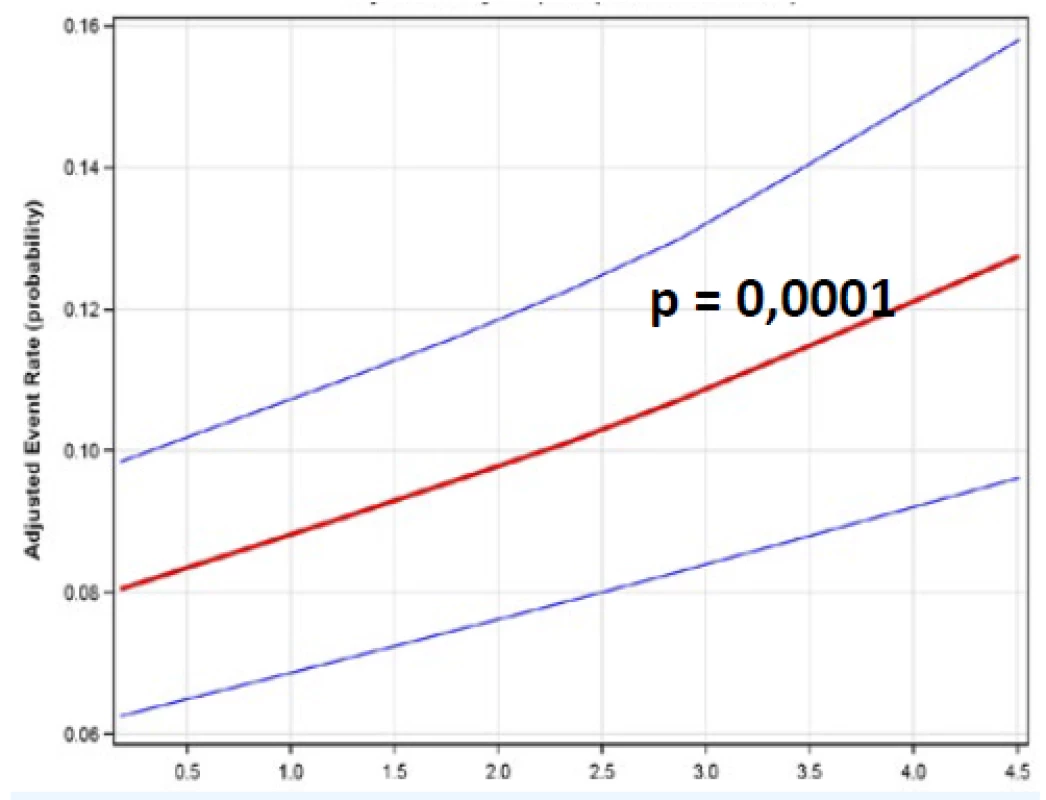
(zdroj: Giugliano RP. ESC Congress, Barcelona, 2017) PCSK9 ovlivňuje inhibicí mRNA další nová molekula – inclisiran. Ten je, stejně jako PCSK9-i, podáván parenterálně. Je však pravděpodobné, že inclisiran se bude podávat jen jednou, maximálně dvakrát ročně. Efekt (hypolipidemický účinek) je přitom impresivní (obr. 6).
Obr. 6. Inclisiran 1× za rok a 2× za rok: redukce LDL cholesterolu ve dni 360 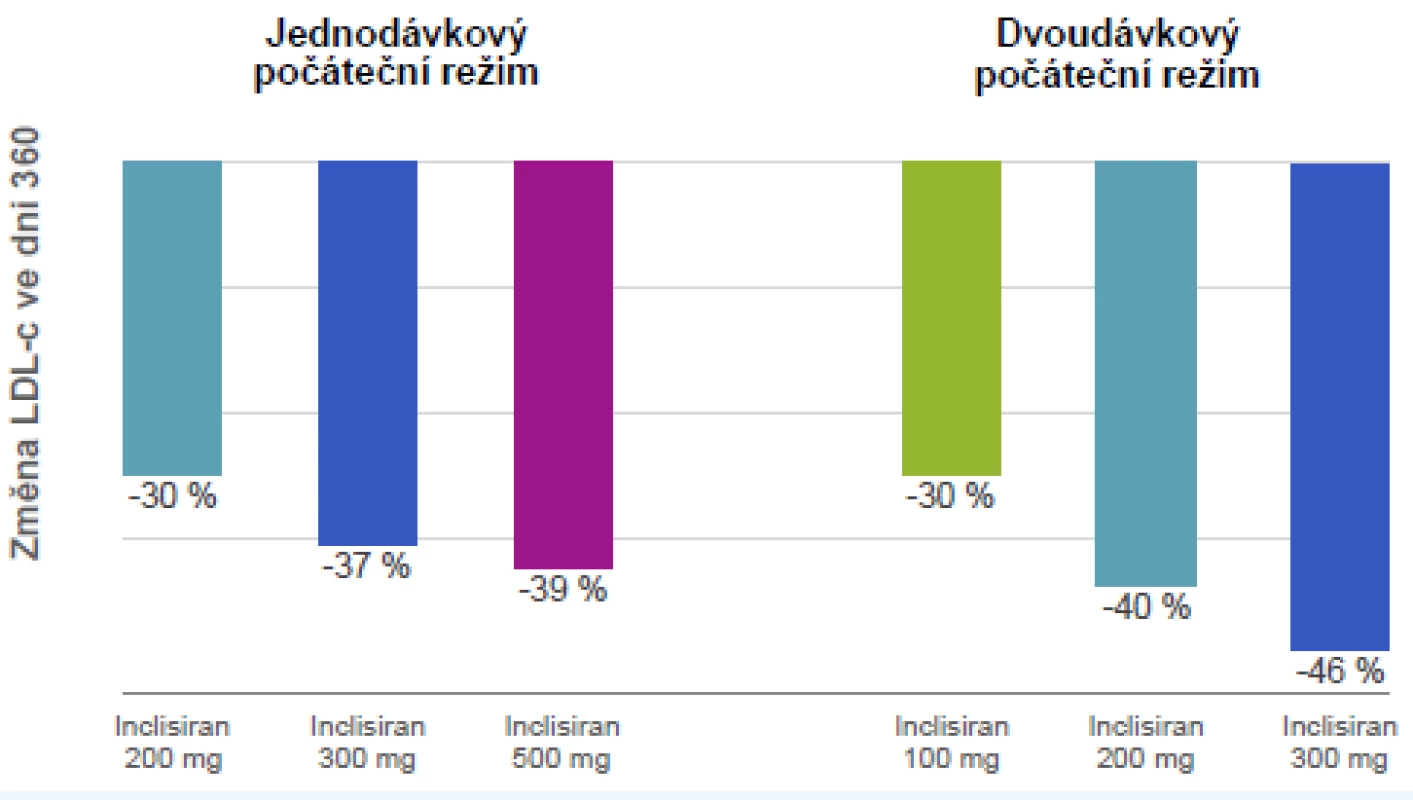
Mipomersen je lékem, který blokuje syntézu apolipoproteinu B zablokováním transkripce RNA pro tento protein a také v širším slova smyslu částečně reprezentuje genovou terapii (28).
Lomitapid, schválený pro léčbu homozygotní familiární hypercholesterolemie, blokuje syntézu lipoproteinů v játrech. Současně působí na tvorbu chylomikronů a ovlivňuje tak hladiny cholesterolu i triglyceridů současně.
Volanesorsen, antisense apolipoprotein C3, byl zmíněn již výše při léčbě FCS. Dramaticky redukuje koncentrace triglyceridů u těžkých hypertriglyceridemií.
Pemafibrát představuje novou generaci fibrátů s lepší bezpečností i účinností. V současné době probíhá velká morbiditně-mortalitní klinická studie, jejíž výsledky jsou očekávány s napětím.
Co bude s inhibitory CETP, je opravdu těžké odhadnout. Tři z nich byly staženy z vývoje pro problémy s bezpečností nebo nedostatečný účinek. Na druhé straně studie REVEAL s anacetrapibem (30 tisíc nemocných v sekundární prevenci KVO) potvrdila nejen velmi pozitivní „lipidové účinky“ (tab. 1), především však došlo po 4 letech sledování ke statisticky významnému poklesu KVO o 9 %. To je více než v některých podobných studiích s dalšími hypolipidemiky, která se již běžně v praxi užívají. Výrobce se v současné době rozhoduje, zda bude uvádět přípravek na trh.
Tab. 1. Studie REVEAL – lipidy 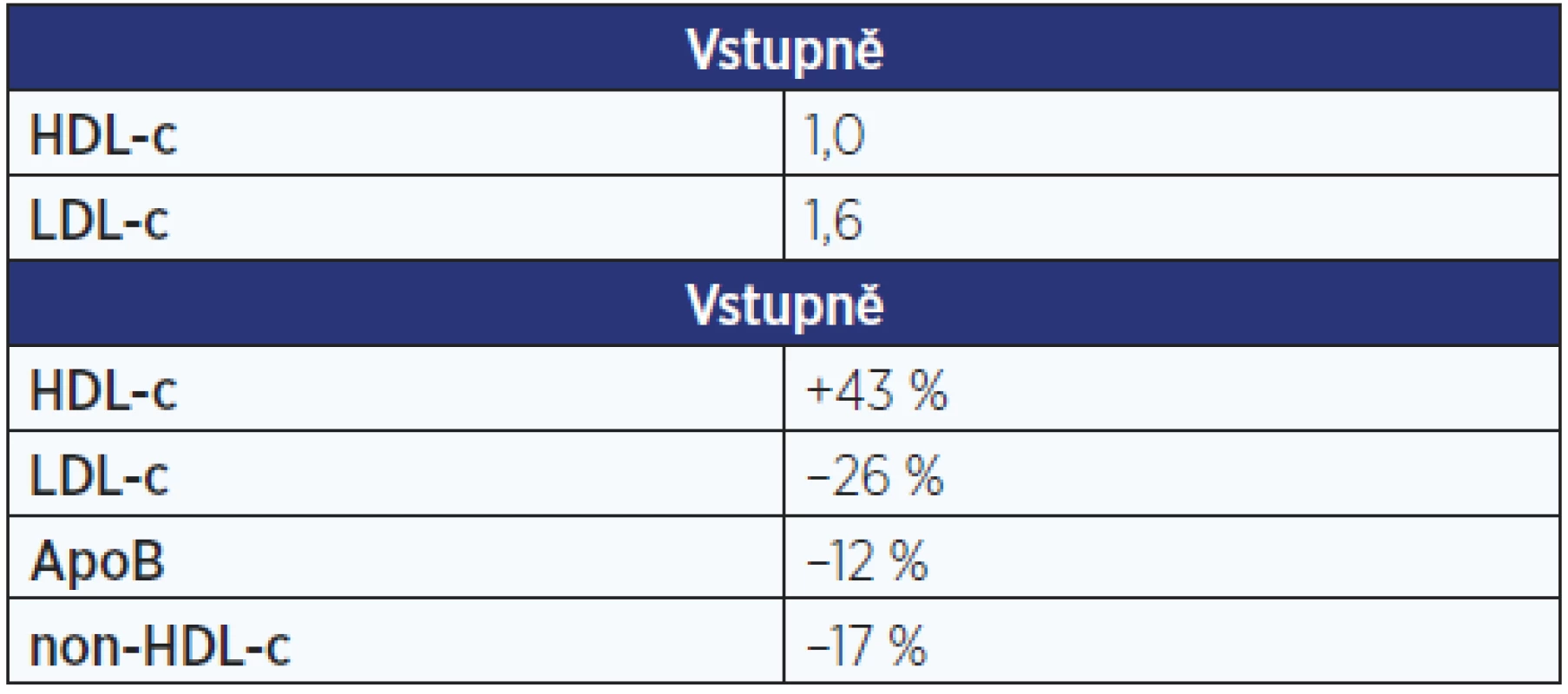
MÁME SE BÁT VELMI NÍZKÉHO CHOLESTEROLU?
Velmi častou otázkou kladenou v souvislosti s léčbou HLP a DLP je: Jak nízko je dost nízko (pro LDL)? A není významné snižování cholesterolu nebezpečné, když se jedná o látku opravdu životně důležitou? Ponechám stranou ryzí akademičnost těchto dotazů, protože ani při současné léčbě nedosahuje většina nemocných cílových hodnot (15). Současné armamentarium hypolipidemik skutečně dokáže v kontrolovaných studiích při využití všech prostředků dosáhnout hodnot LDL-c < 0,5 mmol/l.
Zde je třeba opět uvést výsledky studie FOURIER (obr. 7). Nemocní v této studii byli rozdělení do 5 skupin. Jako referenční kvintil sloužila skupina pacientů s LDL-c > 2,6 mmol/l. Další kvintily pak byly charakterizovány stále nižším LDL-c. Skupina nemocných s nejnižšími hodnotami měla LDL-c < 0,5 mmol/l. Pokles LDL-c byl provázen přímo úměrným lineárním poklesem KV příhod. Při srovnání „nejvyšší“ a „nejnižší“ skupiny dosáhl pokles KV příhod 31 %. Nebyly pozorovány žádné nežádoucí účinky nejagresivnější léčby, respektive nejvýraznějšího poklesu LDL-c.
ZÁVĚR
Problematika poruch tukového metabolismu je velmi široká a předložený text je jen malým nahlédnutím do jejích tajů. Někteří, třeba americká NLA (National Lipid Association), považují klinickou lipidologii za samostatný obor, vydávají funkční licence, zavádějí atestace. Já se domnívám, že tato problematika má své kouzlo a nachází své uplatnění právě – nebo především – proto, že je součástí velké interny a měla by její součástí zůstat. Jedině tak bude zajištěn komplexní pohled na nemocného s poruchou tukového metabolismu. Je totiž ohrožen nejen manifestací aterosklerózy, ale i hepatopatií, dekompenzací diabetu a někteří pacienti (s těžkými hypertriglyceridemiemi) akutní pankreatitidou. A to nehovoříme o sekundárních HLP u hypotyreózy, o ovlivnění tukového metabolismu hormony v průběhu života ženy, o LDL aferéze ani o mnoha dalších aspektech problematiky HLP a DLP.
Adresa pro korespondenci:
prof. MUDr. Richard Češka, CSc., FACP, FEFIM
3. interní klinika 1. LF UK a VFN
U Nemocnice 1
128 01 Praha 2
Tel.: 224 962 946
e-mail: richard.ceska@vfn.cz
Zdroje
1. Goldstein JL, Hobbs HH, Brown MS. Familial hypercholesterolemia. In: Scriver CR et al. (eds.) The metabolic and molecular bases of inherited disease, vol. 3 (8th ed.). McGraw-Hill, New York, 2001 : 2863–2914.
2. Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat 1992; 1: 445–466.
3. Innerarity TL, Weisgraber KH, Arnold KS et al. Familial defective apolipoprotein B-100: low density lipoproteins with abnormal receptor binding. Proc Natl Acad Sci USA 1987 : 84: 6919–6923.
4. Fouchier SW, Dallinga-Thie GM, Meijers JC et al. Mutations in STAP1 are associated with autosomal dominant hypercholesterolemia. Circ Res 2014; 115 : 552–555.
5. Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376 : 1713–1722.
6. Giugliano RP, Mach F, Zavitz K et al. Evaluation of cognitive function in a randomized trial of evolocumab. N Engl J Med 2017; 377 : 633–43.
7. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 : 2387–2397.
8. Nicholls SJ, Puri R, Anderson T et al. Effect of evolocumab on progression of coronary disease in statin-treated patients: the GLAGOV randomized clinical trial. JAMA 2016; 316 : 2373–2384.
9. Catapano AL, Graham I, De Backer G et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias. Eur Heart J 2016; 37 : 2999–3058.
10. Češka R a kol. Familiární hypercholesterolemie. Triton, Praha, 2015.
11. Sahebkar A, Watts GF. New LDL-cholesterol lowering therapies: pharmacology, clinical trials, and relevance to acute coronary syndromes. Clin Ther 2013; 35 : 1082–1098.
12. Baigent C, Blackwell L, Emberson J et al.; Cholesterol Treatment Trialists Collaborators. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376 : 1670–1681.
13. Jacobson TA, Ito MK, Maki KC et al. National Lipid Association recommendations for patient-centered management of dyslipidemia: part 1—full report. J Clin Lipidol 2015; 9 : 129–169.
14. Jacobson TA, Maki KC, Orringer CE et al. National Lipid Association recommendations for patient-centered management of dyslipidemia: part 2. J Clin Lipidol 2015; 9(Suppl. 6): S1–S122.
15. Boekholdt SM, Hovingh GK, Mora S et al. Very low levels of atherogenic lipoproteins and the risk for cardiovascular events: a meta-analysis of statin trials. J Am Coll Cardiol 2014; 64 : 485–494.
16. Wiviott SD, Cannon CP, Morrow DA et al. Can low-density lipoprotein be too low? The safety and efficacy of achieving very low low-density lipoprotein with intensive statin therapy: a PROVE IT-TIMI 22 substudy. J Am Coll Cardiol 2005; 46 : 1411–1416.
17. Giugliano RP, Wiviott SD, Blazing MA et al. Long-term safety and efficacy of achieving very low levels of low-density lipoprotein cholesterol: a prespecified analysis of the IMPROVE-IT trial. JAMA Cardiol 2017; 2 : 547–555.
18. Pedersen TR, Kjekshus J, Berg K et al. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344 : 1383–1389.
19. Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339 : 1349–1357.
20. Orringer CE, Jacobson TA, Saseen JJ et al. Update on the use of PCSK9 inhibitors in adults: recommendations from an expert panel of the National Lipid Association. J Clin Lipidol 2017; 11 : 880–890.
21. Lipinski MJ, Benedetto U, Escarcega RO et al. The impact of proprotein convertase subtilisin-kexin type 9 serine protease inhibitors on lipid levels and outcomes in patients with primary hypercholesterolaemia: a network meta-analysis. Eur Heart J 2016; 37 : 536–545.
22. Koren MJ, Sabatine MS, Giugliano RP et al. Long-term low-density lipoprotein cholesterol-lowering effi cacy, persistence, and safety of evolocumab in treatment of hypercholesterolemia: results up to 4 years from the open-label OSLER-1 extension study. JAMA Cardiol 2017; 2 : 598–607.
23. Nicholls SJ, Puri R, Anderson T et al. Effect of evolocumab on progression of coronary disease in statin-treated patients: the GLAGOV randomized clinical trial. JAMA 2016; 316 : 2373–2384.
24. Cannon CP, Blazing MA, Giugliano RP et al.; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 : 2387–2397.
25. Kastelein JJ, Wedel MK, Baker BF et al. Potent reduction of apolipoprotein B and low-density lipoprotein cholesterol by short-term administration of an antisense inhibitor of apolipoprotein B. Circulation 2006; 114 : 1729–1735.
26. Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res 2009, 50(Suppl.): S172–S177.
27. Cohen CJ, Boerwinkle E, Mosley TH et al. Sequence variations in PCSK9, low LDL and protection against coronary heart disease. N Engl J Med 2006; 354 : 1264–1272.
28. Stein EA, Mellis S, Yancopoulos GD et al. Effect of monoclonal antibody to PCSK9 on plasma LDL cholesterol. N Engl J Med 2012; 366 : 1108–1118.
29. The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA 1984; 251(3): 351–364.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodemČlánek Kam směřuje diabetologie?
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Kam směřuje diabetologie?
- Kam míří technologie v diabetologii?
- Hyperlipoproteinemie a (nejen) ateroskleróza: střípky z historie i současnosti
- Glykemická variabilita a mikrovaskulární komplikace diabetu
- Nové směřování chirurgické léčby obezity a některých metabolických onemocnění
- Postavení farmakoterapie v současné péči o obézní
- Incidence diabetu z pohledu dávek systému sociálního zabezpečení
- Tzv. protikuřácký zákon a poskytovatelé zdravotních služeb
- Biomarkery v onkologii: nové horizonty a výzvy v diagnostice a léčbě onkologických onemocnění ISOBM – 44. kongres Mezinárodní společnosti pro onkologii a biomarkery
- Nobelovy ceny za fyziologii a lékařství v letech 1940–1960
- Životní výročí prof. MUDr. Štěpána Svačiny, DrSc., MBA
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- K 85. narozeninám docenta Milana Macka sr.
- 80 let prof. MUDr. Petra Broulíka, DrSc.
- 80 let profesora Petra Goetze
- Ocenění ČLS JEP pro členy Společnosti pro epidemiologii a mikrobiologii ČLS JEP u příležitosti konání KMINE 2017
- Dvorana slávy slovenské medicíny
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (LISTOPAD – PROSINEC 2017)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kam míří technologie v diabetologii?
- K 85. narozeninám docenta Milana Macka sr.
- Nové směřování chirurgické léčby obezity a některých metabolických onemocnění
- Glykemická variabilita a mikrovaskulární komplikace diabetu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



