-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMaligní biliární obstrukce
Malignant biliary obstruction
Pancreatic cancer and cholangiocarcinoma are the most common causes of malignant biliary obstruction. They are diseases of increasing incidence and unfavorable prognosis. Only patients with localized disease indicated for surgery have a chance of long-term survival. These patients represent less than 20 % of all patients, despite the progress in our diagnostic abilities.
Locally advanced and metastatic tumors are treated with palliative chemotherapy or chemoradiotherapy; the results of such treatments are unsatisfactory. The average survival of patients with unresectable disease is 6 months and only 5–10 % of patients survive 5 years.
Biliary drainage is an integral part of palliative treatment. Endoscopically or percutaneosly placed stents improve quality of life, decrease cholestasis and pruritus, but do not significantly improve survival. Biliary stents get occluded over time, possibly resulting in acute cholangitis and require repeated replacement.
Photodynamic therapy and radiofrequency ablation, locally active endoscopic methods, have been increasingly used in recent years in palliative treatment of patients with malignant biliary obstruction. In photodynamic therapy, photosensitizer accumulates in tumor tissue and is activated 48 hours later by light of a specific wave length. Application of low voltage high frequency current during radiofrequency ablation results in tissue destruction by heat. Local ablation techniques can have a significant impact in a large group of patients with malignant biliary obstruction, leading to improved prognosis, quality of life and stent patency.Keywords:
cholangiocarcinoma, pancreatic cancer, stent, photodynamic therapy, radifrequency ablation, brachytherapy
Autoři: doc. MUDr. Ph.D. Tomáš Hucl
Působiště autorů: Klinika hepatogastroenterologie IKEM
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 30-37
Kategorie: Přehledové články
Souhrn
Karcinom pankreatu a karcinom žlučových cest jsou nejčastější příčiny maligní biliární obstrukce. Jedná se o onemocnění se stoupající incidencí a nepříznivou prognózou. Jedinou šanci na přežití mají pacienti s lokalizovanou chorobou, kteří jsou indikováni k chirurgickému výkonu. Navzdory pokrokům v diagnostice je však takových pacientů méně než 20 %.
Lokálně pokročilé nebo generalizované nádory jsou léčené paliativní chemoterapií či chemoradioterapií, výsledky této léčby ovšem jsou neuspokojivé. Průměrná doba přežití léčených pacientů s neresekabilním onemocněním je 6 měsíců, 5 let pak přežívá pouze 5–10 % nemocných.
Nedílnou součástí paliativní léčby je biliární drenáž. Endoskopicky či perkutánně zavedené stenty zlepšují kvalitu života, zmírňují cholestázu a pruritus, avšak zásadně nezlepšují přežití. Biliární stenty se časem obturují, což může vést k akutní cholangitidě, a vyžadují opakované výměny.
Fotodynamická terapie a radiofrekvenční ablace jsou lokálně působící endoskopické metody, které se v poslední době více uplatňují v paliativní léčbě pacientů s maligní biliární obstrukcí. Fotodynamická terapie spočívá v podání fotosenzitizující látky, jež se koncentruje v nádoru a po 48 hodinách se aktivuje světlem určité vlnové délky. Aplikace proudu o vysoké frekvenci při radiofrekvenční ablaci vede k destrukci tkáně vysokou teplotou. Lokálně ablační metody mohou mít zásadní význam pro velkou část pacientů s maligní biliární obstrukcí zlepšením jejich prognózy, kvality života a průchodnosti stentů.Klíčová slova:
cholangiocelulární karcinom, karcinom pankreatu, stent, fotodynamická terapie, radiofrekvenční ablace, brachyterapieÚvod
Nejčastějšími příčinami maligní biliární obstrukce jsou karcinom žlučových cest (cholangiocarcinoma [CCA]) a karcinom pankreatu (pancreatic cancer [PC]). Obě choroby kromě biliární obstrukce spojuje přítomnost často nespecifických příznaků, pozdní diagnóza a nepříznivá prognóza. Pouze menšina pacientů je indikovaná k chirurgické léčbě, která má jako jediná kurativní potenciál. Většina pacientů je odkázána na paliativní způsoby léčby, a umírají tak průměrně do jednoho roku.
Cholangiocelulární karcinom je nejčastější malignitou žlučovodů a druhou nejčastější malignitou jater po hepatocelulárním karcinomu. Jeho původ je v epitelových buňkách žlučovodů či hepatocytech. CCA se podle lokalizace dělí na intrahepatální (iCCA, cca 10 %) a extrahepatální, kdy jsou hranicí žlučovody druhého řádu. Extrahepatální karcinom může být perihilózní (Klatskinův tumor, pCCA, cca 50 %, avšak v některých studiích až 97 %) a distální (dCCA, cca 40 %) (1). Perihilózní karcinom se dále dělí dle míry postižení jednotlivých žlučovodů dle Bismuthovy-Corletteovy klasifikace (2).
Výskyt CCA v posledních desetiletích spíše narůstá a v západním světě dosahuje 1–5/100 000/rok, častěji jsou postiženi muži. Výskyt má však výrazné geografické rozdíly, s nejvyšším zastoupením v některých asijských zemích, kde dosahuje až mnohonásobku výskytu u nás. Příčinou jsou rozdíly v genetických a jiných rizikových faktorech (infekce, hepatolitiáza). V západním světě je nejvýznamnějším rizikovým faktorem primární sklerozující cholangitida. Pět let přežívá asi 10 % pacientů(1, 3, 4).
Duktální adenokarcinom pankreatu je nejčastějším představitelem nádorů pankreatu. Ostatní nádory, jako například acinární karcinom, pankreatoblastom či neuroendokrinní nádory, tvoří menšinu a mají částečně odlišnou etiopatogenezi, manifestaci, diagnostiku i léčbu. Karcinom pankreatu je devastující onemocnění s dlouhodobě omezenými možnostmi léčby a špatnou prognózou. Výskyt této choroby v posledních desetiletích jednoznačně narůstá a v západním světě dosahuje průměrné incidence kolem 8–20/100 000 obyvatel za rok.
Nejčastěji se jedná o onemocnění sporadické, bez známé dominantní příčiny. Mezi rizikové faktory jeho vzniku patří kouření, obezita s nadměrným příjmem tuků, vysoký věk, mužské pohlaví, etnický původ, chronická pankreatitida či diabetes mellitus. V průměru se jedná o čtvrtou nejčastější příčinu úmrtí na nádorová onemocnění. Incidence onemocnění je téměř totožná s prevalencí, neboť 5leté přežití pacientů činí pouze cca 5 %. Hlavní příčinou nepříznivé prognózy je fakt, že onemocnění je v době stanovení diagnózy inoperabilní až u 85 % pacientů (5, 6).
Klinická manifestace a diagnostika
Klinická prezentace u obou chorob závisí na stadiu choroby. V časném stadiu jsou onemocnění většinou klinicky němá nebo asociována s nespecifickými příznaky, jako je dyspepsie, nechutenství, váhový úbytek či bolest. V okamžiku vzniku biliární obstrukce vzniká ikterus. Většina pacientů je v době stanovení diagnózy již v pokročilém stadiu.
Abdominální sonografie je prvním vyšetřením u většiny pacientů. Zásadním vyšetřením pro diagnostiku a staging onemocnění je CT břicha a u CCA kombinace MRI a MRCP. Další vyšetřovací modalitou je endoskopická ultrasonografie (EUS). Nevýhodou vyšetření je jeho invazivita a závislost na schopnostech vyšetřujícího. Výhodou je možnost odběru materiálu k histopatologickému vyšetření, který je indikován při diagnostických nejasnostech nebo ke stanovení definitivní diagnózy v případě onkologické léčby. V případě vysokého podezření na nádorové onemocnění, které je resekabilní, není odběr materiálu nezbytný. Lokální staging pomocí EUS je u CCA obtížný, avšak může napomoci v diagnostice maligní lymfadenopatie. Přesnost diagnostiky CCA lze vylepšit provedením intraduktální ultrasonografie (1, 3, 4).
K histopatologické diagnostice lze kromě EUS použít také odběr materiálu ze zúženého vývodu při ERCP cestou kartáčkového odběru či biopsie. Senzivitita kartáčkového odběru je obecně velmi nízká, lepší je kombinace kartáčkového odběru (senzitivita 35 %) a biopsie (43 %), díky níž celková senzitivita vzroste na 86 % (7). Navýšení senzitivity lze dosáhnout pomocí FISH (fluorescence in situ hybridization), která umožňuje detekci buněčné aneuploidity. Cholangioskopie umožňuje cílený odběr, lze ji doplnit konfokální laserovou endomikroskopií (1, 3, 4).
Rutinní součástí vyšetření je stanovení hodnoty nádorových markerů CA 19-9 a CEA v séru, jejich senzitivita a specificita jsou však omezené. Přítomnost cholestázy a cholangitidy snižují specificitu CA 19-9. U pacientů s hilovou stenózou je vhodné vyloučit autoimunitní cholangitidu pomocí sérového IgG4 (1, 3, 4).
Chirurgická léčba
Rozhodnutí o léčbě by mělo být výsledkem multioborové konzultace zahrnující gastroenterologa, radiologa, chirurga a onkologa. Vzhledem k náročnosti a rizikům léčby je součástí rozhodnutí také věk, klinický stav a přání nemocného. Ani pokročilý věk však nemusí být překážkou radiálního chirurgického řešení (8).
Chirurgická léčba představuje jedinou léčebnou modalitu dávající naději na dlouhodobé přežití u obou chorob. Medián přežití u CCA pacientů s R0 resekcí se pohybuje mezi 1 a 4 roky, kdežto u pacientů s neresekabilním tumorem mezi 5 a 9 měsíci (9). Vzhledem k pozdní diagnostice však R0 resekci podstoupí asi jen 20–30 % pacientů s CCA (4). V závislosti na lokalizaci nádoru je výkonem resekce postiženého žlučovodu, většinou včetně přilehlé části jater (hemihepatektomie včetně segmentu I pro riziko metastáz u pCCA), v případě proximálního nádoru, resekce jater u intrahepatálního nádoru a duodenopankreatektomie u distálního nádoru. Resekce jaterního laloku může v případě jeho malého objemu vyžadovat předoperační embolizaci portální žíly k nárůstu objemu kontralaterálního laloku. Transplantace jater pro CCA je dostupná pouze v několika málo světových centrech pro vybrané pacienty léčené neoadjuvantní chemoradioterapií (1, 3, 4).
Pouze menšina pacientů s PC je indikovaná k chirurgické léčbě. Za resekabilní nádor považujeme onemocnění bez vzdálených metastáz a arteriální invaze. Resekci portální či horní mezenterické žíly lze považovat za opodstatněnou v případě, že umožní R0 resekci. Pětileté přežití u pacientů po resekci karcinomu pankreatu je 20–25 %. Přežití pacientů s lokálně pokročilým nádorem je výrazně lepší než pacientů s metastazujícím (9–15 vs. 3–6 měsíců). Mezi negativní prognostické faktory patří pozitivní resekční okraje (R1 a R2 resekce), nízká diferenciace, velikost tumoru a pozitivní nález v uzlinách. Nádory lokalizované v hlavě jsou indikované k duodenopankreatektomii, nádory v distální části pankreatu lze odstranit za cenu levostranné hemipankreatektomie se splenektomií, někdy je nutná totální pankreatektomie (6, 10).
Chemoterapie a radioterapie
Adjuvantní terapie
Pacienti po resekci CCA by měli být zvážení k účasti v klinických studiích s adjuvantní chemoterapií či chemoradioterapií. V současné době nejsou k dispozici data, která by jednoznačně prokazovala efekt této léčby v adjuvanci (3).
U pacientů po resekci karcinomu pankreatu se většinou vyvine systémová recidiva (70 %). Přežití po resekci bez chemoterapie činí kolem 10 % a zvyšuje se na 25 % s užitím chemoterapie (studie ESPAC 01, CONKO 001, RTOG-9704), adjuvantní chemoterapie tak více než zdvojnásobuje procento přežití. Užití radioterapie je kontroverzní, neboť k průkazu jejího příznivého účinku chybějí randomizované kontrolované studie. Naopak studie ESPAC-1 prokázala dokonce horší výsledky u pacientů léčených radioterapií, otázkou však zůstává design studie i způsob a kvalita radioterapie.
Chemoterapii zahajujeme v průměru za 1–2 měsíce po operaci a spočívá v podání 6 cyklů gemcitabinu či 5-fluorouracilu. Gemcitabin a 5-fluorouracil jsou stejně efektivní, 5-fluorouracil však má více vedlejších účinků (ESPAC-3) (6, 10).
Paliativní terapie
Význam chemoterapie proti prosté paliaci byl prokázán u cholangiocelulárního karcinomu ve studii s 5-fluorouracilem. Léčení pacienti měli medián přežití 6 měsíců oproti 2,5 měsíce u neléčených pacientů (11). O skoro 15 let později byl stanoven nový standard.
Britská studie ABC-02, ve které bylo hodnoceno 410 pacientů s lokálně pokročilým nebo generalizovaným CCA, karcinomem žlučníku či papily, hodnotila 24týdenní léčbu kombinací gemcitabinu s cisplatinou oproti samotnému gemcitabinu. Medián přežití činil 11,7 vs. 8,1 měsíce (p < 0,001). Toxicita byla podobná v obou skupinách, kromě mírně vyšší hematologické toxicity u kombinované léčby. Pacienti v celkově nedobrém stavu (performance status 2) a s nádory papily z kombinační léčby neprofitovali (12).
U nemocných s generalizovaným nádorem je dlouhodobě standardem monoterapie gemcitabinem, jež prokazatelně mírně zlepšuje přežití. Vedle toho také pozitivně ovlivňuje symptomy nemoci a zlepšuje kvalitu života. Vzhledem k chemorezistenci na gemcitabin a nedostatečnému efektu byla v této indikaci zkoušena řada kombinací léků. V nedávné době se ukázalo, že kombinace FOLFIRINOX (5-fluorouracil, irinotekan, oxaliplatina) je lepší ve srovnání s monoterapií gemcitabinem ve smyslu přežití pacientů (studie ACCORD 11). Ve srovnání s gemcitabinem byla objektivní odpověď přítomna u 32 vs. 9 % pacientů (p = 0,0001) a přežití dosahovalo 11,1 vs. 6,8 měsíce (p < 0,0001). Výskyt nežádoucích účinků (neutropenie, trombocytopenie, neuropatie, zvracení) však byl vyšší. Užití režimu FOLFIRINOX je vhodné u pacientů v dobrém klinickém stavu a absencí hyperbilirubinemie nad 1,5násobek normy (13).
Účinnost kombinace gemcitabinu s paklitaxelem vázaným na nanopartikule albuminu (nab-paklitaxel) byla prokázána v mezinárodní studii MPACT. Objektivní odpověď ve srovnání se samotným gemcitabinem byla přítomná u 23 % pacientů ve srovnání se 7 % v kontrolní skupině (p < 0,0001) a medián přežití činil 8,5 vs. 6,7 měsíce (p < 0,001). Neutropenie, únava, průjem a neuropatie však také byly častější (14).
Endoskopická biliární drenáž
Drenáž žlučových cest je v případě maligní biliární obstrukce indikovaná jako přemostění k operaci nebo u inoperabilních pacientů k trvalé paliaci. Užití stentů vede k biliární dekompresi, snížení ikteru, svědění a rizika vzniku cholangitidy. Z praktického hlediska je vhodné rozdělení biliární drenáže na předoperační a paliativní, podle lokalizace stenózy pak na drenáž distální (karcinom pankreatu, distální CCA) a proximální (perihilózní CCA).
Předoperační drenáž distální
Drenáž žlučových cest u pacientů s operabilní maligní stenózou distálního choledochu je dlouhodobě diskutované téma. Její význam spočívá ve snížení ikteru a prevenci komplikací cholestázy. Obstrukční ikterus může vést k jaterní či renální dysfunkci. Dále také může předoperační drenáž poskytnout čas potřebný k neoadjuvantní léčbě. Zavedení stentu (plastikového ani metalického) neinterferuje s provedením operace. Na druhé straně časná operace bez drenáže předejde možným komplikacím drenážní intervence a ušetří její náklady.
Multicentrická randomizovaná studie u 202 pacientů s resekabilním karcinomem pankreatu rozdělila nemocné do dvou skupin, z nichž v první byla provedena 4–6 týdnů trvající předoperační drenáž a ve druhé chirurgický zákrok do týdne od diagnózy. Ve skupině s předoperační drenáží bylo významně více komplikací (74 vs. 39 %), mortalita však byla srovnatelná. Autory studie tak předoperační drenáž doporučena nebyla. Je však třeba si uvědomit, že pacienti měli bilirubin < 250 µmol/l, byli operováni do jednoho týdne, neúspěšnost ERCP činila 25 % a použity byly pouze plastové stenty (15).
V multicentrické studii s 241 pacienty s karcinomem pankreatu bylo retrospektivně hodnoceno předoperační zavedení metalického stentu. Tato studie naopak ukázala vysokou efektivitu ERCP, avšak také riziko komplikací. Úspěšnost zavedení stentů byla 100% a drenáž vedla k regresi ikteru. Čtrnáct pacientů (5,8 %) mělo okluzi stentů v průměrné době 6,6 měsíce. Akutními komplikacemi byly pankreatitida (14 pacientů), migrace stentu (12 pacientů) a perforace duodena (3 pacienti) (16).
Předoperační drenáž proximální
Předoperační drenáž u pacientů s proximální stenózou by měla být provedena pouze u selektované skupiny pacientů, neboť je zde riziko komplikací. Jednoznačně je indikovaná u pacientů s cholangitidou nebo těžkým svěděním, často je provedena po diagnostické cholangiografii s odběrem biopsie. Metaanalýza 11 studií, z nichž pouze jedna byla prospektivní, prokázala, že pacienti s předoperační drenáží měli signifikantně více pooperačních a infekčních komplikací (17).
Typy biliárních stentů
K dispozici jsou plastikové či metalické stenty. Plastikové stenty jsou vyrobeny z teflonu, polyuretanu či polyetylenu, jejich šířka se pohybuje od 7 do 11,5 Fr a délka od 5 do 15 cm . Samoexpandibilní metalické stenty jsou nejčastěji nitinolové (kombinace niklu a titanu). Mohou být potažené průhlednou vrstvou z různých materiálů. Důvodem potažení stentů je snaha snížit prorůstání nádoru a jejich možné odstranění. Potažení je u některých stentů částečné. Stenty jsou uloženy v zaváděcím systému, který je 6–8,5 Fr široký a zavádí se skrze endoskop, šířka samotného stentu se pohybuje mezi 6 a 10 mm. Po zavedení se stent ukotví do okolní tkáně expanzivní radiální silou. Plastikové i metalické stenty jsou vyráběny různými producenty.
Průchodnost metalických stentů je větší ve srovnání s průchodností stentů plastikových. Mnoho studií uvádí průměrnou průchodnost metalických stentů až 270 dnů. V randomizované studii se 105 pacienty byla průchodnost metalických stentů ve srovnání s plastikovými významně větší (273 vs. 126 dnů) (18), nicméně přežití pacientů nebylo rozdílné. Zavedení metalického stentu tak lze doporučit u těch pacientů s distální stenózou, jejichž předpokládaná doba přežití přesahuje 3 měsíce, nelze však očekávat vliv na přežití.
Řada studií srovnávala potahované a nepotahované metalické stenty pro distální biliární obstrukci s různými výsledky. Metaanalýza studií neprokázala rozdílnou průchodnost stentů v 6 a 12 měsících ani v komplikacích jako pankreatitida, cholecystitida, perforace, krvácení či cholangitida. Potahované stenty měly vyšší riziko migrace, nádorového přerůstání a nižší riziko vrůstání (19). Jiná studie také prokázala, že riziko vzniku cholecystitidy je stejné u potahovaných i nepotahovaných stentů (10 vs. 9 %) (20).
Paliativní drenáž proximální
V případě paliativní léčby hilové obstrukce lze aplikovat plastikové i metalické stenty. Používáme nepotahované metalické stenty, abychom se vyhnuli uzavření kontralaterálního segmentu. Prospektivní randomizovaná studie se 108 pacienty ukázala, že pacienti s metalickými stenty měli ve srovnání s plastikovými stenty častěji úspěšnou drenáž (70 vs. 46 %; p = 0,01), a dokonce delší přežití (126 vs. 49 dnů; p = 0,02) (21). Pro stenózy typu Bismuth II–IV s předpokládanou dobou přežití nad 3 měsíce je tak použití metalických stentů výhodné.
Diskutovanou otázkou zůstává nutnost bilaterálního stentování u pacientů s hilovou stenózou. U pacientů se stenózou typu Bismuth I je dostatečné zavedení jednoho stentu. U pacientů s pokročilejší stenózou (Bismuth II–IV) situace není jednoznačná. Chang et al. ve své studii ukázali, že bilaterální drenáž vedla k delšímu přežití (225 vs. 145 dnů; p < 0,001). Nicméně neúspěšná bilaterální drenáž měla velké riziko cholangitidy (32 vs. 6 %) a nižší přežití (46 vs. 225 dnů), což bylo vysvětleno instrumentací v nezadrénovaném laloku (22) .
Kritériem k hodnocení účinnosti ale může být spíše objem drénované části jater. Drenáž alespoň 25 % objemu jater se dříve považovala za dostatečnou k ústupu ikteru (23). Vienne et al ukázali, že pacienti s drenáží více než 50 % objemu jater měli efektivnější drenáž než ti s nižším objemem (82 vs. 45 %) (24). Vzhledem k tomu, že pravý lalok zaujímá v průměru 55–60 %, levý lalok 30–35 % a kaudatus 10 % objemu jater (4), drénování 50 % objemu jater může vyžadovat více než jeden stent, ať už bilaterálně či unilaterálně multisegmentálně.
Efektivitě drenáže může napomoci před výkonem provedené MRCP a CT/MRI volumometrie k určení objemu, anatomie žlučovodů a vyloučení atrofie. Pro svoji vysokou technickou náročnost a rizika by hilová drenáž měla být prováděna v centrech s multidisciplinárním zázemím a zkušeným endoskopistou (4).
Perkutánní drenáž
Endoskopická a perkutánní drenáž jsou považovány za méně invazivní způsoby drenáže žlučovodů ve srovnání s chirurgickým bypassem. Perkutánní přístup (perkutánní transhepatální cholangiografie [PTC]) má své výhody v lepší toleranci výkonu pacientem, možnosti výběru drénovaného laloku a často vyšší technické úspěšnosti v překonávání obtížných stenóz. Na druhou stranu je perkutánní přístup zatížen nezanedbatelným rizikem komplikací, bolestí v místě vpichu a trvalým dyskomfortem v případě, že je ponechán transkutánní katétr.
U pacientů s pokročilejšími stenózami (II–IV) však může být perkutánní drenáž úspěšnější než endoskopie. V retrospektivní studii byli hodnoceni 41 pacienti s perkutánně či endoskopicky zavedenými SEMS (samoexpandibilní metalický stent). Úspěšnost drenáže byla výrazně vyšší ve skupině perkutánní (93 vs. 77 %; p = 0,049). Množství komplikací a průměrné přežití byly srovnatelné (25).
EUS navigovaná drenáž
Nově se rozvíjející modalitou v endoskopické léčbě maligní biliární obstrukce je endosonograficky navigovaná drenáž. Její užití přichází v úvahu především v situaci nezdařeného ERCP a kontraindikací k PTC. Přístup může být zajištěn několika způsoby: EUS navigovanou rendez-vous s dokončením pomocí ERCP (obr. 1), transduodenální drenáží hepatocholedochu či transgastrickou drenáží levostranných intrahepatálních žlučovodů.
Obr. 1. EUS-navigovaná biliární drenáž (T. Hucl, IKEM): A) Endosonografická transduodenální (bulbus) punkce proximálního choledochu zobrazující distální stenózu. B) Zavedení vodiče cestou transduodenálního přístupu do distální stenózy a papilou do sestupného duodena. C) Uchopení transpapilárně zavedeného vodiče ERCP přístrojem v duodenu. D) SEMS překlenující stenózu distálního choledochu. 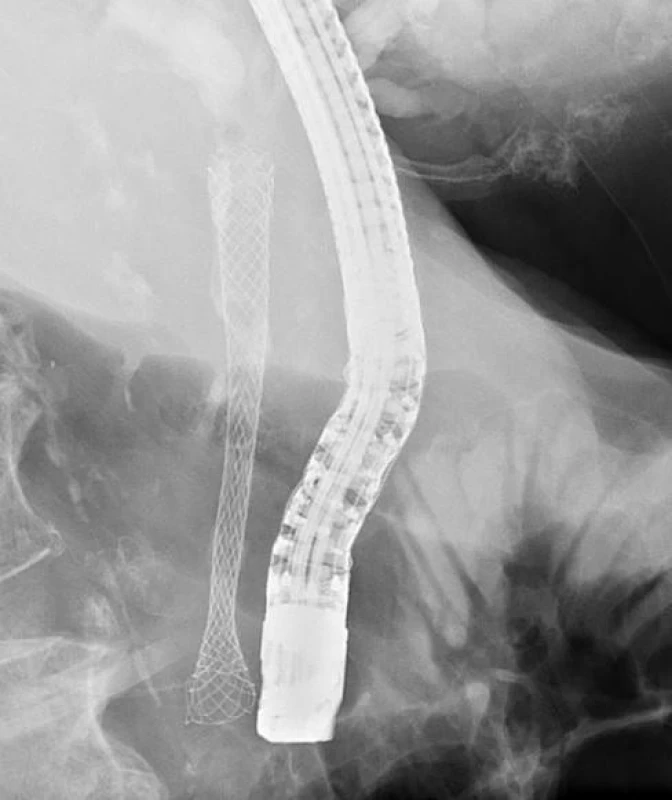
Technický úspěch těchto výkonů může ve zkušených rukách dosáhnout 70–98 %, je však třeba pamatovat na vysoké riziko komplikací, které dosahuje až 20 % (26). Tento postup je tak nutno na většině pracovišť považovat za experimentální.
Lokálně ablativní techniky
Biliární drenáž je standardem v paliativní léčbě maligní biliární obstrukce. Vede ke zmírnění symptomů a zlepšení kvality života snížením cholestázy, svědění, rizika cholangitidy a bolesti, avšak nezlepšuje zásadně přežití. Metalické stenty nabízejí delší průchodnost oproti plastikovým, avšak u více než 50 % pacientů dojde k okluzi stentu do 6–8 měsíců (27).
Užití fotodynamické terapie a radiofrekvenční ablace se v současné době rozvíjí za účelem lokální nádorové nekrózy ve snaze zlepšit průchodnost stentů a přežití pacientů (28).
Fotodynamická terapie
Fotodynamická terapie (photodynamic therapy [PDT]) je dvoustupňová metoda, kdy užití dvou netoxických komponent vede k nekróze tkáně. První komponentou je fotosenzitivní látka, která se dopraví do cílové tkáně. Druhou komponentou je světlo specifické vlnové délky, jež látku aktivuje.
Fotosenzitivní látka se preferenčně akumuluje v nádorových buňkách, játrech a slezině, odkud je většinou vyloučena do 72 hodin, a také v kůži, kde zůstává až 30 dnů. Mechanismus, jakým se tato látka preferenčně akumuluje v nádorových buňkách, není objasněn. Po vystavení působení světla specifické vlnové délky dochází k její aktivaci, což vede k tvorbě kyslíkových radikálů, které jsou následně zodpovědné za buněčnou toxicitu, apoptózu a nekrózu. Laserové světlo pochází ze speciálního zdroje (28, 29).
Porfimer sodný (Photofrin, Pinnacle Biologics, Bannockburn, USA) a meso-tetrahydroxyfenyl chlorin (Foscan, Biolitec Pharma Ltd, Edinburgh, Velká Británie) jsou porfyrinové deriváty, které se v současné době užívají k fotodynamické terapii v USA a Evropě. Jejich intravenózní podání v dávce 2 mg/kg předchází o 48 hodin vlastní terapii. Laserové světlo je aplikováno pomocí 3 metry dlouhého světelného rtg-kontrastního kabelu, který je zaveden lateroskopem po vodiči do místa stenózy. Je užíváno světlo o vlnové délce 630 nm. Po aplikaci světla následuje zavedení stentu. Aplikace může být opakována v tříměsíčních intervalech. Pacienti se musejí vyvarovat přímému oslunění po dobu nejméně 4–6 týdnů. Další nevýhodou metody je její technologická náročnost a vysoká cena (28, 29).
První popis případu užití fotodynamické terapie byl publikován již v roce 1991 (30). Řada následně realizovaných studií potvrdila technickou proveditelnost a bezpečnost metody a naznačily lepší přežití (31). V první kontrolované randomizované studii bylo zařazeno 39 pacientů, u kterých nedošlo během 7 dnů k dostatečnému poklesu bilirubinu po zavedení stentu. Byli randomizováni k fotodynamické terapii s drenáží oproti samotné drenáži. Studie byla předčasně ukončena pro výrazně lepší výsledek v intervenční skupině (Ortner). Průměrné přežití pacientů s PDT dosahovalo 493 dnů ve srovnání s 98 dny bez PDT (p < 0,0001) (32). Ve druhé randomizované studii s 32 pacienty byl medián přežití u PDT pacientů 630 dnů ve srovnání s 210 dny ve druhé skupině (p = 0,01). Ve skupině s PDT se nevyskytla fotosenzitivita, častější však byla akutní cholangitida (33).
Efekt PDT hodnotila také retrospektivní studie z jednoho centra v USA s 48 pacienty, kteří byli léčeni v předchozích 5 letech. Pacienti s PDT vykazovali výrazně lepší přežití (486 vs. 222 dnů; p = 0,003). Nutno však dodat, že 22 pacientů podstupovalo chemoterapii a 19 pacientů extrakorporální radioterapii, což mohlo ovlivnit výsledky (34).
Efekt chemoterapie na PDT byl prokázán v následujících studiích. Retrospektivní analýza ukázala medián přežití 538 dnů u pacientů s PDT a chemoterapií ve srovnání s 334 dny u pacientů léčených pouze PDT (35). Jiná studie tyto výsledky potvrdila a ukázala prodloužení progression free survival z 8 na 17 měsíců u pacientů, kteří byli k PDT léčeni ještě chemoterapií (36). Tyto retrospektivní výsledky naznačují na synergický efekt obou modalit, prospektivní randomizované studie však chybí.
Radiofrekvenční ablace
Radiofrekvenční ablace je metoda užívaná v léčbě jícnových, kolorektálních a primárních či sekundárních malignit jater. Její užití u maligní biliární obstrukce spočívá v lokální aplikaci vysokofrekvenčního proudu o nízké voltáži endoskopickou či perkutánní cestou. Aplikace proudu vyvolává pomocí vibrace elektronů zvýšení teploty, která pak způsobuje koagulační nekrózu okolní tkáně. Proud s těmito charakteristikami nevede k depolarizaci nervů a svalů. S průběhem ablace narůstá impedance, která zamezuje dalšímu šíření účinku. Metoda je technicky jednoduchá a finanční nenáročná (28, 37).
Endoskopický způsob léčby získává v posledních letech na popularitě. Pro endoluminální ablaci maligní stenózy je v současnosti k dispozici 8F 1,8 m dlouhá sonda, na jejímž konci jsou dvě 8mm elektrody, mezi nimiž je 8mm mezera (Habib, EndoHPB, Emcision, UK). Tato sonda se po vodiči zavede do místa stenózy a aplikuje se proud o výkonu 7–10 W po dobu 60–120 s. Ablace je následována zavedením plastikového či metalického stentu (28, 37) (obr. 2 a 3).
Obr. 2. RFA proximální stenózy (T. Hucl, IKEM): A) Hilová stenóza Bismuth IIIb. B) RFA levého hepatiku. C) RFA pravého hepatiku. D) bilaterálně zavedené SEMS. 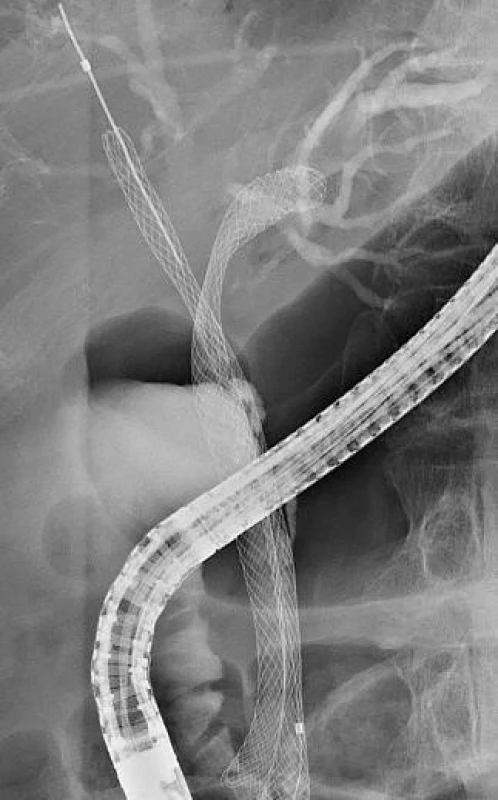
Obr. 3. RFA distální stenózy (T. Hucl, IKEM): A) RFA distální stenózy. B) SEMS překlenující distální stenózu. 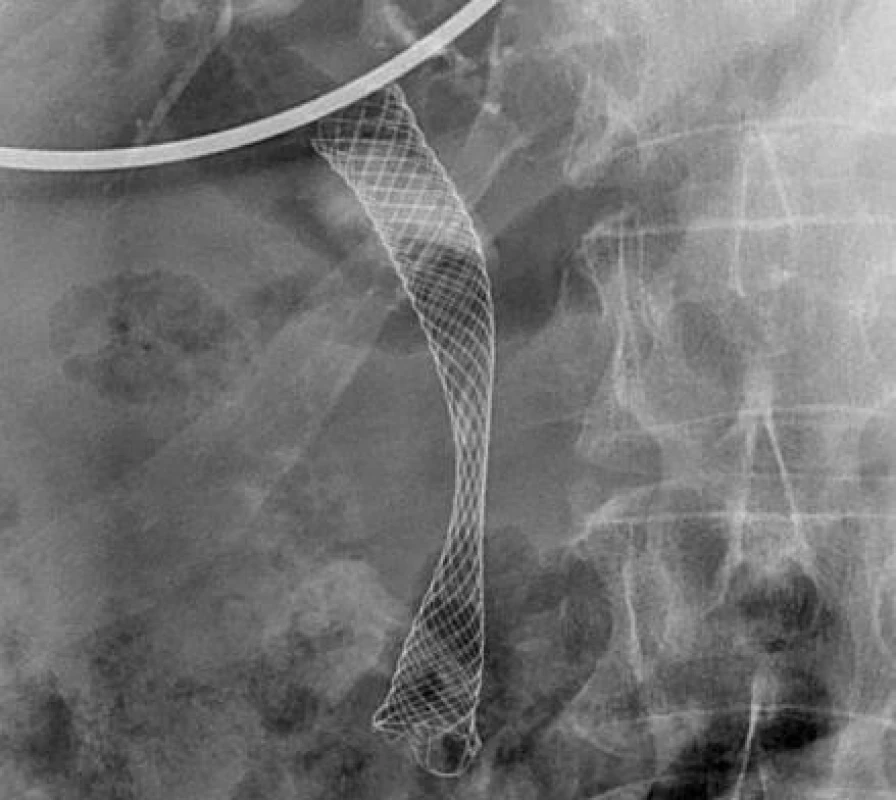
Experimentální práce na zvířatech, které umožnily studovat efekt RFA na tkáň žlučovodu a jater v závislosti na množství a době působení proudu, byly následované retrospektivními klinickými studiemi (28). Steel et al. hodnotili RFA u 22 pacientů s maligní biliární obstrukcí (16 PC, 6 CCA) ošetřených v letech 2009 a 2010. RFA byla úspěšná u 21 pacientů a byla následována úspěšným zavedením SEMS. U 1 pacienta se nedostavil efekt drenáže a pacient zemřel. U 20 pacientů byl stent průchodný za 30 dnů. Do 90 dnů zemřel další pacient s průchodným stentem a vyskytly se 3 okluze stentu. Nežádoucími účinky byly pankreatitida a v jednom případě cholecystitida u 2 pacientů (38).
V rakouské národní retrospektivní studii bylo provedeno 84 RFA u 58 pacientů v 11 centrech. Klatskinův tumor byl přítomen u 45 z nich. Technická proveditelnost dosáhla 100 %. Vyskytly se však významné komplikace u nezanedbatelného množství pacientů (1 infarkt jater, 5 cholangitid, 3 hemobilie, 2 sepse, 1 empyém žlučníku, 1 jaterní koma). Medián průchodnosti stentů byl 170 dnů. Rozdíl v průchodnosti metalických a plastikových stentů byl patrný, avšak nikoli statisticky významný (218 vs. 115, NS). Medián přežití činil 10,6 měsíce od RFA a 17,9 měsíce od stanovení diagnózy (39).
V recentně publikované case-control studii bylo provedeno retrospektivní srovnání 23 pacientů a 46 kontrol s karcinomem pankreatu. Skupiny pacientů byly srovnatelné mírou metastatického postižení a podáváním chemoterapie. K drenáži byl použit nepotahovaný SEMS. Komplikace byly minimální, jednou se vyskytla elevace AMS a jednou cholangitida. Medián přežití činil 226 vs. 123 dnů (p = 0,01). Medián průchodnosti stentu však nebyl statisticky lepší (40).
Nedávno také byly publikovány výsledky retrospektivní studie, která srovnávala skupinu pacientů léčených PDT a RFA. 16 pacientů podstoupilo RFA a 32 pacientů PDT. Medián přežití nebyl mezi skupinami významně rozdílný (9,6 vs. 7.5 měsíce; p = 0,779). Okluze stentu a cholangitida byly častější ve skupině s RFA. Studie je však kritizována pro řadu nedostatků, jako jsou např. rozdíly mezi pacienty nebo použití jiných typů stentů v obou skupinách a rovněž absence kontrolní skupiny (pouze stenty) (41).
Při RFA se vyskytla řada většinou mírných komplikací. Nejčastěji se jedná o přechodnou bolest břicha. Nejvážnější komplikací byla hemobilie a jaterní infarkt. Tři případy hemobilie se vyskytly ve studii Tal et al., kdy dva pacienti dokonce zemřeli a jeden byl ošetřen zavedením SEMS. Zajímavé je, že všechny tyto případy hemobilie se staly u pacientů, u kterých byl zaveden plastikový stent. Technika ablace byla také odlišná od dnes již běžně užívané techniky (42, 43).
Brachyterapie
Intraluminální brachyterapie může být provedena endoskopicky či perkutánně. Spočívá v aplikaci radioizotopu iridia-192 cestou katétru. Výhodami jsou možnost dosažení vyšší dávky radiace díky těsné blízkosti zdroje a nádoru a nižší riziko poškození okolních orgánů. Radan Brůha a jeho spolupracovníci ze IV. interní klinice 1. LF UK a VFN v Praze publikovali soubor 32 pacientů s maligní obstrukcí žlučovodů léčených perkutánně 192Ir v dávce 30 G a zavedením SEMS. Průměrná doba přežití dosahovala 457 dnů. Autoři nepozorovali žádné komplikace (44).
Jiní čeští autoři srovnávali perkutánně provedenou brachyterapii v kombinaci s externí radiací u 21 pacientů oproti samotnému stentu u 21 pacientů. Kombinační léčba měla lepší přežití (388 vs. 298 dnů) (45). Kombinace intraluminální a externí radioterapie může mít vysoký výskyt komplikací, v některých studiích je uváděn výskyt cholangitidy 40–50 % a gastrointestinální toxicity 8–42 % (3).
Závěr
Většina pacientů s maligní biliární obstrukcí není kandidáty chirurgické léčby, která jako jediná v současné době dává šanci na dlouhodobé přežití. Jsou tak indikovaní k paliativní onkologické léčbě, jejíž výsledky jsou neuspokojivé.
Nedílnou součástí léčby operovaných i neoperovaných pacientů je drenáž žlučových cest endoskopickou či perkutánní cestou. Samotná drenáž nezlepšuje zásadně přežití pacientů, zlepšuje však kvalitu života. Endoskopická drenáž je invazivní, technicky náročná a spojená s rizikem komplikací. Její indikace, načasování a provedení má svá pravidla, která snižují rizika komplikací a zvyšují její efektivitu.
Endoskopické lokálně ablativní techniky se v posledních letech rozvíjejí a jejich vhodné užití může vést ke zlepšení prognózy, kvality života či průchodnosti biliárních stentů.
Seznam zkratek
PC − karcinom pankreatu
CCA − cholangiokarcinom
ERCP − endoskopická retrográdní cholangiopankreatografie
EUS − endoskopická ultrasonografie
MRI − magnetická rezonance
MRCP − MRI cholangiopankreatikografie
SEMS − samoexpandibilní metalický stent
PDT − fotodynamická terapie
RFA − radiofrekvenční ablace
Korespondenční adresa
doc. MUDr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 9
140 21 Praha 4
Tel.: 261 362 600
Fax: 261 362 615
Zdroje
1. Rizvi S, Gores GJ. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology 2013; 145(6): 1215−1229.
2. Deoliveira ML, Schulick RD, Nimura Y et al. New staging system and a registry for perihilar cholangiocarcinoma. Hepatology 2011; 53(4): 1363−1371.
3. Khan SA, Davidson BR, Goldin RD et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update. Gut 2012; 61(12): 1657−1669.
4. Rerknimitr R, Angsuwatcharakon P, Ratanachu-ek T et al. Asia-Pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma. J Gastroenterol Hepatol 2013; 28(4): 593−607.
5. Lowenfels AB, Maisonneuve P. Epidemiology and risk factors for pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 20(2): 197−209.
6. Vincent A, Herman J, Schulick R et al. Pancreatic cancer. Lancet 2011; 378(9791): 607−620.
7. Ponchon T, Gagnon P, Berger F et al. Value of endobiliary brush cytology and biopsies for the diagnosis of malignant bile duct stenosis: results of a prospective study. Gastrointest Endosc 1995; 42(6): 565−572.
8. Oliverius M, Kala Z, Varga M et al. Radical surgery for pancreatic malignancy in the elderly. Pancreatology 2010; 10(4): 499−502.
9. Witzigmann H, Berr F, Ringel U et al. Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma: palliative photodynamic therapy plus stenting is comparable to r1/r2 resection. Ann Surg 2006; 244(2): 230−239.
10. Van Laethem JL, Verslype C, Iovanna JL et al. New strategies and designs in pancreatic cancer research: consensus guidelines report from a European expert panel. Ann Oncol 2012; 23(3): 570−576.
11. Glimelius B, Hoffman K, Sjoden PO et al. Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer. Ann Oncol 1996; 7(6): 593−600.
12. Valle J, Wasan H, Palmer DH et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010; 362(14): 1273−1281.
13. Conroy T, Desseigne F, Ychou M et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364(19): 1817−1825.
14. Goldstein D, El-Maraghi RH, Hammel P et al. Nab-paclitaxel plus gemcitabine for metastatic pancreatic cancer: long-term survival from a phase III trial. J Natl Cancer Inst 2015; 107(2).
15. van der Gaag NA, Rauws EA, van Eijck CH et al. Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med 2010; 362(2): 129−137.
16. Siddiqui AA, Mehendiratta V, Loren D et al. Self-expanding metal stents (SEMS) for preoperative biliary decompression in patients with resectable and borderline-resectable pancreatic cancer: outcomes in 241 patients. Dig Dis Sci 2013; 58(6): 1744−1750.
17. Liu F, Li Y, Wei Y, Li B. Preoperative biliary drainage before resection for hilar cholangiocarcinoma: whether or not? A systematic review. Dig Dis Sci 2011; 56(3): 663−672.
18. Davids PH, Groen AK, Rauws EA et al. Randomised trial of self-expanding metal stents versus polyethylene stents for distal malignant biliary obstruction. Lancet 1992; 340(8834–8835): 1488−1492.
19. Almadi MA, Barkun AN, Martel M. No benefit of covered vs uncovered self-expandable metal stents in patients with malignant distal biliary obstruction: a meta-analysis. Clin Gastroenterol Hepatol 2013; 11(1): 27−37.e1.
20. Suk KT, Kim HS, Kim JW et al. Risk factors for cholecystitis after metal stent placement in malignant biliary obstruction. Gastrointest Endosc 2006; 64(4): 522−529.
21. Sangchan A, Kongkasame W, Pugkhem A et al. Efficacy of metal and plastic stents in unresectable complex hilar cholangiocarcinoma: a randomized controlled trial. Gastrointest Endosc 2012; 76(1): 93−99.
22. Chang WH, Kortan P, Haber GB. Outcome in patients with bifurcation tumors who undergo unilateral versus bilateral hepatic duct drainage. Gastrointest Endosc 1998; 47(5): 354−362.
23. Dowsett JF, Vaira D, Hatfield AR et al. Endoscopic biliary therapy using the combined percutaneous and endoscopic technique. Gastroenterology. 1989; 96(4): 1180−1186.
24. Vienne A, Hobeika E, Gouya H et al. Prediction of drainage effectiveness during endoscopic stenting of malignant hilar strictures: the role of liver volume assessment. Gastrointest Endosc 2010; 72(4): 728−735.
25. Paik WH, Park YS, Hwang JH et al. Palliative treatment with self-expandable metallic stents in patients with advanced type III or IV hilar cholangiocarcinoma: a percutaneous versus endoscopic approach. Gastrointest Endosc 2009; 69(1): 55−62.
26. Maranki J, Hernandez AJ, Arslan B et al. Interventional endoscopic ultrasound-guided cholangiography: long-term experience of an emerging alternative to percutaneous transhepatic cholangiography. Endoscopy 2009; 41(6): 532−538.
27. O'Brien S, Hatfield AR, Craig PI, Williams SP. A three year follow up of self expanding metal stents in the endoscopic palliation of longterm survivors with malignant biliary obstruction. Gut 1995; 36(4): 618−621.
28. Patel J, Rizk N, Kahaleh M. Role of photodynamic therapy and intraductal radiofrequency ablation in cholangiocarcinoma. Best Pract Res Clin Gastroenterol 2015; 29(2): 309−318.
29. Tomizawa Y, Tian J. Photodynamic therapy for unresectable cholangiocarcinoma. Dig Dis Sci 2012; 57(2): 274−283.
30. McCaughan JS jr., Mertens BF, Cho C et al. Photodynamic therapy to treat tumors of the extrahepatic biliary ducts. A case report. Arch Surg 1991; 126(1): 111−113.
31. Dumoulin FL, Gerhardt T, Fuchs S et al. Phase II study of photodynamic therapy and metal stent as palliative treatment for nonresectable hilar cholangiocarcinoma. Gastrointest Endosc 2003; 57(7): 860−867.
32. Ortner ME, Caca K, Berr F et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. Gastroenterology 2003; 125(5): 1355−1363.
33. Zoepf T, Jakobs R, Arnold JC et al. Palliation of nonresectable bile duct cancer: improved survival after photodynamic therapy. Am J Gastroenterol 2005; 100(11): 2426−2430.
34. Kahaleh M, Mishra R, Shami VM et al. Unresectable cholangiocarcinoma: comparison of survival in biliary stenting alone versus stenting with photodynamic therapy. Clin Gastroenterol Hepatol 2008; 6(3): 290−297.
35. Hong MJ, Cheon YK, Lee EJ et al. Long-term outcome of photodynamic therapy with systemic chemotherapy compared to photodynamic therapy alone in patients with advanced hilar cholangiocarcinoma. Gut Liver 2014; 8(3): 318−323.
36. Park do H, Lee SS, Park SE et al. Randomised phase II trial of photodynamic therapy plus oral fluoropyrimidine, S-1, versus photodynamic therapy alone for unresectable hilar cholangiocarcinoma. Eur J Cancer 2014; 50(7): 1259−1268.
37. Reddy DN, Ramchandani M. Endoscopic palliation of advanced cholangiocarcinoma: can we go beyond stenting? Gastrointest Endosc 2014; 80(5): 805−806.
38. Steel AW, Postgate AJ, Khorsandi S et al. Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction. Gastrointest Endosc 2011; 73(1): 149−153.
39. Dolak W, Schreiber F, Schwaighofer H et al. Endoscopic radiofrequency ablation for malignant biliary obstruction: a nationwide retrospective study of 84 consecutive applications. Surg Endosc 2014; 28(3): 854−860.
40. Kallis Y, Phillips N, Steel A et al. Analysis of Endoscopic Radiofrequency Ablation of Biliary Malignant Strictures in Pancreatic Cancer Suggests Potential Survival Benefit. Dig Dis Sci 2015; 60(11): 3449−3455.
41. Strand DS, Cosgrove ND, Patrie JT et al. ERCP-directed radiofrequency ablation and photodynamic therapy are associated with comparable survival in the treatment of unresectable cholangiocarcinoma. Gastrointest Endosc 2014; 80(5): 794−804.
42. Roque J, Ho SH, Reddy N, Goh KL. Endoscopic ablation therapy for biliopancreatic malignancies. Clin Endosc 2015; 48(1): 15−19.
43. Tal AO, Vermehren J, Friedrich-Rust M et al. Intraductal endoscopic radiofrequency ablation for the treatment of hilar non-resectable malignant bile duct obstruction. World J Gastrointest Endosc 2014; 6(1): 13−19.
44. Brůha R, Petrtýl J, Kubecová M et al. Intraluminal brachytherapy and selfexpandable stents in nonresectable biliary malignancies − the question of long-term palliation. Hepatogastroenterology 2001; 48(39): 631−637.
45. Válek V, Kysela P, Kala Z et al. Brachytherapy and percutaneous stenting in the treatment of cholangiocarcinoma: a prospective randomised study. Eur J Radiol 2007; 62(2): 175−179.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Nové zobrazovací metody v endoskopické diagnostice nádorů trávicího ústrojí
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Maligní biliární obstrukce
- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Časná detekce sporadického karcinomu pankreatu
- Vyšetření mutace KRAS v EUS-FNA preparátech pacientů s tumorem pankreatu
- Na úvod nového ročníku
- Prognostický význam ART skóre u pacientů s intermediárním hepatocelulárním karcinomem
- Jubilanti − leden 2016
- Za profesorem Vratislavem Schreiberem
- Jubilanti − únor 2016
- Prof. MUDr. Josef Marek, DrSc., osmdesátiletý
- Kalendář odborných akcí – únor/březen 2016
- Editorial: Gastrointestinální onkologie – prevence, diagnostika i léčba
- Populační screening kolorektálního karcinomu v České republice
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Maligní biliární obstrukce
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Populační screening kolorektálního karcinomu v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání










