-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
Pancreatic cancer – current effective diagnostic and therapeutic approach
Pancreatic cancer is solid malignant, chemoresistant tumour with unfavourable prognosis. Radical resection with adjuvant chemotherapy is only potential curable therapeutic modality enabling to prolong survival of 20 % patients. Borderline conception contents active approach to primary non-resectable patients to reach resectability by neoadjuvant chemo(radio)therapy. Palliative and symptomatic therapy is indicated in about 70 % patients.
In the case of suspicious of pancreatic cancer, patient should be referral to specialized centre. Effective diagnostic therapeutic approach only guarantees optimal quality of life of these patients.Key words:
pancreatic cancer – diagnosis and therapy, multidisciplinary approach, quality of life
Autoři: prof. MUDr. CSc. Miroslav Ryska
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN Praha: U vojenské nemocnice 1200, Praha Fakulta zdravotnictva a sociální práce, Trnavská univerzita, Trnava 6
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 38-43
Kategorie: Přehledové články
Souhrn
Karcinom pankreatu je solidní zhoubný, chemoradiorezistentní nádor s nepříznivou prognózou. Radikální resekce je jedinou potenciálně kurabilní terapeutickou modalitou, která ve spojení s adjuvantní chemoterapií signifikantně prodlužuje přežití u 20 % pacientů. U 10–15 % nemocných s primárně neresekabilním nádorem (borderline) je v současné době preferován aktivní přístup prostřednictvím neodjuvantní chemo(radio)terapie k dosažení následné resekce. U 65–70 % nemocných je indikována paliativní či symptomatická terapie.
Při podezření na karcinom pankreatu je nutné odeslat pacienta co nejdříve na specializované pracoviště. Efektivní diagnostický a terapeutický přístup je pro tyto nemocné jedinou garancí zachování optimální kvality života.Klíčová slova:
karcinom pankreatu – diagnostika a terapie, multioborový přístup, kvalita životaÚvod
Karcinom pankreatu (PC) představuje v České republice po kolorektálním karcinomu druhé nejčastější nádorové onemocnění zažívacího traktu a šesté nejčastější nádorové onemocnění vůbec. S celkovou incidencí 10 nových případů na 100 tisíc obyvatel/rok, u věkových kategorií nad 60 let však s incidencí několikanásobně vyšší, je ČR na druhém místě ve světě, těsně za Japonskem (1). Z tohoto počtu se v 90 % případů jedná o adenokarcinom. Zbytek připadá na vzácné primární tumory, malignizované cystické tumory pankreatu, neuroendokrinní tumory a sekundární metastatická postižení. V širším klinickém pohledu lze mezi malignity hlavy pankreatu počítat i karcinom distálního žlučovodu a maligní ampulom – vyžadují shodnou chirurgickou terapii a přístup. Ampulom má oproti PC a karcinomu žlučových cest výrazně lepší prognózu.
5leté přežití pacientů všech stadií PC se dlouhodobě pohybuje pod 5 % (2). Nízké přežití dělá z PC celosvětově 4. nejčastější nádorovou příčinu úmrtí (3), kdy je mortalita téměř totožná s incidencí a roční počet úmrtí téměř dosahuje počtu úmrtí na nádory s několikanásobně vyšší incidencí (např. karcinomy prostaty u mužů a kolorektální karcinomy u žen). Přestože PC tvoří pouze 2,6 % hlášených zhoubných novotvarů, je příčinou 7 % úmrtí na nádor a jeho mortalita se na rozdíl od karcinomu prsu, prostaty a kolorektálního karcinomu za posledních 30 let spíše narůstá. Tato data ukazují jednak na velice agresivní biologickou povahu PC, ale také na velmi limitované možnosti prevence a screeningu.
Nehledě na skutečnost, že známe rizikové faktory, časné symptomy a subtyp diabetu T3cDM provázející PC (4), dosud nebyly stanoveny vhodné markery onemocnění. Opakované a kombinované vyšetřování pomocí zobrazovacích metod s vysokou rozlišovací schopností lze provádět pouze u vysoce rizikových skupin, nikoli však široce ve screeningu časných stadií. U části nemocných lze zaznamenat předcházející nově vzniklý diabetes a zvýšení sérových hodnot CA 19-9. Nicméně diagnostický přínos hodnota CA 19-9 nemá, neboť zvýšené hladiny nacházíme i u jiných, zčásti i benigních onemocnění (5). Pozdní diagnózu potvrzuje i zastoupení jednotlivých klinických stadií v České republice, kdy převažuje IV. stadium (70 %) s rostoucím meziročním trendem a malé počty ostatních stadií se stabilními počty (viz www.svod.cz).
Jedinou šancí na dlouhodobé přežívání pacientů s PC je multimodální léčba, ve které hraje zásadní roli radikální resekce. Nepříznivým faktem zůstává, že resekabilních je jen 20 % nemocných. Nález hodnocený jako lokálně pokročilý bez vzdálených metastáz, ale neresekabilní očekávejme u 30 % pacientů (6). Více než 50 % tvoří pacienti s generalizovaným onemocněním. Medián přežití pacientů podstupujících resekční výkon s kurativním záměrem doplněný adjuvantní chemoterapií dosahuje 20–24 měsíců, 5leté přežívání 20 %, zatímco medián přežití lokálně pokročilého karcinomu pankreatu se pohybuje pouze mezi 9 a 13 měsíci (7).
Vysvětlením špatných výsledků současné léčby je pravděpodobně skutečnost, že PC se vyvíjí relativně pomalu, přibližně v průběhu deseti let, a my jej léčíme až v jeho terminální fázi. Onemocnění je pak třeba chápat jako systémové, nikoli jako lokální a regionální (8). Nádor se navíc nešíří jenom lymfatickými cévami, ale také perineurálně.
Omezené možnosti prevence a časné diagnostiky vedoucí k nálezu pokročilých stadií onemocnění při prvním kontaktu s lékařem, rekurence po radikálním resekčním výkonu, malá efektivita systémové protinádorové léčby a krátké přežívání (např. ve srovnání s kolorektálním karcinomem) často u lékařské veřejnosti způsobují přetrvávající pocit terapeutické beznaděje. Ta finálně vede nejen k podceňování současných terapeutických možností, ale mnohdy i ke špatné klinické praxi. Řada nemocných je dlouze vyšetřována a tím je promarněna doba vhodná k provedení resekčního výkonu (9). Neuspokojivé výsledky a ekonomická neefektivita takového postupu jsou zřejmé. Mnohdy nejsou respektovány poznatky týkající se kvality života v závislosti na zvolené léčebné metodě (10). Z těchto důvodů nemalé procento nemocných z poskytované terapie v naší republice neprofituje. Část nemocných navíc krátký úsek zbývajícího života stráví ve zdravotnickém zařízení, ať již s komplikací málo efektivní léčby nebo v marné naději na vyléčení.
Cílem následujícího sdělení je proto na základě klinické praxe stručně prezentovat současný efektivní diagnosticko-terapeutický postup.
Symptomy onemocnění
PC je v 70 % lokalizován v hlavě pankreatu s rozvojem obstrukčního ikteru (11). Omezení odtoku žluče obvykle vede k bezbolestnému zvětšení žlučníku, ke Courvoisierovu znamení. Ojediněle může být prvním projevem akutní cholangitida s Charcotovou trias a sepsí. Obdobně uzávěr pankreatického vývodu vede k jeho dilataci a výjimečně může vyústit i v projevy akutní pankreatitidy. Nespecifické příznaky jako bolesti v zádech, horní dyspepsie, nechutenství a váhová redukce přivádějí pacienta k lékaři zpravidla ve stadiu lokálně pokročilého onemocnění, nebo dokonce generalizace. Růst PC vzdáleně od intrapankreatické části žlučovodu nevede k obstrukci žlučovodů, jedinými symptomy tak zůstávají bolest s dyspepsií. Lokalizace PC na oblast těla a kaudy pankreatu, ale i na oblast processus uncinatus proto znamená velmi často neresekabilitu.
Přibližně 85 % nemocných se před manifestací PC nově objeví porucha glukózové tolerance, resp. diabetes mellitus (4).
Stanovení stagingu onemocnění
Časná stadia jsou vesměs diagnostikována náhodně, u asymptomatických nemocných. Rutinně užívané ultrasonografické abdominální vyšetření, které může takovou patologii odhalit, má přesnost 67–90 % (12). Přesné zobrazení se stanovením stagingu však toto vyšetření neumožňuje.
Klíčová pro zhodnocení nálezu a resekability je výpočetní tomografie (CT) dle standardního protokolu (max. 1mm řezy, 3 kontrastní fáze: parenchymatózní, arteriální, portální) bez použití orálně podané kontrastní látky. Není chybou, když primárně provedené CT vyšetření v rámci stanovení základní diagnózy tato kritéria nesplňuje. V centru, kam má být pacient s diagnózou PC nebo s podezřením na PC urychleně odeslán, je nutné jej ke stanovení stagingu urychleně opakovat. Mimo vyhodnocení lokálních charakteristik tumoru (velikost, lokalizace, vztah k tepnám a žilám) nám přináší informaci o přítomnosti sekundarit, volné tekutiny v dutině břišní nebo ložiskového postižení peritonea. Tedy o známkách generalizace nemoci a neresekabilitě.
Druhým zásadním vyšetřením, které upřesní staging PC, je endoultrasonografie (EUS) doplněná o tenkojehlovou aspirační biopsii (FNAB). Kromě zobrazení lokalizace a velikosti tumoru je EUS přínosná v hodnocení žilní a tepenné angioinvaze, zvláště je-li použito dopplerovské mapování krevního toku (13). FNAB může morfologicky potvrdit suspekci na malignitu. Není však podmínkou indikace operačního řešení. Podstatná je cytologická či histologická verifikace PC získaná prostřednictvím FNAB u neresekabilních tumorů. Podmiňuje podání paliativní chemoterapie.
CT a EUS tvoří základní rámec hodnocení stagingu onemocnění a především resekability. CT a magnetická rezonance (MRI) jsou vzájemně zastupitelné modality a v naprosté většině případů není nutné provádět obě vyšetření současně.
Endoskopickou retrográdní cholangiopankreatografii (ERCP) nelze v současné době považovat u nemocných s PC za diagnostický prostředek. Nepodává informaci ani o velikosti tumoru, ani o angioinvazi. Předoperační dekomprese žlučových cest zavedením stentu nejen nevede k lepším výsledkům resekčního výkonu, ale navíc způsobuje signifikantně vyšší výskyt pooperačních komplikací (14). Nehledě na tyto skutečnosti se nadále u většiny nemocných ERCP provádí jako první výkon s přesvědčením, že je třeba co nejrychleji ošetřit obstrukční ikterus. Pacienti tak odcházejí na CT se zpožděním. Při resekčním výkonu je stent odstraněn jako nadbytečný. ERCP může být v této fázi vyšetření přínosná u nemocných, u kterých představuje možnost histologické verifikace tumorů Vaterovy papily či distálního žlučovodu (kartáčová biopsie) a je indikována u nemocných s cholangitidou nebo při předpokladu zpoždění chirurgického výkonu.
Řešení obstrukčního ikteru před stanovením stagingu PC (a tím i terapeutického postupu) perkutánní transhepatickou drenáží (PTD) je pro pacienta velmi nešťastné.
Pozitronová emisní tomografie (PET) může být přínosná s cílem detekce diseminace onemocnění. V současné době není uváděna v rámci standardního vyšetřování (12) a až na výjimky by čekání na její provedení nemělo být důvodem k oddálení prezentace pacienta na multioborové komisi s cílem indikovat či neindikovat radikální resekci.
U všech nemocných s PC je nutné před zahájením léčby staging provést. Jen tak je možné zodpovědně rozhodnout o efektivním terapeutickém postupu u konkrétního pacienta. U větší části nemocných, u kterých není indikována chirurgická léčba, je tento staging de facto definitivní. U menší části nemocných je stagingem předoperačním. Celé období vyšetřování se stanovením léčebného postupu je nutné provést co nejrychleji. Nemělo by být delší než 2 týdny.
Po stanovení stagingu lze pacienty s PC rozdělit na: A) primárně resekabilní: T1–2; B) borderline resekabilní: T3; C) neresekabilní pro lokálně pokročilý nález: T4; D) neresekabilní pro metastatickou formu onemocnění: T3–4, M1 (12). Hodnocení „N“ v úvaze o výběru optimální terapii hraje okrajovou roli a je záměrně vynecháno.
Indikace k resekčnímu výkonu nebo k paliativní léčbě
Resekabilní jsou tumory ve stadiu I a II, resekabilita ve III. stadiu je určena typem vaskulární invaze. Obecně je akceptováno, že žilní invaze do portomezenterického segmentu není kontraindikací k resekci a odstranění části žilní stěny nebo její náhrada, přinášejí stejné výsledky jako resekce provedené u tumorů bez angioinvaze.
Oproti tomu arteriální invaze do arteria hepatica communis či truncus coeliacus nebo do arteria mesenterica superior je chápána jako znak lokální pokročilosti onemocnění a resekční výkony u takových tumorů nepřinášejí očekávané výsledky (15,16). Rozšířené výkony neprokázaly pozitivní vliv na prodloužení přežívání (17).
Stanovení peroperačního stagingu onemocnění
V průběhu operace porovnáváme rozsah patologického nálezu s předoperačním stagingem a stanovíme staging peroperační. Hodnocení resekability během operačního výkonu znamená vyloučení metastatického rozsevu, vyloučení arteriální angioinvaze do a. mesenterica superior a do truncus coeliacus a vyloučení prorůstání do okolních orgánů.
Radikální resekční výkon znamená odstranit postiženou část slinivky s provedením standardní lymfadenektomie. Při lokalizaci v hlavě pankreatu provádíme proximální pankreatoduodenektomii (obr. 1), při lokalizaci v těle a v kaudě levostrannou pankreatektomii se splenektomií (obr. 2). Podmínkou radikality je průkaz negativních okrajů resekátu. Rekonstrukce po resekci portomezenterického segmentu při prorůstání tumoru do žilní stěny se většinou zdaří bez náhrady prostým přiblížením a sešitím okrajů (obr. 3, 4). Při negativních resekčních okrajích lze považovat resekci za radikální. Totální pankreatektomie není v současné době považována u PC za standardní výkon (obr. 5). Odstranění jaterních metastáz (obr. 6) není v rámci standardní terapie indikováno (25).
Obr. 1. Stav po proximální pankreatoduodenektomii se standardní lymfadenektomií (peroperační foto) 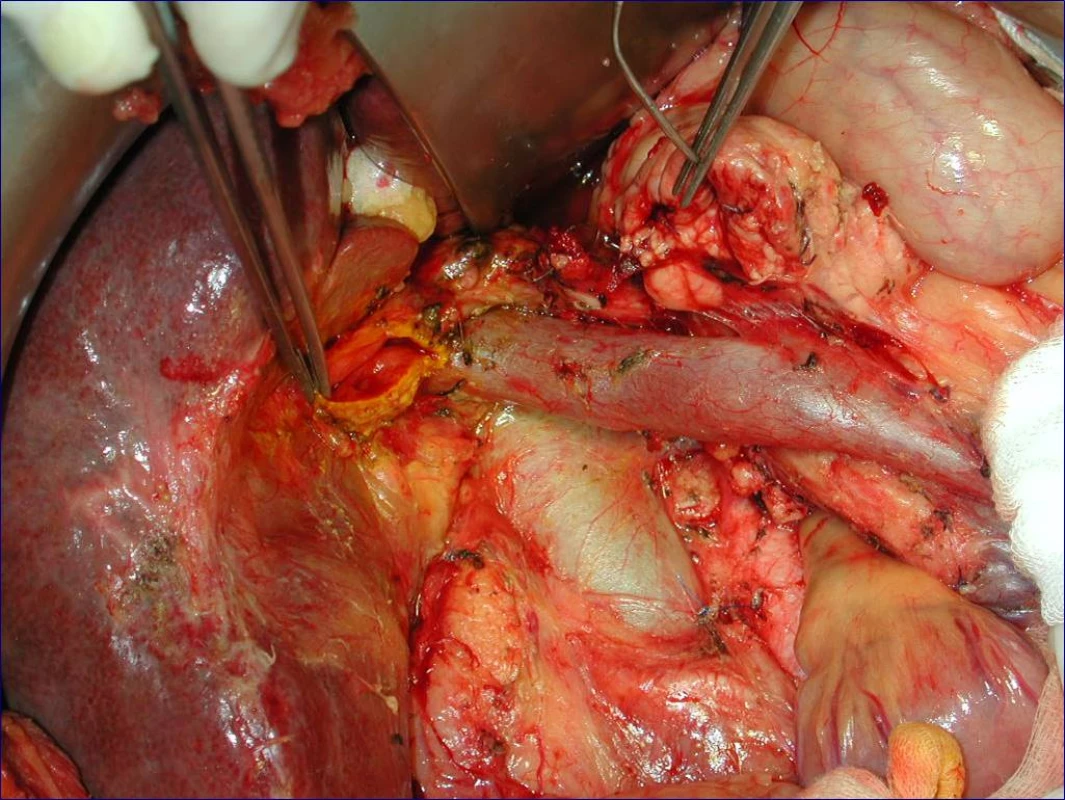
Obr. 2. Levostranná pankreatektomie se splenektomií (preparát) 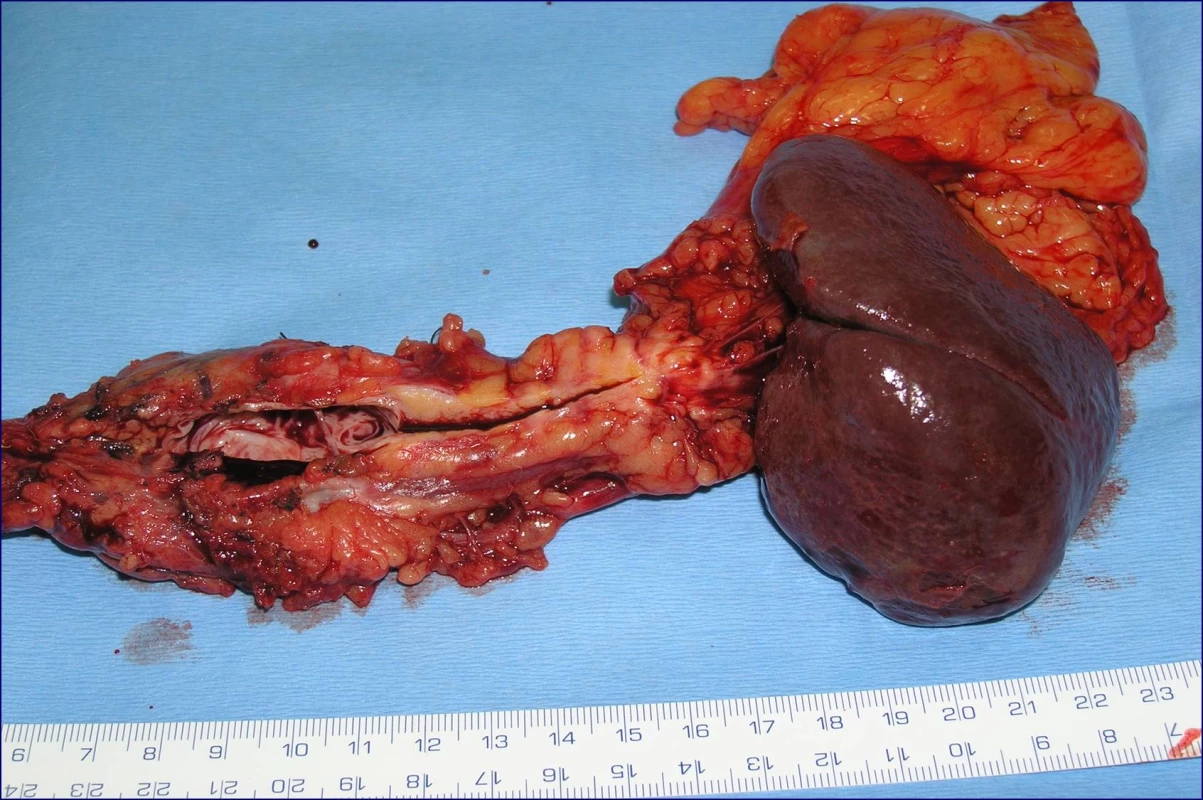
Obr. 3. Stav po proximální pankreatoduodenektomii se standardní lymfadenektomií a resekci portomezenterického segmentu (peroperační foto) 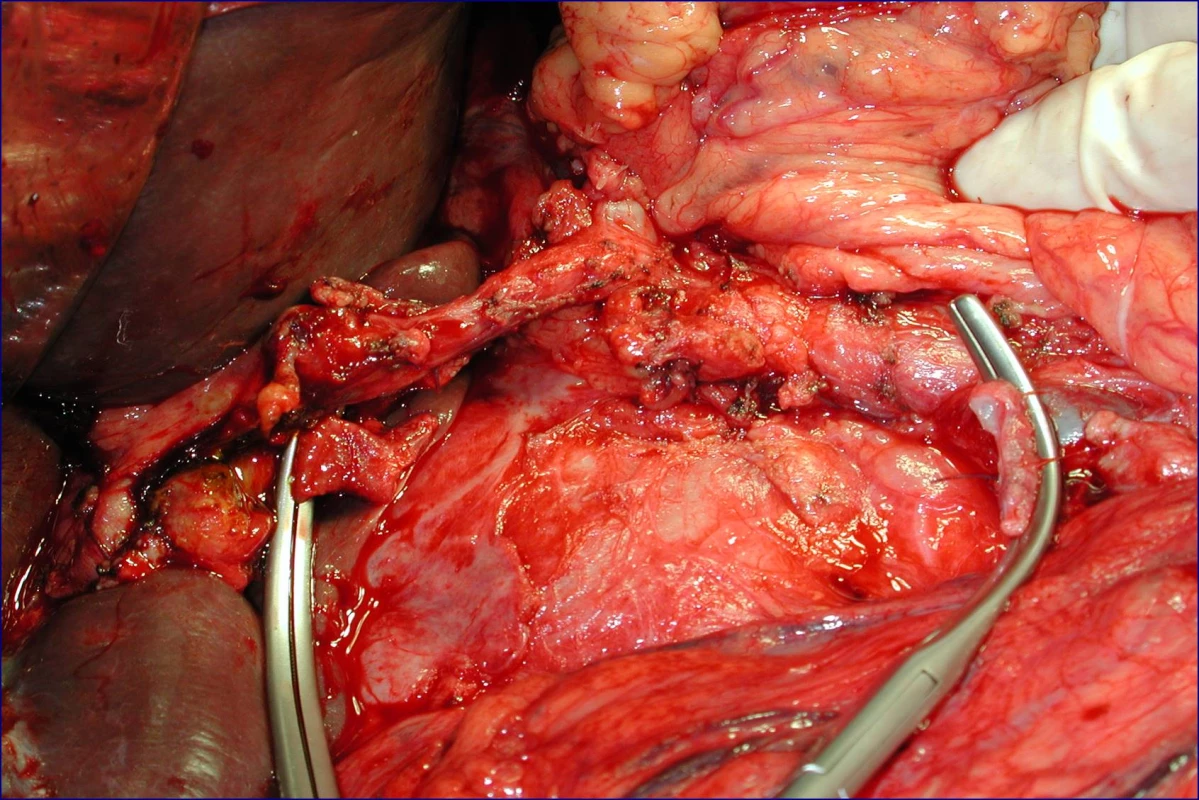
Obr. 4. Stav po provedení žilní rekonstrukce u téhož pacienta (peroperační foto) 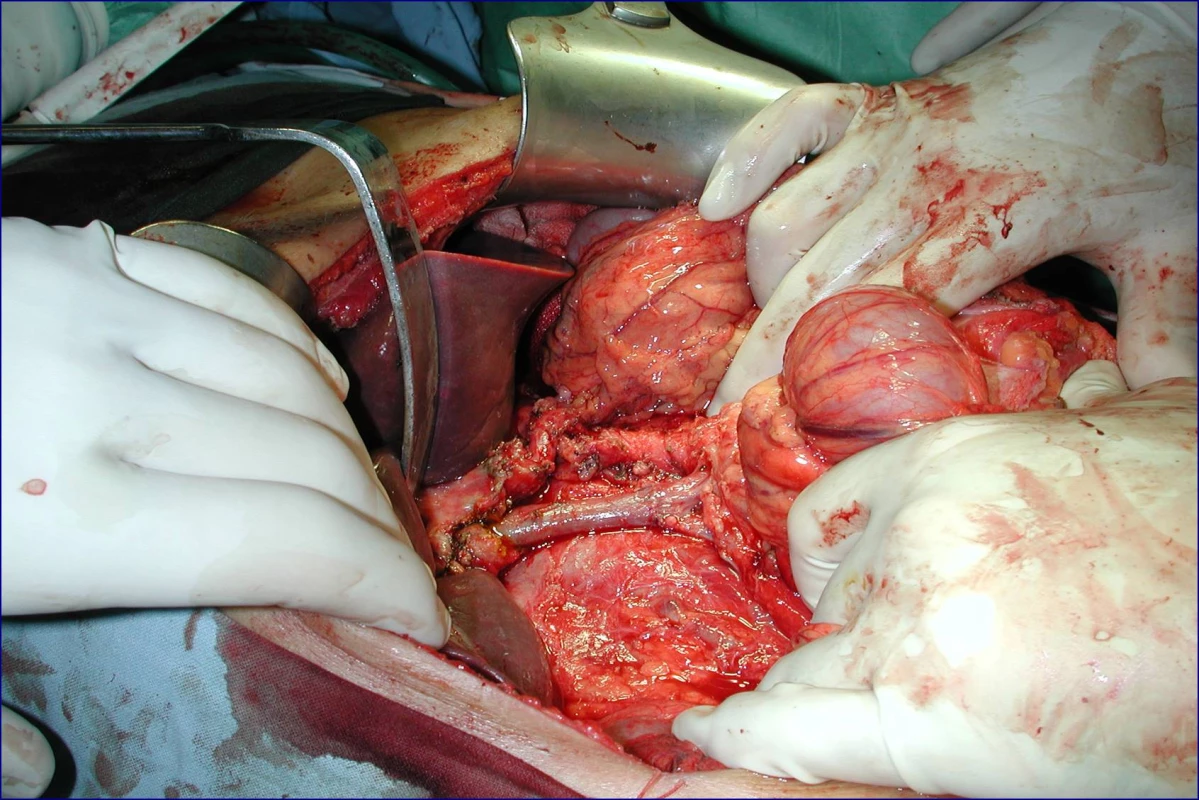
Obr. 5. Totální pankreatektomie se splenektomií (preparát) 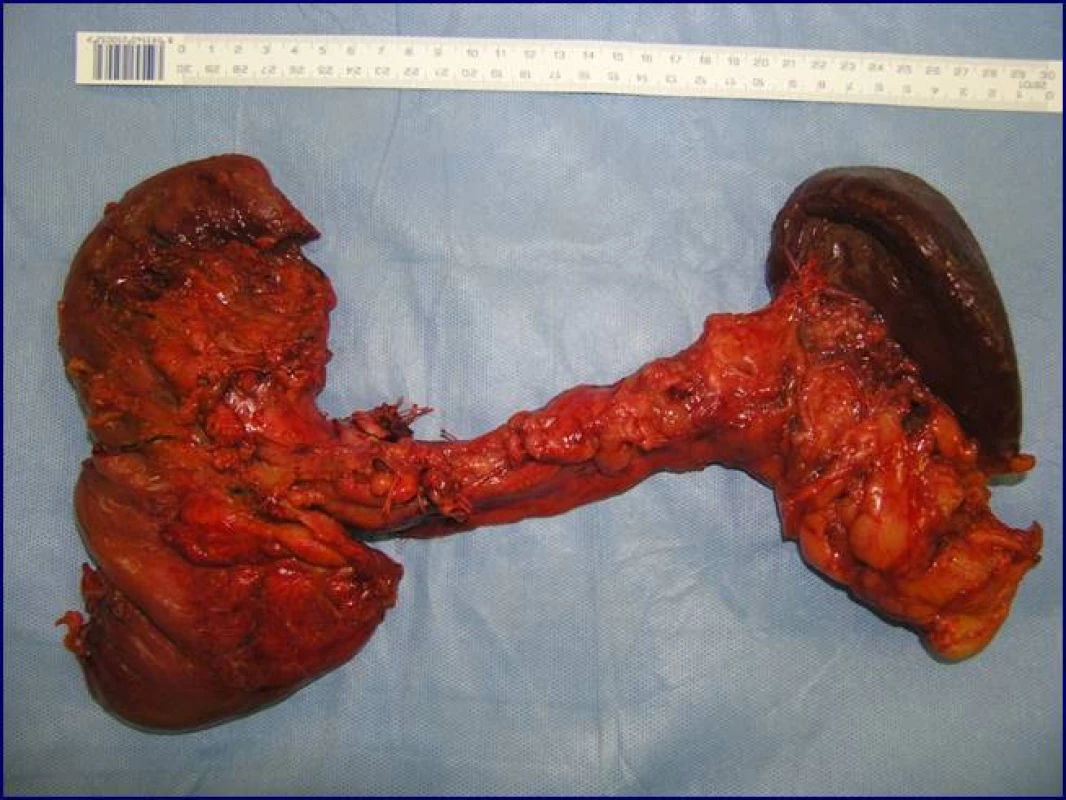
Obr. 6. Jaterní metastáza při duktálním adenokarcinomu hlavy pankreatu (peroperační nález) 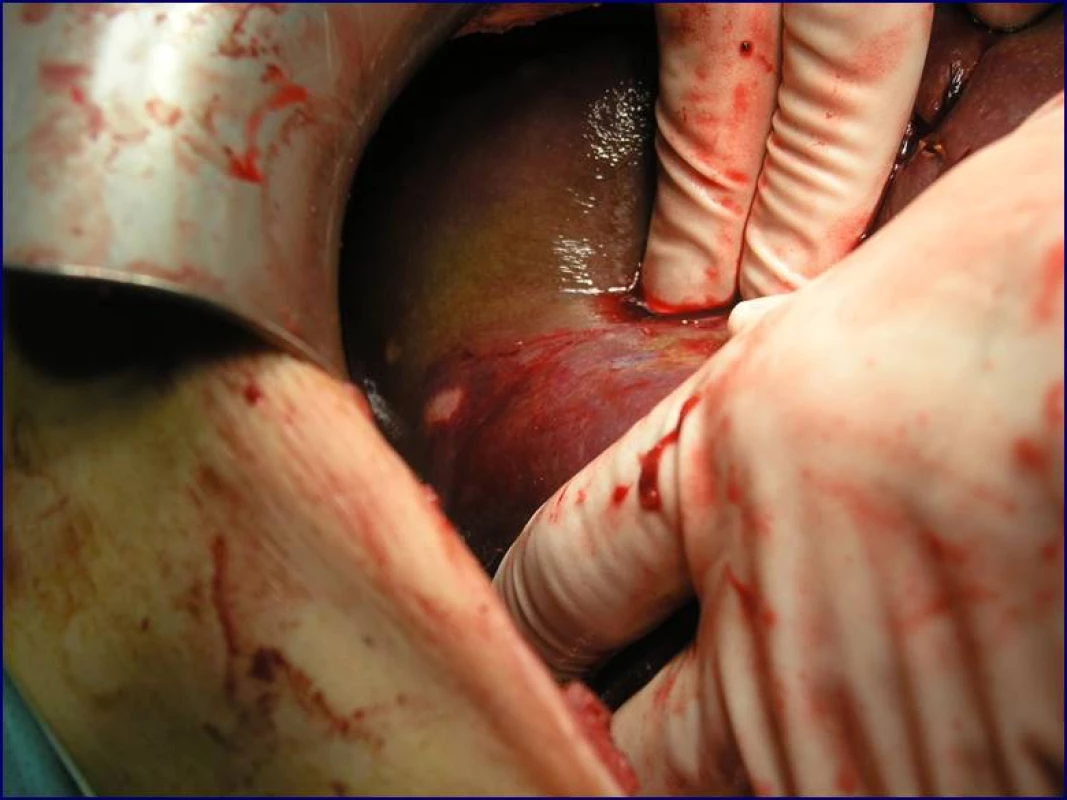
Operační nález se liší od předoperačního stagingu až u třetiny nemocných. V naprosté většině případů se jedná o staging vyšší. V této skupině tak můžeme očekávat neplánované explorace nebo místo plánovaného resekčního výkonu zvažujeme provedení paliativního výkonu, zejména biliodigestivní anastomózy. Není chybou anastomózu provést, nicméně ponechání již endoskopicky zavedeného, snadno vyměnitelného stentu výkon zjednoduší a omezí ho pouze na transduodenální odběr bioptických vzorků tru-cut jehlou u těch nemocných, u kterých nebyla malignita ověřena pomocí FNAB. Gastrojejunoanastomózu preventivně neprovádíme.
Při pokročilém nálezu, tj. při stanovení stagingu T3–4, N1–2 a M0–1, indikujeme paliativní terapii. U některých mladých nemocných nebo starších nemocných v dobrém biologickém stavu můžeme provést paliativní resekci, a to především z psychologického hlediska. Plánované provedení biliodigestivní anastomózy indikujeme při obtížích s výměnou stentu při relativně delší prospekci života nemocného. Gastroenteroanastomóza je u těchto nemocných indikována ojediněle, a to v případě obstrukce duodena tumorem. Nicméně její průchodnost nemusí znamenat obnovu pasáže. Důvodem je porucha motility žaludku a tenkého střeva způsobená základním onemocněním.
Komplikace resekčních výkonů
Ačkoliv se časná letalita resekce pankreatu v posledních 25 letech výrazně snížila a ve specializovaných centrech nepřevyšuje 3–5 % (18), morbidita dosahuje až 60 % (19). Nejzávažnějšími komplikacemi jsou dehiscence pankreatodigestivní anastomózy s rozvojem pankreatické a často i enterální píštěle, krvácení a nitrobřišní infekt. Pankreatická píštěl se vyskytuje v 10–28,5 % případů (20). U části nemocných znamená časnou reoperaci s dlouhodobou pooperační hospitalizací.
Prevencí pooperační pankreatitidy je šetrná operační technika a vyloučení peroperační teplé ischemie pankreatu. Příčinou krvácení do GIT bývá peptická ulcerace, krvácení z anastomóz, arodovaný arteriální pahýl s rupturou do tenkého střeva nebo natrávená stěna cévy pankreatickou šťávou.
Protrahované poruchy vyprazdňování žaludku můžeme sledovat po proximální resekci pankreatu u 33–45 % nemocných (21). I když není spojena s vyšší mortalitou, je příčinou prodloužené hospitalizace a tím i zvýšení nákladů na léčbu. Časná enterální výživa se ukazuje jako vhodná prevence této komplikace.
Koncepce borderline resekability
Nízká operabilita nemocných s PC a skutečnost, že předoperační staging u části nemocných nevystihuje pokročilost onemocnění, vedly k úvaze o neoadjuvantní chemoterapii již na začátku 90. let, kdy některé klinické studie prokázaly její přínos u primárně radikálně neresekovatelných nemocných.
Koncept postupu u tzv. boderline resekabilních PC zformulovali Katz et al. (22 – upraveno):
- Kompletní odstranění nádoru a lymfatických uzlin s negativními okraji je podmínkou dlouhodobého přežívání, a to včetně nádorem postiženého žilního portomezenterického segmentu.
- Resekce postižené části a. hepatica je také podmínkou dlouhodobého přežití, nikoli však resekce postižené části a. mesenterica sup.
- Tzv. downstagingu je možné podáním cytotoxických látek samotných nebo v kombinaci s radioterapií dosáhnout zřídka.
- Neoadjuvantní chemoterapii či chemoradioterapii je možné podat u vybraných nemocných s cílem dosažení následného radikálního výkonu. Neoadjuvantní léčba je vhodná pouze u nemocných, u kterých je obava, že při primární resekci neodstraníme nádor kompletně.
Byť Katzova definice nebyla konsenzuálně přijata, její další upřesnění se týkala pouze stupně angioinvaze do stěny a. mesenterica sup. a preference anatomických poměrů před klinickými (23). Od neoadjuvantní terapie neočekávejme downstaging, ale stabilizaci rentgenologického nálezu bez rozvoje metastáz. Takový pacient je po absolvování dvouměsíční neoadjuvantní chemo(radio)terapie indikován k radikální resekci (24, 25). Je třeba zmínit, že toto dělení nemocných s PC na primárně resekabilní, boderline resekabilní a lokálně či generalizovaně neresekabilní se nikterak nepromítlo do probíhajících populačních studií.
Bylo provedeno několik klinických studií, většinou retrospektivních v rámci jedné instituce, s různými neodjuvantními protokoly, postavenými většinou na bázi gemcitabinu, kapecitabinu nebo 5FU v rámci chemoterapie či chemoradioterapie s dosažením resekce R0 u 78–91 % nemocných a celkovým přežitím shodným s přežitím u primárně resekovatelných (26, 27). Na rozdíl od USA evropská pracoviště upřednostňují chemoterapii před chemoradioterapií. Ve vztahu k negativnímu výsledku klinické studie FFCD/SFRO nelze opominout vysvětlení možného detrimentálního efektu chemoradioterapie aktivací signálních drah MET a MAPK (28, 29). Absence jednotného protokolu tak vede k nejasnostem v zařazení pacientů této skupiny do klinických studií. Nutnost standardizace celého postupu je zřejmá.
V České republice dosud relevantní data publikována nebyla. Vlastní zkušenosti máme pouze se 2 pacienty, u kterých neoadjuvantní chemoterapie při primárně neresekabilním nálezu znamenala výraznou rentgenologickou regresi s následnou možností provedení radikálního resekčního výkonu.
Adjuvantní léčba a její indikace
Byť je přínos pooperační chemoterapie, intraoperační nebo pooperační radioterapie, hormonální terapie či imunoterapie v současné době limitován, velké randomizované studie (CONKO-001, ESPAC-3) prokázaly její signifikantní přínos u nemocných po provedené radikální resekci. Nebyl prokázán signifikantní rozdíl mezi podáním 5FU/FA a gemcitabinem. Gemcitabin je však pacientem významně lépe snášen. Nebyl prokázán signifikantní přínos adjuvantní chemoradioterapie ve studii ESPAC-1 (30).
Biologická protinádorová léčba doposud nesplnila do ní vkládaná velká očekávání a její podávání je předmětem klinických studií.
Výsledky
Průměrné přežití u neoperovaného nemocného nebo po paliativním operačním výkonu je uváděno v rozmezí 4–6 měsíců, po resekčním výkonu 15–18 měsíců s mediánem rekurence 8–9 měsíců (7, 15–18). Celkové pětileté přežití u nemocných s PC je uváděno v 5 %, nicméně radikální resekce v rámci multimodální léčby tento podíl zvyšuje až na 20 % (15).
Porovnání mediánu přežívání u neresekovaných a radikálně resekovaných nemocných proto jednoznačně hovoří ve prospěch radikálně resekovaných. Adjuvantní chemoterapie signifikantně prodlužuje přežívání u radikálně operovaných. Proto by měla být podávána u všech nemocných po provedené radikální resekci, v ČR v souladu se „Zásadami cytostatické terapie maligních onkologických onemocnění“ (tč. 11. vydání).
Faktory ovlivňující přežívání po resekčním výkonu
Nezávislými faktory ovlivňujícími přežívání nemocného s PC jsou lokalizace nádoru, jeho velikost (T > 2 cm), přítomnost N2–3 uzlin (25) a angioinvazivita. Horší prognóza u nemocných s karcinomem v oblasti processus uncinatus je způsobena pozdními klinickými příznaky. Negativními faktory jsou grading (31) a pozitivita resekční plochy (32, 33). Perineurální šíření nádoru patří jednoznačně k velmi nepříznivým faktorům u duktálního karcinomu pankreatu. Peroperační převod krve snižuje šanci nemocného na dlouhodobé přežívání. Negativní vliv na dlouhodobé přežívání nemá ikterus (bilirubin > 100 μmol/l). Předoperační ztráta na váze a provedení rozšířeného operačního výkonu nemá signifikantní význam pro dlouhodobé přežívání nemocného (11).
Nepochybný vliv má biologická povaha nádoru: buněčná diferenciace a přítomnost mutovaných onkogenů a supresorových genů. Jednoznačný je vztah mezi počtem resekčních výkonů provedených na chirurgickém pracovišti s perioperační mortalitou a morbiditou. Je také argumentem pro centralizaci těchto nemocných.
Závěr
Karcinom pankreatu je šestou nejčastější malignitou. Jde o solidní zhoubný nádor s nepříznivou prognózou. Medián přežívání u pacientů s neresekabilním nádorem je velmi nízký.
Kontrastní CT je zásadním vyšetřením pro stanovení stagingu onemocnění. Endoskopická ultrasonografie s FNAB staging upřesní a morfologickou verifikací umožní podávat paliativní chemoterapii. Angioinvazi do arteria mesenterica sup. a do truncus coeliacus považujeme za projev pokročilosti onemocnění – provedení resekčního výkonu neznamená prodloužení života. ERCP není u nemocných s karcinomem pankreatu diagnostickou metodou. Její provedení se zavedením stentu žlučových cest je indikováno jako součást paliativní léčby. PET nepatří do standardního vyšetřovacího protokolu.
Radikální resekce je jedinou potenciálně kurabilní terapeutickou modalitou, která ve spojení s adjuvantní chemoterapií signifikantně prodlužuje přežití. Je proveditelná u 20 % pacientů a znamená 20% 5leté přežívání. U 80 % nemocných je indikována paliativní či symptomatická terapie. Cílem radikální resekce je signifikantně prodloužit život a jeho kvalitu při nízkém riziku perioperačního úmrtí. Smyslem paliativní a symptomatické terapie je zkvalitnit nemocnému zbytek života.
Vzhledem k současným poznatkům v onkogenezi karcinomu pankreatu je nutné celý diagnosticko-terapeutický proces zkvalitnit. Při podezření na karcinom pankreatu je třeba odeslat pacienta co nejdříve na specializované pracoviště s funkčním multioborovým týmem, které je schopno zajistit efektivní léčbu včetně celoživotního dispenzáře.
Přetrvávající pocit beznaděje u části odborné veřejnosti je nutné nahradit racionálním postupem. Jen tak lze pacientům s karcinomem pankreatu v rámci současného poznání efektivně pomoci.
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Práce byla podpořena granty IGA MZČR NT 13 263 a ZRO MO 1012.
Korespondenční adresa
prof. MUDr. Miroslav Ryska, CSc.
Chirurgická klinika 2. lékařské fakulty UK a Ústřední vojenské nemocnice − Vojenské fakultní nemocnice Praha
U vojenské nemocnice 1200
160 00 Praha 6
e-mail: miroslav.ryska@uvn.cz
Zdroje
1. Dušek L, Kubásek M, Koptíková J et al. Epidemiologie zhoubných nádorů v České republice. Dostupné na: http://www.svod.cz
2. Hidalgo M. Pancreatic cancer. N Engl J Med 2010; 362 : 1605–1617.
3. Siegel R, Ma J, Zou Z et al. Cancer statistics, 2014. CA Cancer J Clin 2014; 64 : 9–29.
4. Cui Y, Andersen DK. Diabetes and pancreatic cancer. Endocr Relat Cancer 2012; 19: F9–F26.
5. Frebourg T, Bercoff E, Manchon N et al. The evaluation of Ca 19-9 antigen level in the early detection of pancreatic cancer. A prospective study of 866 patients. Cancer 1988; 62 : 2287–2290.
6. Oettle H, Neuhaus P, Hochhaus A et al. Adjuvant chemotherapy gemcitabine and long-term outcomes among patients with resected pancreaticcancer: the CONKO-001 randomized trial. JAMA 2013; 310 : 1473–1481.
7. Heinemann V, Haas M, Boeck S. Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer. Ann Oncol 2013; 24 : 2484–2492.
8. Yachida S, Jones S, Bozic I et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature 2010; 467 : 1114–1117.
9. Cooper M, Newman NA, Ibrahim AM et al. Unnecessary tests and procedures in patients presenting with solid tumors of the pancreas. J Gastrointest Surg 2013; 17 : 1218–1223.
10. Ryska M, Dušek L, Pohnán R et al. Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu. Multicentrická prospektivní studie. Rozhl Chir 2012; 91 : 207–216.
11. Ducreux M, Cuhna AS, Caramella V et al. Cancer of the pancreas: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; Suppl. 5: v56–v68.
12. Pietryga JA, Morgan DE. Imaging preoperatively for pancreatic adenocarcinoma. J Gastrointest Oncol 2015; 6 : 343–357.
13. Ardengh JC, Malheiros CA, Pereira V et al. Endoscopic ultrasound-guided fine-needle aspiration using helical computerized tomography for TN staging and vascular injury in operable pancreatic carcinoma. JOP 2009; 10 : 310–317.
14. Petr WT, Pistes MD, Wayne A et al. Effect of praeoperative biliary decompression on pancreaticoduodenectomy – associated morbidity in 300 consecutive patients. Ann Surg 2001; 234 : 47–55.
15. Tempero, MA, Arnoletti JP, Behrman SW et al. Pancreatic adenocarcinoma, vision 2.2012: featured updates to the NCCN guidelines. J Natl Compr Canc Netw 2012; 10 : 703–713.
16. Glanemann M, Shi B, Liang F et al. Surgical strategies for treatment of malignit pancreatic tumors: extended, standard or local surgery? World J Surg Oncol 2008; 6 : 123.
17. Nimura Y, Nagino M, Takao S et al. Standard versus extended lymphadenectomy in radical pancreatoduodenectomy for ductal adenocarcinoma of the head of the pancreas. Long-term results of a Japanese multicenter randomized controlled trial. J Hepatobiliary Pancreat Sci 2012; 19 : 230–241.
18. Hariharan D, Saied A, Kocher HM. Analysis of mortality rates for pancreatic cancer across the word. HPB 2008; 10 : 58–62.
19. Büchler MW, Wagner M, Schmied BM et al. Changes in morbidity after pancreatic resection. Toward the end of completion pancreatectomy. Arch Surg 2003; 138 : 1210–1314.
20. Faccioli N, Foti G, Molinari E et al. Role of fistulography in evaluating pancreatic fistula after pancreaticoduodenectomy. BJR 2012; 85 : 219–224.
21. Gerritsen A, Wennink RAW, Besselink MGH et al. Early oral feeding after pancreatoduodenectomy enhances recovery without increasing morbidity. HPB 2014; 16 : 656–664.
22. Katz MH, Marsh R, Herman JM et al. Borderline resectable pancreatic cancer: need for standardization and methods for optimal clinical trial design. Ann Surg Oncol 2013; 20 : 2787–2795.
23. Lopez NE, Prendergast C, Lowy AM. Borderline resectable pancreatic cancer: definitions and management. WJG 2014; 20 : 10740–10751.
24. Katz MH, Fleming JB, Bhosale P et al. Response of borderline resectable pancreatic cancer to neoadjuvant therapy is not reflected by radiographic indicators. Cancer 2012; 118 : 5749–5756.
25. Nentwich MF, König A, Izbicki JR. Limit of surgery for pancreatic cancer. Rozhl Chir 2014; 93 : 445–449.
26. Chuong MD, Springett GM, Freilich JM et al. Stereotactic body radiation therapy for locally advanced and borderline resectable pancreatic cancer is effective and well tolerated. Int J Radiat Oncol Biol Phys 2013; 86 : 516–522.
27. Barugola G, Partelli S, Crippa S et al. Outcomes after resection of locally advanced or borderline resectable pancreatic cancer after neoadjuvant therapy. Am J Surg 2012; 203 : 132–139.
28. Chauffert B et al. Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5‑FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer. Definitive results of the 2000–2001 FFCD/SFRO study. Ann Oncol 2008; 19 : 1592–1599.
29. Ohuchida K et al. Radiation to stromal fibroblasts increases invasiveness of pancreatic cancer cells through tumor–stromal interactions. Cancer Res 2004; 64 : 3215–3222.
30. Neoptolemos JP, Stocken DD, Bassi C, et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 2010; 304 : 1073–1081.
31. Pawlik TM, Gleisner AL, Cameron JL et al. Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer. Surgery 2007; 141 : 610–618.
32. Rochefort MM, Ankeny JS, Kadera BE et al. Impact of tumor grade on pancreatic cancer prognosis: validation of a novel TNMG staging system. Ann Surg Oncol 2013; 20 : 4322–4329.
33. Verbeke CS, Leitch D, Menon KV et al. Redefining the R1 resection in pancreatic cancer. Br J Surg 2006; 93 : 1232–1237.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Maligní biliární obstrukceČlánek Na úvod nového ročníkuČlánek Jubilanti − leden 2016Článek Jubilanti − únor 2016
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Nové zobrazovací metody v endoskopické diagnostice nádorů trávicího ústrojí
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Maligní biliární obstrukce
- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Časná detekce sporadického karcinomu pankreatu
- Vyšetření mutace KRAS v EUS-FNA preparátech pacientů s tumorem pankreatu
- Na úvod nového ročníku
- Prognostický význam ART skóre u pacientů s intermediárním hepatocelulárním karcinomem
- Jubilanti − leden 2016
- Za profesorem Vratislavem Schreiberem
- Jubilanti − únor 2016
- Prof. MUDr. Josef Marek, DrSc., osmdesátiletý
- Kalendář odborných akcí – únor/březen 2016
- Editorial: Gastrointestinální onkologie – prevence, diagnostika i léčba
- Populační screening kolorektálního karcinomu v České republice
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Maligní biliární obstrukce
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Populační screening kolorektálního karcinomu v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



