-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZměny v genové expresi během inzulínové rezistence a „diabezity“ v inzulín-senzitivních tkánícha možnosti jejich regulace
Gene Expression Changes During Insulin Resistance and „Diabesity“ in Insulin-sensitive Tissues and Possibilities of Their Regulation
Type 2 diabetes mellitus (T2DM) gains considerable and pandemic proportions and becomes noticeable problem in a social and economic sphere. In spite of all effort, exact mechanism of T2DM origin has not been elucidated yet. Studying of transcriptom is one possibility how to explain pathophysiological processes in insulin-sensitive tissues. Obtained data can serve as a base for predicting of new therapeutic targets of this disease. This overall review introduces crucial genes whose level of products changes during T2DM. The article gives notice to a diet composition, which is an important environmental factor, which is able to influence a disease outbreak. Not only the role of fats, but also influence of some plant compounds, which would be able to serve as an alternative to present prophylaxis or treatment of T2DM, have been discussed.
Key words:
type 2 diabetes mellitus; transcriptom; chronic inflammation; therapeutic target.
Autoři: J. Hošek; M. Bartoš
Působiště autorů: Ústav přírodních léčiv, Farmaceutická fakulta, Veterinární a farmaceutická univerzita, Brno
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 360-366
Kategorie: Přehledový článek
Souhrn
Diabetes mellitus typu 2 (T2DM) nabývá v dnešní době pandemických rozměrů a stává se výraznou zátěží sociální a ekonomické sféry. Přes veškerou snahu není ani dnes detailně znám přesný mechanismus vzniku T2DM. Jednou cest jak studovat patofyziologické pochody v inzulín-senzitivních tkáních je studium transkriptomu. Takto získané údaje mohou posloužit jako základ pro vytipování nových vhodných terapeutických cílů toho onemocnění. Přehledový článek souhrnně představuje nejvýznamnější geny, u kterých se mění hladina jejich produktů v průběhu diabetu. Současně upozorňuje na důležitý prvek prostředí, který ovlivňuje nástup nemoci, a to složení stravy. Nemluví se jen o úloze tuků, ale i o vlivu některých rostlinných látek, které by v budoucnu mohly posloužit jako alternativa k současné profylaxi nebo léčbě T2DM.
Klíčová slova:
diabetes mellitus typu 2, transkriptom, chronický zánět, terapeutický cíl.Přibližně 90 % diabetiků má diabetes typu 2 (na inzulínu nezávislý – T2DM). Jedná se o chronické progresivní onemocnění charakterizované inzulínovou rezistencí, která je definována jako snížená vnímavost (senzitivita) buněk k inzulínu. Následná hyperglykémie způsobuje závažné mikro - a makrovaskulární komplikace (nefropatie, neuropatie či retinopatie). Postupem času dochází i k degeneraci β-buněk, které se snaží zvýšenou hladinu glukózy v krvi kompenzovat zvýšenou produkcí inzulínu. Podle WHO patří mezi hlavní rizikové faktory věk nad 40 let, dlouhodobě snížená fyzická aktivita a v neposlední řadě nadváha s BMI ≥ 27 kg/m2 (1).
A právě obezita je považována za hlavní příčinu vzniku T2DM. Proto se někdy užívá pro společné označení obou problémů termín „diabezity“ (obezitou indukovaný diabetes mellitus) (2, 3), který tak současně reflektuje etiologii a klinickou manifestaci.
Diabetes mellitus nabývá v dnešní době pandemických rozměrů. Do roku 2030 se celosvětově očekává více než zdvojnásobení počtu nemocných jedinců (4). Znamená to více jak 366 milionů lidí s diabetem, což bude odpovídat 4,4 % světové populace. To bude představovat značnou sociální a ekonomickou zátěž.
Přes mnohaletý intenzivní výzkum T2DM zůstává otázkou jeho přesná příčina. Jsou známé některé patogenetické mechanismy (např. genové mutace) a enviromentální faktory (pohyb, dieta …), ale jejich přesné působení a regulace už méně.
Jednou z možností jak studovat patologické změny v tkáních nemocných diabetem je sledování změn exprese některých klíčových proteinů. Znalost lidského transkriptomu (soubor všech RNA nacházejících se v buňce v daný čas) a proteomu (soubor všech proteinů nacházejících se v buňce v daný čas) představuje jedinečný nástroj pro hledání příčin a následků nemoci či diagnostických a terapeutických cílů (5).
Tento přehledový článek si klade za cíl sumarizovat dosavadní znalosti o změnách exprese nejvýznamnějších genů, jejichž hladina může ovlivnit vznik a průběh T2DM, a to v hlavních inzulín-responzivních tkáních, což je především tuková tkáň, následně játra a svaly. Současně jsou zmíněny i některé mechanismy jejich regulace z pohledu potencionálních terapeutických cílů.
Genové exprese v bílé tukové tkáni
Bílá tuková tkáň je klíčový regulátor energetického metabolismu a hraje centrální roli v rovnováze mezi skladováním a mobilizací energie na úrovni celého organismu (6). Jedná se také o velmi aktivní endokrinní orgán, který svými působky (adipokiny) ovlivňuje řadu metabolických pochodů v těle (7). Mezi nejdůležitější adipokiny patří leptin, adiponektin, TNF-α, IL-6 či rezistin. Přitom adiponektin a TNF-α antagonisticky ovlivňují inzulínovou senzitivitu (6).
Chronický zánět, cytokiny a jejich vztah k T2DM
T2DM je charakterizován mírným chronickým zánětem v tukové tkáni, který vzniká jako následek obezity a zvyšující se hmoty tukové tkáně (8). Následná zvýšená aktivita zánětu (např. vyšší produkce TNF-α) je spojována s výskytem inzulínové rezistence. Nicméně není stále jasné, zda vzniká prvně zánět nebo inzulínová rezistence. Předpokládá se, že v závislosti na akumulaci tuků, buňky tukové tkáně (adipocyty) tento zánět iniciují a makrofágy, které jsou infiltrovány do této tkáně, tento zánětlivý signál amplifikují (8). Ovlivnění regulace exprese pro - a protizánětlivých adipokinů může být jedním z cílů terapie diabetu.
Inzulín, kromě jiného, indukuje v adipocytech expresi IL 6 a TNF-α. Je ale možné, že inzulín stimuluje tvorbu IL 6 přes stimulaci těchto buněk pomocí TNF-α (9). Oba tyto cytokiny jsou označovány jako prozánětlivé (10). Avšak u IL-6 byly prokázány i protizánětlivé účinky (11). Inzulín zároveň inhibuje tvorbu adiponektinu (12). Srovnatelně účinný, co se účinku na expresi adiponektinu týče, je i TNF-α (12).
Vliv volných mastných kyselin na vznik inzulínové rezistence
Tukové buňky na svém povrchu exprimují receptor TLR4, který v buňkách imunitního systému rozpoznává bakteriální lipopolysacharidy (LPS). Po jeho aktivaci se spustí signální dráha vedoucí k aktivaci NF-κB a zánětlivé reakci. Bylo prokázáno, že pro aktivaci TLR4 postačuje pouze lipidická složka LPS, a to především nasycené mastné kyseliny (13).
Jako vedlejší produkt metabolismu lipidů uvolňují adipocyty do svého okolí volné mastné kyseliny (FFA) (14), jejichž množství narůstá u obézních jedinců (15). Část těchto FFA se váže na TLR4 a přes aktivaci NF-κB zapíná zánětlivou reakci vedoucí ke zvýšené expresi prozánětlivých cytokinů a chemokinů (16). Takto aktivovaný zánět může ve svém důsledku vést až ke vzniku inzulínové rezistence. Mezi hlavní cíle transkripčního faktoru NF-κB s potencionálním zapojením do patogeneze T2DM patří TNF-α, rezistin, IL-6, TLR4, COX2 (cyklooxigenáza 2) a mnoho dalších (8, 16, 17). Podle posledních studií se však ukazuje, že TNF-α produkovaný tukovou tkání pravděpodobně nepochází z adipocytů (18). V adipocytech ovlivněných LPS je exprese mRNA TNF-α nízká, a jeho hladinu tak budou ovlivňovat pravděpodobné jiné buňky, s největší pravděpodobností infiltrované makrofágy.
NF-κB může být také aktivován oxidačním stresem nebo stresem endoplazmatického retikula (ER stress) (8). Volné kyslíkové radikály mohou snížit i produkci adiponektinu.
V buňce samotné mohou sloužit mastné kyseliny také jako ligand proliferačního faktoru PPARγ (19). Nasycené mastné kyseliny se chovají jako inhibitory a nenasycené jako aktivátory (19), svou úlohu zde hraje i konformace těchto kyselin (20). Tento protein je dominantně exprimován v adipocytech, kde hraje důležitou roli během adipogeneze (21) a podporuje inzulínovou senzitivitu v buňkách v kontextu s obezitou (22). Ve své funkci transkripčního faktoru řídí transkripci proteinů, které se významnou měrou podílí na metabolismu tuků a malou částí i na metabolismu cukrů. Do utilizace sacharidů zasahuje převážně řízením transkripce transmembránového přenašeče glukózy, GLUT4 (20). Zpracování tuků ovlivňuje na více úrovních, od membránového transportního proteinu CD-36/FAT, přes intracelulární vazebný protein aP2/FABP až po metabolické enzymy acetyl-CoA-karboxylázu (ACC), acyl-CoA-oxidázu (AOX) či glycerol-3-fosfát dehydrogenázu (GPDH) (19, 20). Taktéž ovlivňuje svou vlastní expresi a expresi hormonu leptinu (20).
Regulace lipolýzy
Další z možností jak snížit množství tukové tkáně, a tím i zredukovat obezitu a k ní přidružené komplikace jako např. inzulínovou rezistenci, je aktivace lipolýzy v tukové tkáni. K indukci lipolýzy dochází aktivací β2-adrenoceptorů nebo působením natriuretickým peptidem či růstovým hormonem, k její inhibici naopak aktivací α2-adrenoceptorů. Během lipolýzy však dochází k uvolňování FFA do cirkulace, což opět může vést k inzulínové rezistenci. Tyto aktivátory se stávají farmakologicky zajímavými pouze v případě, že zároveň aktivují (nebo jako léčivo obsahují další účinnou látku) oxidativní spalování mastných kyselin (23). Agonisté β adrenoceptorů navozují snížení exprese adiponektinu za současného zvýšení exprese TNF-α a adiponektinového receptoru 2 (6). Na základě těchto pozorování byla navržena hypotéza, že vyšším množstvím receptoru se buňky snaží kompenzovat potlačenou expresi adiponektinu (6). Tato zpětnovazebná smyčka napomáhá udržovat lipidovou homeostázi v adipocytech.
Transkriptom tukové tkáně při T2DM
Změny v expresním profilu v tukové tkáni při diabezitě sledoval Brown et al. (3). Leptin měl jako jediný zvýšenou expresi, ostatní proteiny měly hladiny snížené. Mezi proteiny (respektive jejich mRNA) se sníženou produkcí patří například výše uvedený PPARγ, glukózový transmembránový přenašeč GLUT2 či gluthation S-tranferáza A3 (GSTA3) a albumin. Diabetické buňky vykazují také sníženou expresi GLUT1 a 4 a hexokinázy II, která katalyzuje první krok vnitrobuněčného metabolismu glukózy (24).
Technologie DNA čipů pomohla odhalit několik desítek genů, které jsou pod přímou transkripční kontrolou účinku inzulínu. V práci Sartipy a Loskutoffa (24) je identifikována skupina genů, jejichž hladina exprese se nemění ani během inzulínové rezistence. Patří do ní např. ranskripční faktor Erg 1 či epiregulin, jejichž tvorbu inzulín indukuje nebo β3 adrenoceptor, jehož exprese je naopak inzulínem utlumena.
Přehled diskutovaných signálních drah a možnosti regulace genové exprese v adipocytech jsou znázorněny na obrázku 1.
Obr. 1. Změna exprese vybraných genů v adipocytech tukové tkáně a jejich (pato)fyziologický efekt Šipka značí zvýšenou expresi a šipka sníženou expresi. aP2 – adipocytární protein 2, COX2 – cyklooxigenáza 2, ER – endoplazmatické retikulum, FAT – transportér mastných kyselin, FFA – volné mastné kyseliny, GLUT – glukózový transportér z rodiny SLC2A, IL-6 – interleukin 6, MCP-1 – monocytární chemoatraktant protein-1, NF-κB – jaderný faktor kappa B, PPAR – peroxizomální receptor aktivovaný proliferátory, ROS – reaktivní kyslíkové radikály, TNF-α – tumor necrosis factor α, TLR4 – toll-like receptor 4 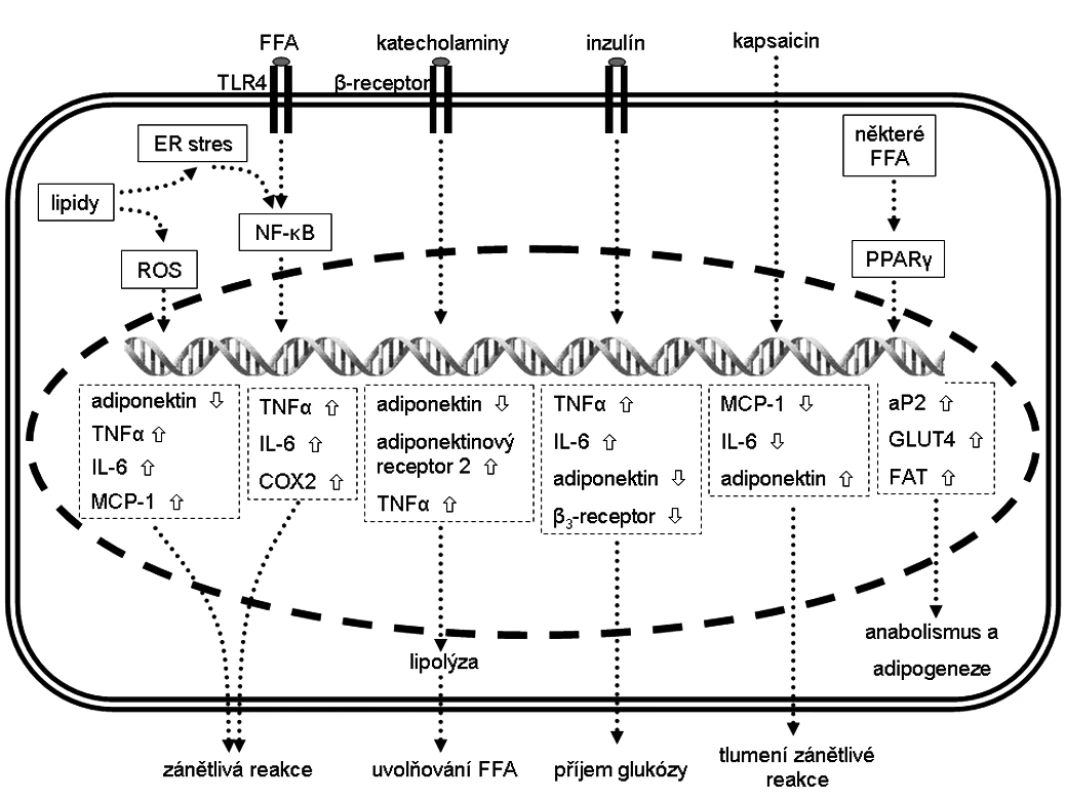
Genové exprese v játrech
Játra představují důležitý orgán pro kontrolu glukózové a lipidové homeostáze. Vstřebáváním nebo vylučováním glukózy do krevního oběhu regulují její hladinu v závislosti na její koncentraci a aktuální potřebě těla (25). Dysregulace uvolňování glukózy do krve v játrech vede k hyperglykémii a T2DM. Klíčovou roli v tvorbě glukózy (glykogenlýza nebo glukoneogeneze) hrají enzymy EPCK (fosfoenolpyruvát karboxykináza) a G6Páza (glukózo-6-fosfatáza). Inzulín inhibuje expresi těchto genů (26), zatímco glukagon a glukokortikoidy působí antagonisticky vůči inzulínu (27). Zvýšená glukoneogeneze způsobená zvýšenou expresí genů PEPCK a G6Páza dokáže navodit metabolické defekty pozorované u T2DM (24). Alterace funkce jednoho takového jaterního genu může mít neblahé účinky na celkovou glukózovou a lipidovou homeostázu in vivo (25). Na druhé straně stojí jaterní glukokináza (GK), jejíž exprese je indukována inzulínem (28). Při nadměrné produkci GK v pokusných zvířatech (29) nebo při allosterické aktivaci (30) dojde ke zvýšenému zachytávání glukózy, čímž se sníží její obsah v krvi. To činí z GK nadějný terapeutický cíl pro léčbu diabetu.
Dieta bohatá na cukry indukuje v játrech tvorbu lipogenních enzymů. Pro aktivaci této dráhy je nutná ještě přítomnost inzulínu (28, 31). Mezi tyto enzymy patří již výše popsaná GK, FAS nebo ACC. Zároveň dochází k útlumu tvorby PEPCK.
Při obezitě, kdy vzrůstá množství tukové tkáně a adipocytů, reagují játra na tuto skutečnost velmi citlivě. Více tukové tkáně znamená více uvolněných adipokinů do krevního řečiště. Tato disbalance může narušit metabolickou rovnováhu v játrech a převrátit ji na stranu lipogeneze (32). Zvýšené ukládání tuku může vést až ke vzniku na alkoholu nezávislé steatózy jater (NAFLD).
Kromě adipokinů působí na jaterní tkáň i vyšší koncentrace FFA. Tyto mastné kyseliny slouží jako ligandy PPARα (19), který svou vazbou aktivují. PPARα v buňkách pracuje jako transkripční faktor a jeho cílové geny jsou zapojeny do β-oxidace mastných kyselin (33, 34). Jako aktivátory však působí hlavně nenasycené mastné kyseliny (19), pro terapeutické využití se uvažuje o n-3 polynenasycených mastných kyselinách (35). PPARγ působí tedy antagonisticky (má katabolické účinky) oproti PPARα, který se nachází v adipocytech.
V diabetických játrech byla prokázána změněná exprese mnoha dalších genů. Výrazný pokles byl zjištěn u proteinu Tff3, a to 593× oproti kontrole (3). Tento protein je dominantně exprimován ve střevní mukóze, ale je aktivní i v játrech. V souvislosti s diabetem není zatím zkoumán, ale jeho zvýšená produkce v játrech je asociována se žlučovými kameny (hepatolithiasis) (36). V diabetických játrech byla taktéž snížena exprese PPARγ, zvýšená exprese byla naopak prokázána například u receptoru pro lipoprotein s velmi nízkou hustotou (VLDLR) (3).
Možnosti regulace genové exprese v hepatocytech jsou souhrnně znázorněny na obrázku.
Obr. 2. Změna exprese vybraných genů v hepatocytech a jejich (pato)fyziologický efekt Šipka značí zvýšenou expresi, šipka sníženou expresi a šipka mírně zvýšenou expresi. ACC – acetyl-CoA-kaboxyláza, FAS – syntáza mastných kyselin, FFA – volné mastné kyseliny, G6Páza – glukózo-6-fosfatáza, GK – glukokináza, GLUT – glukózový transportér z rodiny SLC2A, PEPCK – fosfoenolpyruvát karboxykináza, PPAR – peroxizomální receptor aktivovaný proliferátory, TNF-α – tumor necrosis factor α, TLR4 – toll-like receptor 4 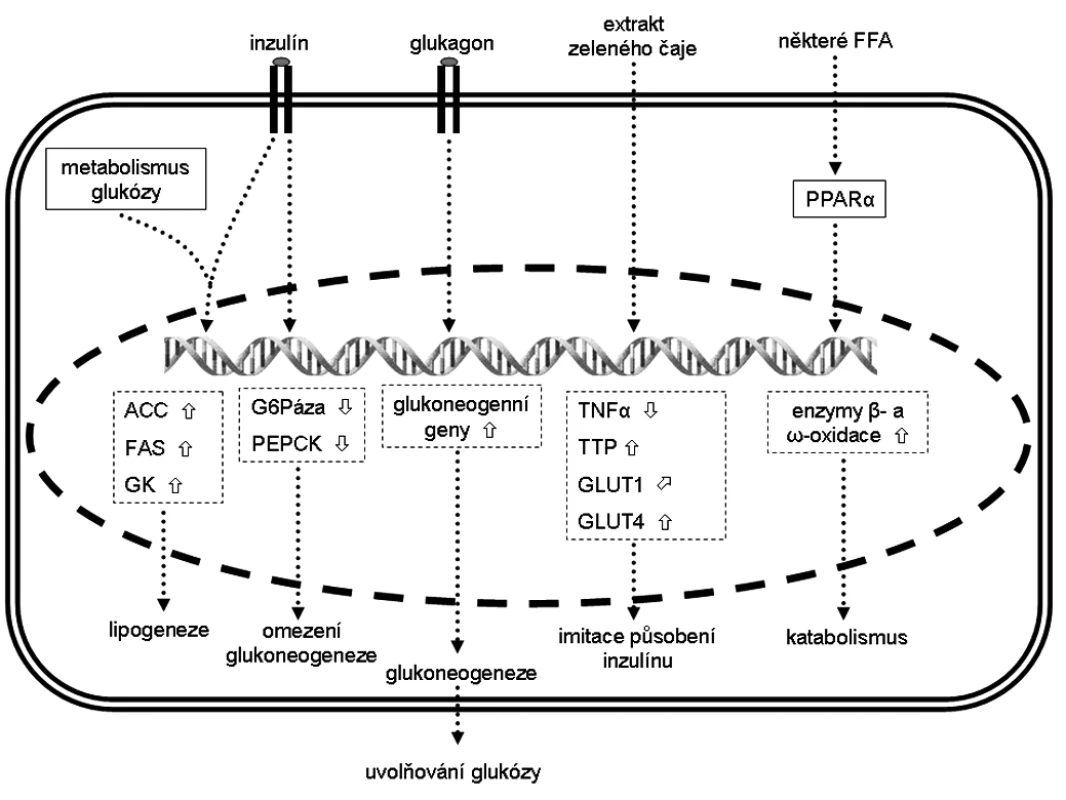
Genové exprese ve svalech
Svaly představují jednoho z hlavních „odběratelů a spotřebitelů“ glukózy v těle. Tu následně skladují ve formě glykogenu pro základní energetickou potřebu. Hlavním transmembránovým přenašečem glukózy ve svalech je GLUT4, jehož exprese je řízena jak samotným inzulínem, tak i metabolity a svalovou činností (37). Kromě tohoto proteinu inzulín kontroluje přepis přibližně 800 dalších genů (38). U 409 z nich je známa funkce. Proteiny jimi kódované je možné rozdělit do několika hlavních skupin: 29 % je zapojeno do regulace translace, 14 % do regulace energetického metabolismu a 12 % do intracelulární signalizace. Zbytek pak náleží do kategorie cytoskeletárního transportu, receptorů či odbourávání nepotřebných proteinů (38).
Při svalové činnosti vzniká velké množství reaktivních kyslíkových radikálů (ROS), které se podílí na aktivování drah vedoucích k příjmu glukózy během svalové kontrakce (39). Ale oxidativní stres se významnou měrou podílí i na patogenezi T2DM (40). U pacientů s T2DM bylo prokázáno poškození obranných mechanismů proti oxidativnímu stresu, a to sníženou tvorbou enzymů HSP72 (Heat shock protein 72) a HO-1 (hem oxygenáza 1) (40). Na druhou stranu řada studií potvrzuje teorii, že pravidelný pohyb snižuje inzulínovou rezistenci a napomáhá předcházet vzniku T2DM (41). Dochází při něm ke snižování objemu tukové tkáně, a tím i k redukci produkce FFA a prozánětlivých cytokinů. Je možné, že IL-6 produkovaný ve svalech by mohl mít protizánětlivé účinky a cvičení by tak působilo proti nemocem charakterizovaných mírným zánětem, kam se řadí mimo jiné diabetes typu 2 či arterioskleróza (11). Současně se během svalové činnosti odbourá značná část uložené energie za současné aktivace příjmu glukózy do svalů. Svalovou kontrakci lze také simulovat podáním aktivátorů AMPK (AMP – activated protein kinase), který je klíčovým enzymem v signální dráze při svalové práci (41, 42). Tím opět dojde ke zvýšenému záchytu glukózy z krve a nížení glykémie.
Na rozdíl od tukové tkáně a jater není ve svalech aktivována zánětlivá kaskáda narůstající masou tukové tkáně. Zánět je ale možné experimentálně vyvolat například intramuskulární injekcí lipidů. Jak se zdá, svaly představují spíše pouze cíl zánětem indukované inzulínové rezistence než místo vzniku zánětu (8).
Změna exprese vybraných genů ve svalových myocytech je zobrazena na obrázku.
Obr. 3. Změna exprese vybraných genů ve svalových myocytech a jejich (pato)fyziologický efekt Šipka značí zvýšenou expresi, šipka sníženou expresi a šipka mírně sníženou expresi. FAT – transportér mastných kyselin, GLUT – glukózový transportér z rodiny SLC2A, TNF-α – tumor necrosis factor α, TTP – tristetraprolin 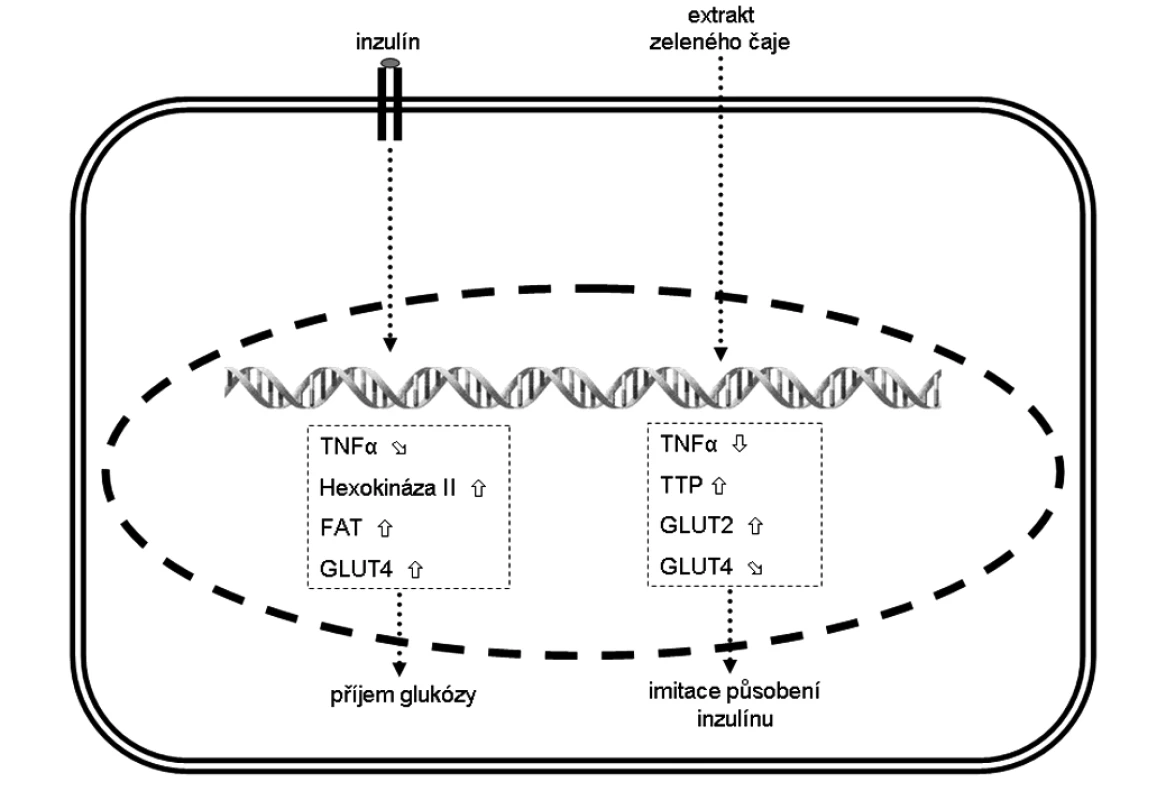
Vliv diety na inzulínovou rezistenci
Složení přijímané stravy má výrazný vliv na vznik a průběh inzulínové rezistence. Nejdůležitější složku z tohoto pohledu představují tuky. Jak již bylo zmíněno výše, FFA, které vznikají jako meziprodukt metabolismu tuků, mohou fungovat jako koaktivátory transkripčních faktorů rodiny PPAR. Vliv na metabolismus záleží na složení a vzájemných poměrech mastných kyselin ve stravě. Západní styl života je charakteristický nízkým příjmem omega-3 nenasycených mastných kyselin a vysokým příjmem nasycených a transnenasycených mastných kyselin (43). Tato kombinace, kromě jiných příčin, jako je nedostatek pohybu či pozitivní energetická bilance, velmi přispívá ke vzniku obezity a následným problémům (kardiovaskulární komplikace, T2DM …). Dlouhodobě zvýšená hladina FFA je jednou z příčin inzulínové rezistence. Tak, jak je inzulínová rezistence stěžejní abnormalitou při T2DM, tak FFA představují jeden ze základních znaků, který slouží jako mechanické pojítko mezi narůstající tukovou tkání a T2DM (44).
Kromě množství a formy přijaté energie v potravinách ovlivňují inzulínovou rezistenci například i některé rostlinné látky. Řada z nich byla, či stále je, využívána v lidovém léčitelství. Například extrakt zeleného čaje může do jisté míry imitovat působení inzulínu. Při jeho podávání se zvyšuje exprese transmembránových glukózových přenašečů z GLUT rodiny ve svalech a játrech (45, 46). Zároveň se snižuje produkce prozánětlivého TNF-α. Tato skutečnost je vysvětlována zvýšenou expresí proteinu tristetraprolinu (TTP; Zft36) (46). Tento protein se váže a destabilizuje pro-zánětlivé molekuly mRNA (např. TNF-α). Agens indukující produkci TTP by mohl mít potenciální terapeutickou hodnotu při prevenci anebo léčbě zánětlivých onemocnění (46).
Další fytochemikálií použitelnou na modulaci inzulínové rezistence je kapsaicin (pálivá složka paprik). Po jeho aplikaci dochází k iniciaci produkce adiponektinu v tukové tkáni a zároveň ke snížené produkci IL-6 a prozánětlivého adipokinu MCP-1 (monocyte chemoattractant protein-1) (47). MCP-1 indukuje migraci a aktivaci makrofágů do tukové tkáně (48). Tímto procesem se akceleruje chronický zánět, který je charakteristický pro T2DM. MCP-1 tak hraje důležitou roli při rozvoji diabezity a jako takový představuje vhodný terapeutický cíl pro modulaci patologických stavů způsobených obezitou (48).
Závěr
Pozitivní energetická bilance, dlouhodobě snížená pohybová aktivita a změněné stravovací návyky vedou k rozvoji metabolického syndromu, inzulínové rezistence a nakonec k diabetes mellitus 2. typu. V dnešní době je klíčové pochopit základní biologické pochody, které jsou charakteristické pro tuto nemoc pandemických rozměrů. Detailní znalost působení inzulínu a znalost dysregulací genové exprese při diabezitě může vést k lepšímu pochopení mechanismů inzulínové rezistence. Poskytne zároveň možnost pro vývoj nových léků a zkvalitnění léčby.
Zkratky
ACC – acetyl-CoA-carboxylase (acetyl-CoA-karboxyláza)
AMPK – AMP-activated protein kinase (protein kináza aktivovaná adenosinmonofosfátem)
AOX – acyl-CoA-oxidase (acyl-CoA-oxidáza)
aP2 – adipocytární protein 2
BMI – body mass index (index tělesné hmotnosti)
COX2 – cyklooxigenáza 2
DNA – deoxyribonucleic acid (deoxyribonukleová kyselina)
Erg-1 – early growth response 1 (transkripční faktor brzké odpovědi)
FABP – fatty acid binding protein (protein vázající mastné kyseliny)
FAS – fatty acid synthase (syntáza mastných kyselin)
FAT – fatty acid transporter (transportér mastných kyselin)
FFA – free fatty acids (volné mastné kyseliny)
G6Páza – glukose-6-phosphatase (glukózo-6-fosfatáza)
GK – glukokináza
GLUT – glukózový transportér z rodiny SLC2A
GPDH – glycerol-3-phosphate dehydrogenase (glycerol-3-fosfát dehydrogenáza)
GSTA3 – gluthation S-tranferase A3 (gluthation S-tranferáza A3)
HO-1 – hemoxigenáza 1
HSP72 – heat shock protein 72 (protein tepelného šoku 72)
IL-6 – interleukin 6
LPS – lipopolysacharidy
MCP-1 – monocyte chemoattractant protein-1 (monocytární chemoatraktant protein-1)
mRNA – mediator ribonucleic acid (mediátorová ribonukleová kyselina)
NAFLD – nonalcoholic fatty liver disease (na alkoholu nezávislá steatóza jater)
NF-κB – nuclear factor kappa B (jaderný faktor kappa B)
PEPCK – phosphoenolpyruvate carboxykinase (fosfoenolpyruvát karboxykináza)
PPAR – peroxisome proliferator-activated receptors (peroxisomální receptor aktivovaný proliferátory)
RNA – ribonucleic acid (ribonukleová kyselina)
ROS – reactive oxygen species (reaktivní kyslíkové radikály)
T2DM – type 2 diabetes mellitus (diabetes mellitus typu 2)
Tff3 – trefoil 3
TNF-α – tumor necrosis factor α
TLR4 – toll-like receptor 4
TTP – tristetraprolin
VLDLR – very-low density lipoprotein receptor (receptor pro lipoprotein s velmi nízkou hustotou)
WHO – World Health Organization (Světová zdravotnická organizace)
Mgr. Jan Hošek
Ústav přírodních léčiv FaF VFU
Palackého 1–3, 612 42 Brno
fax: +420 541 240 606, e-mail: hhosek@gmail.com
Zdroje
1. http://www.leb.emro.who.int/2006%20Guideline%20diab2. pdf (online 19. 5. 2008).
2. Astrup, A., Finer, N.: Redefining type 2 diabetes: „diabesity“ or „obesity dependent diabetes mellitus“? Obes. Rev., 2000, 1, s. 57–59.
3. Brown, A. C., Olver, W. I., Donnelly, C. J. et al.: Searching QTL by gene expression: analysis of diabesity. BMC Genet., 2005, 6, s. 12.
4. Wild, S., Roglic, G., Green, A. et al.: Global prevalence of diabetes: Estimates for the year 2000 and projections for 2030. Diabetes care, 2004, 27, s. 1047–1053.
5. Toye, A., Gauguier, D.: Genetics and functional genomics of type 2 diabetes mellitus. Genome Biol., 2003, 4, s. 241.
6. Fu, L., Isobe, K., Zeng, Q. et al.: ß-adrenoreceptor agonists downregulate adiponectin, but upregulate adiponectin receptor and tumor necrosis factor-β expression in adipocytes. Eur. J. Pharmacol., 2007, 569, s. 155–162.
7. Trayhurn, P., Bing, C., Wood, S.: Adipose tissue and adipokines – Energy regulation from the human perspective. J. Nutr., 2006, 136 (Suppl.), s. 1935S–1939S.
8. Shoelson, S. E., Lee, J., Goldfine, A. B.: Inflammation and insulin resistance. J. Clin. Invest., 2006, 116, s. 1793–1801.
9. Krogh-Madson, R., Plomgaard, P., Keller, C., Pedersen, B. K.: Insulin stimulates interleukin–6 and tumor necrosis factor–α gene expression in human subcutaneous adipose tissue. Am. J. Physiol. Endocrinol. Metab., 2004, 286, s. E234–E238.
10. Zou, C., Shao, J.: Role of adypocytokines in obesity-associated insulin resistance. J. Nutr. Biochem., 2008, 19, s. 277–286.
11. Starkie, R. L., Ostrowski, S. R., Jauffred, S. et al.: Exercise and IL-6 infusion inhibit endotoxin-induced TNF-α production in humans. Faseb J., 2003, 17, s. 884–886.
12. Fasshauser, M., Klein, J., Neumann, S. et al.: Hormonal Regulation of Adiponectin Gene Expression in 3T3-L1 Adipocytes. Biochem. Biophys. Res. Commun., 2002, 290, 1084–1089.
13. Lee, J. Y., Sohn, K. H., Rhee, S. H., Hwang, D.: Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooygenase-2 mediated through Toll-like receptor 4. J. Biol. Chem., 2001, 276, s. 16683–16689.
14. Näslund, B., Bernström, K., Lundin, A., Arner, P.: Release of small amounts of free fatty acids from human adipocytes as determined by chemiluminescence. J. Lipid Res., 1993, 34, s. 633–641.
15. Wilding, J. P. H.: The importance of free fatty acids in the development of Type 2 diabetes. Diabetic Med., 2007, 24, s. 934–945.
16. Shi, H., Kokoeva, M. V., Inouye, K. et al.: TLR4 links innate immunity and fatty acid–induced insulin resistance. J. Clin. Invest., 2006, 116, 3015–3025.
17. Hwang, D.: Modulation of the expression of cyclooxygenase 2 by fatty acids mediated through Toll-like receptor 4-derived signaling pathways. FASEB J., 2001, 15, s. 2556–2564.
18. Hoch, M., Eberle, A. N., Peterli, R. et al.: LPS induces interleukin-6 and interleukin-8 but not tumor necrosis factor--alpha in human adipocytes. Cytokine, 2008, 41, s. 29–37.
19. Desvergne, B., Wahli, W.: Peroxisome proliferator-activated receptors: Nuclear control of metabolism. Endocr. Rev., 1999, 20, s. 649–688.
20. Brown, J. M., Boysen, M. S., Jensen, S. S. et al.: Isomer-specific regulation of metabolism and PPARγ signaling by CLA in human preadipocytes. J. Lipid Res., 2003, 44, s. 1287–1300.
21. Tontonoz, P., Hu, E., Graves, R. A. et al.: mPPAR gamma 2: tissue-specific regulator of an adipocyte enhancer. Genes Dev., 1994, 8, s. 1224–1234.
22. Moller, D. E,, Berger, J. P.: Role of PPARs in the regulation of obesity-related insulin sensitivity and inflammation. Int. J. Obes. Relat. Metab. Disord., 2003, 27 (Suppl. 3), s. S17–S21.
23. Langin, D.: Adipose tissue lipolysis as a metabolic pathway to define pharmacological strategies against obesity and the metabolic syndrome. Pharmacol. Res., 2006, 53, s. 482–491.
24. Sartipy, P., Loskutoff, D. J.: Expression profiling identifies genes that continue to respond to insulin in adipocytes made insulin-resistant by treatment with tumor necrosis factor-α. J. Biol. Chem., 2003, 278, s. 52298–52306.
25. Postic, C., Dentin, R., Girard, J.: Role of the liver in the control of carbohydrate and lipid homeostasis. Diabetes Metab., 2004, 30, s. 398–408.
26. Lochhead, P. A., Coghlan, M. P., Rice, S. Q. J., Sutherland, C.: Inhibition of GSK3 selectively reduces G6Pase and PEPCK gene expression. Diabetes, 2001, 50, s. 937–947.
27. Haber, B. A., Chin, S., Chuang, E. et al.: High levels of glucose-6-phosphatase gene and protein expression reflect an adaptive response in proliferating liver and diabetes. J. Clin. Invest., 1995, 95, s. 832–841.
28. Gregori, C., Guillet-Deniau, I., Girard, J. et al.: Insulin regulation of glucokinase gene expression: evidence against a role for sterol regulatory element binding protein 1 in primary hepatocytes. FEBS Lett., 2006, 580, s. 410–414.
29. O’Doherty, R. M., Lehman, D. L., Télémaque-Potts, S., Newgard, C. B.: Metabolic impact of glucokinase overexpression in liver: lowering of blood glucose in fed rats is accompanied by hyperlipidemia. Diabetes, 1999, 48, s. 2022–2027.
30. Grimsby, J., Sarabu, R., Corbett, W. L. et al.: Allosteric activators of glucokinase: potential role in diabetes therapy. Science, 2003, 301, s. 370–373.
31. Stoeckman, A. K., Towle, H. C.: The role of SREBP-1c in nutritional regulation of lipogenic enzyme gene expression. J. Biol. Chem., 2002, 277, s. 27029–27035.
32. Queshi, K., Abrahams, G. A.: Metabolic liver disease of obesity and role of adipose tissue in the pathogenesis of nonalcoholic fatty liver disease. World J. Gastroenterol., 2007, 13, s. 3540–3553.
33. Patsouris, D., Reddy, J. K., Müller, M., Kersten, S.: Peroxisome proliferator-activated receptor alpha mediates the effects of high-fat diet on hepatic gene expression. Endocrinology, 2006, 147, s. 1508–1516.
34. Tamura, K., Ono, A., Miyagishima, T. et al.: Profiling of gene expression in rat liver and rat primary cultured hepatocytes treated with peroxisome proliferators. J. Toxicol. Sci., 2006, 31, s. 471–490.
35. Svegliati-Baroni, G., Candelaresi, C., Saccomanno, S. et al.: A Model of Insulin Resistance and Nonalcoholic Steatohepatitis in Rats: Role of Peroxisome Proliferator-Activated Receptor-α and n-3 Polyunsaturated Fatty Acid Treatment on Liver Injury. Am. J. Pathol., 2006, 169, s. 846–860.
36. Sasaki, M., Ikeda, H., Ohira, S. et al.: Expression of trefoil factor family 1, 2, and 3 peptide is augmented in hepatolithiasis. Peptides, 2004, 25, s. 763–770.
37. Zorzano, A., Palacín, M., Gumą, A.: Mechanisms regulating GLUT4 glucose transporter expressio and glucose transport in skeletal muscle. Acta Physiol. Scand., 2005, 183, s. 43–58.
38. Rome, S., Clément, K., Rabasa-Lhoret, R. et al.: Microarray profiling of human skeletal muscle reveals that insulin regulates ~800 genes during a hyperinsulinemic clamp. J. Biol. Chem., 2003, 278, s. 18063–18068.
39. Sandström, M. E., Zhang, S. J., Bruton, J. et al.: Role of reactive oxygen species in contraction-mediated glucose transport in mouse skeletal muscle. J. Physiol., 2006, 575, s. 251–262.
40. Bruce, C. R., Carey, A. L., Hawley, J. A., Febbraio, M. A.: Intramuscular heat shock protein 72 and heme oxygenase-1 mRNA are reduced in patients with type 2 diabetes: evidence that insulin resistance is associated with a disturbed antioxidant defense mechanism. Diabetes, 2003, 52, s. 2338–2345.
41. Hawley, J. A.: Exercise as a therapeutic intervention for the prevention and treatment of insulin resistance. Diabetes Metab. Res. Rev., 2004, 20, s. 383–393.
42. Göransson, O., McBride, A., Hawley, S. A. et al.: Mechanism of action of A–769662, a valuable tool for activation of AMP-activated protein kinase. J. Biol. Chem., 2007, 282, s. 32549–32560.
43. Haag, M., Dippenaar, N. G.: Dietary fats, fatty acids and insulin resistance: short review of a multifaceted connection. Med. Sci. Monit., 2005, 11, s. RA359–RA367.
44. Wilding, J. P. H.: The importance of free fatty acids in the development of Type 2 diabetes. Diabet. Med., 2007, 24, s. 934–945.
45. Cao, H., Hininger-Favier, I., Kelly, M. A. et al.: Green tea polyphenol extract regulates the expression of genes involved in glucose uptake and insulin signaling in rats fed a high fructose diet. J. Agric. Food Chem., 2007, 55, s. 6372–6378.
46. Cao, H., Kelly, M. A., Kari, F. et al.: Green tea increases anti-inflammatory tristetraprolin and decreases pro-inflammatory tumor necrosis factor mRNA levels in rats. J. Inflamm. (Lond.), 2007, 4, s. 1.
47. Kang, J. H., Kim, C. S., Han, I. S. et al.: Capsaicin, a spicy component of hot peppers, modulates adipokine gene expression and protein release from obese-mouse adipose tissues and isolated adipocytes, and suppresses the inflammatory responses of adipose tissue macrophages. FEBS Lett., 2007, 581, s. 4389–4396.
48. Yu, R., Kim, C. S., Kwon, B. S., Kawada, T.: Mesenteric adipose tissue-derived monocyte chemoattractant protein-1 plays a crucial role in adipose tissue macrophage migration and activation in obese mice. Obesity (Silver Spring), 2006, 14, s. 1353–1362.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Nová funkce C3d komplementové komponenty
- Změny v genové expresi během inzulínové rezistence a „diabezity“ v inzulín-senzitivních tkánícha možnosti jejich regulace
- Migrace různých typů lymfocytů ve tkáni
- Biologická a nebiologická eliminační léčba akutního selhání jater Experimentální práce na velkém laboratorním zvířeti
- Vztah inzulínové rezistence a množství viscerálního tuku
- Využitie profilov génovej expresie k stanoveniu odpovedi k neoadjuvantnej konkomitantnej chemorádioterapii u pacientov s karcinómom rekta: pilotná štúdia
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC3. Vývoj v období po narození*
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
- Toll-like receptory a jejich generická variabilita při streptokokové pneumonii
- Prof. R. čihák – anatom a embryolog – 80. výročí narození
- Série seminářů „nová legislativa“ programu PACE oslovila i lékaře
- Medical Fair
- Před úsvitem, po ránu
- Základy klinické farmakologie
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Vztah inzulínové rezistence a množství viscerálního tuku
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



