-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využitie profilov génovej expresie k stanoveniu odpovedi k neoadjuvantnej konkomitantnej chemorádioterapii u pacientov s karcinómom rekta: pilotná štúdia
Gene Expression Profiling in Prediction of Tumor Response to Neoadjuvant Concomitant Chemoradiotherapy in Patients with Locally Advanced Rectal Carcinoma: Pilot Study
Background.
Neoadjuvant concomitant chemoradiotherapy has become a standard treatment of locally advanced rectal adenocarcinomas (LARA). It can reduce tumor volume, thus increases a feasibility of sphincter-sparing surgery, shows less acute toxicity, improves local control rate. It is based on fluoropyrimidines (5-fluorouracil, capecitabine) with concurrent radiotherapy. The aim of the study was to evaluate the capability of gene expression method to identify nonresponders (NR) pretherapeutically.Methods and Results.
17 patients with LARA, clinical stage II, III according to IUCC were enrolled into our pilot study. Response to therapy was determined clinically by transrectal ultrasonography and CT/MRI before and after therapy and histopathologically by TRG (tumor regression grade) according to Mandard. Patients with TRG 1–2 were included to responders group (R) and patients with TRG 4–5 composed NR group. Gene expression levels of 440 genes were obtained by low-density oligonucleotide microarrays. Gene expression data analysis based on SAM (Significance Analysis of Microarrays) and t-test methods identified 8 genes (RB1, RBBP4, HYOU1, JUNB, MDM4, CANX, MMP2, TCF7L2) significantly upregulated in NR.Conclusions.
Validation of identified changes on the mRNA level (Real-Time PCR) and on protein level (immunohistochemistry) is ongoing. We suggest that low-density oligonucleotide microarray technology could contribute to individualize the therapy of patients with LARA.Key words:
neoadjuvant therapy, fluoropyrimidines, radiotherapy, rectal adenocarcinomas, gene expression profiling, DNA arrays.
Autoři: I. Garajová 1,5; O. Slabý 2,5; M. Svoboda 1,5
; P. Fabian 2; J. Silák 3; T. Šmerdová 2; I. Kocák 1; J. Růžičková 4; J. Hoch 6; R. Vyzula 1,5
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Oddělení onkologické a experimentální patologie, Masarykův onkologický ústav, Brno 2; Oddělení chirurgické onkologie, Masarykův onkologický ústav, Brno 3; Klinika radiační onkologie, Masarykův onkologický ústav, Brno 4; Lékařská fakulta, Masarykova univerzita, Brno 5; Chirurgická klinika 2. LF UK a FNM, Praha 6
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 381-386
Kategorie: Původní práce
Souhrn
Východisko.
Neoadjuvantná konkomitantná chemorádioterapia je štandardnou liečbou lokálne pokročilých nádorov konečníka. Jej cieľom je zredukovať objem nádoru, viesť k sfinkter-šetriacemu radikálnemu chirurgickému zákroku. Charakteristická je menšia toxicita a menej lokoregionálnych recidív. Je založená na fluoropyrimidínoch (5-fluorouracil, kapecitabín) s konkomitantnou rádioterapiou. Cieľom našej štúdie bolo charakterizovať na molekulárnej úrovni pacientov, ktorí sú rezistentní k neoadjuvantnej chemorádioterapii.Metódy a výsledky.
Do pilotnej štúdie bolo zaradených 17 pacientov s histologicky verifikovaným adenokarcinómom rekta v klinickom štádiu II a III podľa IUCC. Odpoveď na liečbu bola hodnotená klinicky pomocou transrektálnej ultrasonografie a CT/MRI pred a po liečbe a histopatologicky pomocou TRG (Tumor Regression Grade) podľa Mandarda. Pacienti s TRG 1–2 boli zaradení do skupiny respondérov a pacienti charakterizovaní TRG 4–5 tvorili skupinu nonrespondérov. Použili sme nízkohustotné oligonukleotidové čipy nesúce sondy pre detekciu 440 génov. K identifikácii génov rozdielne exprimovaných medzi dvoma skupinami pacientov sme použili t‑test a metódu SAM (Significance Analysis of Microarrays) s výsledným počtom 8 génov signifikantne up-regulovaných u nonrespondérov (RB1, RBBP4, HYOU1, JUNB, MDM4, CANX, MMP2, TCF7L2).Závery.
Po rozšírení súboru, validácii výsledkov na úrovni mRNA metódou qRT-PCR a imunohistochemicky na proteínovej úrovni, by tieto sady génov mohli slúžiť k individualizácii terapie pacientov s lokálne pokročilým karcinómom rekta.Kľúčové slová:
neoadjuvantná terapia, fluoropyrimidíny, rádioterapia, karcinóm rekta, profily génovej expresie, DNA čípy.Neoadjuvantná (predoperačná) konkomitantná chemorádioterapia je štandardnou liečbou lokálne pokročilých nádorov konečníka. Jedná sa o klinické štádium II (cT3–4, N0, M0) a III (cT1–T4, N+, M0) podľa IUCC (International Union Against Cancer). Jej cieľom je zredukovať objem nádoru, a tým viesť k radikálnemu (R0) chirurgickému zákroku a prípadne i zvýšiť pravdepodobnosť sfinkter-šetriaceho výkonu, bez nutnosti vytvorenia stómie, a tým zvýšiť kvalitu života pacientov (1, 2). Neoadjuvantná liečba je založená na konkomitantnej aplikácii rádioterapie (45 Gy v 25 frakciích na panvu + boost na lôžko tumoru do celkovej dávky 50,4 Gy) a chemoterapie na bázi fluoropyrimidínov (5 fluorouracil, 5-FU, v dávke 225 mg/m2/deň aplikovaný kontinuálne po dobu rádioterapie alebo perorálne podávaný kapecitabín v dávke 825 mg/m2/2× denne. Operačné riešenie nasleduje za 4 až 6 týždňov po ukončenej neoadjuvantnej liečbe. Tento typ liečby má nižší výskyt akútnej toxicity a menej lokoregionálnych recidív v porovnaní s pacientmi, ktorí boli liečení primárne operačne s následnou adjuvantnou chemorádioterapiou (3) alebo len samotným operačným výkonom (4). Podľa klinickej štúdie EORTC 22921, ktorá zrovnávala množstvo lokoregionálnych recidív u pacientov liečených buď predoperačne rádioterapiou sólo (45 Gy), alebo predoperačnou chemorádioterapiou (5-FU, 45 Gy), tí pacienti, ktorí boli liečení kombinovanou terapiou, mali nižší počet lokoregionálnych recidív (9 % vs. 17 %) (5). Rovnako dizajnovaná retrospektívna francúzska štúdia FFCD 9203 (predoperačná rádioterapia versus predoperačná chemorádioterapia s 5-FU, celková dávka rádioterapie v oboch ramenách bola 45 Gy) došla taktiež k záveru, že kombinovaná liečba vedie k nižšiemu počtu lokoregionálnych recidív (8 % vs. 16,5 %) (6). Ďalšia štúdia poukazuje na dôležitosť spôsobu aplikácie fluoropyrimidínov, 5-FU podávaný formou kontinuálnej intravenóznej infúzie alebo perorálne podaný kapecitabín vykazujú menší výskyt akútnej toxicity a vyššiu efektivitu v porovnaní s bolusovým podaním 5-FU (7). Táto liečba nie je úspešná u všetkých pacientov. Odpoveď varíruje od kompletnej patologickej remisie (pCR, ypT0ypN0) až po úplnú rezistenciu k liečbe. Kompletná patologická remisia sa vyskytuje 10–20 % prípadov (8, 9). Pacienti s kompletnou patologickou remisiou majú lepšiu dlhodobú prognózu (9, 10). Pacientov so žiadnou/minimálnou odpoveďou tumoru na neoadjuvantnú chemorádioterapiu dosiaľ nie je možné identifikovať pred začatím liečby. Na základe našich doposiaľ nepublikovaných výsledkov sa jedná približne o 12 % pacientov. Skúšalo sa mnoho potencionálnych prediktorov liečebnej odpovede, žiaden sa však v klinickej praxi nepoužíva (11). Otvára sa možnosť identifikácie tejto skupiny pacientov na molekulárnej úrovni, charakterizovať ich metódami genomického profilovania pomocou DNA čípov (12, 13). DNA čípy umožňujú v krátkom čase paralelne monitorovať expresiu tisícok génov, prípadne i celý ľudský genóm na úrovni RNA (transkriptóm) (14). Štúdie založené na čípovej technológii dokázali veľmi dobré analytické vlastnosti, ale s minimálnym prienikom medzi jednotlivými génovými sadami. Zrovnateľnosť a reprodukovateľnosť týchto štúdií je ďalej významne ovplyvnená ich technologickou rozmanitosťou a výsledky, ktorých bolo pomocou nich dosiahnutých, nemožno považovať za konkluzívne. Cieľom tejto štúdie bolo overiť možnosti využitia nízkohustotných oligonukleotidových čípov pre molekulárnu charakteristiku adenokarcinómov pacientov liečených neoadjuvantnou chemorádioterapiou a k identifikácii génov spojených s rezistenciou nádorových buniek k neoadjuvantnej liečbe. V budúcnosti by bolo možné získané molekulárne prediktory použiť k individualizácii liečby pacientov s lokálne pokročilým karcinómom rekta a u vybranej skupiny pacientov tak predísť zbytočnému oddialeniu chirurgického výkonu a eventuálnej toxicity neoadjuvantnej liečby.
Súbor pacientov a použité metódy
Súbor pacientov
Do štúdie bolo zaradených 17 pacientov s histologicky verifikovaným adenokarcinómom rekta v klinickom štádiu II a III podľa IUCC, ktorí boli liečení v Masarykovom onkologickom ústave v rokoch 2005–2007. Odpoveď na liečbu bola hodnotená klinicky (cT a cN) pomocou transrektálnej ultrasonografie (TRUS) a CT/MRI pred a po liečbe a histopatologicky pomocou stupnice TRG (Tumor Regression Grade) podľa Mandarda. TRG skóre nadobúda hodnoty od 1 do 5.Skóre TRG 1 znamená najlepšiu odpoveď tumoru na aplikovanú liečbu, kedy došlo k úplnému vymiznutiu nádorových buniek z pôvodného miesta tumoru a k ich nahradeniu reparačnými bunkami (hlavne fibroblastmi), naopak skóre TRG 5 znamená, že v tumore po liečbe nenastali žiadne alebo iba minimálne zmeny a väčšina jeho objemu je stále tvorená vitálnymi nádorovými bunkami (15). Na základe TRG skóre boli pacienti rozdelení do dvoch skupín. Prvú skupinu, označení ako „respondéry“, tvorili pacienti s tumormi, u ktorých došlo k regresii nádoru hodnotenou ako TRG 1–2. Druhú skupinu, označení ako „nonrespondéry“, tvorili pacienti s tumormi, u ktorých nastala minimálna alebo žiadna odpoveď na aplikovanú neoadjuvantnú liečbu, skóre TRG 4–5. Všetci pacienti podpísali informovaný súhlas s neoadjuvantnou liečbou a s odberom vzoriek nádorového tkaniva.
Izolácia a kontrola kvality RNA
Bioptický materiál bol ihneď po chirurgickom vyňatí zamrazený a uskladnený pri -80 oC do ďalšieho spracovania. Celková RNA bola izolovaná pomocou TriReagentu (MRC, Research, USA) podľa doporučenia výrobcu. Čistota bola overená spektrofotometricky pomocou prístroja NanoDrop a nekontaminovaná RNA (A260/A280 > 2; A260/A230 > 1,7) bola ďalej spracovaná. Integrita RNA bola kontrolovaná metódou kapilárnej gélovej elektroforézy prístrojom Agilent 2100 Bioanalyzer (Agilent Technologies, USA). Iba nefragmentovaná RNA charakterizovaná hodnotou RIN (RNA Integrity Number) vyššou než 7 bola použitá pre ďalšiu analýzu (16).
Spracovanie oligonukleotidových čípov (Oligo GEArrays)
K získaniu expresných profilov sme použili nízkohustotné oligonukleotidové čípy Cancer Oligo GEArray (OHS-802) společnosti SuperArray (SuperArray Bioscience Corp., USA) nesúce sondy pre detekciu 440 génov so známou funkciou v nádorovej biológii. K lineárnej amplifikácii ~3 μg intaktnej RNA každého vzorku a jej značeniu biotínom-16--UTP (Enzo Life Sciences, USA) sme použili kit TrueLabeling-AMP™ 2.0 (SuperArray Bioscience Corp., USA). Získaná cRNA bola prečistená pomocou kolonkového kitu ArrayGrade™ cRNA Cleanup Kit (SuperArray Bioscience Corp., USA). cRNA sondy boli následne denaturované a hybridizované 20 hodín na nylonovej membráne čípu nesúceho oligonukleotidové sondy špecifické pre jednotlivé gény. Hybridizovaná cRNA bola detekovaná po väzbe biotínu na avidin-fosfatázový konjugát chemiluminiscenčnou reakciou s činidlom CDPstar (Tropix, Inc., Bedford, USA). Všetky postupy boli realizované podľa doporučenia výrobcu. Chemiluminiscenční obraz bol snímaný 16-bitovou chladenou CCD kamerou (Alpha Innotech Ltd., USA) po dobu 7 minút.
Analýza obrazu a spracovanie dát
Analýza obrazu, odčítanie pozadia (spot s najnižšou intenzitou) a normalizácia dát bola realizovaná pomocou webovej aplikácie GEArray Expression Analysis Suite (SuperArray Bioscience Corp., USA). Intenzita signálu jednotlivých spotov bola normalizovaná pomocou sady housekeepingových génov (GAPDH, ACTB, HSPCB, RPS27A a B2M). Štatistická analýza a vizualizácia normalizovaných dát boli realizované pomocou softwaru TIGR MultiExperiment Viewer version 3.1 (The Institute for Genomic Research, 2003, http://www.tigr.org) (17). K identifikácii génov rozdielne exprimovaných medzi dvoma skupinami pacientov sme použili dvojvýberový t-test (α = 0,01) a metódu SAM (Significance Analysis of Microarrays) (18). Metóda SAM bola použitá k štúdii typu „two class unpaired data“ s počtom permutácií 1000, pre minimálnu hodnotu odhadu FDR (false discovery rate) bola stanovená hranica ∆ = 0,74 medzi skupinami pacientov s rôznou odpoveďou na neoadjuvantnú liečbu.
Výsledky
Klinická charakteristika súboru analyzovaných pacientov
Do štúdie bolo zaradených celkom 17 pacientov; 10 pacientov tvorilo skupinu respondérov (6 pacietov s TRG 1 a 4 pacienti s TRG 2), zvyšných 7 pacientov tvorili skupinu nonrespondérov (všetci TRG 4). Medián veku pacientov bol 55 rokov (v rozmedzí od 31 do 68 rokov). Väčšina pacientov bola mužského pohlavia (n = 13), 14 pacientov mala ochorenie v klinickom štádiu III, 3 pacienti v štádiu II. Preferovanejším chemoterapeutickým režimom bol kapecitabín (n = 13), najmä kvôli jeho perorálnej liekovej forme (tzv. „patient-friendly chemotherapy“). Dowstaging (DS) v „T/N“ sme definovali ako zníženie „T/N“ klasifikácie od klinického stagingu pomocou TRUS predoperačne (cT a cN) voči patologickému stagingu (ypT a ypN). Downstaging v parametru „T“ nastal u 7 respondérov a 2 nonrespondérov, downstaging v parametru „N“ nastal u 7 respondérov a 5 nonrespondérov. Predoperačnú eleváciu nadorového márkru CEA sme pozorovali u 1 pacienta odpovedajúceho na liečbu a 3 pacientov neodpovedajúcich na liečbu, nádorový marker CA 19–9 bol elevovaný predoperačne len v jednom prípade pacienta, ktorý bol rezistentný k neoadjuvantnej chemorádioterapii. Redukcia chemoterapie nebola nutná u žiadneho pacienta, jej odklad kvôli myelotoxicite bol nutný u jedného pacienta, redukcia dávky rádioterapie bola zaznamenaná v jednom prípade (34 Gy, -37 %). Vzdialenosť od anokutánnej línie (AC línia) bola od 4 do 13 cm, celkovo u piatich pacientov bola po ukončení neoadjuvatnej liečbe nutná trvalá stómia. Charakteristika súboru pacientov je v tabuľke 1.
Tab. 1. Charakteristika súboru pacientov 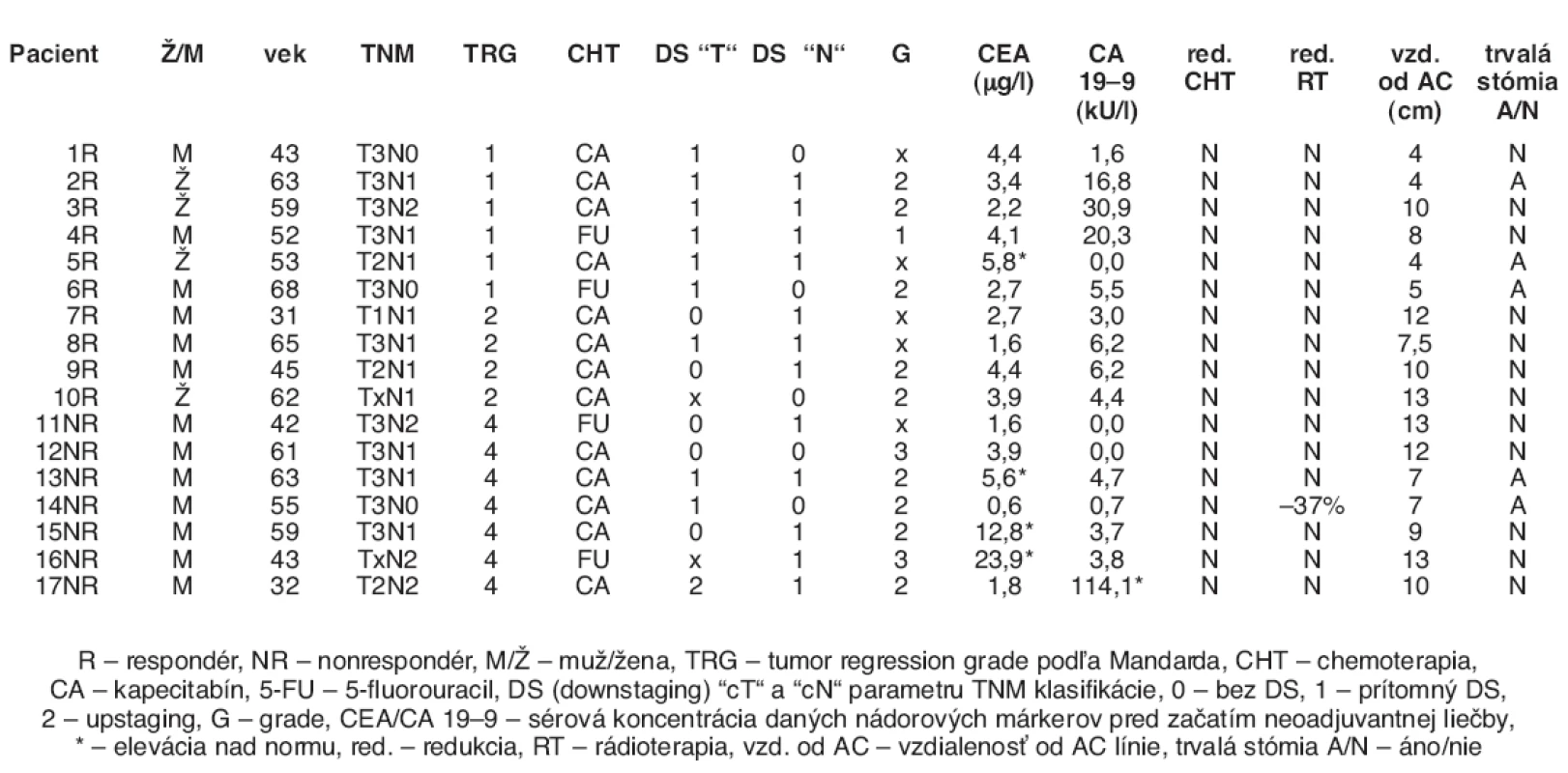
Analýza expresných profilov nádorov pacientov podľa odpovedi na neoadjuvantnú chemorádioterapiu
Relatívna expresia 440 génov bola stanovená u 17 primárnych rektálnych karcinómov pred začatím liečby neoadjuvantnou konkomitantnou chemorádioterapiou. Gény s expresiou nižšou než 5 % mediánu expresie všetkých analyzovaných génov boli považované za neexprimované. Pomocou t-testu (α = 0,01) a metódy SAM bolo identifikovaných 8 génov (RB1, RBBP4, HYOU1, JUNB, MDM4, CANX, MMP2, TCF7L2) signifikantne up-regulovaných v nádoroch nonrespondérov (tab. 2). Príklady dvoch nízkohustotných oligonukleotidových čipov sú na obrázku 1.
Tab. 2. Skupina génov, ktoré sú up-regulované u pacientov, ktorých karcinóm konečníka bol rezistetný na neoadjuvantnú chemorádioterapiu 
Obr. 1. Ukážka nízkohustotných oligonukleotidových čípov analyzovaných vzoriek 
Diskusia
Cieľom štúdie bolo overiť možnosť využitia nízkohustotných oligonukleotidových čípov k predikcii úspešnosti neoadjuvantnej konkomitantnej chemorádioterapie u pacientov s lokálne pokročilým karcinómom rekta. Identifikovali sme 8 génov so signifikantne zvýšenou expresiou v karcinómoch rezistentných k aplikovanej chemorádioterapii. V prípade všetkých 8 génov je naše pozorovanie v súlade s ich biologickou funkciou. Publikačne je doložená spojitosť medzi expresiou týchto génov a zvýšenej schopnosti bunkového prežívania, chemorezistencie či rádiorezistencie (19, 20).
Regulátor bunkového cyklu, retinoblastomový gén RB1, a jeho mutácie vedúce k strate regulácie bunkovej proliferácie, boli dokázané u mnohých nádorových ochoreniach (21). Zvýšené hladiny proteínu RB1 sú asociované s amplifikáciou génu pre dihydrofolát reduktázu (DHFR), ktorá je jedným z mechanizmov rezistencie na anti-folátovú chemoterapiu (21). Proteín RB1 bol tiež študovaný v súvislosti s proteínom BAG-1 (Bcl-2 associated athanogene-1), ktorého koexpresia v bunkovom jadre zvyšovala odolnosť kolorektálnych nádorových buniek voči indukcii apoptózy gama žiarením (21). Proteín RB interaguje s viacerými bunkovými proteínmi, napríklad i s RbAp48, ktorý sme identifikovali i v našej štúdii. Tento proteín je up-regulovaný u nonrespondérov. RBBP4 (RbAp48) sa špecificky viaže na C-koniec RB1 génu. Reguluje morfológiu buniek a organizáciu cytoskeletu prostredníctvom zvýšenej K-Ras aktivity a signálnej dráhy MAPK, tým dochádza k zvýšeniu proliferácie a útlmu apoptotických procesov (22). Tento gén je down-regulovaný v prípade nefunkčnosti NF-κB (nuclear factor kappaB). NF-κB je multiproteínový komplex, ktorý plní funkciu transkripčného faktora a riadi génovú expresiu hlavne antiapoptotických génov, cytokínov a génov pre angiogenézu (23). Imunohistochemická analýza nádorového/nenádorového tkaniva štítnej žľazy potvrdila vysokú expresiu RbAP48 v nádorovom tkanive (23). Protein HYOU1 (Orp150) má dôležitú úlohu pri hypoxii/ischémii a angiogenéze. Hypoxia je známym induktorom rádiorezistencie (24). Zvýšená expresia HYOU1 bola popísaná u nádorových ochoreniach prostaty, močového mechúra a prsu (25). Jeho zvýšená expresia je indikátorom horšej prognózy u invazívneho mamárneho karcinómu (25). Zvýšená expresia JUNB vedie k zvýšeniu proliferácie buniek, k zníženiu apoptózy, synergizuje s NF-κB (26). Ďalším z identifikovaných génov je MDM4, ktorého proteínový produkt interaguje s proteínom p53. Ribozomálny stres spôsobený narušením syntézy rRNA vyvolá uvoľnenie proteínov z nukleolov, ktoré vyväzujú MDM2, a bránia tak MDM2-riadenej degradácii p53. K aktivácii p53 ribozomálnym stresom je nutná tiež degradácia MDM4 (27). Bunky so zvýšenou expresiou MDM4 sú menej citlivé k aktinomycínom-D indukovanej zástave bunkového cyklu vďaka tvorbe MDM4-p53 inaktívnych komplexov. Tento efekt bol pozorovaný in vivo u myší, kde zvýšená expresia MDM4 bola spojená s rezistenciou na 5-fluorouracil (27). Kalnexín je membránový proteín endoplazmatického retikula (ER), s vysokou afinitou k vápenatým iontom, ktorý sa zásadným spôsobom podieľa na regulácii indukcie apoptózy na základe ER stresu (28). Metaloproteinázy a ich inhibítory sa všeobecne zúčastňujú procesu metastázovania nádorového ochorenia. Menšia expresia MMP-2 (gelatináza A) je spojená s lepšou odpoveďou na neoadjuvantnú chemorádioterapiu u pacientov s nádormi dutiny ústnej (29). Zvýšená plazmatická hladina MMP-2 (30) i zvýšená expresia MMP-2 v nádorovom tkanive u pacientov s kolorektálnym karcinómom koreluje s horším prežívaním a väčším rizikom vzniku vzdialených metastáz (31). TF7L2 (TCF-4) je dôležitou súčasťou Wnt/ß-katenínovej signálnej dráhy. TCF/ß-katenínový komplex je spojený s trvalou aktiváciou Wnt signálnej dráhy, ktorá sa zúčastňuje regulácie transkripcie predovšetkým génov, ktoré sú nutné pre proliferáciu bunky a génov s antiapoptotickou funkciou, napr. c-myc, cyklín D1 (32).
V tabuľke 3 sú zhrnuté najdôležitejšie štúdie, ktoré pomocou čípovej analýzy identifikovali gény, ktorých nádorová expresia sa líšila medzi skupinami pacientov s lokálne pokročilým karcinómom konečníka, ktorí odpovedali na neoadjuvantnú liečbu a ktorí boli k nej rezistentní. Ghandimi et al. analyzovali profil génovej expresie 30 pacientov, na 23 vzorkách identifikoval 54 génový prediktor liečebnej odpovede, ktorý overil na validačnej skupine 7 pacientov s citlivosťou 78 % a špecificitou 83 % (33). Watanabe et al. analyzovali génovú expresiu u 52 pacientov, identifikovali 33 génov, ktoré označili za prediktívne k odpovedi na rádioterapiu (34). Kim et al. pracovali so 46 pacientmi, identifikovali rozdiel v nádorovej expresii 95 génoch medzi jednotlivými skupinami pacientov (35).
Pomocou nízkohustotných oligonukleotidových čípov sme identifikovali 8 génov; ich zvýšená expresia je asociovaná s rezistenciou k neoadjuvatnej chemorádioterapii. Po rozšírení nášho súboru pacientov a po validácii výsledkov na úrovni mRNA metódou qRT-PCR a imunohistochemicky na proteínovej úrovni, by tieto sady génov mohli slúžiť nielen k rozšíreniu poznatkov o molekulárnej podstate nádorovej invazivity, diseminácie, chemorezistencie a rádiorezistencie, ale súčasne byť tiež jedným z krokov vedúcich smerom k individualizácii terapie pacientov s lokálne pokročilým karcinómom rekta.
Skratky
CT – počítačová tomografia
ER – endoplazmatické retikulum
Gy – gray
IUCC – International Union Against Cancer
MR – magnetická rezonancia
mRNA – messenger RNA
NF-κB – nuclear factor kappa B
NR – nonrespondéry
5-FU – 5-fluorouracil
R – respondéry
RNA – ribonukleová kyselina
qRT-PCR – kvantitatívna PCR v reálnom čase
TRG – tumor regression grade
TRUS – transrektálna ultrasonografia
Práca bola podporená grantom IGA MZ ČR NR/9076–4.
MUDr. Ingrid Garajová
Klinika komplexní onkologické péče, Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
fax: +420 543 132 455, e-mail: garajova@mou.cz
Zdroje
1. Rimkus, C., Friederichs, J., Boulesteix, A. et al.: Microarray-based prediction of tumor response to neoadjuvant radiochemotherapy of patients with locally advanced rectal carcinoma. Clinical Gastroenterology and Hepatology, 2008, 6, s. 53–61.
2. Kocáková, I., Růžičková, J., Kocák I. et al.: Role of concomitant chemoradiotherapy in the treatment algorithm for rectal carcinoma. Čas. Lék. čes., 2003, 142 (Suppl. 1), s. 32–35.
3. Sauer, R., Becker, H., Hohenberger, W. et al.: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N. Eng. J. Med., 2004, 351, s. 1731–1740.
4. Kapiteijn, E., Marijnen, C., Nagtegaal, I. et al.: Preoperative radiotherapy combined with total mesorectal excision for resecable rectal cancer. N. Eng. J. Med., 2001, 345, s. 638–646.
5. Bosset, J., Collette, L., Calais, G. et al.: Chemotherapy with preoperative radiotherapy in rectal cancer. N. Eng. J. Med., 2006, 355, s. 1114–1123.
6. Gerard, J., Conroy, T., Bonnetain, F. et al.: Preoperative radiotherapy with or without concurrent fluorouracil with leucovorin in T3–4 rectal cancers: results of FFCD 9203. J. Clin. Oncol., 2006, 24, s. 4620–4625.
7. Yerushalmi, R., Idelevich, E., Dror, Y. et al.: Preoperative chemoradiation in rectal cancer: retrospective comparison between capecitabine and continous infusion of 5-fluorouracil. J. Clin. Oncol., 2006, 93, s. 529–533.
8. Ortholan, C., Francois, E., Thomas, O. et al.: Role of radiotherapy with surgery for T3 and resecable T4 rectal cancer: evidence from randomized trials. Dis. Colon Rectum, 2006, 49, s. 302–310.
9. Kim, D., Kim, D., Kim, T. et al.: Is T classification still correlated with lymph node status after preoperative chemoradiotherapy for rectal cancer? Cancer, 2006, 106, s. 1694–700.
10. Theodoropoulos, G., Wise, W., Padmanabhan., A. et al.: T‑level downstaging and complete pathological response after preoperative chemoradiation for advanced rectal cancer result in decreased recurrence and improved disease-free survival. Dis. Colon Rectum, 2002, 45, s. 895–903.
11. Kocáková, I., Svoboda M., K., Kubosova, K. et al.: Preoperative radiotherapy and concomitant capecitabine treatment induce thymidylate synthase and thymidine physphorylase mRNAs in rectal carcinoma. Neoplasma, 2007, 54, s. 447–453.
12. Merkerová, M., Kráčmarová, A., Bruchová, H. et al.: Využití biočipových technologií v onkologii. Klin. Onkol., 2006, 19 (Suppl. 2), s. 333–337.
13. Brdička, R., Bruchová, H. et al.: Vznik a rozmach čipových technológií. Klin. Onkol., 2006, 19 (Suppl. 2), s. 331–332.
14. Svoboda, M., Michálek, J. et al: Úvod do technologie DNA čipů. Lékař a technika, 2006, 35, s. 67–75.
15. Mandard, A., Dalibard, F., Mandard, J. et al.: Pathologic assessment of tumor regression after preoperative chemoradiotherapy of oesophageal carcinoma: Clinicopathologic correlations. Cancer, 1994, 73, s. 2680–2686.
16. Schroeder, A., Mueller, O., Stocker, S. et al.: The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol. Biol., 2006, 7, s. 3–13.
17. Dudoit, S., Gentleman, R., Quackenbush, J. et al.: Open source software for the analysis of microarray data. Biotechniques, 2003 (Suppl.), s. 45–51.
18. Kooperberg, C., Sipione, S., LeBlanc, M. et al.: Evaluating test statistics to select interesting genes in microarray experiments. Hum. Mol. Genet., 2002, 11, s. 2223–2232.
19. Slabý, O., Garajová, I., Svoboda, M. et al.: Pilotní studie identifikace prognostických markerů u pacientů s kolorektálním karcinomem analýzou profilů genové exprese. Klin. Onkol., 2006, 19 (Suppl. 2), s. 402–407.
20. Slabý, O., Garajová, I., Svoboda, M. et al.: Studium patogeneze kolorektálních karcinomů pomocí profilů genové exprese a možnosti jejich využití v diagnostické a prediktivní onkologii. Klin. Onkol., 2006, 19 (Suppl. 2), s. 382–388.
21. Clemo, N., Arhel, N., Barnes, J. et al.: The role of the retinoblastoma protein (Rb) in the nuclear localization of BAG-1: implications for colorectal tumour cell survival. Biochem. Soc. Trans., 2005, 33, s. 676–678.
22. Scuto, A., Zhang, H., Zhao, H. et al.: RbAp48 regulates cytoskeletal organization and morphology by increasing K–Ras activity and signaling through mitogen-activated protein kinase. Cancer Res., 2007, 67, s. 10317–10324.
23. Pacifico, F., Paolillo, M., Chiapetta, G. et al.: RbAp48 is a target of nuclear factor-kappaB activity in thyroid cancer. J. Clin. Endocrinol. Metab., 2007, 92, s. 1458–1466.
24. Wardman, P.: Chemical radiosenzitiers for use in radiotherapy. Clin. Oncol. (R. Coll. Radiol.), 2007, 19, s. 397–417.
25. Stojadinovic, A., Hooke, J., Shriver, C. et al.: HYOU1/Orp150 expression in breast cancer. Med. Sci. Monit., 2007, 13, s. 231–239.
26. Mathas, S., Hinz, M., Anagnostopoulos, I. et al.: Aberrantly expressed c-Jun and JunB are a hallmark of Hodgkin lymphoma cells, stimulate proliferation and synergize with NF-B. Embo J., 2002, 21, s. 4104–4113.
27. Gilkes, D., Chen, L., Chen, J. et al.: MDMX regulation of p53 response to ribosomal stress. Embo J., 2006, 25, s. 5614–5625.
28. Delom, F., Fessart, D., Chevet, E. et al.: Regulation of calnexin sub-cellular localization modulates endoplasmic reticulum stress-induced apoptosis in MCF-7 cells. Apoptosis, 2007, 12, s. 293–305.
29. Arenas-Huertero, F., Herrera-Goepfert, R., Delgado-Chavez, R. et al.: Matrix metalloproteinases expressed in squamous cell carcinoma of the oral cavity: correlation with clinicopathologic features and neo–adjuvant chemotherapy response. J. Exp. Clin. Cancer Res., 1999, 18, s. 279–284.
30. Angenete, E., Langenskiöld, M., Falk, P. et al.: Matrix metalloproteinases in rectal mucosa, tumour and plasma: response after preoperative irradiation. Int. J. Colorectal. Dis., 2007, 22, s. 667–674.
31. Hilska, M., Roberts, P., Collan, Y. et al.: Prognostic significance of matrix metalloproteinases-1,-2,-7 and -13 and tissue inhibitors of metalloproteinases-1,-2,-3 and -4 in colorectal cancer. Int. J. Cancer, 2007, 15, s. 714–723.
32. Burwinkel, B., Shanmugam, K., Hemminki, K. et al.: Transcription factor 7-like 2 (TCF7L2) variant is associated with familial breast cancer risk: a case control study. BMC Cancer, 2006, 6, s. 268–271.
33. Ghadimi, B., Grade, M., Difilippantonio, M. et al.: Effectiveness of gene expression profiling for response prediction of rectal adenocarcinomas to preoperative chemoradiotherapy. J. Clin. Oncol., 2005, 23, s. 1826–1838.
34. Watanabe, T., Komuro, Y., Kiyomatsu, T. et al.: Prediction of sensitivity of rectal cancer cells in response to preoperative radiotherapy by DNA microarray analysis of gene expression profiles. Cancer Res., 2006, 66, s. 3370–3374.
35. Kim, I., Lim, S., Kang, H. et al.: Microarray gene expression profiling for predicting complete response to preoperative chemoradiotherapy in patients with advanced rectal cancer. Dis. Colon Rectum, 2007, 50, s. 1342–1353.
36. Dworak, O., Keilholz, L., Hoffman, A. et al.: Pathological features of rectal cancer after preoperative radiochemotherapy. Int. J. Colorectal. Dis., 1997, 12, s. 19–23.
37. Response assessment of nonsurgical treatment for colorectal carcinoma. Japanese classification of colorectal carcinoma. Japanese Society for Cancer of the Colon and Rectum. 1st English ed.Tokyo, Kanehara & Co. Ltd, 1997, s. 77–82.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Nová funkce C3d komplementové komponenty
- Změny v genové expresi během inzulínové rezistence a „diabezity“ v inzulín-senzitivních tkánícha možnosti jejich regulace
- Migrace různých typů lymfocytů ve tkáni
- Biologická a nebiologická eliminační léčba akutního selhání jater Experimentální práce na velkém laboratorním zvířeti
- Vztah inzulínové rezistence a množství viscerálního tuku
- Využitie profilov génovej expresie k stanoveniu odpovedi k neoadjuvantnej konkomitantnej chemorádioterapii u pacientov s karcinómom rekta: pilotná štúdia
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC3. Vývoj v období po narození*
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
- Toll-like receptory a jejich generická variabilita při streptokokové pneumonii
- Prof. R. čihák – anatom a embryolog – 80. výročí narození
- Série seminářů „nová legislativa“ programu PACE oslovila i lékaře
- Medical Fair
- Před úsvitem, po ránu
- Základy klinické farmakologie
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Vztah inzulínové rezistence a množství viscerálního tuku
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



