-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSeptický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
Septic shock in fatal pneumonia caused by Staphylococcus aureus: The significance of producing Pantone-Valentine leukocidine – case report
Necrotizing pneumonia caused by Staphylococcus aureus producing Pantone-Valentine leukocidin (PVL) is a rare but life-threatening disease. Early diagnosis of staphylococcal etiology is necessary for successful treatment. Linezolid is the first choice antibiotic that should be preferred to beta-lactams and vancomycin in this indication.
We report a case of 29-year-old man who was admitted for severe septic shock and incipient pneumonia and died 8 hours after admission despite intensive care. PVL-producing Staphylococcus aureus was isolated from the blood cultures.Keywords:
sepsis – pneumonia – Staphylococcus aureus – Pantone-Valentine leukocidin
Autoři: Beneš Jiří 1; Myslivec Ondřej 2; Laštíková Jarmila 3; Gabrielová Alice 4; Petráš Petr 5; Pantůček Roman 6
Působiště autorů: Klinika infekčních nemocí 3. LF UK, FN Na Bulovce, Praha 1; 1. interní oddělení FN Na Bulovce, Praha 2; Patologicko-anatomické oddělení FN Na Bulovce, Praha 3; Oddělení klinické mikrobiologie FN Na Bulovce, Praha 4; Národní referenční laboratoř pro stafylokoky, Státní zdravotní ústav, Praha 5; Ústav experimentální biologie, Přírodovědecká fakulta MU, Brno 6
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 6, s. 337-341
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Nekrotizující pneumonie vyvolaná zlatým stafylokokem produkujícím Pantonův-Valentinův leukocidin (PVL) je vzácná, ale životu nebezpečná choroba. Pro úspěšnou léčbu je nutné rychlé rozpoznání stafylokokové etiologie. Lékem volby je linezolid, který má v této indikaci přednost před beta-laktamovými antibiotiky i vankomycinem.
Prezentujeme případ 29letého muže, který byl přijat na interní oddělení pro těžký septický šok a počínající pneumonii a přes veškerou péči zemřel za 8 hodin po přijetí. Kmen Staphylococcus aureus, izolovaný z hemokultur, byl producentem PVL.Klíčová slova:
sepse – pneumonie – Staphylococcus aureus – Pantonův-Valentinův leukocidinÚvod
Pro léčbu těžké sepse byly přijaty léčebné standardy, které obsahují doporučení podat baktericidní antibiotikum, obvykle ze skupiny beta-laktamů, do 1 hodiny po stanovení diagnózy [1]. Při neznámé etiologii sepse se volí nejspíše přípravek ze skupiny karbapenemů nebo cefalosporin 3.–4. generace, někdy v kombinaci s aminoglykosidem nebo vankomycinem. Doporučení pro terapii těžce probíhající pneumonie vychází z podobných zásad, postupem volby je podání penicilinového nebo cefalosporinového antibiotika v kombinaci s makrolidem, popř. tzv. respirační fluorochinolony v monoterapii [2].
V některých situacích však tyto doporučené postupy mohou selhat. V České republice bylo v posledních dvou letech hlášeno 7 případů těžké pneumonie provázené hypotenzí, které nereagovaly na standardní terapii. Tato onemocnění byla způsobena zlatým stafylokokem, který tvořil zvláštní toxin, nazývaný Pantonův-Valentinův leukocidin (tab. 1). Volba antibiotika v těchto případech musí být jiná, jinak hrozí smrt pacienta.
Tab. 1. Případy pneumonie způsobené S. aureus s produkcí PVL v ČR od prosince 2007 
aKazuistika je popsána v tomto sdělení. MRSA – meticilin-rezistentní S. aureus, MSSA – meticilin-senzitivní S. aureus Pantonův-Valentinův leukocidin (PVL) je vysoce účinný toxin, který se zanoří do buněčné membrány polymorfonukleárů nebo makrofágů a vytvoří v ní otvory, jimiž unikne buněčný obsah. Bakterie prostřednictvím tohoto toxinu dokáže zabíjet leukocyty ještě dříve, než se k ní mohou přiblížit. Tím je znemožněna fagocytóza a mikrobi ve tkáních se tak mohou snadno množit.
Geny pro tvorbu PVL se vyskytují jen asi u 2 % kmenů Staphylococcus aureus, a to především u kmenů, které se šíří volně v komunitě. V nozokomiálním prostředí se bakterie s produkcí PVL objevují jen výjimečně. Z praktického hlediska je důležité, že přítomnost genů pro tvorbu PVL bývá často spojena s rezistencí na beta-laktamová antibiotika – jde pak o tzv. komunitní kmeny S. aureus rezistentní k meticilinu, v anglické literatuře označované akronymem CA-MRSA (community-acquired methicillin-resistant Staphylococcus aureus).
Kmeny S. aureus produkující PVL vyvolávají obvykle infekce kůže a měkkých tkání anebo pneumonie, naopak jen vzácně jsou nalézány jako původci endokarditid, sepsí nebo osteomyelitid [7]. Nejvíce nebezpečné jsou pneumonie, které mají velice rychlý průběh a často končí fatálně. Postiženými jsou přitom zpravidla mladí a dosud zdraví lidé. Zrádnost onemocnění způsobených jmenovanými kmeny S. aureus ukazuje připojená kazuistika.
Kazuistika
Na ambulanci interního oddělení přišel 29letý muž a zde zkolaboval ještě před přijetím. Měl neměřitelný krevní tlak a známky centralizace oběhu, proto byl okamžitě převezen na JIP, kde mu byl zaveden centrální žilní katétr a zahájena resuscitace oběhu.
Pacient byl schvácený, s dechovou frekvencí 30/min, bez ikteru a hemoragických projevů. Kůže na končetinách, trupu i obličeji byla mramorovaná, chladná, cyanotická. Na horních končetinách i v obou tříslech byly patrné četné starší jizvičky po vpichách. Spojivky byly prokrvené, jazyk oschlý, žlutavě povleklý, náplň krčních žil nezvýšena, dýchání symetrické, čisté, akce srdeční pravidelná, 120/min, ozvy tlumené, bez šelestu, břicho v úrovni, palpačně nebolestivé, játra a slezina nezvětšeny, oblast ledvin nebolestivá, dolní končetiny bez otoků a známek flebotrombózy. Při orientačním neurologickém vyšetření byly shledány jen středně vyjádřené meningeální příznaky, bez fokálních projevů.
Po zahájení resuscitační léčby byl nemocný schopen vypovídat, proto bylo možné sepsat základní anamnézu. Pacient přiznal nitrožilní toxikomanii, v letech 1999–2004 byl závislý na heroinu, nyní užíval pravidelně clonazepam (Rivotril) a buprenorfin (Subutex). Kromě toho si nitrožilně stále píchal metamfetamin (pervitin), cca 1krát měsíčně, poslední aplikaci udával před 10 dny. Z osobní anamnézy byl dále významný jen údaj o chronické hepatitidě (blíže nespecifikovaný), alergii na penicilin a stav po appendektomii v dětství. Pacient byl také opakovaně ambulantně léčen pro výsevy herpes simplex; poslední erupce nastala měsíc před popisovanou hospitalizací a vyrážka postihovala nejen oblast rtu, ale i dolní víčko a spojivku levého oka.
Nynější onemocnění začalo asi před 10 dny bolestmi zad, kyčlí a celého těla a celkovou slabostí. Poslední dva dny se stav zhoršoval, pacient měl pocit horečky, ale neměřil se.
Výsledky odběrů krve z centrálního žilního katétru: leukocyty 10,2 x 109/l; erytrocyty 5,26 x 1012/l; hemoglobin 156 g/l; trombocyty 171 x 109/l; Quickův čas – INR 1,51; APTT-R 1,03; D-dimery > 2000 ng/ml. Glykémie 4,56 mmol/l; Na 129,5 mmol/l; K 4,95 mmol/l; Cl 85 mmol/; urea 17,97 mmol/l; kreatinin 407 μmol/l; bilirubin 54 μmol/l; AST 11,54 μkat/l; ALT 4,09 μkat/l; ALP 1,41 μkat/l; GMT 0,39 μkat/l; CK 171,50 μkat/l; CKMB 2,26 μkat/l; troponin 0,04 μg/l; myoglobin > 10000 μg/l; albumin 29 g/l; CRP 307,7 mg/l; prokalcitonin >10 ng/ml; pH 7,053; pCO2 3,51 kPa; pO2 13,29 kPa; BE -21,1 mmol/l.
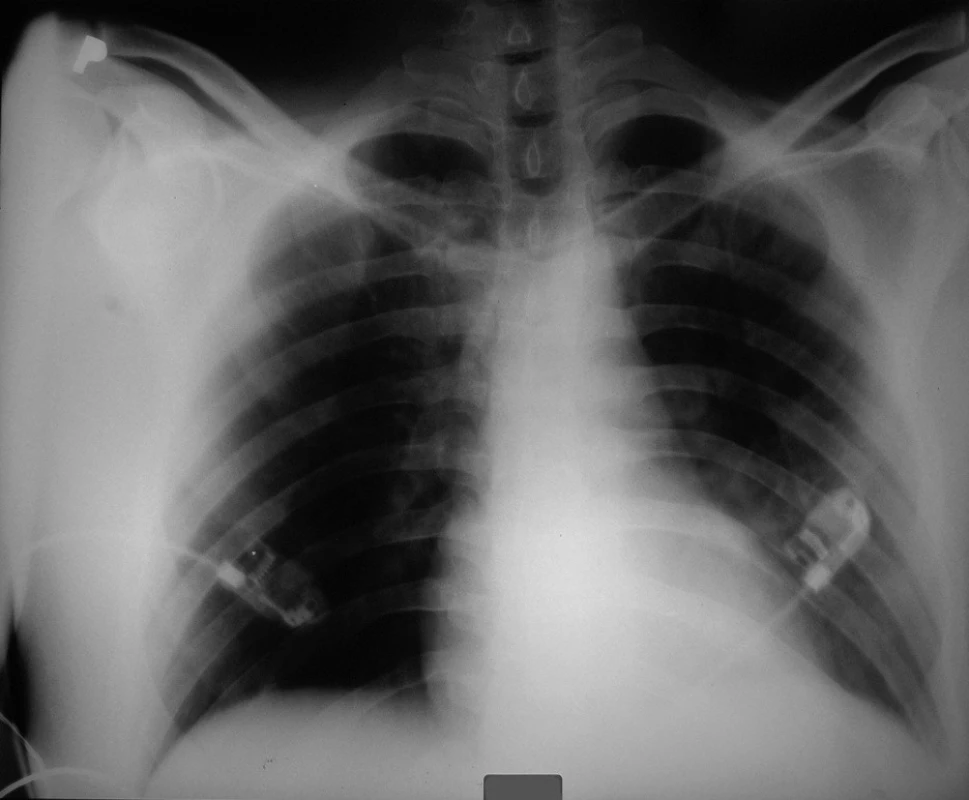
Křivka EKG ukazovala sinusový rytmus s AV blokádou 2. stupně, bez známek ložiskové léze myokardu. Na RTG snímku plic byl popsán nevelký infiltrát parakardiálně vlevo, zmnožená plicní kresba v pravém horním plicním laloku, srdce nezvětšeno (obr. 1).
Stav byl hodnocen jako septický šok nejasné etiologie. Přivolaný konziliář z infekční kliniky vyslovil na základě údajů o aktivní toxikomanii podezření na infekční endokarditidu trikuspidální chlopně s embolizacemi do plic.
Pacient dostával od příjmu infuze krystaloidů i koloidů, noradrenalin, hydrokortizon, omeprazol. Po odběru dvou hemokultur byla zahájena léčba cefotaximem, k němuž byl s ohledem na možnou endokarditidu přidán vankomycin. Přes veškerou léčbu trvala těžká hypotenze a cyanóza, pacient zůstával anurický. Za 3 hodiny po přijetí byla provedena orotracheální intubace a zahájena umělá plicní ventilace. Byla zavedena nazogastrická sonda. O hodinu později začal pacient mohutně zvracet krev. Urgentní gastroskopie prokázala vícečetné plošné ulcerace, odpovídající ezofagitidě III. stupně, a povředovou deformaci pyloru. Stav se podařilo zvládnout podáním terlipressinu (Remestyp), krevní tlak přechodně vystoupal na hodnoty kolem 110/50, stoupla i tělesná teplota na 38,1 °C. Trvala však periferní cyanóza. Za 8 hodin po příjmu se objevila bradykardie a rozšíření QRS komplexů s následným rychlým přechodem do asystolie. Kardiopulmonální resuscitace byla neúspěšná a pacient zemřel.
Následující den byly v obou odebraných hemokulturách v mikroskopickém obraze patrné grampozitivní koky ve shlucích, což dále podpořilo domněnku o stafylokokové sepsi, nejspíše endokarditidě. Pitva však endokarditidu nepotvrdila. Příčinou smrti byla oboustranná pneumonie, s hnisavou pleuritidou vlevo. Nález na srdci i mozku (pozitivní meningeální příznaky) byl normální, nebylo zjištěno žádné další ložisko infekce.
Histologický nález na plicích byl popsán následovně: Pleura levé plíce je výrazně prokrvená, na povrchu s masivní infiltrací polymorfonukleárů. Většina polymorfonukleárů jeví známky rozpadu, v jejich místě jsou patrné shluky bazofilní drtě. V parenchymu levé i pravé plíce je difuzní řídký eozinofilní exsudát, s přítomností alveolárních makrofágů. Množství polymorfonukleárů je minimální, místy tyto buňky zcela chybějí. Intersticium je výrazně prokrvené, ložiskově má charakter hemoragicko-nekrotické pneumonie.
Mikrob izolovaný z obou hemokultur byl Staphylococcus aureus, rezistentní ke všem testovaným beta--laktamovým antibiotikům (penicilinu, oxacilinu, ampicilinu, ko-ampicilinu, cefalotinu) a dále k erytromycinu, linkomycinu a ofloxacinu. Citlivost byla zachována ke ko-trimoxazolu, gentamicinu, amikacinu, vankomycinu, tetracyklinu, chloramfenikolu, rifampicinu a linezolidu.
Kmen byl dále zaslán do Národní referenční laboratoře pro stafylokoky v SZÚ, Praha. Zde byla potvrzena přítomnost clumping-faktoru, tvorba hyaluronidázy, hemolyzinu alfa a toxinu PVL. Mikrob naopak nebyl producentem žádného enterotoxinu, exfoliatinu ani toxinu syndromu toxického šoku TSST-1. Fagotypová charakteristika: 54, 79, 83A, 84, 85, 95. DNA mikroba obsahovala gen mecA kódující rezistenci k meticilinu a ostatním beta-laktamům – jednalo se tedy o MRSA. Na Přírodovědecké fakultě Masarykovy univerzity v Brně byla provedena podrobná genotypizace bakteriálního kmene prostřednictvím pulzní gelové elektroforézy, PCR identifikace mobilních genetických elementů a sekvenční analýzy genu spa. Využitím těchto postupů bylo zjištěno, že izolát patří do celosvětově rozšířeného komunitního klonu MRSA USA300.
Závěrečná diagnóza
- Oboustranná alární pneumonie způsobená kmenem Staphylococcus aureus, rezistentního k meticilinu (MRSA) a produkujícího Pantonův-Valentinův leukocidin (PVL).
- Hnisavá pleuritida vlevo, s progresí do mediastina, fibrinózní perikarditida.
- Septický šok rezistentní na léčbu jako příčina smrti.
- Hematemeza při těžké chronické vředové chorobě gastroduodenální.
- Nitrožilní toxikomanie, chronická virová hepatitida (anamnesticky).
Diskuse
V popsaném případě se pacient do nemocnice dostavil příliš pozdě a letálnímu zakončení nebylo možné zabránit. Nicméně kazuistiky jiných nemocných ukazují, že i při akutním průběhu choroby je možné vyléčení, podá-li se účinná terapie okamžitě.
Prvotní otázka tedy zní: Na základě jakých indicií by lékař měl pomýšlet na možnost, že původcem nemoci je S. aureus tvořící PVL? Odpovědi přináší tabulka 2.
Tab. 2. Charakteristické klinické a laboratorní projevy infekce, které lze využít pro časnou diagnózu (ne všechny bývají současně přítomny) 
K údajům v tabulce doplňujeme vysvětlující komentář:
Ad 1) Na výskyt těžkých stafylokokových pneumonií u kojenců upozorňují kromě tuzemské kazuistiky i zahraniční autoři [5, 8].
Ad 3) Projevy hypotenze nebo septického šoku se vysvětlují tím, že stafylokokové toxiny mohou působit jako superantigeny [7]. To znamená, že tyto toxiny se přímo vážou na receptory T lymfocytů a indukují v nich tvorbu prozánětlivých cytokinů. Množství uvolněných prozánětlivých cytokinů často několikanásobně překračuje hodnoty, které doprovázejí běžnou sepsi. Proto i klinické projevy stafylokokových toxikóz (např. syndromu toxického šoku) mohou být bouřlivější než projevy stafylokokové sepse.
Ad 4) a 6) Nízký počet polymorfonukleárů je způsoben účinkem stafylokokového leukocidinu. V naší kazuistice měl sice pacient leukocytózu 10,2 x 109/l, vzhledem k závažnosti a akutnosti onemocnění by však bylo možné očekávat vyšší hodnoty. Největší nedostatek leukocytů je vždycky v místě infekce, protože zde je největší koncentrace stafylokokového leukocidinu. Tuto situaci dobře vystihuje histologický popis postižené plicní tkáně.
Ad 7) Samozřejmě je nezbytné před zahájením antibiotické terapie provést odběry na kultivaci, aby bylo možné zjistit agens a určit citlivost mikroba na antibiotika; na výsledek kultivačního vyšetření však není možné při rozhodování čekat.
Druhou otázkou je, jak má lékař při vážném podezření na stafylokokovou pneumonii terapeuticky reagovat. V době, kdy není ještě k dispozici výsledek citlivosti, nelze použít beta-laktamová antibiotika, protože kmeny MRSA jsou vůči nim rezistentní. Podobně nelze použít ani makrolidy, linkosamidy, fluorochinolony, chloramfenikol nebo doxycyklin, protože citlovost vůči těmto antibiotikům je v populaci stafylokoků heterogenní. Obecně se při stafylokokové sepsi s dosud neurčenou citlivostí doporučuje podat vankomycin, u stafylokokové pneumonie však platí výjimka – zde se jako nejvýhodnější jeví linezolid (Zyvoxid) [7].
Přednosti linezolidu oproti vankomycinu v léčbě stafylokokové pneumonie jsou dvojí:
a) Linezolid v plicní tkáni i v aveolární tekutině dosahuje stejných nebo vyšších hladin než v plasmě. Naproti tomu koncentrace vankomycinu v plicní tkáni se pohybuje v rozsahu 24–41 % sérových hladin a vylučování do alveolární telutiny je ještě nižší – 5 až 25 % sérových hladin [9].
b) Linezolid v bakteriálních buňkách inhibuje proteosyntézu, takže je schopen rychle zastavit tvorbu stafylokokových toxinů. Vankomycin je sice baktericidní, ale jeho působení je cíleno na inhibici tvorby buněčné stěny a do procesu proteosyntézy nijak nezasahuje. Na bakterie, které se nedělí a přitom tvoří toxin, účinkuje vankomycin se značnou latencí [10]. Zbývá dodat, že u dobře citlivých bakterií lze jako alternativu linezolidu podat kombinaci oxacilinu či vankomycinu s klindamycinem [11]. Kombinace vankomycinu s linezolidem se však nedoporučuje, protože mezi těmito antibiotiky byl popsán antagonismus [12].
Nejdůležitějším uváděným nežádoucím účinkem linezolidu je jeho potenciální hematotoxicita, která se může projevit přechodnou poruchou dělení a zrání hematopoetických buněk v kostní dřeni [13]. Ošetřující lékaři proto mohou mít obavy z podávání tohoto antibiotika u nemocných s leukopenií. Tyto obavy jsou však neopodstatněné. Leukopenie u nemocných se stafylokokovou infekcí je způsobena lytickým účinkem stafylokokového toxinu na zralé leukocyty, krvetvorba u těchto jedinců není narušena. Navíc hematotoxicita linezolidu je kumulativní a objevuje se zpravidla až po dvou týdnech podávání nebo později [13]. Pro léčbu stafylokokové pneumonie by 14denní antibiotická kúra měla být dostačující [7].
Podle některých autorů by kromě antibiotické léčby měl pacient dostat i intravenózní imunoglobuliny v dávce kolem 2 g/kg hmotnosti [11, 14], nejde však o obecně sdílené mínění [15].
Je důležité, že i poměrně rozsáhlá devastace plicní tkáně se u přeživších pacientů může po několika měsících dechové rehabilitace upravit natolik, že postiženého jedince v běžném životě neomezuje [11, 16].
Závěr
Skutečná incidence pneumonií vyvolaných S. aureus s produkcí PVL není známa. Je možné, že každý rok v České republice zemře několik dalších nemocných, aniž se zjistí podstata jejich choroby. Prosíme proto lékaře, pracující na odděleních intenzivní péče, aby na tuto nemoc mysleli a aby pacienty s podezřením na stafylokokovou etiologii neléčili podle jinak platných doporučených postupů. Dále je prosíme, aby při podezření na tuto diagnózu nezapomněli zpětně informovat své kolegy na mikrobiologických odděleních – ti pak zajistí zaslání izolovaného kmene do referenční laboratoře k potvrzení diagnózy.
Poděkování: Podrobná mikrobiologická charakterizace byla provedena v rámci projektu Grantové agentury České republiky (310/09/0459).
Došlo dne 3. 8. 2010.
Přijato dne 21. 9. 2010.
Adresa pro korespondenci:
Doc. MUDr. Jiří Beneš, CSc.
Infekční klinika 3. LF UK
FN Na Bulovce, Praha 8
e-mail: benes.infekce@seznam.cz
Zdroje
1. Dellinger, R. P., Levy, M. M., Carlet, J. M. et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2008. Crit. Care Med., 2008, 36, 1, p. 296–327.
2. Kolek, V. et al. Standard léčebného plánu: Diagnostika a léčba komunitně získané pneumonie dospělých. Doporučený postup České pneumologické a ftizeologické společnosti. Dostupné na www: http://www.pneumologie. cz/odborne/doc/Pneumonie%20standard%20RESP2%202007.pdf
3. Petráš, P., Ježek, P., Machová, I. et al. Další smrtelný případ pneumonie vyvolaný kmenem Staphylococus aureus s produkcí Pantonova-Valentinova leukocidinu. Zprávy EM (SZÚ Praha), 2008, 18, 1, p. 15–17.
4. Ježek, P., Bílina, P., Petráš, P. Fatální pneumonie vyvolaná kmenem Staphylococcus aureus produkujícím Pantonův-Valentinův leukocidin. Antiinfect News, 2010, 1, 1, p. 10–12.
5. Heinige, P., Dedek, V., Fajt, M. et al. Nekrotizující pneumonie kojence s fatálním průběhem, způsobená PVL pozitivním zlatým stafylokokem. Pediatr. Prax., 2009, 10, 5, p. 326–328.
6. Petráš, P., Rumlerová, M., Machová, I. et al. Letální abscedující pneumonie vyvolaná kmenem Staphylococcus aureus oxacilin rezistentním s produkcí Pantonova-Valentinova leukocidinu. Prakt. Lék., 2007, 88, 4, p. 236–239.
7. Que, Y. A., Morellion, P. Staphylococcus aureus (including staphylococcal toxic shock). In Mandell, G. L., Bennett, J. E., Dolin, R. (eds) Principles and Practice of Infectious Diseases. 7th ed. Philadelphia: Churchill Livingstone, 2009, p. 2543–2578.
8. Rojo, P., Barrios, M., Palacios, A. et al. Community-associated Staphylococcus aureus infections in children. Expert Rev. Anti. Infect. Ther., 2010, 8, 5, p. 541–554.
9. Stein, G. E., Wells, E. M. The importance of tissue penetration in archieving successful antimicrobial treatment of nosocomial pneumonia and complicated skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus: vancomycin and linezolid. Curr. Med. Res. Opin., 2010, 26, 3, p. 571–588.
10. Yanagihara, K., Kihara, R., Araki, N. et al. Efficacy of linezolid against Panton-Valentine leucocidin (PVL-positive methicillin-resistant Staphylococcus aureus (MRSA) in a mouse model of haematogenous pulmonary infection. Int. J. Antimicrob. Agents, 2009, 34, 5, p. 477–481.
11. Rouzic, N., Janvier, F., Libert, N. et al. Prompt and succesful toxin-targeting treatment of three patients with necrotizing pneumonia due to Staphylococcus aureus strains carrying the Panton-Valentine leucocidin genes. J. Clin. Microbiol., 2010, 48, 5, p. 1952–1955.
12. Singh, S. R., Bacon, A. E., Young, D. C., Couch, K. A. In vitro 24-hour time-kill studies of vancomycin and linezolid in combination versus methicillin-resistant Staphylococcus aureus. Antimicrob. Agents Chemother., 2009, 53, 10, p. 4495–4497.
13. Zyvoxid. Souhrn informací o přípravku (SPC).
14. http://www.xalatan.cz/files/spc/pfizer/Zyvoxid/Zyvoxid_ SPC_25jun09.pdf
15. Gauduchon, V., Cozon, G., Vandenesch, F. et al. Neutralization of Staphylococcus aureus Panton-Valentine leukocidin by intravenous immunoglobulin in vitro. J. Infect. Dis., 2004, 189, 2, p. 346–353.
16. Morgan, M. S. Diagnosis and treatment of Panton-Valentine leukocidin (PVL)-associated staphylococcal pneumonia. Int. J. Antimicrob. Agents, 2007, 30, 4, p. 289–296.
17. Napolitano, L. M., Brunsvold, M. E., Reddy, R. C., Hyzy, R. C. Community-acquired methicillin-resistant Staphylococcus aureus pneumonia and ARDS. Chest, 2009, 136, 5, p. 1407–1412.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Chladná hlava nad zlatoČlánek Zápis z jednání výboru ČSIMČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍKČlánek Trombocyty v sepsiČlánek Výborová schůze ČSARIM
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 6- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Chladná hlava nad zlato
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Nemocniční používání terapeutické mírné hypotermie u pacientů přežívajících po srdeční zástavě – nárůst v České republice (PRE-COOL 2: Hospital Survey 2008)
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
- Dynamika neurofilamenta pNF-H jako prediktor mortality u dětí s poraněním mozku
- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Trombocyty v sepsi
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- In memoriam doc. MUDr. Václav Trávníček, CSc. (1924–2010)
- Statistika oboru anesteziologie a resuscitace
- Výborová schůze ČSARIM
- Seznam akcí pořádaných v roce 2010 společností ČSARIM nebo pod její záštitou
- Zápis z jednání výboru ČSIM
- Česká resuscitační rada – nová organizace založena s podporou ČSARIM a ČSIM
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Trombocyty v sepsi
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání