-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDynamika neurofilamenta pNF-H jako prediktor mortality u dětí s poraněním mozku
Dynamics of the neurofilament pNF-H as a predictor of mortality in children with brain injury
Objective:
The aim of the study was to determine the importance of increased levels of a high-molecular weight form of neuro-filament subunit (pNF-H) in the serum of children with brain injury, as a predictor of mortality.Design:
Prospective observational study.Setting:
Department of Anaesthesiology and Intensive Care Medicine, University Hospital. Materials and methods: Total 50 children aged 0–19 years hospitalized between June 2007 and September 2009 with severe brain injury were examined. Serum samples were collected on admission and each following day for the first 6 days of hospitalization. Statistical analysis was performed using Wilcoxon test (p < 0.05). The dynamics of the protein serum levels was determined by ANOVA model and discriminatory values of pNF-H were determined by ROC analysis.Results:
Eight (8) children died in the observation group. In these patients, compared with the survivors, we observed a significant increase in the serum values in the first 3 days, followed by a stagnation: Day 1 : 310 pg/mL vs. 97.7 (p = 0.17); day 2 : 1307 pg/mL vs. 153 (p = 0.004); day 3 : 2640 pg/mL vs. 227 (p = 0.006); day 4 : 2100 pg/mL vs. 199 (p = 0.001); day 5 : 847 pg/mL vs. 467 (p = 0.03); day 6 : 1762 pg/mL vs. 573 (p= 0.03). The results of ROC analysis suggest that the levels of pNF-H measured from the second to the sixth day of hospitalization are a suitable predictor of mortality.Conclusion:
A significant relation of elevated serum levels of pNF-H and mortality was found in patients after cranio-cerebral injury.Key words:
head injury – neurofilament – biomarker – dynamics – children
Autoři: Žurek Jiří 1,2; Baštáková Lenka 1; Mihalčin Matúš 1; Forbelská Marie 3; Fedora Michal 1,2
Působiště autorů: Lékařská fakulta, Masarykova univerzita, Brno 1; Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno 2; Ústav matematiky a statistiky, Přírodovědecká fakulta, Masarykova univerzita, Brno 3
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 6, s. 331-336
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Cílem práce bylo zjistit význam dynamiky sérové hladiny vysokomolekulární formy neurofilamentové podjednotky (pNF-H) u dětí s poraněním mozku jako prediktoru mortality.Typ studie:
Prospektivní observační studie.Typ pracoviště:
Anesteziologicko-resuscitační klinika fakultní nemocnice.Materiál a metoda:
Do studie bylo zařazeno 50 dětí ve věku 0–19 let (22 chlapců a 28 dívek), hospitalizovaných s poraněním mozku v období od června 2007 do září 2009. Vzorky séra k diagnostice pNF-H byly odebírány při přijetí, poté následně každý den po dobu 6 dnů. Následně byly analyzovány metodou ELISA. Ke statistickému hodnocení byl použit Wilcoxonův test (hladina významnosti p < 0,05). K určení dynamiky hodnot proteinů byla použita analýza rozptylu (ANOVA) a ke stanovení diskriminačních hodnot pNF-H byla provedena ROC analýza.Výsledky:
Ve sledované skupině zemřelo 8 dětí. U těchto pacientů ve srovnání s přeživšími byl pozorován výrazný nárůst sérových hladin hodnot pNF-H v prvních 3 dnech, následován stagnací: 1. den: 310 pg/ml vs 97.7 (p = 0,17); 2. den 1307 pg/ml vs 153 (p = 0,004); 3. den: 2640 pg/ml vs 227 (p = 0,006); 4. den: 2100 pg/ml vs 199 (p = 0,001); 5. den: 847 pg/ml vs 467 (p = 0.03); 6. den: 1762 pg/ml vs 573 (p = 0,03). Z výsledků ROC analýzy vyplývá, že k predikci mortality jsou vhodné hladiny pNF-H naměřené 2.–6. den hospitalizace.Závěr:
U dětí po kraniocerebrálním poranění byly nalezeny zvýšené hladiny pNF-H v séru v signifikantním vztahu k mortalitě.Klíčová slova:
kraniotrauma – neurofilamenta – biomarker – dynamika – dětiÚvod
Poranění mozku jako následek úrazu (Traumatic Brain Injury, TBI) je závažný celosvětový zdravotní problém. Představuje riziko trvalé invalidizace s velice špatnou prognózou léčby a nezřídka s letálním koncem. I když výsledky léčby jsou u dětí statisticky výrazně lepší než u dospělých (nižší mortalita, méně přetrvávajících vegetativních stavů, častější restituce ad integrum), přesto jsou často příčinou neurologických deficitů a mohou dítě nepříznivě poznamenat na celý život. Nejčastější příčiny TBI jsou pády a dopravní nehody, zejména u dětí do 4 let věku [1]. V dnešní době hodnotíme závažnost poranění zejména na základě klinického stavu pacienta: Glasgow Coma Scale (GCS), amnézie, zvracení, bolest hlavy a pomocí zobrazovacích metod. V akutní fázi TBI využíváme CT vyšetření, které poskytuje uspokojivou základní informaci, nedokáže však dobře zobrazit difuzní axonální poškození. Mnohem vyšší senzitivitu mají vyšetření MRI, SPECT a PET. Využití této diagnostiky je ale limitováno její dostupností a závažností stavu pacienta.
V posledních letech se do popředí zájmu dostává studium biochemických markerů traumatického poranění mozku. Nejvíce studované markery TBI jsou gliální fibrilární kyselý protein (GFAP), bazický myelinový protein (MBP), neuron specifická enoláza (NSE) a S-100 proteiny [2]. Jako vhodný marker poškození nervové tkáně se jeví také hyperfosforylována axonální forma vysokomolekulární neurofilamentové podjednotky NF-H (pNF-H) [3]. Neurofilamenta (NF) představují hlavní složku cytoskeletu neuronů. Jsou mnohem četnější v axonech, kde regulují jejich průměr. Podílejí se zřejmě na odolnosti buněk vůči deformacím a na regulačních procesech [4]. U savců se neurofilamenta skládají ze tří proteinových podjednotek – lehké (NF-L), středně těžké (NF-M) a těžké (NF-H), α-internexinu a nestinu [5]. NF-H podjednotka obsahuje neobvyklé tandemové repetice aminokyselin lysin-serin-prolin (KSP). Tyto repetice jsou velice četné a v axonálních neurofilamentech jsou všechny serinové zbytky fosforylovány (pNF-H) [6]. Hyperfosforylovaný pNF-H protein je více rezistentní k proteázam a dosahuje dostatečně vysokých hladin v séru po TBI, což umožňuje snadnou detekci imunologickými metodami.
Cílem této studie bylo vyhodnocení dynamiky sérových hladin pNF-H a jejich vztah k mortalitě u dětí s TBI. Druhým cílem bylo stanovení optimalního cut-off pro predikci mortality.
Soubor pacientů a metoda
Protokol studie a informovaný souhlas byly schváleny Etickou komisi Fakultní nemocnice Brno.
Tato prospektivní observační studie zahrnuje 50 dětí ve věku 0–19 roků (22 chlapců a 28 dívek), s prokázaným poraněním mozku, hospitalizovaných od června 2007 do září 2009 ve Fakultní nemocnici Brno na Klinice dětské anesteziologie a resuscitace.
Sledovali jsme základní demografická data souboru, GCS, Pediatric Trauma Score (PTS). Glasgow Coma Scale [7] bylo zaznamenáno na základě informace Zdravotnické záchranné služby, ještě před farmakologickým ovlivněním. Pediatric Trauma Score představuje skórovací systém při hodnocení závažnosti úrazů u pediatrických pacientů [8]. PTS se skládá ze šesti parametrů ovlivňujích klinický stav zraněného dítěte. Během počátečního posouzení se vyhodnocuje každý parametr zraněných dětí, vycházející ze tří přidružených proměnných: +2 (žádné zranění nebo bez ohrožení života); +1 (drobné poranění nebo potenciální ohrožení života); -1 (život ohrožující stav). Součet při vyhodnocení se může pohybovat od +12 do -6. Při hodnotě < 8–9 by dítě mělo být hospitalizováno ve specializovaném zdravotnickém zařízení s komplexní pediatrickou péčí.
Po diagnostickém vyhodnocení a případně neurochirurgické intervenci všichni pacienti dostali standardní neurointenzivní terapii, zahrnující intubaci, mechanickou ventilaci, hemodynamické monitorování a monitorování intrakraniálního tlaku podle TBI terapeutického protokolu. Intrakraniální hypertenze byla léčena podle standardního protokolu, který zahrnuje sedaci, relaxaci, mírnou hyperventilaci (cílové PaCO2 32–35 mm Hg), osmoterapii a použití barbiturátů. Hodnoty mozkového perfuzního tlaku byly udržovány na úrovni 60 mm Hg (50 mm Hg u kojenců), a to regulací intrakraniálního tlaku pod hodnotu 20 mm Hg (15 mm Hg u kojenců) a středního arteriálního tlaku na 80 mm Hg (70 mm Hg u kojenců). Venózní vzorky krve ke stanovení hodnot NF-H byly odebrány vždy při přijetí, následně každý den až do 6. dne hospitalizace; potom byly centrifugovány a sérum pro analýzu bylo zamraženo při -70 °C. Hodnota NF-H byla stanovena metodou ELISA na běžně komerčně dostupném setu (BioVendor, Laboratorní medicína, a. s., Česká republika). S odstupem šesti měsíců od úrazu bylo podle protokolu provedeno neurologické vyšetření ke stanovení eventuálního neurologického deficitu. Osoby provádějící diagnostiku a neurologické vyšetření neměly přístup ke klinickým datům.
Statistická metoda
Dynamika (kinetika) hodnot NF-H v průběhu 6 dnů byla modelována pomocí analýzy rozptylu (ANOVA). Vzájemná korelace hodnot v rámci pacientů byla v modelu řešena použitím kovarianční symetrické matice (typu „compound symetry“). Analýza byla provedena na logaritmicky transformovaných datech, aby bylo dosaženo přibližně normálního rozložení hodnocených dat (předpoklad analýzy). Zvolená hladina významnosti byla p < 0,05. Za účelem stanovení diskriminačních charakteristik hodnoty proteinu jsme provedli ROC analýzu. Uváděny jsou ROC křivky spolu s danými diagnostickými charakteristikami (senzitivita, specificita, pozitivní a negativní prediktivní hodnota), dále AUC a optimální cut-off hodnota při nejlepší diagnostické schopnosti proteinu. K statistickému zpracování byl využit software Statistica 9 (StatSoft, Inc.).
Výsledky
Jako klíčový bod pro všechny prediktivní analýzy byla určena mortalita. Hladiny pNF-H v séru u našich pacientů byly v rozmezí od nedetekovatelných (méně než 12,0 pg/ml) až do nejvyšší zachycené hodnoty 7845 pg/ml. Z 50 sledovaných dětí 8 zemřelo (všechny smrt mozku), 3 zůstaly těžce postiženy a 39 dětí mělo po úrazu minimální nebo žádné následky. Demografická data sledovaného souboru jsou uvedena v tabulce 1.
Tab. 1. Demografická data souboru 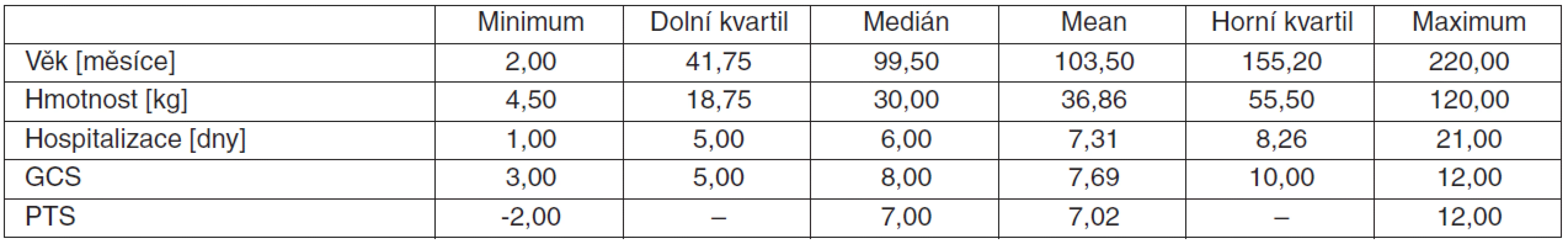
Zkratky: GCS – Glasgow Coma Scale, PTS – Pediatric Trauma Score Dynamika pNF-H
Z grafu 1 je patrná rozdílnost střední hodnoty a variability hodnot v jednotlivých dnech pro pacienty, kteří přežili (non-exitus) a pacienty, kteří zemřeli (exitus). U pacientů, kteří následky poranění mozku nepřežili, byly hladiny pNF-H v séru již od 1. dne vyšší. Zatímco u skupiny přeživších pacientů hladiny v séru mírně stoupaly od 2. až po 6. den hospitalizace, u zemřelých byl výrazný nárůst patrný v prvních 3 dnech, pak byla pozorována stagnace na vyšších hodnotách během celého období sledování, které trvalo celkem 6 dnů. Grafické vyjádření lze podpořit i neparametrickým statistickým testem (Wilcoxonův Rank-Sum-Test/Mannův-Whitneyův test). S výjimkou prvního dne, kdy byla sérová hladina mezi soubory zemřelí/přeživší 310 pg . ml-1 vs 97.7 pg . ml-1 (p = 0,17), tak byl rozdíl ve střední hodnotě statisticky významný ve všech dnech – 2. den: 1307 pg . ml-1 vs 53 (p = 0,004); 3. den: 2640 pg . ml-1 vs 227 (p = 0,006); 4. den: 2100 pg . ml-1 vs 199 (p = 0,001); 5. den: 847 pg . ml-1 vs 467 (p = 0,03); 6. den: 1762 pg . ml-1 vs 573 (p = 0,03) (tab. 2).
Graf 1. Rozdílnost střední hodnoty a variability hodnot log (pNF-H) v jednotlivých dnech Legenda: Kolečko značí odhad střední hodnoty, nahoru a dolů je přidána hodnota výběrové směrodatné odchylky. 
Tab. 2. Rozdíl v dynamice pNF-H přeživší/zemřelí (Exact Wilcoxon Mann-Whitney Rank Sum Test) 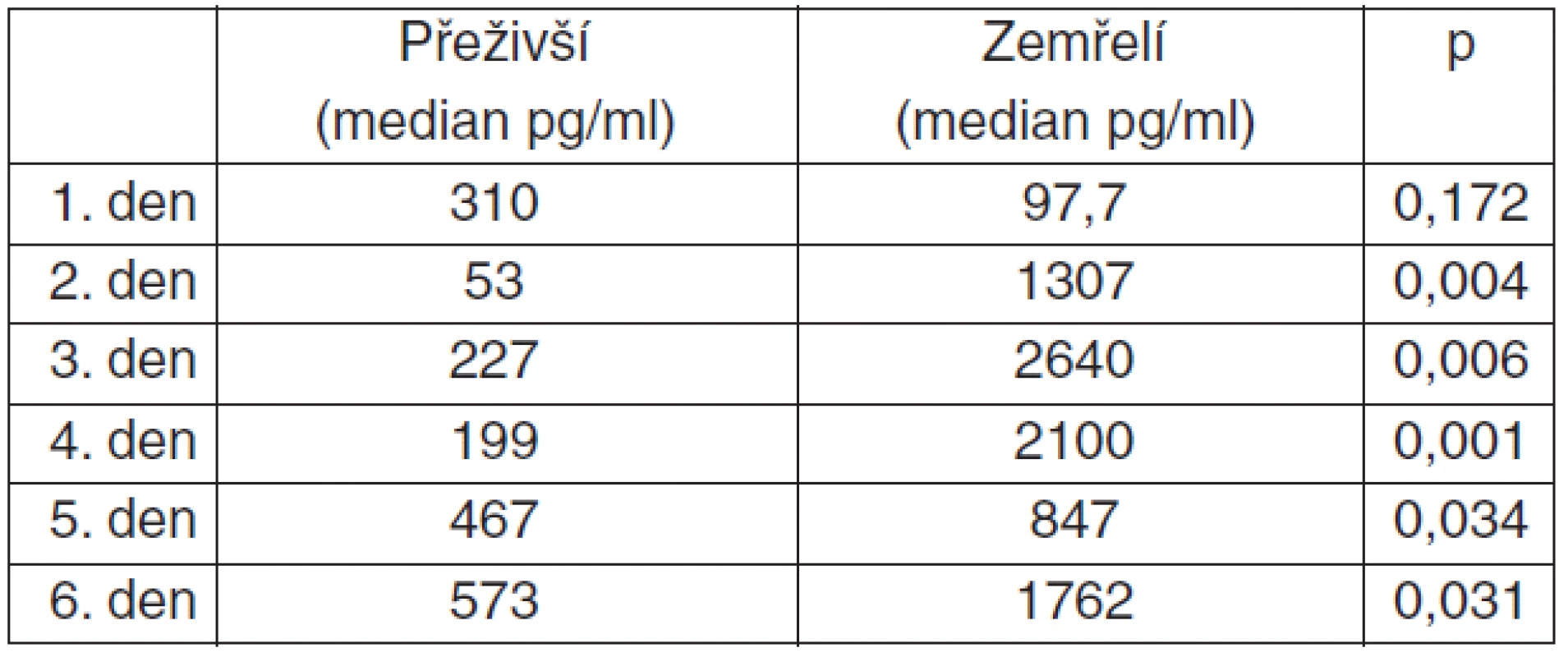
ROC analýza (Receiver Operating Characteristic analysis)
Je zjevné, že hodnoty cut-off se od prvního až po šestý den zvyšují, a to z hodnoty 36,1 (1. den) až na 787,6 pg . ml-1 (6. den). Již z tvarů ROC křivek je zřejmé, že diagnostická efektivita stoupá s průběhem času. Tohle tvrzení lze podpořit i číselně, a to pomocí výpočtu plochy pod křivkou (AUC, Area Under the Curve). K predikci mortality jsou nejlepší sérové hladiny pNF-H naměřené 3. a 4. den hospitalizace, jelikož mají nejvyšší hodnoty AUC, senzitivitu a specificitu – obrázek 1, tabulka 3.
Obr. 1. ROC křivky pro hodnoty log pNF-H V grafech jsou uvedeny intervaly spolehlivosti.Na ROC křivkách jsou vyznačeny optimální cut-off hodnoty (plně vybarvený čtverec), které maximalizují součet senzitivity a specificity. 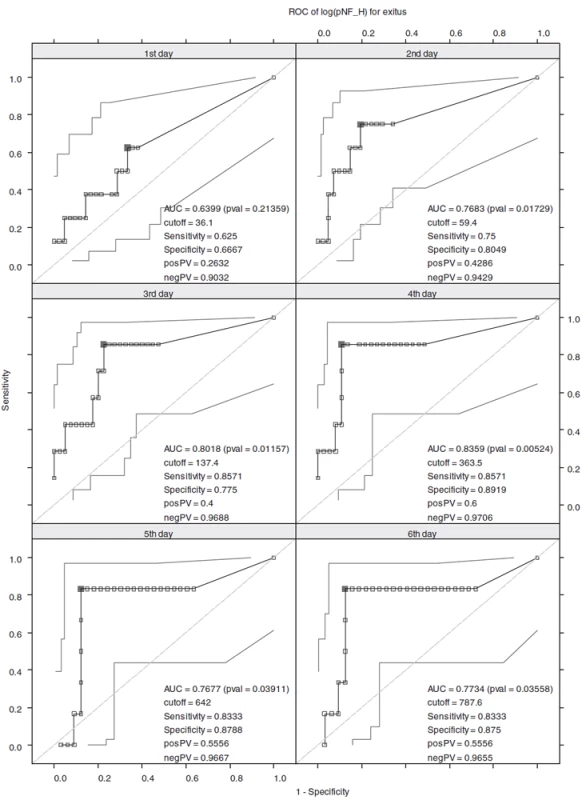
Tab. 3. Výsledky ROC analýzy pro pNF-H 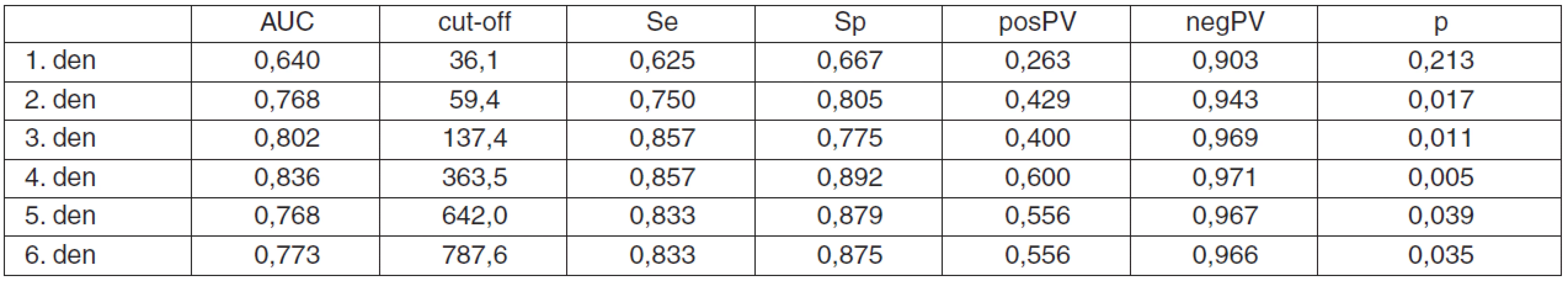
Vysvětlivky: AUC (plocha pod ROC křivkou), cut-off (optimální hodnota pro predikci exitu, pg/ml), Se (senzitivita), Sp (specificita), posPV (pozitivní prediktivní hodnota), negPV (negativní prediktivní hodnota), p-value (pravděpodobnost, že AUC bude větší než 0,5). Diskuse
Glasgow Coma Scale a vyšetření pomocí počítačové tomografie patří v současnosti mezi standardy pro posuzování závažnosti a vizualizaci poškození mozku po TBI [9]. Navzdory informacím z klinických a radiologických vyšetření, odhad prognózy pacientů po TBI zůstává nejistý. Biochemický marker(y) rozsahu poškození mozku provázející úraz hlavy by pomohl stratifikovat pacienty do prognostických skupin, sledovat rozsah sekundárního poškození a efekt terapie, a pomoci tak při vývoji účinnějších protokolů léčby. Biomarkery detekovatelné v séru jsou vhodnější jak pro kliniku, tak i pro výzkum, protože krev je mnohem snadněji dostupná než mozkomíšní mok. Použitelné biomarkery by měly být schopné předpovědět stupeň poranění a výsledný funkční deficit, měly by mít vysokou senzitivitu a specificitu, po poranění by měly být detekovatelné časně a v jasně definovaném časovém odstupu. Měly by být brány v úvahu také možné věkové a intersexuální rozdíly v profilu daného biomarkeru. V ideálním případě by to měly být biologické substráty specifické pro CNS a měly by poskytovat informaci o mechanismu zranění, což je často využívané kritérium k rozlišení biochemických markerů od jiných markerů zranění, které obvykle tuto informaci neposkytují [10].
Cílem naší studie bylo zjistit korelaci sérové hladiny pNF-H s mortalitou v průběhu času, najít optimální hodnotu cut-off pro každý den.
V naší studii jsme prokázali, že pNF-H může být detekován v signifikantním množství v krvi dětí s poraněním mozku. Je to dáno tím, že neurofilamentová podjednotka H je rezistentnější vůči calpainu (proteolytický enzym) a ostatním proteázám více než podjednotky NF-M a NF-L [3]. Přítomnost pNF-H v krvi je tedy příznačná pro poškození a/nebo smrt neuronů.
Dat pro porovnání chování pNF-H u pediatrické populace je velmi málo. Haqqanni et al. prokázali zvýšené hodnoty pNF-H u dětí s TBI s nepříznivým outcome [11]. Lewis et al. ve své studii u dospělých pacientů s rupturou intrakraniálního aneurysmatu a následným subarachnoidálním krvácením popsali pNF-H jako prediktor nepříznivé prognózy. Jako hraniční byla určena hladina pNF-H > 700 pg . ml-1. Senzitivita a prediktivní hodnota u takto zvolené cut-off byla 100% [12].
Jediná nám známá studie zabývající se dynamikou pNF-H po poranění mozku byla provedena v experimentu na zvířatech a prokázala zvýšení hladin pNF-H v séru v závislosti na rozsahu poranění mozku [13]. Byl zjištěn rychlý nárůst průměrné sérové hladiny pNF-H několik hodin po zranění, následován poklesem a pak méně výrazným vzestupem 2 dny po zranění, způsobený pravděpodobně sekundární axonální degenerací. Hladiny pNF-H poté pozvolna klesly několik následujících dnů. V naší studii byly u dětských pacientů po TBI nalezeny zvýšené hladiny pNF-H v séru, které byly v signifikantním vztahu k mortalitě, dvouvrcholová křivka popsaná u zvířat však zjištěna nebyla. Pro vysvětlení příčin smrti a rozdílu chování dynamiky pNF-H u animálního modelu a u dětí bude v budoucnu potřeba dalších studií. V současné době pro tento nález vysvětlení nemáme. Rozsah poškození, GCS ani GOS nebyly ve vztahu k hladinám pNF-H hodnoceny. Vycházejíce z dynamiky proteinu, navrhli jsme hodnoty pro hodnocení rizika úmrtí u dětí po TBI pro každý den pozorování (viz tab. 3). Pro predikci špatné prognózy jsou vhodné hodnoty naměřené 2.–6.den po úrazu (AUC > 0,5; p-value < 0,05).
Vzhledem k prokázaným extrakraniálním zdrojům u jiných biomarkerů a neúspěchu najít spolehlivý biomarker použitelný pro screening, byly testovány kombinace biomarkerů ve snaze dosáhnout lepších výsledků při predikci prognózy. Lo et al. zkoumali u 28 dětí s TBI prediktivní schopnost u více biomarkerů z různých skupin mediátorů ve snaze určit, zda by kombinace dvou sérových biomarkerů mohla dosáhnout lepšího výsledku při predikci prognózy než jednotlivé biomarkery samostatně [14]. Hodnotili osm různých neurospecifických a zánětlivých biomarkerů (S100B, NSE, IL-6, IL-8, IL-10, SICAM, L-selektin a endotelin) 1. den po úrazu a srovnávali hodnoty s výsledným stavem 6 měsíců po úrazu. Došli k závěru, že hodnocení kombinace sérových hladin dvou biomarkerů (mediátor zánětu a CNS specifický protein) umožňuje přesnější predikci nepříznivého výsledku léčby po traumatu mozku u dětí ve srovnání s jednotlivými biomarkery samostatně. Volba kombinace biomarkerů bude ale vyžadovat výběr podle klinické souvislosti a bude přitom nutná znalost o možném extracerebrálním původu daných markerů a vztah sérových hladin k věku.
Již samotné pNF-H má vysokou negativní prediktivní hodnotu, průměrná hodnota za 6 dní byla 95,7 %. Na základě předchozích studií předpokládáme, že kombinace pNF-H s dalším markerem by jednak ještě zvedla negativní prediktivní hodnotu a navíc zvýšila senzitivitu a specificitu testu.
K plnému pochopení využití pNF-H jako biomarkeru, budou potřebné další studie tohoto proteinu. Avšak, jak již bylo zmíněno výše, pNF-H se nachází výhradně v axonech a axonální postižení je hlavní problém u mnoha typů neurologického poškození a chorobných stavů, jako jsou TBI, roztroušená skleróza a amyotrofická laterální skleróza [15]. Vzhledem k tomu, že pNF-H je protein specifický pro axony, mohl by být v budoucnu využíván i k časné diagnostice difuzního axonálního poškození (DAP). V současnosti k diagnóze DAP vede zejména nesoulad mezi klinickým stavem a nálezem na CT [16]. V poslední době se prokazuje, že k disrupci axonů nedochází ihned po úrazu, ale až po určité době. Právě proto by časná diagnostika hned po úrazu dávala možnost cíleného terapeutického zásahu před definitivním přerušením axonu [17].
Závěr
Hyperfosforylované neurofilamentum pNF-H splňuje kritéria pro biochemický marker poškození nervové tkáně u dětí. Lze jej časně detekovat v séru po TBI a jeví se být vhodným prediktorem mortality.
Došlo dne 16. 5. 2010.
Přijato dne 21. 9. 2010.
Adresa pro korespondenci:
MUDr. Jiří Žurek
Klinika dětské anesteziologie a resuscitace FN Brno
Černopolní 9
662 63 Brno
e-mail: jzurek@fnbrno.
Zdroje
1. Brichtová, E. Kraniocerebrální poranění v dětském věku. 1. vyd. Praha: Triton, 2008. P. 140 s. ISBN 978-80-7387-087-4.
2. Ingebrigtsen, T., Romner, B. Biochemical Serum Markers of TBI. The Journal of Trauma Injury. Infection and Crit. Care, 2002, 52, p. 798–808.
3. Anderson, K., Scheff, S., Miller, K., Roberts, K., Gilmer, L., Yang, C., Shaw, G. The Phosphorylated Axonal Form of the Neurofilament Subunit NF-H (pNF-H) as a Blood Biomarker of Traumatic Brain Injury. Journal of Neurotrauma, 2008, 25, 9, p. 1079–1085.
4. Hirokawa, N., Glicksman, M. A., Willard, M. B. Organization of mammalian neurofilament polypeptides within the neuronal cytoskeleton. J. Cell Biol., 1984, 98, p. 1523–1536.
5. Lee, M. K., Cleveland, D. W. Neurofilament subunit NF-H modulates axonal diameter by selectively slowing neurofilament transport. Curr. Opin. Cell Biol., 1994, 6, p. 34–40.
6. Strong, M. J., Strong, W. L., Jaffe, H., Traggert, B., Sopper, M. M., Pant, H. C. Phosphorylation state of the native high-molecular-weight neurofilament subunit protein from cervical spinal cord in sporadic myotrophic lateral sclerosis. J. Neurochem., 2001, 76, p. 1315–1325.
7. Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. Lancet, 1974, 2, p. 81–84.
8. Tepas, J. et al. The Pediatric Trauma Score as a predictor of injury severity in the injured child. J. Pediat. Surg., 1987, 22, p. 14–18.
9. Casmiro, M., Maitan, S., De Pasquale, F., Cova, V., Scarpa, E., Vignatelli, L. Cerebrospinal fluid and serum neuron-specific enolase concentrations in a normal population. Eur. J. Neurol., 2005, 12, 5, p. 369–374.
10. Pineda, J. A., Wang, K. K., Hayes, R. L. Biomarkers of proteolytic damage following traumatic brain injury. Brain Pathol., 2004, 14, p. 202–209.
11. Haqqani, A. S., Hutchison, J. S., Ward, R., Stanimirovic, D. B. Biomarkers and diagnosis; protein biomarkers in serum of pediatric patients with severe traumatic brain injury identified by ICAT-LC-MS/MS. J. Neurotrauma, 2007, 1, p. 54–74.
12. Lewis, S. B., Wolper, R. A., Miralia, L., Yang, C., Shaw, G. Detection of phosphorylated NF-H in the cerebrospinal fluid and blood of aneurysmal subarachnoid hemorrhage patients. J. Cereb. Blood Flow Metab., 2008, 28, p. 1261–1271.
13. Shaw, G., Yang, C., Ellis, R. et al. Hyperphosphorylated neurofilament NF-H is a serum biomarker of axonal injury. Biochem. Biophys. Res. Commun., 2005, 336, p. 1268–1277.
14. Lo, T. Y., Jones, P. A., Minns, R. A. Pediatric brain trauma outcome prediction using paired serum levels of inflammatory mediators and brain specific proteins. J. Neurotrauma, 2009, 26, 9, p. 1479–1487.
15. Buki et al. All roads lead to disconnection? – Traumatic axonal injury revisited. Acta Neurochirurgica, 2006, 148, p. 181–194.
16. Xue, Y. L., Dong, F. F. Diffuse axonal injury: Novel insights into detection and treatment. J. Clin. Neurosci., 2009, 16, 5, p. 614–619.
17. Meythaler, J. M. et al. Amantadine to improve neurorecovery in traumatic brain injury-associated diffuse axonal injury: a pilot double-blind randomized trial. J. Head Trauma Rehabil., 2002, 17, 4, p. 300–313.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Chladná hlava nad zlatoČlánek Zápis z jednání výboru ČSIMČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍKČlánek Trombocyty v sepsiČlánek Výborová schůze ČSARIM
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 6- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Chladná hlava nad zlato
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Nemocniční používání terapeutické mírné hypotermie u pacientů přežívajících po srdeční zástavě – nárůst v České republice (PRE-COOL 2: Hospital Survey 2008)
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
- Dynamika neurofilamenta pNF-H jako prediktor mortality u dětí s poraněním mozku
- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Trombocyty v sepsi
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- In memoriam doc. MUDr. Václav Trávníček, CSc. (1924–2010)
- Statistika oboru anesteziologie a resuscitace
- Výborová schůze ČSARIM
- Seznam akcí pořádaných v roce 2010 společností ČSARIM nebo pod její záštitou
- Zápis z jednání výboru ČSIM
- Česká resuscitační rada – nová organizace založena s podporou ČSARIM a ČSIM
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Trombocyty v sepsi
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



