-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
Amanita phalloides intoxication: mechanism of toxicity, clinical manifestations and therapeutic approaches
Ingestion of Amanita phalloides is the most common cause of fatal mushroom poisoning. The clinical picture of intoxication varies from mild subclinical manifestation to lethal fulminant course with the development of acute liver failure. Early diagnosis of Amanita phalloides poisoning is crucial for the outcome but i tis difficult because it is often mistaken as gastroenteritis or due to other mushroom poisoning. The diagnosis is based on the history of recent mushroom ingestion followed by gastrointestinal symptoms, typical time course and laboratory markers and is proven with mycological examination or toxicological examination. Specific treatment consists of detoxification procedures, supportive measures, administration of drugs and therapy in the specialized intensive care unit in the case of acute liver failure. In selected patients with acute liver failure urgent liver transplantation is the only life-saving option.
Keywords:
intoxication – acute liver failure – Amanita phalloides – urgent liver transplantation
Autoři: Eva Kieslichová
Působiště autorů: 1. lékařská fakulta Univerzity Karlovy, Praha ; Klinika anesteziologie, resuscitace a intenzivní péče, Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Vnitř Lék 2021; 67(E-7): 13-17
Kategorie: Přehledové články
Souhrn
Požití muchomůrky zelené (Amanita phalloides) je nejčastější příčinou smrtelné otravy houbami. Klinický obraz intoxikace kolísá od mírných subklinických projevů až po fulminantní průběh s rozvojem akutního selhání jater. Pro osud pacienta má zásadní význam včasná diagnóza intoxikace muchomůrkou zelenou. Ta je ale často obtížná vzhledem k možnosti záměny za gastroenteritidu nebo za otravu jinými houbami. Diagnóza je založena na anamnéze nedávného požití houby s následnými gastrointestinálními příznaky, typickém časovém průběhu a laboratorních vyšetřeních a potvrzuje se mykologickým a toxikologickým vyšetřením. Specifická léčba spočívá v detoxikačních postupech, podpůrných opatřeních, farmakoterapii a v terapii na specializované jednotce intenzivní péče v případě akutního selhání jater. U vybraných pacientů s akutním selháním jater je jedinou možností záchrany života urgentní transplantace jater.
Klíčová slova:
intoxikace – akutní selhání jater – Amanita phalloides – urgentní transplantace jater
Úvod
Sběr divoce rostoucích hub je vyhledávanou relaxační aktivitou a jejich konzumace je v řadě zemí, včetně České republiky, rozšířena. Sbírání hub ve volné přírodě může být ale nebezpečné, a to i pro ty, kteří jsou v jejich určování zběhlí. Otrava houbami je často důsledkem nevhodných podmínek při sběru, uchovávání a přípravě hub primárně netoxických, dochází ale i k nezáměrnému i záměrnému požití toxických hub s fatálními následky (1). Skutečný výskyt intoxikací houbami není přesně znám; ohlašovací povinnost neexistuje, relativně mnoho případů zůstává nehlášeno a toxikologická střediska tak mají pouze neúplné údaje.
K nejjedovatějším patří houby obsahující amatoxiny, jedná se o houby tří rodů: Amanita (muchomůrka zelená, vzácněji muchomůrka bílá, muchomůrka jízlivá), Galerina (čepičatka) a Lepiota (bedla), přičemž většina fatalit připadá na muchomůrku zelenou (Amanita phalloides), která je v angličtině známá jako „death cap“ („klobouk smrti“). Otrava těmito houbami představuje celosvětový problém, případy otrav byly popsány v Evropě, Severní Americe, ale také v Africe, Asii, Austrálii a Střední a Jižní Americe (2). Muchomůrka zelená (Obr. 1) je hlavní evropskou jedovatou houbou, nejčastěji se vyskytuje ve vlhkých lesích, zejména v bukových a dubových, roste v období od června do října. K otravě dochází většinou záměnou za jedlé houby, může jít ale i o sebevražedný nebo vražedný úmysl. Udává se, že je příčinou více než 90 % fatálních případů otravy houbami (3, 4). Na základě dostupných dat se míra mortality po otravě muchomůrkou zelenou pohybuje v rozmezí 10 až 30 %, u osob mladších než 10 let je to až 50 %. Za prediktory nepříznivé prognózy u intoxikace muchomůrkou zelenou (5, 6) jsou považovány tyto faktory:
dětský věk, nízká tělesná hmotnost
množství požitého toxinu
interval mezi požitím a nástupem gastrointestinálních příznaků (průjem) < 8 h
protrombinový index < 10% (INR > 6)
Obr. 1. Amanita phalloides. Zdroj: Zdroj: Wikimedia Commons, povolení ke kopírování pod GNU Free Documentation License. Fotograf: Archenzo 
Mechanismus toxicity
Muchomůrka zelená obsahuje dva typy toxinů: amatoxiny (bicyklické oktapeptidy) a falotoxiny (cyklické heptapeptidy).
Amatoxiny, proteiny o molekulární váze 900 daltonů, jsou termostabilní, odolné vůči varu i chladu, přetrvávají i v sušených houbách; byl dokonce dokumentován případ fatální intoxikace po konzumaci muchomůrky zmrazené 8 měsíců (7). LD50 amatoxinů je velmi nízká. Letální dávka amatoxinu je pro člověka 0,1 mg/kg tělesné hmotnosti, což může představovat požití jedné plodnice (8).
Hlavní komponentou amatoxinů je α‑amanitin, který je spolu s β‑amanitinem zodpovědný za toxický účinek. Amanitiny se irreverzibilně váží v poměru 1 : 1 na podjednotku RNA polymerázy II a inhibují syntézu messenger RNA v eukaryotických buňkách. Takto narušená transkripce DNA vede k nekróze buněk, v nichž probíhá intenzivní syntéza bílkovin, a které byly jako první vystaveny vysokým dávkám toxinů. Primárně dochází k poškození metabolicky aktivních tkání s vysokým stupněm proteosyntézy (gastrointestinální trakt, hepatocyty, proximální tubuly ledvin). Dalším potenciálním mechanismem toxicity amanitinů je synergie α‑amanitinu s endogenními cytokiny (např. TNF: tumor necrosis factor) a poškození buněk prostřednicvím indukce apoptózy.
Amanitiny se vstřebávají epitelem trávicího traktu a slabě se váží na bílkoviny plazmy, jejich clearance z plazmy obvykle trvá do 48 hodin od požití. Jakmile se amanitiny dostanou do jater, jsou aktivně vychytávány jaterními buňkami, dochází k jejich transportu nespecifickým transportním systémem do hepatocytů, kde vyvolávají rozsáhlou centrolobulární nekrózu a vakuolární degeneraci hepatocytů (Obr. 2). Zhruba 60 % vstřebaného α‑amanitinu se vylučuje do žluči a do jater se vrací enterohepatálním oběhem. Kolem 40 % amanitinu se vylučuje ledvinami, toxin je filtrován glomeruly a zpětně vstřebáván v renálních tubulech, což vede k přímému toxickému působení na tubulární epitel. Akutní poškození ledvin, často pozorované při intoxikaci muchomůrkou zelenou, lze přičíst nefrotoxickému působení amanitinů v kombinaci s dehydratací při průjmu a zvracení. V histologickém nálezu dominuje obraz akutní tubulární nekrózy s hyalinními válci a odlitky v tubulech. U zvířat i lidí, kteří zemřeli na následky intoxikace amanitou, bylo buněčné poškození zjištěno také v pankreatu, nadledvinách a varlatech.
Obr. 2. Akutní selhání jater při intoxikaci muchomůrkou zelenou (100). (autor: doc. MUDr. Eva Sticová, Ph.D., Pracoviště klinické a transplantační patologie, IKEM) 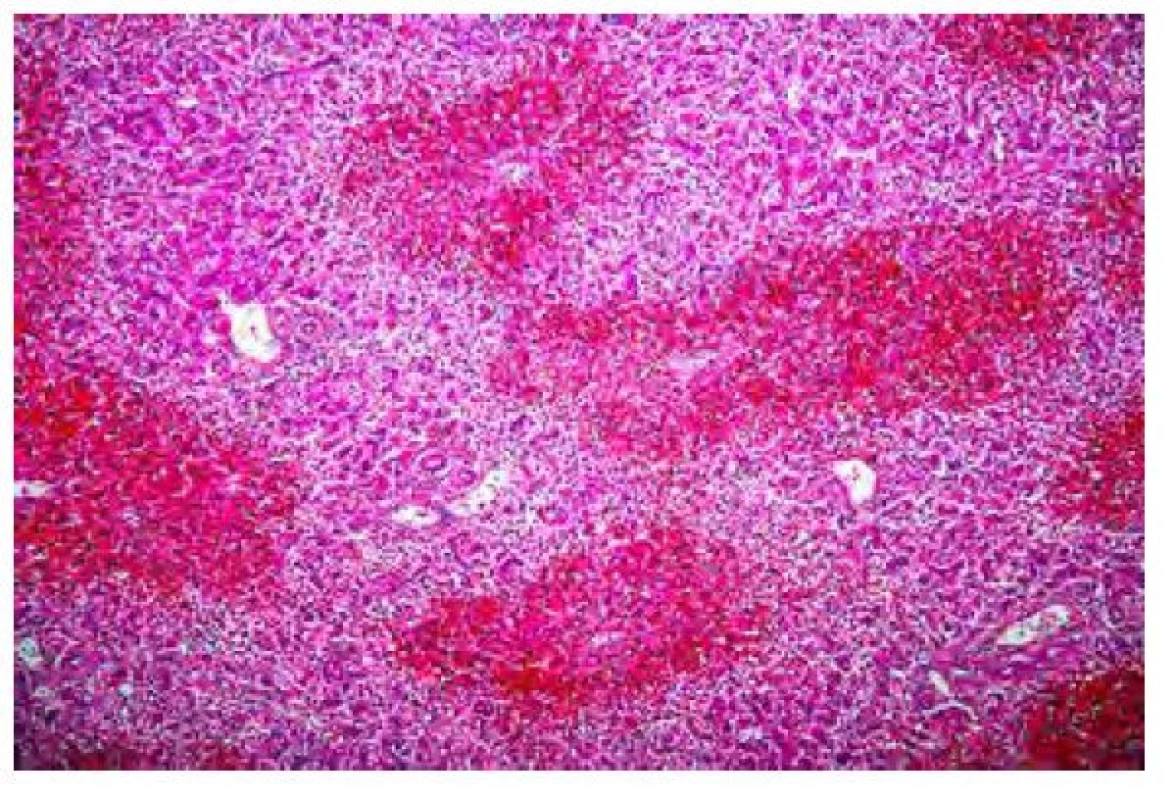
Falotoxiny ruší polymerizačně‑depolymerizační cyklus, dochází k narušení funkce buněčných membrán a k nekróze buňky. Zdrojem jejich toxicity je thiamidová vazba atomu síry na indolovém kruhu. Poškozují celulární membránu enterocytů a jsou zodpovědné za iniciální gastrointestinální příznaky (nauzea, zvracení a průjem) u intoxikovaných jedinců. I když jsou falotoxiny hepatotoxické, k toxicitě muchomůrky zelené přispívají málo, protože nedochází k jejich vstřebávání ze střev a nedostávají se do jater.
Klinický průběh intoxikace
Klinický obraz otravy muchomůrkou zelenou se pohybuje od mírných subklinických projevů až po letální fulminantní průběh. Závažnost intoxikace závisí především na požitém množství toxinu a na čase, který uběhl od požití do zahájení léčby (3, 4, 9).
Otrava muchomůrkou zelenou má charakteristický průběh (10), který lze rozdělit do čtyř po sobě nastupujících stadií:
Stadium latence – asymptomatická fáze (6–12 hodin po požití) Pro počáteční fázi je charakteristická absence jakýchkoliv příznaků, což je pro otravu muchomůrkou zelenou typické. U jiných intoxikací houbami je asymptomatická fáze kratší, obvykle 1–2 hodiny po požití, nebo chybí vůbec.
Stadium gastrointestinálních příznaků (12–24 hodin) Druhá fáze je charakterizována gastrointestinálními příznaky; trvá asi 24 hodin. Objevují se křeče v břiše, nauzea, zvracení a profuzní vodnaté průjmy, které mohou vést k dehydrataci a minerálovému rozvratu (tzv. obraz cholera‑like diarrhoe). Tato fáze může svádět k mylné diagnóze virové gastroenteritidy nebo náhlé příhody břišní. Jaterní a renální funkce jsou v tomto období obvykle normální.
Stadium zdánlivé rekonvalescence (24–48 hodin) Jedná se o stadium odeznívání gastrointestinálních příznaků při současné elevaci jaterních testů. V této fázi se začínají objevovat známky postižení jater a ledvin.
Stadium selhání jater a akutního poškození ledvin (4–7 dní)
U pacientů s příznivým průběhem dochází přechodně k akutnímu poškození ledvin a elevaci aminotransferáz, snížení syntézy koagulačních faktorů a hyperbilirubinemii s následnou rychlou reparací ledvin i jater ad integrum a obnovou normální kvality života.
Část pacientů intoxikaci přežije, ale má trvalé následky ve formě jaterní fibrózy a poškození renálních tubulů.
U části pacientů s nepříznivým průběhem dochází k rozvoji akutního poškození ledvin a akutního selhání jater (ASJ), které je definováno jako náhle vzniklé, rychle progredující a život ohrožující onemocnění s vysokou mortalitou. Je charakterizováno náhlým nástupem závažné jaterní dysfunkce u jedinců bez předchozího onemocnění jater, kdy do 26 týdnů od počátečních příznaků dochází k rozvoji koagulopatie (protrombinový čas > 15 sekund nebo mezinárodní normalizační poměr [INR] > 1,5) a jaterní encefalopatie. Pro intoxikaci muchomůrkou zelenou je typický hyperakutní průběh s rozvojem ASJ během 1 týdne (11, 12). Nenastane‑li na podpůrné terapii reparace jater nebo nedojde‑li k provedení transplantace jater, dochází k časnému úmrtí v důsledku multiorgánové dysfunkce nebo nitrolební hypertenze; v případě nepříznivého průběhu se uvádí medián doby do úmrtí 6,1 dne (5, 9).
Diagnóza
Diagnóza se zakládá na pečlivém posouzení anamnézy a klinických projevů, je potvrzena mykologickým vyšetřením žaludečního obsahu a stolice a laboratorním průkazem amanitinu (krev, moč). Pro osud pacienta je časná diagnóza intoxikace muchomůrkou zelenou zcela zásadní. Každý pacient s akutními gastrointestinálními příznaky v období pozdního léta nebo časného podzimu by měl být automaticky dotazován na požití hub. Důležité je propojit klinické projevy s požitím hub, protože zjištění této souvislosti může být znesnadněno odstupem mezi nástupem příznaků a požitím hub.
Při rozhovoru s pacienty s podezřením na otravu houbami nebo s jejich příbuznými je třeba se zaměřit na podrobnou anamnézu. Mezi hlavní otázky lékaře by měl patřit popis konzumovaných hub, prostředí, v němž byly houby nasbírány, počet různých typů požitých hub, skladování před spotřebou, příprava před požitím, nástup podobných příznaků u osob, které jedly stejné houby, a čas od požití hub do nástupu příznaků. Je zapotřebí získat zbytky hub, i již zpracovaných, zvratky nebo vzorky stolice k mykologickému vyšetření. Ke konzultaci diagnostiky i terapie intoxikace je vhodné kontaktovat toxikologické středisko (Toxikologické informační středisko, Klinika pracovního lékařství Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha, telefon: 224 91 92 93 nebo 224 91 54 02, e-mail: tis@vfn.cz).
Laboratorní diagnostika
Amatoxiny se nacházejí v séru do 24 hodin po požití, mohou být detekovány až do 48 hodin. Do moči jsou vylučovány až 72 hodin po požití. Koncentraci amatoxinu v moči a krvi lze měřit pomocí radioimunoanalýzy nebo vysokoúčinné kapalinové chromatografie. Korelace mezi plazmatickými koncentracemi amatoxinů a klinickou závažností intoxikace nebyla prokázána.
Terapie
Doporučení k terapii intoxikace muchomůrkou zelenou nejsou založena na výsledcích velkých randomizovaných studií, které jsou obtížně proveditelné vzhledem k malému počtu pacientů. Jsou publikovány pouze výsledky léčby menších souborů pacientů, kazuistická sdělení nebo metaanalýzy (13). Terapie otravy spočívá v předběžné lékařské péči, podpůrných opatřeních, specifické terapii včetně podpůrné terapie jaterního selhání (10, 11, 14). V případě rozvoje ASJ je nutno zvažovat urgentní transplantaci jater jako jedinou úspěšnou možnost léčby (11, 12).
Předběžná lékařská péče zahrnuje postupy gastrointestinální dekontaminace. Jejich účinnost úzce souvisí s jejich časným provedením. Základní opatření při intoxikaci se provádí neprodleně po zjištění intoxikace v nejbližším zdravotnickém zařízení. Pacienty s rozvojem ASJ je třeba hospitalizovat na specializované jednotce intenzivní péče pracoviště, kde je možné transplantaci jater provést. V České republice se transplantace jater provádí v Transplantačním centru Institutu klinické a experimentální medicíny v Praze a v Centru kardiovaskulární a transplantační chirurgie v Brně.
Terapeutické postupy při intoxikaci amanitiny:
Dekontaminace
K základním úvodním opatřením patří gastrointestinální dekontaminace (4, 10). Nedošlo‑li k opakovanému zvracení, je vhodný výplach žaludku vlažným fyziologickým roztokem k odstranění zbylých plodnic a zamezení vstřebávání toxinů. Výplach žaludku je nejpřínosnější časně po požití, ideálně do 1 hodiny, ale vzhledem možnosti přetrvávání plodnic v žaludku delší dobu je možné ho provést i po několika hodinách. Jedná se o invazivní výkon, který má řadu rizik a měl by být prováděn s velkou opatrností zkušeným lékařem, aby se předešlo komplikacím. U pacientů s poruchou vědomí a s oslabenými obrannými reflexy je nutné zajištění dýchacích cest endotracheální intubací před zákrokem. Dále je třeba zabránit reabsorpci amatoxinů ze střeva a přerušit jejich enterohepatální oběh podáváním aktivního uhlí, které je vhodné aplikovat i v rámci první pomoci už při podezření na intoxikaci. Aktivní uhlí se podává opakovaně v dávce 1 g/kg hmotnosti perorálně nebo do nazogastrické sondy po 4 hodinách po dobu 24–48 hodin bez ohledu na dobu od požití hub. Došlo‑li k odeznění průjmu, je vhodné podání laxativ (polyetylenglykol). Plodnice mohou zůstat ve střevech i několik dní, proto je doporučována i aplikace vysokých klyzmat k jejich odstranění.
Současně s dekontaminací je nutná dostatečná hydratace podáváním balancovaných krystaloidních roztoků a úprava iontové dysbalance a metabolické acidózy. Forsírovaná diuréza již není doporučována, výdej moči cca 100–200ml/hod po dobu 4–5 dnů se považuje za dostatečný ke zvýšení renální eliminace amatoxinů (4, 10).
Farmakoterapie
Doporučenou terapií první volby je při intoxikaci muchomůrkou zelenou silibinin v kombinaci s N‑acetyl ‑ cysteinem. Silibinin, ve vodě rozpustný derivát silymarinu, je preferován na základě výsledků velké retrospektivní analýzy z roku 2002, jeho podávání je asociováno s lepším přežíváním pacientů než dříve doporučované vysoké dávky krystalického penicilinu (13, 15). Silibinin má přímé hepatoprotektivní účinky, přerušuje enterohepatální recirkulaci amanitinu, inhibuje vazbu amanitinu na membrány hepatocytů, soutěží s amanitinem při transmembránovém transportu a inhibuje průnik amanitinu do jaterních buněk. Kromě toho zřejmě ovlivňuje i sekundární uptake v játrech, mediovaný enterohepatální cirkulací. K podání silibininu by mělo dojít co nejdříve po požití, optimálně do 48 hodin. Terapii je vhodné zahájit i při pouhém podezření na intoxikaci. Podává se v dávkách 20–50mg/kg/den nitrožilně ve čtyřech dvouhodinových infuzích, terapie má trvat 4–5 dní.
Od dříve doporučovaných vysokých dávek penicilinu G (1 000 000 IU/kg první den, poté 500 000 IU/kg další dva dny; celkem 4–5 dní) se v současnosti ustoupilo, přesto zůstal součástí některých protokolů, zejména v případě nedostupnosti silibininu (9). Podávání penicilinu je odůvodňováno schopností vytěsnit amanitin z vazby na plazmatické bílkoviny. Vazbou kyselého amanitinu může penicilin bránit jeho vychytávání játry a průniku do hepatocytů, není vyloučeno ani primární působení na intracelulární úrovni. Penicilin v megadávkách však znamená i přívod většího množství kalia a riziko alergických reakcí. Účinnost jiných antibiotik, zejména cefalosporinů, zatím nebyla přesvědčivě prokázána (4, 13). Pro kombinovanou léčbu silibininem a penicilinem neexistují klinická data, která by podporovala superioritu tohoto přístupu vůči terapii silibininem (16).
N‑acetylcystein se standardně užívá jako antidotum při otravě paracetamolem, kdy slouží jako zdroj cysteinu k syntéze glutathionu. N‑acetylcystein má rovněž antioxidační účinky, je schopný vázat volné kyslíkové radikály; zmírňuje zánětlivou reakci na oxidativní poškození a má příznivý vliv na mikrocirkulaci (17). Z těchto důvodů je užíván i při terapii ASJ neparacetamolové etiologie a k terapii intoxikace muchomůrkou zelenou. N‑acetylcystein se podává nitrožilně, nejčastěji v dávce 150 mg/kg/den jako bolus, dále 300 mg/kg/den cca 5 dnů (Doporučený postup České hepatologické společnosti: https://www.ces‑hep. cz), případně v podobném schématu jako při intoxikaci paracetamolem (150 mg/kg během 15–30 minut, poté 50 mg/kg během 4 hodin a následně 100 mg/kg v průběhu 16 hodin; celkově 300/mg/kg během 20 hodin) (11, 12). Nežádoucí anafylaktoidní reakce jsou pozorovány jen zřídka.
Eliminační metody
Vzhledem ke krátkodobé přítomnosti amatoxinů v plazmě by jejich odstranění mimotělními eliminačními metodami bylo přínosné pouze při časném zahájení, tedy brzo po nástupu gastrointestinálních příznaků. Účinnost mimotělních eliminačních metod, jako je hemodialýza, hemoperfuze nebo plazmaferéza, je vzhledem k rychlé clearanci amanitinů z krve omezená (18). Příznivější výsledky jsou popisovány při užití plazmaferézy při její aplikaci během prvních 36–48 hodin v kombinaci s konzervativní terapií (19). Na časné provedení plazmaferézy je možno pomýšlet při kombinaci faktorů nepříznivé prognózy intoxikace (5). Náhrada funkce ledvin intermitentní nebo kontinuální hemodialýzou je indikovaná při rozvoji akutního poškození ledvin s oligoanurií a vzestupem dusíkatých katabolitů, tekutinovém přetížení, metabolickém rozvratu s acidózou a hyperlaktatemií a pro kontrolu hyperamonemie při ASJ.
Podpůrná terapie akutního selhání jater
V případě rozvoje ASJ se obecná podpůrná terapie neliší od ASJ z jiných příčin. Základní principy konzervativní léčby ASJ spočívají v udržení hemodynamické stability, v léčbě respirační dysfunkce, v prevenci a terapii nitrolební hypertenze, korekci poruch acidobazické rovnováhy a iontové dysbalance. Nutná je léčba hypoglykemie, korekce koagulopatie při krvácivých komplikacích, náhrada funkce ledvin při akutním poškození ledvin, prevence a léčba infekčních komplikací a podávání výživy (11, 12). Arteficiální přístrojová podpora jater se využívá jako možnost k překlenutí doby potřebné k přežití do transplantace jater nebo do spontánního zotavení. Stávající nebiologické systémy jsou schopny nahradit detoxikační funkci selhávajících jater; jsou odstraňovány nejen ve vodě rozpustné, ale i na albumin vázané toxiny. Nejčastěji užívanými podpůrnými systémy v Evropě jsou systém MARS (Molecular Adsorbent Recirculating System) a systém frakcionované plazmatické separace a adsorpce (přístroj Prometheus). Alternativou je vysookobjemová výměna plazmy, při níž dochází k odstraňování toxických metabolitů, doplnění potenciálně prospěšných faktorů a odstranění mediátorů selhání orgánových systémů (11).
Transplantace jater
Vzhledem k vysoké regenerační schopnosti jater je ASJ potenciálně reverzibilní. Pro většinu pacientů s ASJ ale představuje urgentně provedená transplantace jater jedinou šanci na přežití, proto by na ni mělo být vždy pomýšleno (20, 21). Rozhodování o indikaci a načasování transplantace je obtížné. Důležité je získat co největší jistotu o špatné prognóze intoxikovaného. Je ‑ li transplantace provedena příliš brzo, je možné, že by pacient býval přežil bez narušené kvality života. Je ‑ li naopak indikována příliš pozdě, může pacient zemřít dříve, než bude k dispozici vhodný orgán.
Nejčastěji užívanými kritérii k hodnocení nepříznivé prognózy a pro indikaci urgentní transplantace jater u pacientů s ASJ jsou King’s College kritéria (Tab. 1), jejichž platnost byla opakovaně validována (11). Splnění těchto kritérií znamená méně než 20% pravděpodobnost přežití bez transplantace. Tato kritéria však nemusí být v případě intoxikace amatoxiny jednoduše použitelná (5, 6). Vzhledem k tomu, že parametr „etiologie“ je vždy negativní, jelikož intoxikace amatoxiny není zohledněna, jsou ve skutečnosti používány čtyři parametry. Parametr „trvání ikteru před nástupem encefalopatie > 7 dnů“ vykazuje u intoxikovaných velmi nízkou senzitivitu, jelikož cca 83 % nepřeživších pacientů umírá do 9. dne. Hladina bilirubinu rovněž není v těchto případech optimálním ukazatelem. Dle vlastních výsledků z transplantačního centra IKEM mají standardní King’s College kritéria pro indikaci urgentní transplantace jater u ASJ po otravě muchomůrkou zelenou dobrou prognostickou hodnotu a jsou použitelná k indikaci k urgentní transplantaci jater i u těchto pacientů (22).
Tab. 1. King´s College kritéria k urgentní transplantaci jater (11) 
Závěr
Intoxikace muchomůrkou zelenou je spojena s vysokým rizikem úmrtí pacienta. Vzhledem k tomu, že nejúčinnějším opatřením je intoxikaci předcházet, je nezbytné edukovat veřejnost o riziku intoxikace muchomůrkou zelenou. Otrava má sezónní charakter a typický průběh v několika fázích. Důležitá je časná diagnostika otravy a okamžité zahájení podpůrné léčby. Při rozvoji závažného poškození jater je třeba pacienta přeložit na specializovanou jednotku intenzivní péče a zvažovat transplantaci jater.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Eva Kieslichová, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní péče, Institut klinické a experimentální medicíny Vídeňská 1958/9, 140 00 Praha 4
Cit. zkr: Vnitř Lék 2021; 67(7): E13–E17
Článek přijat redakcí: 21. 7. 2021
Článek přijat po recenzích: 8. 10. 2021
Zdroje
1. Karlson‑Stiber C, Persson H. Cytotoxic fungi‑an overview. Toxicon, 2003; 42(4): 339–349.
2. Diaz JH. Amatoxin‑Containing Mushroom Poisonings: Species, Toxidromes, Treatments, and Outcomes. Wilderness Environ Med 2018; 29(1): 111–118.
3. Broussard CN, Aggarwal A, Lacey SR et al. Mushroom poisoning–from diarrhea to liver transplantation. Am J Gastroenterol, 2001; 96 (11): 3195–3198.
4. Mas A. Mushrooms, amatoxins and the liver. J Hepatol, 2005; 42(2): 166–169.
5. Ganzert M, Felgenhauer N, Zilker T. Indication of liver transplantation following amatoxin intoxication. J Hepatol, 2005; 42(2): 202–209.
6. Escudie C. Francoz JP, Vine R et al. Amanita phalloides poisoning: reassessment of prognostic factors and indications for emergency liver transplantation. Journal of Hepatology, 2007; 46(3): 466–473.
7. Himmelmann A, Mang G, Schnorf‑Huber S. Lethal ingestion of stored Amanita phalloides mushrooms. Swiss Med Wkly, 2001;131(41-42): 616–617.
8. Garcia J, Costa VM, Carvalho A et al. Amanita phalloides poisoning: mechanisms of toxicity and treatment. Food Chem Toxicol, 2015; 86 : 41–55.
9. Le Darre B, Ferron PJ, Gicquel T. Toxic effects of amanitins: Repurposing toxicities toward new therapeutics. Toxins, 2021; 13(6): 417.
10. Santi, L, Maggioli C, Mastroroberto M et al. Acute Liver Failure Caused by Amanita phalloides Poisoning. Int J Hepatol, 2012; 2012 : 487–480.
11. European Association for the Study of the Liver. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol, 2017; 66(5): 1047–1081.
12. Montrief T, Koyfman A, Long B. Acute liver failure: A review for emergency physicians. Am J Emerg Med, 2019; 37(2): 329–337.
13. Enjalbert F, Rapior S, Nouguier‑Soulé J et al. Treatment of amatoxin poisoning: 20-year retrospective analysis. J Toxicol Clin Toxicol, 2002; 40(6): 715–757.
14. Ye Y, Liu Z. Management of Amanita phalloides poisoning: a literature review and update. J. Crit Care, 2018; 46 : 17–22.
15. Lacombe G. Towards evidence‑based emergency medicine: best BETs from the Manchester Royal Infirmary. BET 1: Silibinin in suspected amatoxin ‑ containing mushroom poisoning. Emerg Med J, 2016; 33(1): 76–77.
16. Ganzert M, Felgenhauer N, Schuster T et al. Amanita poisoning – comparison of silibinin with a combination of silibinin and penicillin. Dtsch Med Wochenschr, 2008; 133(4): 2261–67.
17. Liu J, Chen Y, Gao Y, et al. N‑acetylcysteine as a treatment for amatoxin poisoning: a systematic review. Clin Toxicol (Phila), 2020; 58(11): 1015–1022.
18. Mullins ME, Horowitz BZ. The futility of hemoperfusion and hemodialysis in Amanita phalloides poisoning. Vet Hum Toxicol, 2000; 42(2): 90–91.
19. Jander S, Bischoff J, Woodcock BG. Plasmapheresis in the treatment of Amanita phalloides poisoning: II. A review and recommendations. Ther Apher, 2000; 4(4): 308–312.
20. Karvellas CJ, Tillman H, Leung AA et al. United States Acute Liver Failure Study Group. Acute liver injury and acute liver failure from mushroom poisoning in North America. Liver Int, 2016; 36(7): 1043–1050.
21. Seetharam A. Intensive care management of acute liver failure: Considerations while awaiting liver transplantation. J Clin Transl Hepatol, 2019; 7(4): 384–391.
22. Kieslichová E, Fraňková S, Protuš M et al. Acute liver failure due to Amanita phalloides poisoning: therapeutic approach and outcome. Transplantation Proceedings 2018; 50(1): 192–197.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo E-7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Úskalí diagnostiky autoimunitní pankreatitidy
- Monitoring a analýza rizikových faktorů pádů pacientů hospitalizovaných v nemocnicích
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Úskalí diagnostiky autoimunitní pankreatitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



