-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Amiodaronem indukované postižení plic u pacienta s fibrilací síní
Amiodarone induced pulmonary toxicity
Amiodarone is one of the more frequently used drugs in the treatment of supraventricular and ventricular arrhythmias. Many adverse effects, more or less serious, are associated with its administration. Amiodaron-induced pulmonary toxicity (AIPT) is quite rare but represents one of the most severe adverse effects with high mortality. We present an 80 years old patient, who used amidorane due to paroxysmal atrial fibrillation for several years. Within 3 months, he was repeatedly hospitalized for a bilateral pneumonia. Eventually, AIPT was diagnosed. Early diagnosis, proper therapy of AIPT and changed antiarrhythmic therapy has significantly improved the clinical status of our patient. In this case we demonstrate typical clinical presentations of AIPT as well as the most common diagnostic procedures and recommended treatment methods. Finally, some other commonly used therapeutical options for supraventricular arrhythmias are mentioned. Future options are outlined.
Keywords:
amiodarone – AIPT – amiodarone induced pulmonary toxicity – amiodarone lung
Autoři: Martin Hudec 1,2; Petra Vysočanová 1,2; Vojtěch Brázdil 1,2; Martin Poloczek 1,2; Martin Hetmer 1,2; Jiřina; Little 3; Martina Doubková 2,4; Petr Kala 1,2
Působiště autorů: Interní kardiologická klinika Fakultní nemocnice Brno 1; Lékařská fakulta Masarykovy univerzity Brno 2; Klinika radiologie a nukleární medicíny Fakultní nemocnice Brno 3; Klinika nemocí plicních a tuberkulózy Fakultní nemocnice Brno 4
Vyšlo v časopise: Vnitř Lék 2021; 67(E-7): 18-23
Kategorie: Kazuistiky
Souhrn
Amiodaron patří mezi nejčastěji užívaná antiarytmika vůbec, a to v léčbě komorových i supraventrikulárních arytmií. Jeho užívání je však spojeno s celou řadou nežádoucích účinků. Mezi méně časté patří amiodaronem indukované postižení plic (AIPP), které se zároveň řadí mezi ty nejzávažnější. Kazuistika popisuje případ 80letého pacienta dlouhodobě léčeného amiodaronem pro paroxysmální fibrilaci síní. V rozmezí 3 měsíců byl pacient opakovaně hospitalizován pro bilaterální pneumonii. S odstupem u něj bylo diagnostikováno právě AIPP. Správně vedená diagnostika, vhodná terapie AIPP a úprava antiarytmické terapie vedla k významnému zlepšení klinického stavu pacienta. V této kazuistice ukazujeme typický klinický obraz onemocnění, ideální diagnostický postup i doporučené terapeutické možnosti. Závěrem jsou shrnuty jiné běžně využívané možnosti léčby supraventrikulárních arytmií a nastíněny i možnosti budoucí.
Klíčová slova:
amiodaron – AIPP – amiodaronem indukované postižení plic – amiodaronová plíce
Úvod
Amiodaron‑hydrochlorid byl počátkem 60. let představen jako antianginózní léčivo, a to pro svůj vazodilatační účinek. S odstupem let se začal zkoumat jeho vliv na akční potenciál buněk myokardu a jako antiarytmikum byl schválen v polovině 80. let (1, 2). Dnes se dle Vaughan-Williams klasifikace řadí mezi antiarytmika III. třídy. Jeho antiarytmický účinek je však komplexní. V menší míře ovlivňuje i Na+ - kanály a Ca+ - kanály (účinek podobný antiarytmikům I. třídy) a také non-kompetivně ovlivňuje adrenergní receptory (účinek podobný antiarytmikům II. třídy) (2, 3). V dnešní době patří amiodaron mezi nejužívanější antiarytmika, a to nejen v terapii fibrilace síní. Nadšení z jeho ideálního antiarytmického účinku však brzdí celá řada nežádoucích účinků spojená s jeho užíváním. Mezi nejčastější patří: oční rohovková depozita v 95 % případů, gastrointestinální potíže u 35 % pacientů (nauzea, zvracení, nechutenství), kožní fotosensitivita a dobře známé thyreopatie, vyskytující se až u 25 % pacientů (4). K méně častému, o to však závažnějšímu nežádoucím účinku, patří amiodaronem indukované postižení plic (AIPP) prezentované v následující kazuistice.
Kazuistika
80letý polymorbidní muž byl na naši kliniku přijat v červenci 2020 k došetření recidivujících bronchopneumonií, makroskopické hematurie a k dechové a fyzické rehabilitaci. V osobní anamnéze dominovaly paroxysmální fibrilace síní, chronické srdeční selhání se zachovalou ejekční frakcí (heart failure with preserved ejection fration – HFpEF), hypertenzní nemoc a chronická renální insuficience 3. stupně dle CKD‑EPI (Chronic Kidney Disease Epidemiology Collaboration). V dlouhodobě užívané medikaci jsme dokumentovali kombinaci antihypertenzní medikace (metoprolol, lerkanidipin, spironolakton, urapidil), amiodaron v dávce 200 mg/den a dlouhodobou orální antikoagulaci apixabanem, který byl v době přijetí nahrazen nadroparinem v redukované dávce z důvodu hematurie. Subjektivně pacient udával mírné zhoršení dušnosti v posledním roce (NYHA II), které bylo dáváno do souvislosti s HFpEF. Ve fyzikálním vyšetření dominovaly poslechově bilaterální krepitace nad plicními bazemi.
V první části se ve stručnosti zaměřujeme na makroskopickou hematurii a její řešení (bez dalších komentářů v následné diskuzi – není tématem této práce). Druhá část bude věnována samotné plicní problematice, stejně jako hlavní body diskuze.
Makroskopická hematurie přetrvávala u pacienta od přijetí. Pro vysoké ischemické riziko při paroxysmální fibrilaci síní (CHA2DS2 - VASc skóre 4 – stratifikace vysokého rizika ischemické cévní mozkové příhody u pacientů s fibrilací síní) byl pacient dlouhodobě na orální antikoagulační terapii apixabanem, které přetrvávalo i při kompromisní dávce nadroparinu. Při opakovaných urologických a cystoskopických vyšetřeních nebyl nalezen ošetřitelný zdroj krvácení, popisováno bylo spíše difuzní slizniční krvácení. Histologické vyšetření vzorku stěny močového měchýře neprokázalo onkologicky suspektní buňky. Pro vysoké krvácivé riziko (HAS‑BLED skóre 4 – skórovací systém pro hodnocení rizika závažného krvácení u pacientů s fibrilací síní užívajících antikoagulační terapii) a současně výše zmíněné ischemické riziko při paroxysmální fibrilaci síní byl indikován katetrizační uzávěr ouška levé síně okludérem Amulet (Amplatzer) 25 mm. Výkon proběhl bez komplikací s optimálním výsledkem (obrázky 1–3). Oproti obvyklé počáteční duální antiagregační terapii zde byla zvolena 3měsíční monoterapie clopidogrelem s následným převodem na acetylsalicylovou kyselinu. Hematurie promptně po výkonu regredovala a nebylo třeba dalších urologických intervencí.
Obr. 1. Uzávěr ouška levé síně – sizing ouška levé síně 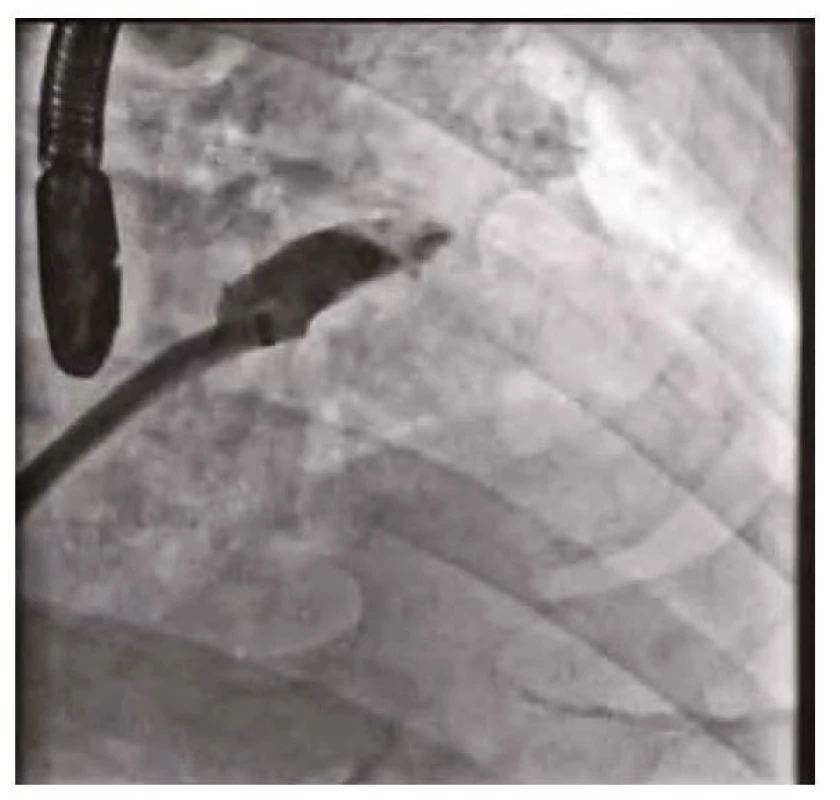
Obr. 2. Uzávěr ouška levé síně – katetrizační umístění okludéru do ouška levé síně 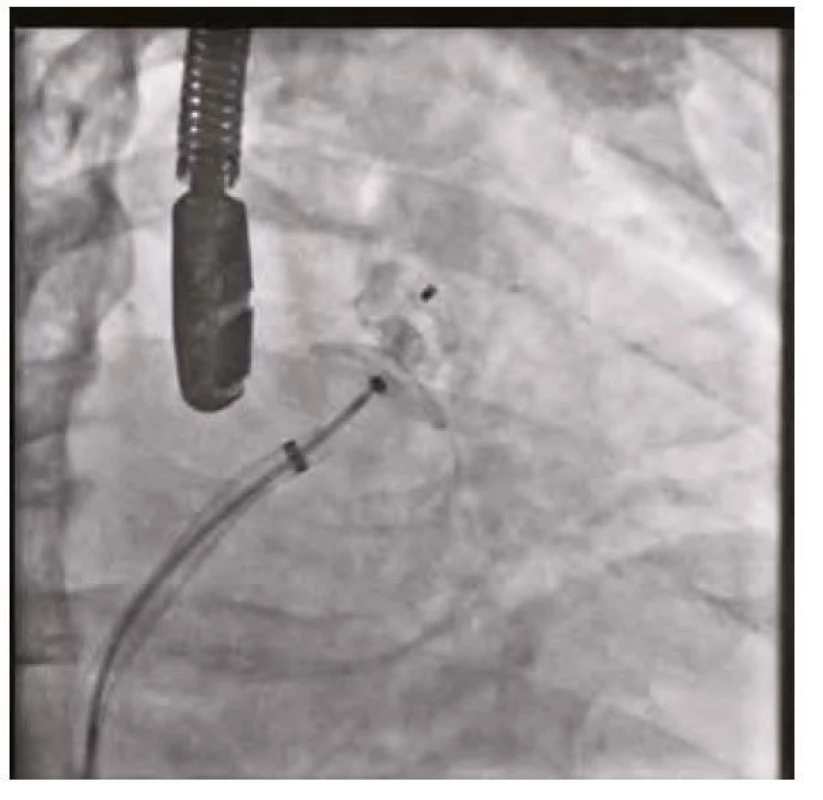
Obr. 3. Uzávěr ouška levé síně – odpoutání okludéru s jeho optimální polohou 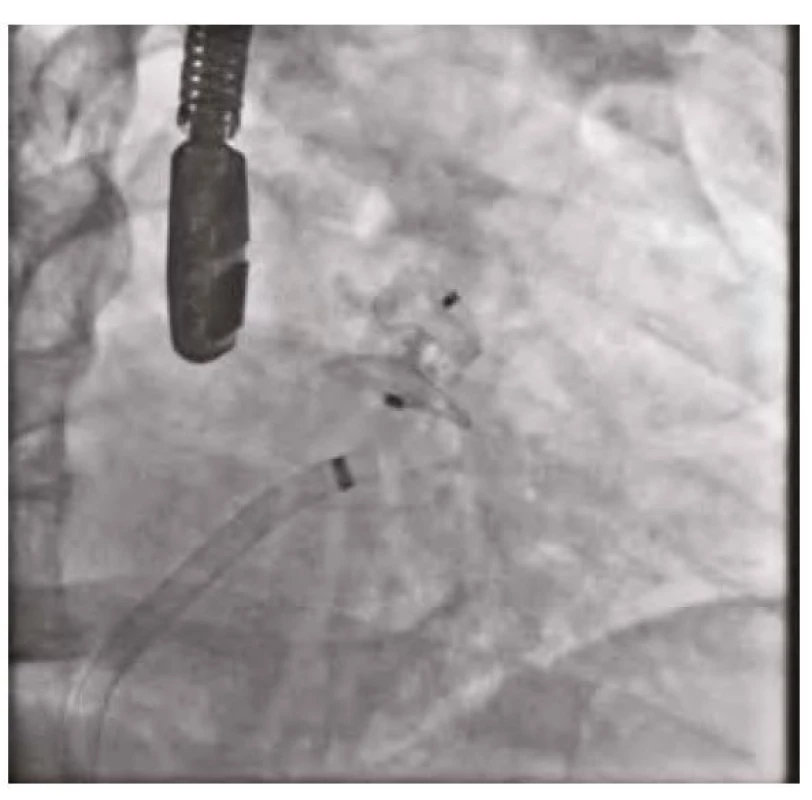
Plicní postižení. Během 3 měsíců byl pacient opakovaně hospitalizován pro bilaterální pneumonie. Při první hospitalizaci v dubnu 2020 byl nález potvrzen dle prostého rentgenového snímku (RTG) hrudníku (Obr. 4) i dle počítačové tomografie (CT) plic (Obr. 5). Na CT byly popisovány bilaterální plicní infiltráty typu ground‑glass opacit“ – v období epidemie covidu-19 vzniklo podezření spíše na virovou pneumonii, která však byla opakovaně vyloučena negativními stěry z nasopharyngu, stejně jako další běžní původci pneumonií. Pacient byl přeléčen empiricky kombinací antibiotické terapie (klarithromycin + ceftriaxon), a to s dobrým efektem a parciální regresí infiltrací na kontrolním RTG plic (Obr. 6). Z pohledu pneumologa bylo vysloveno podezření na intersticiální plicní proces a pro anamnézu dlouhodobého užívání amiodaronu (užíván od r. 2013; kumulativní dávka více než 150 g) konkrétně na amiodaronem indukované postižení plic. Anamnesticky byl však amiodaron jediným tolerovaným antiarytmikem pro udržení sinusového rytmu, a proto nebylo indikováno jeho vysazení. V klinicky dobrém stavu, s infiltracemi ve významné regresi, byl pacient přeložen do Odborného léčebného ústavu k další rehabilitaci. Důležitou informací je nyní výsledek vstupní spirometrie (viz Tab. 1), vylučující obstrukční chorobu a spíše podporující diagnózu restriktivního postižení (stále při zavedené medikaci amiodaronem).
Obr. 4. RTG plic z dubna 2020 vstupní – bilaterální zastínění s maximem v dolních a středních plicních polích 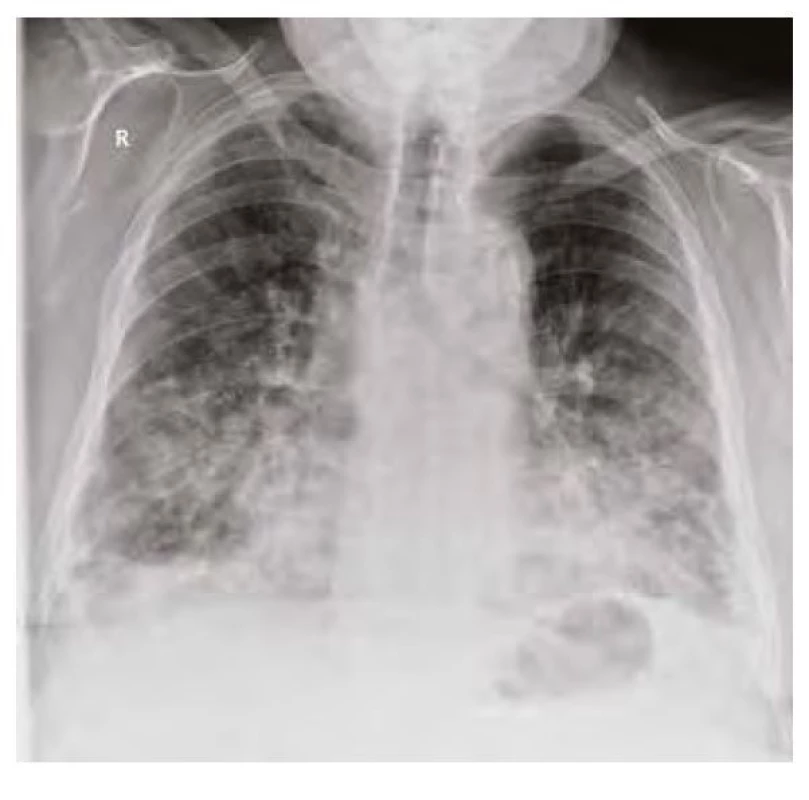
Obr. 5. CT plic duben 2020 – bilaterální postižení plicního parenchymu typu ground-glass s okrsky drobných konsolidací 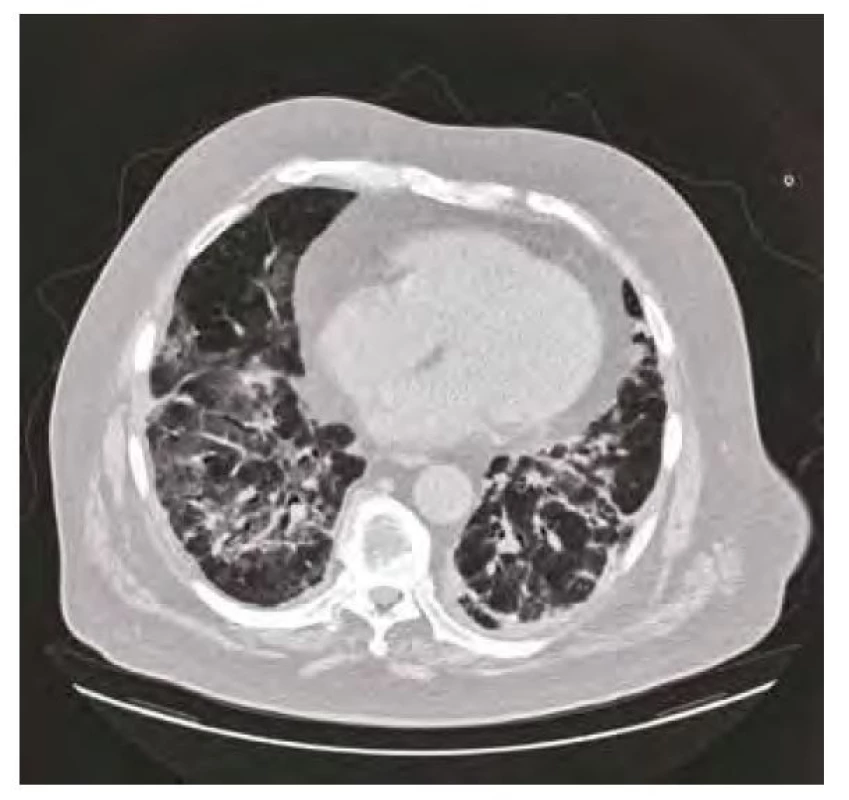
Obr. 6. RTG plic před propuštěním v květnu 2020 – parciální regrese oboustranného zastínění 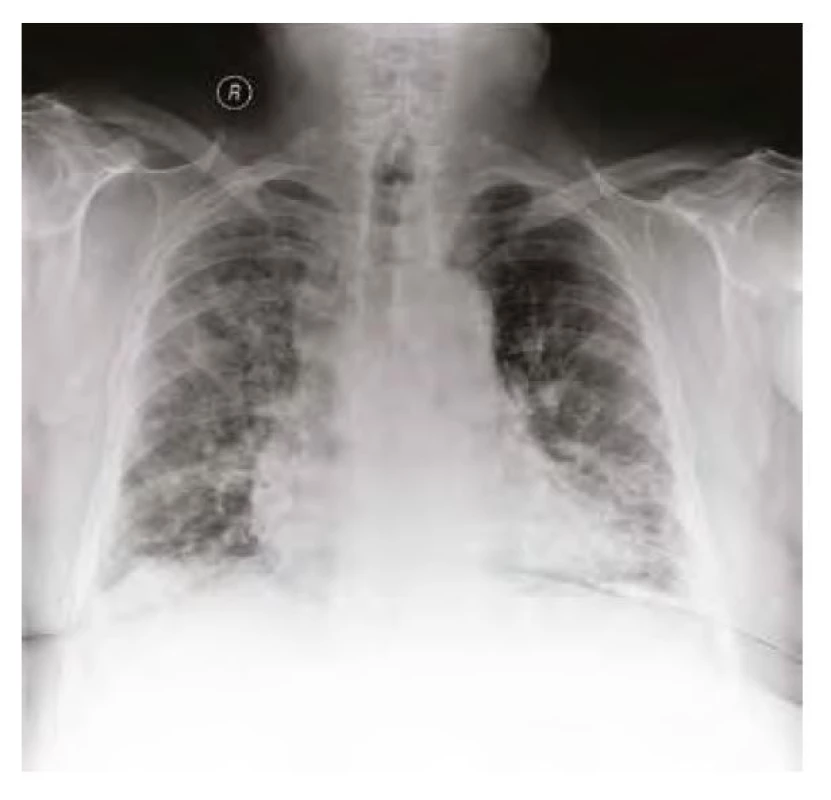
Po více než měsíční rehabilitaci byl z Odborného léčebného ústavu propuštěn v klinicky dobrém stavu do domácí péče. Již po několika dnech pociťoval opětovné zhoršení dušnosti a v červenci 2020 byl znovu hospitalizován s recidivou bilaterální pneumonie. Tentokrát s výraznou hyposaturací, nutností orotracheální intubace a několikadenní umělé plicní ventilace. Na RTG plic (Obr. 7) byly opět popisovány bilaterální plicní infiltráty. Amiodaron byl trvale vysazen z medikace a byla zavedena terapie antibiotiky, bronchodilatancii a inhalačními a systémově podávanými kortikoidy. Po více než měsíční intenzivní léčbě bylo patrné klinické zlepšení pacienta i regrese nálezu na CT plic (Obr. 8) i RTG plic (Obr. 9) a pacient byl opět odeslán do Odborného léčebného ústavu k intenzivní dechové rehabilitaci. Výstupní výsledek spirometrie (kdy byl amiodaron vysazen asi 3 měsíce) ukazovalo zlepšení všech hodnocených parametrů v porovnání s výsledky před vysazením amiodaronu (viz Tab. 1). Výrazná regrese plicních infiltrací je patrná i na RTG plic (Obr. 10). Pacient byl v říjnu 2020 propuštěn v dobrém klinickém stavu a se zavedenou kortikoterapií do domácí péče.
Obr. 7. RTG plic při přijetí v 72020 – recidiva bilaterálního zastínění v kombinaci s bilaterálních fluidothoraxem 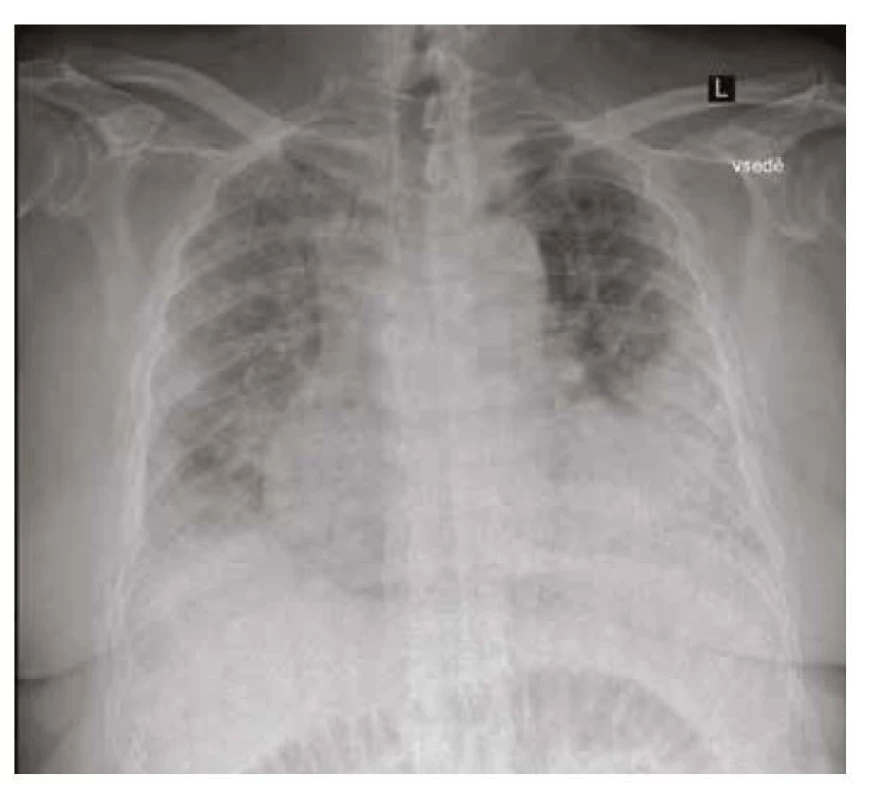
Obr. 8. CT plic červenec 2020 – regrese bilaterálních plicních infiltrátů s reziduálními oboustrannými výpotky 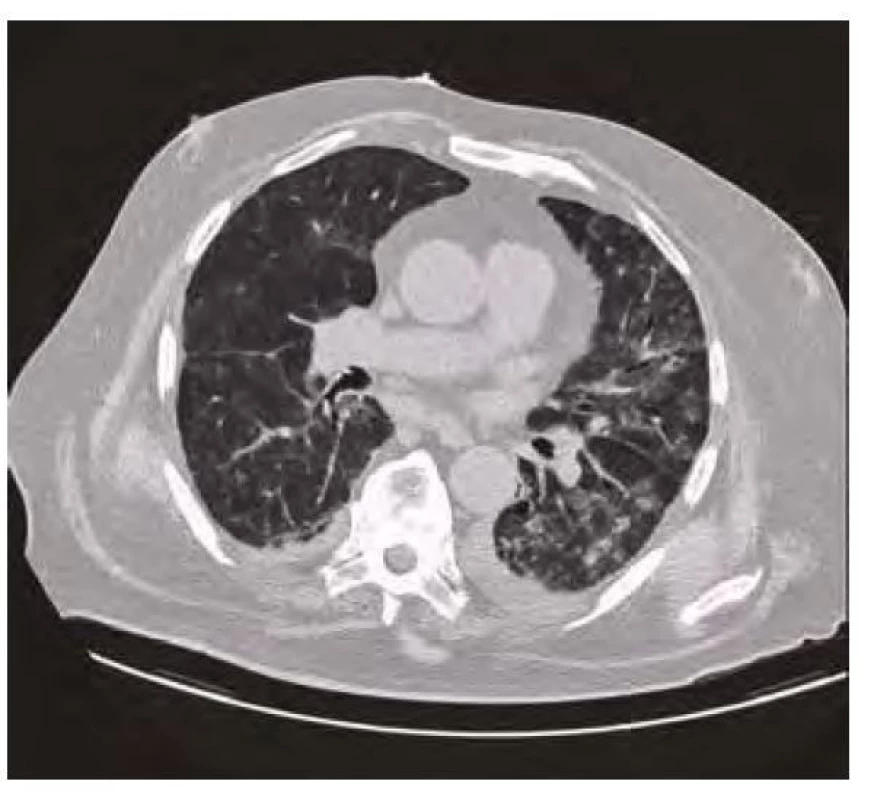
Obr. 9. RTG plic před propuštěním srpen 2020 – částečná regrese v bilaterálním zastínění 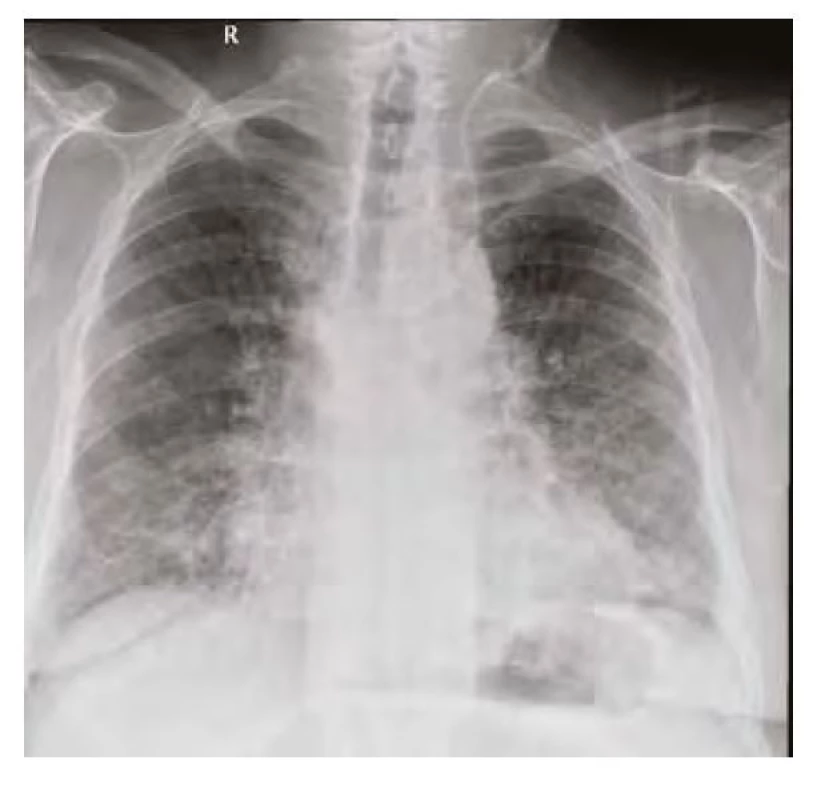
Obr. 10. RTG plic 3 měsíce od vysazení amiodaronu – normalizace nálezu 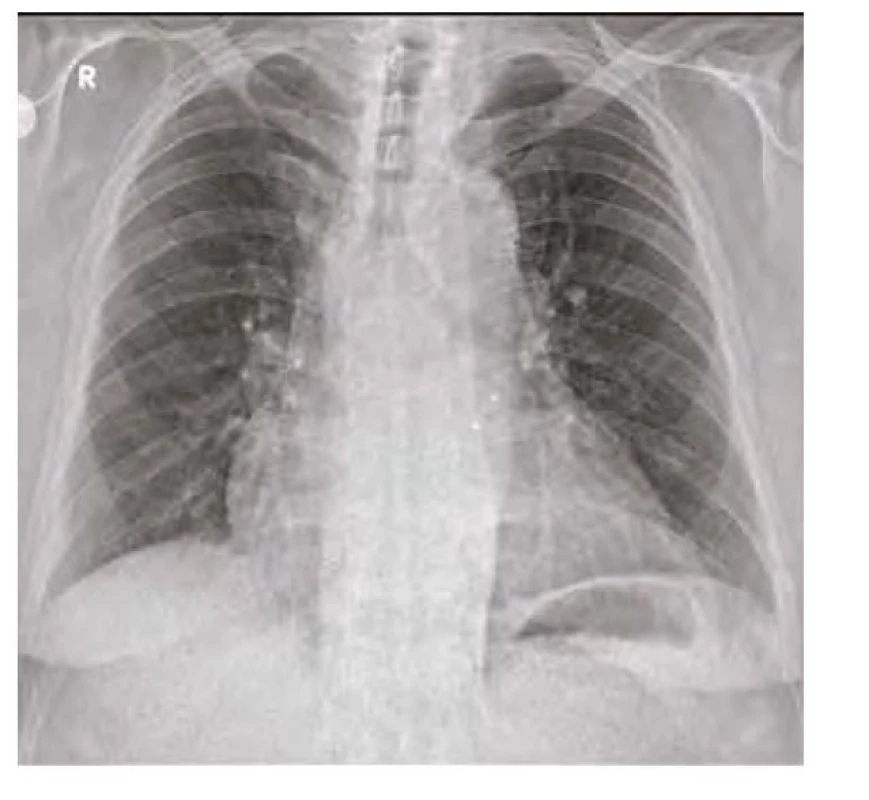
Tab. 1. Srovnání vybraných parametrů spirometrie při terapii amiodaronem (sloupec A) a 3 měsíce po jeho vysazení se současnou terapií kortikoidy (sloupec B) 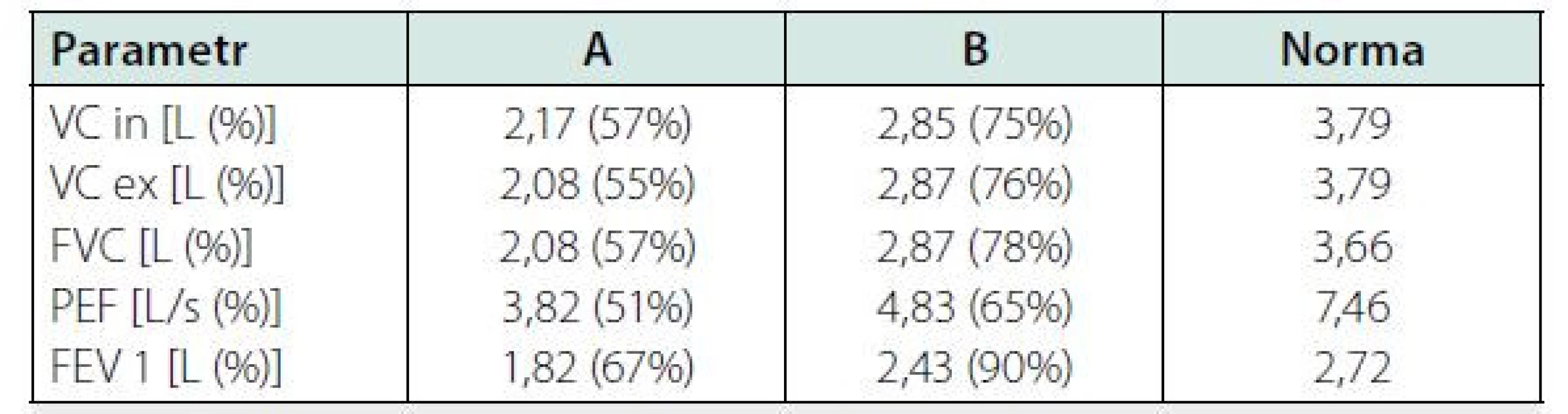
VC in (inspirační vítální kapacita plic), VC ex (exspirační vitální kapacita plic), FVC (usilovná respirační forsírovaná vitální kapacita plic), PEF (vrcholový výdechový průtok), FEV1 (objem vzduchu vydechnutý s maximálním úsilím za 1 sekundu) Diskuze
Amiodaronem indukované postižení plic není časté – udává se v různých pracích v rozmezí u 5 % až 15 % pacientů (5). Dusman et al. zjistili výskyt AIPP u 6 % pacientů v souboru více než 500 pacientů užívajících amiodaron (6). Z výčtu nežádoucích účinků amiodaronu patří AIPP mezi nejzávažnější a v případě, že se projeví, je smrtnost okolo 10% (7). Rizikovými faktory pro vznik AIPP jsou věk (nad 65let), pohlaví (muži), doba užívání a celková dávka (více než 150 g) a také jiná plicní onemocnění či kouření (8). První dokumentované případy poškození plic ve spojení s užíváním amiodaronu jsou již z počátku 80. let (9). Ani po této relativně dlouhé periodě stále není přesně znám patogenetický mechanismus plicního poškození.
Po stránce struktury je amiodaron lipofilní látka, která se kumuluje v plicích. K samotnému poškození dochází dvěma mechanismy – přímá toxicita a pak nepřímo, rozvojem zánětlivé hypersenzitivní reakce. Amiodaron a jeho metabolity mají přímý toxický vliv na endoteliální buňky a pneumocyty II. typu. Tento proces současně spouští zánětlivou hypersenzitivní reakci – vznikají kyslíkové radikály, prozánětlivé cytokiny a aktivují se další buňky zánětlivé reakce (T‑lymfocyty, makrofágy). Dochází k poškozování plicního parenchymu, které může vést až k jeho fibrotizaci (10). Při mikroskopickém vyšetření se často objevují pěnové makrofágy. Amiodaron ovlivňuje metabolismus intracelulárních fosfolipidů, a to především inhibicí fosfolipázy, kdy dochází k jejich hromadění. Takto změněné makrofágy se objevují především v plicních alveolech či intersticiu, což vede ke vzniku tzv. lipoidní pneumonie. Klinicky se AIPP může manifestovat formou akutní, subakutní či chronickou. Akutní forma se projeví bronchospasmy, intersticiální pneumonitidou či ARDS (acute respiratory distress syndrome). Při přechodu do formy chronické může časem dojít až k intersticiální plicní fibrotizaci (8,10).
Samotná diagnóza AIPP je určena per exclusionem, a to po vyloučeních ostatních příčin intertsticiálního postižení plic v kombinaci s klinickými fakty. Škála diferenciální diagnostiky je velmi široká – pouze léčivých látek, které mohou vést k toxickému postižení plic, je více než 1000 a jejich podrobný výčet lze nalézt na webových stránkách (www.pneumotox.com (11)). V diagnostice je tedy přirozeně nezbytný anamnestický údaj o užívání amiodaronu. Typickými symptomy jsou zhoršení dušnosti, hyposaturace, suchý kašel, pleurální bolesti či subfebrilie. Objektivně mohou být difuzně slyšitelné chrůpky, krepitace či třecí šelest. Jako zásadní se v literatuře uvádí funkční plicní vyšetření (spirometrie a vyšetření plicní difuze). Diagnostickým kritériem při vyšetření plicní difuzní kapacity je její redukce o 15–20 %, výsledky spirometrie zase ukazují na restrikční poruchu (12). Pomocným mohou být radiodiagnostické metody – RTG a CT plic. Nicméně většina léků, včetně amiodaronu, nemá specifický radiologický nález. U amiodaronu se tak setkáváme s rozmanitým radiologickým nálezem. Na RTG plic jsou časté difuzní oboustranné, případně i jednostranné infiltráty, při fibróze retikulonodulární opacity. Dle Marchlinskeho (13) bývají predominantně postiženy horní plicní laloky, a to především pravý. Souvisí to s lepší oxygenací, a tedy potenciálem tvorby kyslíkových radikálů – ani toto však není v zcela specifické. Stejně tak i CT plic zobrazí celou řadu patologií (okrajové konsolidace parenchymu, alveolární opacity, intersticiální uzlíky, fokální atelektázy, zesílení pleury či různý stupeň fibrózy) (14), v závislosti na stupni postižení parenchymu. Mezi CT‑nálezy patří také opacity mléčného skla (8), vyskytující se např. při virových pneumoniích (v dnešní době známé především u covid-19 pneumonií).
Dalším dílkem diagnostiky bývá bronchoalveolární laváže (BAL). U AIPP nacházíme již zmiňované pěnové makrofágy, bývá zvýšený počet lymfocytů (s převahou CD8+ T‑lymfocytů) a typicky pro amiodaron snížený poměr CD4+/CD8+ T‑lymfocytů (15). Zatímco tedy BAL nás může diagnosticky významně posunout, patologické vyšetření bioptického vzorku plicní tkáně není rutinně doporučováno, a to s ohledem na nespecifický mikroskopický nález (viz Tab. 2).
Tab. 2. Shrnutí diagnostických postupů AIPP. Důraz je kladen na funkční plicní vyšetření 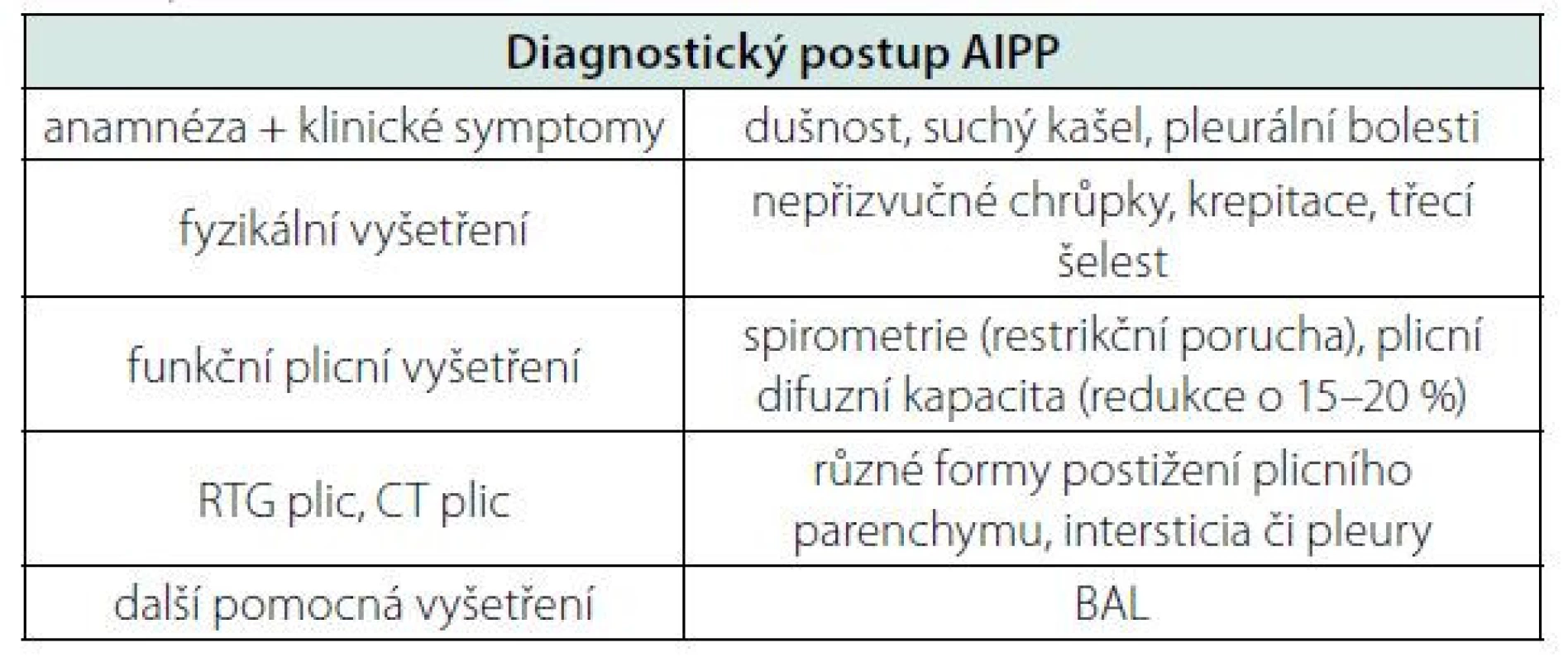
Při terapii AIPP je v první řadě nutné vysazení amiodaronu. Vhledem k jeho dlouhému biologickému poločasu, lipofilii a kumulaci nejen v plicích, ale i v játrech, slezině, rohovce, je úplný terapeutický efekt zřejmý až s delším časovým odstupem. Hlavním terapeutickým cílem je zastavit zánětlivé změny v jejich reverzibilní fázi a předejít tak ireverzibilní fibrotizaci. Terapie je jednak symptomatická (bronchodilatancia, mukolytika, popřípadě antibiotická terapie při nasedající superinfekci), jednak cílená formou protizánětlivé kortikoterapie. Zcela jednoznačná doporučení při terapii lékových postižení plic, tedy v ohledu na dobu užívání kortikoidů v tuto chvíli nejsou (16). Na našem pracovišti máme dobré zkušenosti s podáváním prednisonu v úvodní dávce 40 mg – 60 mg. Tato terapie musí být dlouhodobá – 6 až 12 měsíců, s velmi opatrným snížením dávky. Dle Okayasu (5) vede příliš rychlé vysazení kortikoidní terapie k časným relapsům (Tab. 3). Dlouhodobé užívání kortikoterapie s sebou přináší celou řadu dalších nežádoucích účinků, na které musíme myslet.
Tab. 3. Shrnutí terapeutického postupu 
S vysazením antiarytmické terapie amiodaronem nám často vzniká další problém, a to otázka další strategie terapie fibrilace síní. V případě volby kontroly frekvence si většinou vystačíme s navýšením terapie betablokátory či digoxinem. U pacientů s farmakorezistentní symptomatickou fibrilaci síní, u kterých se nedaří kontrola tepové frekvence, je další možností implantace jedno – dutinového kardiostimulátoru a následná neselektivní ablace atrioventrikulárního uzlu. Toto řešení s sebou nese rizika spojená s jednokomorovou stimulací pravé komory. Proto by měla být zvážena i možnost současné resynchronizační stimulace levokomorovou elektrodou (CRT – pacing) či snad v budoucnu stimulace Hissova svazku, která je v samých začátcích uvedení do běžné klinické praxe. V případě strategie k udržení sinusového rytmu je třeba zvolit jiná, u nás dostupná antiarytmika – sotalol či propafenon. Terapie propafenonem má některé kontraindikace – především významnější systolickou dysfunkci levé komory. Kontroverzní je jeho indikace u pacientů s ischemickou chorobou srdeční, kde je dle guidelines Evropské kardiologické společnosti propafenon kontraindikován (17). V souhrnu údajů o léčivém produktu (SPC) z databáze Státního ústavu pro kontrolu léčiv (SÚKL) je ale propafenon kontraindikován pouze u pacientů v časovém období prvních 3 měsíců po infarktu myokardu. Jeho použití musí být vždy dobře zváženo.
U pacientů pravidelně užívajících amiodaron by měl dispenzarizující lékař brát v potaz možný výskyt nežádoucích účinků a na příznaky těch nejčastějších a také nejzávažnějších by se měl v rámci pravidelných kontrol zaměřit. V roce 2016 vyšla v USA doporučení pro lékaře předepisující amiodaron (18). V tomto přehledném dokumentu je shrnuto, jaká vyšetření by u těchto pacientů měla být prováděna, a to s cílem časného záchytu nežádoucích účinků. V případě AIPP je zmíněn RTG plic – na začátku podávání amiodaronu a poté jednou ročně. Dále funkční plicní vyšetření (spirometrie, difuzní kapacita plic) na začátku užívání a dále při nejasném nálezu na RTG plic či při klinických příznacích AIPP.
Závěr
V dnešní době poznamenané epidemií covidu-19 je a stále častěji bude po zdravotnickém systému požadováno došetřování etiologie dušnosti pacientů. Nesmíme však zapomínat také na příčiny neinfekční. AIPP nepatří mezi časté nežádoucí účinky spojené s užíváním amiodaronu, rozhodně však je počítáno mezi ty nejzávažnější. Při jeho preskripci by měly být vždy zváženy i jiné terapeutické možnosti a poměr efektu/ rizik při jeho dlouhodobé, často i trvalé léčbě. Kritériem v terapeutické rozvaze bude zajisté také věk pacienta a jeho přidružené komorbidity. Při volbě amiodaronu by měl dispenzarizující lékař vždy brát v potaz rizika spojená s jeho užíváním a zaměřit se na časné odhalení vedlejších účinků a zabránit možnému zhoršení zdravotního stavu našich pacientů, optimálně ve spolupráci s lékaři primární péče. Rozmanitost a závažnost nežádoucích účinků nás musí vést k důslednému sledování pacientů a kladení důrazu na včasný záchyt možných symptomů.
Podpořeno MZ ČR – RVO (FNBr, 65269705 Kazuistika bude prezentována formou sdělení na 29. výročním sjezdu České kardiologické společnosti.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martin Hudec
Interní kardiologická klinika LF MU a FN Brno Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(7): E18–E23
Článek přijat redakcí: 23. 7. 2021
Článek přijat po recenzích: 11. 10. 2021
Zdroje
1. Bexton RS, John Camm A. Drugs with a class III antiarrhythmic action. Pharmacol Ther 1982;17(3): 315-355. doi: 10.1016/0163-7258(82)90020-1.
2. Hrckova Y, Sarapatkova H, Lukl J. Vedlejsi ucinky amiodaronu. Intern Med Pract 2006; 7(6): 288–290.
3. Kodama I, Kamiya K, Toyama J. Amiodarone: ionic and cellular mechanisms of action of the most promising class III agent. Am J Cardiol 1999; 84(9): 20–28. doi:10.1016/ S0002-9149(99)00698-0.
4. Jafari‑Fesharaki M, Scheinman MM. Adverse Effects of Amiodarone. Pacing Clin Electrophysiol. 1998; 21(1): 108-120. doi:10.1111/j.1540-8159.1998.tb01068.x
5. Okayasu K, Takeda Y, Kojima J et al. Amiodarone Pulmonary Toxicity: A Patient with Three Recurrences of Pulmonary Toxicity and Consideration of the Probable Risk for Relapse. Intern Med. 2006; 45(22):1303–1307. doi:10.2169/internalmedicine.45.1800
6. Dusman RE, Stanton MS, Miles WM et al. Clinical features of amiodarone ‑ induced pulmonary toxicity. Circulation. 1990; 82(1): 51–59. doi:10.1161/01.CIR.82. 1. 51.
7. Pitcher WD. Southwestern Internal Medicine Conference: Amiodarone Pulmonary Toxicity. Am J Med Sci. 1992; 303(3): 206–212. doi:10.1097/00000441-199203000-00012.
8. Papiris SA, Triantafillidou C, Kolilekas L et al. Amiodarone: Review of Pulmonary Effects and Toxicity. Drug Saf. 2010; 33(7): 539–558. doi:10.2165/11532320-000000000-00000
9. Wood DL, Osborn MJ, Rooke J et al. Amiodarone Pulmonary Toxicity: Report of Two Cases Associated With Rapidly Progressive Fatal Adult Respiratory Distress Syndrome After Pulmonary Angiography. Mayo Clin Proc 1985; 60(9): 601–603. doi:10.1016/S0025 - 6196(12)60983-5.
10. Feduska ET, Thoma BN, Torjman MC et al. Acute Amiodarone Pulmonary Toxicity. J Cardiothorac Vasc Anesth. Published online November 2020: S1053077020311745. doi: 10.1053/j.jvca.2020. 10. 060.
11. The drug‑induced respiratory disease website. [cit. 2021-06-26]. Dostupné z WWW:https:// www.pneumotox.com/drug/index/.
12. Gleadhill IC, Wise RA, Schonfeld SA et al. Serial lung function testing in patients treated with Amiodarone: A prospective study. Am J Med 1989; 86(1): 4–10. doi:10.1016/0002 - 9343(89)90221-0.
13. Marchlinski FE. Amiodarone Pulmonary Toxicity. Ann Intern Med 1982; 97(6):839. doi:10.7326/0003-4819-97-6-839.
14. Siniakowicz RM, Narula D, Suster B et al. Diagnosis of Amiodarone Pulmonary Toxicity with HighResolution Computerized Tomographic Scan. J Cardiovasc Electrophysiol 2001; 12(4): 431–436. doi:10.1046/j.1540-8167.2001.00431.x.
15. Lošťáková V, Kuna M, Kolek V et al. Drug ‑ induced lung injury. Klin Farmakol Farm 2019; 32(4): 21–31. doi:10.36290/far.2018.025.
16. Kubo K, Azuma A, Kanazawa M et al. Consensus statement for the diagnosis and treatment of drug ‑ induced lung injuries. Respir Investig 2013; 51(4): 260–277. doi:10.1016/j. resinv.2013. 09. 001.
17. Potpara T, Dagres N, Arbelo E et al. The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC): 126.
18. Epstein AE, Olshansky B, Naccarelli GV et al. Practical Management Guide for Clinicians Who Treat Patients with Amiodarone. Am J Med 2016; 129(5): 468–475. doi:10.1016/j. amjmed.2015. 08. 039.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo E-7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Úskalí diagnostiky autoimunitní pankreatitidy
- Monitoring a analýza rizikových faktorů pádů pacientů hospitalizovaných v nemocnicích
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Intoxikace muchomůrkou zelenou: mechanismus toxicity, klinické projevy a terapeutické postupy
- Amiodaronem indukované postižení plic u pacienta s fibrilací síní
- Odporúčania bezpečného odberu venóznej krvi uzavretým odberovým systémom
- Úskalí diagnostiky autoimunitní pankreatitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



