-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Racionální diagnostika cholangiokarcinomu
The rational diagnostic of cholangiocarcinoma
Cholangiocarcinoma (CC) is a rare malignant tumour arising from cholangiocytes, and its prognosis is usually unfavourable, mostly as a result of late diagnosis of the tumour. The current incidence of cholangiocarcinoma in the Czech Republic is 1.4/100,000 inhabitants per year; in less than 30 % of patients with CC, one of the known risk factors can be identified, most frequently, primary sclerosing cholangitis. Only patients with early diagnosed and surgically amenable cholangiocarcinoma are likely to have a longer survival time; in their case, survival for more than five years has been achieved in 20 % to 40 %. From the perspective of the need for early diagnosis of CC, a significant part is played by imaging and histopathologic evaluation; the early diagnostic significance of oncomarkers is limited. The rational early diagnosis of CC consists in effective use of differentiated advantages of different imaging modalities – MRI with DSA appears to be the optimal method, endosonography is a sensitive method for the identification of malignancy in the hepatic hilum or distal common bile duct, MRCP (magnetic resonance cholangiopancreatography) is used to display pathological changes in the biliary tree, ERCP (endoscopic retrograde cholangiopancreatography) allows material removal for histopathological examination. Other new approaches are also beneficial, such as IDUS – intraductal ultrasonography of biliary tract or SPY-GLASS, enabling examination of the bile ducts by direct view with the possibility of taking targeted biopsies. Sensitivity and specificity of histology and cytology can be increased by using the molecular cytogenetic FISH method, i.e. fluorescence in situ by hybridization, with a specificity of 97 %.
Key words:
epidemiology – cholangiokarcinoma – rational diagnostic – risk factors
Autoři: Martin Rydlo 1; Jana Dvořáčková 2; Tomáš Kupka 1; Pavel Klvaňa 1; Jaroslav Havelka 3; Magdalena Uvírová 4; Edvard Geryk 5; Daniel Czerný 3; Tomáš Jonszta 3; Martina Bojková 1; Vladimír Hrabovský 1; Veronika Jelínková 1; Arnošt Martínek 1; Petr Dítě 1
Působiště autorů: Interní klinika LF OU a FN Ostrava 1; Ústav patologie LF OU a FN Ostrava 2; Ústav radiodiagnostický LF OU a FN Ostrava 3; CGB laboratoř, Ostrava 4; Oddělení pro vědu a výzkum FN Brno 5
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 125-133
Kategorie: Přehledné referáty
Souhrn
Cholangiokarcinom (CC) je vzácný maligní nádor vznikající z cholangiocytů. Prognóza CC bývá většinou nepříznivá. Zásadní podíl na této skutečnosti má pozdní diagnóza nádoru. Současná incidence CC v České republice činí asi 1,4 na 100 000 obyvatel za rok; u méně než 30 % pacientů s CC lze identifikovat některý ze známých rizikových faktorů, nejčastěji primární sklerozující cholangiitidu. Naději na delší dobu přežití mají pacienti s časně diagnostikovaným, chirurgicky řešitelným CC, u kterých dosahuje 5letá doba přežití asi 20–40 %. Pro časnou diagnózu CC mají zásadní význam zobrazovací metody a histopatologické zhodnocení, zatímco časně diagnostický význam onkomarkerů je omezený. Racionální časná diagnostika CC spočívá v účelném využití diferencovaných výhod jednotlivých zobrazovacích metod – optimální se jeví MRI s DSA, EUS je citlivou metodou pro identifikaci malignit v oblasti jaterního hilu nebo distálního choledochu, zatímco MRCP (magnetic resonance cholangiopancreatography) spíše při zobrazení patologických změn biliárního stromu, ERCP (endoscopic retrograde cholangiopancreatography) umožňuje odběr materiálu pro histopatologické vyšetření. Přínosem jsou i novější diagnostické metody, např. IDUS – intraduktální ultrasonografie biliárních cest anebo SPY-GLASS, umožňující vyšetřit žlučové cesty přímým pohledem s možností odběru cíleného bioptického vzorku. Specificitu i senzitivitu histologického a cytologického vyšetření lze zvýšit využitím molekulárně cytogenetické metody FISH, tj. fluorescenční in situ hybridizací, u níž specificita dosahuje 97 %.
Klíčová slova:
epidemiologie – cholangiokarcinom – racionální diagnostika – rizikové faktoryEpidemiologie
Cholangiokarcinom (číslo diagnózy C22.1) zaujímá 10–15 % všech hepatobiliárních malignit a je druhým nejčastějším primárním nádorem jater ve světě [1]. Epidemiologická data prokazují mírný a konstantní nárůst nových onemocnění CC [2]. V USA je incidence cholangiokarcinomu asi 7 na 1 milion obyvatel [3], ve Velké Británii v roce 2012 zemřelo na toto nádorové onemocnění 1 500 nemocných [4]. V České republice v průběhu let 1991–2010 byl cholangiokarcinom zjištěn u 996 mužů, což představuje 9,7 % ze všech 10 293 jaterních novotvarů, u žen dokonce v 15,5 % všech jaterních novotvarů. Dle věkových kategorií se CC vyskytuje u mužů nejčastěji v 7. dekádě (31,9 %), zatímco u žen v dekádě 8. (33,9 %) [5], graf 1.
Graf 1. Trend prevalence nemocných s cholangiokarcinomem. Upraveno podle [5] ![Trend prevalence nemocných s cholangiokarcinomem. Upraveno podle [5]](https://pl-master.mdcdn.cz/media/image/65a0f80c0004f655f4d4ffe38d545575.png?version=1537794340)
Rizikové faktory
Rizikové faktory jsou nalézány v méně než 30 % všech případů CC; kromě primární sklerozující cholangiitidy (PSC), která je považována za nejčastější známý rizikový faktor pro vznik CC, jsou mezi dalšími rizikovými faktory uváděny věk (více než 2/3 pacientů je starších 65 let) [6,8], chronické hepatitidy B a C [7], intraduktální konkrementy [6–8]; Caroliho nemoc [6,8], cysty, adenomy a papilomatóza žlučových cest [6–8], parazitární infekce (Opisthoorcis viverrini, Clonorchis sinensis) [7,9], metabolický syndrom, obezita, NAFLD (Non-alcoholic fatty liver disease – nealkoholová steatóza jater), diabetes mellitus [10], nosičství Salmonella typhi [8,9], expozice thorotrastu [8,11], Lynchův syndrom a další [9]. Ale jak uvedeno výše, nejčastějším predispozičním faktorem pro vznik CC je primární sklerozující cholangiitida [12,13]. V Claessenově studii z roku 2009 [12] bylo sledováno 211 osob s PSC, z nichž 60 % bylo současně postiženo ulcerózní kolitidou. U 41 % sledovaných osob vznikl následně kolorektální karcinom a u 39 % osob byl později prokázán CC. Ze sledovaného souboru celkem 41 % nemocných zemřelo následkem maligního onemocnění. Přitom medián intervalu mezi diagnózou CC a diagnózou PSC činil 2,5 roku, nejdelší interval mezi diagnózou PSC a diagnózou CC činil 9,8 roku.
Anatomická klasifikace
Pod pojem cholangiokarcinom jsou zahrnovány všechny karcinomy žlučových cest; asi 20 % všech CC je lokalizováno intrahepatálně; 50–60 % CC se nachází perihilózně (tyto CC jsou řazeny k extrahepatickým CC), téměř 20 % patří k distálním extrahepatálním tumorům a 5 % CC je klasifikováno jako multifokální nádory. Asi 70 % všech CC se nachází mimo jaterní parenchym, predilekční lokalitou je proximální ductus choledochus v oblasti junkce. Tento typ CC je označován jako Klatskinův tumor. Různě lokalizované typy CC se liší nejen četností, ale i biologickým chováním i volbou následného léčebného postupu. Ve smyslu Bismuthovy-Corlettovy klasifikace z roku 1975 [14] jsou perihilózní tumory dále děleny do následujících podskupin:
- I. typ: postižen je d. choledochus distálně od bifurkace
- II. typ: je postižena bifurkace (aniž jsou významně postiženy pravý či levý ductus hepaticus)
- III. typ: je postižen d. hepaticus communis a buď pravý (IIIa) anebo levý (IIIb) hepaticus
- IV. typ: multicentrické či oboustranné intrahepatické segmentální postižení anebo postižení bifurkace a obou hepatiků [12]
V roce 2011 Deoliveira et al [15] představili novější klasifikaci perihilózních CC, která oproti uvedené klasifikaci Bismuthově-Corlettově zahrnuje další prognostické faktory, jako jsou angioinvaze do jaterní tepny či portální žíly, metastatický rozsev, postižení uzlin, velikost tumoru, další jaterní onemocnění i předpokládaný postresekční objem jaterní tkáně. Deoliveirova klasifikace by měla přesněji identifikovat faktory, které jsou významné pro další léčebnou péči i prognózu jednotlivých nemocných s CC.
Diagnostika
Diagnostika časných, chirurgicky řešitelných stadií cholangiokarcinomu je velmi obtížná, a tím i prognóza dlouhodobého přežití osob s CC je většinou nepříznivá. Pacienti s časně diagnostikovaným CC, který je řešitelný chirurgicky, mívají 5letou dobu přežití v 20–40 % [14]. V současné době je v době stanovení diagnózy CC indikováno k chirurgickému řešení pouze asi 15–35 % pacientů [16]. Je proto zásadní otázkou, jaké diagnostické postupy mohou pozitivně ovlivnit naši diagnostickou efektivitu, resp. přispět k časné a přesné diferenciální diagnostice. Náš příspěvek vychází z doporučení Britské gastroenterologické společnosti z roku 2013 [10], která jsou revizí doporučení této společnosti z roku 2002 [17].
Pro CC bývá typickým iniciálním klinickým nálezem bezbolestný obraz obstrukčního ikteru, který je dán progredující okluzí žlučových cest nádorem [18]. Ale klinické projevy jsou často obdobné jako u primární biliární cirhózy, např. pruritus či známky cholangiitidy [19]. Současně mohou být již přítomny obecné příznaky maligního onemocnění, jako je únavnost a ztráta tělesné hmotnosti. V diagnostice CC není žádné laboratorní vyšetření krve dostatečně specifické; zvýšení obstruktivních jaterních enzymů je logické, v počínající fázi nemoci lze nalézt např. i zvýšení CRP či hypalbuminemii [20]. Z nádorových markerů je nejčastěji používáno stanovení CA19–9 a CA125. Avšak jak senzitivita CA19–9 (40–70 %), tak specificita (50–70 %), včetně pozitivní prediktivní hodnoty (16–40 %), jsou nízké [21], navíc zvýšení CA19–9 provází další hepatobiliární choroby (PSC, nemaligní obstruktivní ikterus, cirhózu, tumory pankreatu atd) [21].
CA125 bývá pozitivní asi u 65 % osob s CC, přičemž nelze vyloučit, že CA125 může být potenciálním perspektivním markerem pro hodnocení délky přižití těchto nemocných [22]. Význam některých novějších onkomarkerů (např. insulin-like growth factor 2, metalloproteináza 7 nebo mucin MUC5AC) je nyní validizován v klinických studiích [23].
V diagnostice rizikových prekancerózních stavů může být problémem diferenciální diagnostika PSC vzhledem k dalším cholestatickým chorobám – např. k primární biliární cirhóze (diferenčními parametry mohou být i AMA, pANCA, MRCP, ERCP, biopsie atd), problémem může být i odlišení PSC od cholangiitidy s pozitivitou IgG4 jak v krevním séru, tak ve tkáni žlučovodu [25]. V tomto případě může být určitým vodítkem fakt, že ve většině případů bývá PSC diagnostikována spíše u mladších osob ve věku mezi 30–40 lety, zatímco IgG4 cholangiitida postihuje spíše jedince starší 50 let. Je třeba také zmínit, že zatímco výskyt cholangiokarcinomu u nemocných s PSC je udáván u 10–30 % nemocných, tak u pacientů s IgG4 cholangiitidou dosud taková souvislost prokázána nebyla [8].
Zobrazovací metody
Zásadní význam v diagnostice CC mají zobrazovací metody, které často současně umožňují i cílené odběry tkáně k histologickému vyšetření; na druhé straně ani tyto metody nemusí být dostatečně citlivé v diagnostice časných stadií. Ultrazvukové vyšetření břicha má sice vysokou negativní prediktivní hodnotu (90 %), ale jeho senzitivita, včetně pozitivní prediktivní hodnoty, nepřesahuje 50 % [25].
Spirální multislice CT vyšetření v časné diagnostice CC má senzitivitu až 80 %, umožňuje zobrazit i lymfadenopatii, extrahepatické metastázy nebo lokalizaci nádorové masy intrahepaticky. Kombinace CT vyšetření a pozitronové emisní tomografie není výtěžnější než CT vyšetření, ale tato kombinace vyšetření by snad mohla být výhledově využívána pro zhodnocení předoperačního stagingu [26,27].
MRCP (magnetic resonance cholangiopancreatography/MR cholangiopankreatografie) je neinvazivní metoda, která slouží k zobrazení a hodnocení intrahepatických a extrahepatických žlučových cest a pankreatického vývodu. Na rozdíl od endoskopické retrográdní cholangiopankreatografie (ERCP, obr. 1) při MRCP (obr. 2) není potřeba aplikovat kontrastní látku do biliárního systému. Jsou tak vyloučena rizika spojená s endoskopickým výkonem a aplikací jodové kontrastní látky. Při MRCP se používají techniky silně T2 vážených obrazů, které díky dlouhému T2 relaxačnímu času tekutin dávají vysoký signál stacionární nebo pomalu tekoucí tekutiny v hepatikobiliárním systému a signál z cév a ostatních měkkých tkání je potlačen (obr. 3). MRCP lze provádět technikami 2D zobrazení během zadržení dechu v trvání 5–15 s, nebo technikami 3D (obr. 4), s volným dýcháním a monitoringem pohybu bránice, okolo 3–5 min, navíc s možností multiplanárních rekonstrukcí.
Obr. 1. Pacient (1964): vyšetření ERCP. 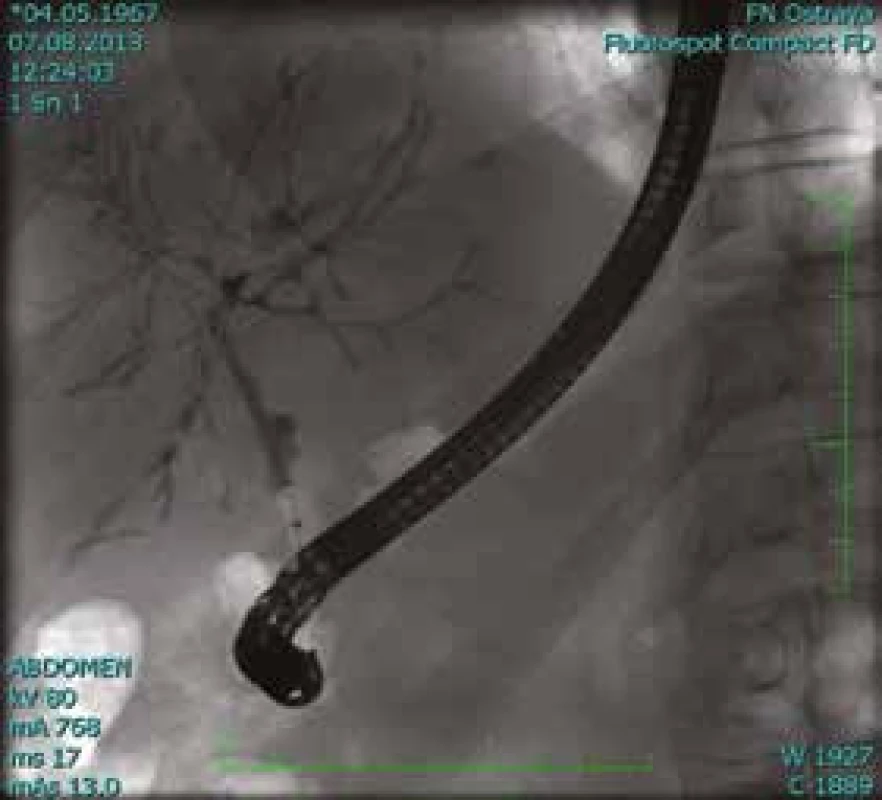
Obraz PSC s typickými segmentárními stenózami a dilatacemi převážně na intrahepatálních větvích (nález nevylučuje současnou přítomnost CC) Obr. 2. Pacient (1960): patrný štíhlý ductus choledochus. 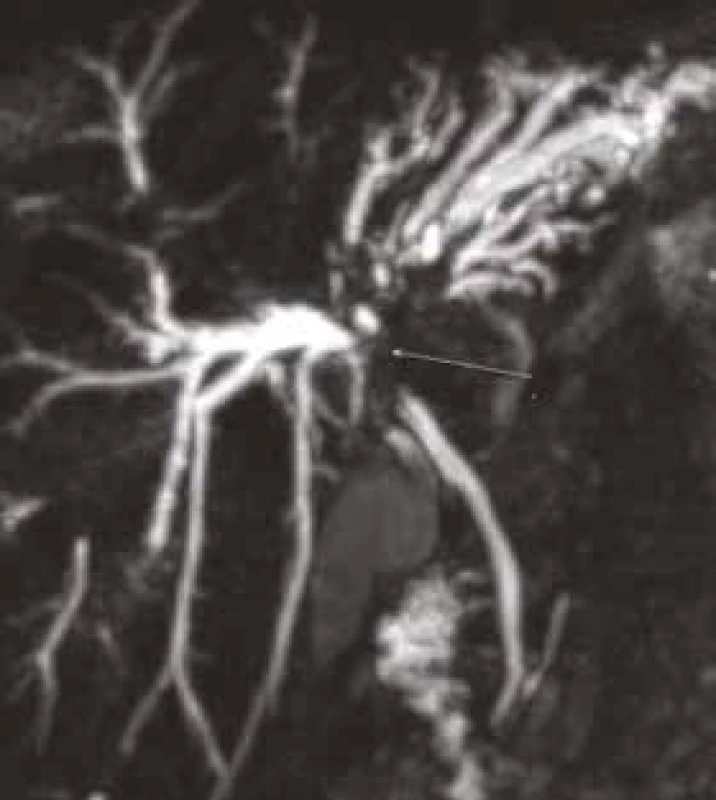
Hepatocholedochus, defekt v oblasti junkce hepatiků a dilatace intrahepatických žlučových cest, výraznější jsou změny v oblasti levého hepatiku. MRCP, MIP (maximum intensity projection) rekonstrukce Obr. 3. Pacient (1960): nasycení patologických hmot v oblasti junkce hepatiků i podél levého hepatiku. 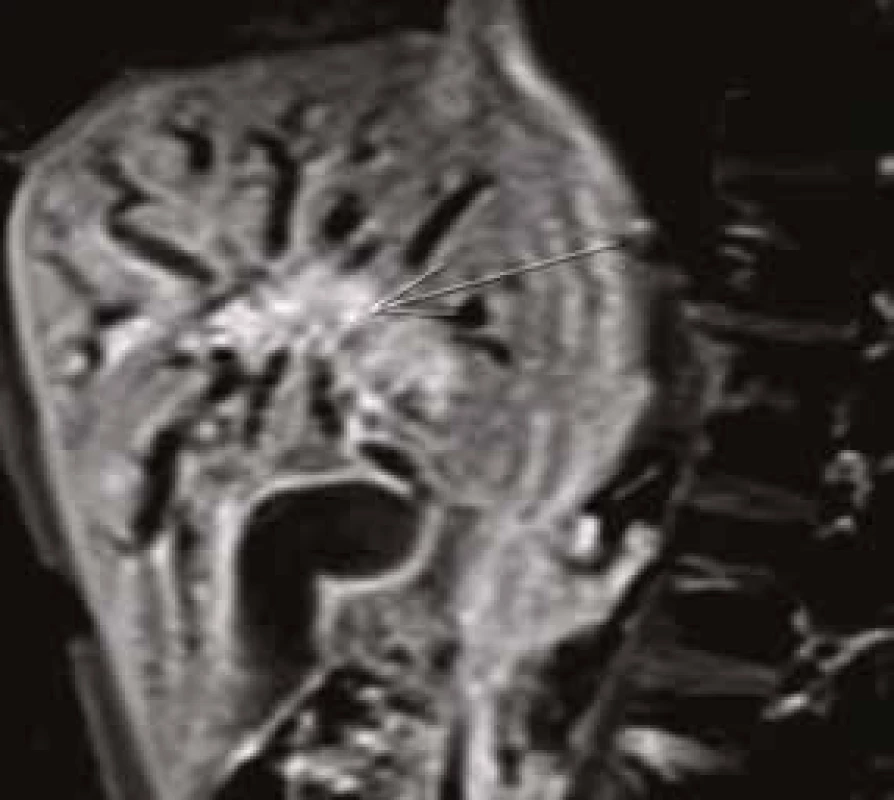
Postkontrastní T1 vážené, 3D gradientní USG, breath hold, sagitální rovina Obr. 4. Pacient (1960): nasycení patologických hmot v oblasti junkce hepatiků. 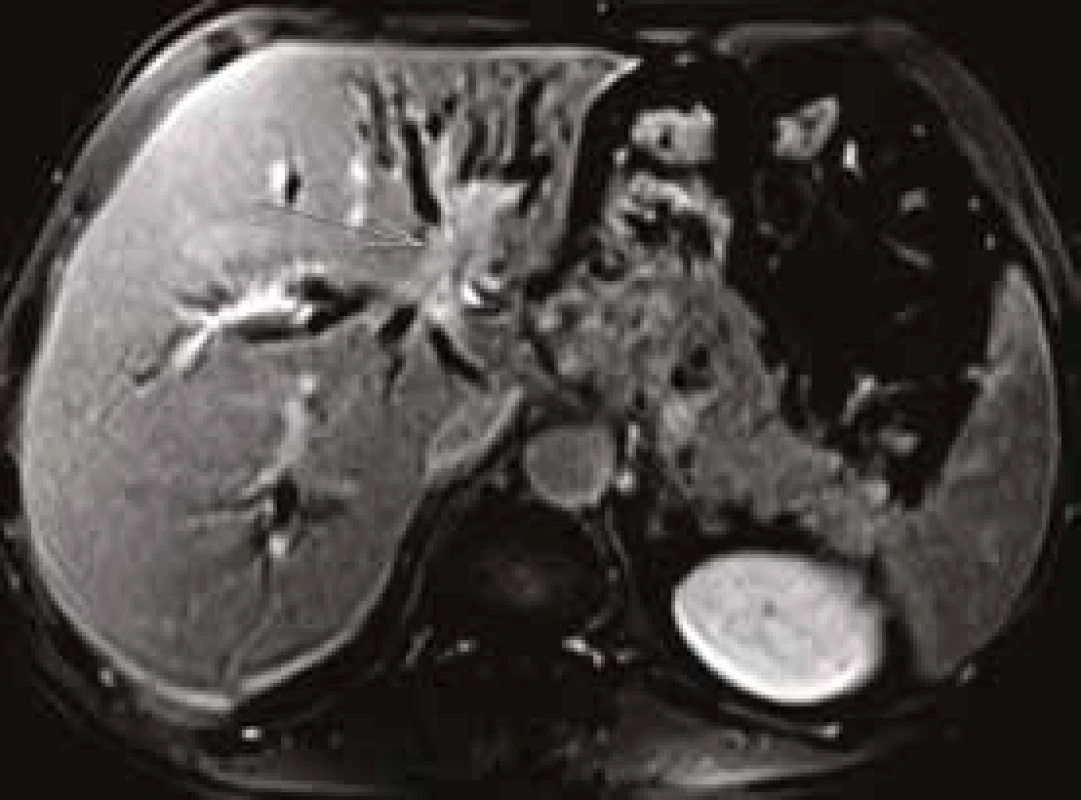
Postkontrastní T1 vážené, 3D gradientní USG, breath hold, axiální rovina Neinvazivní magnetická rezonance (non invasive magnetic resonance imaging) a digitální subtrakční angiografie (DSA) se v současné době zdají být optimálními metodami v časné diagnostice suspektního cholangiokarcinomu. MRI a DSA [28,29], zvláště v kombinaci s ERCP, která umožňuje odběr tkáně k histopatologickému zhodnocení, poskytují nejpřesnější informace o lokalizaci nádoru, jeho rozsahu i metastatickém rozsevu, tj. přinášejí zásadní podklady pro rozhodnutí o možnostech chirurgického řešení. MR cholangiopankreatikografie (MRCP) představuje neinvazivní zobrazovací metodu (bez aplikace kontrastní látky) umožňující zobrazení intrahepatických a extrahepatických žlučových cest včetně pankreatického ductus Wirsungi. Další možností, jak zpřesnit diagnostiku CC, je výše uvedená vyšetření doplnit ještě klasickým nativním eventuálně postkontrastním MRI vyšetřením jater a DWI (diffusion weighted imaging).
Možnosti využití CT pozitronové emisní tomografie (PET-CT) v diagnostice časných stadií CC je limitováno velmi často se vyskytující současnou cholangiitidou, která mnohdy znemožňuje správnou interpretaci [29–31].
Endosonografické vyšetření má vysokou citlivost v diagnostice nálezů v oblasti jaterního hilu, distálního choledochu, žlučníku a při posuzování regionálních lymfatických uzlin [32,33]. Vyšetření umožňuje cílený odběr tkáně, čímž jeho pozitivní prediktivní hodnota narůstá téměř ke 100 %. Bohužel nízká negativní prediktivní hodnota nevylučuje malignitu při negativním histologickém nálezu.
Zobrazení žlučového stromu je možné rovněž pomocí perkutánní transhepatální cholangiografie (PTC). V diferenciální diagnostice mezi cholangiokarcinomem a benigní biliární stenózou byla prokázána v retrospektivní srovnávací studii senzitivita MRCP v 96 %, specificita 85 %, zatímco při ERCP byla senzitivita 80 % a specifita 75 %. Zásadní předností ERCP (i PTC) je možnost získání vzorku žluči k cytologickému vyšetření. PTC je v současnosti ale prováděna méně často vzhledem k invazivitě výkonu i riziku možných komplikací [35].
Endoskopické vyšetření žlučových cest (obr. 5) je historicky možné od roku 1976, kdy byl zaveden systém mother-baby. Ultratenký endoskop neboli babyscop byl zaváděn pracovním kanálem duodenoskopu. Tento systém potvrdil správnost konceptu, ale nikdy nedosáhl širokého uplatnění pro vysokou fragilitu instrumentaria. Od roku 2008 je dostupný Spy GlassTM Direct Visualisation system. Speciální ultratenký (10 Fr) katétr je zaváděn jedním endoskopistou pracovním kanálem duodenoskopu. Katétr obsahuje svazek světelných vláken pro osvit a přenos obrazu, 2 kanálky pro oplach a jeden instrumentační kanál o průměru 1,2 mm. Distální konec katétru je ohebný ve 2 na sebe kolmých rovinách. Instrumentačním kanálkem lze zavést speciální bioptické kleště a provést odběr biopsie pod endoskopickou kontrolou. Cholangioskopie (obr. 6) je přínosná v případech tzv. neurčených stenóz, tedy v případech, v nichž ERCP s brushingem a biopsií neobjasní diagnózu. Hlavními indikacemi cholangioskopie jsou tedy diagnostika nejasné léze žlučových cest a zaměření sondy pro elektrohydraulickou litotrypsi obtížné choledocholitiázy [33,36].
Obr. 5. Intraduktální endosonografie: adenom žlučovodu 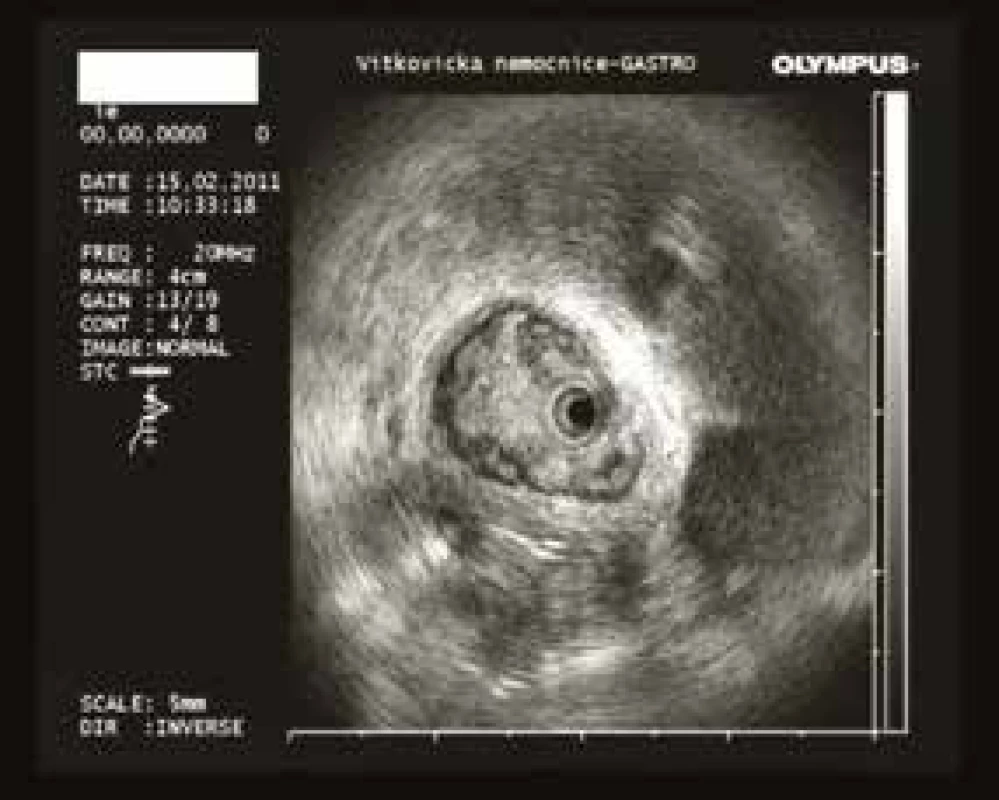
Použito se svolením prim. MUDr. Urbana, Ph.D., Vítkovická nemocnice v Ostravě Obr. 6. Cholangioskopie Spyglass: polypoidní nádorová masa v terminálním úseku žlučovodu – histologicky adenom 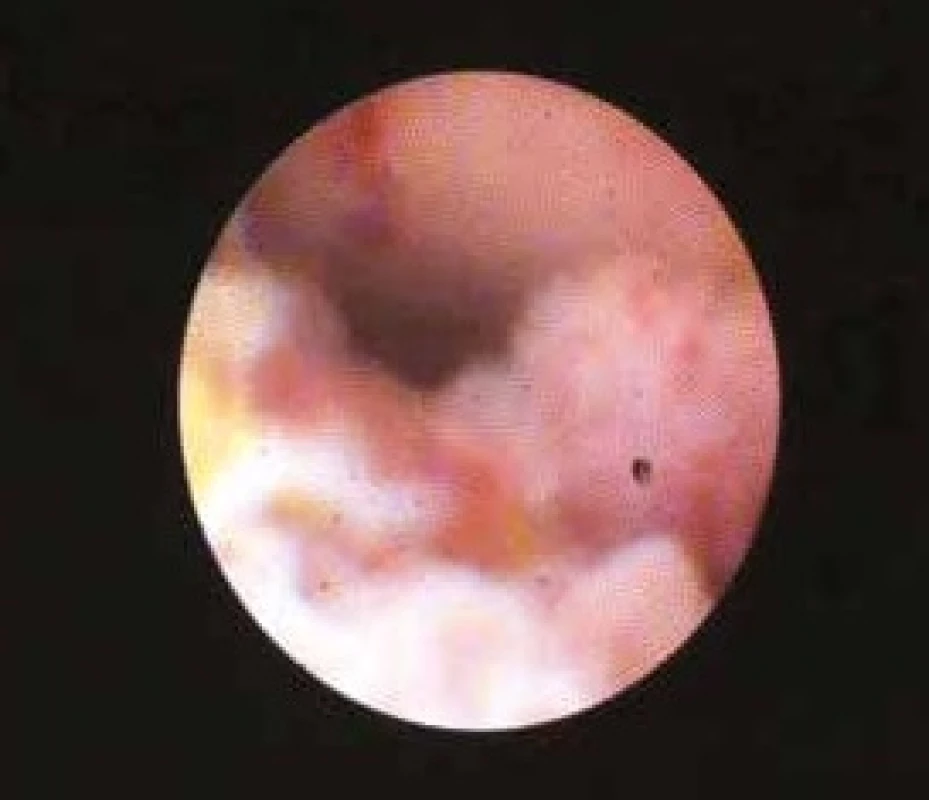
Použito se svolením prim. MUDr. Urbana, Ph.D., Vítkovická nemocnice v Ostravě Indikace k chirurgickému řešení závisí na lokalizaci a velikosti (rozsahu) nádoru i na eventuálním metastatickém rozsevu: souhrnně lze říci, že v současné době nejpřesnější údaje k chirurgické indikaci vyplývají z kombinace vyšetření MRI s kontrastní angiografií a dalším vyšetření, při kterém lze odebrat tkáňový vzorek pro histologické nebo cytologické vyšetření (ERCP, PTC, EUS, IDUS, cholangioskopie) [17,29].
Histologické a cytologické vyšetření
Histologické anebo cytologické vyšetření je součástí diagnostického armentaria. Cholangiocelulární karcinomy vyrůstají z buněk biliárního stromu, a proto se mohou nacházet kdekoli od Vaterské papily až po nejmenší intrahepatální žlučovody. Dle WHO klasifikace 2010 [37] dělíme tyto nádory na 2 základní skupiny, a to na karcinomy intrahepatální a extrahepatální. Jejich další rozdělení dle typu a topografie demonstruje schéma 1.
Schéma 1. Rozdělení cholangiocelulárního karcinomu dle typu a topografie 
Mikroskopicky jsou cholangiogenní karcinomy charakterizovány převážně tubulární strukturou s nápadnou fibroprodukcí (obr. 7) a v imunohistochemickém vyšetření pak pozitivitou CK7 a CK19 (obr. 8 a obr. 9). Ostatní histologické typy karcinomů jako karcinom mucinózní, skvamózní, adenoskvamózní, intestinální, papilární, drobnobuněčný nebo karcinom z prstenčitých buněk se vyskytují méně často. Asi v 1 % všech karcinomů jater se vyskytuje kombinovaný hepatocelulární cholangiokarcinom (HCCC), u kterého se rozlišují další podtypy, a to: HCCC klasický typ, HCCC subtyp s rysy kmenových buněk, HCCC s rysy kmenových buněk, tzv. intermediální buněčný typ, a HCCC s rysy kmenových buněk, tzv. cholangiocelulární typ. Jednotlivé typy se liší expresí biliárních markerů, jako jsou c-kit, CD56, EpCAM a vimentin. Toto rozlišení zatím nemá větší klinický význam, jelikož nejsou známy žádné rozdíly v jejich biologickém chování [38–40].
Obr. 7. Histologie: hematoxylin-eozin (HE): trabekulárně uspořádané struktury maligního nádoru s desmoplastickou komponentou odpovídající obrazu cholangiocelulárního karcinomu 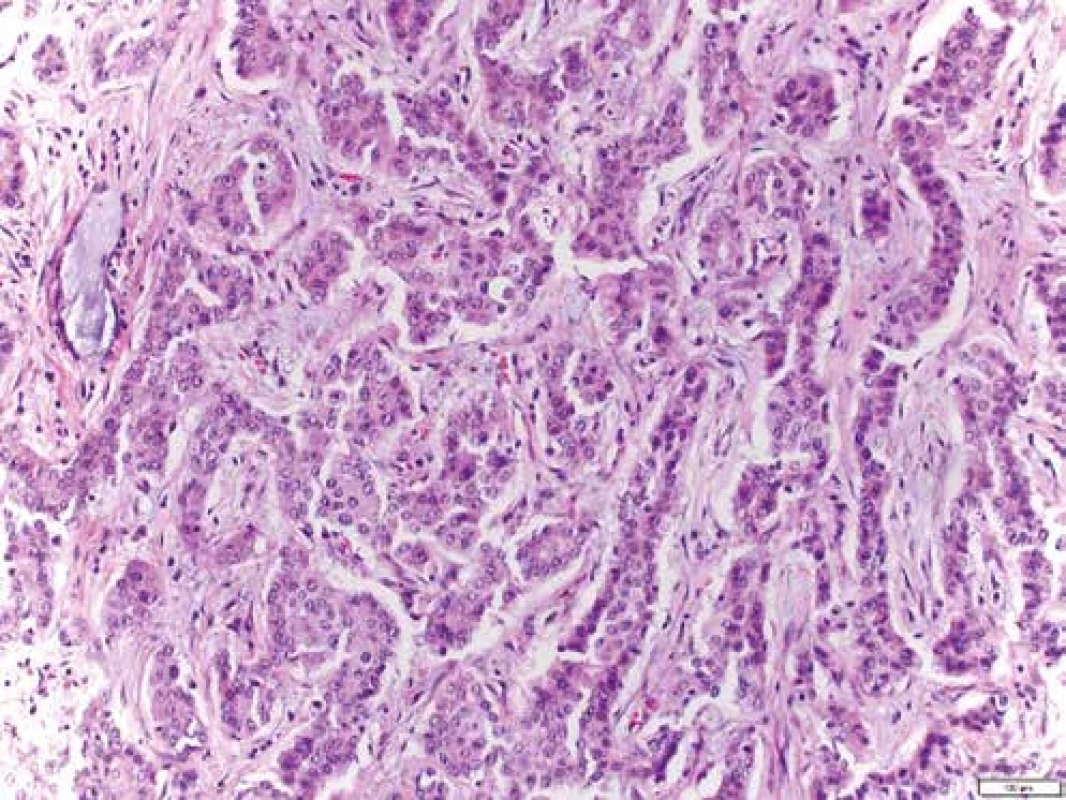
Zvětšeno 200krát, Olympus DP73 Obr. 8. Imunohistochemický průkaz CK 7 v nádorových buňkách v řezech z cytobloku. 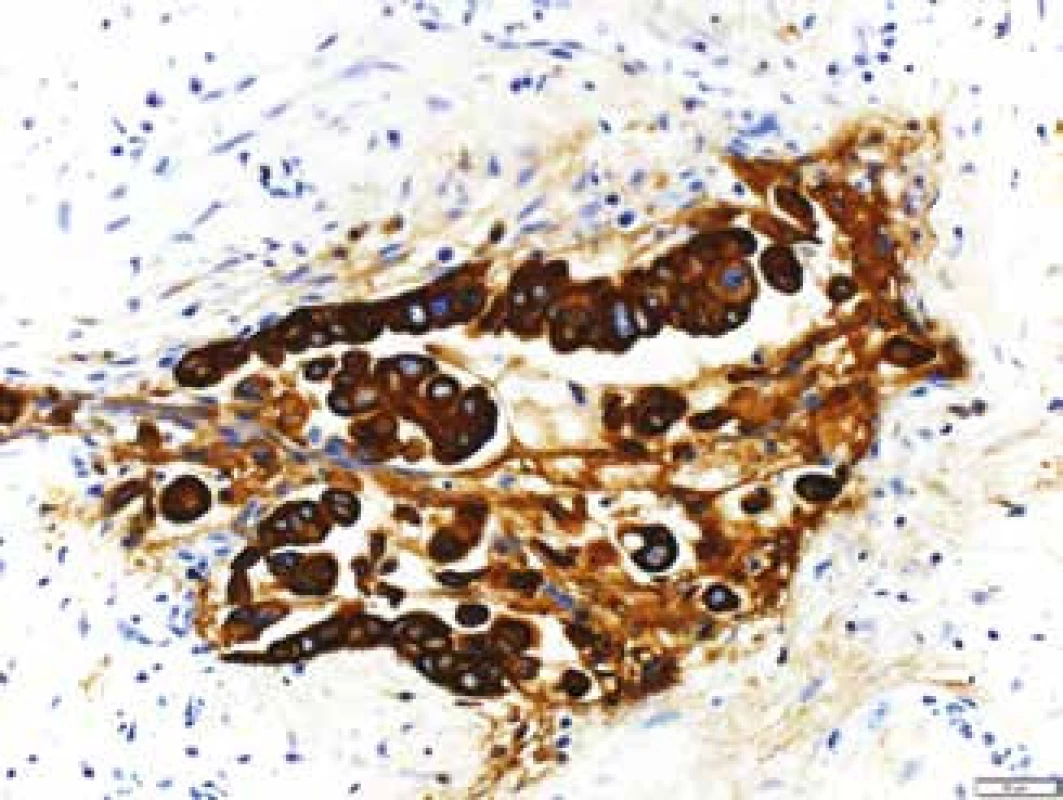
Barvení IHC CK7, zvětšení 100krát, foto Olympus DP 70 Obr. 9. Cytologický nátěr maligních buněk z tenkojehlové aspirační cytologie s průkazem PAS reakce (Periodic Acid Schiff) pozitivních vakuol. 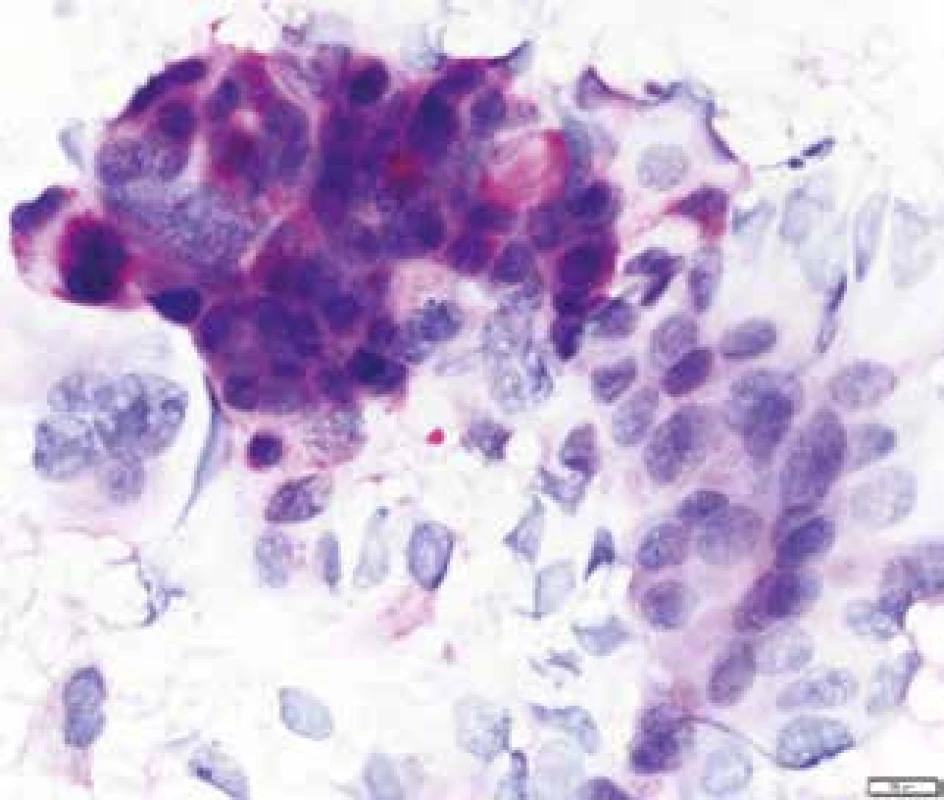
Barvení PAS, zvětšení 200krát, foto Olympus DP 70 V diagnostice CC (HCCC) lze použít tkáňové vzorky, které byly získány:
- standardní biopsií formou excize patologické tkáně, jehlové biopsie nebo biopsie získané při endoskopickém vyšetření
- peroperační biopsií
- tenkojehlovou aspirační biopsií (FNAB)
- kartáčkovým stěrem na cytologické vyšetření
Kritéria malignity jsou obecně dána empiricky, avšak liší se pro každou lokalitu. Vždy jde o skládání komplexu znaků, jako je posouzení struktury, zhodnocení cytologických znaků, charakteru buněk či jader, proliferační aktivity a posouzení jejich růstových schopností.
Diferenciální diagnóza mezi CC a HCC je důležitá i proto, že cholangiokarcinomy mají velmi nepříznivou prognózu, a to i v případě jaterní transplantace, a tak diagnóza cholangiokarcinomu je v mnoha transplantačních centrech považována za kontraindikaci transplantace [40,41]. Naopak, protože hepatocelulární karcinom (HCC) má (při splnění určitých kritérií) příznivé transplantační výsledky, tak by z klinického hlediska měla být histopatologická diagnostika jednoznačným klíčem k dalšímu rozhodování o léčebném postupu. Bohužel toto rozhodování na úrovni histopatologie není a nemůže být jednoznačné, protože hepatocyty i cholangiocyty vznikají pravděpodobně v oblasti Heringových kanálků z tzv. progenitorových buněk, které se mohou diferencovat jak v hepatocyty, tak cholangiocyty, a tak velká skupina nádorů jater vykazuje pozitivitu imunohistochemických markerů obou skupin. Protože diagnóza cholangiocelulárního karcinomu má, jak výše uvedeno, důležité konsekvence týkající se výběru dalšího léčebného postupu, většina transplantačních center vyžaduje k diagnóze cholangiokarcinomu nejen jednoznačnou morfologii s fibroprodukcí a struktury tubulárního adenokarcinomu, ale též pozitivní imunohistochemický průkaz CK19.
Problematika histologického ověření ložiskových jaterních lézí je primárně závislá i na skutečnosti, zda léze se nachází v cirhotickém terénu či nikoli. Klíčové je odlišení CC od hepatocelulárního karcinomu (HCC). Diagnóza může být problematická i u dobře diferencovaných HCC; pro tuto lokalitu nejsou definována jednoznačná kritéria malignity a rozhodnutí o biologickém chování těchto afekcí je často arbitrární [9,41]. S pomocí peroperačního kryostatického vyšetření („nazmrzlo“) lze většinou vyloučit metastatický původ ložiska. Protože epitel žlučovodů exprimuje „své“ markery shodně nejen v celém průběhu (včetně pankreatické části žlučovodu), ale také i v části pankreatických vývodů, tak v současnosti neexistuje metoda, která by dokázala jednoznačně odlišit primární cholangiogenní či metastatický pankreatický původ tumoru v játrech.
V oblasti extrahepatálních žlučových cest je obtížná diferenciální diagnostika primárních a sekundárních cholangiitid oproti karcinomu žlučových cest, protože kontakt žluči s intersticiem v oblasti poškozeného epitelu žlučovodů vyvolá v intersticiální tkáni komplexní zánětlivou reakci, při níž iritace žlučovými kyselinami a dalšími složkami žluči stimuluje tkáň k fibroprodukci. Vzniklé fibrotické změny jsou nejen makroskopicky, ale mnohdy i mikroskopicky neodlišitelné od fibroplazie doprovázející maligní nádor. Při mikroskopickém vyšetření jde o komplikovaný problém, který v malé excizi vede k diagnostickým rozpakům s vysokým procentem nejasných nebo „nesprávných“ závěrů [42].
Z endoskopických bioptických vzorků lze diagnostikovat nádorové afekce z oblasti Vaterské papily, pokud jsou histopatologické změny přítomny v odebraných povrchových partiích epitelu. Problém nastává, pokud je tumor lokalizován v těsném sousedství odebraného bioptického vzorku; pak epitel papily vykazuje pravidelně „pouze“ výrazné zánětlivé iritační změny a ani při opakovaných endoskopických odběrech nebývá ve vzorcích tumor zastižen. V takových případech může být výhodnější aspirační biopsie tenkou jehlou (FNAB – fine needle aspiration biopsy) a cytologické vyšetření. Cytologické vzorky jsou získávány jednak při přímém odběru žluči v průběhu ERCP vyšetření, jednak pomocí FNAB pod endosonografickým navedením bioptické jehly. Standardní cytologie v materiálu získaném při ERCP vyšetření vykazuje (u pacientů s CC) v méně než 50 % pozitivitu nálezů cholangiokarcinomu, avšak jestliže je současně ještě provedena cílená biopsie tkáně, zvýší se pozitivita záchytu až na 70 %. Při využití molekulárně cytogenetické metody FISH (fluorescenční in situ hybridizace) pro stanovení polysomie chromozomů 3,7 a 17, případně delece oblasti 9p21 (tumorsupresorový gen CDKN2A), se zvyšuje senzitivita až na 98 % [46]. Při fluorescenční in situ hybridizaci pro stanovení polysomie chromozomů 3,7 a 17, případně delece oblasti 9p21 (tumorsupresorový gen CDKN2A) hybridizuje fluorescenčně značená molekula nukleové kyseliny – sonda s hledanou a analyzovanou sekvencí nukleové kyseliny přímo v buňce, „na místě“, na histologických řezech tkáně či na izolovaných buňkách v cytologickém preparátu (obr. 10). Specificita FISH je uváděna 97 % [43]. FISH metoda je u nás dostupná ve většině cytogenetických laboratoří.
Obr. 10. Polysomie chromozomu 7, použitá sonda KREATECH Diagnostic, ON EGFR, Her-1 (7p11)/SE 7 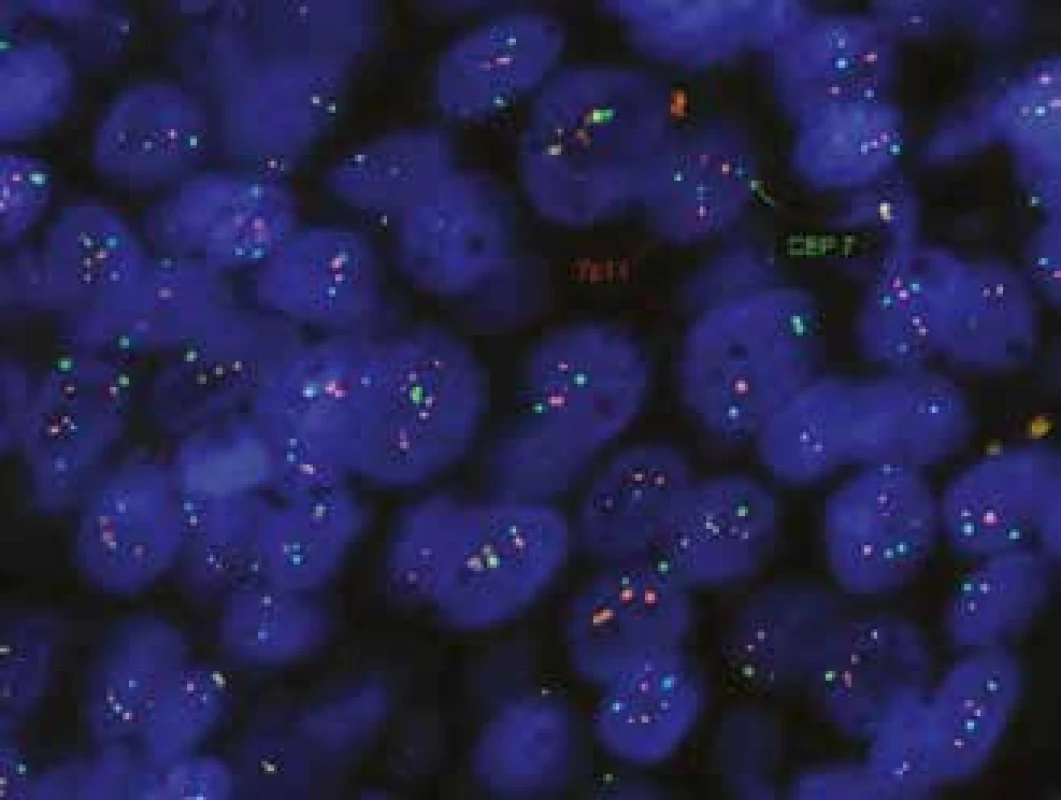
Molekulární genetika (obr. 10)
Mezi rizikové faktory, které mohou mít zásadní vliv na patogenesi cholangiogenního karcinomu, náleží zánětlivé procesy – např. zmíněná PSC. Zánětlivé buňky jsou asociovány s oxidativním stresem, který může vést ke genetickým mutacím, poškození DNA a inhibici DNA repair enzymů, nadprodukci vaskulárního endoteliálního faktoru (VEGF), což může způsobovat angiogenezi a generování cytokinů, které vedou k vyloučení apoptózy a podpoře buněčné proliferace [47]. Kancerogeneze u cholangiogenního karcinomu se tedy zúčastňují geny ovlivňující buněčný cyklus a apoptózu. Patří sem KRAS gen ovlivňující mechanizmus buněčného růstu a diferenciace. Tento protoonkogen konvertuje v aktivní onkogen bodovou mutací v kodonech 12, 13 nebo 61. Frekvence výskytu mutovaného genu KRAS je v závislosti na rase velice variabilní a má také vysokou geografickou variabilitu (např. 50–56 % v japonské populaci pacientů s CC vs 0–8 % u thajských pacientů s CC). Je uváděn větší výskyt mutací u periduktálních a spikulárních karcinomů než u „mass forming“ tumorů. Dalším významným tumorsupresorovým genem, který má zásadní význam v karcinogenezi obecně, je gen TP53. K jeho inaktivaci může docházet mutací genu nebo delecí lokusu chromozomu 17p13, na kterém je gen lokalizován. Incidence mutace genu TP53 u intrahepatálního cholangiogenního karcinomu je 11–37 % a delece oblasti 17p13 38 % případů. V posledních studiích je prokázán také významný vliv epigenetických změn na vznik cholangiogenního karcinomu, které vedou k hypermetylaci promotorů mnoha genů. S těmito změnami bývají asociovány především mutace genů IDH1 a IDH2 (kódují izocitrátdehydrogenázu), které bývají přítomny u 10–23 % cholangiogenních karcinomů. Mutace IDH1 a IDH2 genů vedou k nadprodukci 2-hydroxyglutarátu, který se takto jeví jako potenciální biomarker pro monitorování terapie specifickými inhibitory IDH mutace, které jsou v současnosti testovány na zvířecích modelech [47]. Ve studiích cholangiogenních karcinomů jsou popisovány také genetické a epigenetické změny genu CDKN2A, který je regulátorem inhibitorů cyklindependentních kináz. Metylace CpG ostrůvků v oblasti 5‘, která způsobí inaktivaci genu CDKN2A, je přítomna v 54 %, alelická ztráta CDKN2A genu (lokus 9p21) ve 20 % a bialelická delece genu CDKN2A u 5 % cholangiogenních karcinomů [45]. Aktivace genu EGFR koreluje s rekurencí tumoru a horší prognózou, také ERBB2 exprese je asociována s progresí tumoru. Intracelulární mechanizmy mají za následek aktivaci RAS-RAF-MAPK nebo COX2 signální dráhy. Významnou roli hraje při vzniku cholangiogenního karcinomu také NOTCH signální dráha. U většiny cholangiogenních karcinomů dochází k telomerázové aktivaci. Mikrosatelitová instabilita je málo frekventní [46].
Závěr
Cholangiokarcinom je relativně vzácný nádor, který má příznivou prognózu pouze v případě, že je včas diagnostikován. Jen včasná diagnóza umožňuje adekvátní chirurgické řešení jako v současné době jedinou efektivní možnost úspěšné léčby pacienta. Při podezření na cholangiokarcinom se jeví jako optimální diagnostický postup následující kombinace vyšetření:
- nativní a postkontrastní vyšetření magnetickou rezonancí (jehož součástí je i MRCP) a vyšetření digitální subtrakční angiografií
- výše uvedené zobrazovací metody je nutno doplnit některým z vyšetření, která umožňují odběr vzorků k histologickému nebo cytologickému vyšetření (ERCP, EUS, PTC, IDUS, Spy-Glass)
- senzitivitu i specificitu histologického a cytologického vyšetření lze zvýšit využitím molekulárně cytogenetické metody FISH (fluorescenční hybridizace in situ), jejíž specificita dosahuje hodnoty až 97 %, senzitivita 98 %.
Doručeno do redakce 29. 7. 2015
Přijato po recenzi 15. 10. 2015
MUDr. Martin Rydlo, Ph.D.
drrydlo@seznam.cz
Interní klinika LF OU a FN Ostrava
www.fnbrno.cz
Zdroje
1. Shaib Y, El-Serag HB. The epidemiology of cholangiocarcinoma. Semin Liv Dis 2004; 24(2): 115–125.
2. Patel T. Increase incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. Hepatology 2001; 33(6): 1353–1357.
3. Shaib YH, Davila JA, Mc Glynn K et al. Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase? J Hepatol 2004; 40(3): 472–477.
4. Taylor-Robinson SD, Toledano MB, Arora S et al. Increase in mortality rates from intrahepatic cholangiocarcinoma in England and Wales 1968–1998. Gut 2001; 48(6): 816–820.
5. ÚZIS. Novotvary ČR 1991–2010. Zdravotnická statistika. Ediční řada. ÚZIS ČR: Praha. Dostupné z WWW: http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary.
6. Blechacz B, Komuta M, Roskams T et al. Clinical diagnosis and staging of cholangiocarcinoma. Nat Rev Gastroenterol Hepatol 2011; 8(9): 512–522.
7. Tyson GL, El-Serag HB. Risk factors for cholangiocarcinoma. Hepatology 2011; 54(1): 173–184.
8. Khan SA, Thomas HC, Davidson BR et al. Cholangiocarcinoma. Lancet 2005; 366(9493): 1303–1314. Erratum in Lancet 2006; 367(9523): 1656.
9. Khan SA, Toledano MB, Taylor-Robinson SD. Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma. HPB (Oxford) 2008; 10(2): 77–82.
10. Khan SA, Davidson BR, Goldin RD et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update. Gut 2012; 61(12): 1657–1669.
11. Adenugba A, Khan SA, Taylor-Robinson SD et al. Polychlorinated biphenyls in bile of patients with biliary tract cancer. Chemosphere 2009; 76(6): 841–846.
12. Claessen MM, Vleggaar FP, Tytgat KM et al. High lifetime risk of cancer in primary sclerosing cholangitis. J Hepatol 2009; 50(1): 158–164.
13. Abbas G, Lindor KD. Cholangiocarcinoma in primary sclerosing cholangitis. J Gastrointest Cancer 2009; 40(1–2): 19–25.
14. Bismuth H, Castaing D. Hepatobiliary malignancy. Edward Arnold: London 1994.
15. Deoliveira ML, Schulick RD, Nimura Y et al. New staging system and a registry for perihilar cholangiocarcinoma. Hepatology 2011; 53(4): 1363–1371.
16. Endo I, Gonen M, Yopp AC et al. Intrahepatic cholangiocarcinoma: rising frequency, improved survival, and determinants of outcome after resection. Ann Surg 2008; 248(1): 84–96.
17. Khan SA, Davidson BR, Goldin R et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: consensus document. Gut 2002; 51(Suppl 6): VI1-VI9.
18. Skipworth JR, Keane MG, Pereira SP. Update on the management of cholangiocarcinoma. Dig Sci 2014; 32(5): 570–578.
19. Ehrmann J, Hůlek P et al. Hepatologie. Grada: Praha 2014 : 602–604. ISBN 978–80–247–5510–6.
20. Patel AH, Harnois DM, Klee GG et al. The utility of CA 19–9 in the diagnoses of cholangiocarcinoma in patiens without primary sclerosing cholangitis. Am J Gastroenterol 2000; 95(1): 204–207.
21. Bonney GK, Craven RA, Prasad R et al. Circulating markers of biliary malignancy: opportunities in proteomics? Lancet Oncol 2008; 9(2): 149–158.
22. Hultcrantz R, Olsson R, Danielsson A et al. A 3-year prospective study on serum tumor markers used for detecting cholangiocarcinoma in patients with primary sclerosing cholangitis. J Hepatol 1999; 30(4): 669–673.
23. Charatcharoenwitthaya P, Enders FB, Halling KC et al. Utility of serum tumor markers, imaging, and biliary cytology for detecting cholangiocarcinoma in primary sclerosing cholangitis. Hepatology 2008; 48(4): 1106–1117.
24. Ghazale A, Chari ST, Zhang L et al. Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy. Gastroenterology 2008; 134(3): 706–715.
25. Kuszyk BS, Soyer P, Bluemke DA et al. Intrahepatic cholangiocarcinoma: the role of imaging in detection and staging. Crit Rev Diagn Imaging 1997; 38(1): 59–88.
26. Kluge R, Schmidt F, Caca K et al. Positron emission tomography with [(18)F]fluoro-2-deoxy-D-glucose for diagnosis and staging of bile duct cancer. Hepatology 2001; 33(5): 1029–1035.
27. Kim JY, Kim MH, Lee TY et al. Clinical role of 18F-FDG PET-CT in suspected and potentially operable cholangiocarcinoma: a prospective study compared with conventional imaging. Am J Gastroenterol 2008; 103(5): 1145–1151.
28. Maccioni F, Martinelli M, Al Ansari N et al. Magnetic resonance cholangiography: past, present and future: a review. Eur Rev Med Pharmacol Sci 2010; 14(8): 721–725.
29. Romagnuolo J, Bardou M, Rahme E et al. Magnetic resonance cholangiopancreatography: a meta-analysis of test performance in suspected biliary disease. Ann Intern Med 2003; 139(7): 547–557.
30. Corvera CU, Blumgart LH, Akhurst T et al. 18F-Fluorodeoxyglucose positron emission tomography influences management decisions in patients with biliary cancer. J Am Coll Surg 2008; 206(1): 57–65.
31. Furukawa H, Ikuma H, Asakura K et al. Prognostic importace of standardized uptake value on F-18 fluorodeoxyglucose-positron emission tomography in biliary tract carcinoma. J Surg Oncol 2009; 100(6): 494–499.
32. Weynand B, Deprez P. Endoscopic ultrasound guided fine needle aspiration in biliary and pancreatic diseases: pitfalls and performances. Acta Gastroenterol Belg 2004; 67(3): 294–300.
33. Chen YK, Parsi MA, Binmoeller KF et al. Single-operator cholangioscopy in patiens requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc 2011; 74(4): 805–814.
34. Sharma AK. Role of MRCP versus ERCP in bile duct cholangiocarcinoma and benign stricture. Biomed Imaging Interv J 2007; 3(1): e12-e545.
35. DeWitt J, Misra VL, Leblanc JK et al. EUS-guided FNA of proximal biliary strictures after negative ERCP brush cytology results. Gastrointest Endosc 2006; 64(3): 325–333.
36. Urban O, Arnelo U, Kliment M et al. Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti. Gastroent Hepatol 2013; 67(2): 124–126.
37. Bosman FT, Carneiro F, Hruban RH et al. WHO classification of tumours of the digestive system. 4th ed. IARC: Lyon 2010. ISBN 9789283224327.
38. Akiba J, Nakashima O, Hattori S et al. Clinicopathologic analysis of combined hepatocellular-cholangiocarcinoma according to the latest WHO classification. Am J Surg Pathol 2013; 37(4): 496–505.
39. Hytiroglou P, Theise ND. Differential diagnosis of hepatocellular nodular lesions. Semin Diagn Pathol 1998; 15(4): 285–299.
40. Gores GJ. Cholangiocarcinoma: current concepts and insights. Hepatology 2003; 37(5): 961–969.
41. Honsová E. Úloha patologa v diagnostice a léčbě onemocnění v hepatobiliární oblasti. Bulletin HPB 2004; 12(1–2): 1–2.
42. Honsová E. Histopatologická diagnóza hepatocelulárního karcinomu. Gastroent Hepatol 2012; 66(2): 93–98.
43. Levy MJ, Baron TH, Clayton AC et al. Prospective evaluation of advanced molecular markers and imaging techniques in patients with indeterminace bile duct strictures. Am J Gastroenterol 2008; 103(5): 1263–1273.
44. Gonda TA, Glick MP, Sethi A et al. Polysomy and p16 deletion by fluorescence in situ hybridization in the diagnosis of indeterminate biliary strictures. Gastrointest Endosc 2012; 75(1): 74–79.
45. Atlas of Genetics and Cytogenetics in Oncology and Haematology. Dostupné z WWW: http://atlasgeneticsoncology.org/.
46. Cheng L, Eble JN. Molecular surgical patology. Springer: New York 2013. ISBN 978–1461448990.
47. Rizvi S, Gores GJ. Molecular pathogenesis of cholangiocarcinoma. Dig Dis 2014; 32(5): 564–569.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Fekálna mikrobiálna terapiaČlánek Otrava olovem – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



