-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
Lead poisoning. A surprising cause of constipation, abdominal pain and anemia
This article reports on patient that has been presented with sudden onset of constipation, abdominal pain and normocytic anemia. Gastroscopy and colonoscopy ruled out an organic diseases. In peripheral blood and bone marrow aspirates mears, coarse basophilic stippling of erythrocyte (and erythroblasts) point out a possibility of heavy metal poisoning. The level of plumbemia exceeded 8.4 times the maximal permitted value for common (non-professional) population. A source of poisoning was indentified from a glaze on a ceramic jug, from which the patient had drank tea with lemon for three months. A lead concentration in the tea extract was 227 mg/kg. In developed countries, lead poisoning is a rare diagnosis. As the symptoms are nonspecific, missed diagnoses could occur, especially in sporadic, non-occupational exposure. However, a microscopic evaluation of the peripheral bloods mear with finding of predominantly coarse basophilic stippling of erythrocyte mayle ad to suspicion of lead poisoning.
Key words:
abdominal pain – basophilic stippling of erythrocyte – constipation – lead poisoning – normocytic anemia – plumbemia
Autoři: Iva Hoffmanová 1; Petra Kačírková 2; Irena Kučerová 3; Rudolf Ševčík 4; Daniel Sánchez 5
Působiště autorů: II. interní klinika 3. LF UK a FN Královské Vinohrady Praha 1; Ústav laboratorní diagnostiky 3. LF UK a FN Královské Vinohrady Praha 2; Ordinace praktického lékaře, Klinika pracovního a cestovního lékařství 3. LF UK a FN Královské Vinohrady Praha 3; Ústav konzervace potravin Fakulty potravinářské a biochemické technologie Vysoké školy chemicko-technologické Praha 4; Laboratoř buněčné a molekulární imunologie Mikrobiologického ústavu AV ČR, v. v. i., Praha 5
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 157-163
Kategorie: Kazuistiky
Souhrn
Článek popisuje případ pacienta s náhle vzniklou obstipací, bolestmi břicha a normocytární anémií. Endoskopické vyšetření horní a dolní části trávicího traktu vyloučilo organickou příčinu obtíží. Vyšetření nátěru krve a aspirátu kostní dřeně s nálezem hrubého bazofilního tečkování v erytrocytech a erytroblastech upozornilo na možnost otravy těžkými kovy. Hodnota plumbemie 8,4násobně překročila limit přípustný pro běžnou populaci. Jako zdroj intoxikace byla identifikována olovnatá glazura keramického džbánku, ze kterého pacient pil zhruba 3 měsíce čaj s citronem. Koncentrace olova v čajovém výluhu dosahovala hodnoty 227 mg/kg. Otrava olovem v souvislosti s neprofesionální expozicí tomuto kovu je ve vyspělých zemích výjimečnou situací provázenou nespecifickou symptomatologií, a tak může zůstat nerozpoznána. Mikroskopické vyšetření nátěru krve s nálezem převážně hrubého bazofilního tečkování erytrocytů však může na tuto vzácnou diagnózu upozornit.
Klíčová slova:
bazofilní tečkování erytrocytů – bolesti břicha – normocytární anémie – otrava olovem – plumbemie – zácpaKazuistika
61letý pacient, zaměstnáním elektrikář, v osobní anamnéze s hypertenzí léčenou 5 mg perindoprilu a s benigní hypertrofií prostaty léčenou 0,4 mg tamsulosinu, se zavedeným permanentním močovým katétrem před plánovanou transuretrální resekcí prostaty, byl vyšetřen na chirurgické ambulanci dne 20. 5. 2013 pro nově vzniklou, 5 dní trvající obstipaci bez zástavy odchodu plynů, pro intermitentní bolesti břicha kolem pupku a ojedinělé zvracení potravy bez patologické příměsi. Kvůli uvedeným obtížím nemocný v posledních dnech výrazně omezil příjem potravy i tekutin. Objektivní nález na břiše nesvědčil pro náhlou příhodu břišní, přítomno bylo pouze oblenění peristaltiky. Pacient byl hospitalizován na interní klinice. Celkově dominovaly známky dehydratace s hypotenzí (TK 80/60 mm Hg). Ostatní fyzikální vyšetření (včetně per rectum) byla v normě. Nativní RTG snímek břicha ukázal meteorizmus kliček tlustého střeva a distenzi colon transversum až na 64 mm (obr. 1). Sonografické vyšetření břicha popsalo výraznou pneumatózu tračníku s mírnou distenzí kliček tenkého střeva, nález na ostatních nitrobřišních orgánech byl v normě. Laboratorní vyšetření zachytilo mírnou normocytární normochromní anémii (hladina hemoglobinu 97 g/l, MCV 83,2 fl), normální sérovou hladinu železa (13,0 μmol/l), mírně zvýšenou hladinu feritinu (477 μg/l) a bilirubinu (28,8 μmol/l), zvýšenou hladinu urey (17,2 mmol/l) a kreatininu (172 μmol/l). Jaterní enzymy, iontogram, hladina transferinu, albuminu, kyseliny močové, glykemie a CRP, biochemické vyšetření moči a vyšetření močového sedimentu byly v normě. Pacient neměl v anamnéze ani při fyzikálním vyšetření žádné zjevné krvácivé projevy. Haemoccult byl negativní. Po infuzní léčbě došlo rychle k ústupu hypotenze a posléze i k normalizaci renálních funkcí. Následně bylo provedeno CT břicha a malé pánve s podáním perorálního i intravenózního kontrastu, které prokázalo distenzi tračníku od céka až po lienální flexuru; distenze v céku dosahovala 9 cm (obr. 2). Podání perorální kontrastní látky v rámci přípravy na CT vyšetření vedlo k vyprázdnění střevního obsahu a vymizení abdominální symptomatologie. Po 2 dnech hospitalizace byl pacient propuštěn do ambulantní péče. Následné kolonoskopické vyšetření ukázalo normální nález až do terminálního ilea; gastroskopické vyšetření zjistilo pouze refluxní ezofagitidu 2. stupně klasifikace Savary-Miller, která byla léčena inhibitory protonové pumpy. Anémie (opět bez jakýchkoliv hemoragických projevů) nadále progredovala až k hodnotě hemoglobinu 77 g/l, s mírnou relativní retikulocytózou (3,7 %) a pacient byl opět přijat dne 31. 5. 2013 na interní kliniku. Byly podány 4 erytrocytární resuspenze. Sternální punkce prokázala trilineární hematopoézu s výraznými abnormalitami erytropoézy s dominujícím hrubým bazofilním tečkováním erytroblastů a erytrocytů (obr. 3). Převážně hrubé bazofilní tečkování erytrocytů bylo detekováno i při současném mikroskopickém vyšetření nátěru krve (obr. 4). Nález vzbudil suspekci na intoxikaci olovem. Následně byla vyšetřena sérová hladina olova. Její hodnota (0,675 mg/l) 8,4násobně překročila přípustný limit pro běžnou populaci. Koncentrace olova v moči (1,22 mg/l) byla 6krát zvýšená, koncentrace kyseliny 5-aminolevulové v moči (26,48 mg/g kreatininu) byla téměř dvojnásobně zvýšená a koncentrace porfyrinů v moči (1,69 mg/g kreatininu) byla 8,5násobně zvýšená.
Obr. 1. Nativní RTG snímek břicha: výrazná distenze celého tračníku 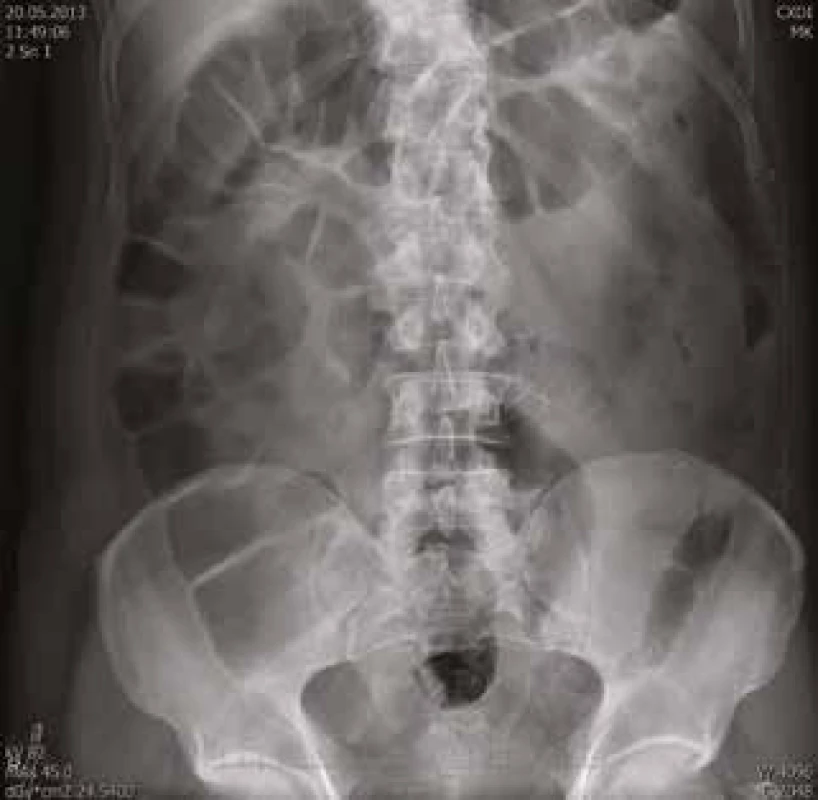
Obr. 2. CT břicha, koronární scan: výrazná distenze tračníku, v céku dosahuje až 9 cm 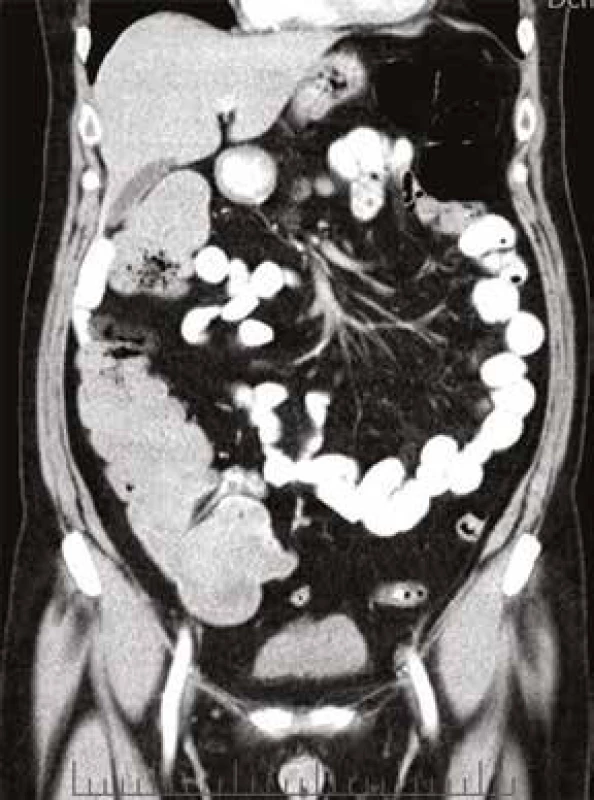
Obr. 3. Nátěr aspirátu kostní dřeně 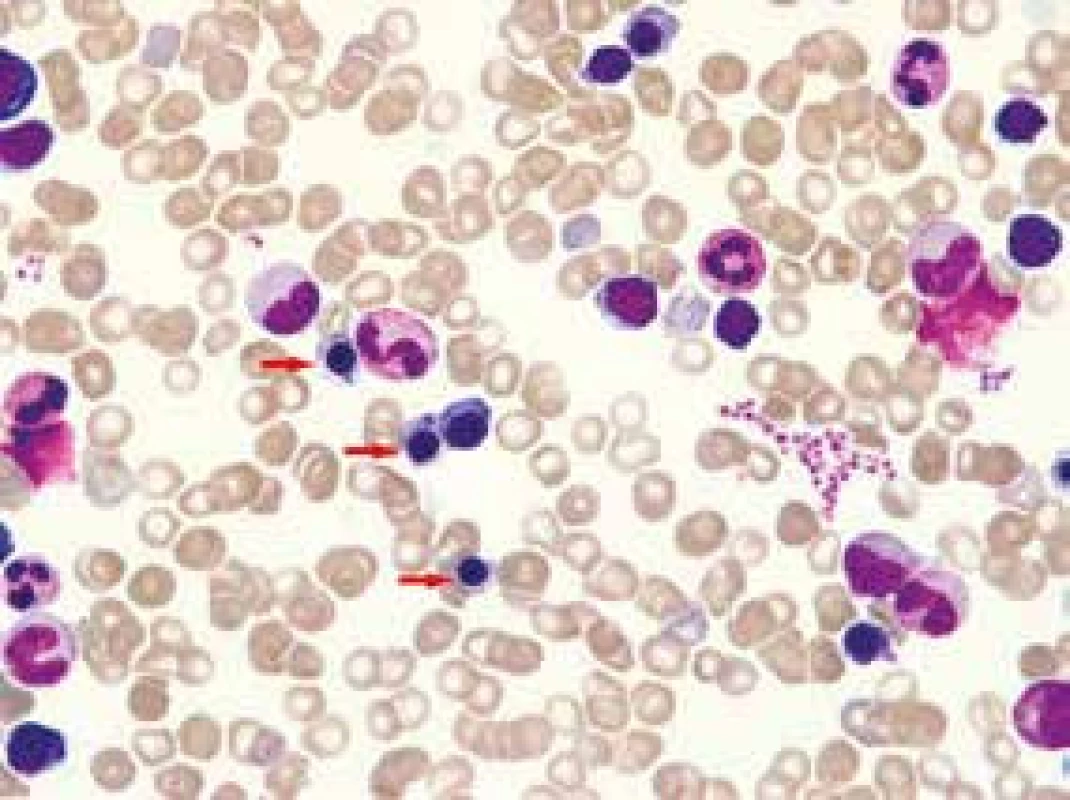
Změny erytropoézy: hrubé bazofilní tečkování a výpadky barvitelnosti cytoplazmy (porucha hemoglobinizace) erytroblastů (viz šipky), hrubé bazofilní tečkování erytrocytů. Barvení dle Maye-Grünwalda a Giemsy-Romanowského, původní zvětšení 1 000krát Obr. 4. Nátěr periferní krve 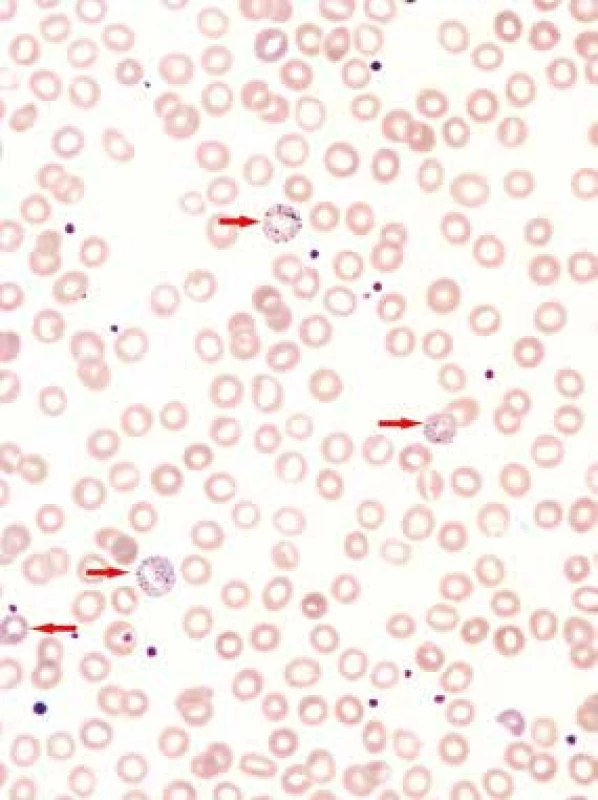
Nápadné hrubé bazofilní tečkováni erytrocytů (viz šipky), lehká anizocytóza a lehká hypochromie erytrocytů. Barvení dle Maye-Grünwalda a Giemsy-Romanowského, původní zvětšení 1 000krát Pacient pracoval jako elektrikář, nebyl tedy v riziku profesionální expozice olovu. Podrobným pátráním jsme zjistili, že zdrojem intoxikace byla olověná glazura kameninového džbánku. Džbánek byl zakoupen na tržišti a nebyl certifikován pro styk s potravinami dle vyhlášky č. 38/2001 Sb. [1] a ani nebyl k tomuto účelu určen. Do džbánku si pacient v posledních 3 měsících denně připravoval horký čaj s citronem, aby si zlepšil pitný režim. Čaj z tohoto džbánku pak popíjel vždy po celý den. Koncentrace olova v čajovém výluhu ze džbánku dosahovala hodnoty 227 mg/kg. Takto extrémně vysoká koncentrace je vysvětlitelná významným uvolňováním tohoto kovu z glazury při několikahodinové expozici kyselé (pH výluhu bylo 3,5) a zpočátku velmi horké tekutině (čaji). Vzhledem k tomu, že pacient bydlel v domě, kde je dosud olověná vodovodní přípojka, byla stanovena i koncentrace olova ve vodě z vodovodu. Zde byla koncentrace olova pouze 0,029 mg/kg vody, což je hodnota přibližně identická s nejvyšší přípustnou hodnotou koncentrace olova v pitné vodě [2].
Dne 26. 6. 2013 byla zahájena 5denní chelatační léčba 2,3-dimerkaptojantarovou kyselinou zvanou sukcimer (preparát Succicaptal) v dávce 600 mg perorálně 3krát denně po 8 hodinách. Každý den bylo stanoveno vylučování olova do moči, které dosáhlo maxima (1,95 mg/l) 2. den léčby. Po 5 dnech užívání sukcimeru klesla plumbemie na hodnotu 0,379 mg/l (tj. pod úrovní limitu pro profesionálně exponovanou populaci), vylučování olova do moči kleslo na 0,468 mg/l a léčba byla ukončena. Paralelně s tím poklesly i močové koncentrace 5-aminolevulové kyseliny (6,49 mg/g kreatininu) a porfyrinů (0,405 mg/g kreatininu). Pacient byl nadále ambulantně sledován. 14 dní po ukončení léčby sukcimerem byla znovu stanovena plumbemie; její hodnota 0,333 mg/l nebyla indikací k opakování chelatační léčby. Postupně došlo k normalizaci červeného krevního obrazu: v den ukončení léčby sukcimerem byla hladina hemoglobinu 92 g/l, za 14 dní 116 g/l, za další měsíc 130 g/l a stabilní hladina hemoglobinu setrvává dlouhodobě.
Diskuse
Olovo (latinsky plumbum, -i, n.) je těžký toxický kov modravě šedé barvy, který je znám lidstvu od starověku. Zmínky o něm nalezneme již ve Starém Zákoně [3]. Alchymisté olovo spojovali s planetou Saturn a nazývali Saturnův kov.
Olovo je dobře kujné i při pokojové teplotě a odolné vůči korozi. Olověné rudy (nejčastěji sulfid olovnatý – galenit) jsou v přírodě relativně dobře dostupné, často se nacházejí poblíž rud stříbrných. Pro své výhodné fyzikálně-chemické vlastnosti bylo olovo využíváno již ve starověku. Nejstarší dochovaný olověný předmět pochází z Malé Asie a datuje se do období 3 000–2 000 př. n. l. Ve starověkém Římě se z olova vyrábělo vodovodní potrubí a nádobí, octan olovnatý se používal jako sladidlo. Historici se domnívají, že nadměrné užívání olova bylo jedním z faktorů, které vedly k zániku Římské říše [4,5]. Olověné potrubí se k rozvodům pitné vody používalo ještě v období mezi 1. a 2. světovou válkou. Od počátku 20. století byl vnitřní průsvit olověného potrubí sířený nebo potažen ochrannou cínovou vrstvou k zamezení uvolňování olova do pitné vody. Některé olověné přípojky a domovní instalace zůstávají v provozu na mnoha místech Evropy, včetně České republiky, dodnes [6]. Dle vyhlášky č. 252/2004 Sb., novelizované v prosinci roku 2013 [2] je limit koncentrace olova v pitné vodě 10 µg/l, nejvyšší mezní hodnota je 26 μg/l. Další uplatnění našlo olovo ve středověku při výrobě vitráží, střešních krytin či k zalévání železných součásti do kamenných staveb. Olovnatá běloba (zásaditý uhličitan olovnatý) a žlutý chroman olovnatý jsou malířské pigmenty, které se ještě ve druhé polovině 20. století užívaly ve vnitřních i venkovních nátěrech. Tetraetylolovo se do konce 20. století přidávalo do benzínu jako antidetonační přísada. Slitiny olova s cínem a antimonem se užívaly k odlévání písmen v tiskárnách (liteřina) [4,5].
Olověné pájky jsou v současnosti užívány při opravách elektroniky. Olovem se pokrývá vnitřek ocelových nádob na uchovávání agresivních tekutin, např. kyseliny sírové, se kterou olovo nereaguje (olovo se naopak rozpouští v kyselině dusičné). Největším průmyslovým využitím olova je výroba elektrických akumulátorů. Olovo se dále používá k výrobě kluzných ložisek pro automobilový průmysl a nábojů do střelných zbraní [4,5]. Dokonce i olověné broky a olůvka sloužící k rybolovu přispívají ke kontaminaci životního prostředí. Z olovnatého skla, které je díky přidání sloučenin olova méně tvrdé a lesklejší, se vyrábějí broušené dekorativní předměty. Oxidy olova jsou součástí keramických glazur a emailů. V lékařství slouží olovo k odstínění RTG a γ záření [5].
Olovo patří mezi toxické prvky. V pevném skupenství málo toxické, toxičtější je v podobě prachu, nejtoxičtější jsou páry. Olovo a jeho organické sloučeniny se nejlépe vstřebávají cestou inhalační, avšak rozpouští se i v teplé kyselině chlorovodíkové, resp. v žaludeční šťávě [7].
V minulosti docházelo ke značné kontaminaci ovzduší, pitné vody, půdy i potravin a chronické otravy olovem bývaly časté. Zásadní poznatky o škodlivosti olova shromáždil pařížský lékař Louis Tanquerel des Planches, který roku 1839 popsal intoxikaci olovem u souboru 1 200 pacientů [5,8]. Avšak ještě v 1. polovině 20. století bylo olovo velmi běžně užívaným kovem.
Ve vyspělých zemích v 21. století již není populace ohrožena kontaminací životního prostředí olovem. Profesionální riziko se však vyskytuje v hutích barevných kovů (bronz, mosaz), při pájení, při výrobě akumulátorových autobaterií, olovnatého skla, nábojů či při glazování keramiky. V těchto provozech dochází k uvolňování olověného prachu či par taveného olova do vzduchu a platí zde přísná hygienická opatření (ventilace, omezení prašnosti, ochranné pomůcky, zákaz jídla a kouření, používání pracovních oděvů, důkladná osobní hygiena a biologické monitorování, kontroly koncentrace olova v pracovním ovzduší) [7–9].
Otrava olovem v souvislosti s neprofesionální expozicí je ve vyspělých zemích zcela výjimečná. Nicméně jsou popisovány intoxikace olovem po požití nápojů (zejména kyselých či horkých), které byly v delším kontaktu s olovnatými glazurami keramických nádob. Nebezpečné jsou zejména nedostatečně vypálené či porušené glazury. Vysoká kontaminace olovem a jinými těžkými kovy (arsen, kadmium, rtuť) byla nalezena v perorálně užívaných lidových léčivech či potravních doplňcích čínského, indického či jiného asijského, středně-východního a hispánského původu [5,9,10]. Byla popsána řada případů těžkých otrav olovem po užití těchto léčiv [11], včetně přípravků ajurvédské medicíny [12,13]. Možné jsou otravy i po požití olověných předmětů, např. diabolek, které setrvávají delší dobu v trávicím traktu [7,14].
Olovo se do organizmu dostává zejména inhalační a perorální cestou. Dermální absorpce je nevýznamná a týká se jen olova vázaného v organických sloučeninách (např. tetraetylolovo). Trávicím traktem se olovo vstřebává variabilně. Zejména u dětí je vstřebáváno 30–50 % perorálně přijatého olova, s věkem se schopnost absorpce trávicím traktem snižuje, dospělí absorbují jen přibližně 10 %. Absorpce olova je závislá na řadě faktorů, jakými jsou chemická forma olova, velikost jeho částic, doba průchodu trávicím traktem (transit time) a nutriční stav jedince. Malnutrice, deficit kalcia, železa, zinku, nízkokalorická, nízkobílkovinná a vysokotuková dieta vedou ke zvýšenému vstřebávání olova. Naopak mezi protektivní faktory patří dieta bohatá na fosfáty, riboflavin, vitamin C a E. Vstřebané olovo se distribuuje mezi 3 kompartmenty: krev, měkké tkáně (mozek, plíce, ledviny, játra, slezina, svaly, kůže a sliznice) a mineralizované tkáně (kosti a zuby) [5,9].
Z toxikologického hlediska je nejdůležitější krevní pool, v němž jsou vázána asi 2 % olova; z toho 99 % je deponováno v erytrocytech a jen v malé míře je olovo rozpuštěno v plazmě. Z krevního poolu se olovo rychle distribuuje do ostatních orgánů a naopak při detoxikační léčbě se z parenchymatózních orgánů rychle uvolňuje zpět do krve. Z krve se olovo eliminuje s poločasem 1 měsíce u dospělých a až 10 měsíců u dětí [5,8]. Nejvíce olova (u dospělých až 90 %, u dětí přibližně 75 %) se z krve distribuuje do kostí, zejména do těch kostních regionů, ve kterých v době expozice olovem probíhá aktivní kalcifikace. U dětí je procentuálně více olova ukládáno do měkkých tkání včetně mozku. Z trabekulární kosti se olovo eliminuje s poločasem 90 dnů, zatímco z kosti kortikální s poločasem 10–30 let. Při fyziologickém stresu, v těhotenství, laktaci, menopauze, při chronickém onemocnění, hypertyreóze, horečce, frakturách, deficitu kalcia a v pokročilém věku se olovo z kostí mobilizuje a uvolňuje do krve [5]. Olovo se vylučuje převážně močí, v menší míře žlučí a následně stolicí.
V organizmu olovo vykazuje vysokou afinitu k sulfhydrylové (SH) skupině a interferuje s aktivitou některých enzymových systémů. Další toxický efekt spočívá v inhibici řady buněčných funkcí dependentních na kalciu: Pb2+ se váže ke kalciem aktivovaným proteinům s vyšší afinitou než Ca2+, a tak oba ionty kompetují na příslušných vazebných místech. Olovo ovlivňuje funkci buněčných membrán a transportních či energetických systémů [5]; redukuje rovněž schopnost reparace DNA po expozici ionizujícímu záření, i když chromozomální aberace u dělníků exponovaných olovu zvýšeny nebyly [15,16]. Klinicky nejvýznamnější je inhibice enzymů zúčastněných v syntéze hemu: zejména dehydratázy 5-aminolevulové kyseliny (jež katalyzuje přeměnu 2 molekul 5-aminolevulové kyseliny na molekulu porfobilinogenu) a ferochelatázy (jež zajišťuje inkorporaci železa do protoporfyrinu za vzniku hemu) [17,18], schéma. V důsledku této enzymové inhibice se hromadí 5-aminolevulová kyselina a porfyriny (zejména uroporfyrinogen III a koproporfyrinogen III). Stanovení koncentrace těchto metabolitů v moči se využívá společně s koncentrací olova v moči a v plné krvi k diagnostice otravy olovem [7]. Porucha syntézy hemu vede k rozvoji anémie z inefektivní erytropoézy, v menší míře se na anémii podílí i zkrácené přežívání erytrocytů s mírnou hemolýzou (spojenou se zvýšením hladiny nekonjugovaného bilirubinu) [7,11].
Schéma. Olovo a syntéza hemu: inhibice aktivity dehydratázy 5-aminolevulové kyseliny a ferochelatázy 
Upraveno podle [18] Otrava olovem, plumbizmus, je definována jako sérová koncentrace > 0,1 mg/l [9].
Akutní intoxikace olovem je vzácná, dříve vznikala po požití rozpustných sloučenin olova (např. octanu olovnatého užívaného k obkladům). Klinicky se projevuje příznaky z podráždění gastrointestinálního traktu: zvracení, kolikovité bolesti břicha, průjem [7].
Chronická otrava se vyvíjí většinou při profesionální expozici a souvisí s postupnou kumulací olova v organizmu. Opakovaný příjem velmi malých množství olova a dlouhý eliminační poločas vytvářejí podmínky pro kumulaci. Kromě kolikovitých bolestí břicha (tzv. saturninské koliky, způsobené pravděpodobně zvýšenou sérovou hladinou porfyrinogenů a špatně reagující na spazmolytika), zácpy a anémie se popisuje i šedavě popelavé zbarvení kůže, šedý lem na dásních (způsobený ukládáním sulfidu olovnatého při nedostatečné ústní hygieně), kovová pachuť v ústech, nechutenství. Anémie je typicky normocytární či mikrocytární, normochromní či hypochromií, někdy s mírnou retikulocytózou, a s normální či zvýšenou sérovou hladinou železa. Charakteristické bazofilní tečkování erytrocytů a erytroblastů, u otravy olovem zpravidla hrubé, vzniká agregací ribozomů díky poškození degradace RNA v důsledku olovem způsobeného deficitu pyrimidin 5´-nukleotidázy [5,7]. Železo nevyužité pro tvorbu hemu se může kumulovat v erytrocytech, v nichž spolu s fragmenty mitochondrií vytváří mikroskopicky detekovatelná Pappenheimerova tělíska. Vzácně vzniká i tubulointersticiální nefritida z poškození proximálních tubulů s aminoacidurií, fosfaturií a glykosurií (Fanconiho syndrom), která bývá spojena s dnou (saturninská dna) a hypertenzí. Může se objevit hepatopatie, periferní motorická neuropatie (zejména v inervační oblasti nejvíce namáhaných svalů končetin, případně neuropatie n. radialis) či encefalopatie s poruchami paměti, soustředění, zmateností a insomnií. Chronická otrava olovem vede k poruše reprodukčních funkcí, u těhotných žen dochází k potratům či předčasným porodům. Olovo prochází placentou a vylučuje se do mateřského mléka. Extrémně vysoké sérové hladiny olova způsobují dysrupci endoteliálních buněk hematoencefalické bariéry, což vede k rozvoji hemoragické encefalopatie, projevující se křečemi a poruchou vědomí. Ve vážných případech může dojít k úmrtí [5,7].
Profesionální otravy a znečištění životního prostředí olovem jsou problémem v méně rozvinutých zemích [9]. V rozvojových zemích je např. dosud používán olovnatý benzín [19]. Chronickou intoxikací v souvislosti s environmentální kontaminací jsou ohroženy zejména děti. Kromě zvýšeného vstřebávání z trávicího traktu je u dětí i více olova ukládáno do orgánů, zejména mozku, kostí, ledvin [20]. Děti jsou citlivější vůči neurotoxickému poškození. Neurokognitivní deficity navozené olovem jsou ireverzibilní. Dokonce mírně zvýšené sérové koncentrace olova mohou vést k permanentnímu poškození vyvíjejícího se dětského mozku, vzhledem k nezralé a zvýšeně propustné hematoencefalické bariéře [20–22].
Klinickým problémem spojeným s intoxikací olovem je, že se na ni nepomýšlí.
Klíčovým vyšetřením pro diagnostiku otravy olovem je stanovení hladiny olova v plné krvi (tj. včetně erytrocytů). Výše plumbemie koreluje s klinickými příznaky otravy [7]. U profesionálně exponovaných osob je přípustný limit plumbemie do 0,4 mg/l, tj. 2 μmol/l [23]; u běžné populace jsou referenční hodnoty následující: u mužů < 0,08 mg/l, u žen < 0,065 mg/l a u dětí < 0,055 mg/l [24].
Mezi další biochemická vyšetření, která lze (ale pro diagnostiku není nutno použít) patří:
- stanovení koncentrace 5-aminolevulové kyseliny v moči; pro profesionálně exponované osoby se za limitní považují hodnoty 15 mg/g kreatininu, tj. 13 μmol/mmol kreatininu [23]
- semikvantitativní stanovení koncentrace porfyrinův moči; pro profesionálně exponované osoby se za limitní považují hodnoty 0,2 mg/g kreatininu, tj. 0,035 μmol/mmol kreatininu [23]; u obecné populace by limity uvedené pro profesionálně exponované osoby neměly být překročeny, resp. by hodnoty měly být jistě nižší
- stanovení koncentrace olova v moči (referenční hodnota < 0,2 mg/l)
Porucha syntézy hemu provázející otravu olovem může být rovněž potvrzena zvýšením sérové hladiny Zn-protoporfyrinu; v důsledku inhibice ferochelatázy se na protoporfyrin místo železa váže zinek. Hladina Zn-protoporfyrinu je úměrná depu olova v organizmu. Laboratorně lze rovněž prokázat snížení aktivity dehydratázy 5-aminolevulové kyseliny. Sledování koncentrace olova v moči má význam při léčbě a slouží k odhadu depa olova v organizmu. Vylučování více než 2 mg olova/24 hodin svědčí o významném množství olova v organizmu [7].
Léčba otravy olovem spočívá v odstranění expozice a v podání chelatačních látek, které tvoří s olovem ve vodě rozpustný komplex, jež se z organizmu vyloučí močí. Druh chelatační léčby se řídí věkem pacienta, symptomatologií a zejména výší plumbemie [9]. Během léčby se sleduje plumbemie a odpady olova do moči [7,9].
Typickým parenterálním lékem je sodno-vápenatá sůl kyseliny etylendiaminotetraoctové (CaNa2EDTA) v přípravku Chelintox. Mezi nežádoucí účinky patří nefrotoxicita, deplece kalia, zinku a mědi. Současná adekvátní hydratace redukuje riziko nefrotoxicity [9]. Právě pro nefrotoxicitu a depleci elementárních prvků se však Chelintox do České republiky nedováží.
Preferuje se perorální podávání 2,3-dimerkaptojantarové kyseliny (DMSA, dimercaptosuccinic acid), zvané sukcimer (preparát Succicaptal cps) [7–9]. Dávka se volí individuálně a v léčbě se pokračuje, dokud přetrvává vylučování olova do moči v množství větším než 2 mg/den [7]. Nejčastější léčebné schéma spočívá ve 2 cyklech trvajících 19 dní. Prvních 5 dní se podává 10 mg/kg 3krát denně, dalších 14 dní 2krát denně. Cyklus se opakuje po 2týdenní přestávce znovu. K nežádoucím účinkům patří přechodná elevace transamináz, neutropenie, abdominální křeče či mukokutánní reakce (ty jsou nutností k přerušení léčby). Deplece zinku a mědi je mírnější než v případě užití CaNa2EDTA [9].
V případě vzniku nežádoucích účinků výše zmíněné chelatační léčby lze užít D-penicilamin v dávce 250 mg perorálně 4krát denně. Je rovněž užíván u mírných otrav olovem u dětí v dávce 15 mg/kg denně. Délka léčby trvá 4–12 týdnů.
Vhodnou součástí léčby je odstranění nutričních deficitů, vysokobílkovinná strava, dostatek vápníku, železa, zinku, riboflavinu, vitaminu C a E [9].
Závěr
Chronická otrava olovem je přetrvávajícím problémem, zejména u dětí, v méně rozvinutých zemích v souvislosti s kontaminací životního prostředí. Ve vyspělých zemích je environmentální intoxikace nepravděpodobná, rovněž tak řada preventivních a kontrolních opatření minimalizuje riziko intoxikace v souvislosti s profesionální expozicí.
Avšak intoxikace náhodné, jak demonstruje uvedená kazuistika, se mohou vzácně vyskytnout a být zdrojem diagnostických obtíží. V rámci diferenciální diagnostiky anémie nejasného původu je vhodné požadovat mikroskopické vyšetření nátěru periferní krve cílené na detekci bazofilního tečkování erytrocytů, neboť automatické analyzátory krevního obrazu nejsou schopny zachytit změny erytrocytů, které by mohly na otravu olovem upozornit.
Doručeno do redakce 21. 9. 2015
Přijato po recenzi 6. 11. 2015
MUDr. Iva Hoffmanová, Ph.D.
iva.hoffmanova@fnkv.cz
II. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
www.fnkv.cz
Zdroje
1. Vyhláška č. 38/2001 Sb. Vyhláška Ministerstva zdravotnictví o hygienických požadavcích na výrobky určené pro styk s potravinami a pokrmy. Dostupné z WWW: http://www.tzb-info.cz/pravni-predpisy/vyhlaska-c-38–2001-sb-o-hygienickych-pozadavcich-na-vyrobky-urcene-pro-styk-s-potravinami-a-pokrmy.
2. Vyhláška č. 252/2004 Sb., kterou se stanoví hygienické požadavky na pitnou a teplou vodu a četnost a rozsah kontroly pitné vody. Novelizace 12/2013. Dostupné z WWW: http://www.tzb-info.cz/pravni-predpisy/vyhlaska-c-252–2004-sb-kterou-se-stanovi-hygienicke-pozadavky-na-pitnou-a-teplou-vodu-a-cetnost-a-rozsah-kontroly-pitne-vody.
3. Bible21. Dostupné z WWW: http://bible.kazani.cz/?q=olovo.
4. Bencko V, Cikrt M, Lener J. Toxické kovy v životním a pracovním prostředí člověka. Grada: Praha 1995. ISBN 80–7169–150-X.
5. Holstege CP. Pathophysiology and Etiology of Lead Toxicity. Dostupné z WWW: http://emedicine.medscape.com/article/2060369-overview#a1.
6. Kožíšek F, Nešpůrková L, Weyessa GD et al. Olovo a pitná voda: situace v České republice. Dostupné z WWW: http://meteau.cz/doc/vh1_2008.pdf.
7. Pelclová D et al. Nemoci z povolání a intoxikace. 3.vyd. Karolinum: Praha 2014. ISBN 978–80–246–2597–3.
8. Pelclová D. Patří otravy olovem minulosti? Lékařské listy 2001; 30 (Příloha). Dostupné z WWW: http://zdravi.e15.cz/clanek/priloha-lekarske-listy/patri-otravy-olovem-minulosti-137595.
9. Kianoush S, Sadeghi M, Balali-Mood M. Recent Advances in the Clinical Management of Lead Poisoning. Acta Med Iran 2015; 53(6): 327–336.
10. Ko RJ. Adulterants in Asian patent medicines. N Engl J Med 1998; 339(12): 847.
11. Lv C, Xu Y, Wang J et al. Dysplastic changes in erythroid precursors as a manifestation of lead poisoning: report of a case and review of literature. Int J Clin Exp Pathol 2015; 8(1): 818–823.
12. Meiman J, Thiboldeaux R, Anderson H. Lead Poisoning and Anemia Associated with Use of Ayurvedic Medications Purchased on the Internet – Wisconsin, 2015. MMWR Morb Mortal Wkly Rep 2015; 64(32): 883.
13. Orchard GR, Hielscher KA, Wilke AD et al. Lead poisoning in Australia associated with privately imported Ayurvedic complementary medicine. Anaesth Intensive Care 2015; 43(5): 669–670.
14. Vlček K, Šenholdová Z, Pelclová D et al. Těžká otrava olovem po požití broků. Čas Lék Česk 2005; 144(4): 282–284.
15. Karakaya AE, Ozcagli E, Ertas N et al. Assessment of abnormal DNA repair responses and genotoxic effects in lead exposed workers. Am J Ind Med 2005; 47(4): 358–363.
16. Pelclová D, Pícková J, Patzelová V. Chromosomal aberrations, hormone levels and oxidative phenotype (P450 2D6) in low occupational lead exposure. CEJOEM 1997; 3(4): 314–322.
17. Kumar V, Abbas AK, Aster JC. Robbins&Cotran Pathologic Basis of Disease. 8th ed. Elsevier 2009. ISBN 978–1416031215.
18. Silbernagl S, Despopoulos A. Atlas fyziologie člověka. 6. ed. Grada: Praha 2004. ISBN 978–80–247–0630–6.
19. Bravo AH, Sanchez AP, Sosa ER et al. The potential impact of gasoline additives on air quality in developing countries. Clean Technol Environ Policy 2006; 8(3): 174–181.
20. Woolf AD, Goldman R, Bellinger DC. Update on the clinical management of child hood lead poisoning. Pediatr Clin North Am 2007; 54(2): 271–294 VIII.
21. Chandran L, Cataldo R. Lead poisoning: basics and new developments. Pediatr Rev 2010; 31(10): 399–405.
22. Warniment C, Tsang K, Galazka SS. Lead poisoning in children. American Fam Physician 2010; 81(6): 751–757.
23. Vyhláška 432/2003 Sb. Vyhláška, kterou se stanoví podmínky pro zařazování prací do kategorií, limitní hodnoty ukazatelů biologických expozičních testů, podmínky odběru biologického materiálu pro provádění biologických expozičních testů a náležitosti hlášení prací s azbestem a biologickými činiteli. Dostupné z WWW: https://www.zakonyprolidi.cz/cs/2003–432.
24. Černá M, Krsková A, Cejchanová M et al. Human biomonitoring in the Czech Republic: a noverview. Int J Hyg Environ Health 2012; 215(2): 109–119.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Fekálna mikrobiálna terapiaČlánek Otrava olovem – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



