-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Použití systémových glukokortikoidů v terapii infekčních nemocí
Use of systemic glucocorticoids in therapy of infectious diseases
Glucocorticoids have been known and used in clinical practice for many years now, still their position in the treatment of infectious diseases is continuously developing. Still there are only few review papers focusing on their use in this area. This article summarizes the present knowledge of possible use of glucocorticoids in therapy of infectious diseases. Despite the known contraindication of these agents in the case of acute infections, there have been areas identified where the results of clinical assessments indicate possible benefit. Given the complexity of the problems and sometimes controversial conclusions, each administration of glucocorticoids to a patient with an infectious disease should be preceded by a careful consideration and assessment of an individual benefit and possible risks following from the treatment.
Key words:
glucocorticoids – infectious diseases
Autoři: Lucie Hromádková 1,2
Působiště autorů: Oddělení klinické farmacie, Nemocnice Na Homolce, Praha 1; Oddělení klinické farmacie Lékárny Masarykovy nemocnice Ústí nad Labem 2
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 134-138
Kategorie: Přehledné referáty
Souhrn
Glukokortikoidy jsou známé a v klinické praxi používané již řadu let, přesto se jejich postavení v léčbě infekčních nemocí neustále vyvíjí. Přehledových prací, které by se tématu jejich využití v této oblasti věnovaly, je však velice málo. Předkládaná práce shrnuje dosavadní poznatky o možném využití glukokortikoidů v terapii infekčních nemocí. Přes známou kontraindikaci těchto látek u akutních infekcí byly nalezeny oblasti, v nichž výsledky klinických hodnocení naznačují možný prospěch. Vzhledem ke složitosti problematiky a někdy kontroverzním závěrům by však každému podání glukokortikoidů pacientovi s infekční nemocí mělo předcházet pečlivé zvážení a posouzení individuálního prospěchu a případných rizik plynoucích z léčby.
Klíčová slova:
glukokortikoidy – infekční nemociÚvod
Imunosupresivní a protizánětlivé vlastnosti glukokortikoidů (GK) jsou využívány terapeuticky při léčbě mnoha nemocí. Toto působení GK však stojí i za rozvojem typického nežádoucího účinku, kterým je snížená rezistence vůči bakteriálním, virovým a mykotickým infekcím a vyšší frekvence výskytu těchto infekcí při GK léčbě [1,2]. Suprese imunitního systému umožňuje snazší rozvoj infekce a díky snížené zánětlivé odezvě mohou být v úvodu maskovány její příznaky, což může vést k oddálení diagnostiky a ve výsledku i k horšímu průběhu infekčního onemocnění. Riziko tohoto nežádoucího jevu stoupá s dávkou a délkou terapie GK, obvykle se jako hraniční udává denní dávka 10 mg a kumulativní dávka 700 mg prednisonu či jeho ekvivalentu [1]. Základní charakteristiky systémových GK aktuálně dostupných na českém trhu shrnuje tab. 1.
Tab. 1. Základní charakteristika systémových glukokortikoidů 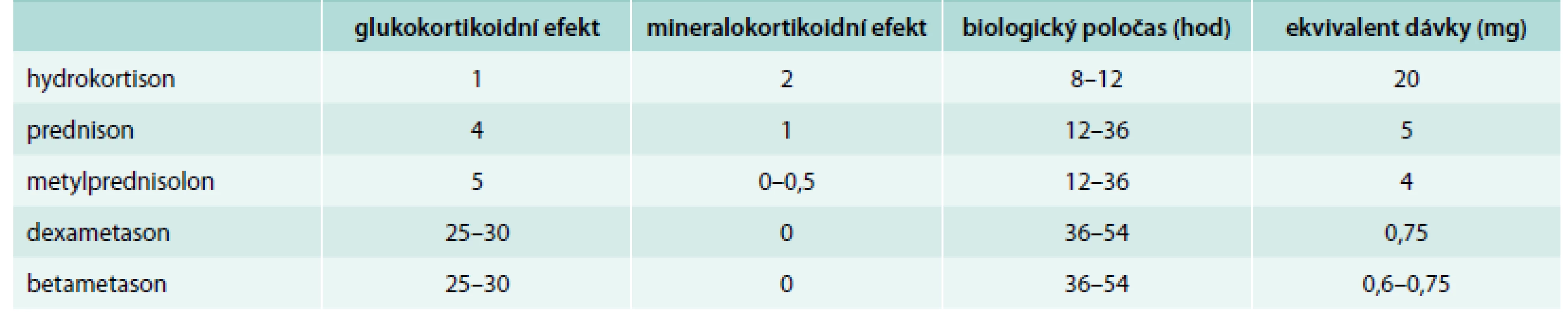
Z výše uvedeného vyplývá logická kontraindikace GK při akutních infekčních nemocích. V praxi se však v některých případech s podáním GK u infekčních nemocí setkáváme a jejich podávání může být ve vybraných případech smysluplné. Předpoklad pozitivního působení GK spočívá ve snížení destrukce tkání způsobené imunitní reakcí, dále ve snížení odpovědi organizmu na destrukci mikroorganizmů protiinfekční látkou (např. prevence a léčba Jarischovy-Herxheimerovy reakce) a v neposlední řadě v kompenzaci adrenální insuficience způsobené kritickým stavem provázejícím infekční nemoc. GK mohou být dále efektivní v ovlivnění doprovodných symptomů infekčních nemocí, jako jsou otok, fibrotizace tkání a zánětlivé změny (např. u laryngotracheitidy, parotitické orchitidy, zduření lymfatických tkání, serózních meningitid a meningoencefalitid, varicelové pneumonie, oční formy toxoplazmózy a toxokarózy).
Přehledných prací, které by se tématu využití GK u infekčních nemocí podrobněji věnovaly, je velmi málo. Přesto je tato problematika trvale aktuální a je řešena v každodenní praxi. Z tohoto důvodu je předkládán následující text, který vychází z principů medicíny založené na důkazech a jehož cílem je přehledně a stručně shrnout současný stav poznání v oblasti využití GK u infekčních nemocí se zaměřením na stavy a nemoci, se kterými se můžeme v českých poměrech setkat a u kterých byl efekt GK studován.
Septický šok
Role GK v terapii septického šoku vyplývá z předpokladu relativní adrenální insuficience při akutní stresové reakci. Dvě metaanalýzy [3,4] neshledaly při krátkodobém podání vysokých dávek pozitivní efekt a používání GK nedoporučily. U populace pacientů se závažnou sepsí byl naopak pozorován profit terapie hydrokortisonem v dávce 200–300 mg za den při léčbě delší než 5 dnů. Systematická rešerše prací [5] celkový benefit GK léčby u septického šoku nepotvrdila, při podrobnější analýze však bylo pozorováno snížení 28denní mortality a snížení rekurence šoku u subpopulace léčené dávkami 200–300 mg hydrokortisonu denně. V dalším multicentrickém dvojitě zaslepeném randomizovaném kontrolovaném hodnocení [6] byl sice pozorován rychlejší ústup šoku, rozdíl v mortalitě ale zaznamenán nebyl a ve větvi léčené GK bylo navíc pozorováno více epizod superinfekcí. V roce 2012 byla vydána aktualizovaná mezinárodní doporučení pro léčbu septického šoku [7], která zahrnula i doporučení pro používání GK. Na základě těchto doporučení by GK neměly být podávány v případě léčby sepse bez přítomnosti šoku. Neměly by být podány ani v případě, v němž je možné hemodynamickou stabilitu adekvátně obnovit jinými metodami (tekutinovou resuscitací, vazopresory). V případě, že nelze preferovanými postupy adekvátní odpovědi dosáhnout, lze přistoupit k podávání intravenózního hydrokortisonu v dávce 200 mg/den do obnovení hemodynamické stability.
Komunitní pneumonie
Podávání GK jako podpůrné terapie komunitní pneumonie je již dlouhá léta spornou oblastí. Zlepšení přežití po podání GK bylo pozorováno v jednom menším randomizovaném kontrolovaném hodnocení [8] a v jedné retrospektivní práci [9] u pacientů s těžkou komunitní pneumonií. Stejně tak některá další hodnocení shledala pozitivní vliv GK u pacientů s těžkou komunitní pneumonií (zkrácení doby hospitalizace a nutnosti mechanické ventilace) [10–12]. Protichůdné výsledky však přinesla některá další hodnocení. V jednom větším randomizovaném kontrolovaném hodnocení [13] bylo sledováno 213 pacientů, pozitivní efekt GK však u nich nebyl patrný, naopak bylo zaznamenáno vyšší riziko rekurence známek pneumonie. Oproti předchozím hodnocením byl v tomto případě zahrnut nižší počet pacientů s těžkou formou nemoci. Pozitivní efekt GK nebyl shledán ani v dalším hodnocení zahrnujícím pacienty s mírnou formou nemoci [14]. V roce 2014 shrnula výsledky metaanalýza 4 hodnocení (264 pacientů) provedených u pacientů s těžkou komunitní pneumonií [15]. V závěru této metaanalýzy byla konstatována nízká kvalita evidence a poukázáno na nemožnost vytvořit adekvátní doporučení pro používání GK v praxi. Diskuse nad používáním byla otevřena opět na jaře roku 2015, kdy bylo v časopise JAMA uveřejněno španělské multicentrické dvojitě zaslepené randomizované klinické hodnocení [16]. Zařazeni byli pacienti s těžkou komunitní pneumonií se současně přítomnou těžkou zánětlivou odezvou (CRP > 150 mg/l při přijetí). Pacienti byli randomizováni k podání intravenózního bolusu metylprednisolonu v dávce 0,5 mg/kg každých 12 hod (n = 61) a k podání placeba (n = 59). Délka léčby trvala v obou případech 5 dní s počátkem během prvních 36 hodin po přijetí. Ve skupině léčené GK bylo pozorováno méně časté selhání léčby, rozdíl v mortalitě během hospitalizace nalezen nebyl. Nová zjištění se opět přiklonila k použití GK jako adjuvantní terapie u těžké komunitní pneumonie s vysokou zánětlivou odezvou. Před vytvořením definitivních doporučení je však vzhledem k předchozím kontroverzním závěrům vhodné vyčkat na potvrzující výsledky.
Bakteriální meningitida
Použití GK v léčbě bakteriální meningitidy bylo dlouhou dobu kontroverzní a podložené spíše menšími klinickými hodnoceními u dětských pacientů. Nový pohled přineslo uveřejnění randomizovaného kontrolovaného hodnocení s 301 pacienty [17], po kterém následovala další [18,19]. V roce 2013 pak byly dosavadní výsledky 25 prací (4 121 pacientů) shrnuty v metaanalýze [20]. U pacientů léčených GK bylo prokázáno signifikantní snížení ztráty sluchu (zvláště u meningitidy způsobené Haemophilus influenzae) a krátkodobých neurologických následků, ovlivnění dlouhodobých neurologických následků však nebylo pozorováno. U meningitidy způsobené Streptococcus pneumoniae bylo navíc prokázáno snížení mortality (u Neisseria meningitidis a Haemophilus influenzae nebyl výsledek signifikantní). Z nežádoucích účinků byl patrný častější výskyt návratné horečky, ostatní nežádoucí účinky nebyly zvýšeny. Autoři metaanalýzy doporučují GK jako adjuvantní léčbu bakteriální meningitidy, přičemž jejich nejvyšší efekt se předpokládá při zahájení před nebo s první dávkou antibiotika. Nejčastěji byla použita 4denní intravenózní léčba dexametasonem v dávce 10 mg po 6 hodinách.
Tuberkulóza
Plicní tuberkulóza
Možnosti uplatnění GK v léčbě plicní tuberkulózy byly rozsáhle studovány v 2. polovině minulého století. V roce 2002 byla publikována rešerše 11 hodnocení [21], která v různé míře prokázala signifikantní snížení doby hospitalizace, redukci zánětlivých markerů, horečky a kašle a rychlejší odeznění RTG nálezu. GK neovlivnily mortalitu, počet selhání léčby, mikrobiologický nález, plicní funkce s odstupem 2 a 3 let ani nežádoucí účinky antituberkulotik. Vzhledem k heterogenitě zařazených hodnocení však nebylo možné jejich výsledky jednotně statisticky shrnout. Nutno také podotknout, že do rešerše byly zahrnuty především starší práce, z nichž pouze 2 použily režim s rifampicinem. Právě v jednom z nich (s 530 pacienty) [22] nebyl shledán žádný efekt GK, proto otázka jejich podávání v léčbě plicní formy tuberkulózy zůstává spíše kontroverzní. Po publikování rešerše se již další nová hodnocení na toto téma téměř neobjevila. V případě HIV pozitivních pacientů byl shledán nepříznivý poměr rizika a prospěchu z léčby GK (vzestup CD4 a zvýšení HIV RNA) [23] a v této skupině pacientů by GK pro léčbu plicní formy tuberkulózy neměly být používány.
Tuberkulózní meningitida
Předpoklad působení GK v léčbě tuberkulózní meningitidy spočívá ve snížení nepřiměřené zánětlivé reakce. Přestože rešerše 6 prací [24] s celkovým počtem 595 převážně dětských pacientů nepřinesla žádný jasný závěr ani doporučení, výzkum v této oblasti neustal. Klinické hodnocení provedené u 545 dospělých pacientů [25] a následně i metaanalýza s celkovým počtem 1 140 HIV negativních pacientů [26] prokázaly pozitivní efekt GK, včetně snížení mortality a neurologických komplikací. Nežádoucí účinky léčby GK byly většinou mírné a nejčastěji zahrnovaly hyperglykemii, gastrointestinální krvácení a sekundární bakteriální a mykotické infekce. V případě tuberkulózní meningitidy se tak, na rozdíl od plicní formy, staly GK doporučenou adjuvantní léčbou HIV negativních pacientů. Dávkovací schéma vychází z publikovaných prací, v nichž byl ve většině případů podáván dexametason v dávce 0,3–0,4 mg/kg/den s postupným snižováním po dobu 8 týdnů (první 4 týdny v intravenózní formě) [27,28]. U HIV pozitivních pacientů je použití GK zatím nejasné.
Tuberkulózní perikarditida
Používání GK v léčbě tuberkulózní perikarditidy rovněž zaznamenalo významné změny. Doporučení z roku 2003 podporovala podávání GK při léčbě tuberkulózní perikarditidy u všech pacientů [29], a to i přesto, že bylo téma považováno spíše za kontroverzní z důvodu nedostatečné statistické významnosti dosažených výsledků. Do doporučení se promítaly především výsledky metaanalýzy 4 prací (469 pacientů, jedna práce s HIV pozitivními pacienty), která zjistila trend (statisticky nevýznamný) k nižší celkové mortalitě u pacientů léčených GK [30]. Podobný trend byl pozorován i u HIV pozitivních pacientů [31]. V případě perikarditidy s rozsáhlým perikardiálním výpotkem bylo v různé míře pozorováno urychlení redukce výpotku a návratu k běžné fyzické aktivitě, ovlivnění hepatomegalie, snížení počtu případů s perikarditidou asociované smrti a zmenšení potřeby sekundární perikardiocentézy a drenáže v odstupu 10 let [31–33]. U konstriktivní perikarditidy pak bylo pozorováno zlepšení tolerance zátěže, snížení tachykardie a retence tekutin [32]. Klinický benefit se však zdál být nižší než v případě perikarditidy s výpotkem. K současnému odklonu od rutinního používání GK v léčbě tuberkulózní perikarditidy přispěla především práce publikovaná v roce 2014 [34]. GK by měly být v současné době zvažovány především u pacientů ve vysokém riziku zánětlivých komplikací a s přetrvávajícím vysokým rizikem progrese do konstriktivní formy nemoci (rozsáhlý výpotek, velké množství zánětlivých buněk v perikardiální tekutině, časné známky konstrikce). Léčba užívaná v klinických hodnoceních trvala většinou 11 týdnů a byl při ní použit prednison ve snižující se dávce s 60 mg v úvodu.
Septická artritida
V případě septické artritidy se předpokládá především symptomatický účinek GK na snížení destrukce kloubu zánětem. V dvojitě zaslepeném, placebem kontrolovaném klinickém hodnocení u dětských pacientů (3 měsíce-13 let) bylo po 4denní intravenózní léčbě GK prokázáno zkrácení doby trvání horečky a délky antibiotické léčby a dále snížení bolestivosti a reziduální dysfunkce kloubu po 12 měsících [35]. Zkrácení délky hospitalizace a antibiotické léčby pak bylo potvrzeno i pozdějším dvojitě zaslepeným randomizovaným kontrolovaným hodnocením u dětí [36]. Nežádoucí účinky GK nebyly sledovány. I přes pozitivní výsledky léčby GK ve výše uvedených hodnoceních není rutinní podávání GK u dětí doporučeno. V případě očekávaného přínosu lze zvážit 4denní léčbu dexametasonem v dávce 0,15–0,2 mg/kg se zahájením s počátkem antibiotické terapie [37]. U dospělé populace data o prospěšnosti GK chybí.
Herpes zoster
Přínos léčby GK byl hodnocen i v případě infekce herpes zoster. Pět randomizovaných kontrolovaných hodnocení, která zahrnula celkem 780 pacientů s akutním bolestivým onemocněním, však nepřineslo jasné výsledky. Tři práce (88 % pacientů) prokázaly symptomatické působení GK [38–40]. Po léčbě GK došlo k redukci bolesti, ke zlepšení spánku, k urychlení hojení lézí a návratu k běžným aktivitám a ke snížení spotřeby analgetik. Nejvyšší efekt byl přitom pozorován během prvních dnů léčby a u pacientů s výraznou bolestí. Druhá 2 hodnocení zahrnula pacienty až po delším trvání nemoci (po 5 dnech) a jejich výsledky byly negativní [41,42]. Ani v jedné práci GK nesnížily incidenci postherpetické neuralgie. Dle současných poznatků je tak možné zvážit adjuvantní terapii GK pouze v případě očekávaného přínosu pro pacienta a výrazné bolesti nereagující na léčbu opioidními analgetiky. Léčba použitá v klinických hodnoceních začínala počáteční dávkou 40–60 mg prednisonu za den s postupným snižováním po dobu 21 dní.
Infekční mononukleóza
Symptomatický efekt GK (snížení bolesti v krku, nevolnosti, lymfadenopatie, zlepšení koncentrace) byl pozorován u infekční mononukleózy v metaanalýze 7 klinických hodnocení (362 pacientů). Nebyl však prokázán vliv na zkrácení doby trvání nemoci a výskyt relapsů nemoci a pozdních komplikací během jednoho roku [43]. V současné době GK nejsou doporučeny pro rutinní léčbu infekční mononukleózy, mohou však být užitečné při řešení vážných komplikací, jako jsou respirační potíže či těžký faryngeální otok [44].
Pneumocystová pneumonie
Předpoklad pozitivního působení GK u pneumocystové pneumonie spočívá ve snížení časného zhoršení plicních funkcí po nasazení antibiotik. U HIV pozitivních pacientů bylo prokázáno zlepšení klinických výsledků (snížení horečky, tachypnoe a dyspnoe) a snížení mortality [45], zatímco u HIV negativních pacientů nebyly výsledky přesvědčivé [46,47]. Vzhledem k vysoké mortalitě provázející pneumocystovou pneumonii však bylo konsenzuálně doporučeno zvážit vhodnost GK i u vysoce rizikových HIV negativních pacientů (s vědomím absence důkazů o jednoznačné prospěšnosti). U HIV pozitivních pacientů se doporučuje 3týdenní léčba prednisonem (či jeho ekvivalentu) s počáteční dávkou 80 mg (5 dní) s postupným snižováním (40 mg 5 dní, 20 mg 11 dní). Zahájení terapie by mělo být časné, nejlépe do 72 hod od počátku příznaků [48]. Léčba je doporučena především pacientům se středně závažným až závažným onemocněním [pO2 < 9,3 kPa, P(A-a)O2 > 4,7 kPa], u nichž byly výsledky nejpřesvědčivější.
Závěr
Téma podání GK u infekčních nemocí je v odborné společnosti stále velmi kontroverzní a názory na tuto problematiku se vyvíjejí a mění v průběhu času. Předkládaná práce shrnuje dosavadní poznatky medicíny založené na důkazech o použití GK v terapii infekčních nemocí. Přes známé imunosupresivní účinky GK je patrné, že kontraindikace u akutních infekčních nemocí nemusí být absolutní a že existují případy, v nichž pacienti z podání GK u těchto nemocí profitují. Předkládaná problematika však stále skýtá mnohé limity, kterými jsou především nedostatek dat, nízké počty pacientů v provedených klinických hodnoceních a mnohdy kontroverzní výsledky. Text se zaměřuje na oblasti, v nichž výsledky prací naznačují možný prospěch GK, ač se v praxi tyto látky empiricky využívají i v ovlivnění některých dalších infekčních nemocí. Přesto u většiny infekcí zůstávají GK stále kontraindikovány a vzhledem k výše uvedeným limitům by každému podání GK pacientovi s infekční nemocí mělo předcházet pečlivé zvážení a posouzení individuálního prospěchu a případných rizik této léčby.
Doručeno do redakce 20. 7. 2015
Přijato po recenzi 25. 10. 2015
PharmDr. Lucie Hromádková, Ph.D.
lucie.hromadkova@gmail.com
Oddělení klinické farmacie Nemocnice Na Homolce, Praha
www.homolka.cz
Oddělení klinické farmacie Lékárny Masarykovy nemocnice Ústí nad Labem
www.kzcr.eu
Zdroje
1. Stuck AE, Minder CE, Fre FJ. Risk of infectious complications in patients taking glucocorticosteroids. Rev Infect Dis 1989; 11(6): 954–963.
2. Cutolo M, Seriolo B, Pizzorni C et al. Use of glucocorticoids and risk of infections. Autoimmun Rev 2008; 8(2): 153–155.
3. Cronin L, Cook DJ, Carlet J et al. Corticosteroid treatment for sepsis: A critical appraisal and meta-analysis of the literature. Crit Care Med 1995; 23(8): 1430–1439.
4. Lefering R, Neugebauer E. Steroid controversy in sepsis and septic shock: a meta-analysis. Crit Care Med 1995; 23(7): 1294–1303.
5. Annane D, Bellissant E, Bollaert PE et al. Corticosteroids for treating severe sepsis and septic shock. Cochrane Database System Rev 2004; (1): CD002243.
6. Mason PE, Al-Khafaji A, Milbrandt EB et al. CORTICUS: The end of unconditional love for steroid use? Crit Care 2009; 13(4): 309.
7. Dellinger RP, Levy MM, Rhodes A et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 2013; 41(2): 580–637.
8. Canfalonieri M, Urbino R, Potena A et al. Hydrocortisone infusione for severe community acquired pneumonia. A preliminary randomized study. Am J Respir Crit Care Med 2005; 171(3): 242–248.
9. Garcia-Vidal C, Calbo E, Pascual V et al. Effects of systemic steroids in patients with severe community-acquired pneumonia. Eur Respir J 2007; 30(5): 951–956.
10. Marik P, Kraus P, Sribante J et al. Hydrocortisone and tumor necrosis factor in severe community-acquired pneumonia: a randomized controlled study. Chest 1993; 104(2): 389–392.
11. Sabry NA, El-Din Omar E. Corticosteroids and ICU-course of community acquired pneumonia in Egyptian settings. Pharmacol Pharm 2011; 2(2): 73–81.
12. Meijvis S, Hardeman H, Remmelts HHF et al. Dexamethasone and length of hospital stay in patients with community-acquired pneumonia: a randomised, double-blind, placebo-controlled trial. Lancet 2011; 377(9782): 2023–2030.
13. Snijders D, Daniels JMA, de Graaff CS et al. Efficacy of corticosteroids in community-acquired pneumonia. Am J Respir Crit Care Med 2010; 181(9): 975–982.
14. McHardy VU, Schonell ME. Ampicillin dosage and use of prednisolone in treatment of pneumonia: co-operative controlled trial. Brit Med J 1972; 4(5840): 569–573.
15. Gorman SK, Slavik RS, Marin J. Corticosteroid treatment of severe community-acquired pneumonia. Ann Pharmacother 2007; 41(7): 1233–1237.
16. Torres A, Sibila O, Ferrer M et al. Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 2015; 313(7): 677–686.
17. de Gans J, van de Beek D. European dexamethasone in adulthood bacterial meningitis study investigators. Dexamethasone in adults with bacterial meningitis. N Engl J Med 2002; 347(20): 1549–1556.
18. Scarborough M, Gordon SB, Whitty CJM et al. Corticosteroids for bacterial meningitis in adults in sub-Saharan Africa. N Engl J Med 2007; 357(24): 2441–2450.
19. Nguyen TH, Tran TH, Twaites G et al. Dexamethasone in Vietnamese adolescents and adults with bacterial meningitis. N Engl J Med 2007; 357(24): 2431–2440.
20. Brouwer MC, McIntyre P, Prasad K et al. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev 2013; 6: CD004405.
21. Smego RA, Ahmed N. A systematic review of the adjunctive use of systemic corticosteroids for pulmonary tuberculosis. Int J Tuber Lung Dis 2002; 7(3): 208–213.
22. Tuberculosis Research Centre. Study of chemotherapy regimens of 5 and 7 months’ duration and the role of corticosteroids in the treatment of sputum-positive patients with pulmonary tuberculosis in South India. Tubercle 1983; 64(2): 73–91.
23. Mayanja-Kizza H, Jones-Lopez E, Okwera A et al. Immunoadjuvant prednisolone therapy for HIV-associated tuberculosis: a phase 2 clinical trial in Uganda. J Infect Dis 2005; 15; 191(6): 856–865.
24. Prasad K, Volmink J, Menon GR. Steroids for treating tuberculous meningitis. Cochrane Database System Rev 2000; (3): CD002244.
25. Thwaites GE, Nguyen DB, Nguyen HD et al. Dexamethasone for the treatment of tuberculous meningitis in adolescents and adults. N Engl J Med 2004; 351(17): 1741–1751.
26. Prasad K, Singh MB. Corticosteroids for managing tuberculous meningitis. Cochrane Database Syst Rev 2008; (1): CD002244.
27. Thwaites G, Fisher M, Hemingway C et al. British Infection Society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children. J Infect 2009; 59(3): 167–187.
28. Marx GE, Chan ED. Tuberculous meningitis: diagnosis and treatment overview. Tuberc Res Treat 2011; 2011 : 798764. Dostupné z DOI: http://dx.doi.org/10.1155/2011/798764.
29. American Thoracic Society; CDC; Infectious Diseases Society of America. Treatment of tuberculosis. MMWR Recomm Rep 2003; 52 (RR-11): 1–77. Erratum in MMWR Recomm Rep 2005; 53(51): 1203.
30. Mayosi BM, Ntsekhe M, Volmink JA et al. Interventions for treating tuberculous pericarditis. Cochrane Database System Rev 2002; (4): CD000526.
31. Hakim JG, Ternouth I, Mushangi E et al. Double-blind randomised placebo-controlled trial of adjuvant prednisolone in the treatment of effusive tuberculous pericarditis in HIV seropositive patients. Heart 2000; 84(2): 183–188.
32. Strang JIG, Kakaza HHS, Gibson DG et al. Controlled clinical trial of complete open surgical drainage and of prednisolone in treatment of tuberculous pericardial effusion in Transkei. Lancet 1988; 2(8614): 759–764.
33. Strang JI, Nunn AJ, Johnson DA et al. Management of tuberculous constrictive pericarditis and tuberculous pericardial effusion in Transkei: results at 10 years follow-up. QJM 2004; 97(8): 525–535.
34. Mayosi BM, Ntsekhe M, Bosch J et al. Prednisolone and Mycobacterium indicus pranii in tuberculous pericarditis. N Engl J Med 2014; 371(12): 1121–1130.
35. Odio CM, Ramirez T, Arias G et al. Double blind, randomized, placebo-controlled study of dexamethasone therapy for hematogenous septic arthritis in children. Pediatr Infect Dis J 2003; 22(10): 883–888.
36. Harel L, Prais D, Bar-On E et al. Dexamethasone therapy for septic arthritis in children: results of a randomized double-blind placebo-controlled study. J Pediatr Orthop 2011; 31(2): 211–215.
37. Aberdein J, Singer M. Clinical review: A systematic review of corticosteroid use in infections. Critical Care 2006; 10(1): 203.
38. Wood MJ, Johnson RW et al. A randomized trial of acyclovir for 7 days or 21 days with and without prednisolone for treatment of acute herpes zoster. N Engl J Med 1994; 330(13): 896–900.
39. Whitley RJ, Weiss H, Gnann JW et al. Acyclovir with and without prednisone for the treatment of herpes zoster: a randomized, placebo-controlled trial. Ann Intern Med 1996; 125(5): 376–383.
40. Esmann V, Kroon S, Peterslund NA et al. Prednisolone does not prevent post-herpetic neuralgia. Lancet 198; 2(8551): 126–129.
41. Clemmensen OJ, Andersen KE. ACTH versus prednisone and placebo in herpes zoster treatment. Clin Exp Dermatol 1984; 9(6): 557–563.
42. Eaglstein WH, Katz R, Brown JA. The effects of early corticosteroid therapy on the skin eruption and pain of herpes zoster. JAMA 1970; 211(10): 1681–1683.
43. Candy B, Hotopf M. Steroids for symptom control in infectious mononucleosis. Cochrane Database Syst Rev 2006; 19(3): CD004402.
44. Luzuriaga K, Sullivan JL. Infectious mononucleosis. N Engl J Med 2010; 362(21): 1993–2000.
45. Briel M, Bucher HC, Boscacci R et al. Adjunctive corticosteroids for Pneumocystis jiroveci pneumonia in patients with HIV-infection. Cochrane Database Syst Rev 2006; 19(3): CD006150.
46. Pareja JG, Garland R, Koziel H. Use of adjunctive corticosteroids in severe adult non-HIV Pneumocystis carinii pneumonia. Chest 1998; 113(5): 1215–1224.
47. Delclaux C, Zahar JR, Amraoui G et al. Corticosteroids as adjunctive therapy for severe Pneumocystis carinii pneumonia in non-human immunodeficiency virus-infected patients: retrospective study of 31 patients. Clin Infect Dis 1999; 29(3): 670.
48. Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: Recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. [2.4.2015]. Dostupné z WWW: http://aidsinfo.nih.gov/contentfiles/lvguidelines/adult_oi.pdf.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Fekálna mikrobiálna terapiaČlánek Otrava olovem – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



