-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
The patient complains of spinal pain or fatigue and weakness. How do I recognize whether their cause is spondylarthrosis, the patient’s age or multiple myeloma?
Multiple myeloma has varied manifestations which resemble common patient complaints and that is why this disease is typically not diagnosed until it reaches an advanced stage. Spinal pains can be an expression of deformative and discogenous changes, but also a symptom of multiple myeloma. Pains in the long bones may result from the pain radiating from an arthrotic joint, but also from a large myelomatic osteolytic lesion which makes the bone prone to a spontaneous fracture. Pathological weariness may have many causes, multiple myeloma being one of them. Anemia may have a large number of causes and multiple myeloma is one of them. Raised creatinine levels and renal failure can also be due to many causes and again, multiple myeloma is one of them. Weakened immunity and frequent infections can also have many causes, among them multiple myeloma. Confusion and sleepiness may be due to psychiatric diagnosis, but also may result from hypercalcemia associated with multiple myeloma. The following text which is designed for non-hematology physicians therefore describes in detail the symptoms of multiple myeloma and diagnostic steps leading to establishing the diagnosis and it only briefly outlines the treatment related information. You can also visit www.myeloma.cz for details. This text aims to summarize the symptoms of multiple myeloma for physicians not specializing in hematology in order to facilitate earlier diagnosing of the disease.
Key words:
monoclonal gammapathy of undetermined significance – multiple myeloma – osteolysis – renal failure
Autoři: Zdeněk Adam 1; Eva Pourová 2; Luděk Pour 1; Eva Michalková 1; Marta Krejčí 1; Renata Koukalová 3; Zdeněk Řehák 3; Jiří Vaníček 4; Tomáš Nebeský 5; Hana Petrášová 5; Sabina Ševčíková 6; Michal Mašek 7; Zdeněk Král 1; Aleš Čermák 8
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Ordinace praktického lékaře pro dospělé Pustiměř 2; Oddělení nukleární medicíny, centrum PET, RECAMO, Masarykův onkologický ústav Brno 3; Klinika zobrazovacích metod LF MU a FN u sv. Anny Brno 4; Radiologická klinika LF MU a FN Brno 5; Katedra patologické fyziologie LF MU Brno 6; Klinika úrazové chirurgie LF MU a FN Brno 7; Urologická klinika LF MU a FN Brno 8
Vyšlo v časopise: Vnitř Lék 2016; 62(2): 114-124
Kategorie: Přehledné referáty
Souhrn
Mnohočetný myelom má velmi pestré projevy, které se často podobají běžným steskům nemocných, a proto obvykle je tato nemoc rozpoznávaná až ve formě pokročilé. Bolesti v páteři mohou být projevem deformativních a diskogenních změn, ale také projevem mnohočetného myelomu. Bolesti v dlouhých kostech mohou být důsledkem iradiace bolesti z artrotického kloubu, ale také velkého myelomového osteolytického ložiska, ohrožující kost spontánní frakturou. Patologická únava může mít mnoho příčin a mnohočetný myelom je jednou z nich. Anémie může mít také velké množství příčin a mnohočetný myelom je jednou z nich. Stoupající hodnoty kreatininu a renální selhání může mít také mnoho příčin a opět mnohočetný myelom je jednou z nich. Zhoršení imunity a vznik častých infekcí může být vlivem mnoha příčin, jednou z nich je mnohočetný myelom. Zmatenost, spavost může být projevem psychiatrické diagnózy, ale také projevem hyperkalcemie při mnohočetném myelomu. Proto v následujícím textu, který je určen pro lékaře nehematology, jsou podrobně rozebírány příznaky mnohočetného myelomu a diagnostické kroky vedoucí ke stanovení diagnózy a jen ve stručné podobě podány obrysové informace o léčbě. Podrobnosti lze nalézt také na www.myeloma.cz. Cílem textu je připomenout nehematologům projevy mnohočetného myelomu a posunout rozpoznávání této nemoci do časnějších forem.
Klíčová slova:
mnohočetný myelom – monoklonální gamapatie nejistého významu – osteolýza – renální selháníÚvod – charakteristika nemoci a její definice
Mnohočetný myelom je onemocnění vyznačující se klonální proliferací patologických plazmocytů v kostní dřeni, které se nazývají myelomové buňky. Tyto buňky utlačují fyziologickou krvetvorbu v kostní dřeni a často způsobují destrukci kosti. Způsobují tak anémii, případně trombocytopenii, a v 80 % osteolytické změny skeletu. Myelomové buňky tvoří obvykle kompletní molekulu monoklonálního imunoglobulinu a lehké řetězce κ nebo λ, v některých případech tvoří pouze volné lehké řetězce. Výjimečné jsou nesekreční formy mnohočetného myelomu, u nichž dochází ve dřeni k infiltraci myelomovými buňkami, ale v séru není prokazatelný žádný monoklonální imunoglobulin.
Mnohočetný myelom tvoří asi 10 % všech hematologických malignit, jeho incidence se pohybuje mezi 3–4/100 000. Medián věku při stanovení diagnózy je kolem 66 let a pouze 2 % osob jsou v době stanovení diagnózy mladší 40 let. Čím vyšší věková kategorie, tím je vyšší výskyt této nemoci. Nemoci obvykle předchází monoklonální gamapatie nejistého významu (MGUS), z níž se v průběhu let mnohočetný myelom může vyvinout. To je důvodem, proč nabízíme sledování všem osobám s přítomností monoklonálního imunoglobulinu nesplňujícím ještě diagnózu mnohočetného myelomu. Cílem tohoto sledování je však podchytit transformaci do mnohočetného myelomu, ale také odhalit případné jiné nemoci, neboť incidence maligních chorob je u pacientů s MGUS vyšší než v průměrné populaci.
Mnohočetný myelom lze úspěšně léčit i ve vyšším věku, protože je poměrně dobře citlivý na léčbu. Podmínkou úspěšné léčby je dobrá schopnost spolupráce nemocného a dále včasné stanovení diagnózy, a to dříve, než nemoc výrazně poškodí nemocného. Dříve, než poškodí jeho hybnost, a tím i schopnost absolvovat léčbu. Zásadní pro prognózu nemocného je, zda jeho lékař alespoň vysloví podezření na tuto nemoc včas a pošle nemocného k cílenému vyšetření, nebo zda jeho lékař promešká („prošvihne“) možnost časného stanovení diagnózy. V praxi pořád vidíme, že nemocní přicházejí obvykle s nemocí již velmi pokročilou, často se závažným poškozením skeletu. A proto se obracíme na lékařskou veřejnost s tímto textem, jehož cílem je upozornit na mnohočetný myelom. Proto také se soustředíme na příznaky nemoci a na stanovení diagnózy a o léčbě budeme referovat stručněji.
Chtěli bychom zdůraznit, že v populaci starší 50 let nejde o nemoc až tak vzácnou. Incidence nemoci je sice 3–4/100 000 všech obyvatel, ale vyskytuje se dominantně ve věku nad 50 let, takže v populaci osob starších 50 let je její incidence podstatně vyšší než 3–4/100 000, podobně jako je podstatně vyšší incidence MGUS u osob nad 50 let oproti mladší populaci.
Příznaky mnohočetného myelomu
Klasickou trojici příznaků tvoří patologická únava, bolesti páteře a dlouhých kostí a opakované infekce. Nejčastějším příznakem nemoci jsou bolesti v zádech, případně v jiných částech skeletu. U 70 % nemocných je v době stanovení diagnózy přítomna anémie (která může být příčinou chronické patologické únavy a nevýkonnosti), asi u 20 % je zvýšená koncentrace kreatininu a u 10–20 % chorých je v době stanovení diagnózy přítomna i hyperkalcemie.
Mnohočetný myelom se může hlásit i dalšími pestrými příznaky (schéma 1). Protože pozdní rozpoznání nemoci zhoršuje kvalitu života nemocného i jeho prognózu, probereme v dalším textu podrobně diferenciální diagnostiku příznaků, které mimo jiné mohou signalizovat přítomnost mnohočetného myelomu [1–4].
Schéma 1. Příznaky mnohočetného myelomu 
Bolesti zad nebo dlouhých kostí a diferenciální diagnostika bolesti páteře
Prvním signálem přítomnosti této nemoci mohou být postupně se zhoršující bolesti v zádech či v dlouhých kostech. Bolesti v páteři má občas každý člověk starší 30 let. Je těžké tedy rozpoznat, zda bolesti jsou způsobeny nemaligními příčinami, nebo mnohočetným myelomem anebo metastázami do skeletu zatím nerozpoznaného primárního tumoru.
Běžné bolesti v páteři se často do měsíce zmírní nebo vymizí. Pokud se bolest do měsíce nezmírní či dokonce se postupně zintenzivňuje, je to jednoznačnou indikací k laboratornímu a zobrazovacímu vyšetření. Doporučený diferenciálně diagnostický postup při bolesti v páteři uvádí schéma 2. Jsou-li na RTG obrazu známky kompresivní zlomeniny obratle a není známý úrazový děj, je nezbytné určit etiologii této fraktury dalšími vyšetřovacími metodami. Je nutné odlišit, zda se jedná o patologickou frakturu při senilní osteoporóze, nebo při osteoporóze způsobené mnohočetným myelomem nebo metastázami zatím nepoznaného tumoru.
Schéma 2. Diferenciální diagnostika bolesti v lumbosakrální oblasti či v jiném úseku páteře Jsme si vědomi, že do žádného schématu nelze vtěsnat všechny případy ze života. Uvedeným schématem chceme pouze zdůraznit, že by bolesti páteře nikdy neměly být léčeny déle než 1 měsíc bez základního vyšetření, které v přehledu uvádíme, a že i jedna odchylka od normy v základních vyšetřeních musí být indikací k dalšímu podrobnějšímu vyšetřování. 
Pokud dojde k extramedulárnímu šíření myelomových hmot mimo kost do spinálního kanálu, nebo k dislokaci obratlů, objevují se neurologické funkční poruchy horních, případně dolních končetin nebo příznaky cauda equina, tj. porucha inervace svěračů, retence moči, sedlovitá porucha senzitivity, je nutné okamžité CT nebo MR zobrazení a pokud lze, odstranění komprese do 24 hodin od prvních známek komprese nervových struktur, tedy dokud je naděje na reverzibilitu nervového poškození. Viděli jsme i postižení ischiadického nervu již v průběhu malou pánví, u něhož bylo MR vyšetření bederní páteře normální a až CT pánve prokázalo mimokostní propagaci myelomu a kompresi n. ischiadici. Postižení skeletu mnohočetným myelomem demonstrují obr. 1 a obr. 2, jejichž cílem je ukázat, jak se zobrazí změny ve skeletu a v kostní dřeni při RTG vyšetření, při vyšetření MR a klasickým CT zobrazením, a dále jaké upřesnění informace přináší PET-CT, při němž low dose CT informuje o struktuře hydroxyapatitové struktury kosti a PET informuje o biologické aktivitě infiltrátu.

<b>CT vyšetření:</b> osteolytická ložiska sterna s okrajovou uzurací kortikalis Obr. 1. Současné CT a MR vyšetření hrudníku u pacienta s bolestmi hrudního koše a monoklonální gamapatií. Standardní RTG zobrazení skeletu u tohoto pacienta neprokazovalo vůbec žádné známky mnohočetného myelomu, zatímco na MR a CT je již zřetelný obraz pokročilé nemoci, vyžadující léčbu. Tyto snímky ilustrují, že v případně bolesti páteře a kostí u člověka s monoklonální gamapatií je nutno při negativním nálezu na klasickém RTG provést další doplňující vyšetření. 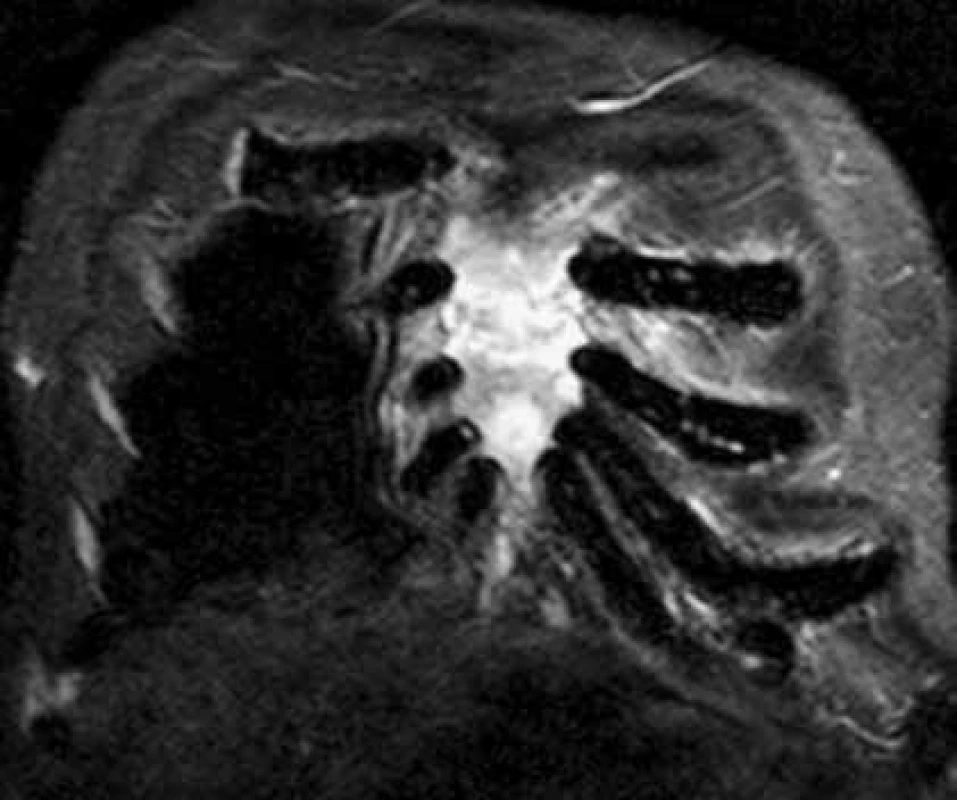
MR vyšetření: patrna nádorová aktivita a infiltrace celého sterna Obr. 2. PET CT zobrazí postižení skeletu MIP obraz (maximum intensity projections) biodistribuce FDG ve snímané oblasti, mimo fyziologickou aktivitu (v mozkové kůře, patrových tonzilách, ledvinách a močovém měchýři) se zobrazují četná hypermetabolická ložiska ve skeletu od kalvy až po pánevní kosti. 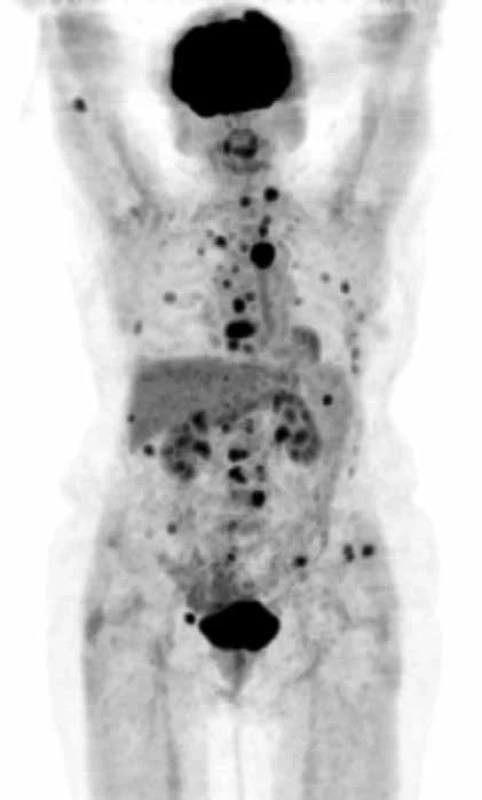
Nejčastější chybou vedoucí k pozdnímu rozpoznání nemoci je neprovedení základních vyšetření uvedených ve výše uvedeném schématu či neodeslání nemocných s bolestmi v páteři a s odchylkami v základních laboratorních parametrech na pracoviště, na němž mohou provést podrobnější zobrazení metodou MR nebo CT a další vyšetření [5–7].
Renální selhání s retencí dusíkatých látek nebo nefrotický syndrom a další formy poškození organizmu monoklonálním imunoglobulinem
Kompletní molekula fyziologického imunoglobulinu a stejně tak monoklonálního imunoglobulinu neprochází neporušenou glomerulární membránou, zatímco lehké řetězce i při jejich fyziologických nízkých koncentracích volně procházejí intaktní glomerulární membránou a jsou v proximálních tubulech vstřebávány. Poté, co se lehké řetězce dostanou z tubulů do nitra buňky, jsou intracelulárně hydrolyzovány na aminokyseliny, a ty se zpět dostávají do oběhu.
V případě mnohočetného myelomu, u něhož je v séru kompletní molekula monoklonálního imunoglobulinu i zvýšená koncentrace lehkých řetězců κ či λ, či jsou přítomny pouze lehké řetězce κ nebo λ, přechází přes glomerulární membránu do proximálních tubulů zvýšené množství volných lehkých řetězců, dostávající se do dalších částí nefronu a objevují se v moči. V distálním tubulu, v němž se moč koncentruje, dochází k jejich precipitaci spolu s Tammovým-Horsfalovým proteinem a vznikají tak odlitkové válce, které závažně poškozují funkci nefronu a způsobí renální selhání s retencí dusíkatých látek (obr. 3).
Obr. 3. Tubuly poškozují agregáty monoklonálních lehkých řetězců, glomerulární membránu poškozují amyloidová či neamyloidová depozita Volné lehké řetězce jsou fyziologicky filtrovány v glomerulech a vstřebávány v proximálním tubulu. Při vysoké koncentraci volných lehkých řetězců imunoglobulinů v plazmě procházejí volné lehké řetězce do distálních částí nefronu, v němž dochází ke koncentraci moči, k precipitaci těchto lehkých řetězců a ke tvorbě odlitkových válců. To závažně poškodí funkci ledvin. V močovém sedimentu pak lze nalézt zvýšené množství hyalinních válců a zvýšený odpad bílkoviny za 24 hodin. Elektroforézou lze v moči prokázat lehké řetězce jako tzv. Bence Jonesovu bílkovinu. 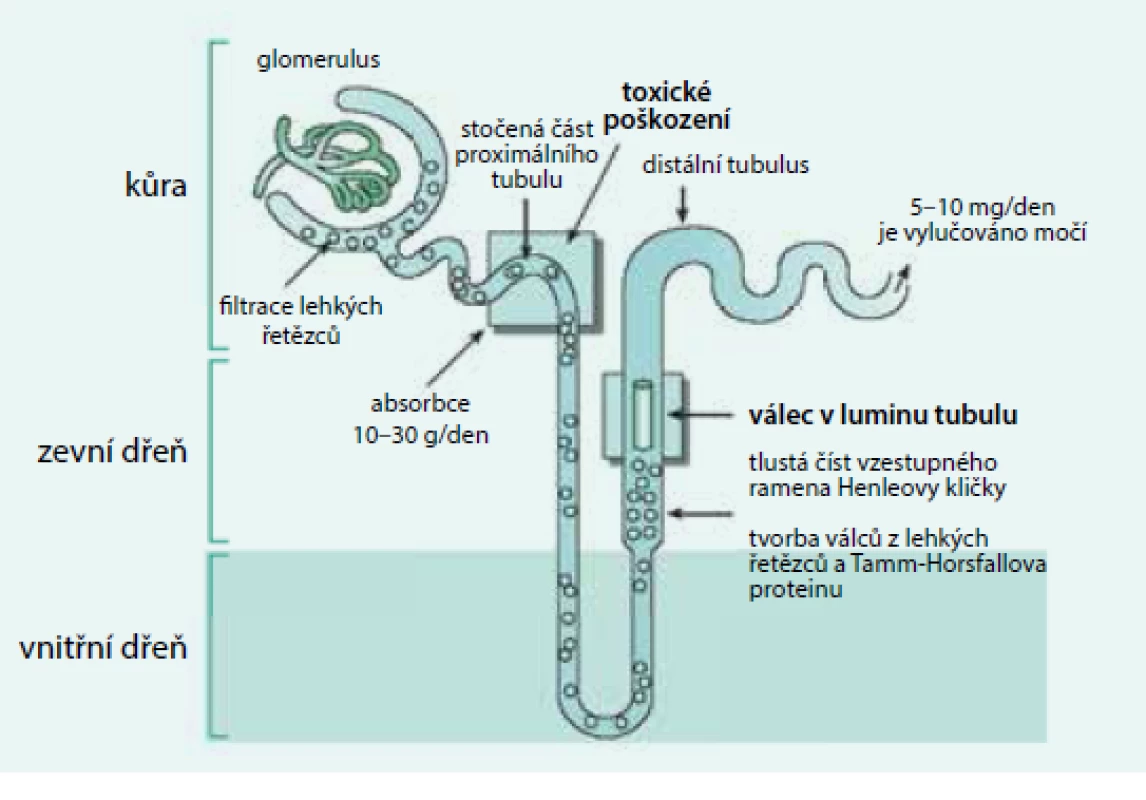
Z uvedeného patofyziologického mechanizmu je pochopitelné, proč dehydratace s následným zahuštěním moči v tubulech poškozuje ledviny. A stejně tak výše uvedená fakta objasňují, proč aplikace kontrastní látky, vylučované ledvinami, může dále přispět k vysrážení lehkých řetězců v tubulech, k vytvoření odlitkových válců a k závažnému poškození ledvin, a proč se nemocným s vyšším odpadem monoklonálních lehkých řetězců močí za 24 hodin (Bence Jonesovy bílkoviny) doporučuje udržovat diurézu nad 3,0 litry.
V některých případech monoklonální imunoglobulin poškozuje také glomerulární membránu. To vede k neselektivní proteinurii s přítomností nejen lehkých řetězců, ale i kompletní molekuly monoklonálního imunoglobulinu. Větší odpady bílkovin v moči pak způsobují nefrotický syndrom. Tato situace je často projevem amyloidové nefropatie [8–10].
Z klinického pohledu je nejčastějším projevem poškozeni ledvin neoligurické či oligurické selhání ledvin s retencí dusíkatých látek. Méně častým důsledkem mnohočetného myelomu je poškození ledvin se vznikem nefrotického syndromu se závažnou proteinurií, hypalbuminemií a otoky nohou. Osud nemocného zde opět závisí na včas stanovení diagnózy, protože čím déle nefropatie trvá, tím menší naděje, že při potlačení tvorby volných lehkých řetězců léčbou se zlepší funkce ledvin. Další formy poškození organizmu monoklonálním imunoglobulinem uvádí tab. 1.
Tab. 1. Přehled nemocí, které mohou způsobit molekuly monoklonálního imunoglobulinu 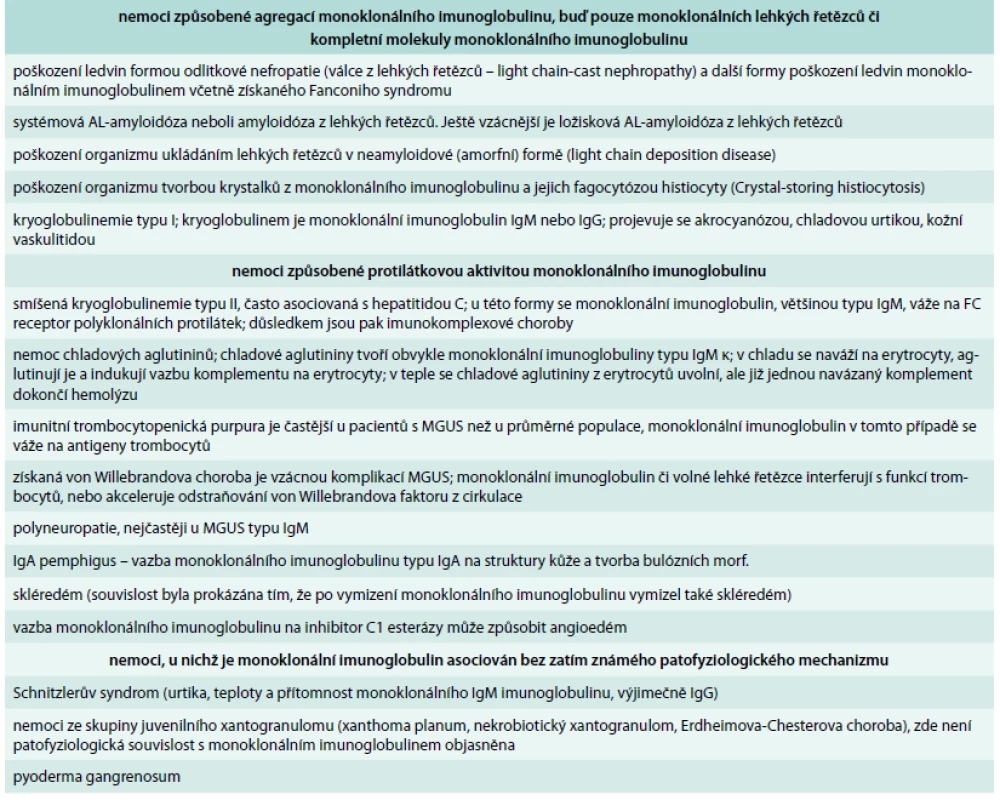
Snížení B buněčné i T buněčné imunitní obrany
U osob s mnohočetným myelomem dominuje zpočátku porucha B buněčné imunity, s postupem nemoci je prokazatelná také porucha T buněčné imunity. Defekt B buněčné imunity způsobuje omezenou produkci funkčních imunoglobulinů. Jejich koncentrace v krvi s progresí nemoci postupně klesá a schopnost tvořit odpovídající imunoglobulin po antigenní stimulaci je omezená.
Nedostatek funkčních protilátek usnadňuje vznik bakteriálních infekcí a způsobuje jejich agresivnější průběh ve srovnání se zdravými osobami.
Pokud vznikne pásový opar, musíme na něj pohlížet jako na signál deficitu či zhoršení T buněčné imunity, a tedy signalizaci recidivy nemoci či vzniku jiné maligní nemoci. U některých nemocných se diagnóza mnohočetného myelomu zjistila, když se hledala příčina opakovaných infekcí, které pacient dříve nemíval [1].
Anémie, trombocytopenie, neutropenie
Úvodní příznakem mnohočetného myelomu může být chronická patologická únava v důsledku chudokrevnosti, případně krvácení při malém počtu krevních destiček či poruše srážení krve způsobené monoklonální gamapatií. Anémie je přítomna v 70 % u nově diagnostikovaných nemocných. Méně často mají nově diagnostikovaní nemocní klinicky závažný pokles všech krvinek (pancytopenii) [1].
Trombocytopatie a koagulopatie způsobená monoklonálním imunoglobulinem
Monoklonální imunoglobulin může zasáhnout do hemostázy. Relativně častá je interakce lehkých řetězců s trombocyty, která způsobuje trombocytopatii. Připomínáme, že o trombocytopatii neinformují běžná předoperační koagulační vyšetření (INR, APTT, fibrinogen). Takže chce-li mít lékař informaci o funkci krevních destiček, musí požádat o vyšetření agregace trombocytů a test krvácivosti.
Někdy zasahuje monoklonální imunoglobulin rušivě do koagulační kaskády a způsobí prodloužení běžně vyšetřovaných koagulačních parametrů.
Méně často způsobuje monoklonální imunoglobulin hyperkoagulaci, která může vyústit v tromboembolickou komplikaci jako vůbec první příznak této nemoci u jinak asymptomatického nemocného [1]. Jedna z našich pacientek podstoupila vyšetření pro dušnost s nálezem pravostranné plicní hypertenze velmi pravděpodobně na základě sukcesivní plicní embolizace, a teprve poté byl odhalen symptomatický mnohočetný myelom a zahájena léčba.
Zvyšování viskozity vlivem monoklonálního imunoglobulinu
Při hodnotách celkové bílkoviny > 110 g/l mohou být koncentrace monoklonálního imunoglobulinu tak vysoké, že způsobují projevy hyperviskozity. Plazmaferéza je léčbou volby pro nemocné s klinickými projevy hyperviskozity. To, že viskozita je tak závažná, že zhoršuje průtok krve mikrocirkulací, může zjistit oční lékaři při vyšetřování očního pozadí (fundus paraproteinemicus) [1].
Stanovení diagnózy
Diagnóza mnohočetného myelomu se stanovuje na základě vyhodnocení morfologických, zobrazovacích a laboratorních údajů a jejich srovnání s kritérii přijatými pro tuto nemoc.
Pro stanovení diagnózy jsou zásadní tato vyšetření:
- vyšetření počtu a klonality plazmatických buněk v kostní dřeni. Používá se metoda sternální punkce nebo trepanobiopsie lopaty kosti kyčelní s odběrem válečku kostní dřeně k histologickému vyšetření. Aspirovaná kostní dřeň ze sternální punkce či trepanobiopsie se používá nejen cytologickému vyšetření se stanovením počtu plazmocytů, ale také k flowcytometrickému vyšetření počtu a klonality plazmocytů.
- průkaz kostního poškození. Osteolytická ložiska jsou zřetelná na RTG snímku až při vymizení nejméně 30–40 % hydroxyapatitu z ložiska. CT znázorní osteolytická ložiska podstatně přesněji a dříve než běžný RTG snímek. Při zobrazení pomocí MR lze velmi dobře rozpoznat přítomnost patologické infiltrace v kostní dřeni anebo mimokostní propagaci myelomových hmot, např. do páteřního kanálu. Ložiska ve skeletu lze také velmi dobře znázornit pomocí PET či PET-CT vyšetření. Nově se do popředí dostává metoda celotělového low-dose CT, které při nízké dávce záření informuje podstatně přesněji o osteolytických změnách než klasické RTG vyšetření. Zatím jej provádějí jen některá pracoviště.
- průkaz monoklonálního imunoglobulinu v séru a v moči a vyšetření volných lehkých řetězců κ a λ. Metoda zvaná imunofixace, nebo též imunofixační elektroforéza prováděná v moči i v séru, odpoví na otázku, zda je či není přítomný monoklonální imunoglobulin a jakého je typu. Metoda zvaná denzitometrie stanoví koncentraci monoklonálního imunoglobulinu v séru anebo v moči. Základem je provedení elektroforézy bílkoviny v séru a v moči. Následně se určí, který pruh představuje monoklonální imunoglobulin. Biochemická metoda zvaná denzitometrie pak stanoví, jak velkou část z koncentrace celkové bílkoviny představuje monoklonální imunoglobulin a stanoví tak jeho koncentraci. Proto se v biochemických výsledcích označuje slovem denzitometrie v séru a v moči koncentrace monoklonálního imunoglobulinu v séru a v moči. Pozor, musíme odlišit biochemickou metodu denzitometrii, která stanoví kvantitu monoklonálního imunoglobulinu od metody kostní denzitometrie, která stanoví hustotu (denzitu) kostní tkáně.
Tyto metody doplňuje stanovení volných lehkých řetězců κ a λ v séru a stanovení jejich poměru. Volné lehké řetězce se fyziologicky vylučují ledvinami, jejich koncentrace se zvyšuje při renálním selhání, a proto se uvádí i jejich poměr. Pokud je jejich poměr 100 a vyšší či 0,01 a nižší, tak to signalizuje již symptomatickou formu nemoci. Dále se vyšetřují koncentrace polyklonálních imunoglobulinů. Výhoda vyšetření polyklonálních imunoglobulinů je mimo jiné i v tom, že výsledek vidíme ještě v den odběru. Pro mnohočetný myelom je typický pokles fyziologických imunoglobulinů, takže pouze může být zvýšená koncentrace té třídy imunoglobulinů, v které je přítomný monoklonální imunoglobulin, a ostatní vyšetřené třídy imunoglobulinů budou mít sníženou koncentraci.
Tyto výsledky pak porovnáme s platnými kritérii, která se samozřejmě stále vyvíjejí [11–14]. Současná kritéria zobrazuje tab. 2 a tab. 3.
Tab. 2. Definice jednotek provázených monoklonálním imunoglobulinem typu IgG nebo IgA dle International Myeloma Working Group 2010 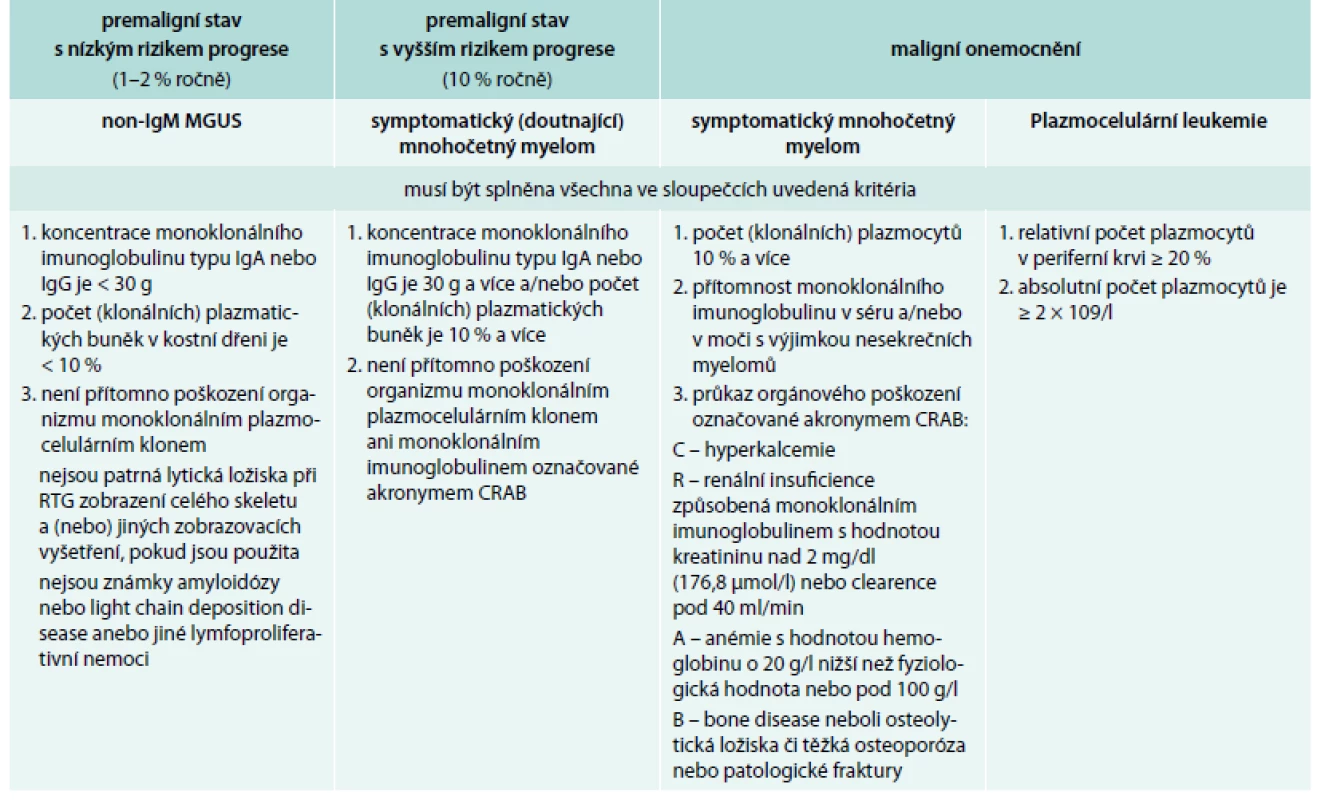
MGUS – monoclonal gammopathy of undetermined signifikance/monoklonální gamapatie nejistého významu Tab. 3. Definice jednotek provázených pouze klonálními volnými lehkými řetězci imunoglobulinu kappa nebo lambda dle International Myeloma Working Group 2010 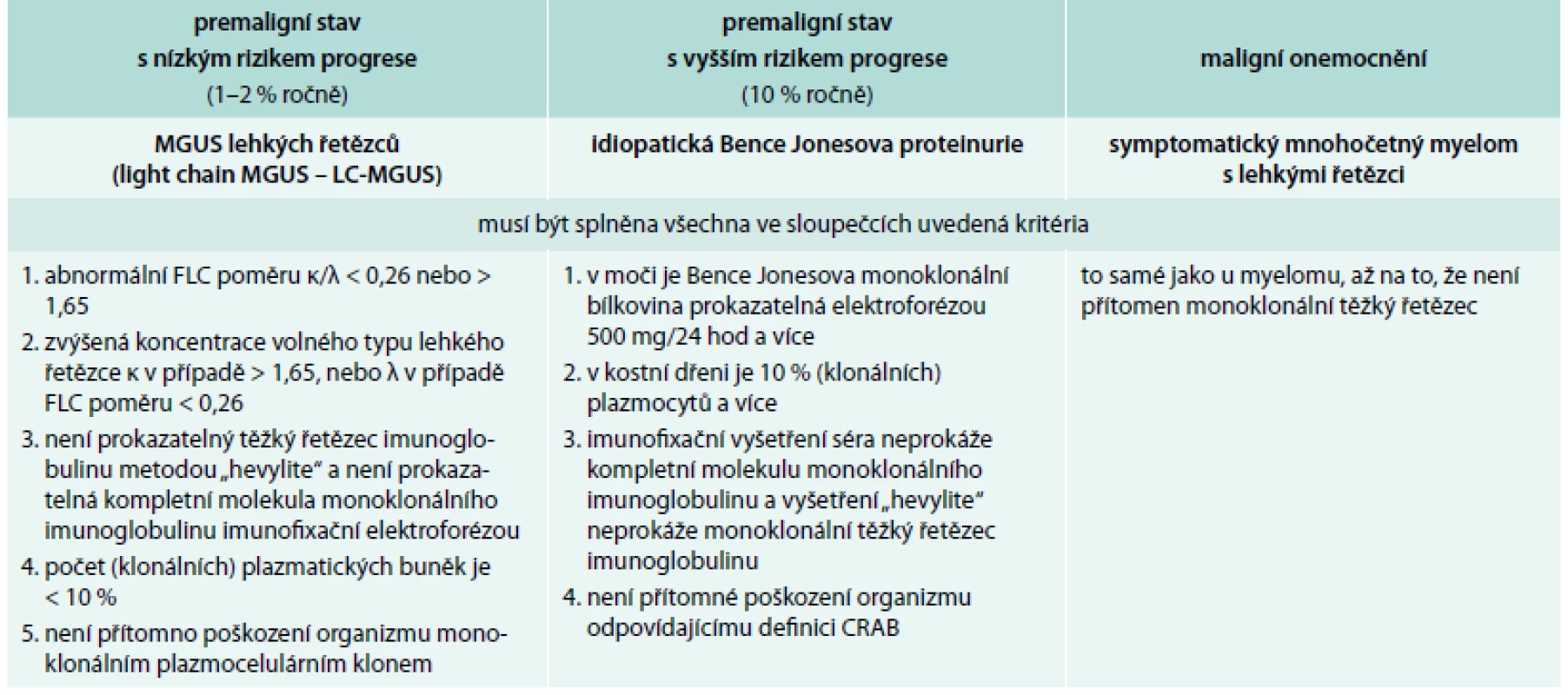
FLC – free light chain neboli volné lehké řetězce, biochemické výsledky z laboratoří obsahují anglickou zkratkou FLC, takže v tabulce je použita zkratka FLC Léčba mnohočetného myelomu
Protinádorová chemoterapie
Pacienti s asymptomatickou formou se v roce 2015 pouze sledují a léčba se u nich zahajuje až při zřetelných symptomech nemoci. Zahájení chemoterapie již u pacientů s asymptomatickou formou nepřineslo prodloužení celkového přežití. Zda tato praxí ověřená zkušenost při použití klasické chemoterapie bude platit i pro nové biologické léky, testují nyní klinické studie.
Léčba myelomu ve věku do 65 let obvykle obsahuje již v první léčebné linii vysokodávkovanou chemoterapii s autologní transplantací krvetvorných buněk.
Léčba mnohočetného myelomu pacientů nad 65 let již obvykle neobsahuje vysokodávkovanou chemoterapii s autologní transplantací kostní dřeně, byť jsou výjimky, u nichž je biologický stav pacienta tak výborný, že i po 65. roku života je možné podat vysokodávkovanou chemoterapii.
Cílem léčby je dosáhnout remise, tedy ústupu laboratorních a klinických známek nemoci.
Úvodní léčba se skládá obvykle z kombinace alkylačních látek (cyklofosfamid nebo melfalan), nárazových vysokých dávek glukokortikoidů (dexametazon 20–40 mg) a některého z nových necytostatických léků pro tuto nemoc, talidomidu anebo bortezomibu. Třetí nový lék pro tuto nemoci, lenalidomid, je v roce 2015 používán obvykle pro léčbu relapsu.
Uvedená chemoterapie je obvykle dobře snášena i pacienty ve vyšším věku a je možné ji podávat, pokud je nemocný schopen spolupráce. Jen je nutno pečlivě sledovat nežádoucí účinky a vhodně upravovat dávky tak, aby jednoznačně převážil přínos léčby nad jejími nežádoucími účinky.
Musíme zdůraznit, že podstata léčby myelomu je podávání iniciální chemoterapie relativně dlouho, po dobu 8–12 měsíců. Tato dlouhodobost léčby představuje určitou zátěž, s níž se musí pacient i jeho rodina vyrovnat. V roce 2015 stále ještě není přesně definován přínos udržovací léčby a podávání udržovací léčby probíhá jen v rámci klinických studií.
Po dosažení remise a ukončení léčby jsou nemocní kontrolováni v 1–3měsíčních intervalech a v případě recidivy nemoci s klinickými projevy se obnovuje léčba se stejným cílem – dosáhnout další remise nemoci [1,15,16]. V případě, že nemoc recidivuje za delší období než je rok od ukončení léčby, lze použít stejnou léčbu, kterou měl indikovanou již dříve. V případě, že recidiva nemoci vznikne do jednoho roku od ukončení léčby, doporučuje se vždy pro tuto nemoc otestovat jiné, zatím nepoužité léky. Pokud je k dispozici zamražený štěp krvetvorné tkáně, lze u vhodných pacientů léčit relaps opakováním vysokodávkované chemoterapie.
Další vývoj chemoterapie mnohočetného myelomu
Léčba myelomu se však velmi rychle vyvíjí. Od roku 2015 je již k dispozici v limitované podobě pomalidomid, nový a snad účinnější derivát již známého lenalidomidu. Jeho použití je limitováno pro pacienty rezistentní na všechny doposud dostupné léčebné linie. V roce 2015 je zatím jen v rámci klinických studií dostupný nový derivát odvozený od bortezomibu jménem karfilzomib, který se dle dostupných klinických studií zdá účinnější než bortezomib. A v roce 2015 se k nám alespoň ve formě klinických studií dostávají nové léky typu monoklonálních protilátek proti antigenům myelomových buněk (daratumumab). Lze tedy očekávat, že léčba myelomu se bude v následujících letech dále měnit.
Radioterapie
Je pravidelnou součástí léčby mnohočetného myelomu. Radioterapie v kurativní dávce (30–40 Gy) má potenciál zničit myelomové buňky v ozařovaném ložisku. To způsobí zastavení osteolýzy a někdy může převážit novotvorba kosti po záření. Projeví se to jako osteosklerotické ohraničení myelomového ložiska. Kurativní záření považujeme za vhodné pro všechna velká ložiska potencionálně ohrožující nosnost skeletu. V případě, že ložisko již uzuruje kortikalis, byla by před zahájením radioterapie vhodná konzultace s ortopedem, zda není vhodná preventivní operační fixace. Dále radioterapii v kurativní dávce používáme na mimokostní propagaci myelomových hmot.
Pokud stav pacienta nedovolí použít kurativní záření, je vhodné paliativní či analgetickou dávkou (10–15 Gy při aplikaci 2–3 Gy na frakci) zmenšit intenzitu bolesti. Nižší dávky záření sice nemají tumoricidní efekt, ale výrazně zmenšují intenzitu bolesti v ozařovaném místě. Dále je známo, že jednorázová ozáření v dávce 8 Gy má podobný efekt jako výše uvedené analgetické ozáření [1].
Operační léčba patologických fraktur
Každou patologickou frakturu obratle musí posoudit chirurg, běžně operující kosti, tedy ortoped nebo traumatolog. Každá fraktura dlouhé kosti se obvykle léčí vnitřní fixací a ne fixací zevní, jak je obvyklé u běžné úrazové fraktury. V případě, že se objeví velké osteolytické ložisko v nosném skeletu – tibie, femory, které výrazně snižuje nosnost skeletu, doporučují ortopedové provedení preventivní vnitřní operační fixace před vznikem zlomeniny. Domluva s ortopedy či traumatology na řešení velkých osteolytických ložisek s rizikem fraktury a na řešení patologických fraktur patří do komplexní péče o tyto nemocné.
Po provedení vnitřní fixace je po zhojení operační rány vhodná radioterapie v kurativní dávce na patologické ložisko. Lokální zničení myelomových buněk v místě patologické fraktury zářením umožní její hojení. Každou patologickou frakturu páteře musí posoudit ortoped či neurochirurg, aby rozhodl, zda se jedná o stabilní patologickou frakturu, u níž je dostačující zevní fixace ortézou, nebo zda je nutný operační zákrok s vnitřní fixací.
V případě, že není nutný operační zákrok, pomůže ortéza a následná radioterapie cílená na komprimovaný obratel.
Novou alternativou je vertebroplastika, což je perkutánní injekce polymetakrylátu či podobné rychle tuhnoucí látky do nitra obratle. Tato injekce zpevní obratel, zmenší bolestivost, ale neobnoví původní výšku obratle.
Metoda kyfoplastiky je založena také na perkutánní punkci pod CT kontrolou. Do těla komprimovaného obratle se jehlou vpraví malý naplnitelný balónek. Naplněním balónku se vytvoří dutina a obnoví se původní výška komprimovaného obratle. Po odstranění balónku se vyplní dutina rychle tvrdnoucím materiálem. Nejedná se o jednoduchou a levnou metodou, ale dle našich dosavadních zkušeností můžeme potvrdit, že zákrok vedl k okamžité úlevě od bolestí a ke zlepšení hybnosti. Vertebroplastiku a kyfoplastiku provádějí intervenční radiologové či ortopedové pod CT kontrolou [1].
Léčba míšní komprese
Míšní komprese může být způsobena kostními strukturami při patologické fraktuře anebo extramedulární propagací mnohočetného myelomu. Základním vyšetřením pro rozhodování je MR. Pokud se u pacienta s monoklonální gamapatií objeví nová bolest v oblasti páteře spojená s poruchou senzitivity či hybnosti, je nutné provést akutně vyšetření MR. V případě, že míšní komprese vznikla následkem nestabilní fraktury a je způsobena kostní tkání, pak může pomoci jedině rychlá operace, provedená do 24 hodin od vzniku neurologických příznaků. Dodržení tohoto intervalu vyžaduje nadstandardní snahu všech zainteresovaných lékařů, ale jedině při dodržení tohoto intervalu je naděje na zásadní zlepšení neurologického poškození.
V případě, že míšní komprese vznikne extramedulární expanzí myelomových hmot do páteřního kanálu, je preferována léčba vysokými dávkami dexametazonu a radioterapií (případně konkomitantní chemoterapií a radioterapií). Tato léčba se musí zahájit do 24 hodin od zjištění míšní komprese. Je tedy nutná rychlá domluva s radioterapeutickým pracovištěm na akutní radioterapii a vhodné frakcionaci. Radioterapeuti v případě intraspinální expanze myelomu používají vyšších dávek pro aplikaci, než je obvyklá frakce 2 Gy.
Operační zákrok se doporučuje pouze v případě nestability páteře anebo komprese nervů či míchy kostními strukturami.
Pokud se však lékař setká s člověkem, u něhož nebyla doposud zjištěna žádná maligní choroba a u něhož byla náhle zjištěna míšní komprese patologickou tkání, je na místě operační zákrok, který alespoň částečně dekomprimuje míchu a zároveň umožní odebrání vzorku na histologické vyšetření [1].
Podpůrná léčba zpomalující osteolýzu
Bisfosfonáty (klodronat, zoledronat, pamidronat, ibandronat) jsou léky, které zpomalují odbourávání kosti a mírní bolest. Důležité je zahájit podávání těchto léků ihned při zjištění nemoci a podávat je dlouhodobě, po dobu aktivity nemoci. Pokud je nemoc více než 2 roky v kompletní remisi, tak se jejich podávání ukončuje. U nemocných, kteří tyto léky dlouhodobě dostávají, probíhá patologická osteolýza podstatně pomaleji, takže tito nemocní mají signifikantně méně patologických fraktur, míšních kompresí a menší spotřebu analgetik než nemocní, kteří bisfosfonáty nedostávali. Před zahájením léčby bisfosfonáty se dnes vyžaduje vyjádření stomatologa, že v dohledné době nebude nutná extrakce zubu. A pokud by v budoucnu byla extrakce nutná, je nutné přerušit bisfosfonáty asi 3 měsíce před extrakcí zubu a samotnou extrakci provést v antibiotické cloně. Cílem těchto opatření je maximálně snížit riziko osteonekrózy. Jako ostenekrózu označujeme situaci, v níž po extrakci zubu nedojde k zacelení rány, ale naopak obnaží se kost, která se infikuje a mění na kost osteonekrotickou. Rizikem osteonekrózy čelisti jsou ohroženi všechny osoby, které užívají dlouhodobě bisfosfonáty a z nějakého důvodu musí podstoupit extrakci zubu. Proto před každou extrakcí zubu je nutno dotázat se nemocného, zda bere bisfosfonáty, a pokud ano, tak použít všechna dostupná preventivní opatření k minimalizaci tohoto rizika [1]. Při dlouhodobé léčbě bisfosfonáty byly vzácně popsány i takzvané atypické fraktury, např. spontánní fraktura metatarzálních kostí po krátké chůzi, tedy podobné fraktury, jako byly popsány u vojáků po dlouhých pochodech (pochodová fraktura). Příčinou těchto atypických fraktur je fakt, že bisfosfonáty vedou ke zvýšení denzity kostí, ale že toto zvýšení denzity je u některých osob spojeno s vyšší křehkostí kosti.
Prognóza a důležitost včasného stanovení diagnózy
Klasická chemoterapie prodloužila medián přežití z 8–11 měsíců (medián přežití pacientů bez cytostatické léčby) na 3–4 roky. Při klasické chemoterapii žilo 10 % pacientů déle než 10 let.
Vysokodávkovaná chemoterapie prodloužila medián přežití o 1,5 roku a počet nemocných, kteří žijí déle než 10 let, se zvýšil na 20 %.
Nové léky, které se při léčbě mnohočetného myelomu používají v posledních 8 letech (talidomid, revlimid a lenalidomid), dále prodlužují délku přežití a zřejmě zvýší počet nemocných žijících déle než 10 let na více než 30 %.
Tolik statistické údaje. U jednotlivých nemocných pak vždy záleží jednak na míře agresivity nemoci, ale také na tom, jak moc pokročilé onemocnění je při zahájení léčby. Čím později je stanovena diagnóza, tím více je komplikací, které ztěžují provedení léčby.
Závěry pro praxi
- Když se u člověka zjistí stoupající hodnoty kreatininu, čili počínající selhání ledvin, je třeba v rámci diferenciální diagnózy zvážit vyšetření hodnoty volných lehkých řetězců κ a λ v séru.
- Když za vámi přijde nemocný a stěžuje si na zcela nové bolesti páteře, které se postupně zhoršují a trvají již déle než 1 měsíc, je třeba udělat nejen RTG snímek páteře, ale alespoň základní laboratorní odběry, krevní obraz, sedimentaci, CRP, celkovou bílkovinu, albumin a ionty včetně kalcia. Pokud je alespoň jedna hodnota patologická, je to důvodem k podezření na maligní původ této bolesti a je vhodné provést další vyšetření k potvrzení či vyloučení této možnosti
- Pokud si pacient stěžuje na vyzařování bolesti z určitého místa páteře do oblastí, do nichž vedou nervová vlákna, vycházející z této části páteře, někdy se zhoršující při zvýšení žilního tlaku (zakašlání, kýchnutí), je podezření na kompresi nervového kořene či míchy a je nutné vyšetření neurologem, který případně indikuje akutní zobrazení MR či CT.
- Pokud si žena stěžuje na bolesti páteře a metoda kostní denzitometrie prokáže osteoporózu, je třeba vždy provést diferenciální diagnostiku osteoporózy, tedy i laboratorní vyloučení myelomu, vyšetření monoklonálního imunoglobulinu a volných lehkých řetězců.
- Pokud je u pacienta s myelomem detekováno velké osteolytické ložisko v nosném skeletu, je nutné konzultovat s ortopedem preventivní operační zpevnění uvedené oblasti.
- Pokud u pacienta s myelomem vznikne patologická fraktura, je nutné ji řešit vnitřní fixací, pokud je proveditelná, a pak může následovat radioterapie.
Doručeno do redakce 31. 7. 2015
Přijato po recenzi 21. 9. 2015
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno
www.fnbrno.cz
Zdroje
1. Hájek R, Adam Z, Ščudla V et al. za Českou myelomovou skupinu. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou. Transfuze a hematologie dnes 2012; 18(Suppl 1). Dostupné z WWW: http://www.myeloma.cz/res/file/Trans%20suppl%201.pdf.
2. Ščudla V, Pika T, Minařík J. Role stanovení těžkých/lehkých párů řetězců imunoglobulinů u monoklonálních gamapatií. Vnitř Lék 2015; 61(1): 60–61; 63–71.
3. Adam Z, Krejčí M, Pour L et al. Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014. Vnitř Lék 2014; 60(10): 861–879.
4. Špička I, Klánová M. Mnohočetný myelom. Vnitř Lék 2013; 59(7): 627–630.
5. Hrabálek L, Bačovský J, Ščudla V et al. Mnohočetný myelom páteře a jeho chirurgická léčba. Rozhl Chir 2011; 90(5): 270–276.
6. Ščudla V, Herman M, Minařík J et al. Přínos celotělovém magnetické rezonance pro diagnózu MGUS a mnohočetného myelomu a stanovení Durie Salmon staging plus systému. Vnitř Lék 2011; 57(1): 52–60.
7. Vaníček J, Krupa P, Adam Z. Přínos různých zobrazovacích technik pro stanovení diagnózy a sledování aktivity mnohočetného myelomu. Vnitř Lék 2010; 56(6): 585–590.
8. Adam Z, Ščudla V, Krejčí M et al. Léčba AL-amyloidózy, přínos nových léků, bortezomibu, thalidomidu a lenalidomidu. Vnitř Lék 2013; 59(1): 37–58.
9. Adam Z, Štork M, Pour L et al. Výsledky léčby AL-amyloidózy léčebnými režimy obsahujícími bortezomib, dexametazon a dále cyklofosfamid anebo doxorubicin. Vnitř Lék 2012; 58(12): 896–903.
10. Ščudla V, Minařík J, Pika T. Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease). Vnitř Lék 2012; 58(1): 38–43.
11. Rajkumar SV, Kyle RA, Baudi FK. Advances in the diagnosis, classification, risk stratification and management of monolocnal gammopathies of undetermined significance: Implication for recategorizing disease entities in the presence of evolving scientific evidence. Mayo Clin Proc 2010; 85(10): 945–948.
12. Mian M, Franz I, Wasle I et al. “Idiopathic Bence-Jones proteinuria”: a new characterization of an old entity. Ann Hematol 2013; 92(9): 1263–1270.
13. Fernández de Larrea C, Kyle RA, Durie BG et al. International Myeloma Working Group. Plasma cell leukemia: consensus statement on diagnostic requirements, response criteria and treatment recommendations by the International Myeloma Working Group. Leukemia 2013; 27(4): 780–791.
14. Kyle RA, Durie BG, Rajkumar SV et al. International Myeloma Working Group (IMWG). Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24(6): 1121–1127.
15. Hájek R, Plonková H, Gumulec J. Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem. Klin Onkol. 2013; 26(3): 163–169.
16. Kubiczková L, Matějíková J, Sedlaříková L et al. Proteasomové inhibitory v léčbě mnohočetného myelomu. Klin Onkol 2013; 26(1): 11–18.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Fekálna mikrobiálna terapiaČlánek Otrava olovem – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Racionální diagnostika cholangiokarcinomu
- Použití systémových glukokortikoidů v terapii infekčních nemocí
- Inhibitory protonové pumpy a jejich účinek na kosti
- Fekálna mikrobiálna terapia
- Těžká osteoporóza aneb Příběh chronické polékové hyponatremie
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
-
PRAXBIND® – nová jistota při léčbě perorálním antikoagulanciem PRADAXA®
Zpráva z odborného sympozia Další krok k bezpečnější antikoagulaci pořádaného Českou společností pro trombózu a hemostázu ČLS JEP ve spolupráci se společností Boehringer Ingelheim - Ivana Štětkářová (ed) et al. Moderní farmakoterapie v neurologii
- Ladislav Hagara. Ottova encyklopédia húb.
- Chronická pankreatitida diagnostikovaná po první atace akutní pankreatitidy – editorial
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Fekální transplantace střevní mikroflóry – editorial
- Otrava olovem – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Pacient si stěžuje na bolesti v páteři nebo na únavu a slabost. Jak rozeznám, zda je příčinou spondylartróza, věk nemocného anebo mnohočetný myelom?
- Otrava olovem – překvapivá příčina bolestí břicha, obstipace a anémie
- Kortikosteroidy v léčbě infekčních nemocí – editorial
- Antagonisté receptorů pro angiotenzin II (AT1-blokátory) v léčbě hypertenze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



