-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Management of angioedema. Guidelines of the Angiology Section of Slovak Medical Chamber (2013)
Angioedema is defined as a vascular reaction of the deep dermis/mucous and/or subcutaneous/submucosal tissues with localized vasodilatation and increased permeability of blood vessels resulting in tissue swelling. Angioedema can be mediated by bradykinin or mast cell mediators including histamine. Bradykinin-mediated angioedema can occur either on a hereditary (HAE) or acquired (AAE) basis, due to a deficiency/defect of C1 inhibitor (C1-INH) or not. Three forms of HAE have been defined: HAE due to C1-INH deficiency (type 1 HAE, HAE-1), characterized by low antigenic and functional C1-INH levels; HAE due to C1-INH dysfunction (type 2 HAE, HAE-2), characterized by normal (or elevated) antigenic but low functional C1-INH levels; and HAE with normal C1-INH antigenic and functional levels (HAE-3). Acquired C1-INH deficiency refers to patients with angioedema due to C1-INH deficiency on an acquired basis. There are a variety of acquired types of angioedema not due to C1-INH deficiency, and these may be bradykinin mediated (e.g. angiotensin-converting enzyme inhibitor-induced angioedema) or mast cell mediator histamine mediated (e.g. anaphylactic angioedema and urticarial angioedema). In recent years there have been several changes on how we look at the anaphylaxis. The spectrum of trigger factors and diagnostic and therapeutic algorithms has changed significantly. The anaphylaxis is regarded as any sudden severe hypersensitive reaction, which potentially can lead to death. Term anaphylactoid reaction is no more recommended to be used. Drug of first choice is adrenaline/epinephrine administered intramuscularly. Each patient at risk of angioedema should have a written individual rescue plan and knowledge how to use the first aid medicines.
Key words:
angioedema – AS SMC guidelines – CEAP (clinical-etiology-anatomy-patophysiology classification) – bradykinin
Autoři: Peter Gavorník 1,2,3; Ľudovít Gašpar 1,3; Andrej Dukát 1,3
Působiště autorů: II. interná klinika LF UK a UN Bratislava, Slovenská republika, prednosta doc. MUDr. Ľudovít Gašpar, CSc. 1; Prvé angiologické pracovisko (PAP), vedúci lekár doc. MUDr. Peter Gavorník, PhD., mim. prof. 2; Sekcia angiológov Slovenskej lekárskej komory, predseda doc. MUDr. Peter Gavorník, PhD., mim. prof. 3
Vyšlo v časopise: Vnitř Lék 2014; 60(5-6): 490-498
Kategorie: Doporučené postupy
Souhrn
Angioedém sa definuje ako vaskulárna reakcia kože/slizníc alebo subkutánnych/submukóznych tkanív s lokalizovanou vazodilatáciou a zvýšenou permeabilitou krvných ciev s následným opuchom. Je indukovaný bradykinínom alebo mediátormi mastocytov, vrátane histamínu. Bradykinínový angioedém je hereditárny alebo akvirovaný a spôsobený je buď deficitom/defektom inhibítora C1 komplementového systému (C1-INH), alebo bez jeho deficitu. Rozlišujú sa 3 formy hereditárneho angioedému: HAE-1 (deficit C1-INH) s nízkou hladinou a zníženou funkciou C1-INH; HAE-2 (dysfunkcia C1-INH) s normálnou alebo zvýšenou hladinou, ale zníženou funkciou C1-INH; HAE-3 s normálnou hladinou i funkciou C1-INH. Akvirovaný angioedém má viac foriem: angioedém spôsobený deficitom C1-INH zo získaných príčin; bradykinínový angioedém indukovaný ACE inhibítormi; mediátormi mastocytov indukovaný anafylaktický angioedém a urtikáriový angioedém. V ostatných rokoch došlo k viacerým zmenám v pohľade na anafylaxiu, zmenám v spektre spúšťacích faktorov a v diagnostickom a terapeutickom algoritme. Za anafylaxiu sa považuje akákoľvek ťažká náhla hypersenzitívna reakcia, ktorá potenciálne môže viesť k úmrtiu. Neodporúča sa používať pojem anafylaktoidná reakcia. Liekom prvej voľby je adrenalín podaný intramuskulárne. Každý pacient ohrozený angioedémom by mal mať písomne vypracovaný individuálny záchranný plán a poznať spôsob podania liekov prvej pomoci.
Kľúčové slová:
angioedém – bradykinín – CEAP (klinicko-etiologicko-anatomicko-patofyziologická klasifikácia angioedému) – odporúčania AS SLKÚvod
Angioedém (AE), Quinckeho edém (nesprávne tiež angioneurotický edém) je akútny často tranzitórny a recidivujúci vaskulárny opuch kože, podkožného tkaniva alebo slizníc, submukózneho tkaniva v oblasti hlavy a krku, ale aj v iných častiach organizmu (vrátane respiračného a gastrointestinálneho systému), ktorý indukujú vazoaktívne mediátory, spôsobujúce vazodilatáciu a zvýšenú cievnu permeabilitu [1]. Vyskytuje sa počas života až u 15 % populácie [1–10]. Patrí medzi urgentné/emergentné klinické stavy, ktoré môžu ohroziť život bezprostredne najmä akútnou respiračnou insuficienciou a šokom [1–43]. Časť pacientov tieto komplikácie neprežije, napriek rýchlej a správnej diagnóze a aj primeranej liečbe [1–10,40–43]. Angioedém nie je jednotnou nozologickou jednotkou, ale sú to poruchy/choroby s rozdielnymi klinicko-etiologicko-anatomicko-patofyziologickými prejavmi a mechanizmami, ktoré je potrebné poznať pre efektívnu racionálnu kauzálnu terapiu (tab. 1) [6].
Tab. 1. Klinicko-etiologicko-anatomicko-patofyziologická (CEAP) klasifikácia angioedému podľa Angiologickej sekcie Slovenskej lekárskej komory (AS SLK, 2013) 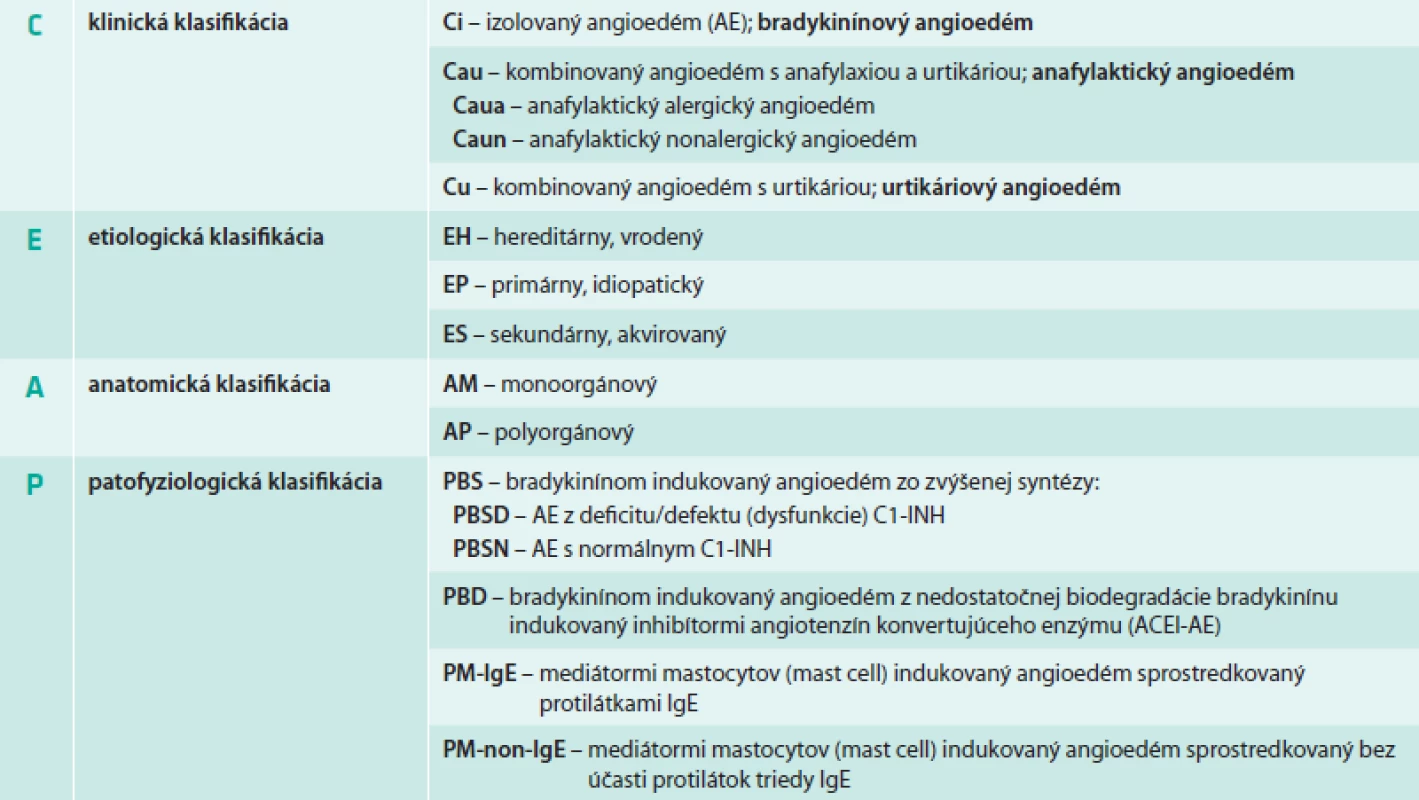
Klinicko-etiologicko-anatomicko-patofyziologická (CEAP) klasifikácia angioedému podľa Angiologickej sekcie Slovenskej lekárskej komory (AS SLK, 2013)
Klinická klasifikácia (C)
Klinicky sa vyskytuje buď samostatne (izolovaný angioedém – CiAE), alebo ako kombinovaný AE s urtikáriou (žihľavkou) – CuAE, alebo spolu s anafylaxiou a urtikáriou – CauAE. Výhodou tohto klinického rozdelenia je, že poukazuje zároveň aj na etiopatogenézu. Izolovaný AE je indukovaný bradykinínom – PB, zatiaľ čo kombinované angioedémy sú indukované mediátormi, ktoré sú uvoľnené zo žírnych buniek (mastocytov – PM) a cirkulujúcich bazofilov: buď sú sprostredkované protilátkami IgE (IgE angioedémy); alebo sú sprostredkované bez účasti protilátok IgE (non-IgE angioedémy). Anafylaktický angioedém (CauAE) je AE s klinickým obrazom anafylaxie. Rozlišuje sa jednak alergický a jednak nealergický anafylaktický angioedém. Urtikáriový angioedém (CuAE) je AE s klinickým obrazom urtikárie (tab. 1 a 2).
Tab. 2. Klasifikácia angioedému podľa WAO (2012) [1] ![Klasifikácia angioedému podľa WAO (2012) [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/39c9bf4c46fe4529c2b7371d9d0f0c5f.png)
AAE – acquired angioedema due to C1 inhibitor deficiency ACEI – angiotensin-converting enzyme-induced angioedema AE AE – angioedema HAE-1 – hereditary angioedema due to C1 inhibitor deficiency HAE-2 – hereditary angioedema due to C1 inhibitor defect HAE-3 – hereditary angioedema with normal C1 inhibitor levels Etiologická klasifikácia (E)
EH – hereditárny, vrodený angioedém je autozomálne dominantne dedičná mutácia jedného z 2 génov pre tvorbu inhibítora C1 komplementového systému (C1-INH), ktorá spôsobuje deficit/defekt C1-INH alebo spôsobuje HAE bez jeho deficitu. C1-INH reguluje nielen aktivitu C1 komplementu, ale pôsobí aj na kalikreín-kinínový, hemokoagulačný a fibrinolytický systém. HAE sa manifestuje v detstve, najčastejšie v 6.–8. roku života. Rozoznávajú sa 3 typy HAE [1,5,8,11,15–17,23,30,31,33]:
- typ 1 HAE (HAE-1) je deficit C1-INH so zníženou hladinou C1-INH, zníženou funkciou C1-INH a so znížením C4
- typ 2 HAE (HAE-2) je dysfunkcia C1-INH s normálnou (alebo aj zvýšenou) hladinou C1-INH, zníženou funkciou C1-INH a so znížením C4
- typ 3 HAE (HAE-3) je s normálnou hladinou i funkciou C1-INH a s normálnou C4. Ide o mutácie génov pre tvorbu hemokoagulačného faktora XII, ktorý je dysfunkčný. Klinicky je estrogén-dependentný. Vyskytuje sa v gravidite a pri estrogénovej liečbe.
EP – primárny, idiopatický izolovaný angioedém s klinickým obrazom podobným ako pri HAE, ale s neznámymi mediátormi a etiopatogenetickými mechanizmami. Pri pomocných vyšetreniach sa nezisťujú žiadne zmeny. Reaguje dobre na liečbu používanú pri HAE [1,34–36].
ES – sekundárny, akvirovaný angioedém je nonhereditárny AE ako klinický prejav (signum) alebo komplikácia nejakej konkrétnej získanej základnej poruchy (causa principalis) alebo základnej choroby (morbus principalis). Manifestuje sa kedykoľvek v živote, rodinná a osobná anamnéza je väčšinou negatívna (tab. 1 a 2).
Anatomická klasifikácia (A)
AM – monoorgánový angioedém, pri ktorom je postihnutá iba 1 orgánová oblasť človeka.
AP – polyorgánový angioedém, pri ktorom sú postihnuté 2 a viac orgánových oblastí človeka, výnimočne aj generalizovaný edém (tab. 1).
Patofyziologická klasifikácia (P)
PB – bradykinínom indukovaný angioedém
je klinicky izolovaný angioedém (CiAE). Bradykinín je nanopeptid, ktorý vzniká z kininogénu s vysokou molekulovou hmotnosťou (HMWK) pôsobením kalikreínu pri aktivácii tzv. faktorov kontaktu (hemokoagulačný Hagemanov faktor XII, prekalikreín, HMWK a C1-inhibítor). Nadbytok bradykinínu vyvoláva vazodilatáciu a zvýšenú cievnu permeabilitu prostredníctvom väzby na bradykinínový B2 receptor. To môže vzniknúť 2 hlavnými mechanizmami: nadmernou syntézou bradykinínu (PBS) alebo nedostatočnou degradáciou bradykinínu (PBD) (tab. 1). Podľa odporúčaní Svetovej alergiologickej organizácie (World Allergy Organization – WAO) sa rozoznávajú 2 druhy angioedému (tab. 2) [1]:
- angioedém z deficitu/defektu (dysfunkcie) C1-INH (PBS), jednak hereditárny (EHAE-1; EHAE-2), jednak sekundárny, akvirovaný (ESAE), pri ktorom je deficit/funkčná dysfunkcia C1-INH spôsobená inými mechanizmami
- angioedém s normálnym C1-INH, jednak hereditárny 3. typ HAE a jednak sekundárny, akvirovaný angioedém z nedostatočnej biodegradácie bradykinínu (PBD) indukovaný inhibítormi angiotenzín konvertujúceho enzýmu (ACEI-AE) (tab. 1) [1,31,33].
Pri jednom type ESAE je zvýšená spotreba (konzumpcia) C1-INH a C1q komplementu. Vyskytuje sa u chorých s lymfoproliferatívnymi chorobami (B lymfóm, plazmocytóm, chronická lymfatická leukémia), pri solídnych zhubných nádorových chorobách (kolorektálny karcinóm, karcinóm žalúdka, prsníka a i.), pri imunopatogénne podmienených chorobách (systémový lupus erythematosus, reumatoidná artritída, Hashimotova autoimunitná tyreoiditída), pri niektorých infekciách (infekčná mononukleóza, Helicobacter pylori) a pod.
Druhý typ ESAE je autoimunitný s tvorbou protilátok proti C1-INH pri imunopatogénne podmienených chorobách (systémový lupus erythematosus, reumatoidná artritída, Hashimotova autoimunitná tyreoiditída). Autoprotilátky nebránia ani syntéze, ani degradácii C1-INH, ale blokujú jeho aktivitu.
PM – mediátormi mastocytov indukovaný angioedém
je klinicky kombinovaný edém, ktorý je buď sprostredkovaný IgE protilátkami, alebo je sprostredkovaný bez účasti IgE protilátok. Podľa tohto mechanizmu sa rozlišujú 2 podskupiny PMAE:
PMAE-IgE – mediátormi mastocytov (mast cell)
indukovaný angioedém sprostredkovaný protilátkami IgE [1], je klinicky kombinovaný angioedém s anafylaxiou a urtikáriou (CauAE) – anafylaktický angioedém.
Za anafylaxiu sa dnes považuje akákoľvek závažná, náhla, neočakávaná a často nepredvídateľná hypersenzitívna reakcia, ktorá potenciálne môže viesť k úmrtiu [9]. Pojem anafylaxia (z gréckeho ana – proti, phylaxis – ochrana) pochádza z roku 1902 od francúzskych lekárov Portiera a Richeta, ktorí takto vyjadrili opak od slova profylaxia – ochrana. Anafylaxia sa klinicky zväčša spája s obrazom ťažkej artériovej hypotenzie a šokového stavu (anafylaktického šoku), ktorý sa rozvinie bezprostredne po kontakte s látkou alergénovej povahy. Vyhodnotenia dlhotrvajúcich sledovaní z posledných rokov však ukázali, že iniciálne klinické prejavy u pacientov, ktorí exitovali na anafylaxiu, mali častejšie charakter respiračnej insuficiencie ako cirkulačného šoku. Obzvlášť sa to týkalo prípadov anafylaxie vyvolanej potravinami, ktorá je v populácii najčastejšia [7,9,10]. Tieto zistenia boli dôvodom k prijatiu širšej definície anafylaxie (tab. 3).
Tab. 3. Hlavné klinické diagnostické kritéria anafylaxie [7,9,43] ![Hlavné klinické diagnostické kritéria anafylaxie [7,9,43]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b2dc025fd7e7d4d2e9f1ab5bd44aa573.png)
Starší pojem „anafylaktoidná reakcia“ sa v súčasnosti už neodporúča používať, nakoľko je mätúci a z hľadiska liečby nemá žiadny význam! Svetová alergiologická organizácia (World Allergy Organization – WAO) navrhuje používať pre reakcie sprostredkované protilátkami triedy IgE, IgG alebo imunokomplexami pojem alergická anafylaxia [9]. Podľa AS SLK: alergický anafylaktický angioedém – Caua (tab. 1). Pre anafylaxiu podmienenú neimunitnými mechanizmami (chlad, fyzická námaha, niektoré typy liekov) odporúča WAO pojem nealergická anafylaxia [9]. Podľa AS SLK: nonalergický anafylaktický angioedém – Caun (tab. 1).
Mechanizmom vzniku anafylaxie (anafylaktického angioedému) pri PMAE-IgE je reakcia IgE protilátok viazaných na povrchu mastocytov a bazofilov s príslušným alergénom. Dochádza k agregácii vysoko afinitného receptora pre IgE a rýchlemu uvoľneniu obsahu cytoplazmatických granúl do cirkulácie. Obsah granúl pozostáva z preformovaných mediátorov, ako sú histamín, tryptáza, karboxypeptidáza, chymáza a proteoglykany. Súčasne sa aktivujú fosfolipáza A2, cyklooxygenázy a lipoxygenázy, ktorých výsledkom sú metabolity kyseliny arachidónovej, ako sú prostaglandíny a leukotriény. Podobne sa aktivuje syntéza celého radu cytokínov a otvára sa endotelová vaskulárna bariéra.
Zatiaľ nie je úplne jasné, nakoľko sa na celom procese podieľajú genetické faktory a prečo sa anafylaxia vyskytne len u malej časti z tých, ktorí sú senzibilizovaní na alergény, alebo prečo jej intenzita kolíše od spontánne ustupujúcej príhody až po fatálny stav. Identifikovanie rizikových faktorov, spúšťačov a efektorového mechanizmu je z hľadiska prevencie a zníženia rizika ďalšej reakcie kľúčové [7,9,10,28,29,40].
Primárnou eflorescenciou pri urtikárii (žihľavke; hives, nettle-rash) je urtika, ktorú tvorí ružový až červený pomerne presne ohraničený plošný pupenec (pomfus) s výrazným pruritom. Urtika je spôsobená ohraničeným edémom v hornom kóriu kože, môže byť rôznej veľkosti od niekoľkých milimetrov až po rozsiahle splývavé mapovité plochy. V mieste urtiky vzniká najprv sčervenanie so svrbením, následne dermálny edém spôsobí vznik vyvýšenej urtikariálnej pomfy živočervenej farby, polotuhej konzistencie, niekedy s bledým centrom a okolitým erytematóznym dvorcom ako reflexnou vazodilatáciou. Reakcia sa volá Lewisova triáda (ako pri intrakutánnej aplikácii histamínu) [12,13].
PMAE-non-IgE – mediátormi mastocytov (mast cell) indukovaný
angioedém sprostredkovaný bez účasti protilátok triedy IgE je klinicky kombinovaný angioedém s urtikáriou (CuAE). V centre patofyziológie urtikáriového angioedému je aktivácia tkanivových mastocytov, z ktorých sa uvoľňujú 3 veľké skupiny mediátorov:
- vazoaktívne a hladké svaly ovplyvňujúce mediátory: histamín, leukotriény C4, D4 a E4, kiníny a prostaglandín D2
- chemotaktické mediátory: eozinofilný chemotaktický faktor – ECF-A, trombocyty aktivujúci faktor – PAF, chemotaktický faktor pre neutrofily
- heparín a proteolytické enzýmy: trypsín a chymotrypsín, ktoré modulujú alebo stimulujú produkciu mediátorov a ich aktivitu.
Mastocyt je tiež zdrojom množstva cytokínov a je schopný produkovať a uvoľňovať najmä interleukín IL1, 2, 3, 4, 5, 6, faktor stimulujúci kolónie granulocytov a makrofágov, interferón γ a tumor nekrotizujúci faktor α. Prostredníctvom IL4 zvyšuje mastocyt proliferáciu B-lymfocytov, cestou IL5 diferenciáciu eozinofilov a prostredníctvom IL6 rast a diferenciáciu T - a B-lymfocytov. IL3 zahajuje syntézu histamínu.
Histamín sa do organizmu dostáva buď exogénnou cestou (napr. po uštipnutí hmyzom, ktorého exkréty obsahujú histamín), alebo sa uvoľňuje endogénne – degranuláciou tkanivových mastocytov. Degranuláciu môžu pri non-IgE AE vyvolať fyzikálne činitele (tlak, teplo, chlad, UV žiarenie), chemické látky (kontaktné jedy, napr. pŕhľava), pôsobenie liberátorov histamínu (atropín, chinín) a pod. Mastocyty po degranulácii nezanikajú, ale sú nejaký čas (hodiny, dni) refraktérne voči ďalšej stimulácii, čo vysvetľuje skutočnosť, že na tom istom mieste po odoznení AE a urtikárie nejaký čas nevznikajú nové klinické prejavy – refraktérna fáza CuAE (tab. 1) [2,12,13,22,40].
Klinický obraz
Angioedém indukovaný bradykinínom je akútny, vznikajúci postupne za niekoľko hodín po provokujúcich faktoroch (úraz, stomatologické a chirurgické výkony, menzes, gravidita, hormonálna antikoncepcia s estrogénmi, chlad, psychoemocionálny stres, infekcia a pod.), je častejšie monoorgánový ako polyorgánový, najčastejšie na hlave a krku (mihalnice, pery, jazyk, uvula, hrtan – s následnou život ohrozujúcou edémovou obštrukciou horných dýchacích ciest a asfyxiou – Quinckeho choroba); postihuje horné končatiny, genitál, gastrointestinálny, urogenitálny, centrálny nervový systém. Chýba pruritus a urtikária (izolovaný angioedém). Sú ale často prodromálne klinické prejavy, najčastejšie bolesti brucha, nauzea, vracanie, hnačky (môže imitovať akútnu brušnú príhodu); polakizúria, strangúria, retencia moču; bolesti hlavy, kŕče, afázia, hemiparéza. Všetky prodromálne symptómy a znaky sú prejavom vznikajúceho angioedému v príslušných orgánových oblastiach. Nereaguje na podanie adrenalínu, glukokortikoidov a antihistaminík. Spontánne ustupuje počas 1–4 dní. Recidívy sú v rôznej frekvencii (od niekoľkých dní až roky). Pri HAE je pozitívna rodinná anamnéza, v osobnej anamnéze vznik v detstve, výskyt zriedkavý (1 : 10 000–50 000 v populácii) [1,5,8,11,15–17,23,30,31,33].
Angioedém indukovaný mediátormi mastocytov sprostredkovaný IgE a bez účasti IgE protilátok s anafylaxiou a urtikáriou je akútny, neočakávaný a nepredvídateľný. Zoznam spúšťacích faktorov anafylaxie je prakticky nekonečný, avšak niektoré spúšťače sú významne častejšie (tab. 4) [9]. Rizikové faktory pacienta rozdeľuje WAO na „vekové“ (najviac sú ohrozené deti, adolescenti a starí ľudia), konkomitantné choroby (astma bronchiale a iné respiračné choroby, kardiovaskulárne choroby, mastocytóza, alergická rinitída, ekzém a depresia), liekové a drogové rizikové faktory (betablokátory, ACEI, analgetiká, alkohol) a „amplifikačné kofaktory anafylaxie“ (telesná námaha, psychoemocionálny stres, akútna infekcia, cestovanie alebo náhla zmena životných zvyklostí, predmenštruačný syndróm a pod.) [9].
Tab. 4. Zoznam najvýznamnejších spúšťacích faktorov pre anafylaxiu. Upravené podľa [9,43]. ![Zoznam najvýznamnejších spúšťacích faktorov pre anafylaxiu. Upravené podľa [9,43].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/930bcdd0432f35ed4f28ba586eaed9bd.png)
Prejavy anafylaxie nastávajú niekedy už počas alebo desiatky sekúnd po zjedení potravy, na ktorú človek reaguje alergicky; pri parenterálnej aplikácii liekov, po užití liekov, po bodnutí hmyzom, po fyzickej námahe, pri alergii na latex a po iných spúšťačoch (tab. 4). Prvým príznakom býva zvyčajne výraznejšie svrbenie (pruritus) kože na rôznych miestach tela. Môže sa objaviť začervenanie a opuch na koži, urtikária, vyrážka, ekzém, pocity tepla, pokles krvného tlaku, búchanie srdca (tachykardia). Človek vie, že sa niečo zmenilo a niečo sa deje, nemusí však vedieť, o čo ide. Cíti sa čudne, má závraty, môžu byť poruchy videnia (zdá sa, že je všetko zrazu malé, alebo rozdvojené). Môže sa objaviť výrazná nádcha, kýchanie. Môže sa značne sťažiť (dyspnoe) alebo zrýchliť dýchanie (tachypnoe), zmeniť srdcový rytmus. Inokedy má pacient bolesti brucha, vracanie, hnačku. Tieto klinické prejavy môžu byť oddelené, alebo sa objavia postupne [7,9,10,28,29,40]. Kardinálne klinické diagnostické kritériá anafylaxie (anafylaktického angioedému) uvádza tab. 3 [7,9]. Ak naozaj ide o anafylaxiu, stav sa v priebehu niekoľkých minút môže prudko zhoršiť až do straty vedomia. V určitom percente prípadov má priebeh anafylaxie dvojfázový alebo prolongovaný charakter. Prevalencia a incidencia CauAE má na celom svete stúpajúcu tendenciu. Údaje z retrospektívnej Rochesterskej populačnej štúdie ukázali, že sa počet prípadov v ostatných 2 desaťročiach zdvojnásobil. V 80. rokoch minulého storočia bola incidencia anafylaktického angioedému 21 prípadov na 100 000 obyvateľov za rok, ale v 90. rokoch minulého storočia už 50 prípadov na 100 000 obyvateľov za rok [24,25]. Na rozdiel od minulosti sa anafylaxia rozvinie častejšie v prostredí mimo zdravotníckeho zariadenia, v domácom alebo voľnočasovom prostredí. Úmrtie sa vyskytuje približne v 1 % všetkých prípadov anafylaxie [9,26]. Spontánne ustupujúce a neliečené CauPM recidivujú obvykle s neodhadnuteľným, spravidla vážnejším priebehom.
Diagnóza a diferenciálna diagnóza
Základom rýchlej a správnej diagnózy je orientačná anamnéza a fyzikálne interné vyšetrenie. Vylúčiť musíme predovšetkým iné edémové stavy (tab. 5), akútny infarkt myokardu, akútne zlyhanie srdca, vénovú tromboembóliu (VTE), náhlu cievnu mozgovú príhodu, generalizovanú urtikáriu, asthma bronchiale, synkopu, panický záchvat, aspiráciu cudzieho telesa a iné akútne stavy. V rámci potrebného vénového prístupu odoberáme krv aj na vyšetrenia, ktorými po zvládnutí akútneho stavu identifikujeme efektorové mechanizmy angioedému (hladina C1-INH, funkcia C1-INH, C4; protryptáza, α/β-tryptáza, histamín). V moči vyšetrujeme aj histamín a jeho metabolit N-metylhistamín. Treba zdôrazniť, že pre diagnózu angioedému nejestvuje žiadny špecifický laboratórny marker. Pomocné vyšetrenia sú však potrebné pre diferenciálnu diagnózu aj iných akútnych stavov [1,9,40].
Tab. 5. Klinicko-etiopatogenetická klasifikácia a diferenciálna diagnóza edémových stavov [6,35,36,43] ![Klinicko-etiopatogenetická klasifikácia a diferenciálna diagnóza edémových stavov [6,35,36,43]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8b49b8011a36b0079ae022d00522e2df.png)
Liečba a prevencia
Ak je to možné, už pri akýchkoľvek prodromálnych klinických prejavoch prerušiť expozíciu spúšťacieho faktora, napr. zastaviť intravénové podávanie terapeutickej alebo diagnostickej látky apod.
Liekom prvej voľby je jednoznačne epinefrín (adrenalín), Adrenalin sol. inj. (1 mg/1 ml amp) podaný intramuskulárne (i.m.) v dávke 0,01 mg/kg, maximálne 0,5 mg (dospelý pacient), 0,3 mg (deti). Všetky ostatné lieky sa považujú za doplňujúce [1–40]. Pre podanie adrenalínu prakticky neexistuje absolútna kontraindikácia [9]. Všetky publikované práce zdôrazňujú najmä časový faktor, pretože väčšina úmrtí na anafylaxiu sa spájala s oneskoreným podaním alebo nepodaním adrenalínu. Preferuje sa intramuskulárne podanie, nakoľko adrenalín má dobrú biologickú dostupnosť a vrcholové koncentrácie dosahuje v priebehu 10 minút. Takáto forma podania je navyše bezpečnejšia a účinok adrenalínu je dlhší. Miestom vpichu by mal byť horný anterolaterálny kvadrant femorálnej oblasti, nie gluteálny sval. Používanie adrenalínovych pier – (auto)injektorov (u nás registrovaný EpiPen 0,3 mg a Jext 300 µg pre dospelých; EpiPen Jr a Jext 150 µg pre deti) sa dnes považuje za súčasť štandardného vybavenia každej pohotovostnej lekárničky a každého pohotovostného kufríka lekára. Injekcia sa aplikuje asi zo vzdialenosti 10 cm tak, že ihlu prudko zabodneme do vonkajšej strany stehna v 90-stupňovom uhle. Ihlu treba podržať na mieste 10 sekúnd, potom autoinjektor vytiahneme. Miesto vpichu masírujeme 10 sekúnd. Opakovaná injekcia môže byť podaná v prípade potreby po 15 minútach.
Pacienta s príznakmi anafylaxie ukladáme do protišokovej (Trendelenburgovej) polohy, ktorá zlepšuje vénový návrat (hlava a srdce sú nižšie ako zvyšok tela). Výnimkou je dyspnoe pri astmatickom záchvate, kedy musí byť pacient v polosede.
Súčasne intravénovo (kanylovým vénovým prístupom) dopĺňame objem tekutín formou kryštaloidov (zväčša fyziologický 0,9% roztok NaCl) rýchlosťou 20 ml/kg/20 min (rýchla volumexpanzia). Pacientom s respiračnými klinickými prejavmi by mal byť podaný kyslík a inhalačne β2-mimetikum, buď salbutamol (Ventolin) alebo fenoterol (Berotec) po 2–4 dávkach. Pri stridore je treba zvážiť inhaláciu nebulizovaného adrenalínu.
Až potom nasleduje podanie kortikosteroidov a antihistaminík. Nástup účinku kortikoidov je oneskorený a uprednostňuje sa intravénové podanie hydrokortizónu (Hydrocortison 100 mg amp.) v dávke 2–4 mg/kg každých 6 hod, alebo metylprednizolónu (Solu-Medrol) v dávke 1–2 mg/kg každých 6 hod. Úlohou kortikoidov je potlačiť oneskorené prejavy (bifázický alebo prolongovaný priebeh). Z antihistaminík sa odporúčajú nielen H1-antihistaminiká, napr. bisulepín (Dithiaden sol. inj. 1 mg/2 ml amp.) v dávke 1–2 mg i.v. každých 8 hod; ale aj H2-antihistaminiká, napr. ranitidín (Ranital sol. inj. 50 mg/2 ml amp. v i.v. infúzii pomaly počas 2 hodín [2,3,7,9,10,40].
Minimálny čas pozorovania v zdravotníckom zariadení by mal byť 24 hod, v prípade hypotenzie s okamžitým prístupom k intenzívnej starostlivosti a monitorovania vitálnych funkcií. Treba byť pripravený na okamžité začatie kardiopulmonálnej resuscitácie (CPR) – súhrn úkonov, ktorých cieľom je obnovenie vitálnych funkcií a záchrana života pri zastavení obehu alebo dýchania. Ich postupnosť sa nazýva reťazec prežitia (chain of survival) [37–39]. Už pri podozrení na možnosť zastavenia obehu alebo dýchania najskôr zabezpečíme prostredie vhodné na resuscitačné úkony. V súčasnosti nepostupujeme podľa pôvodne navrhnutého mnemotechnického algoritmu ABCDE (Airway – dýchacie cesty; Breathing – dýchanie; Circulation – obeh; Disability – nevládnosť; Exposure – odhalenie, vyzlečenie pacienta), ale prvé 3 kroky majú zmenené poradie (CABDE). Overíme stav vedomia reakciou na oslovenie. Ak pacient nereaguje a normálne nedýcha, tak privoláme pomoc (v teréne telefonovať na 112 alebo 155). Pacienta otočíme na chrbát a neodkladne zahájime nepriamu masáž srdca (C) vystretými hornými končatinami približne v strede sterna s frekvenciou asi 100 stlačení za minútu, do hĺbky asi 5 cm, čas stlačenia a uvoľnenia je rovnako dlhý. Po 30 stlačeniach aplikujeme 2 vdychy (B), za súčasného záklonu hlavy, upchatia nosa a predsunutia sánky. Oba vdychy by nemali trvať viac ako 5 sekúnd, pretože každé prerušenie masáže srdca znižuje prežívanie. Pri CPR dvoma osobami masáž srdca počas aplikácie vdychov neprerušujeme. Ak nenastane exkurzia hrudníka, ukazuje to na obštrukciu v dýchacích cestách (A). Intubáciu pacienta by mal vykonávať len lekár s dostatočnou praxou a prerušenie nepriamej masáže srdca počas intubácie nesmie presiahnuť 10 sekúnd! Po intubácii pacient ventiluje (B) za použitia ambuvaku s frekvenciou vdychov 10 za minútu bez prerušenia masáže srdca. Pri fibrilácii komôr je potrebné vykonať včasnú defibriláciu. Je samozrejmé, že je treba viesť o všetkom podrobný emergentný protokol [1,9,37–39].
Prvou a najdôležitejšou úlohou liečby angioedému indukovaného bradykinínom je zhodnotenie a zabezpečenie horných dýchacích ciest. Endotracheálna intubácia má byť realizovaná ihneď, ak je prítomný stridor či zastavenie dýchania. Zriedkavo je potrebné vykonať akútnu krikotyroidotómiu [1].
Liečbou prvej voľby akútneho ataku PBAE je substitučná terapia koncentrátom C1-INH [1]. Intravénovo (i.v.) sa aplikuje pasterizovaný C1-INH derivovaný z plazmy (Berinert) 1 000 U u dospelých, 500 U u detí s biologickým polčasom 36–48 hod.; alebo nanofiltrovaný C1-INH derivovaný z plazmy (Cinryze) 1 000 U, tiež s biologickým polčasom 36–48 hod. [18]; alebo rekombinantný humánny C1-INH (Rhucin) 100 U/kg. Je kontraindikovaný pri alergii na králika. Pri prvých dvoch prípravkoch je potenciálne nebezpečenstvo prenosu vírusových nákaz a anafylaxie. V ostatných odporúčaniach WAO sa ako alternatíva prvej voľby uvádza podanie dvoch novších liekov. Ekalantid (Kalbitor) je inhibítor kalikreínu, ktorý sa v dávke 30 mg aplikuje subkutánne (s.c.), biologický polčas má 2–4 hod. [1,20]. Ikatibant (Firazyr) je antagonista bradykinínového receptora B2, ktorý sa tiež aplikuje subkutánne v dávke 30 mg a má biologický polčas 2–4 hod. [1,19]. Významnou výhodou týchto 2 liekov je neprítomnosť humánnych či animálnych kontaminantov, ako aj to, že sú optimálnymi pre domácu aplikáciu. Pri nedostupnosti uvedených prípravkov sa odporúča čerstvá mrazená plazma [1], avšak jej použitie ostáva kontroverzné vzhľadom na to, že môže teoreticky dokonca zhoršiť akútny atak, hoci v kontrolovaných štúdiách sa to nepozorovalo.
Pre dlhotrvajúcu (celoživotnú) udržiavaciu preventívnu liečbu je možné použiť 3 skupiny liekov [1,30].
Syntetické 17α-alkylované androgény,
ako danazol, stanazolol a oxandrolón, majú preukázateľný terapeutický prínos s malými nežiaducimi účinkami. Kontraindikáciou pre túto liečbu je gravidita, dojčenie, karcinóm prostaty a detský vek (do ukončenia rastu). Nežiadúce účinky sú závislé od podávanej dávky, pričom najvýznamnejšou je hepatotoxicita a virilizácia. V úvode liečby možno začať s vysokou dávkou (400–600 mg danazolu denne) s následným znížením dávky, alebo naopak sa začína s nízkou počiatočnou dávkou (50–200 mg denne) s jej následným zvyšovaním podľa klinickej odpovede. Pacienti by mali byť liečení čo najnižšou dávkou potrebnou na dosiahnutie a udržanie kontroly nad klinickými prejavmi, obyčajne 50–200 mg danazolu denne alebo každý 2. deň. Dôležité je pravidelné monitorovanie funkcií pečene a lipidového profilu.
Antifibrinolytické lieky:
kyselina ε-aminokaprónová (EACA) a kyselina tranexámová sú považované za menej účinné ako androgény. Vzhľadom na ich priaznivý bezpečnostný profil sú často vyhradené pre pacientov s neznášanlivosťou androgénov.
Koncentrát C1-INH
významne znižuje frekvenciu atakov u pacientov liečených doma infúziou koncentrátu C1-INH každých 5–7 dní v dávke 1 000 UI. V gravidite je najbezpečnejšou profylaktickou liečbou. Koncentrát C1-INH je vhodný aj na krátkotrvajúcu profylaxiu pred akoukoľvek chirurgickou alebo endoskopickou intervenciou.
Všetci pacienti s HAE by mali byť vybavení informačným náramkom, poprípade náhrdelníkom, s označením ochorenia a s písomným plánom liečby akútnych atakov s postihnutím dýchacích ciest pre použitie na oddelení intenzívnej starostlivosti [1].
Po zvládnutí akútneho stavu angioedému sa pred prepustením domov veľmi zdôrazňuje dôkladná inštruktáž pacienta a jeho rodiny o postupe v prípade opakovania sa angioedému. Pacient by nemal opustiť zdravotnícke zariadenie bez poskytnutia liekov prvej pomoci, vrátane adrenalínoveho pera, antihistaminika, pripadne inhalačného salbutamolu a bez uistenia sa, že porozumel spôsobu aplikácie. Ďalším krokom je včasné začatie vyšetrenia na identifikovanie spúšťacieho faktora. Sérové koncentrácie alergénovošpecifických IgE dosahujú najvyššie hodnoty až po 2 týždňoch od anafylaxie. Toto vyšetrenie sa preto realizuje s uvedeným odstupom. V prípade nejasnej príčiny môže byť odber krvi a zmrazenie vzorky séra počas akútneho stavu za účelom stanovenia koncentrácie tryptázy cennou pomôckou pri objasňovaní mechanizmu anafylaxie. Dlhotrvajúca preventívna liečba spočíva predovšetkým v dôslednej ochrane pred kontaktom so spúšťačom, prípadne v profylaktickom podávaní antihistaminík [1,30]. Omalizumab je anti-IgE monoklonálna protilátka s úspechom nedávno použitá v preventívnej liečbe IgE angioedémov s urtikáriou (CuSAE) [21]. V prípade alergie na bodnutie hmyzom je významným terapeutickým nástrojom alergénová imunoterapia. Každý pacient s angioedémom, najmä ohrozený anafylaxiou, by mal mať vypracovaný individuálny záchranný plán, ktorý obsahuje okrem liekov a spôsobu ich aplikácie aj informáciu o alergénoch, na ktoré je pacient precitlivený, a kontakt na blízku osobu a svojho ošetrujúceho lekára.
Záver
Základným predpokladom kauzálnej racionálnej efektívnej terapie angioedému je rýchla a správna komplexná klinicko-etiologicko-anatomicko-patofyziologická diagnóza. Angioedém patrí medzi urgentné/emergentné interdisciplinárne klinické stavy, ktoré môžu bezprostredne ohroziť život najmä akútnou respiračnou insuficienciou a šokom. Incidencia angioedému sa v ostatných rokoch zvyšuje obdobne, ako sa neustále zvyšuje incidencia aj ďalších cievnych chorôb (angiopandémia 3. milénia). Základné princípy manažmentu angioedému by mal ovládať nielen každý internista, angiológ, alergiológ či iní klinickí špecialisti, ale prakticky každý lekár.
doc. MUDr. Peter Gavorník, Ph.D., mim. prof.
peter.gavornik@sm.uniba.sk
II. interná klinika LF UK a UN Bratislava, Slovenská republika
www.fmed.uniba.sk
Doručeno do redakce: 19. 9. 2013
Zdroje
1. Craig T, Pürsün E, Bork K et al. WAO Guideline for the Management of Hereditary Angioedema. World Allergy Organ J 2012; 5(12): 182–199.
2. Sánchez-Borges M, Asero R, Ansodegui IJ et al (WAO Scientific and Clinical Issues Council). Diagnosis and Treatment of Urticaria and Angioedema: A Worldwide Perspective. World Allergy Organ J 2012; 5(11): 125–147.
3. Thong B, Mirakian R, Castells M et al. World Allergy Organization International Survey on Diagnostic Procedures and Therapies in Drug Allergy/Hypersensitivity. World Allergy Organ J 2011; 4(12): 257–270.
4. Valent P, Klion AD, Rosenwasser LJ et al. International Consensus on: Eosinophil Disorders. World Allergy Organ J 2012; 5(12): 174–181.
5. Jeseňák M, Bánovčin P. Hereditárny angioedém na Slovensku – stále veľká neznáma? Pediatria pre prax 2013; 14(S1): 10–12.
6. Gavorník P. Etiopatogenéza a diferenciálna diagnóza edémových stavov. Kardiológia/Cardiology 2009; 18(2): 73–78.
7. Sampson HA, Munoz-Furlong A, Campbell RL et al. Second symposium on the definition management of anaphylaxis: summary report – Second National Institute of and Infectious Disease/Food Allergy Anaphylaxis Network symposium. J Allergy Clin Immunol 2006; 117(2): 391–397.
8. Kadaňka Z, Peška S, Bednařík J. Orolinguální angioedém jako komplikace trombolytické léčby pacientů s akutní ischemickou cévní mozkovou příhodou. Neurológia pre prax 2013; 14(1): 50–52.
9. Simons FER, Ardusso LRF, M Beatrice Bilò MB et al. World Allergy Organization Guidelines for the Assessment and Management of Anaphylaxis. World Allergy Organ J 2011; 4(2): 13–37.
10. Boyce JA, Assa´ad A, Burks AW et al. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel. J Allergy Clin Immunol 2010; 126(Suppl.6): S1-S58.
11. Zanichelli A. Medical management of hereditary angioedema: review for the internist. Gaz Med Ital 2013; 172(3): 185–199.
12. Zuberbier T, Asero R, Binslev-Jensen C et al. EAACI/GA(2)LEN/EDF/WAO guideline: definition, classification and diagnosis of urticaria. Allergy 2009; 64(10): 1417–1426.
13. Zuberbier T, Asero R, Binslev-Jensen C et al. EAACI/GA(2)LEN/EDF/WAO guideline: management of urticaria. Allergy 2009; 64(10): 1427–1443.
14. Adam Z, Tomiška M, Krejčí M et al. Diferenciální diagnostika eozinofilie. Vnitř Lék 2009; 55(Suppl 1): S125-S144.
15. Kestler A, Keyes L. Uvular Angioedema (Quincke’s Disease). N Engl J Med 2003; 349(9): 867.
16. Zuraw BL. Hereditary angioedema. N Engl J Med 2008; 359(10): 1027–1036.
17. Králičková P, Burešová E, Freiberger T et al. Hereditární angioedém – opomíjená diagnoza. Vnitř Lék 2010; 56(9): 927–931.
18. Zuraw BL, Busse PJ, White M et al. Nanofiltered C1 Inhibitor Concentrate for Treatment of Hereditary Angioedema. N Engl J Med 2010; 363(6): 513–522.
19. Cicardi M, Banerji A, Bracho F et al. Icatibant, a New Bradykinin-Receptor Antagonist, in Hereditary Angioedema. N Engl J Med 2010; 363(6): 532–541.
20. Cicardi M, Levy RJ, McNeil DL et al. Ecallantide for the Treatment of Acute Attacks in Hereditary Angioedema. N Engl J Med 2010; 363(6): 523–531.
21. Maurer M, Rosén K, Hsieh HJ et al. Omalizumab for the Treatment of Chronic Idiopathic or Spontaneous Urticaria. N Engl J Med 2013; 368(10): 924–935. Correction: N Engl J Med 2013; 368(24): 2340–2341.
22. Szturz P, Adam Z, Klabusay M et al. Schnitzlersyndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu. Vnitř Lék 2011; 57(1): 97–112.
23. Longhurst H, Cicardi M. Hereditary angio-oedema. Lancet 2012; 379(9814): 474–481.
24. Decker WW, Campbell RL, Manivannan V et al. The etiology and incidence of anaphylaxis in Rochester, Minnesota: a report from the Rochester Epidemiology Project. J Allergy Clin Immunol 2008; 122(6): 1161–1165.
25. Lin RY, Anderson AS, Shah SN et al. Increasing anaphylaxis hospitalizations in the first 2 decades of life: New York State, 1990–2006. Ann Allergy Asthma Immunol 2008; 101(4): 387–393.
26. Helbing A, Hurmi T, Mueller LR et al. Incidence of anaphylaxis with circulatory symptoms: a study over a 3-year period comprising 940.000 inhabitants of the Swiss Canton Bern. Clin Exp Allergy 2004; 34(2): 285–290.
27. Benkelfat R, Gouin S, Larose G et al. Medication Errors in the management of anaphylaxis in a pediatric emergency department. J Emerg Med 2013; 45(3): 419–425.
28. Nowak R, Farrar JR, Brenner JR et al. Customizing anaphylaxis guidelines for emergency medicine. J Emerg Med 2013; 45(2): 299–306.
29. Goldflam K, Silvers CT. Exercise-induced anaphylaxis as a cause of syncope. J Emerg Med 2012; 43(4): 651–654.
30. Moellman JJ, Bernstein JA. Diagnosis and management of hereditary angioedema: An emergency medicine perspective. J Emerg Med 2012; 43(2): 391–400.
31. Hassen GW, Kalantari H, Parraga M et al. Fresh Frozen Plasma for Progressive and Refractory Angiotensin-Converting Enzyme Inhibitor-induced Angioedema. J Emerg Med 2013; 44(4): 764–772.
32. Druey KM, Greipp PR. Narrative Review: The Systemic Capillary Leak Syndrome. Ann Intern Med 2010; 153(2): 90–98.
33. Winters ME, Rosenbaum S, Vilke GM et al. Emergency Department Management of Patients with ACE-inhibitor Angioedema. J Emerg Med 2013; 45(5):775–780.
34. Lewis LM. Angioedema: Etiology, Pathophysiology, Current and Emerging Therapies. J Emerg Med 2013; 45(5):789–796.
35. Gavorník P. Všeobecná angiológia. Angiologická propedeutika. Cievne choroby. Univerzita Komenského-Vydavateľstvo UK: Bratislava 2001. ISBN 80–223–1608–3.
36. Gavorník P. Angiológia pre všeobecných praktických lekárov. Flebológia. Dr. Josef Raabe: Bratislava 2013. ISBN 978–80–8140–083–4.
37. Nolan JP, Hazinski MF, Billi JE et al. 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Part 1 – Part 12. Resuscitation 2010. Dostupné z DOI: <http://doi: 10.1016/j.resuscitation.2010.08.022>.
38. Nolan JP, Soar J, Zideman DA et al (ERC Guidelines Writing Group). European Resuscitation Council Guidelines for Resuscitation 2010. Section 1 – Section 10. Resuscitation 2010; 81(10): 1219–1452.
39. Mundell WC, Kennedy CC, Szostek JH et al. Simulation technology for resuscitation training: a systematic review and meta-analysis. Resuscitation 2013; 84(9): 1174–1183.
40. Castells MC (ed). Anaphylaxis and Hypersensitivity Reactions. Humana Pr (Springer):New York 2011. ISBN 978–1-60327–950–5.
41. Hassen GW, Tu TJ, Wei DH et al. Does Angiotensin-Converting Enzyme Inhibitor Use Exacerbate Hereditary Angioedema? J Emerg Med 2013; 45(4): 602–608.
42. Siracusa MC, Kim BS, Spergel JM et al. Basophils and allergic inflammation. J Allergy Clin Immunol 2013; 132(4): 789–801.
43. Gavorník P, Gašpar Ľ, Dukát A. Nová klasifikácia, diagnóza a manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013). Anestéziol intenzívna med 2013; 2(2): 71–76.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 5-6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Význam stanovení natriuretických peptidů a prokalcitoninu u akutního srdečního selhání
- XVII International Congress on Nutrition and Metabolism in Renal Disease
- Rozlúčka s profesorom Ďurišom, nestorom Slovenskej internej medicíny
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



