-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oxidační stres u pacientů s onemocněním ledvin
Oxidative stress in kidney disease patients
Patients with chronic kidney disease are exposed to oxidative stress (OS) that contributes to deterioration of health. Decrease in renal excretory capacity contributes to the accumulation of pro-oxidative substances that are detrimental not only to kidney but to the whole organism including the cardiovascular system. Components of antioxidant system play an important role in the elimination of the OS. The monitoring of antioxidant levels and products of oxidative damage in these patients and the correct interpretation of relationship between these markers and the function of kidney and other organs may contribute to the more effective treatment and health improvement of the patients.
Key words:
reactive oxygen and nitrogen species – antioxidants – kidney – dialysis – transplantation – immunosuppressives
Autoři: J. Vostálová 1; A. Galandáková 1; P. Štrebl 2; J. Zadražil 2; M. Kajabová 3; P. Schneiderka 3
Působiště autorů: Ústav lékařské chemie a biochemie Lékařské fakulty UP Olomouc, přednostka prof. RNDr. Jitka Ulrichová, CSc. 1; III. interní nefrologická, revmatologická a endokrinologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Vlastimil Ščudla, CSc. 2; Oddělení klinické biochemie a imunogenetiky FN Olomouc, vedoucí oddělení doc. RNDr. Tomáš Adam, Ph. D. 3
Vyšlo v časopise: Vnitř Lék 2012; 58(3): 202-207
Kategorie: Přehledné referáty
Souhrn
Pacienti s chronickým onemocněním ledvin jsou vystaveni oxidačnímu stresu (OS), který se podílí na zhoršení zdravotního stavu. Snížená exkreční schopnost ledvin vede k akumulaci látek s prooxidačními vlastnostmi, které poškozují nejen ledviny, ale celý organizmus, včetně kardiovaskulárního systému. Jednotlivé složky antioxidačního systému hrají významnou roli v eliminaci OS. Právě sledování hladin antioxidantů a produktů OS u těchto pacientů a jejich správná interpretace ve vztahu k funkci ledvin a dalších orgánů, může přispět k zefektivnění jejich léčby a zlepšení zdravotního stavu.
Klíčová slova:
reaktivní formy kyslíku a dusíku – antioxidanty – ledviny – dialýza – transplantace – imunosupresivaÚvod
U nemocných s chronickým selháním ledvin je pozorován výrazný nárůst incidence kardiovaskulárních komplikací. Incidence kardiovaskulárních onemocnění je přibližně 10–20krát vyšší u nemocných s chronickým selháním ledvin v porovnání s běžnou populací. Kardiovaskulární komplikace jsou příčinou téměř 50–60 % úmrtí pacientů po transplantaci ledviny (TL) [1–4]. Na této skutečnosti se podílí celá řada rizikových faktorů (tab. 1), včetně netradičního rizikového faktoru oxidačního stresu (OS) [5,6].
Tab. 1. Faktory podílející se na rozvoji kardiovaskulárních onemocněních u pacientů s chronickým selháním ledvin. Upraveno podle [5]. ![Faktory podílející se na rozvoji kardiovaskulárních onemocněních u pacientů s chronickým selháním ledvin. Upraveno podle [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/024a5d50bfc34756e31906d63253f367.png)
Volné radikály a oxidační stres
Volné radikály (VR) jsou atomy nebo molekuly, které mají alespoň jeden orbital s jedním nepárovým elektronem. Vznikají ztrátou či přijetím elektronu, což je činí nestabilními a vysoce reaktivními. Radikály se snaží chybějící elektron doplnit nebo odevzdat reakcí s okolními molekulami, čímž dochází k tvorbě dalších radikálů. Řetězová reakce je ukončena, setkají-li se dva VR nebo setká-li se radikál s látkou, jejíž radikál je stabilnější a může přetrvávat delší dobu, aniž by reagoval s další molekulou ve svém okolí [7].
V organizmu vznikají 2 formy reaktivních sloučenin. Jedna forma je odvozena od kyslíku – reaktivní formy kyslíku (ROS) [8], druhá od dusíku – reaktivní formy dusíku (RNS) [9]. Mezi reaktivní formy kyslíku a dusíku (RONS) se řadí nejen VR, ale také sloučeniny, které samy radikály nejsou, ale mohou se podílet na jejich vzniku (tab. 2).
Tab. 2. Přehled reaktivních forem kyslíku a dusíku, jejich hlavní enzymatické zdroje. Upraveno podle [7,9]. ![Přehled reaktivních forem kyslíku a dusíku, jejich hlavní enzymatické zdroje. Upraveno podle [7,9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/938ff1ad170846791c6fbdcf21ad7bdd.png)
Na vzniku RONS se podílí řada faktorů, které můžeme rozdělit na exogenní a endogenní. Endogenními zdroji radikálů jsou: dýchací řetězec, metabolizmus endogenních a exogenních látek, syntéza prostaglandinů, aktivace bílých krvinek, fagocytóza, autooxidace thiolů, hyperglykemie, ischemie/reperfuze atd. Mezi exogenní zdroje řadíme ionizující a ultrafialové záření, intoxikace kovy, kouření, některá léčiva aj. [10]. K produkci VR přispívají atomy přechodných kovů (železo, měď, nikl, mangan, titan aj.), které, pokud nejsou vázány na bílkovinu, velmi ochotně reagují s peroxidem vodíku za vzniku ROS. Produktem této tzv. Fentonovy reakce je velmi reaktivní hydroxylový radikál (HO•) (obr. 1). HO• může reagovat s okolními makromolekulami a poškozovat je. Dalším produktem Fentonovy reakce je hydroxidový anion (OH¯), který je odstraňován činností nárazníkových systémů [10].
Obr. 1. Fentonova reakce [35]. Reakcí tranzitního kovu (např. dvojmocného železa) s peroxidem vodíku (peroxidy) vzniká velmi reaktivní, a tedy nebezpečný hydroxylový radikál (HO<sup>•</sup>) a hydroxidový anion (OH¯). ![Fentonova reakce [35]. Reakcí tranzitního kovu (např. dvojmocného železa) s peroxidem vodíku (peroxidy) vzniká velmi reaktivní, a tedy nebezpečný hydroxylový radikál (HO<sup>•</sup>) a hydroxidový anion (OH¯).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/85533a80ad65ddce1cea8ecb16674740.png)
RONS jsou pro funkci organizmu nezbytné a prospěšné, protože v nízkých koncentracích hrají roli signálních molekul a zapojují se např. do reakcí imunitního systému. Při infekci jsou součástí obranné mašinerie buňky. Stimulace leukocytů a makrofágů je spojena s aktivací NADPH-oxidázy, která katalyzuje syntézu superoxidového radikálu (obr. 2) [11]. Také radikál oxidu dusnatého (NO•) tvořený syntázou oxidu dusnatého je nezbytný pro funkci endotelu. Tento radikál však ochotně reaguje se superoxidovým radikálem za vzniku peroxynitritu (ONOO¯), který se podílí na modifikaci proteinů, lipidů a nukleových kyselin. Z peroxynitritu vzniká kyselina peroxynitritová (ONOOH), která se rozkládá na HO• a radikál oxidu dusičitého (NO2•), který oxiduje mastné kyseliny a modifikuje aminokyseliny. Snížení vnitrobuněčné hladiny NO• reakcí s O2•¯ vede k poruchám funkce endotelu a k ateroskleróze. ONOO¯ reaguje snadno s kyselinou chlornou, která je tvořena myeloperoxidázou, a vzniká chlorid nitrylu (NO2Cl) a NO2•, které oxidačně modifikují makromolekuly ve svém okolí [12]. Při vzestupu hladiny RONS dochází ke změně oxidoredukčního stavu buňky a ovlivnění signálních drah, např. signální dráhy řízené komplexem aktin-Keap 1 s jaderným faktorem Nrf2, která řídí syntézu některých antioxidačních enzymů a enzymů 2. fáze [13]. Za normálních fyziologických podmínek je mezi produkcí RONS a hladinou antioxidantů udržována rovnováha celou řadou proteinů a nízkomolekulárních látek. Při výrazné nadprodukci RONS dochází ke změnám, které mohou vyústit až ve smrt buňky. Stav způsobený nadměrnou tvorbou RONS a nedostatečnou schopností organizmu odstraňovat reaktivní meziprodukty se nazývá oxidační stres (OS) [14].
Obr. 2. Reakce katalyzovaná NADPH-oxidázou [35]. NADPH-oxidáza katalyzuje vznik superoxidu (O<sub>2</sub> <sup>•</sup>¯) jednoelektronovou redukcí kyslíku. ![Reakce katalyzovaná NADPH-oxidázou [35]. NADPH-oxidáza katalyzuje vznik superoxidu (O<sub>2</sub> <sup>•</sup>¯) jednoelektronovou redukcí kyslíku.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7973a882a82ad1110b5aa653edbc8f40.png)
Reakce reaktivních forem kyslíku a dusíku s biomolekulami
RONS jsou velice nestabilní a velmi reaktivní a mohou napadnout prakticky jakoukoli molekulu v lidském těle. Nejčastěji dochází k poškození nenasycených mastných kyselin fosfolipidů buněčných membrán (narušení funkce membrán), bílkovin (inaktivace enzymů, poškození transportních molekul, receptorů) a nukleových kyselin (změny genetické informace, mutace).
Lipidy
Poškození mastných kyselin (MK) působením VR nazýváme peroxidace lipidů. Cílem RONS jsou nejčastěji polynenasycené mastné kyseliny (PNMK). V průběhu peroxidace PNMK se vytváří dieny, hydroperoxidy a peroxidy, dochází ke štěpení modifikovaných PNMK a vzniku reaktivních strukturně rozmanitých derivátů uhlovodíků, např. alkanalů (malondialdehydu), alkenolů a jejich hydroxyderivátů (4-hydroxynonenalu) (obr. 3), které je možné sledovat nejen v tělních tekutinách [15], ale i ve vydechovaném vzduchu pacientů léčených dialýzou [16]. K oxidační modifikaci dochází také u lipoproteinů s nízkou hustotou (LDL), které se nazývají oxidované LDL (ox-LDL). Ox-LDL se podílí na poškození cévní stěny a časném stadiu aterosklerózy [17]. LDL částice mohou být také modifikovány kyselinou chlornou. Takto oxidačně modifikované LDL stimulují zánětlivou reakci vedoucí k narušení funkce endotelu [12]. Měření hladiny produktů oxidačního poškození lipidů se velmi často využívá k monitorování OS. Přehled parametrů OS je uveden v tab. 3 [18].
Obr. 3. Poškození mastných kyselin působením volných radikálů (peroxidace lipidů). Proces lipoperoxidace začíná odejmutím vodíkového atomu z metylenové skupiny polynenasycené mastné kyseliny (PNMK; např. působením HO<sup>•</sup>) za vzniku lipidového radikálu. Následně dochází k přesunu vazeb a vzniku konjugovaného dienu, který snadno reaguje s molekulárním kyslíkem za vzniku lipoperoxylového radikálu. Ten může reagovat s další PNMK za vzniku dienů, hydroperoxidů a peroxidů, které jsou dále štěpeny za vzniku reaktivních strukturně rozmanitých derivátů uhlovodíků, např. alkanalů (malondialdehydu), alkenolů a jejich hydroxyderivátů (4-hydroxynonenalu). 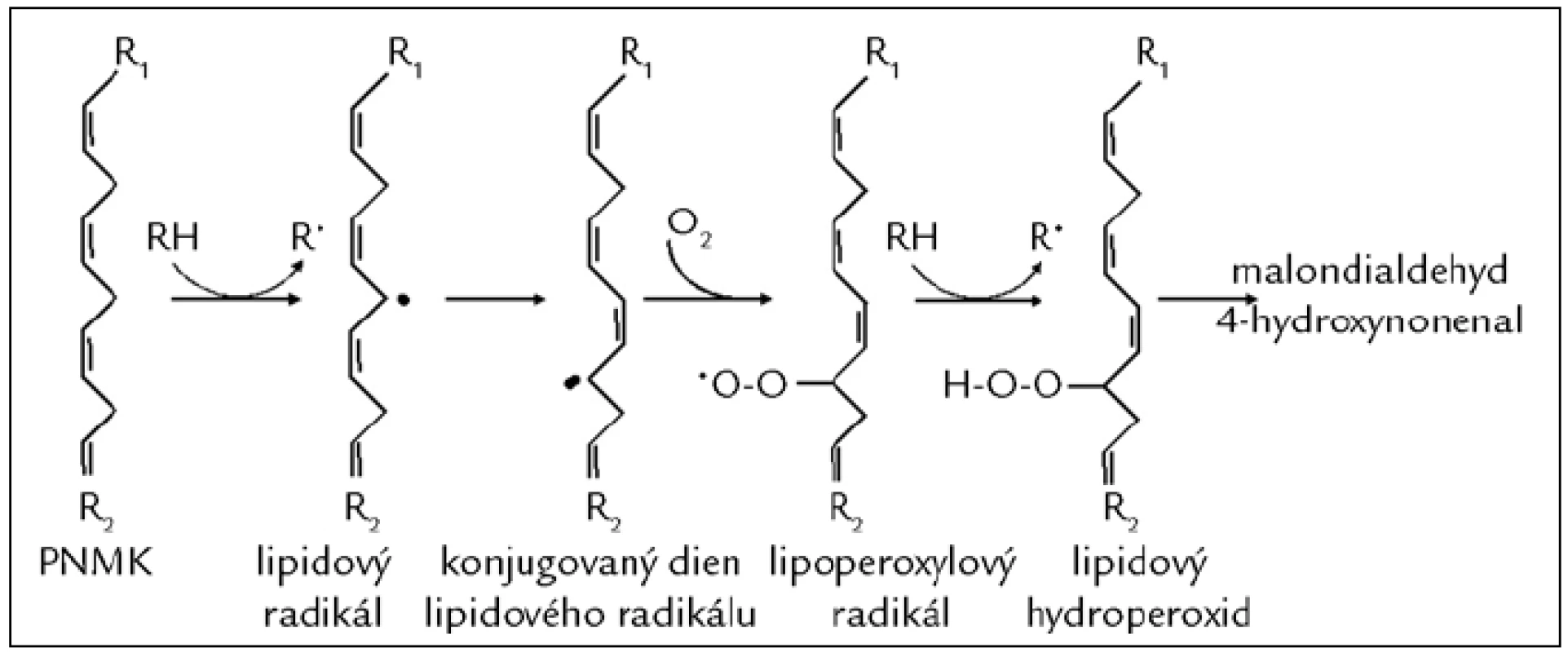
Tab. 3. Klinicky používané markery oxidačního stresu. Upraveno podle [18]. ![Klinicky používané markery oxidačního stresu. Upraveno podle [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/87b452fb3da3d76accb381ce60769571.png)
Proteiny
RONS reagují s proteiny a oxidačně je modifikují (modifikace postranních skupin aminokyselin, oxidace SH skupin, zesíťování peptidových řetězců), což má za následek změnu stability proteinů, např. zvýšený sklon k fragmentaci, nebo naopak rezistenci k proteolýze, tvorbě agregátů proteinů a změně jejich funkce [19]. Proteiny modifikované RONS se nazývají produkty pokročilé oxidace proteinů (AOPP) [20]. AOPP lze rozdělit na nízkomolekulární (převážně modifikovaný albumin) a vysokomolekulární (proteiny o velikosti nad 600 kD), které jsou tvořeny agregáty proteinů vznikajících z modifikovaných bílkovin. AOPP mají zvýšenou rezistenci k proteolytickému štěpení a snižují vazodilatační účinek NO•. AOPP indukují peroxidaci lipidů, syntézu prozánětlivých cytokinů a adhezivních molekul. Mají vysokou afinitu k receptoru pro pokročilé produkty glykace proteinů (RAGE). RAGE jsou exprimovány v ledvinách na povrchu endotelových a mezangiálních buněk a také buněk hladkého svalu a makrofágů. Po navázání AOPP na RAGE je aktivován nukleární faktor κB (NF-κB), což vede ke zvýšené expresi cytokinů, k tvorbě růstových faktorů, adhezivních molekul, syntéze kolagenu IV a fibronektinu a buněčné proliferaci [20,21].
U nemocných s chronickým selháním ledvin je množství oxidačně poškozených proteinů a AOPP výrazně zvýšeno a je považováno za ukazatel OS [22]. Některé bílkoviny, které se hromadí při uremii, se mohou stát základem pro vznik AOPP (např. β2-mikroglobulin) [23]. U pacientů v hemodialýze byla hladina oxidačně modifikovaných proteinů (karbonylovaných proteinů) signifikantně zvýšená v porovnání se zdravými jedinci [24,25]. Prodlužující se dobou hemodialyzačního léčení se jejich hladina zvyšuje [26]. AOPP mají afinitu k receptoru pro lipoproteiny o vysoké hustotě (HDL) třídy B typu I, čímž se podílí na sníženém vychytávání cholesterolu a vzniku abnormálních HDL lipoproteinů s proaterogenním účinkem, a tak dochází k zvýšení kardiovaskulárního rizika těchto pacientů [27].
Nukleové kyseliny
RONS poškozují také genetický materiál oxidační modifikací dusíkatých bazí, a to vznikem zlomů řetězců DNA a tvorbou aduktů. Tyto modifikace mohou vést ke změně exprese genů, přestavbě chromozomů, zastavení replikace atd. K odstranění poškozené DNA využívají buňky specifické a nespecifické opravné mechanizmy [28]. Pokud nedojde k opravení poškozené DNA, dochází ke vzniku mutací, což může vyústit až v karcinogenezi [29].
Všechny dusíkaté báze DNA mohou být oxidačně modifikovány. Nejsnáze je oxidován guanin. Reakcí s HO• vzniká 8-hydroxy-2’-deoxyguanosin (8-OH-dG), který je nejčastějším markerem využívaným pro sledování oxidačního poškození DNA [30]. Herman et al zjistili, že po hemodialýze dochází k nárůstu aktivity reparačních enzymů, což svědčí o schopnosti organizmu odstraňovat oxidačně poškozenou DNA [31]. S modifikací bazí dochází také ke vzniku zlomů v DNA, které je možné sledovat např. v lymfocytech dialyzovaných jedinců citlivou jednobuněčnou gelovou elektroforézou [32–34].
Antioxidační ochrana organizmu
Antioxidační ochrana organizmu, tzv. celková antioxidační kapacita (TAC), je soubor látek – antioxidantů a mechanizmů, které byly v lidském organizmu vyvinuty k odstraňování látek s prooxidačními vlastnostmi. TAC je tvořena strukturně různorodými látkami (vysokomolekulární a nízkomolekulární povahy), jejichž vzájemná souhra je nezbytná (tab. 4, obr. 4) [7].
Tab. 4. Hlavní součásti antioxidační kapacity. Upraveno podle [7]. ![Hlavní součásti antioxidační kapacity. Upraveno podle [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/70b9c7d5c36e22be4669500dae6a346c.png)
Obr. 4. Vzájemný vztah antioxidačních enzymů [35]. Kataláza (KAT), superoxiddismutáza (SOD), glutationreduktáza (GR), glutationperoxidáza (GPX), redukovaný glutation (GSH), oxidovaný glutation (GSSG). ![Vzájemný vztah antioxidačních enzymů [35]. Kataláza (KAT), superoxiddismutáza (SOD), glutationreduktáza (GR), glutationperoxidáza (GPX), redukovaný glutation (GSH), oxidovaný glutation (GSSG).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cb8883c274d7297f7d2bcd33e3541594.png)
Z vysokomolekulárních antioxidantů mají významnou funkci tyto vybrané enzymy: superoxiddismutáza (SOD), glutationperoxidáza (GPX), kataláza (KAT), glutationreduktáza (GR), glutationtranferáza (GST) a proteiny vázající tranzitní kovy (albumin, transferin, ferritin, laktoferin, haptoglobin, hemopexin, ceruloplasmin, metalothioneiny a další) [35]. SOD má 3 izoformy, a to cytoplazmatickou Cu/Zn-SOD, mitochondriální Mn-SOD a extracelulární SOD (vázaná na buněčné membrány) [36]. Všechny izoformy jsou tvořeny v ledvinách ve vysokém množství [12] a podílejí se na odstraňování superoxidového radikálu za vzniku peroxidu vodíku. Ten má relativně dlouhý biologický poločas a snadno difunduje membránami. Peroxid vodíku je odstraňován enzymy KAT a GPX. KAT ho štěpí na vodu a kyslík, zatímco GPX redukuje peroxid vodíku za současné oxidace redukovaného glutationu (GSH). Aby tento enzym mohl odstraňovat peroxid vodíku, je třeba regenerovat oxidovaný glutation na GSH reakcí katalyzovanou GR. GST katalyzuje především detoxifikační reakce elektrofilních organických látek (např. produktů peroxidace lipidů, 4-hydroxynonenalu) s GSH [35]. Vzájemný vztah antioxidačních enzymů znázorňuje obr. 4. Dalším důležitým antioxidačním mechanizmem, který se podílí na odstraňování ROS, je thioredoxinový systém tvořeným thioredoxinem, thioredoxinreduktázou a peroxiredoxinem. Tyto proteiny se hojně nachází v buňkách ledvinných kanálků. U pacientů se sníženou glomerulární filtrací bylo zjištěno, že se zvyšuje množství thioredoxinu spolu s C-reaktivním proteinem [37].
Z nízkomolekulárních antioxidantů má významný podíl na antioxidační ochraně plazmy (tělních tekutin) kyselina močová, která zajišťuje 35–65 % antioxidační kapacity. VR poskytují reakcí s kyselinou močovou urátový radikál, který je detoxikován reakcí s kyselinou askorbovou, nebo vzniká allantoin, který je považován za marker OS [38]. Kromě toho má kyselina močová schopnost vázat ionty železa a mědi, a tím bránit produkci nebezpečného HO• Fentonovou reakcí [39]. Paradoxně jsou však pacienti s hyperurikemií vystaveni OS. Kyselina močová má při vysokých koncentracích prooxidační a prozánětlivé účinky, stimuluje růst buněk hladkého svalstva, moduluje funkci endoteliálních buněk a přispívá k rozvoji hypertenze a kardiovaskulárních onemocnění [40,41]. U uremických pacientů a pacientů s chronickým onemocněním ledvin, kteří nejsou léčeni hemodialýzou, byly rovněž popsány změny hladiny GSH a antioxidačních enzymů [42,43]. Snížení hladiny kyseliny močové allopurinolem je provázeno zlepšením funkce ledvin u pacientů s chronickým selháním ledvin [44].
K nejdůležitějším intracelulárním nízkomolekulárním antioxidantům patří GSH. Jeho funkcí je odstraňování prakticky všech RONS, udržování sulfhydrylových skupin proteinů a peptidů v redukované formě, regenerování tokoferolu a askorbátu. GSH je nezbytným substrátem pro enzymatické reakce katalyzované GPX a GST a je regenerován GR. Alhamdani prokázal, že pacienti s uremií mají sníženou hladinu erytrocytárního GSH a zvýšenou hladinu malondialdehydu v porovnání se zdravou populací. Dále zjistil, že dochází k narušení syntézy GSH, protože aktivita klíčových enzymů biosyntézy γ–glutamylcysteinsyntetázy a glutationsyntetázy je snížena. Tyto změny byly pozorovány také u hemodialyzovaných pacientů a pacientů léčených peritoneální dialýzou, i když hladina GSH či aktivity enzymů glutamylcysteinsyntetázy a glutationsyntetázy nebyly jednorázovou dialýzou ovlivněny [45].
Poměr redukovaných a oxidovaných thiolů (-SH/-SS-) nízkomolekulárních a vysokomolekulárních látek ovlivňuje redoxní homeostázu v buňce. Změny v poměru -SH/-SS - jsou jedním z důležitých nástrojů, jak buňka reguluje enzymovou aktivitu, expresi proteinů a signální dráhy. K poklesu tohoto poměru dochází při zvýšené produkci RONS při OS. U pacientů s akutním nebo chronickým selháním ledvin bylo zjištěno, že albumin má zvýšené množství oxidovaných SH-skupin a má menší schopnost zapojit se do ochranných dějů buněk ledviny. Současně dochází k akumulaci homocysteinu a cysteinu, které negativně působí na endotel [12].
Stanovení antioxidační kapacity
Změny hladin nízkomolekulárních antioxidantů a změny exprese vysokomolekulárních antioxidantů, včetně aktivity antioxidačních enzymů, vyjadřují schopnost organizmu jako celku vyrovnat se s OS, což se odráží v hodnotách TAC. Stanovení TAC je ve většině případů založeno na schopnosti všech součástí biologického materiálu (nízkomolekulární a vysokomolekulární povahy) neutralizovat radikály, které jsou generovány různými chemickými reakcemi. Hodnota TAC se vztahuje ke standardní látce, kterou je nejčastěji ve vodě rozpustný derivát vitaminu E (6-hydroxy-2,5,7,8-tetrametylchroman-2-karboxylová kyselina; Trolox). Současně je vhodné provádět stanovení nízko - a vysokomolekulárních antioxidantů a prooxidantů pro monitorování OS. Tato stanovení jsou založena na fyzikálně-chemických vlastnostech těchto látek a využívá se celé řady laboratorních metodik [46,47]. Pro posouzení OS je vhodné stanovovat několik parametrů, jak antioxidační povahy, tak produktů OS, aby bylo možné získané výsledky co nejlépe interpretovat [48,49].
Také při onemocnění ledvin jsou stanovovány aktivity antioxidačních enzymů, hladiny nízko - a vysokomolekulárních antioxidantů a TAC tělních tekutin. Právě při onemocnění ledvin, kdy je narušena jejich exkreční schopnost a dochází k akumulaci nízkomolekulárních látek, např. kyseliny močové a produktů oxidačních reakcí, je hodnota TAC zkreslena. Proto je vhodné a nutné stanovovat nejenom hladiny TAC, ale i hladiny jednotlivých antioxidantů a ty korelovat s hladinami produktů OS, např. AOPP, a produkty peroxidace lipidů, aby interpretace získaných výsledků byla správná [50].
Závěr
Osoby s chronickým selháním ledvin mají vyšší riziko kardiovaskulárních onemocnění, které je jednou z hlavních příčin jejich úmrtí. Na tomto faktu se kromě celé řady faktorů významně podílí OS. Proto sledování TAC a parametrů OS, správná interpretace zjištěných dat a případná suplementace antioxidanty či zlepšení stravovacích návyků může výrazně přispět k zlepšení zdravotního stavu této skupiny osob.
Práce vznikla v rámci projektů IGA MZ ČR NS 9964/4 a MŠ ČR (MSM 6198959216).
Seznam použitých zkratek
- AOPP – produkty pokročilé oxidace proteinů
- GPX – glutationperoxidáza
- GR – glutationreduktáza
- GSH – redukovaný glutation
- GST – glutationtranferáza
- HDL – lipoprotein o vysoké hustotě
- HO• – hydroxylový radikál
- KAT – kataláza
- LDL – lipoprotein s nízkou hustotou
- MK – mastná kyselina
- NO• – oxid dusnatý
- NO2• – radikál oxidu dusičitého
- NO2Cl – chlorid nitrylu
- 8-OH-dG – 8-hydroxy-2’-deoxyguanosin
- ONOO¯ – peroxynitrit
- ONOOH – kyselina peroxynitritová
- OH¯ – hydroxidový anion
- OS – oxidační stres
- ox-LDL – oxidované LDL
- PNMK – polynenasycené mastné kyseliny
- RAGE – receptor pro pokročilé produkty glykace proteinů
- ROS – reaktivní formy kyslíku
- RONS – reaktivní formy kyslíku a dusíku
- RNS – reaktivní formy dusíku
- SOD – superoxiddismutáza
- TAC – celková antioxidační kapacita
- TL – transplantace ledvin
- VR – volné radikály
Ing. Adéla Galandáková, Ph.D.
http://medchemrs.upol.cz
e-mail: galandakova.a@seznam.cz
Doručeno do redakce: 13. 5. 2011
Přijato po recenzi: 10. 10. 2011
Zdroje
1. Levey AS, Beto JA, Coronado BE et al. Controlling the epidemic of cardiovascular disease in chronic renal disease: what do we know? What do we need to learn? Where do we go from here? National Kidney Foundation Task Force on Cardiovascular Disease. Am J Kidney Dis 1998; 32 : 853–906.
2. Dusilová Sulková S. Klinický význam cévního postižení u diabetiků s onemocněním ledvin – pohled neurologa. Vnitř Lék 2010; 56 : 351–355.
3. Zemánek D. Ischemická choroba srdeční a onemocnění ledvin. Kardiol Rev 2005; 4 : 191–194.
4. Yeo FE, Villines TC, Bucci JR et al. Cardiovascular risk in stage 4 and 5 nephropathy. Adv Chronic Kidney Dis 2004; 11 : 116–133.
5. Rucker D, Tonelli M. Cardiovascular risk and management in chronic kidney disease. Nat Rev Nephrol 2009; 5 : 287–296.
6. Himmelfarb J. Relevance of oxidative pathways in the pathophysiology of chronic kidney disease. Cardiol Clin 2005; 23 : 319–330.
7. Gutteridge JM. Lipid peroxidation and antioxidants as biomarkers of tissue damage. Clin Chem 1995; 41 : 1819–1828.
8. Babior BM. Superoxide: a two-edged sword. Braz J Med Biol Res 1997; 30 : 141–155.
9. Darley-Usmar V, Halliwell B. Blood radicals: reactive nitrogen species, reactive oxygen species, transition metal ions, and the vascular system. Pharm Res 1996; 13 : 649–662.
10. Racek J. Oxidační stres a možnosti jeho ovlivnění. Praha: Galén 2003.
11. DeLeo FR, Renee J, McCormick S et al. Neutrophils exposed to bacterial lipopolysaccharide upregulate NADPH oxidase assembly. J Clin Incest 1998; 101 : 455–463.
12. Himmelfarb J. Uremic toxicity, oxidative stress, and hemodialysis as renal replacement therapy. Semin Dial 2009; 22 : 636–643.
13. Kim HJ, Vaziri ND. Contribution of impaired Nrf2-Keap1 pathway to oxidative stress and inflammation in chronic renal failure. Am J Physiol Renal Physiol 2010; 298: F662–F671.
14. Sies H. Oxidative stress: oxidants and antioxidants. Exp Physiol 1997; 82 : 291–295.
15. Alhamdani MS, Al-Kassir AH, Jaleel NA et al. Elevated levels of alkanals, alkenals and 4-HO-alkenals in plasma of hemodialysis patients. Am J Nephrol 2006; 26 : 299–303.
16. Morena M, Delbosc S, Dupuy AM et al. Overproduction of reactive oxygen species in end-stage renal disease patients: a potential component of hemodialysis-associated inflammation. Hemodial Int 2005; 9 : 37–46.
17. Steinberg D, Parthasarathy S, Carew TE et al. Beyond cholesterol. Modifications of low-density lipoprotein that increase its atherogenicity. N Engl J Med 1989; 320 : 915–924.
18. Locatelli F, Canaud B, Eckardt KU et al. Oxidative stress in end-stage renal disease: an emerging threat to patient outcome. Nephrol Dial Transplant 2003; 18 : 1272–1280.
19. Zadák Z, Hyspler R, Tichá A et al. Antioxidants and vitamins in clinical conditions. Physiol Res 2009; 58: S13–S17.
20. Štípek S et al. Antioxidanty a volné radikály ve zdraví a v nemoci. Praha: Grada 2000.
21. Kalousová M, Zima T, Tesař V et al. Advanced glycoxidation end products in chronic diseases – clinical chemistry and genetic background. Mutat Res 2005; 579 : 37–46.
22. Descamps-Latscha B, Witko-Sarsat V. Oxidative stress in chronic renal failure and hemodialysis. Nephrologie 2003; 24 : 377–379.
23. Capeillere-Blandin C, Deleveau T, Descamps-Latscha B. Structural modification of human β2-microglobulin treated with oxygen-derived radicals. Biochem J 1991; 277 : 175–182.
24. Mitrogianni Z, Barbouti A, Galaris D et al. Oxidative modification of albumin in predialysis, hemodialysis, and peritoneal dialysis patients. Nephron Clin Pract 2009; 113 : 234–240.
25. Simmons EM, Langone A, Sezer MT et al. Effect of renal transplantation on biomarkers of inflammation and oxidative stress in end-stage renal disease patients. Transplantation 2005; 79 : 914–919.
26. Pupim LB, Himmelfarb J, McMonagle E et al. Influence of initiation of maintenance hemodialysis on biomarkers of inflammation and oxidative stress. Kidney Int 2004; 65 : 2371–2379.
27. Marsche G, Frank S, Hrzenjak A et al. Plasma-advanced oxidation protein products are potent high-density lipoprotein receptor antagonists in vivo. Circ Res 2009; 104 : 750–757.
28. Bertram C, Hass R. Cellular responses to reactive oxygen species-induced DNA damage and aging. Biol Chem 2008; 389 : 211–220.
29. Klaunig JE, Kamendulis LM, Hocevar BA. Oxidative stress and oxidative damage in carcinogenesis. Toxicol Pathol 2010; 38 : 96–109.
30. Valko M, Izakovic M, Mazur M et al. Role of oxygen radicals in DNA damage and cancer incidence. Mol Cell Biochem 2004; 266 : 37–56.
31. Herman M, Ori Y, Chagnac A et al. Spontaneous DNA repair increases during hemodialysis. Nephron Clin Pract 2008; 108: c188–c193.
32. Horoz M, Bolukbas FF, Bolukbas C et al. The association of circulating leptin level with peripheral DNA damage in hemodialysis subjects. Clin Biochem 2006; 39 : 918–922.
33. Kobras K, Schupp N, Nehrlich K et al. Relation between different treatment modalities and genomic damage of end-stage renal failure patients. Kidney Blood Press Res 2006; 29 : 10–17.
34. Stoyanova E, Sandoval SB, Zúñiga LA et al. Oxidative DNA damage in chronic renal failure patients. Nephrol Dial Transplant 2010; 25 : 879–885.
35. Racek J, Holeček V. Enzymy a volné radikály. Chem listy 1999; 93 : 774–780.
36. Matés JM, Pérez-Gómez C, Núñez de Castro I. Antioxidant enzymes and human diseases. Clin Biochem 1999; 32 : 595–603.
37. Tsuchikura S, Shoji T, Shimomura N et al. Serum C-reactive protein and thioredoxin levels in subjects with mildly reduced glomerular filtration rate. BMC Nephrol 2010; 11 : 7–13.
38. Kanďár R, Záková P. Allantoin as a marker of oxidative stress in human erythrocytes. Clin Chem Lab Med 2008; 46 : 1270–1274.
39. Kohen R, Nyska A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification. Toxicol Pathol 2002; 30 : 620–650.
40. Sánchez-Lozada LG, Nakagawa T, Kang DH et al. Hormonal and cytokine effects of uric acid. Curr Opin Nephrol Hypertens 2006; 15 : 30–33.
41. Lippi G, Montagnana M, Franchini M et al. The paradoxical relationship between serum uric acid and cardiovascular disease. Clin Chim Acta 2008; 392 : 1–7.
42. Puchades Montesa MJ, González Rico MA, Solís Salguero MA et al. Study of oxidative stress in advanced kidney disease. Nefrologia 2009; 29 : 464–473.
43. Romeu M, Nogues R, Marcas L et al. Evaluation of oxidative stress biomarkers in patients with chronic renal failure: a case control study. BMC Res Notes 2010; 3 : 20–26.
44. Siu YP, Leung KT, Tong MK et al. Use of allopurinol in slowing the progression of renal disease through its ability to lower serum uric acid level. Am J Kidney Dis 2006; 47 : 51–59.
45. Alhamdani MS. Impairment of glutathione biosynthetic pathway in uraemia and dialysis. Nephrol Dial Transplant 2005; 20 : 124–128.
46. Armstrong D. Advanced Protocols in Oxidative Stress I. New York: Springer 2008.
47. Armstrong D. Advanced Protocols in Oxidative Stress II. New York: Springer 2010.
48. Cao G, Prior RL. Comparison of different analytical methods for assessing total antioxidant capacity of human serum. Clin Chem 1998; 44 : 1309–1315.
49. Wayner DD, Burton GW, Ingold KU et al. Quantitative measurement of the total, peroxyl radical-trapping antioxidant capability of human blood plasma by controlled peroxidation. The important contribution made by plasma proteins. FEBS Lett 1985; 187 : 33–37.
50. Kuchta A, Pacanis A, Kortas-Stempak B et al. Estimation of Oxidative Stress Markers in Chronic Kidney Disease. Kidney Blood Press Res 2010; 34 : 12–19.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Castlemanova chorobaČlánek Sekundárne dyslipidémie
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Gen pro FTO a jeho role v genetické determinaci obezity – editorial
- Vývoj séroprevalencie hepatitídy C v rizikovej skupine drogovo závislých jedincov v rokoch 2004–2008 na Slovensku
- Zmeny krvného tlaku u chronicky hemodialyzovaných pacientov
- Přínos centralizace péče o pacienty s akutním krvácením do horního trávicího traktu
- Vitamin D – připomínka známých a přehled méně známých skutečností
- Oxidační stres u pacientů s onemocněním ledvin
- Gen pro FTO a jeho role v genetické determinaci obezity
- Castlemanova choroba
- Sekundárne dyslipidémie
- Androgenní deficit a diabetes
- Doporučení pro léčbu alemtuzumabem u chronické lymfocytární leukemie (CLL)
- Doporučený postup péče o nemocné s prediabetem
- Přínos PET-CT vyšetření pro rozhodování o léčbě lokalizované nodulární formy plicní AL-amyloidózy
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Castlemanova choroba
- Přínos PET-CT vyšetření pro rozhodování o léčbě lokalizované nodulární formy plicní AL-amyloidózy
- Gen pro FTO a jeho role v genetické determinaci obezity
- Zmeny krvného tlaku u chronicky hemodialyzovaných pacientov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



