-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kostní minerální denzita u nemocných s chronickým selháním ledvin při zahájení hemodialyzační léčby
Bone mineral density in patients with chronic renal failure at the start of haemodialysis therapy
Aim:
To determine bone mineral density (BMD) in nephrology patients at the start of haemodialysis therapy and its dependence on some laboratory and clinical characteristics of the study set.Methods:
There were 73 newly haemodialyzed patients accepted in the 3 months period from the beginning of the chronic haemodialysis program. Each patient underwent measurements BMD with DXA method in the area of lumbar spine and the left hip. Ca, P and parathormone values were measured once per month during 3 months before BMD determination. 25-OH vitamin D, estradiol and blood pH were determined only once before the densitometry examination.Results:
BMD in the osteoporosis zone was measured most often in the area of femoral neck in the whole group (prevalence 35 %) and also in the single groups of patients (men, women, non-diabetics, diabetics). In women, BMD findings corresponding to osteoporosis values in the total hip were significantly more often (p < 0.01). In the area of femoral neck and lumbar spine the percentage of women and men in single groups (osteoporosis, osteopenia and normal values) was without any statistical differentiation. Diabetics and non-diabetics did not distinguish in the number of findings osteoporosis and osteopenia in any followed areas of skeleton. As the significant factors predicating BMD there were found: calcium level and sex for the area of the total hip, calcium level, blood pH and height for the femoral neck, and sex for the lumbar spine only. The certain degree of vitamin D deficiency was measured in nearly all patients (mean 11.5 ± 7.4 µg/l), and hypocalcaemia was demonstrated in one fifth of patients.Conclusion:
Bone mineral density values and some laboratory parameters affecting bone metabolism are often abnormal in the patients entering the chronic haemodialysis program and must be taken into consideration.Key words:
bone mineral density – haemodialysis – osteoporosis – vitamin D – hypocalcaemia
Autoři: I. Valkovský 1,5; J. Tvrdík 6; Arnošt Martínek 1,5
; R. Olšanská 1; J. Dědochová 1; N. Petejová 1,5; Z. Švagera 2,5; M. Pernicová 3; Z. Čermáková 4,5
Působiště autorů: Interní klinika FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 1; Oddělení klinické biochemie Ústavu lékařské diagnostiky FN Ostrava, primář RNDr. Zdeněk Švagera, Ph. D. 2; Ústav radiodiagnostický FN Ostrava, přednosta doc. MUDr. Petr Krupa, CSc. 3; Krevní centrum FN Ostrava, primář MUDr. Zuzana Čermáková, Ph. D. 4; Lékařská fakulta Ostravské univerzity Ostrava, děkan doc. MUDr. Arnošt Martínek, CSc. 5; Přírodovědecká fakulta Ostravské univerzity Ostrava, děkan doc. PaedDr. Dana Kričfaluši, CSc. 6
Vyšlo v časopise: Vnitř Lék 2012; 58(11): 817-824
Kategorie: Původní práce
Souhrn
Cíl:
Stanovit kostní minerální denzitu (BMD) u nefrologických pacientů v době zahájení hemodialyzační léčby a její závislost na některých laboratorních a klinických charakteristikách souboru.Metodika:
Do studie bylo zařazeno 73 incidentně dialyzovaných pacientů v období do 3 měsíců od zahájení chronického hemodialyzačního programu. U každého pacienta jsme provedli měření BMD metodou DXA v oblasti bederní páteře a levé kyčle. Hodnoty Ca, P a parathormonu byly měřeny 1krát měsíčně v průběhu 3 měsíců před stanovením BMD. 25-OH vitamin D, estradiol a pH krve byly stanoveny jednorázově před denzitometrickým vyšetřením.Výsledky:
BMD v pásmu osteoporózy byla nejčastěji naměřena v oblasti krčku femuru, a to v celém souboru (prevalence 35 %), a také v jednotlivých skupinách pacientů (ženy, muži, nediabetici, diabetici). Ženy měly významně častější nález BMD odpovídající hodnotám pro osteoporózu v oblasti celkového proximálního femuru (p < 0,01). V oblasti krčku femuru a bederní páteře bylo procento žen a mužů v jednotlivých skupinách (osteoporóza, osteopenie a normální hodnoty) bez statisticky významné odlišnosti. Diabetici a nediabetici se četností nálezů osteopenie a osteoporózy nelišili ani v jedné ze sledovaných oblastí skeletu. Jako významné faktory predikující BMD byly nalezeny: pro oblast celkového proximálního femuru hladina vápníku a pohlaví, pro krček femuru hladina vápníku, pH krve a tělesná výška, pro bederní páteř jen pohlaví. Téměř u všech pacientů byl naměřen určitý stupeň deficitu vitaminu D (průměr 11,5 ± 7,4 µg/l) a u 1/5 pacientů byla prokázána hypokalcemie.Závěr:
Hodnoty kostní minerální denzity a některých laboratorních parametrů ovlivňujících kostní metabolizmus jsou u pacientů vstupujících do chronického hemodialyzačního programu často abnormální a je třeba jim věnovat pozornost.Klíčová slova:
kostní minerální denzita – hemodialýza – osteoporóza – vitamin D – hypokalcemieÚvod
Nemocní s chronickým onemocněním ledvin (CKD) mají významné odchylky v kostním a minerálovém metabolizmu, jenž jsou dnes označovány jako minerálová a kostní porucha při chronickém onemocnění ledvin (Chronic Kidney Disease – Mineral and Bone Disorder, zkráceně CKD-MBD). Progresivní ztráta renálních funkcí vede k řadě poruch minerálového metabolizmu, které nakonec vedou k poškození kostí a kalcifikacím měkkých tkání včetně kalcifikací kardiovaskulárních. Poslední studie ukazují, že existuje silná asociace mezi změnou kostního a minerálového metabolizmu, frakturami a kardiovaskulárním postižením, jež je hlavní příčinou mortality u pacientů s CKD [1].
Při poklesu glomerulární filtrace pod 1 ml/s, tedy od 3. stadia CKD, nastává význačný pokles kostní minerální denzity [2]. Pokles kostní minerální denzity u CKD může být zajisté způsoben specifickým onemocněním těchto nemocných, tedy renální osteopatií, ale i na tyto pacienty působí faktory vedoucí ke vzniku osteoporózy v obecné populaci. Více než 1/2 dialyzovaných nemocných je ve věku nad 60 let. V tomto věku již nastávají nemoci a poruchy spojené se stářím, včetně osteoporózy. Ženy se selháním ledvin mají menopauzu v průměru o 4 roky dříve a porucha steroidních hormonů (deficit estrogenu) je u nich pravidlem. U mužů se selháním ledvin klesá koncentrace testosteronu. Všechny jmenované faktory jsou predispozicí pro osteoporózu [3].
V obecné populaci se diagnóza osteoporózy obvykle opírá o stanovení kostní minerální denzity (BMD) a osteoporóza je pro postmenopauzální ženy a muže nad 50 let definována hodnotou BMD nižší než –2,5 směrodatné odchylky T-skóre [4]. U populace nemocných s chronickým onemocněním ledvin je však hodnocení příčiny poklesu kostní minerální denzity obtížné. Osteoporóza může provázet poruchu kostního metabolizmu u chronického onemocnění ledvin [5]. CKD-MBD tedy významně komplikuje standardní diagnostiku osteoporózy pomocí kostní denzitometrie u nefrologických nemocných [6].
Cílem naší studie bylo stanovit kostní minerální denzitu u nefrologických nemocných v době zahájení hemodialyzační léčby a její závislost na některých laboratorních a klinických charakteristikách souboru.
Medotika
Soubor nemocných
Do studie bylo zařazeno 73 klinicky stabilních pacientů v 5. stadiu chronického onemocnění ledvin (GF < 0,25 ml/s/1,73 m2) nově vstupujících do hemodialyzačního programu. Průměrný věk nemocných byl 65,8 let (SD 14,2 let; věkové rozpětí 19–87 let). 8 pacientů bylo ve věku pod 50 let, 65 pacientů nad 50 let (z nich 30 nad 70 let).
Průměrný věk žen (N = 27) byl 66,5 let (SD 15,7) a nelišil se statisticky významně od věku mužů (N = 46; průměrný věk 65,3 let, SD 13,4).
V souboru bylo 32 diabetiků (2. typu), průměrného věku 70 let (SD 12,4), nediabetiků bylo 41 a jejich průměrný věk 62,5 let (SD 14,8) se významně lišil od věku diabetiků (p < 0,01).
Charakteristika souboru nemocných týkající se hmotnosti, výšky a body mass indexu (BMI) je uvedena v tab. 1. Mezi skupinami žen a mužů byl statisticky významný rozdíl v hmotnosti a výšce, nikoliv však v BMI. Skupiny nediabetiků a diabetiků se hmotností, výškou ani BMI významně nelišily. Nikdo z pacientů neměl v anamnéze osteoporotickou frakturu.
Tab. 1. Charakteristika souboru nemocných dle hmotnosti, výšky a body mass indexu (BMI). 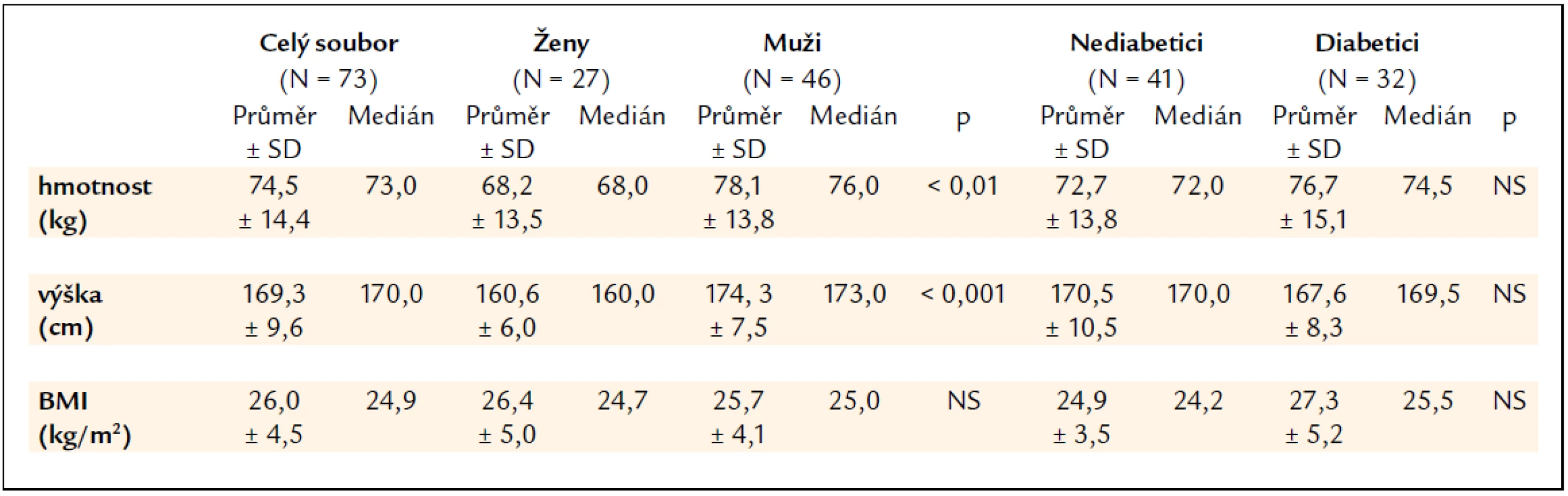
Nejčastější diagnózou renálního onemocnění byla diabetická nefropatie (21krát), následovaly vaskulární nefropatie (17krát), chronická glomerulonefritida (14krát), intersticiální nefritida (9krát), polycystóza ledvin (4krát) a systémová vaskulitida (3krát). Jiné diagnózy byly zastoupeny 5krát. Diabetická nefropatie byla příčinou selhání ledvin u 66 % diabetiků v souboru, u 34 % diabetiků byla příčina jiná, nejčastěji vaskulární nefropatie (19 %).
Studie byla schválena Etickou komisí FN Ostrava, všechny sledované osoby vyjádřily informovaný souhlas s účastí ve studii.
Materiál
Odběr krve pro laboratorní vyšetření byl proveden vždy nalačno. V období před zařazením do hemodialyzačního programu byl odběr proveden ze žíly, po zařazení do hemodialyzační léčby ze zavedené dialyzační jehly bezprostředně před 1. hemodialýzou v týdnu. Materiál byl zpracován standardním způsobem. Sérum bylo získáno centrifugací v chlazené centrifuze (4 °C, 2 500 g, 6 min). Všechny sledované parametry byly stanoveny na Oddělení klinické biochemie FN Ostrava.
Laboratorní metody
Celkový vápník, fosfáty a intaktní parathormon (iPTH) byly měřeny opakovaně, a to 1krát měsíčně v průběhu 3 měsíců před stanovením kostní minerální denzity a k dalšímu hodnocení byl použit průměr těchto 3 hodnot. Ostatní laboratorní parametry (25-OH vitamin D, estradiol a pH krve) byly stanoveny jednorázově před denzitometrickým vyšetřením. Koncentrace iPTH (intaktní parathormon 1-84 + jeho fragment 7-84 s 44,8% zkříženou reaktivitou) byla stanovena metodou enzymoimunoanalýzy na přístroji Immulite 2500 (DPC, Los Angeles, USA). Na přístroji AU 2700 (Beckman Coulter Inc., USA) byly stanoveny koncentrace celkového vápníku a fosfátů. Metodou radioimunoanalýzy byly stanoveny koncentrace estradiolu (Orion Diagnostica, Finsko) a celkového 25-OH vitaminu D, tzn. sumární výsledek D2 a D3 derivátu (DiaSorin Inc., USA). Acidobazická rovnováha (pH krve) byla stanovena na přístroji Radiometer ABL 835 FLEX (Radiometer Medical ApS, Denmark).
Stanovení kostní materiální denzity
Stanovení BMD (bone mineral density) jsme provedli u každého pacienta v období do 3 měsíců od zahájení chronického hemodialyzačního programu. K měření byl použit kostní denzitometr QRD-2000 firmy Hologic pracující na bázi měření absorpce duální energie RTG paprsků (DXA). Výsledky byly vyjádřeny v absolutních hodnotách (g/cm2) a dále jako T-skóre a Z-skóre. Naměřené hodnoty BMD u pacienta byly srovnány s referenčními hodnotami denzity kostního minerálu pro mladého zdravého jedince stejného pohlaví (T-skóre) a referenčními hodnotami pro stejný věk a pohlaví (Z-skóre). Srovnání je vyjádřeno jak velikostí směrodatné odchylky (SD), tak v procentech. Referenční databáze byla vytvořena firmou Hologic na základě 1 000 měření lumbální páteře (650 žen, 350 mužů) a přes 1 400 měření kyčlí (750 žen, 730 mužů) zdravých dobrovolníků. BMD jsme hodnotili ve 2 oblastech centrálního skeletu, a to v oblasti bederní páteře (v rozsahu obratlů L1–L4) a v oblasti levé kyčle (v krčku femuru a celkovém proximálním femuru).
Statistická analýza
Hodnoty sledovaných parametrů jsou vyjádřeny jako medián a průměr ± ± směrodatná odchylka. Významnost rozdílu mezi skupinami byla hodnocena pomocí dvouvýběrového Wilcoxonova testu, shoda zastoupení osteoporózy a osteopenie (tab. 4) pomocí χ2 testu. Modely závislosti BMD na sledovaných faktorech byly vyhledávány pomocí krokové regrese a algoritmu hledání nejlepší podmnožiny regresorů mezi modely prvního řádu. Mezi potenciální regresory, mezi kterými byly vyhledávány zdroje lineární závislosti, byly zařazeny i dichotomické (0, 1) veličiny – pohlaví a diabetes.
Ke statistické analýze byl užit statistický software NCSS (Hintze J., 2001, NCSS and PASS, Number Cruncher Statistical System, Kaysville, Utah, WWW.NCSS.COM).
Výsledky
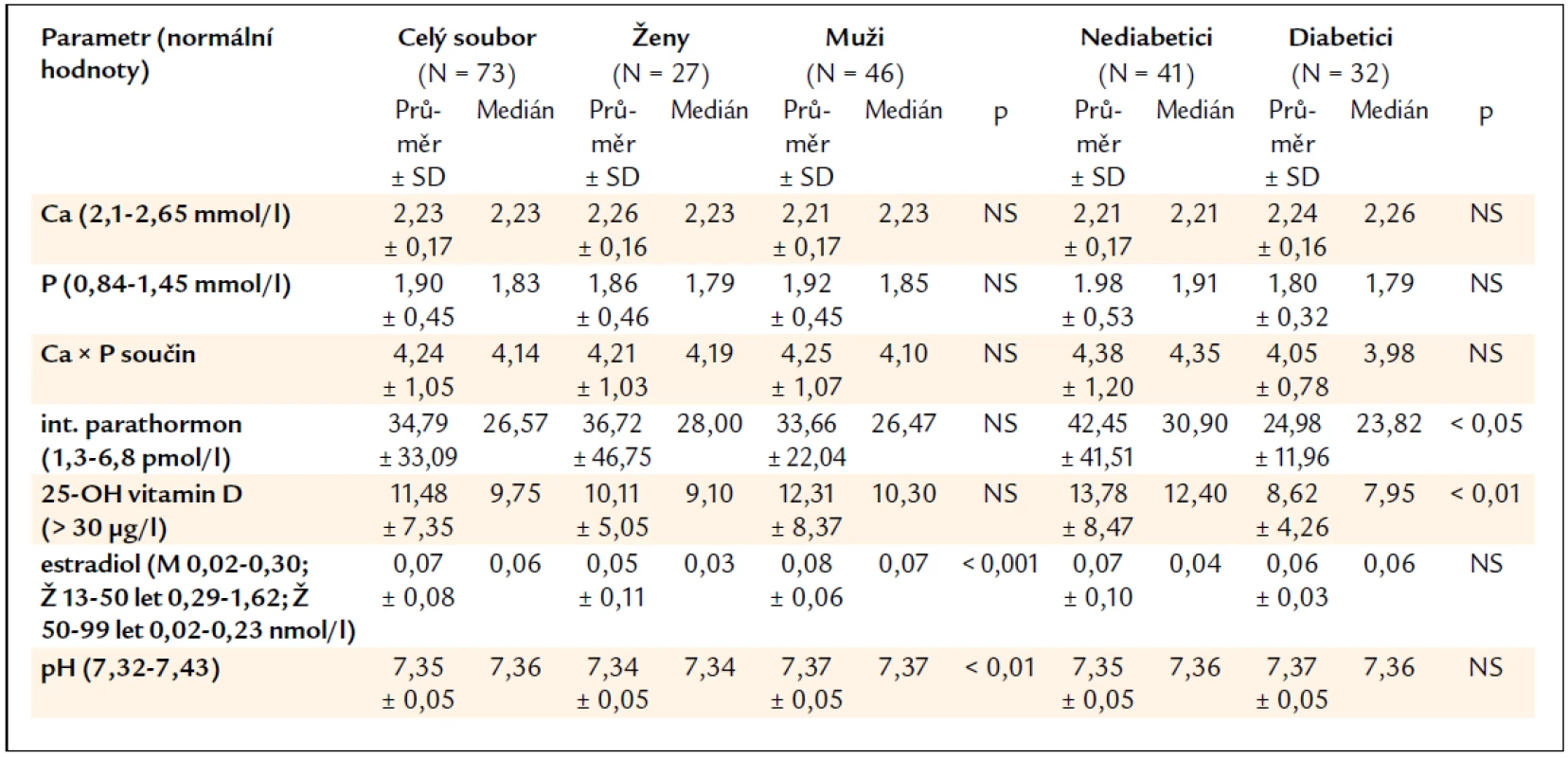
Hodnoty sledovaných laboratorních parametrů (vápníku, fosfátů, kalcium--fosfátového součinu, intaktního parathormonu, 25-OH vitaminu D, estradiolu a pH krve) jsou uvedeny v tab. 2.
Skupina žen se od skupiny mužů statisticky významně lišila jen v hladině estradiolu (vyšší hodnoty u mužů, 89 % žen bylo totiž postmenopauzálních) a pH krve (opět vyšší hodnoty u mužů, v obou skupinách ale byly průměrné hodnoty pH v mezích normy).
Skupina nediabetiků a skupina diabetiků se v laboratorních parametrech významně lišila pouze v hodnotách intaktního parathormonu (nižší hodnoty u diabetiků) a 25-OH vitaminu D (také zde nalezeny nižší hodnoty u diabetiků).
V rámci celého souboru pacientů byl vápník pod dolní hranicí normy u 19 % nemocných a normální u ostatních (kromě 1 pacienta s mírně zvýšenou hodnotou kalcemie).
Fosfor byl zcela v normě (pod 1,45 mmol/l) u 15 % pacientů, mírně zvýšené hodnoty (do 1,78 mmol/l) mělo 27 % souboru a zbývajících 58 % pacientů mělo fosfor nad tuto hodnotu.
Nízké hodnoty intaktního parathormonu (< 16,5 pmol/l) byly naměřeny u 22 % pacientů, střední hodnoty (16,5–33,0 pmol/l ) u 42 % a vysoké hodnoty (> 33,0 pmol/l ) u 36 % pacientů v souboru.
Těžký deficit 25-OH vitaminu D pod 5 µg/l mělo 17 % pacientů, střední deficit (od 5 do 16 µg/l) 61 % pacientů a mírný deficit (od 16 do 30 µg/l) 18 % hemodialyzovaných nemocných. Normální hladiny kalcidiolu (nad 30 µg/l) byly nalezeny jen u 4 % pacientů (u 3 mužů, nediabetiků).
Rozdělení hodnot P, iPTH a stupně deficitu kalcidiolu vychází z doporučení K/DOQI [7].
Naměřená průměrná hodnota estradiolu odpovídala složení souboru, tedy souboru složeného z mužů a převážně postmenopauzálních žen.
Hodnoty pH byly v normě u 75 % pacientů, 21 % souboru mělo hodnotu pH v pásmu acidózy a 4 % v pásmu alkalózy.
Nálezy kostní denzitometrie v celém souboru a skupině žen, mužů, nediabetiků a diabetiků jsou uvedeny v tab. 3. Skupina žen a mužů se statisticky významně lišila v hodnotách kostní minerální denzity vyjádřené v g/cm2 (nižší hodnoty u žen), a to ve všech sledovaných oblastech skeletu, tedy bederní páteři, krčku femuru i celkovém proximálním femuru. V oblasti celkového proximálního femuru se navíc skupina žen a mužů lišila také v hodnotách kostní denzity vyjádřené jako T-skóre. Mezi skupinou nediabetiků a diabetiků nebyl v žádné z měřených oblastí prokázán statisticky významný rozdíl v parametrech kostní minerální denzity.
Tab. 3. Nálezy kostní denzitometrie v celém souboru a skupinách žen, mužů, nediabetiků a diabetiků. 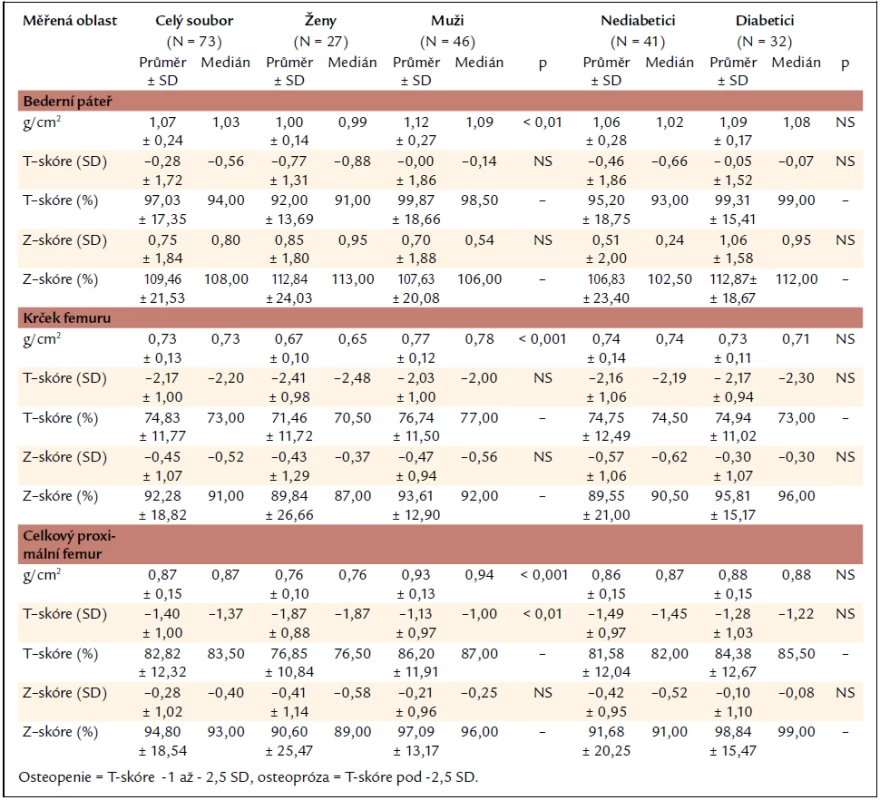
Při hodnocení nálezů kostní minerální denzity vyjádřené jako T-skóre a rozčlenění pacientů do skupin dle hodnot odpovídajících osteoporóze, osteopenii a normálním hodnotám (tab. 4) nacházíme nejčastěji osteoporotické hodnoty T-skóre v oblasti krčku femuru, nejméně často pak v bederní oblasti. Tento nález platí pro celý soubor i jednotlivé skupiny pacientů (ženy, muži, nediabetici, diabetici). Skupiny žen a mužů se statisticky významně liší v četnosti nálezů kostní minerální denzity v pásmu osteoporózy v oblasti celkového proximálního femuru (častější výskyt u žen). V oblasti bederní páteře a krčku femuru je procento žen a mužů v jednotlivých skupinách (osteoporotické, osteopenické a normální hodnoty) bez statisticky významné odlišnosti. Nediabetici se od diabetiků ve výskytu osteopenických a osteoporotických hodnot BMD neliší ani v jedné ze sledovaných oblastí skeletu.
Tab. 4. Procentuální zastoupení nálezů kostní minerální denzity odpovídajících osteoporóze, osteopenii a normální denzitě. 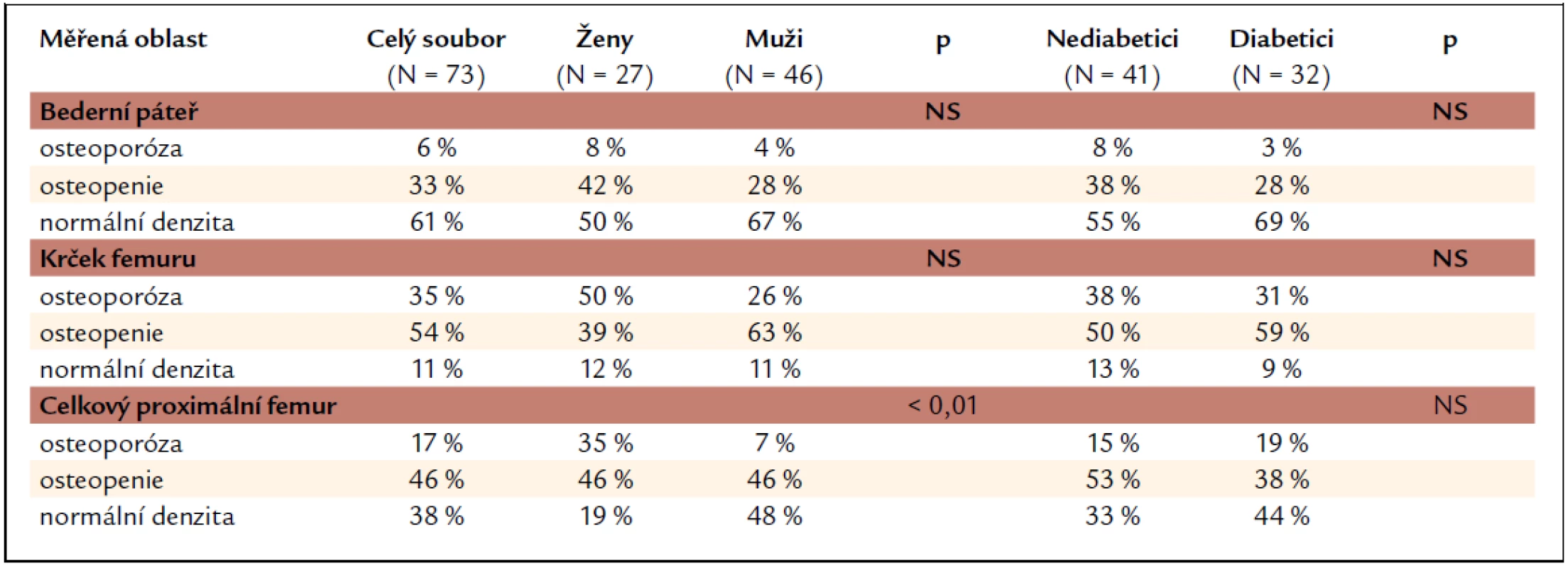
Prevalence osteoporotických hodnot kostní minerální denzity ve věkových skupinách nad 50 let, 50–70 let a nad 70 let je uvedena v tab. 5. Ve věkové skupině do 50 let, která v tabulce není uvedena, bylo jen 8 nemocných (5 mužů a 3 ženy) a pouze 1 žena měla osteoporotické hodnoty BMD.
Tab. 5. Prevalence osteoporotických hodnot kostní minerální denzity u pacientů starších 50 let. 
Modely lineární závislosti kostní minerální denzity na sledovaných laboratorních parametrech, pohlaví a přítomnosti diabetu identifikovaly v oblasti celkového proximálního femuru jako významné faktory predikující kostní minerální denzitu hladinu vápníku a pohlaví, v oblasti krčku femuru pak hladinu vápníku, pH krve a tělesnou výšku. Pro oblast bederní páteře nebyl kromě pohlaví žádný statisticky významný faktor predikující hodnotu kostní minerální denzity nalezen.
Diskuze
U diabetiků byly naměřeny nižší hodnoty intaktního parathormonu. Nižší hodnoty parathormonu a nízký kostní obrat jsou u diabetiků obvyklým nálezem [8,9]. Diabetik v dialyzačním programu je ohrožen spíše adynamickou osteopatií než hyperparatyreózou, hlavním důsledkem poruchy fosfokalciového metabolizmu u těchto pacientů je akcelerované riziko cévních změn, což je zejména negativní pro již samotné důsledky diabetu na cévní systém [10].
Diabetici měli oproti nediabetikům také nižší hladiny 25-OH vitaminu D. Hladiny vitaminu D bývají podle některých studií u diabetiků nižší [10,11]. Z dosud provedených studií nelze učinit jednoznačný závěr, ale vzhledem k vysoké prevalenci hypovitaminózy D v běžné populaci je možné, že se jedná o asociaci nezávislých jevů [12].
Laboratorní hodnoty prokázaly nízkou hodnotu kalcemie u 1/5 pacientů, což poukazuje na nedostatečnou korekci hladin vápníků u části pacientů v období před a na začátku hemodialyzačního programu. Hypokalcemie je jedním z hlavních podnětů vedoucích ke zvýšené činnosti příštítných tělísek s následným zvýšením kostního obratu. Nízké hladiny kalcia jsou navíc asociovány s vyšší mortalitou hemodialyzovaných pacientů [13].
Určitý stupeň deficitu 25-OH vitaminu D byl nalezen téměř u všech našich pacientů. Stanovení 25-OH vitaminu D v krvi se považuje za ukazatel zásob vitaminu D v organizmu. Nedostatek vitaminu D má u pacientů s chronickým onemocněním ledvin vysokou prevalenci. Vyšší hladiny vitaminu D jsou přitom spojeny se signifikantně lepším přežíváním CKD pacientů [14]. Nedostatek nativního vitaminu D je u pacientů s CKD jednou z příčin poklesu koncentrace aktivního vitaminu D (kalcitriolu). Důsledkem nedostatku kalcitriolu je (mimo jiné) snížení střevního vstřebávání vápníku, hypokalcemie a sekundární hyperparatyreóza. Suplementace nativním vitaminem D (ergo - nebo cholekalciferolem) vede k významné úpravě hladin 25-OH vitaminu D a poklesu hladin parathormonu při nízké incidenci hyperkalcemie a hyperfosfatemie [15].
U 4 % pacientů naměřené pH v pásmu alkalózy bylo způsobeno neadekvátní dávkou perorálního bikarbonátu sodného.
Nižší hodnoty BMD u žen a vyšší výskyt osteoporózy u starších pacientů v našem souboru jsou v souladu s nálezy v obecné populaci [16–18].
Prevalence nálezů kostní minerální denzity v pásmu osteoporózy byla u našich pacientů vysoká (tab. 5). U obecné kanadské populace byla osteoporóza ve věkové kategorii 50–70 let zjištěna u 8,6 % a ve věku nad 71 let u 20,3 % populace [16]. V dánské celostátní studii byla prevalence osteoporózy 40,8 % u žen a 17,7 % u mužů starších 50 let [18]. V České republice osteoporóza postihuje 33 % žen a 15 % mužů ve věku nad 50 let a 47 % žen a 39 % mužů ve věku nad 70 let [19]. Metaanalýza denzitometrických studií u dialýzovaných pacientů publikovaná v doporučeních KDIGO ukázala, že v oblasti bederní páteře jsou nálezy BMD obdobné jako u běžné populace, ale v oblastech s větším podílem kortikální kosti (proximální femur, předloktí, celotělové měření) je kostní minerální denzita při srovnání s běžnou populací nižší (Z-skóre je v záporných hodnotách) [20]. To odpovídá i našim nálezům, kdy v krčku a celkovém proximálním femuru je Z-skóre nižší a v oblasti bederní páteře v našem souboru dokonce vyšší (tab. 3). U pacientů se sekundární hyperparatyreózou je totiž postižena především kost kortikální. Navíc hodnoty kostní minerální denzity v oblasti bederní páteře mohou být nadhodnoceny, především z důvodu častých aortálních kalcifikací. Stanovení denzity v oblasti kyčle a předloktí je proto u pacientů s CKD považováno za přesnější [21].
V naší studii nebyly nalezeny rozdíly mezi kostní minerální denzitou diabetiků a nediabetiků. Výsledky studií zabývajících se hodnotami BMD u diabetiků jsou nekonzistentní. Recentní metaanalýza 15 observačních studií zahrnujících celkem 3 437 diabetiků a 19 139 nediabetiků nicméně prokázala signifikantně vyšší hodnoty BMD (g/cm2) u diabetiků 2. typu oproti nediabetikům v oblasti kyčle i páteře [22].
V modelech lineární závislosti jsme nalezli několik faktorů predikujících kostní minerální denzitu pro některou z měřených oblastí. Vyšší hodnoty BMD u mužského pohlaví nejsou překvapující. V našem souboru nalezená pozitivní závislost mezi BMD a hladinou vápníku však v některých studiích zabývajících se touto problematikou zjištěna nebyla [23–25]. Hypokalcemie ale, jak již bylo zmíněno, zvyšuje aktivitu příštítných tělísek a může být projevem osteomalacie. Oba tyto stavy mají negativní vliv na množství kostního minerálu. Námi zjištěná pozitivní korelace mezi tělesnou výškou a BMD je ve studiích zabývající se touto problematikou nalézána nekonzistentně. Naproti tomu malá tělesná hmotnost je prokazatelně rizikovým faktorem pro nízkou kostní minerální denzitu [26,27]. Co se týče námi nalezené negativní závislosti mezi pH krve a BMD, je nutno vzít v úvahu, že pH bylo v našem souboru měřeno jen jednorázově. Je však známo, že acidóza působí negativně ve vztahu ke kostnímu minerálu a kostní struktuře několika mechanizmy: zvyšuje aktivitu osteoklastů a zvyšuje i koncentraci PTH, navíc při acidóze kost působí jako „pufr“ s následkem demineralizace skeletu [28].
Riziko fraktur lze v obecné populaci poměrně dobře odhadnout na podkladě měření BMD. Snížení BMD o 1 SD znamená přibližně 2,2krát vyšší riziko následné zlomeniny. WHO doporučuje hodnocení absolutního rizika zlomenin v následujících 10 letech pomocí nástroje FRAX® WHO Fracture Risk Assessment Tool, kde je možné zadat výsledky BMD v krčku stehenní kosti [29,30]. Praktickým využitím stanovení BMD v obecné populaci je tedy odhad rizika fraktur vedoucí v indikovaných případech k terapeutické aktivitě s následným monitorováním pomocí kontrolních měření BMD.
U pacientů s chronickým onemocněním ledvin je situace v hodnocení změn BMD, stanovení rizika fraktur i léčebných možnostech podstatně méně přehledná. Fraktury kostí jsou přitom u dialyzovaných pacientů časté. Dle dat z USA je u dialyzovaných při srovnání s běžnou populací 4,4krát vyšší výskyt fraktury krčku femuru [31].
Nálezy korelací hodnot BMD k riziku fraktur u CKD populace jsou nekonzistentní. Několik studií nicméně prokázalo prediktivní hodnotu pro vznik fraktury při měření BMD v oblasti distálního předloktí [6]. Většina studií u dialyzovaných pacientů neprokázala rozdíly v kostní minerální denzitě měřené v oblasti femuru a páteře mezi pacienty s frakturami a bez fraktur, ale kostní minerální denzita distálního předloktí nebo celotělová byla často nižší u pacientů se zlomeninami [32]. Bylo by však naivní domnívat se, že samotné vyšetření DXA může postihnout všechny faktory spojené s kostní fragilitou u dialyzační populace [33]. Doporučení KDIGO uvádějí, že u pacientů ve stadiích CKD 3–5 nálezy kostní denzitometrie nepredikují riziko fraktur, tak jak je tomu u obecné populace [20].
Závažným problémem klinické praxe je rozhodnutí, zda pacienty s chronickým onemocněním ledvin a sníženou kostní minerální denzitou do pásma osteoporózy (zvláště při výskytu fraktur) léčit stejně jako osteoporotické pacienty s normální funkcí ledvin. U pacientů ve stadiu CKD 1–3 při absenci biochemických abnormalit upozorňujících na CKD-MBD lze osteoporózu diagnostikovat podle běžných doporučení a použít standardní farmakologickou léčbu. Rozlišení mezi osteoporózou a CKD-MBD se stává obtížnější u CKD ve stadiích 4–5. U pacientů s frakturami lze farmakologickou léčbu zvážit na podkladě biochemických známek kostního obratu a případně provést kostní biopsii [34]. Potencionální nefrotoxicita bisfosfonátů nebyla prokázána, při jejich použití ve stadiích 4–5 CKD je však doporučováno snížení dávkování [35]. Je třeba mít na zřeteli, že většina farmak používaných k léčbě osteoporózy může vést k poklesu kostního obratu a rozvoji adynamické kostní choroby. Taková terapie může ve svém konečném důsledku vést ke zvýšení četnosti fraktur a působit progresi cévních kalcifikací [36]. Denzitometrický nález u dialýzovaných pacientů nelze interpretovat v klasickém pojetí a postupy užívané v léčbě osteoporózy u osob bez onemocnění ledvin jsou rozdílné [37].
Významná část hemodialyzovaných pacientů má již při zahájení hemodialyzační léčby snížené hodnoty kostní minerální denzity, dosahující u více než 1/3 z nich osteoporotických hodnot. Téměř u všech pacientů byl nalezen určitý stupeň deficitu 25-OH vitaminu D a u 1/5 pacientů byla prokázána hypokalcemie.
Klinický význam vyšetření kostní minerální denzity u dialyzovaných pacientů není v současné době přesně objasněn. Nálezy snížené kostní minerální denzity nelze jednoduše interpretovat ve smyslu osteopenie či osteoporózy, tak jak je to zavedeno u normální populace. Na podkladě BMD nelze u těchto nemocných spolehlivě predikovat riziko fraktur. Standardní postupy při diagnostice a léčbě osteoporózy nejsou u dialyzační populace vhodné. Z našich nálezů je ale patrné, že hodnoty kostní minerální denzity a některých laboratorních parametrů ovlivňujících kostní metabolizmus jsou u pacientů vstupujících do chronického hemodialyzačního programu často abnormální a je třeba jim věnovat pozornost.
MUDr. Ivo Valkovský
www.fno.cz
e-mail: ivo.valkovsky@fno.cz
Doručeno do redakce: 17. 5. 2012
Přijato po recenzi: 24. 8. 2012
Zdroje
1. Bellorin-Font E, Adams J, Cunningham J. Osteopenia in uremia. In: Olgaard K, Salutsky IB, Silver J. The Spectrum of Mineral and Bone Disorders in Chronic Kidney Disease. Oxford University Press 2010 : 235–251.
2. Rix M, Andreassen H, Eskildsen P et al. Bone mineral density and biochemical markers of bone turnover in patients with predialysis chronic renal failure. Kidney Int 1999; 56 : 1084–1093.
3. Dusilová Sulková S et al. Renální osteopatie. Praha: Maxdorf 2007 : 160–161.
4. ISCD Official Positions [online]. © 2007 [cit. 2012-03-26]. Dostupné z: http://www.iscd.org/Visitors/pdfs/ISCD2007OfficialPositions-Adult.pdf
5. Miller PD. Diagnosis and treatment of osteoporosis in chronic renal disease. Semin Nephrol 2009; 29 : 144–155.
6. Moe S, Drüeke T, Cunningham J et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69 : 1945–1953.
7. National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Bone Metabolism and Disease in Chronic Kidney Disease. Am J Kidney 2003; 42: (Suppl. 3): 12–16.
Pei Y, Hercz G, Greenwood C et al. Renal osteodystrophy in diabetic patients. Kidney Int 1993; 44 : 159–164.
9. Sotorník I, Kutílek Š et al. Kostní minerály a skelet při chronickém onemocnění ledvin. Praha: Galén 2011 : 344–347.
10. Dusilová Sulková S et al. Renální osteopatie. Praha: Maxdorf 2007 : 156–157.
11. Hutchinson MS, Figenschau Y, Almås B et al. Serum 25-hydroxyvitamin D levels in subjects with reduced glucose tolerance and type 2 diabetes – The Tromsø OGTT-Study. Int J Vitam Nutr Res 2011; 81 : 317–327.
12. Sotorník I, Kutílek Š et al. Kostní minerály a skelet při chronickém onemocnění ledvin. Praha: Galén 2011 : 342.
13. Miller JE, Kovesdy CP, Norris KC et al. Association of cumulatively low or high serum calcium levels with mortality in long-term hemodialysis patients. Am J Nephrol 2010; 32 : 403–413.
14. Pilz S, Iodice S, Zittermann A et al. Vitamin D status and mortality risk in CKD: a meta-analysis of prospective studies. Am J Kidney 2011; 58 : 374–382.
15. Kandula P, Dobre M, Schold JD et al. Vitamin D supplementation in chronic kidney disease: a systematic review and meta-analysis of observational studies and randomized controlled trials. Clin J Am Soc Nephrol 2011; 6 : 50–62.
16. Garriguet D. Bone health: osteoporosis, calcium and vitamin D. Health Rep 2011; 22 : 7 –
17. Vyskočil V. Osteoporóza a ostatní nejčastější metabolická onemocnění skeletu. Praha: Galén 2009 : 27–28.
18. Vestergaard P, Rejnmark L, Mosekilde L. Osteoporosis is markedly underdiagnosed: a nationwide study from Denmark. Osteoporos Int 2005; 16 : 134–141.
19. Společnost pro metabolická onemocnění skeletu. Doporučené postupy pro diagnostiku a terapii postmenopauzální osteoporózy II – část první [online]. © 2007 [cit. 2012-03-26]. Dostupné z: http://www.smos.cz/docs/dp_smos1.pdf.
20. KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int 2009; 76: (Suppl. 13): 32–49.
21. Cunningham J, Sprague SM et al. Osteoporosis in chronic kidney disease. Am J Kidney 2004; 43 : 566–571.
22. Mal L, Oei L, Jiang L et al. Association between bone mineral density and type 2 diabetes mellitus: a meta-analysis of observational studies. Eur J Epidemiol 2012; 27 : 319–332.
23. Ohlídalová K, Mareš J, Ferda J et al. Hodnocení kostní denzity u hemodialyzovaných pacientů. Ces Radiol 2007; 1 : 68–73.
24. Tomida K, Hamano T, Mikami S et al. Serum 25-hydroxyvitamin D as an independent determinant of 1-84 PTH and bone mineral density in non-diabetic predialysis CKD patients. Bone 2009; 44 : 678–683.
25. Binici DN, Gunes N. Risk factors leading to reduce bone mineral density in hemodialysis patients with metabolic syndrome. Ren Fail 2010; 32 : 469–474.
26. Waugh EJ, Lam MA, Hawker GA et al. Risk factors for low bone mass in healthy 40–60 year old women: a systematic review of the literature. Osteoporos Int 2009; 20 : 1–21.
27. Papaioannou A, Kennedy CC, Cranney A et al. Risk factors for low BMD in healthy men age 50 years or older: a systematic review. Osteoporos Int 2009; 20 : 507–518.
28. Dusilová Sulková S et al. Renální osteopatie. Praha: Maxdorf 2007 : 50.
29. Vyskočil V. Současné možnosti léčby osteoporózy.Vnitř Lék 2011; 58 : 749–758.
30. FRAX ® WHO Fracture Risk Assessment Tool [online]. © World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK 2011 [cit. 2012-03-26]. Dostupné z: http://www.shef.ac.uk/FRAX/ dne 29.5.2011.
31. Alem AM, Sherrard DJ, Gillen DL et al. Increased risk of hip fracture among patients with end-stage renal disease. Kidney Int 2000; 58 : 396–399.
Ott SM. Rewiev article: Bone density in patients with chronic kidney disease stages 4–5. Nephrology 2009; 14 : 395–403.
33. Moe SM. Vascular calcification and renal osteodystrophy relationship in chronic kidney disease. Eur J Clin Invest 2006; 36: (Suppl. 2): 51–62.
34. Miller PD. Diagnosis and treatment of osteoporosis in chronic renal disease. Semin Nephrol 2009; 29 : 144–155.
36. Gal-Moscovici A, Sprague SM. Osteoporosis and chronic kidney disease. Semin Dial 2007; 20 : 423–430.
37. Dusilová Sulková S. Kostní choroba u chronického selhání ledvin a její moderní terapie. Vnitř Lék 2011; 57 : 620–625.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Adiponektin ve vztahu k ledvinné dysfunkci u nemocných s diabetes mellitus 2. typu – editorial
- Profylaxe tromboembolické nemoci včera, dnes a zítra – editorial
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta – editorial
- Kostní minerální denzita u nemocných s chronickým selháním ledvin při zahájení hemodialyzační léčby
- Adiponektín vo vzťahu k obličkovej dysfunkcii u chorých s diabetes mellitus 2. typu
- Je syndróm polycystických ovárií asociovaný s autoimunitnou tyreoiditídou?
- Revmatoidní artritida – nezávislý rizikový faktor kardiovaskulárních onemocnění
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Kombinovaná kinezio-flebotromboemboloprofylaxia, mechano-flebotromboemboloprofylaxia a farmako-flebotromboemboloprofylaxia vénovej tromboembólie v internej medicíne
- Účinnost lenalidomidu u vzácných krevních chorob: u histiocytózy z Langerhansových buněk, multicentrické Castlemanovy choroby, POEMS syndromu, Erdheimovy-Chesterovy choroby a angiomatózy. Popis případů a přehled literatury
- Karcinoid a jeho kardiální manifestace
- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Neobvyklá příčina defektu nohy u nemocného s diabetes mellitus
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Každý tep se počítá
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Karcinoid a jeho kardiální manifestace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání