-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
Therapeutic hypothermia after non‑traumatic cardiac arrest for 12 hours: Hospital Karlovy Vary from 2006 to 2009
Introduction and aims:
Therapeutic hypothermia is a standard part of post-resuscitation care. Here we present cohort patients after non-traumatic cardiac arrest and their neurological outcomes who underwent 12 hours of therapeutic hypothermia. Moreover, we focused on examining the results of particular subgroup of patients with initial ventricular fibrillation (VF) with acute myocardial infarction with ST-elevation (STEMI) who underwent coronary intervention (PCI).Methods:
We evaluated retrospectively the patients with non-traumatic out - of - and in-hospital cardiac arrest (IHCA, OHCA), admitted to our intensive care unit (ICU) in 2006 – 2009. Therapeutic hypothermia was induced in all patients with persistent coma after restoration of spontaneous circulation (ROSC). We maintained the target temperature (32 – 34 °C) for 12 hours. Then, passive rewarming followed. Intravascular cooling device was not used. A good neurological outcome was considered to be cerebral performance category (CPC) 1 or 2 at hospital discharge.Results:
Total number of patients was 88 (OHCA n = 63; IHCA n = 25), average age 58 (± 16) years, average APACHE II was 29 (± 6). Men were in 65%. Target temperature was achieved and maintained in 76% of patients. ICU mortality was 32%, hospital mortality 53%. Initial ECG rhytm was VF in 59%, asystoly in 32% and pulsless electrical activity in 9%. Coronary angiography was performed in 57% and PCI in 42% patients. We did not observe severe arrhythmias, minor gastrointestinal bleeding occured in 2%. The infectious complications were recorded: early pneumonia in 7%, tracheobronchitis in 10% and bacteraemia in 1% patients. In the group of 23 patients with VF/ STEMI/ PCI target temperature was achieved and maintained in 91%, ICU and hospital survival rates were 87% and 78%. CPC 1 and 2 was observed in 83% among survivors (n = 15).Conclusions:
We achieved similar results in patients after non-traumatic cardiac arrest who underwent a protocol with 12 hours of therapeutic hypothermia as in studies reporting 24 hours of hypothermia, particularly in patients with VF/ STEMI/ PCI. Twelve hours of therapeutic hypothermia was associated with a low incidence of infectious complications.Key words:
therapeutic hypothermia – cardiac arrest – protocol
Autoři: R. Sýkora; R. Janda
Působiště autorů: Anesteziologicko‑resuscitační oddělení nemocnice v Karlových Varech, Karlovarská krajská nemocnice, a. s., přednosta prim. MU Dr. Roman Brázdil
Vyšlo v časopise: Vnitř Lék 2011; 57(1): 72-77
Kategorie: Původní práce
Souhrn
Úvod a cíle:
Terapeutická hypotermie (TH) je standardní součást poresuscitační péče. Zde prezentujeme výsledky souboru pacientů po netraumatické srdeční zástavě, kteří podstoupili 12 hod terapeutické hypotermie. Navíc jsme se zaměřili na zhodnocení výsledků podskupiny pacientů se vstupní komorovou fibrilací (VF), s akutním infarktem myokardu s ST elevacemi (STEMI), kteří podstoupili koronární intervenci (PCI).Metody:
Retrospektivně jsme zhodnotili pacienty s netraumatickou zástavou oběhu v nemocnici a mimo ni (IHCA, OHCA) přijaté na naše oddělení (ICU) v letech 2006 – 2009 po prvotní implementaci protokolu TH. U nemocných s přetrvávající poruchou vědomí po obnovení spontánního oběhu (ROSC) byla cílová teplota 32 – 34 °C udržována po 12 hod, poté následoval pasivní ohřev. Nepoužívali jsme intravaskulární chladicí zařízení. Jako dobrý neurologický výsledek jsme hodnotili cerebral performance category (CPC) 1 nebo 2 při propuštění z nemocnice.Výsledky:
Celkový počet pacientů v daném období byl 88 (OHCA, n = 63; IHCA, n = 25), průměrný věk 58 (± 16) let, průměrný APACHE II byl 29 (± 6). Mužů bylo 65 %. Cílová teplota byla dosažena a udržena u 76 % nemocných. ICU mortalita byla 32 %, nemocniční mortalita 53 %. Úvodní EKG rytmus byl VF v 59 %, asystolie v 32 % a bezpulzní elektrická aktivita v 9 %. Koronarografie byla provedena u 57 % a PCI byla provedena u 42 % pacientů. U nemocných jsme v průběhu TH nezaznamenali závažné arytmie. Ve 2 % došlo k nezávažnému krvácení do trávicího traktu v průběhu a po TH. Z infekčních komplikací jsme zaznamenali časnou pneumonii v 7 %, tracheobronchitidu kriticky nemocných v 10 % a u 1 % pacientů bakteriemii. Ve skupině 23 pacientů s VF/ STEMI/ PCI byla cílová teplota dosažena v 91 %, ICU a nemocniční přežití bylo 87 % a 78 %, CPC 1 a 2 byla zaznamenána u 83 % přeživších nemocných (n = 15).Závěry:
U pacientů po srdeční zástavě, kteří v letech 2006 – 2009 podstoupili protokol s 12 hod terapeutické hypotermie na ICU v Karlových Varech, jsme dosáhli obdobných výsledků jako u studií s 24hodinovými protokoly, zejména ve skupině pacientů s VF/ STEMI/ PCI. Dvanáct hodin terapeutické hypotermie bylo spojeno s nízkým výskytem infekčních komplikací.Klíčová slova:
terapeutická hypotermie – srdeční zástava – protokolPráce byla publikována ve formě posteru na 30th International Symposium of Intensive Care and Emergency Medicine, Brusel, Belgie, 9. – 12. 3. 2010 pod názvem: Induced hypothermia after cardiac arrest for 12 hours: single-centre experience (Sykora R, Janda R. Critical Care 2010; 14 (Suppl 1): P323 a byla přednesena jako volné sdělení na IV. česko - slovenském kongresu intenzivní medicíny v Brně, 12. – 14. 5. 2010 pod názvem Terapeutická hypotermie po srdeční zástavě na 12 hodin: zkušenost jednoho centra. Sýkora R et al. Sborník abstrakt, ISBN 978 - 80 - 904020 - 6 - 5.
Úvod
Mírná terapeutická hypotermie (mild therapeutic hypothermia – TH) je v současnosti hlavním neuroprotektivním mechanizmem a je standardní součástí poresuscitační péče o nemocné po netraumatické srdeční zástavě [1,2]. Doporučení o TH a jejích indikacích [3] vychází ze 2 základních studií, ve kterých byl popsán vliv TH nejen na neurologické výsledky [4], ale i na mortalitu [5] nemocných po netraumatické srdeční zástavě. Recentně došlo k široké implementaci zahajování TH již v přednemocniční péči (PNP) a poresuscitační intenzivní péči za použití četných méně či více sofistikovaných způsobů a systémů [6,7]. Dosud stále nejsou objasněny či přesně definovány četné aspekty terapeutické hypotermie, jako je délka jejího trvání (expertními názory je nejčastěji doporučovaná doba v současnosti 24 hod), přesná cílová teplota [8], rychlost a doba pro ohřívání pacienta ani dosud není jednoznačným doporučením stanovena superiorita některé z použitých metod k ochlazování [6,9,10].
Cíl
V této práci jsme si stanovili jako cíl zhodnocení nemocničního přežití a neurologických výsledků u nemocných přijatých na anesteziologicko-resuscitační oddělení v Karlových Varech po netraumatické srdeční zástavě v letech 2006 – 2009 po implementaci prvotního protokolu TH v lednu roku 2006. Délka TH byla stanovena na 12 hod v souladu s aktuálními doporučeními na 12 – 24 hod TH [1,2]. V té době byla v nemocnici v Karlových Varech též zahájena činnost centra intervenční kardiologie.
Jako vedlejší cíl jsme se zaměřili na popis výsledků po aplikaci 12 hod TH ve skupině prognosticky příznivých nemocných po resuscitaci, kteří měli vstupní rytmus fibrilaci komor (VF), infarkt myokardu s ST elevacemi (STEMI) a podstoupili koronární intervenci (PCI). Přežití a neurologické výsledky této skupiny jsme porovnali s publikovanými výsledky u stejných skupin pacientů (VF/ STEMI/ PCI), ovšem s 24hodinovými protokoly TH.
Jako druhý vedlejší cíl jsme si stanovili zhodnocení našeho dosavadního protokolu TH. Na základě hodnocení komplikací spojených s implementovaným protokolem TH, zkušeností, proveditelnosti, aktuálních dat, expertních názorů a doporučení jsme se rozhodli pro tvorbu nového protokolu za použití endovaskulárního chladicího zařízení.
Metodika
Retrospektivně jsme zhodnotili výsledky u všech pacientů přijatých na naši jednotku intenzivní péče Anesteziologicko-resuscitačního oddělení nemocnice Karlovy Vary, Karlovarská krajská nemocnice, a.s., (ICU) po netraumatické srdeční zástavě s přetrvávající poruchou vědomí po obnovení spontánní cirkulace (ROSC) v letech 2006 – 2009. Hodnotili jsme ICU mortalitu, nemocniční mortalitu, neurologický výsledek při propuštění nemocného z hospitalizace a incidenci infektů u našich nemocných. Data jsou prezentována jako průměr a směrodatná odchylka či procenta a absolutní počet.
Protokol indukce a udržení terapeutické hypotermie v letech 2006 – 2009
Nemocní se srdeční zástavou mimo nemocnici (OHCA) byli po ROSC přiváženi na emergency anesteziologicko-resuscitačního oddělení týmem rychlé lékařské pomoci (RLP). U nemocných v případě OHCA byla snaha zahájit TH ihned po ROSC buď týmem RZP, nebo byla zahajována okamžitě při příjezdu na emergency. Nemocní se srdeční zástavou v nemocnici (IHCA) byli překládáni přímo na lůžko ICU a TH byla zahajována okamžitě po ROSC.
TH byla indukována povrchovým ochlazováním, rychlou intravenózní aplikací chladného krystaloidu [4 °C, fyziologický roztok nebo Plasmalyte (Baxter Czech spol. s r.o., Praha, ČR) 30 ml/ kg během 30 min] v průběhu příjmu nemocného po srdeční zástavě. Podle potřeby bylo podáváno 150 ml studeného krystaloidního roztoku do nazogastrické sondy každou hodinu a/ nebo byly prováděny výplachy močového měchýře. Všichni nemocní byli v průběhu indukce hypotermie hluboce sedováni (intravenózním podáním propofolu nebo midazolamu a sufentanilu), byli napojeni na umělou plicní ventilaci a podle potřeby relaxováni (intravenózním podáním atrakuria) v případě výskytu třesavky. TH byla udržována po 12 hod od dosažení 32 – 34 °C především povrchovým ochlazováním neregulovatelnými systémy, ledovými obklady. Tyto obklady jsme umísťovali především na hlavu, ramena, třísla. Po 12 hod terapeutické hypotermie následoval pasivní ohřev se stanoveným cílem rychlosti ohřevu 1 °C za 1 hod. Tělesná teplota byla měřena z močového měchýře nebo nazofaryngeálním monitorováním tak, aby naměřená teplota co nejlépe odpovídala teplotě tělesného jádra [6]. Za úspěšně dosaženou jsme hodnotili TH, když bylo dosaženo všech těchto podmínek:
- a) doba indukce za pobytu na EM a ICU nepřesáhla 180 min,
- b) bylo dosaženo cílové teploty 32 – 34 °C,
- c) cílová teplota byla udržena 12 hod.
TH byla indukována a následně udržována bez použití intravaskulárního chladicího zařízení. V přednemocniční ani v nemocniční péči nebyl používán žádný speciální systém pro selektivní ochlazování mozku (chladicí helmy, čepice, Rhinochill apod.) [6]. Profylakticky jsme nepodávali antibiotika. Antiepileptika nebyla podávána rutině. Ostatní péče o nemocné v průběhu TH probíhala podle běžných protokolů a standardů intenzivní péče (protokol pro kontrolu glykemie byl v té době s cílovou hladinou 5 – 7 mmol/ l, profylaxe stresového vředu, prevence ventilátorové pneumonie, podávání nízkomolekulárního heparinu apod.).
Selektivní koronarografie a koronární intervence
Nemocným po příjezdu na emergency a zahájení indukce TH bylo provedeno EKG a transtorakální echokardiografie (TTE) ošetřujícím intenzivistou či kardiologem. Selektivní koronarografii podstupovali neodkladně všichni nemocní, u kterých byly zaznamenány EKG známky akutní ischemie (ST elevace). Dále SKG podstoupili nemocní, u kterých bylo vysoké anamnestické podezření na akutní koronární syndrom a/ nebo koronární etiologii srdeční zástavy (anamnéza ICHS, bolest na hrudi a/ nebo náhle vzniklá dušnost popisovaná rodinou či svědky) nebo nemocní se suspektním nálezem na vstupním TTE. Koronární intervence byly prováděny podle indikace kardiologa. V indukci hypotermie bylo pokračováno i při transportu nemocného na SKG i v jejím průběhu.
Cerebral performance category
Neurologický výsledek u přeživších pacientů jsme hodnotili pomocí škály CPC neboli cerebral performance categories scale, která hodnotí soběstačnost pacientů v běžných činnostech a nakolik jsou závislí na péči druhé osoby, zda jsou schopni pracovat a za jakých podmínek (tab. 1). Tyto škály CPC byly hodnoceny při propuštění z nemocnice nebo zpětným telefonickým ověřením přímo u nemocného nebo u příbuzných uvedených v dokumentaci. Jako dobrý neurologický výsledek jsme hodnotili CPC úrovně 1 a 2.
Tab. 1. Cerebral Performance Categories Scale (CPC). Upraveno podle [25]. ![Cerebral Performance Categories Scale (CPC). Upraveno podle [25].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e3ab87d8adf922d3f52735340b8f48b2.jpeg)
Výsledky
Celkový počet pacientů s netraumatickou srdeční zástavou přijatých na ICU v Karlových Varech mezi roky 2006 a 2009 byl 88 (OHCA n = 63; IHCA n = 25). U všech těchto pacientů byla zahájena indukce mírné TH. TH v cílovém rozmezí byla dosažena a udržena u 76 % pacientů. Základní charakteristika souboru našich pacientů je uvedena v tab. 2 a porovnání výsledků mezi skupinou pacientů s IHCA a OHCA podle vstupního EKG rytmu jsou zobrazeny v tab. 3. Jednoznačně nejlepší přežití a současně i neurologický výsledek měli všeobecně pacienti s komorovou fibrilací, zvláště pak pacienti s fibrilační zástavou a ST elevacemi v nemocnici.
Tab. 2. Základní charakteristika souboru. 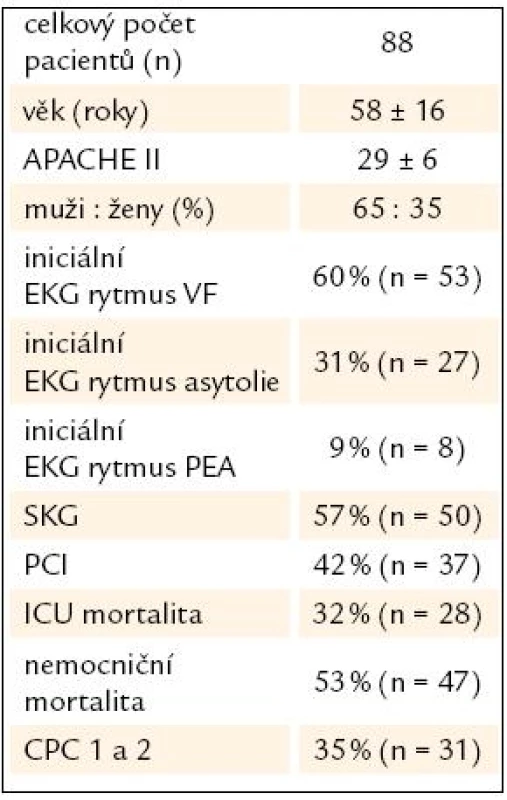
APACHE II – Acute Physiology And Chronic Health Evaluation, VF – komorová fibrilace, PEA – bezpulzní elektrická aktivita, SKG – selektivní koronarografie, PCI – perkutánní koronární intervence, ICU – jednotka intenzivní péče, CPC – cerebral performance category Tab. 3. Přežití a neurologické výsledky u nemocných podle druhu srdeční zástavy. 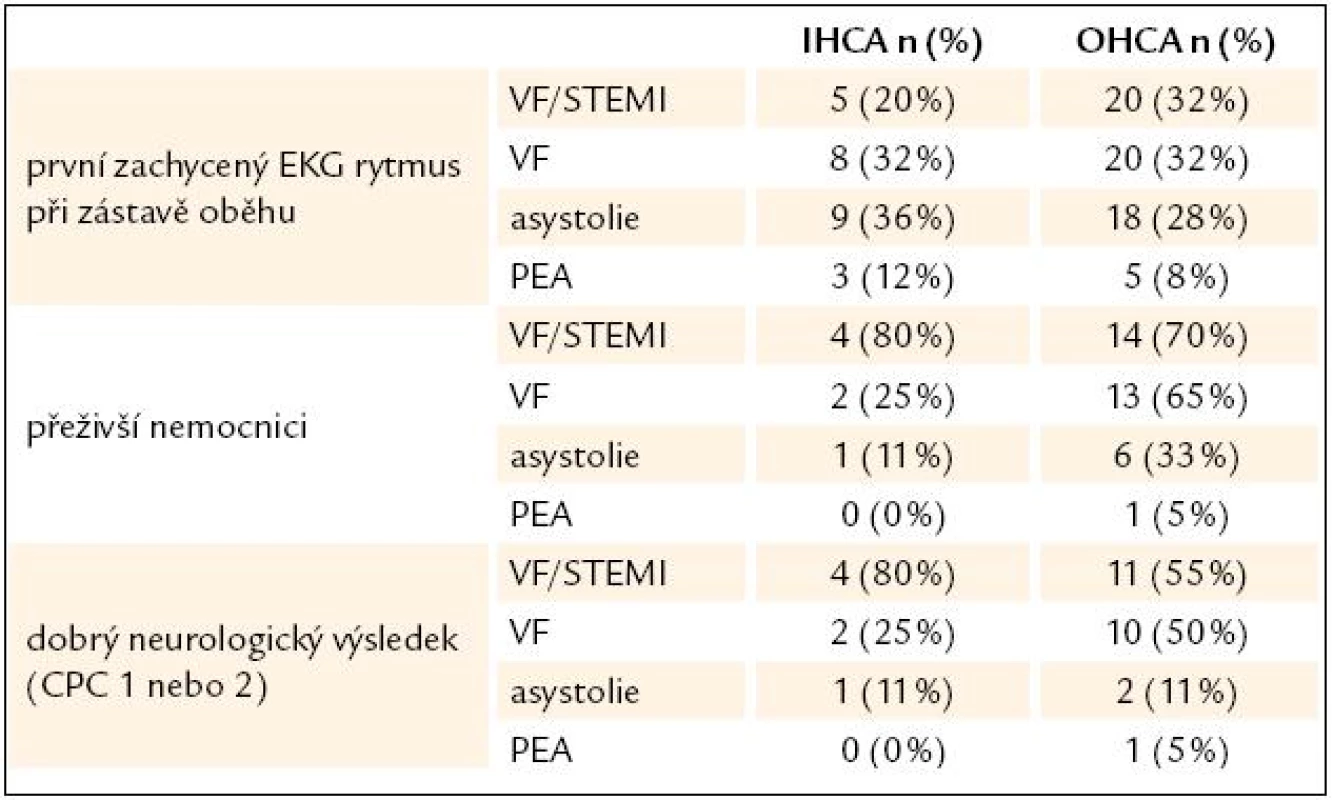
IHCA – srdeční zástava v nemocnici, OHCA – mimonemocniční srdeční zástava, VF – komorová fibrilace, STEMI – infarkt myokardu s ST elevacemi, PEA – bezpulzní elektrická aktivita, CPC – cerebral performance category Komplikace v průběhu terapeutické hypotermie
U nemocných jsme nezaznamenali závažné arytmie/ bradykardie, ve 2 % došlo k nezávažnému krvácení do trávicího traktu (n = 2), bez nutnosti endoskopického ošetřování. Z infekčních komplikací jsme zaznamenali časnou ventilátorovou pneumonii v 7 % (n = 6) a tracheobronchitidu kriticky nemocných v 10 % (n = 9), u 1 % pacientů bakteriemii (n = 1) a žádné infekce močového traktu. V souboru našich nemocných s TH jsme nemuseli řešit závažné a komplikované poruchy iotogramu, závažné bradykardie s přetrvávající srdeční frekvencí pod 40/ min, inzulinorezistenci ani jiné krvácivé komplikace, které by byly nežádoucím účinkem TH.
Skupina pacientů VF/ STEMI/ PCI
Ve skupině 23 pacientů s VF/ STEMI/ PCI byla cílová teplota dosažena a udržena v 91 %, ICU přežití bylo 87 % (n = 20), nemocniční přežití bylo 78 % (n = 18), CPC 1 a 2 byla zaznamenána u 83 % z přeživších nemocných (n = 15). V tab. 4 nabízíme srovnání s výsledky obdobných studií, které se od naší liší především délkou TH trvající 24 hod.
Tab. 4. Srovnání s ostatními skupinami pacientů s VF/STEMI/PCI. 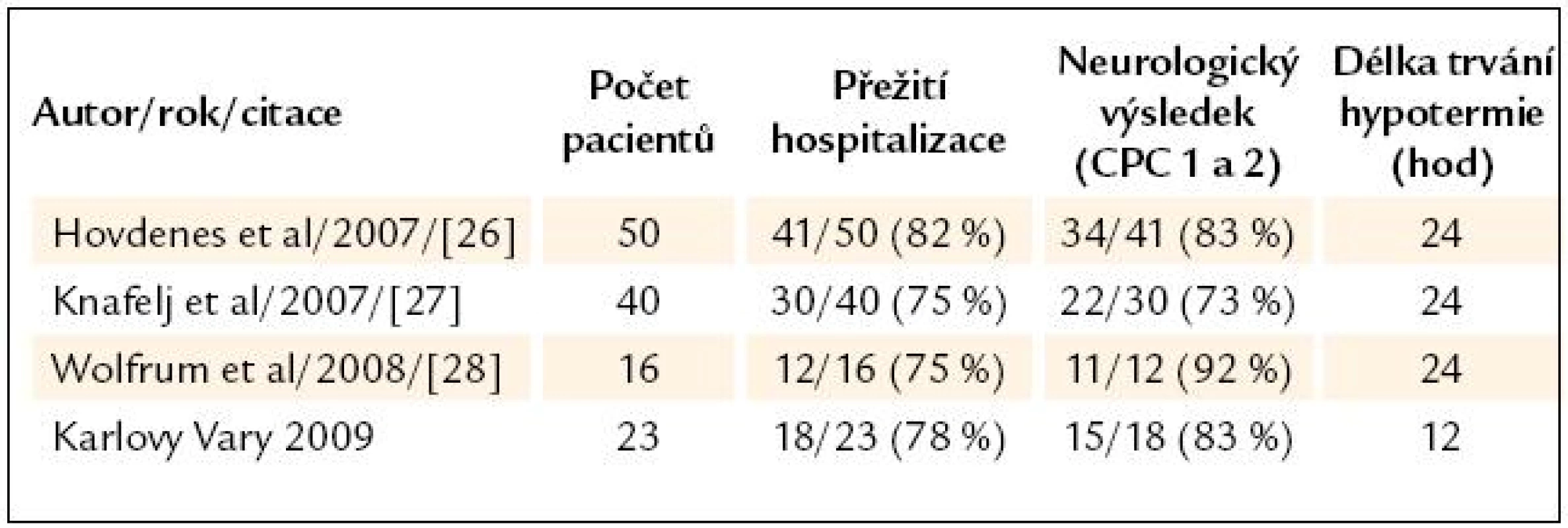
VF/ STEMI/ PCI – pacienti s iniciální komorovou fibrilací, ST elevovaným infarktem myokardu a provedenou koronární intervencí, CPC – cerebral preformance categories Diskuze
Naše studie popisuje velmi dobré výsledky pacientů po netraumatické srdeční zástavě po implementaci prvotního protokolu terapeutické hypotermie z regionální nemocnice s dostupnou kardiointervencí a následnou poresuscitační intenzivní péčí. Specifickým prvkem péče o nemocné po mimonemocniční srdeční zástavě v našem centru byl jejich prvotní příjezd na emergency po ROSC. Zde byla zahájena nebo bylo pokračováno v již zahájené indukci TH, byla provedena TTE a následně transport na SKG a/ nebo pokračování intenzivní poresuscitační péče, toto vše s optimem do 30 min, v reálné situaci vždy do 90 min. Délka trvání TH v době tvorby tohoto protokolu a jeho implementace byla stanovena na 12 hod vzhledem k v té době aktuálním doporučením na trvání TH po dobu 12 – 24 hod.
Více než 3/ 4 nemocných podstoupili celou TH za výše stanovených podmínek. U naprosté většiny popisovaných nemocných byla zahajována TH až v rámci nemocniční péče. Mezi našimi pacienty jsme nepozorovali žádný výskyt klinických známek vzniku plicního otoku následujícího indukci rychlou intravenózní aplikací chladného roztoku v průběhu prvních 24 hod od přijetí. V našem souboru jsme se setkali jen se sporadickými případy nadměrného ochlazení. Nadměrnému ochlazení u našich pacientů jsme předcházeli kontinuálním monitorováním teploty a zmírněním intenzity a frekvence výměny ledových obkladů. Vždy byla vyvinuta maximální snaha o ohřev nadměrně ochlazeného pacienta v co nejkratší době, vzhledem k možnému zhoršení prognózy těchto nemocných [11,12] a současně abychom minimalizovali další možné nežádoucí účinky, jako je např. hypotermií indukovaná bradykardie vyskytující se u nadměrně ochlazených pacientů. Konsekvence vycházející z délky a tíže nadměrného ochlazení jsme již v naší retrospektivní analýze nepopisovali. V průběhu let 2006 – 2009 jsme postupně ustupovali od výplachu žaludku NGS, a zabránili tak možnému vyššímu výskytu krvácivých komplikací a jako doplňkovou metodu jsme ponechali možnost výplachu močového měchýře studeným krystaloidem [6].
Přestože jsme nenasazovali profylakticky antibiotika při indikaci TH, práh pro jejich nasazení byl nízký, obzvláště při podezření na časné pneumonie či obtížnou diferenciální diagnostiku pneumonie a aspirační pneumonitidy. Všichni pacienti však podstoupili komplexní mikrobiologický screening při příjmu nebo před nasazením antibiotik. Celková incidence infekcí, ale i ostatních komplikací byla u našeho souboru nemocných výrazně nižší, než bývá popisováno v literatuře [13]. Nicméně naše studie vzhledem k retrospektivní povaze nezodpovídá otázku, zda je nižší výskyt infekčních i ostatních komplikací výsledkem kratší, 12hodinové, terapeutické hypotermie. Stále tak zůstává nezodpovězena otázka nejen cílové teploty [8], ale i doby trvání TH, ohřevu a udržování normotermie, a to nejen ve vztahu k přežití, neurologickému výsledku, ale i k ostatním komplikacím TH [14,15].
V našem souboru jsme nezaznamenali statisticky významně horší přežití či horší neurologický výsledek ani rozdílný výskyt infekčních komplikací u pacientů, u kterých se nepodařilo dosáhnout TH podle námi stanovených, výše zmíněných kritérií. TH nebylo dosahováno především pro excesivní termogenezi, často spojenou se syndromem systémové zánětlivé odpovědi, nikoliv vždy však s infektem a sepsí. Nicméně i u těchto pacientů byla teplota ovlivňována snahou TH dosáhnout a pouhá normotermie či ovlivňování febrilie mohly tyto výsledky významně ovlivnit [14,15], což však činí výstupy této analýzy obtížněji interpretovatelnými.
Jako lék volby pro posthypoxické křeče či epileptickou aktivitu jsme volili fenytoin, vždy byl konzultován neurolog, ale EEG však nebylo rutinně prováděno.
Nový protokol terapeutické hypotermie
V novém protokolu implementovaném od ledna roku 2010 je nemocný po srdeční zástavě i nadále ve všech případech po ROSC přivážen na emergency, kde je přebírán od RLP nebo jiných resuscitujících. Po nezbytných anamnestických údajích je indikována TH nebo je pokračováno v již zahájené indukci TH. V této chvíli je však nezbytné zhodnotit podíl sedace a/ nebo relaxace od RLP v odhadu úrovně vědomí s ohledem na pokračování TH. Na základě odběru anamnézy, při přítomných ST elevacích nebo jiném vysokém podezření na akutní koronární syndrom a suspektním nálezu na TTE indikujeme společně s kardiology SKG/ PCI. Vždy preferujeme časnou intervenci u koronárních syndromů. Cílem transportů a rozhodování je dosáhnout času door to baloon time 30, maximálně však 90 min. Zásadním rozdílem oproti minulému protokolu je použití intravaskulárního chladicího zařízení u pacientů po srdeční zástavě po návratu na ICU.
Indikací pro TH zůstává zástava oběhu s úspěšnou resuscitací mimo i v nemocnici. Iniciální rytmus může být VF, asystolie, PEA včetně EMD [1,2]. Základní kontraindikací k provádění TH je, vyhoví-li nemocný po ROSC výzvě před rozhodnutím o zahájení IH a terminální stadium chorob. Dalšími kontraindikacemi TH, ale vždy k individuálnímu zvážení, jsou pro nás trauma s krvácením či koagulopatie. Kapitolou hodnou zvláštního zřetele je těhotenství, kdy bychom volili velmi individuální přístup se snahou o maximální ochranu života a neurologického výsledku matky. TH zahajujeme ve spolupráci s RLP rychlou intravenózní aplikací ledového roztoku co nejdříve po ROSC.
Udržení TH dosahujeme s užitím přístroje pro intravaskulární chlazení. Potřebný katétr je umisťován cestou libovolné v. femoralis do v. cava inferior ještě na emergency. Teplota tělesného jádra je měřena v močovém měchýři a čidlo je zapojeno do řídicí jednotky přístroje. Kanylace intravaskulárního chladicího katétru tak předchází odjezdu na SKG a event. zahájení duální antiagregační terapie, současně sestra zahajuje setování přístroje pro endovaskulární chlazení a probíhají další diagnostická vyšetření jako TTE a RTG srdce a plic a je pokračováno v intravenózní indukci hypotermie. Endovaskulární chlazení je zahájeno po návratu z kardiointervence při uložení pacienta na lůžko intenzivní péče. V průběhu nutného transportu nemocného zůstává přístroj v pohotovostním režimu na oddělení. Cílová teplota je nastavena na 33 °C s možností manipulace v rozmezí doporučených 32 – 34 °C. Jako délku TH jsme stanovili dobu 24 hod, vzhledem k převažujícím současným expertním názorům a současně vzhledem k možnosti používání intravaskulárního chladicího zařízení na našem pracovišti. Toto zařízení nám umožňuje snadno a spolehlivě kontrolovat všechny fáze chlazení, ohřevu i udržení normotermie bez zvýšených nároků na ošetřující personál i oproti kratšímu, 12hodinovému povrchovému chlazení. Řízený ohřev po 24 hod TH provádíme rychlostí 0,35 – 0,5 °C/ hod až k 36 °C. K udržení normotermie na úrovni 37,0 °C po dalších 24 – 48 hod přistupujeme individuálně a katétr ponecháváme až 72 hod in situ [16]. Při vynikajícím neurologickém nálezu můžeme ukončit fázi chlazení dříve, ale fázi ohřevu nezrychlujeme vzhledem k možnosti akcentace komplikací z rewarmingu [14,15].
Součástí komplexní poresuscitační intenzivní péče je nyní i rozšířená monitorace hemodynamiky (měření srdečního výdeje, monitorace ScvO2, arteriální hladiny laktátu) a farmakologické i přístrojové ovlivnění hemodynamiky (noradrenalin, dobutamin, levosimendan, intraaortální balonková kontrapulzace). Při umělé plicní ventilaci dbáme na rychlé snížení FiO2 podle PaO2 a saturace hemoglobinu na minimální možnou hodnotu (30 – 40 %) [17,18] a snažíme se optimalizovat PEEPe s ohledem na perfuzi klíčových orgánů (mozku, ledvin a gastrointestinálního traktu) a zároveň s ohledem na afterload levé komory při levostranné dysfunkci [19].
Ke kontrole glykemie přistupujeme podle zavedeného protokolu našeho pracoviště s aktuálně nově stanoveným cílovým rozmezím 8 – 10 mmol/ l [20]. Kontrolujeme rozšířený iontogram (Na, K, Cl, P, Mg, Ca) a v případě nízkých koncentrací iontů intervenujeme jejich substitucí. Nově též sledujeme kinetiku, resp. pokles laktátu jako odpověď na úvodní management [21].
Sledujeme vznikající syndrom systé-mové zánětlivé odpovědi a rozvoj multiorgánové dysfunkce a velkou pozornost věnujeme v těchto stavech diferenciální diagnostice sepse. Soustředíme se na diagnostiku akutního poškození ledvin s možností časného nasazení náhrady funkce ledvin.
Odhad vědomí a prognózy činíme až 72 hod po ohřátí nemocného, neboť TH může měnit kinetiku analgosedace a neurčeným způsobem zasahovat do zotavení mozku [22,23]. Komplexní odhad vědomí i prognózy provádíme společně s neurology a za pomoci vyšetření CT a EEG k vyloučení nonkonvulzivního status epilepticus (tč. v KV nejsou evokované potenciály pro kriticky nemocné dostupné). Koma s areflexií po 72 hod od ohřátí a vyloučení všech ostatních příčin a vlivu sedace může být důvodem k rozhodnutí o paliativní péči [24].
Závěry
Terapeutická hypotermie je v současnosti nesporně klíčová neuroprotektivní intervence v rámci poresuscitační péče pro komatózní nemocné po netraumatické srdeční zástavě. Tento globální pohled je však třeba podrobit dalšímu výzkumu v dosud nedořešených problematických okruzích, jako je délka terapeutické hypotermie a následné normotermie, cílová teplota [8], rychlost ohřevu, superiorita intravaskulárního chlazení, podání antibiotik a výzkum farmakokinetiky léčiv v průběhu hypotermie a hodnocení ukazatelů k prognostikaci neurologického vývoje nemocných [9].
U pacientů po srdeční zástavě, kteří v letech 2006 – 2009 podstoupili protokol s 12 hod terapeutické hypotermie na ICU v Karlových Varech, jsme dosáhli obdobných výsledků jako u studií s 24hodinovými protokoly, zejména ve skupině pacientů s VF/ STEMI/ PCI. Dvanáct hodin terapeutické hypotermie bylo také spojeno s nízkým výskytem infekčních komplikací.
MU Dr. Roman Sýkora, Ph.D.
www.kkn.cz
e-mail: sykora.roman@centrum.czDoručeno do redakce: 19. 5. 2010
Přijato po recenzi: 7. 10. 2010
Zdroje
1. Nolan JP, Morley PT, Vanden Hoek TL et al. Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison committee on Resuscitation. Resuscitation 2003; 57 : 231 – 235.
2. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2005; 112: IV1 – IV203.
3. Bělohlávek J, Šmíd O. Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial. Vnitř Lék 2009; 55 : 1011 – 1013.
4. Bernard SA, Gray TW, Buist MD et al. Treatment of comatose survivors of out - of - hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346 : 557 – 563.
5. The Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002; 346 : 549 – 556.
6. Škulec R, Truhlář A, Ošťádal P et al. Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě. Vnitř Lék 2009; 55 : 1060 – 1069.
7. Skulec R, Truhlar A, Knor J et al. Broad implementation of therapeutic hypothermia after cardiac arrest - Mission possible. Resuscitation 2010; 81 : 779 – 780.
8. Target Temperature Management After Cardiac Arrest. (TTM trial). NCT01020916. http:/ / clinicaltrials.gov. http:/ / clinicaltrials.gov. 2010.
9. Castren M, Silfvast T, Rubertsson S et al. Scandinavian clinical practice guidelines for therapeutic hypothermia and post-resuscitation care after cardiac arrest. Acta Anaesthesiol Scand 2009; 53 : 280 – 288.
10. Clinical and Economical Interest of Endovascular Cooling in the Management of Cardiac Arrest. (ICEREA Study). NCT00392639. http:/ / clinicaltrials.gov. 2009.
11. Škulec R, Kovárnik T, Bělohlávek J et al. Nadměrné ochlazení během mírné hypotermie po srdeční zástavě – fenomén zasluhující pozornost. Vnitř Lék 2008; 54 : 609 – 614.
12. Hoedemaekers CW, Ezzahti M, Gerritsen A et al. Comparison of cooling methods to induce and maintain normo - and hypothermia in intensive care unit patients: a prospective intervention study. Crit Care 2007; 11: R91.
13. Sagalyn E, Band RA, Gaieski DF et al. Therapeutic hypothermia after cardiac arrest in clinical practice: review and compilation of recent experiences. Crit Care Med 2009; 37: S223 – S226.
14. Polderman KH. Mechanisms of action, physiological effects, and complications of hypothermia. Crit Care Med 2009; 37: S186 – S202.
15. Polderman KH, Herold I. Therapeutic hypothermia and controlled normothermia in the intensive care unit: practical considerations, side effects, and cooling methods. Crit Care Med 2009; 37 : 1101 – 1120.
16. Simosa HF, Petersen DJ, Agarwal SK et al. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg 2007; 73 : 461 – 464.
17. Kuisma M, Boyd J, Voipio V et al. Comparison of 30 and the 100% inspired oxygen concentrations during early post-resuscitation period: a randomised controlled pilot study. Resuscitation 2006; 69 : 199 – 206.
18. Ronning OM, Guldvog B. Should stroke victims routinely receive supplemental oxygen? A quasi - randomized controlled trial. Stroke 1999; 30 : 2033 – 2037.
19. Luecke T, Pelosi P. Clinical review: Positive end-expiratory pressure and cardiac output. Crit Care 2005; 9 : 607 – 621.
20. Finfer S, Chittock DR, Su SY et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360 : 1283 – 1297.
21. Jansen TC, van BJ, Schoonderbeek J et al. Early Lactate - Guided Therapy in ICU Patients: A Multicenter, Open - Label, Randomized, Controlled Trial. Am J Respir Crit Care Med 2010; 182 : 752 – 761.
22. Wijdicks EF, Hijdra A, Young GB et al. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2006; 67 : 203 – 210.
23. Young GB. Clinical practice. Neurologic prognosis after cardiac arrest. N Engl J Med 2009; 361 : 605 – 611.
24. Doporučení představenstva ČLK č. 1/ 2010 k postupu při rozhodování o změně léčby intenzivní na léčbu paliativní u pacientů v terminálním stavu, kteří nejsou schopni vyjádřit svou vůli.
25. Safar P. Resuscitation after Brain Ischemia. In: Grenvik A, Safar P. Brain Failure and Resuscitation. New York: Churchill Livingstone 1981 : 155 – 184.
26. Hovdenes J, Laake JH, Aaberge L et al. Therapeutic hypothermia after out - of - hospital cardiac arrest: experiences with patients treated with percutaneous coronary intervention and cardiogenic shock. Acta Anaesthesiol Scand 2007; 51 : 137 – 142.
27. Knafelj R, Radsel P, Ploj T et al. Primary percutaneous coronary intervention and mild induced hypothermia in comatose survivors of ventricular fibrillation with ST-elevation acute myocardial infarction. Resuscitation 2007; 74 : 227 – 234.
28. Wolfrum S, Pierau C, Radke PW et al. Mild therapeutic hypothermia in patients after out - of - hospital cardiac arrest due to acute ST-segment elevation myocardial infarction undergoing immediate percutaneous coronary intervention. Crit Care Med 2008; 36 : 1780 – 1786.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Opoždění diagnózy HELLP syndromu
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
- MU Dr. Václav Jedlička se dožil 85 let
- Terapeutická hypotermie po srdeční zástavě: proč a na jak dlouho? – editorial
- Geny a osteoporóza – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Charakteristika reziduálních tachykardií spojených s koronárním sinem během ablace dlouhodobé perzistentní fibrilace síní
- Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
- Faktory ovlivňující přítomnost varixů a varikózního krvácení u pacientů s jaterní cirhózou
- Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
- Význam genetiky v predikci rizika osteoporózy
- Obezita, body mass index, obvod pasu a mortalita
- Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách?
- Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Opoždění diagnózy HELLP syndromu
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Obezita, body mass index, obvod pasu a mortalita
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



