-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAnémie při chronickém srdečním selhání
Anaemia in chronic heart failure
Anaemia is a relatively frequent co–morbidity of chronic heart as well as chronic renal failure. In both conditions, it represents a strong and independent predictor of increased morbidity and mortality. Aetiology of this anaemia is multi‑factorial. A number of various factors play a role in its development, e. g. inadequate erythropoietin production in the kidneys, bone marrow inhibition, iron deficiency as well as haemodilution associated with fluid retention. Treatment strategies aim at two directions. One is the stimulation of erythropoiesis with recombinant human erythropoietin or its analogues such as darbepoetin α. The other involves iron substitution, administered preferably intravenously for improved efficacy and tolerability. Clinical studies evaluating treatment of anaemia in chronic heart failure with erythropoiesis-stimulating agents conducted so far were of a small scale, were not controlled with placebo and usually assessed proxy parameters. Their results suggested that effective treatment of anaemia in patients with chronic heart failure improves exertion tolerance, clinical status (NYHA class) as well as the quality of life and reduces the need for blood transfusions. Recently completed TREAT study was the first large morbidity and mortality study evaluating treatment of anaemia with an erythropoietin analogue compared to placebo. On a sample of more than 4000 patients with diabetes mellitus, chronic renal failure and significant anaemia, this study has shown that effective treatment of anaemia with darbepoetin α did not affect at all the incidence of cardiovascular and renal events; on the other hand, it had lead to a nearly two‑fold increase in the incidence of cerebrovascular events. Some doubts about the safety of treatment with erythropoiesis-stimulating agents have occurred in the past based on the studies of anaemia treatment in patients with cancer and renal diseases. An answer to the question whether the treatment of anaemia associated with chronic heart failure affects positively the patient prognosis will be provided following the completion of the currently running morbidity and mortality RED-HF study.
Key words:
anaemia – chronic heart failure – chronic renal failure – erythropoiesis-stimulating agents – iron – clinical study FAIR-HF – clinical study TREAT
Autoři: J. Hradec
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2010; 56(8): 854-859
Kategorie: 50. narozeniny prof. MUDr. Jindřicha Špinara, CSc., FESC, člena redakční rady časopisu Vnitřní lékařství
Souhrn
Anémie je při chronickém srdečním selhání podobně jako při chronickém renálním selhání relativně častým jevem. O obou stavů představuje silný a nezávislý prediktor zvýšené morbidity a mortality. Etiologie této anémie je mutifaktoriální. V jejím vzniku hraje roli řada různých faktorů, např. neadekvátní produkce erytropoetinu v ledvinách, útlum kostní dřeně, deficience železa, ale také hemodiluce při retenci tekutin. Léčebné strategie jsou zaměřeny dvěma směry. Jedním je stimulace erytropoézy rekombinantním lidským erytropoetinem anebo jeho analogy, jako je darbepoetin α. Druhým pak substituce železa, pro vyšší účinnost a lepší toleranci především intravenózně. Dosud provedené klinické studie léčby anémie při chronickém srdečním selhání erytropoézu stimulujícími látkami byly menší, nebyly kontrolovány placebem a většinou hodnotily náhradní ukazatele. Jejich výsledky naznačovaly, že účinná léčba anémie u nemocných s chronickým srdečním selháním zlepšuje toleranci zátěže, zlepšuje klinický stav (třídu NYHA) i kvalitu života a snižuje nutnost podávání krevních transfuzí. Nedávno ukončená klinická studie TREAT byla první velká morbiditní a mortalitní studie srovnávající léčbu anémie analogem erytropoetinu proti placebu. U více než 4 000 nemocných s diabetes mellitus, chronickým renálním selháním a významnou anémií ukázala, že účinná léčba anémie darbepoetinem α vůbec neovlivnila výskyt ani kardiovaskulárních, ani renálních příhod, naopak, takřka na dvojnásobek zvýšila výskyt mozkových cévních příhod. Pochybnosti o bezpečnosti léčby erytropoézu stimulujícími látkami vznikly již v minulosti ze studií léčby anémie u onkologických i nefrologických nemocných. Odpověď, zda léčba anémie při chronickém srdečním selhání ovlivní příznivě prognózu nemocných, dostaneme až z výsledků probíhající morbiditně‑mortalitní studie RED‑HF.
Klíčová slova:
anémie – chronické srdeční selhání – chronické renální selhání – erytropoézu stimulující látky – železo – klinická studie FAIR‑HF – klinické studie TREATÚvod
Chronické srdeční selhání (CHSS) je progresivní onemocnění, při kterém počáteční poškození myokardu vede k dalšímu zhoršování funkce srdce a v pokročilé fázi také k poškození dalších orgánů. Srdce disponuje řadou adaptačních mechanizmů k tomu, aby při srdečním selhávání co nejdéle udrželo svou funkci jako pumpy. Patří mezi ně např. Frankův‑Starlingův mechanizmus, aktivace sympatoadrenálního systému a systému renin‑angiotenzin‑aldosteron, stejně jako remodelace myokardu.Důležitým faktorem v udržování energie, která je potřebná k udržení systolické funkce srdce, je nenarušená rovnováha mezi dodávkou a spotřebou kyslíku v myokardu. Nedostatečná dodávka kyslíku může vést až k ischemii myokardu. Myokardiální spotřebu kyslíku určují 3 hlavní faktory, kterými jsou srdeční frekvence, myokardiální kontraktilita a napětí myokardiální stěny. Nabídka kyslíku je ovlivňována plazmatickou koncentrací hemoglobinu a koronárním arteriálním a zejména kapilárním průtokem. Hustá kapilární síť v myokardu zajišťuje, že každý kardiomyocyt bezprostředně přiléhá ke kapiláře. Při CHSS se zvyšuje velikost kardiomyocytů, aniž by však současně přibývalo kapilár. Výsledkem je, že při CHSS, ať již systolické nebo neischemické etiologie, dochází k absolutnímu nebo relativnímu snížení denzity kapilár v myokardu, což vede k myokardiální hypoperfuzi. Snížený krevní průtok se sníženou dodávkou kyslíku do hypertrofického myokardu může vést k dalšímu poškozování kardiomyocytů a progresi srdečního selhání. Samotné primární poškození myokardu, které stojí na začátku vzniku a progrese CHSS, je většinou ireverzibilní. Některé faktory, které vedou k výše popsanému narušení rovnováhy mezi nabídkou a poptávkou kyslíku v myokardu, jsou však léčebně ovlivnitelné až úplně odstranitelné. Příkladem je anémie při CHSS, která může být farmakologicky ovlivnitelná. To samozřejmě vzbudilo velké naděje, že zmírnění nebo úplné odstranění anémie může být další léčebnou strategií, která by mohla zlepšit stále neblahý osud nemocných s CHSS. Tento přehledový článek se pokouší shrnout a diskutovat pokroky ve výzkumu komplexní etiologie anémie při CHSS a první výsledky klinických studií s léčbou této anémie erytropoézu stimulujícími látkami (EPA – erythropoiesis-stimulating agents).
Anémie při chronickém srdečním selhání
Anémie , která je podle Světové zdravotnické organizace definována jako plazmatická koncentrace hemoglobinu (Hb) u mužů < 130 g/l a u žen < 120 g/l, se vyskytuje podle různých zdrojů u 4–61 % nemocných s CHSS [1]. Prevalence anémie se zvyšuje se stoupající tíží srdečního selhání. Uvedené široké rozmezí prevalence anémie je způsobeno širokým rozmezím hodnot Hb použitých k definici anémie a také velmi různorodými soubory nemocných s CHSS, které byly k epidemiologickým analýzám použity. Anémie vede k chronickému objemovému přetížení levé srdeční komory, které způsobuje zvýšenou myokardiální spotřebu kyslíku, dilataci a hypertrofii levé komory. To vše při CHSS negativně ovlivňuje srdeční funkci a působí progresi srdečního selhání. A skutečně také mnohé post‑hoc analýzy randomizovaných a kontrolovaných klinických studií konzistentně ukázaly, že anémie je při CHSS silným a nezávislým prediktorem horší prognózy [1]. Nedávno bylo také retrospektivní analýzou dat ze studie COMET doloženo, že nově vzniklá anémie v průběhu 5letého sledování byla nezávisle sdružena s vyšší morbiditou i mortalitou [2]. Všechna tato data jasně ukazují, že anémie je při CHSS známkou špatné prognózy nemocného. Nastoluje se tak legitimní otázka, zda anémie při CHSS představuje pouze marker špatné prognózy, nebo je s horší prognózou spjata kauzálně, a je tedy rizikovým faktorem. A protože máme k dispozici účinné prostředky k léčbě této anémie, je zodpovězení položené otázky mimořádně důležité. Odpověď ale mohou dát pouze kontrolované, randomizované klinické studie.
Etiologie anémie při CHSS je nepochybně multifaktoriální (obr. 1) [1,3]. V poslední době jsme jí mnohem lépe porozuměli, stále však zůstává mnoho věcí nejasných. Hlavními faktory, které se podílejí na vzniku anémie, jsou neadekvátní produkce erytropoetinu, útlum funkce kostní dřeně, retence tekutin a deficience železa. Podívejme se na tyto hlavní etiologické faktory podrobněji.
Obr. 1. Etiologie anémie u srdečního selhání. 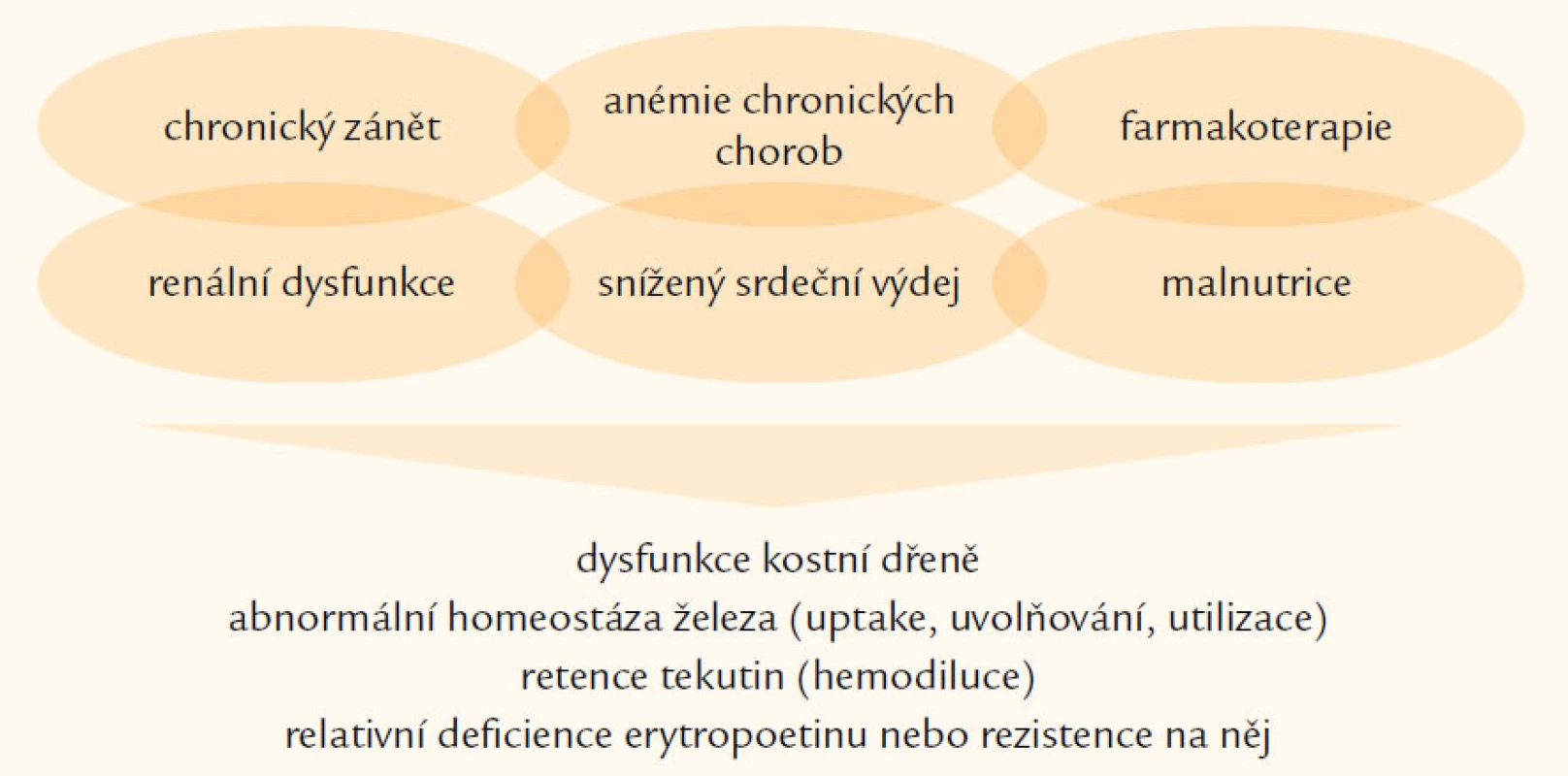
Neadekvátní produkce erytropoetinu
CHSS s anémií je navíc často doprovázeno i chronickým renálním poškozením. Na rozdíl od chronické renální insuficience je však při CHSS koncentrace cirkulujícího erytropoetinu zvýšena a dále se ještě zvyšuje paralelně s progresí CHSS a nezávisle předpovídá špatnou prognózu. Když se ale koncentrace erytropoetinu přepočítá na koncentraci Hb, ukáže se, že 90 % anemických nemocných s CHSS má skutečnou koncentraci erytropoetinu nižší, než by měli mít. Toto oblenění produkce erytropoetinu je prokazatelné i u nemocných s CHSS a normální renální funkcí i nemocných s CHSS bez anémie. Zdá se tedy, že anémie při CHSS není způsobena nedostatečnou tvorbou erytropoetinu, ale spíše neschopností dostatečně adaptovat tvorbu erytropoetinu jeho stoupající potřebě. Obleněná tvorba erytropoetinu je způsobena sníženou perfuzí ledvin a rozvíjející se renální insuficiencí. Také cirkulující zánětlivé cytokiny a léčba inhibitory ACE mohou přímo inhibovat produkci erytropoetinu v ledvinách a přispívat k jeho obleněné tvorbě.
Útlum funkce kostní dřeně
Relativně zvýšené koncentrace erytropoetinu u neanemických nemocných s CHSS ukazují, že buňky kostní dřeně na něj sníženě reagují. Chronické srdeční selhání je často spojeno s vzestupem koncentrací různých cytokinů a jiných biochemických markerů zánětu. Je experimentálně prokázáno, že interleukin‑1, TNF‑α, interferony-α, -β i - γ v kostní dřeni přímo inhibují vyzrávání erytropoetických progenitorových buněk do zralých forem [4]. Inhibiční účinek zánětlivých cytokinů pak zvyšuje plazmatické koncentrace erytropoetinu, které jsou nutné pro udržení adekvátní tvorby erytrocytů. Navíc, leukocyty z krve nemocných s CHSS vykazují známky zrychleného stárnutí a některé podskupiny leukocytů vykazují dysfunkci [5].
Retence tekutin
Retence tekutin, způsobená hypoperfuzí ledvin, má za následek volumexpanzi s hemodilucí, která může způsobit pseudoanémii. Až donedávna byla pseudoanémie považována za problém pouze u nemocných s akutně dekompenzovaným nebo terminálním CHSS. Ukázalo se však, že extracelulární objem je zvýšen i u klinicky naprosto stabilizovaných nemocných bez známek retence tekutin a že subklinická retence tekutin sama o sobě může vést k anémii [4].
Deficience železa
Nemocní s CHSS mají často také standardní biochemické projevy deficience železa. V punktátech kostní dřeně jsou u většiny anemických nemocných s CHSS zásoby železa zcela vyčerpány [6]. Příčinou deplece železa může být nedostatečná výživa, malabsorpce a srdeční kachexie. Situaci může dále zhoršovat užívání kyseliny acetylsalicylové a perorálních antikoagulancií, které mohou vést k mikroskopickým, ale dlouhodobým krevním ztrátám do zažívacího traktu.
Jak se ale překvapivě ukazuje, snížené zásoby železa jsou v kostní dřeni i u neanemických nemocných s CHSS [4]. Železo je zřejmě, podobně jako u jiných chronických onemocnění, redistribuováno do retikuloendoteliálního systému. Proto snížená zásoba železa v kostní dřeni nevysvětluje uspokojivě vznik anémie při srdečním selhání.
Již výše bylo řečeno, že etiologie anémie při CHSS je multifaktoriální. Mnoho výše popsaných faktorů, které jsou spojeny s výskytem anémie, se objevují často i u neanemických nemocných s CHSS. Kostní dřeň potřebuje při CHSS k udržení adekvátní erytropoézy vyšší plazmatickou koncentraci erytropoetinu. Částečně to je zřejmě způsobeno funkčním vyčerpáním kmenových buněk, částečně přímou inhibicí zánětlivými cytokiny a inhibitory ACE. Navíc jsou zásoby železa redistribuovány z kostní dřeně, a tím je erytropoéza dále omezena. Působení všech těchto faktorů vede k tomu, že erytropoetický systém je při CHSS velmi vulnerabilní. S progresí CHSS se zhoršuje perfuze ledvin, rozvíjí se chronické renální selhání s obleněním produkce erytropoetinu a klesá schopnost kostní dřeně uspokojovat zvýšené nároky. To vše je agravováno retencí tekutin, zvýšením objemu cirkulující tekutiny a hemodiluční anémií [7].
Léčebné možnosti
Léčebné strategie u anémie doprovázející CHSS jsou zaměřeny dvěma směry – jednak na substituci železa, jednak na stimulaci erytropoézy rekombinantním lidským erytropoetinem (rhEPO) a jeho novějšími analogy.
Erytropoézu stimulující látky (EPA)
Endogenní erytropoetin představuje základní regulátor tvorby červených krvinek. Tento glykoproteinový hormon se 165 aminokyselinami v molekule je tvořen v ledvinách a je uvolňován do oběhu jako odpověď na jejich hypoxii. Působí v kostní dřeni tím, že zlepšuje (stimuluje) přežívání, proliferaci a diferenciaci erytrocytů z jejich prekurzorových buněk. V roce 1983 byl v laboratořích americké firmy Amgen identifikován a klonován gen pro lidský erytropoetin, a tím byl položen základ k výrobě rhEPO ovariálními buňkami čínských křečků. V roce 1989 byl rhEPO registrován americkou FDA pro léčbu anémie u hemodialyzovaných nemocných pro chronické renální selhání. Je dostupný v subkutánní nebo intravenózní aplikační formě.
Zjištění, že anémie při CHSS je spojena s relativní nedostatečností produkce erytropoetinu v ledvinách a jeho zvýšenou potřebou v kostní dřeni, vedla k testování rhEPO k léčbě této anémie. První malé studie s rhEPO u anemických nemocných s CHSS byly publikovány před takřka 10 roky. Prokázaly příznivý vliv této léčby na náhradní kardiovaskulární cíle, jako je zvýšení hodnoty ejekční frakce levé komory, zlepšení funkční třídy NYHA, zvýšení tolerance zátěže a zlepšení renálních funkcí [8]. Později vyvinula firma Amgen darbepoetin‑α, analogon s delším účinkem a vyšší biologickou aktivitou. Účinek darbepoetinu-α byl u nemocných s CHSS a anémií studován v několika větších klinických studiích. Tyto studie prokázaly, že léčba darbepoetinem-α je bezpečná, účinně zvyšuje plazmatickou koncentraci Hb, zvyšuje toleranci zátěže a zlepšuje kvalitu života [9–11]. Všechny studie s EPA u CHSS a anémií byly zpracovány v metaanalýze, která zahrnula celkem 650 nemocných v 7 studiích. Léčba EPA byla spojena s poklesem výskytu hospitalizací pro srdeční selhání o 41 %, ale žádný rozdíl v mortalitě nebyl pozorován [12].
Substituce železa
Druhou strategií léčby anémie při CHSS je substituce železa, paralelní k léčbě EPA. Jak bylo popsáno výše, je relativní nedostatek železa jedním z hlavních faktorů, které ze podílejí na etiologii anémie při CHSS. Substituce železa je nezbytná pro tvorbu hemoglobinu, zejména u nemocných, kteří jsou současně léčeni rhEPO, protože stimulace erytropoézy ještě zvětšuje funkční nedostatek železa. Perorální přípravky jsou z několika důvodů v této situaci nevhodné. Jednak mohou být při zhoršeném vstřebávání ze zažívacího traktu k dosažení a udržení adekvátních zásob železa nedostatečné, jednak jsou nemocnými často špatně tolerovány pro častý výskyt nežádoucích účinků, jako jsou nauzea, zácpa, tlak až bolesti v epigastriu. Proto se jednoznačně dává přednost intravenózní aplikaci různých přípravků železa (dextranu, glukonátu, laktátu).
Nedávno byly publikovány výsledky klinické studie FAIR-HF, ve které byla studována role i.v. podávaného železa u nemocných s CHSS. Do této studie bylo zařazeno 459 nemocných s CHSS, ve funkční třídě NYHA II nebo III, s průměrnou hodnotou ejekční frakce 0,32. Všichni nemocní měli laboratorně prokázanou deficienci železa, ať již s anémií (Hb 95–120 g/l), nebo bez anémie (Hb 120–135 g/l). Jednou týdně podávaný i.v. přípravek železa (karboxymaltát) rychle vedl k významnému vzestupu plazmatické koncentrace železa. V podskupině anemických nemocných došlo k mírnému vzestupu koncentrace Hb, ale v podskupině nemocných bez anémie nikoliv [13]. Podávání železa zlepšilo významně symptomy, funkční třídu NYHA, kvalitu života i toleranci zátěže (obr. 2). Zajímavé je, že tyto příznivé výsledky byly stejné jak u anemických nemocných, tak u nemocných bez anémie. U aktivně léčených nemocných byl také pozorován trend k méně hospitalizacím. Nicméně léčba i.v. železem vzbuzuje také pochybnosti o tom, zda je bezpečná. Kromě alergických reakcí může železo rovněž urychlovat tvorbu volných kyslíkových radikálů, zvyšovat oxidativní stres a působit endoteliální dysfunkci. Nekontrolované podávání železa může vést k nahromadění toxického množství železa v retikuloendoteliálním systému. Bezpečnost i.v. podávání železa je testována v další probíhající randomizované a kontrolované klinické studii IRON-HF [14].
Obr. 2. Klinická studie FAIR-HF: výsledky 6minutového testu chůzí. Upraveno podle [13]. ![Klinická studie FAIR-HF: výsledky 6minutového testu chůzí. Upraveno podle [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8bedd0bd46c5c36a95d8321c890f3f28.jpeg)
Bezpečnost léčby EPA
Od okamžiku, kdy medicína dostala do rukou účinnou léčbu anémie při chronickém renálním selhání v podobě rhEPO, se EPA staly standardní léčbou nemocných s pokročilým renálním selháním a těžší anémií. Je překvapivé, že za více než 20 let, kdy je tato léčba nefrology hojně používána, nebyla provedena jediná placebem kontrolovaná mortalitně‑morbiditní studie. Předpokládalo se totiž, že zmírnění anémie automaticky vede ke zlepšení prognózy, a proto bylo podávání placeba nemocným s pokročilým renálním selháním a anémií považováno za neetické. Několik málo studií, které byly u nefrologických nemocných provedeny, proto neporovnávaly účinnost EPA proti placebu, ale porovnávaly intenzivnější léčbu EPA s cílem dosažení vyšší koncentrace Hb proti léčbě méně intenzivní s nižší cílovou hodnotou Hb.
Přitom již v roce 1998 byla bez většípozornosti předčasně ukončena klinická studie s 1 233 nemocnými s pokročilým chronickým renálním selháním a anémií, kteří byli léčeni dvěma dávkovacími režimy rhEPO s cílovými hodnotami hematokritu 0,42 a 0,30 [15]. Důvodem k předčasnému ukončení bylo zvýšené riziko úmrtí a nefatálních infarktů myokardu v podskupině nemocných randomizovaných k léčebnému režimu s cílem dosažení vyšších hodnot hematokritu (HR = 1,3, 95% CI = 0,9–1,9). Mezi oběma podskupinami nemocných nebyl žádný rozdíl v hodnotách krevního tlaku, ale u nemocných s cílem dosažení vyšší hodnoty hematokritu byl vyšší výskyt trombóz dialyzačních cévních přístupů (39 % vs 29 %; p = 0,001). Předčasně bylo ukončeno také několik studií u onkologických nemocných s významnou anémií, protože u nemocných léčených rhEPO byla významně vyšší mortalita [16]. Na tento fakt přece jenom zareagovala americká FDA varováním, že mají být podávány co nejnižší dávky EPA, které vedou k pozvolnému vzestupu koncentrace Hb na nejnižší hodnotu, která zabrání nutnosti podávat krevní transfuze. Obavy z kardiovaskulární bezpečnosti EPA významně zesílily poté, co byly v prestižním New England Journal of Medicine v listopadu roku 2006 publikovány 2 nefrologické klinické studie s nemocnými s pokročilým chronickým renálním selháním – studie CHOIR (Correction of Hemoglobin and Outcomes in Renal Insufficiency) [17] a studie CREATE(Cardiovascular Risk reduction by Early Anemia Treatment with Epoietin beta) [18]. Obě tyto studie porovnávaly 2 strategie léčby erytropoetinem s cílem nalézt optimální cílovou koncentraci Hb pro nemocné s pokročilým chronickým selháním ledvin.
Ve studii CHOIR bylo celkem 1 432 ne-mocných randomizováno k léčbě rhEPOs cílem dosažení hodnoty Hb 135 g/l nebo 113 g/l. Nemocní randomizovaní k vyšší cílové hodnotě Hb dostali větší dávky rhEPO i železa a dosáhli vyšší koncentraci Hb. V průběhu sledování v průměru 16 měsíců však u nich byla pozorována vyšší incidence složeného klinického endpointu (úmrtí + infarkt myokardu + hospitalizace pro srdeční selhání + CMP) s HR = 1,34 a p = 0,03 [17]. Rozdíl byl dán především úmrtími (52 vs 36) a hospitalizacemi pro srdeční selhání (64 vs 47). Ve skupině s vyšším cílovým Hb byl také pozorován trend k častější transplantaci ledviny. Mezi oběma podskupinami nebyl pozorován vůbec žádný rozdíl v kvalitě života.
V studii CREATE bylo randomizováno 603 nemocných s pokročilým renálním selháním a významnou anémií randomizovaných k léčbě rhEPO k cílové hodnotě Hb 130–150 g/l nebo pouze k částečné korekci anémie, kdy byl rhEPO podáván pouze při poklesu Hb pod hodnotu 105 g/l. Na rozdíl od studie CHOIR nebyl u nemocných léčených k normálním hodnotám Hb pozorován zvýšený výskyt kardiovaskulárních příhod. Ve skupině s vysokým Hb potřebovalo více nemocných hemodialýzu, ale kvalita života byla v této podskupině zlepšena (p < 0,01) [18].
Překvapivé výsledky studie TREAT
Studie TREAT (The Trial to Reduce car-diovascular Events with Aranesp® Therapy) byla první klinická studie, ve které byla léčba EPA (darbepoetin α – Aranesp®) hodnocena proti placebu. Mnohými to bylo při zahájení studie považováno za neetické. Ve studii bylo randomizováno 4 038 nemocných s diabetes mellitus 2. typu, pokročilým renálním selháním a významnou anémií k dvojitě zaslepenému podávání buď darbepoetinu a, nebo placeba. Výsledky byly překvapivé a nepříjemné. Podávání darbepoetinu α sice významně zvýšilo průměrnou koncentraci hemoglobinu o takřka 20 g/l (z bazálních 104 na 125 vs 106 g/l při placebu) a snížilo také významně počet podaných transfuzí. Neovlivnilo však vůbec výskyt obou primárních kombinovaných sledovaných klinických parametrů – kardiovaskulárního (součet úmrtí a velkých kardiovaskulárních příhod – IM, CMP a srdeční selhání) (obr. 3), ani renálního (úmrtí a terminální renální selhání). Naopak, podávání darbepoetinu bylo spojeno s významně vyšším rizikem CMP, jejichž výskyt stoupl takřka na dvojnásobek (HR = 1,92; p < 0,001) [19].
Obr. 3. Klinická studie TREAT: výskyt primárního kombinovaného kardiovaskulárního endpointu (součet úmrtí + IM + CMP + hospitalizace pro srdeční selhání). Upraveno podle [19]. ![Klinická studie TREAT: výskyt primárního kombinovaného kardiovaskulárního endpointu (součet úmrtí + IM + CMP + hospitalizace pro srdeční selhání). Upraveno podle [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/449ab78e3f7e87676e15c81d9d0d64ab.jpeg)
Závěr
Anémie je nepochybně prediktorem špatné prognózy jak nemocných s chronickým renálním selháním, tak i nemocných s CHSS. Automaticky se předpokládalo, že účinná léčba EPA, která vede k významnému vzestupu plazmatické koncentrace Hb, zlepší nejenom kvalitu života nemocných a sníží nutnost podávání krevních transfuzí, ale také zlepší prognózu. Ukazuje se, že to tak nemusí být. Navíc vznikly důvodné pochybnosti o bezpečnosti léčby EPA. Definitivní odpověď na otázku, zda je léčba EPA u nemocných s CHSS a významnou anémií účinná a bezpečná, přinese, doufejme, klinická studie RED‑HF, ve které má být randomizováno 2 600 nemocných s CHSS a těžkou anémií buď k léčbě darbepoetinem a, nebo k placebu [20]. Primárním sledovaným kombinovaným klinickým ukazatelem je v této studii součet úmrtí a hospitalizací pro zhoršení CHSS. Na její výsledky si asi budeme muset ještě nějaký čas počkat, protože náběr do studie jde nesmírně obtížně a pomalu, nepochybně také pod vlivem dosud publikovaných výsledků výše popsaných studií. A není vyloučeno, že studie bude předčasně ukončena (z etických důvodů?).
Výše popsaná historie léčby, o jejíž účinnosti nikdo nepochyboval, je přesvědčivým dokladem toho, že v medicíně nikdy nemůžeme věřit teoretickým předpokladům, byť by zněly sebevěrohodněji. Vždy je nutno počkat na výsledky klinických studií, které mohou být s teoretickými předpoklady v naprostém rozporu. Historie léčby anémie doprovázející pokročilé renální selhání a zhoubné nádory toho není prvním a určitě ani posledním příkladem.
Doručeno do redakce: 24. 5. 2010
prof. MUDr. Jaromír Hradec, CSc., FESC
www.vfn.cz
e‑mail: jhradec@vfn.cz
Zdroje
1. Tang YD, Katz SD. Anemia in chronic heart failure: prevalence, etiology, clinical correlates, and treatment options. Circulation 2006; 113 : 2454–2461.
2. Komajda M, Anker SD, Charlesworth A et al. The impact on new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J 2006; 27 : 1440–1446.
3. van der Meer P, Voors AA, Lipsic E et al. Erythropoietin in cardiovascular diseases. Eur Hert J 2004; 25 : 285–291.
4. Westenbrink BD, Visser FW, Voors AA et al. Anaemia in chronic heart failure is not only related to impaired renal perfusion and blunted erythropoietin production, but to fluid retention as well. Eur Heart J 2007; 28 : 166–171.
5. van der Harst P, van der Steege G, de Boer RA et al. Telomere length of circulating leukocytes is decreased in patients with chronic heart failure. J Am Coll Cardiol 2007; 49 : 1459–1464.
6. Nanas JN, Matsouka C, Karageorgopoulos D et al. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006; 48 : 2485–2489.
7. Westenbrink BD, de Boer RA, Voors AA et al. Anemia in chronic heart failure: etiology and treatment options. Curr Opin Cardiol 2008; 23 : 141–147.
8. Silverberg DS, Wexler D, Sheps D et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneous erythropoietin and intravenous iron: a randomized controlled study. J Am Coll Cardiol 2001; 37 : 1775–1780.
9. Ghali JK, Anand IS, Abraham WT et al. STAMINA‑HeFT group. Randomized double‑blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation 2008; 117 : 526–535.
10. Ponikowski P, Anker SD, Szachniewicz Jet al. Effect of darbepoetin alfa on exercise tolerance in anemic patients with symptomatic chronic heart failure: a randomized, double‑blind, placebo‑controlled trial. J Am Coll Cardiol 2007; 49 : 753–762.
11. van Veldhuisen DJ, Dickstein K, Cohen‑-Solal A et al. Randomized, double‑blind, placebo‑controlled study to evaluate the effect of two dosing regimens of darbepoetin alfa in patients with heart failure and anaemia. Eur Heart J 2007; 28 : 2208–2216.
12. van der Meer P, Groenveld HF, Januzzi JL Jr et al. Erythropoietin treatment in patients with chronic heart failure: a meta‑analysis. Heart 2009; 95 : 1309–1314.
13. Anker SD Comin-Colet J, Filipptos G et al. FAIR‑HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361 : 2436–2448.
14. Beck da Silva L, Rohde LE, Pereira‑Barretto AC et al. Rationale and design of the IRON‑HF study: a randomized trial to assess the effect of iron supplementation in heart failure patients with anemia. J Card Fail 2007; 13 : 14–17.
15. Besarab A, Bolton WK, Browne JK et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med 1998; 339 : 584–590.
16. Steinbrook R. Erythropoietin, the FDA, and oncology. N Engl J Med 2007; 356 : 2448–2451.
17. Singh AK, Szczech L, Tang KL et al. CHOIR Investigators. Correction of anemia with epoetin alfa in chronic kidney disease. N Engl J Med 2006; 355 : 2085–2098.
18. Drüeke TB, Locatelli G, Clyne N et al. CREATE Investigators. Normalization of haemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med 2006; 355 : 2071–2084.
19. Pfeffer MA, Burdmann EA, Chen CY et al. A trial of darbepoetin alfa in type 2diabetes and chronic kidney disease. N Engl J Med 2009; 361 : 2019–2032.
20. McMurray JJ, Anand IS, Diaz R et al. Design of the Reduction of Events with Darbepoetin alfa in Heart Failure (RED‑HF): a phase III, anaemia correction, morbidity‑mortality trial. Eur J Heart Fail 2009; 11 : 795–801.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Jak a proč změnily staré léky prognózu nemocných s primárním lymfomem CNS? – editorial
- Problematika primárních lymfomů centrálního nervového systému – editorial
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
- Primární lymfomy centrálního nervového systému
- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů
- Imunoglobulin G4 pozitivní cholangitida
- K významnému životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC,
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Rizikový profil hypertonika
- Komplexní léčba kardiovaskulárního rizika. Zaměřeno na telmisartan
- Charakteristiky a osud pacientov s akútnym srdcovým zlyhávaním v aktuálnej klinickej praxi
- Anémie při chronickém srdečním selhání
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Význam fenofibrátu v liečbe aterogénnej dyslipoproteinémie
- Fibrilace síní v době katétrové ablace
- Rychlost aortální pulzové vlny u nemocných s metabolickým syndromem a hypertenzí léčených sartany
- Transplantace srdce – minulost, současnost a výhled do budoucna
- Šobrův den, XXV. konference o hyperlipoproteinemiích
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Anémie při chronickém srdečním selhání
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



