-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
Current cooling methods for induction of mild hypothermia in cardiac arrest survivors
Induction of mild therapeutic hypothermia early after return of spontaneous circulation improves prognosis of cardiac arrest survivors. Rapid cooling of the patients and correct maintainance of the target therapeutic temperature followed by controlled slow rewarming can be achieved by several noninvasive and invasive methods of various efficacy. Elementary and the most frequently used methods are surface cooling via ice ‑ packs and rapid intravenous administration of cold crystaloids. Mattress cooling systems and facilities for endovascular cathether ‑ cooling are more sophisticated, manageable and ensure more precise titration of therapeutic temperature. Cooling caps and helmets leading to selective head cooling can be used as the complementary techniques. Several other methods are too instrumentation ‑ intensive, too invasive or investigated in animal experiments only. Anyway, near future may bring a rapid development of new effective and safe cooling systems.
Key words:
cardiac arrest – mild hypothermia – cooling method
Autoři: R. Škulec 1,2; A. Truhlář 3,4; P. Ošťádal 5; P. Telekes 6; J. Knor 8; M. Ticháček 7; V. Černý 4; J. Šeblová 8
Působiště autorů: Územní středisko záchranné služby Středočeského kraje Beroun, ředitel MU Dr. Martin Houdek 1; Interní oddělení nemocnice Beroun, přednosta prim. doc. MU Dr. Karel Sochor, CSc. 2; Zdravotnická záchranná služba Královéhradeckého kraje, Hradec Králové, ředitel MU Dr. Ladislav Žabka, Ph. D. 3; Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Vladimír Černý, Ph. D., FCCM 4; Kardiologické oddělení Nemocnice Na Homolce Praha, přednosta doc. MU Dr. Miloš Táborský, CSc., FESC, MBA 5; Kardiocentrum Krajské nemocnice Liberec, přednosta prim. MU Dr. Rostislav Polášek 6; Územní středisko záchranné služby Moravskoslezského kraje Opava, ředitel MU Dr. Milan Ticháček 7; Územní středisko záchranné služby Středočeského kraje Kladno, ředitel MU Dr. Martin Houdek 8
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1060-1069
Kategorie: Přehledné referáty
Souhrn
Navození terapeutické mírné hypotermie zlepšuje prognózu nemocných úspěšně resuscitovaných pro srdeční zástavu. K ochlazení pacientů, k udržení správného terapeutického rozmezí tělesné teploty a k následnému pomalému dosažení a udržení normotermie existuje řada neinvazivních i invazivních metod s různou účinností. Jednoduchými a zároveň nejpoužívanějšími postupy jsou povrchové ochlazování ledovými obklady a rychlá nitrožilní aplikace chladného krystaloidního roztoku. Sofistikovanější matracové systémy pro povrchové ochlazování a soustavy pro endovaskulární katetrové chlazení jsou finančně nákladnější, ale zaručují především jednoduchou obsluhu a přesnější titraci cílové terapeutické teploty. Jako doplňkové metody mohou sloužit chladicí helmy nebo čepice vedoucí k selektivnímu ochlazování hlavy. Řada dalších potenciálně použitelných metod je buď příliš náročná na přístrojové vybavení, jsou příliš invazivní, anebo jsou otestované pouze v experimentu. V blízké budoucnosti však lze v této oblasti medicíny očekávat technologický rozvoj s vývojem nových účinných a bezpečných ochlazovacích systémů.
Klíčová slova:
srdeční zástava – mírná hypotermie – ochlazovací metodaÚvod
Terapeutická mírná hypotermie (TH) je v současnosti hlavním pilířem časné neuroprotektivní poresuscitační péče. Pokud je zahájena co nejdříve po obnovení spontánní cirkulace (ROSC), může velmi efektivně zvýšit pravděpodobnost příznivého neurologického výsledku neodkladné resuscitace, a dokonce snížit mortalitu nemocných. Bylo kalkulováno, že na záchranu jednoho pacienta navíc ve srovnání s konvenčními postupy bez TH je třeba ochladit na tělesnou teplotu (TT) 32–34 °C po dobu 12–24 hod pouze 6 nemocných [1]. Její použití oficiálně doporučila Evropská rada pro resuscitaci v roce 2003 [2]. V roce 2005 se metoda stala součástí Evropských doporučení pro kardiopulmonální resuscitaci a následně byla ve vyspělých zemích úspěšně implementovaná do rutinní praxe [3]. Pro splnění základních podmínek – začít ochlazovat co nejdříve, ochladit pacienta co nejrychleji a bezpečně – je kromě kvalifikovaného týmu potřeba mít k dispozici dostatečný výběr vhodných ochlazovacích metod. Některé jsou vhodnější pro použití v nemocnici, jiné pro přednemocniční péči (PNP). V práci uvádíme přehled současných ochlazovacích metod používaných v praxi i těch, které nabízí experimentální medicína.
Patofyziologie posthypoxické encefalopatie a cíle indukce mírné hypotermie po srdeční zástavě
K definitivnímu posthypoxickému poškození mozku i dalších orgánů vedou 3 fáze: ischemicko anoxická během srdeční zástavy, hypoxická s hypoperfuzí během neodkladné resuscitace a ischemicko reperfuzní po dosažení ROSC s následným rozvojem klinického obrazu poresuscitační choroby [4,5]. Během hodin se rozvíjí systémová zánětlivá odpověď se vzestupem hladiny prozánětlivých cytokinů s aktivací komplementu a leukocytů, s rozvojem endoteliální dysfunkce a s poruchou koagulační rovnováhy s následnou mikrovaskulární trombózou. Roli hraje hypoperfuze centrálního nervového systému v důsledku akutního cirkulačního selhání v čele s poresuscitační systolicko diastolickou myokardiální dysfunkcí. Vzniká porucha hematoencefalické bariéry a často se projeví relativní adrenální dysfunkce [5]. Uvedené procesy v mozku vedou jak k nekróze, tak k apoptóze, a to zejména v populacích selektivně vulnerabilních neuronů (obr. 1) [6].
Obr. 1. Celulární a subcelulární mechanizmy ischemicko-reperfuzního poškození mozku. Schéma sestaveno autory podle více zdrojů [5,6,100]. ![Celulární a subcelulární mechanizmy ischemicko-reperfuzního poškození mozku. Schéma sestaveno autory podle více zdrojů [5,6,100].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4d54f94880c28d8421c5cc29370c9577.jpeg)
ATP – adenosin trifosfát, NMDA – N-methyl-D-aspartátový receptor, AMPA – amino-3-hydroxy-5-metylisoxazole-4-propionátový receptor, NO – oxid dusnatý, VMK – volné mastné kyseliny, ARCH – kyselina arachidonová, COX – cyklooxygenáza, LOX – lipooxygenáza, DNA – kyselina deoxyribonukleová V experimentu byla testována řada farmak ovlivňujících patofyziologické pochody ischemicko reperfuzního poškození mozku (barbituráty, kalciové blokátory, inhibitory neuronální apoptózy, vychytávače kyslíkových radikálů, blokátory receptorů glutamátu atd.). Žádné z nich však, i přes dílčí úspěchy, není k dispozici pro použití v humánní medicíně [5]. Naopak, navození TH nespecificky tlumí všechny nepříznivé ischemicko reperfuzní děje, redukuje spotřebu kyslíku o 5–8% na každý stupeň poklesu TT a globálně zpomaluje metabolizmus se snížením produkce toxických metabolitů a snížením nároků na přísun energetických substrátů. Výsledkem je menší posthypoxické poškození mozku, což je hlavní klinický cíl léčby TH [8].
Termoregulace a fyzikální mechanizmy indukce mírné hypotermie
Z hlediska termoregulace rozdělujeme organizmus na centrální kompartment, neboli teplotní jádro (hlava a trup) a na periferní kompartment (končetiny a kůže). Za normální TT považujeme 36,6 ± 0,38 °C. Zatímco TT jádra je udržována konstantní, periferní je nižší o 2–4 °C a může kolísat. Míra tepelných ztrát je regulována ovlivněním prokrvení a pocení kůže a poměrně konstantní ztrátou tepla v plících při ventilaci. Fyzikální mechanizmy regulace tepelných ztrát jsou vyzařování (přesun tepla mezi dvěma povrchy o různé teplotě, které nejsou v přímém kontaktu a mezi nimiž není speciální médium), kondukce (přesun tepla mezi dvěma povrchy o různé teplotě, které jsou v přímém kontaktu), konvekce (přesun tepla do okolního vzduchu) a odpařování (ztráty tepla odpařováním vody z povrchu těla a z plic). Mechanizmem ke zvýšení produkce tepla je svalový třes. Zvyšuje také spotřebu kyslíku o 40–100%, což je u pacientů s posthypoxickým poškozením velmi nežádoucí [9,10]. Při indukci TH je třeba zvýšit tepelné ztráty a zároveň potlačit regulační opatření organizmu. Ztráty tepla zvyšujeme kontaktem periferního nebo centrálního kompartmentu s chladným médiem. Adjuvantní efekt má periferní vazodilatace navozená analgosedací. Nežádoucí svalový třes eliminujeme hlubokou analgosedací a event. myorelaxací [11].
Měření tělesné teploty
Pro hodnocení účinnosti ochlazování je nutné správné měření TT. Při celotělovém ochlazování nás zajímá TT tepelného jádra (odpovídá i TT mozku), při selektivním ochlazování hlavy je důležité monitorování teploty blízké teplotě mozku. Tělesnou teplotu je třeba změřit před zahájením TH a pokračovat kontinuálně během celého protokolu ošetření. Tělesnou teplotu jádra nejlépe reflektuje teplota v a. pulmonalis, v močovém měchýři a tympanická teplota. Validní je i monitorování rektální a nazofaryngeální, méně vhodné je měření ezofageální. Povrchové kožní měření je zcela nespolehlivé [12,13]. Při selektivním ochlazování mozku nejlépe odráží intracerebrální teplotu tympanická TT [14].
Ochlazovací metody
Přehled klinicky využívaných a experimentálních ochlazovacích metod je uveden v tab. 1. Za základní klasifikační přístup jsme zvolili rozdělení na metody vedoucí primárně k celotělovému ochlazení a na metody určené k primárnímu selektivnímu ochlazení hlavy a mozku. Selektivní metody je u dospělých nutné považovat pouze za doplňkové, protože z patofyziologie vyplývá, že po srdeční zástavě je třeba potlačit celotělovou ischemicko reperfuzní reakci.
Povrchové ochlazování
Povrchové ochlazování je jednoduchá a technicky prověřená metoda. V roce 2007 ji v České republice používalo 96% všech jednotek intenzivní péče používajících TH v akutní poresuscitační péči [15]. Byla též hlavním ochlazovacím postupem v klíčových randomizovaných klinických studiích [16,17]. K povrchovému ochlazování je možné využít široké spektrum prostředků.
Nejjednodušší a nejpoužívanější je ochlazování pacienta prostými ledovými obklady. Ochlazovací rychlost je nízká, kolem 0,3–0,8 °C/60 min [18,19]. Vzhledem k tomu, že jde o jednoduchou „manuální“ metodu, je obtížné stanovit správnou dávku ochlazovacího média. Ekvilibrizace ochlazeného povrchu těla a centrálních kompartmentů může být nekonstantní a není možná zpětnovazebná regulace ochlazování. Důsledkem je velmi častý výskyt fenoménu nadměrného ochlazení, tedy poklesu TT pod 32 °C (u 41–63% nemocných). Některé analýzy menších souborů naznačují, že tento fenomén může být spojen s horší prognózou pacientů [20]. Není jasné, zda prognózu zhoršuje přímo nadměrné ochlazení, zda je tento jev pouze markerem primárně horší prognózy pacientů nebo jde o náhodnou asociaci. Přesto je tento problém nutné brát v úvahu a na zachování správného terapeutického rozmezí TT klást velký důraz. Je také nutné zabránit přímému kontaktu ledových obkladů s kůží a eliminovat riziko omrzlin. Metoda je potenciálně použitelná nejen v nemocnici, ale i v PNP. Nevýhodou pro použití v PNP je ale pomalá ochlazovací rychlost a nutnost velkých prostorových požadavků (mrazicí box).
Na pacienta je také možné aplikovat proud chladného vzduchu. Jde o postup bez publikované evidence účinnosti a bezpečnosti.
Sofistikovanější je využití matracových termoregulačních systémů s cirkulací vzduchu nebo vody. Zatímco vzduchové systémy nejsou účinnější než ochlazování ledovými obklady, vodní technologie jsou ve všech směrech výhodnější. Ochlazovací rychlost je přibližně 1,33 °C/60 min a automatická zpětná vazba snižuje výskyt nadměrného ochlazení o 30% (obr. 2) [18].
Obr. 2. Matracový ochlazovací systém s cirkulací vody Blanketrol III, Cincinnati Sub-Zero Products, Inc., Cincinnati, USA. Z databáze Kardiologického oddělení Krajské nemocnice Liberec, a.s., s laskavým svolením MUDr. P. Telekese. 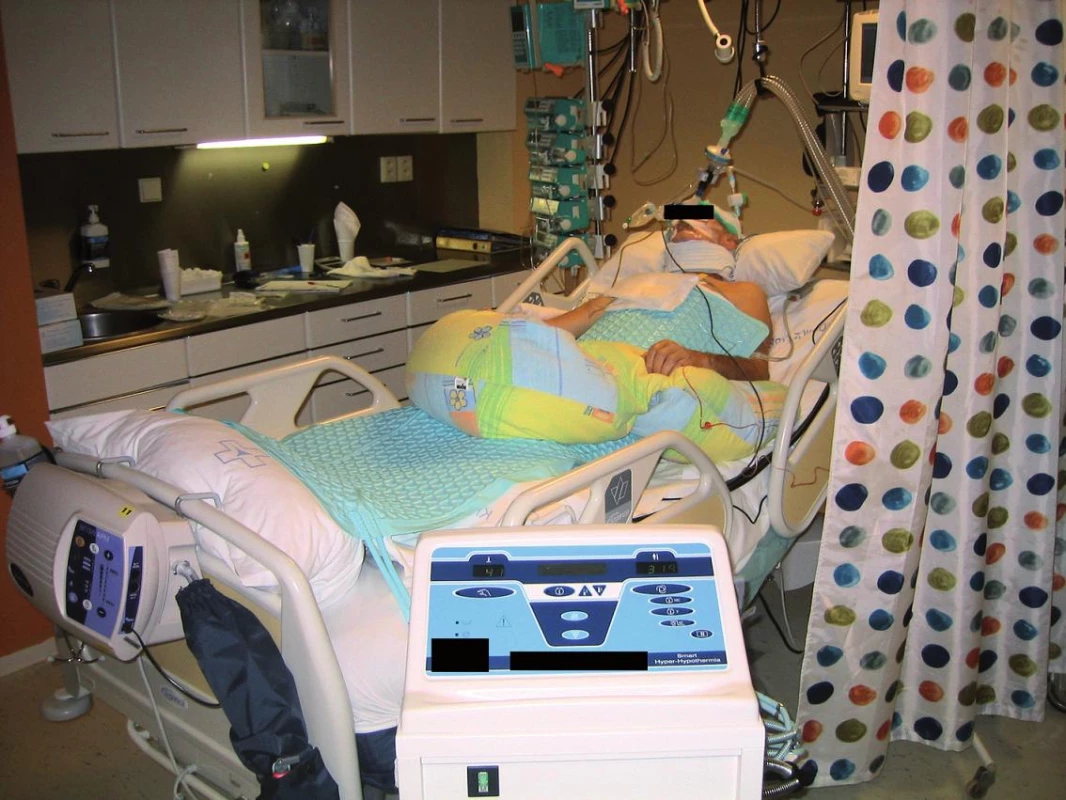
Prvním účinným transportním zařízením k navození TH v PNP na trhu je systém EMCOOLSpad©. Jde o gelové obklady na grafitové bázi s vysokou tepelnou vodivostí a s referovanou ochlazovací rychlostí 1,2 °C/30 min [21].
Rychlá intravenózní aplikace chladného krystaloidního roztoku
Rychlá intravenózní aplikace chladného krystaloidního roztoku (RIVA) o teplotě 4 °C v dávce 30–40ml/kg během 20–30 min do periferní žíly může snížit TT o asi 1,1–2,5 °C. Při použití v PNP dosáhneme u 50–65% nemocných cílové TT 33 °C ještě před předáním pacienta v nemocnici [22–30]. Bylo publikováno několik studií s aplikací fyziologického roztoku nebo Ringerova roztoku testujících technickou účinnost a bezpečnost metody. Výsledky jsou shrnuty v tab. 2. Přes metodologickou heterogenitu z nich vyplývá, že postup je velmi bezpečný. U celkem 312 zařazených nemocných byl pouze 3krát radiologicky pozorován plicní edém. Nebyly identifikovány žádné klinicky relevantní změny elektrolytů, acidobazické rovnováhy a oxygenace, krevního obrazu či koagulačních parametrů [23–25]. Nedošlo k významným změnám plnících tlaků levé a pravé komory a nebyla pozorována změna ejekční frakce levé komory [25]. Metoda byla srovnatelně efektivní při použití v nemocnici i v PNP. Je vhodná k rychlému ochlazení, nicméně i přes opakované následné aplikace chladného roztoku RIVA selhává v dlouhodobém udržení terapeutické teploty [24]. Proto je velmi důležité ihned po předání pacienta na cílové pracoviště navázat další ochlazovací metodou.
Tab. 2. Přehled klinických studií testujících ochlazování pacientů s OHCA pomocí rychlé nitrožilní infuze chladného krystaloidu. 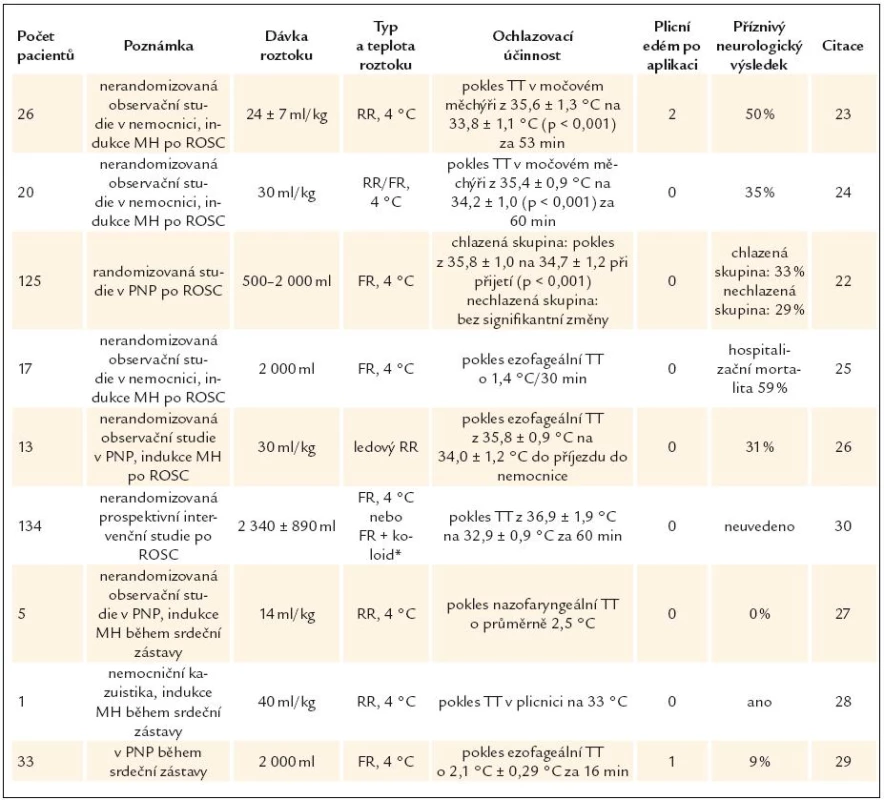
MH – mírná hypotermie, PNP – přednemocniční péče, ROSC – návrat spontánní cirkulace, RR – Ringerův roztok, FR – fyziologický roztok, TT – tělesná teplota *kombinace ledových roztoků a povrchového ochlazování, smíšená populace pacientů po NZO, s kraniocerebrálním traumatem a subarachnoideálním krvácením Účinnější než aplikace krystaloidního roztoku může být podání ledové tříště sestávající z mikročástic ledu a fyziologického roztoku. Tento postup byl však testován zatím pouze ve zvířecím experimentu [31].
Zkušenosti našeho týmu s RIVA v PNP jsou velmi příznivé. U 8 pacientů po srdeční zástavě mimo nemocnici (out of hospital cardiac arrest – OHCA) jsme v PNP dosáhli rychlou aplikací 1 500ml ledového fyziologického roztoku ochlazovací rychlost 2,1 °C/30 min. Zdržení na místě zásahu bylo minimální a nepozorovali jsme žádné komplikace související s ochlazením. Metoda vyžaduje speciální vybavení sanity – autolednici s 24hodinovým provozem s připravenou zásobou ledových infuzí v celkové dávce asi 2 500–3 000ml (obr. 3) a teploměr k spolehlivému změření tělesné teploty. Celý koncept indukce TH po OHCA v PNP v České republice je v současnosti testován v klinické studii PRE-COOL (Prehospital Cooling in Cardiac Arrest Patients), která probíhá ve Středočeském a Královéhradeckém kraji. Má za úkol ověřit rutinní proveditelnost metody v podmínkách České republiky a optimalizovat používaný protokol (www.pre cool.cz).
Obr. 3. Autolednice se zásobou chladného fyziologického roztoku v sanitě. 
Ochlazování metodou RIVA je tedy velmi účinné, bezpečné, jednoduché a ekonomicky nenáročné. Tyto charakteristiky metodu předurčují k využívání v ochlazovací fázi v nemocnici i v přednemocniční péči jako samostatnou, nebo v kombinaci s jinou metodou.
Velkoobjemové podání krystaloidního roztoku do aorty
V rámci dlouholetého výzkumu metodiky oddálené resuscitace (Sustained Resucitation, Emergency Preservation Resucitation) byla vyvinuta velmi rychlá ochlazovací technika. Je plánovaná zejména pro použití v PNP u pacientů s traumatickou srdeční zástavou s hemoragickým šokem. Principem je zavedení balónkového katétru do sestupné aorty s aplikací ledového krystaloidního roztoku v dávce až 100ml/kg do kompartmentu mezi aortální chlopní a insuflovaným balónkem, tedy do oblasti odstupu koronárních tepen a karotid. Ochlazovací rychlost je srovnatelná s kardiopulmonálním bypassem a je možné dosáhnout hluboké hypotermie 5–10 °C. Metoda je zatím experimentální, na prahu klinických studií [32].
Výplach žaludku a/nebo močového měchýře ledovým roztokem
Výplach žaludku a/nebo močového měchýře ledovým roztokem je jednoduchá a poměrně často používaná doplňková ochlazovací metoda (56% pracovišť) [15]. K dispozici je pouze minimální evidence o účinnosti a bezpečnosti. U 6 dobrovolníků v celkové anestezii opakovaný výplach močového měchýře vedl bezpečně k celotělovému ochlazení o 0,8 °C za hodinu. Výplach žaludku naopak indukoval křeče v břiše a průjem [33]. Na modelu experimentálně navozeného stresového vředu byl prokázán nepříznivý lokální efekt chladného výplachu žaludku na intenzitu poškození sliznice [34]. S vědomím malého množství informací lze tedy jako pouze doplňkovou metodu považovat pouze výplach močového měchýře ledovým roztokem.
Ledový výplach serózních dutin
Účinnost a bezpečnost peritoneální laváže byla testována pouze v experimentu u psů. Masivní instilací 10 °C chladného Ringerova roztoku byl bezpečně navozen průměrný pokles tympanické TT o 0,3 °C/min [35]. S klinickým využitím u nemocných po srdeční zástavě však nebyly publikovány žádné zkušenosti. Metoda je poměrně invazivní a při dostupnosti jiných ochlazovacích metod ji považujeme za příliš rizikovou.
Endovaskulární katetrové ochlazování
Principem endovaskulárního katetrového ochlazování (EKO) je speciální katétr zavedený do dolní duté žíly, ve kterém prostřednictvím extrakorporální regulační jednotky cirkuluje chladný fyziologický roztok bez přímého kontaktu s krví (obr. 4). Použití EKO bylo publikováno v řadě indikací, jako jsou léčba hypertermie a udržování normotermie u kriticky nemocných na neurologické JIP, při indukci TH u pacientů s kraniocerebrálním traumatem, s cévní mozkovou příhodou, s akutním infarktem myokardu, při navození TH v rámci prevence kontrastové nefropatie a také opakovaně při indukci TH po srdeční zástavě [36–45]. Tab. 3 nabízí přehled klinických studií hodnotících technickou a klinickou účinnost EKO u této skupiny nemocných. Nepřímo potvrzují již dokumentovanou klinickou účinnost TH a zároveň poukazují na některá specifika metody [23,46–50]. Všichni autoři pozorovali nízký anebo obvyklý výskyt krvácivých, infekčních a oběhových komplikací charakteristických pro nemocné po srdeční zástavě [47,49,50]. Metoda má i svoje limity. Pichon et al udržovali TH po dobu 36 hod a přes dlouhou řízenou ohřívací fázi (vzestup TT o 0,3 °C/hod) pozorovali následnou hypertermii až u 74% pacientů [48]. Wolffovi et al se u 22% nemocných nepodařilo metodou EKO dosáhnout cílové TT 33 °C [46].
Obr. 4. Endovaskulární katetrový ochlazovací systém CoolGard 3000TM a Icy femoral cathetherTM, Alsius Corp., Irvine, USA. 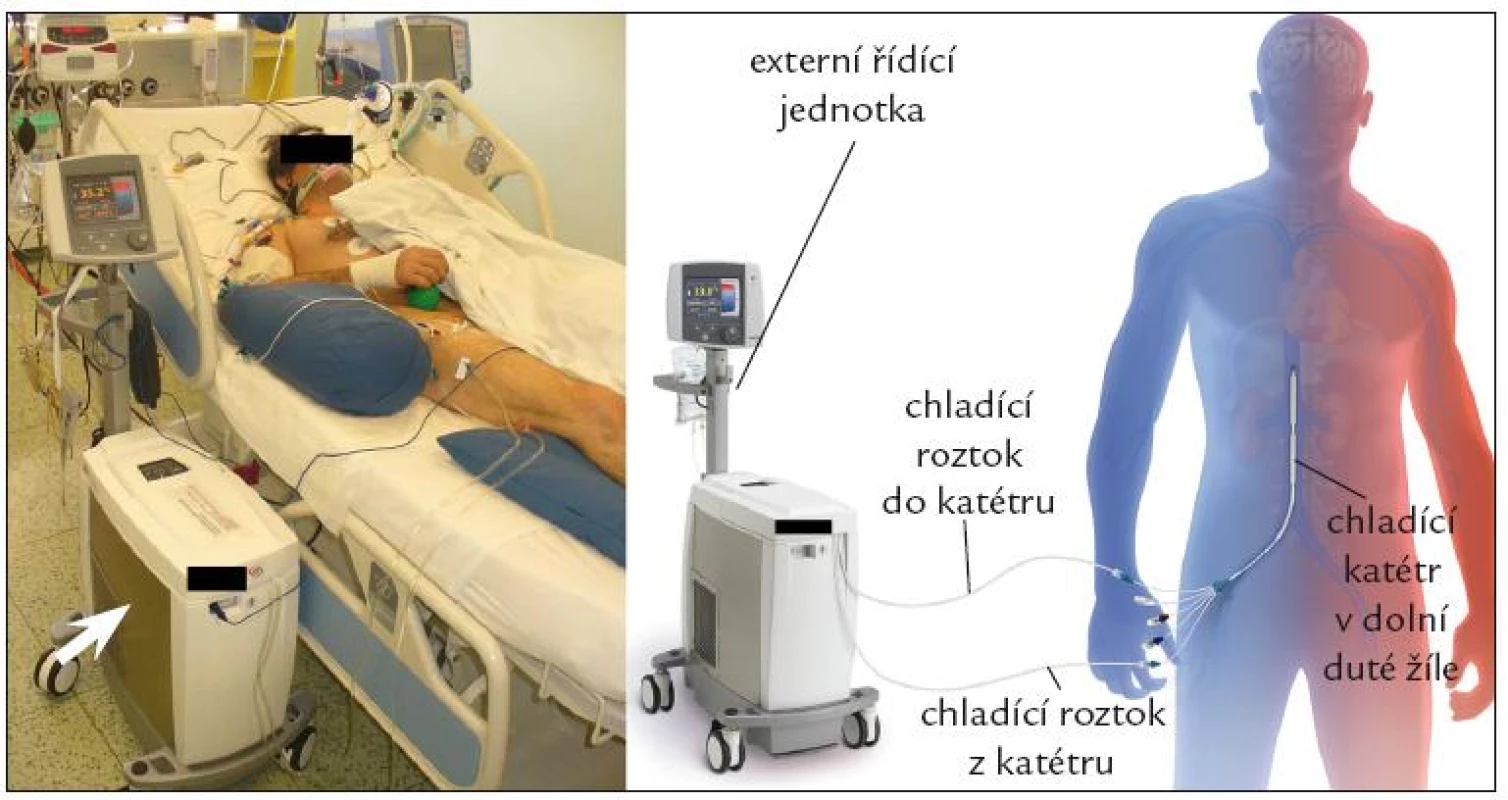
Levá část obrázku ilustrující reálné připojení zapůjčená z databáze Kardiologického oddělení Nemocnice Na Homolce, Praha s laskavým svolením doc. MU Dr. P. Ošťádala, Ph.D. Bílá šipka označuje externí řídicí jednotku. V pravé části obrázku schematické zapojení systému, zapůjčeno od výrobce. Tab. 3. Přehled klinických studií hodnotících účinnost EKO u nemocných po srdeční zástavě. Ve všech studiích byl k ochlazování použit systém CoolGard 3000<sup>TM</sup> a Icy femoral cathether<sup>TM</sup>, Alsius Corp., Irvine, USA. 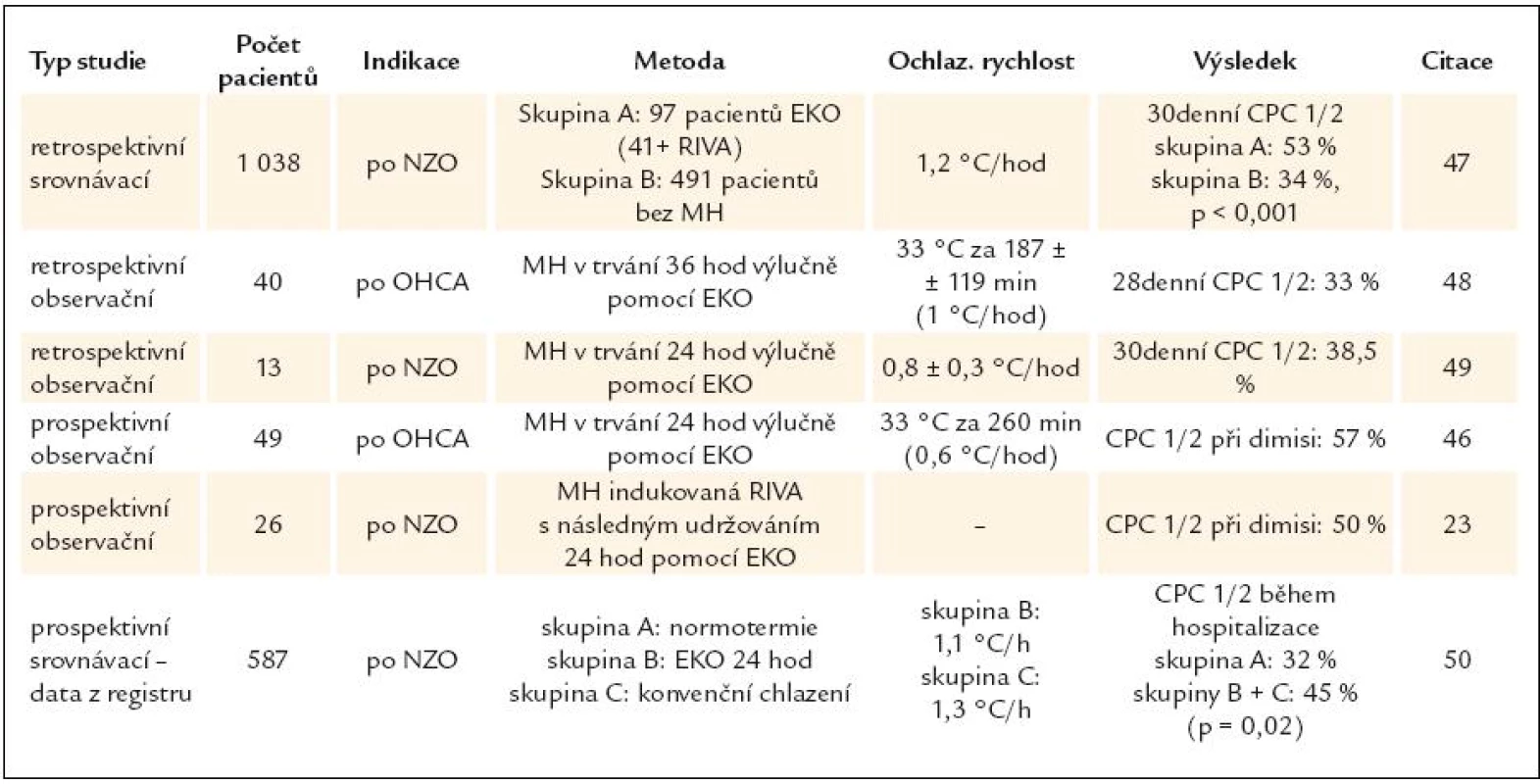
Arrich et al analyzovali rozsáhlý registr ERC HACA-R (European Resuscitation Council Hypothermia After Cardiac Arrest Registry). Celkem hodnotili 587 nemocných z 19 center v západní Evropě. 125 pacientů bylo léčeno normotermií (skupina A) a 462 hypotermií v trvání průměrně 24,3 hod. Z ochlazovaných nemocných bylo 347 (59%) ošetřeno metodou EKO (skupina B), zbývající pacienti povrchovým ochlazováním a metodou RIVA (skupina C). Ve skupině B i C byly pozorovány velmi podobné procedurální charakteristiky, pouze ve skupině C bylo ochlazování po ROSC zahájeno výrazně dříve než ve skupině B (75 vs 150 min, p < 0,05), ochlazovací rychlost byla mírně vyšší (1,1 vs 1,3 °C/hod, p < 0,05) a fáze ohřívání delší (10,5 vs 8,5 hod, p < 0,05). Naopak ve skupině B autoři pozorovali lepší titraci terapeutické teploty a nejnižší průměrná dosažená TT byla vyšší (32,9 vs 32,4 °C, p < 0,05). V celé skupině pacientů léčených TH byl referován relativně nízký výskyt nežádoucích účinků a komplikací (krvácivé komplikace 3%, arytmie 6%). Překvapením je, že arytmie byly pozorovány výrazně častěji u nemocných ochlazovaných metodou EKO (7,2 vs 0,9%, p = 0,01). Předčasně byla TH ukončena u 29 pacientů (6%). Nemocní léčení TH měli vyšší šanci na přežití s příznivým neurologickým výsledkem (OR 1,41, CI 1,08–1,89, p < 0,05) a použití metody zároveň nevedlo k nárůstu přeživších pacientů s nepříznivým neurologickým výsledkem [50]. Jedním z potenciálních nežádoucích účinků ochlazování metodou EKO může být hluboká žilní trombóza. Riziko zvyšuje nejen koagulopatie a imobilizace pacientů, ale i přítomnost žilního katétru ve femorální a dolní duté žíle. Simosa et al cíleně pátrali po incidenci hluboké žilní trombózy v souvislosti s EKO u 10 nemocných léčených TH pro kraniocerebrální trauma. Zjistili až 50% výskyt. Hlavní rizikové faktory byly nízké INR a doba zavedení katétru > 4 dny [51]. Ač tyto výsledky nelze automaticky extrapolovat na nemocné po srdeční zástavě, je jasné, že prevence tromboembolických komplikací je zejména při použití EKO velmi důležitá.
Lze shrnout, že EKO je finančně relativně nákladná metoda, která po zavedení umožňuje spolehlivé udržování terapeutického rozmezí TT ve všech fázích protokolu TH a zejména nižší výskyt nadměrného ochlazení než konvenční metody (pouze u 9–11% nemocných) [18,20]. Klade nízké nároky na intervenci ošetřovatelského personálu během regulace TT. Po ukončení udržovací hypotermické fáze zajistí řízené ohřátí na normální TT a katétr je možné s výhodou ponechat i dále k udržení normotermie. Určitou nevýhodu je pomalejší ochlazovací rychlost ve srovnání s RIVA nebo některými technikami povrchového ochlazování a ruku v ruce s invazivitou metody se pojí i riziko komplikací spojených s používáním centrálních žilních katétrů obecně. Jako optimální se proto jeví zahájit ochlazování i jinou metodou, např. RIVA a paralelně nebo následně navázat metodou EKO.
Ochlazování pomocí mimotělního oběhu
K ochlazení mimotělní cirkulací krve lze použít kardiopulmonální bypass, venovenózní okruh kontinuální hemoeliminační metody doplněný o chladicí jednotku či různé jednoúčelové experimentální prototypy venovenózního okruhu [52–55]. Jedná se o velmi rychlé metody. Pomocí kardiopulmonálního bypassu lze dosáhnout cílové TT 33 °C během 2–3 min [56,57]. Zkušenosti po srdeční zástavě jsou převážně experimentální. Pro technickou náročnost a dostupnost alternativních ochlazovacích metod není těmto invazivním technikám v klinické medicíně věnována velká pozornost. Nagao et al však dosáhli pozoruhodných výsledků. 36 pacientů s OHCA s neúspěšnou klasickou neodkladnou resuscitací bylo napojených na emergentní kardiopulmonální bypass a intraaortální balónkovou kontrapulzaci. Někteří podstoupili urgentní selektivní koronarografii. V případě dosažení hemodynamické stability byla zahájena TH v trvání 71,0 ± 49,0 hod s velmi pomalým zpětným ohříváním (43,9 ± 5,3 hod). TT byla regulovaná prostřednictvím chladicí spirály zařazené do okruhu kontinuální hemodiafiltrace. Z 23 nemocných ošetřených TH bylo dosaženo příznivého neurologického výsledku u 52% [53].
Ochlazování pomocí umělé plicní ventilace
Plíce jsou v termoregulačním systému organizmu významným výměníkem tepla. Přesto není tato možnost v klinické praxi doposud využívána. V několika experimentálních pracích bylo prokázáno, že zatímco účinnost parciální likvidní ventilace u králíků je srovnatelná s povrchovým ochlazováním, totální likvidní ventilace prostřednictvím chladného perfluorokarbonového média je velmi účinná [58]. U králíků a prasat dosahuje ochlazovací rychlost srovnatelnou s kardiopulmonálním bypassem [59,60]. Modifikovaná forma konvenční ventilace doplněná opakovanou laváží perfluorokarbonovým roztokem u psů byla rovněž velmi účinná a vedla k poklesu tympanické TT o 3,7 ± 0,6 °C za 7,5 min [56]. Event. klinickému využití metody prozatím brání absence humánních klinických studií, technická náročnost a dostupnost sice pomalejších, ale podstatně jednodušších a bezpečných postupů.
Farmakologická indukce mírné hypotermie a koncept hibernace
Antipyretika jsou účinná u pacientů s hypertermií. Na indukci hypotermie se nepodílí. V protokolu TH je možné je využít preventivně ve fázi kontroly normotermie [11]. Pro rychlé navození TH je důležité zamezit svalovému třesu v rámci chladové reakce. Proto je v ochlazovací a udržovací fázi nutná hluboká analgosedace, aplikace meperidinu, event. myorelaxace [9,10]. Zdá se, že intenzita chladové reakce závisí i na zvolené ochlazovací metodě. Zatímco při povrchovém ochlazování k ní dochází pravidelně, v případě EKO může být méně častá [61].
Fascinující možností, prozatím však na hranici science-fiction, by mohla být indukce procesu hibernace. Hibernace je behaviorální, fyziologický a molekulární adaptační proces, který umožňuje některým savcům přečkat předpokládané dlouhé období nedostatku potravy. Jde o cyklické mnohadenní epizody hlubokého zpomalení metabolizmu spojené s hlubokou hypotermií o TT blízké 0 °C přerušované krátkými obdobími (asi 24 hod) obnovení metabolických funkcí na obvyklou úroveň s velmi rychlou normalizací TT. Vzhledem k tomu, že proces hibernace je široce distribuován u 3 podtříd savců a 1 třídy ptáků, genovou výbavou pro realizaci tohoto procesu disponují pravděpodobně všichni savci [62]. Aktivace exprese hibernačního fenotypu by tedy teoreticky mohla být novou možností rychlého a hlubokého útlumu metabolických pochodů u stavů s předpokládaným masivním ischemicko reperfuzním poškozením. Hibernace je proces velmi aktivní a regulovaný. Je řízen sekvencí neurogenních i molekulárních mechanizmů. V poslední době bylo identifikováno několik spouštěčů hibernace, jako jsou 2-deoxy-D-glukóza, merkaptoacetát, 3-iodothyronamin a především neurotensin a jeho analog prostupující hematoencefalickou bariérou. V experimentu tento analog u krys se srdeční zástavou vedl k rychlé indukci hypotermie s výrazným neuroprotektivním efektem srovnatelným s účinkem běžných ochlazovacích metod [63]. Představa jednoduché nitrožilní aplikace induktoru hibernace je tedy velmi lákavá, nicméně směřující do daleké budoucnosti.
Systémy pro selektivní ochlazování mozku
Koncept selektivního ochlazování mozku je rozvíjen především s cílem omezení vedlejších celotělových účinků TH. Na druhou stranu přesvědčivá data prokazující snížení mortality jsou k dispozici jen pro celotělovou hypotermii. Celotělová TH může navíc tlumit ischemicko reperfuzní poškození i v jiných orgánových systémech než v mozku.
Na praseti s experimentální srdeční zástavou byl testován efekt femoro karotického bypassu s extrakorporálním chlazením krve. Zjištěn byl preventivní vliv na neurologické postižení, nicméně systém pro svou invazivitu nepronikl do humánní medicíny [64].
Nejdéle jsou k dispozici pro praktické využití chladicí helmy a čepice. Jsou dobře skladovatelné a byly použity v nemocnici i v PNP. Hachimi Idrissi et al randomizovali 16 nemocných resuscitovaných pro srdeční zástavu s asystolií nebo elektromechanickou disociací k navození TH metodou chladicí helmy a 14 pacientů ke standardní terapii. Cílové TT 34 °C v močovém měchýři dosáhli za medián 180 min a tympanicky za medián 60 min. Procedura byla bezpečná a zatímco v hypotermické skupině přežili s příznivým neurologickým výsledkem 2 pacienti, v kontrolní skupině žádný [65]. Storm et al indukovali TH v PNP u 20 nemocných s OHCA pomocí chladicí čepice. Do přijetí do nemocnice poklesla tympanická TT z 35,5 na 34,4 °C (p < 0,001) [66]. Chladicí čepice jsou využívány zejména u dětí. Pro vyšší poměr povrchu hlavy k povrchu celého těla je u dětí tato metoda efektivnější než u dospělých a indukuje i celotělovou hypotermii.
Experimentálně bylo testováno intranazální ochlazování mozku aplikací chladných roztoků či sprejů. Vedlo k významnému poklesu intracerebrální, resp. tympanické TT. Novým zařízením připraveným ke klinickému používání v humánní medicíně je intranazální ochlazovací systém Rhinochill©. Jde o dlouhou nosní sondu, která ze zásobníku produkuje inertní perfluorokarbonový chladný spray a ochlazuje oblast nosohltanu na asi 4 °C. Podle experimentálních prací neochlazuje pouze mozek, ale později vede i k celotělové hypotermii [67].
Závěry a perspektivy
V současné době máme k dispozici řadu různých ochlazovacích metod. V přednemocniční péči je hlavním úkolem rychlé ochlazení pacienta a pokud možno dosažení cílové TT 33 °C. Toto umožňuje zejména RIVA. Dále je pro PNP vhodné povrchové ochlazování transportním systémem EMCOOLSpad© a transportní systémy selektivního ochlazování mozku. Jde o metody jednoduché a nenáročné na čas a obsluhu, blížící se technologii „plug and play“. Účinnější bude pravděpodobně vzájemná kombinace povrchové a/nebo selektivní metody s RIVA.
V nemocnici je nutné dbát nejenom na rychlé dosažení cílové teploty, ale i na spolehlivé udržování terapeutického rozmezí po dobu několika desítek hodin, na řízené pomalé ohřívání a na následné udržení normotermie. Pro tyto účely je ideální zařízení, které převede pacienta všemi fázemi protokolu TH. Takovéto podmínky nejlépe splňují povrchové matracové systémy s cirkulací vody a EKO. Přestože je v nemocnicích v České republice i v západní Evropě a USA doposud nejčastěji používáno jednoduché povrchové ochlazování pomocí ledových obkladů, tuto metodu by postupně měli nahradit zmíněné sofistikovanější a hlavně lépe regulovatelné systémy. V úvodní ochlazovací fázi je vhodná kombinace dvou a více ochlazovacích metod, zejména při používání konvenčních postupů.
Invazivní metody, jako jsou likvidní ventilace nebo ochlazování krve mimotělním oběhem, zůstanou pro přístrojovou náročnost a absenci výrazné výhody pravděpodobně pouze experimentální nebo určené pro specifické situace na několika málo pracovištích.
Účinnost odložené resuscitace v klinické medicíně bude zřejmě ověřena v příštích letech. Farmakologická indukce hibernace se jeví sice v současnosti velmi vzdáleným cílem, ale ne zcela bez perspektivy jejího využití v reálné klinické praxi.
Za hlavní úkoly v České republice nyní považujeme zejména implementaci metody TH do praxe na všech jednotkách intenzivní péče poskytujících časnou poresuscitační péči (na počátku lhostejno jakou metodou) a proniknutí indukce TH do PNP jako rutinního postupu u pacientů resuscitovaných pro OHCA. Lze předpokládat, že rozvoj používání TH jako součásti poresuscitační péče vzbudí zájem výrobců zdravotnické techniky a budou vyvíjeny nové a finančně dostupné systémy.
MUDr. Roman Škulec
www.uszssk.cz
e mail: skulec@email.cz
Zdroje
1. Holzer M, Bernard SA, Hachimi ‑ Idrissi S et al. Hypothermia for neuroprotection after cardiac arrest: systematic review and individual patient data meta‑analysis. Crit Care Med 2005; 33 : 414 – 418.
2. Nolan JP, Morley PT, Hoek TL et al. Advancement Life support Task Force of the International Liaison committee on Resuscitation. Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison committee on Resuscitation. Resuscitation 2003; 57 : 231 – 235.
3. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 7.5: postresuscitation Support. Circulation 2005; 112 (Suppl 1): IV – 84 – 8.
4. Safar P. Effects of the postresuscitation syndrome on cerebral recovery from cardiac arrest. Crit Care Med 1985; 13 : 932 – 935.
5. Safar P, Behringer W, Böttiger BW et al. Cerebral resuscitation potentials for cardiac arrest. Crit Care Med 2002; 30 (Suppl 4): S140 – S144.
6. Abe K, Aoki M, Kawagoe J et al. Ischemic delayed neuronal death. A mitochondrial hypothesis. Stroke 1995; 26 : 1478 – 1489.
7. O’Neil BJ, Neumar RW, Ebmeyer U et al. 13. Global brain ischemia and reperfusion. In: Paradis NA, Halperin HR, Kern KB et al (eds). Cardiac Arrest. The Science and Practice of Resuscitation Medicine. 2nd ed. Cambridge: Cambridge University Press 2007 : 236 – 281.
8. Polderman KH. Application of therapeutic hypothermia in the ICU: opportunities and pitfalls of a promising treatment modality. Part 1: Indications and evidence. Intensive Care Med 2004; 30 : 556 – 575.
9. Frank SM, Fleisher LA, Olson KF et al. Multivariate determinants of early postoperative oxygen consumption in elderly patients. Effects of shivering, body temperature, and gender. Anesthesiology 1995; 83 : 241 – 249.
10. Horvath SM, Spurr GB, Hutt BK et al. Metabolic cost of shivering. J Appl Physiol 1956; 8 : 595 – 602.
11. Polderman KH. Application of therapeutic hypothermia in the intensive care unit Opportunities and pitfalls of a promising treatment modality. Part 2: Practical aspects and side effects. Intensive Care Med 2004; 30 : 757 – 769.
12. Lefrant JY, Muller L, de La Coussaye JE et al. Temperature measurement in intensive care patients: comparison of urinary bladder, oesophageal, rectal, axillary, and inguinal methods versus pulmonary artery core method. Intensive Care Med 2003; 29 : 414 – 418.
13. Khan TA, Vohra HA, Paul S et al. Axillary and tympanic membrane temperature measurements are unreliable early after cardiopulmonary bypass. Eur J Anaesthesiol 2006; 23 : 551 – 554.
14. Camboni D, Philipp A, Schebesch KM et al. Accuracy of core temperature measurement in deep hypothermic circulatory arrest. Interact Cardiovasc Thorac Surg 2008; 7 : 922 – 924.
15. Skulec R, Dostalova G, Kovarnik T et al. Therapeutic hypothermia in cardiac arrest survivors: a survey of practice in the Czech Republic. Resuscitation 2008; 77 : 419 – 420.
16. Bernard SA, Gray TW, Buist MD et al. Treatment of comatose survivors of out ‑ of ‑ hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346 : 557 – 563.
17. The Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002; 346 : 549 – 556.
18. Hoedemaekers CW, Ezzahti M, Gerritsen A et al. Comparison of cooling methods to induce and maintain normo ‑ and hypothermia in intensive care unit patients: a prospective intervention study. Crit Care 2007; 11: R91.
19. Škulec R, Šeblová J, Linhart A. Účinnost ochlazovacích režimů při indukci mírné hypotermie po srdeční zástavě v nemocniční a přednemocniční péči. Cor Vasa 2008; 50 : 64.
20. Škulec R, Kovárník T, Bělohlávek J et al. Nadměrné ochlazení během mírné hypotermie po srdeční zástavě – fenomén zasluhující pozornost. Vnitř Lék 2008; 54 : 609 – 614.
21. Uray T, Malzer R. Vienna Hypothermia After Cardiac Arrest (HACA) Study Group. Out ‑ of ‑ hospital surface cooling to induce mild hypothermia in human cardiac arrest: A feasibility trial. Resuscitation 2008; 77 : 331 – 338.
22. Kim F, Olsufka M, Longstreth WT jr et al. Pilot randomized clinical trial of prehospital induction of mild hypothermia in out ‑ of ‑ hospital cardiac arrest patients with a rapid infusion of 4 degrees C normal saline. Circulation 2007; 115 : 3064 – 3070.
23. Kliegel A, Losert H, Sterz F et al. Cold simple intravenous infusions preceding special endovascular cooling for faster induction of mild hypothermia after cardiac arrest ‑ a feasibility study. Resuscitation 2005; 64 : 347 – 351.
24. Kliegel A, Janata A, Wandaller C et al. Cold infusions alone are effective for induction of therapeutic hypothermia but do not keep patients cool after cardiac arrest. Resuscitation 2007; 73 : 46 – 53.
25. Kim F, Olsufka M, Carlbom D et al. Pilot study of rapid infusion of 2 L of 4 degrees C normal saline for induction of mild hypothermia in hospitalized, comatose survivors of out ‑ of ‑ hospital cardiac arrest. Circulation 2005; 112 : 715 – 719.
26. Virkkunen I, Yli ‑ Hankala A, Silfvast T. Induction of therapeutic hypothermia after cardiac arrest in prehospital patients using ice ‑ cold Ringer’s solution: a pilot study. Resuscitation 2004; 62 : 299 – 302.
27. Kämäräinen A, Virkkunen I, Tenhunen J et al. Prehospital induction of therapeutic hypothermia during CPR: a pilot study. Resuscitation 2008; 76 : 360 – 363.
28. Bernard SA, Rosalion A. Therapeutic hypothermia induced during cardiopulmonary resuscitation using large ‑ volume, ice ‑ cold intravenous fluid. Resuscitation 2008; 76 : 311 – 313.
29. Bruel C, Parienti JJ, Marie W et al. Mild hypothermia during advanced life support: a preliminary study in out ‑ of ‑ hospital cardiac arrest. Crit Care 2008; 12: R31.
30. Polderman KH, Rijnsburger ER, Peerdeman SM et al. Induction of hypothermia in patients with various types of neurologic injury with use of large volumes of ice ‑ cold intravenous fluid. Crit Care Med 2005; 33 : 2744 – 2751.
31. Vanden Hoek TL, Kasza KE, Beiser DG et al. Induced hypothermia by central venous infusion: saline ice slurry versus chilled saline. Crit Care Med 2004; 32 (Suppl 9): S425 – S431.
32. Drábek T. Emergency Preservation and Resuscitation – nová šance pro oběti traumatické srdeční zástavy. Anest Intenziv Med 2007; 18 : 351 – 356.
33. Plattner O, Kurz A, Sessler DI et al. Efficacy of intraoperative cooling methods. Anesthesiology 1997; 87 : 1089 – 1095.
34. Menguy R, Masters YF. Influence of cold on stress ulceration and on gastric mucosal blood flow and energy metabolism. Ann Surg 1981; 194 : 29 – 34.
35. Xiao F, Safar P, Alexander H. Peritoneal cooling for mild cerebral hypothermia after cardiac arrest in dogs. Resuscitation 1995; 30 : 51 – 59.
36. Diringer MN. Neurocritical Care Fever Reduction Trial Group. Treatment of fever in the neurologic intensive care unit with a catheter‑based heat exchange system. Crit Care Med 2004; 32 : 559 – 564.
37. Schmutzhard E, Engelhardt K, Beer R et al. Safety and efficacy of a novel intravascular cooling device to control body temperature in neurologic intensive care patients: a prospective pilot study. Crit Care Med 2002; 30 : 2481 – 2488.
38. Lyden PD, Allgren RL, Ng K et al. Intravascular Cooling in the Treatment of Stroke (ICTuS): early clinical experience. J Stroke Cerebrovasc Dis 2005; 14 : 107 – 114.
39. Guluma KZ, Oh H, Yu SW et al. Effect of endovascular hypothermia on acute ischemic edema: morphometric analysis of the ICTuS trial. Neurocrit Care 2008; 8 : 42 – 47.
40. Georgiadis D, Schwarz S, Kollmar R et al. Endovascular cooling for moderate hypothermia in patients with acute stroke: first results of a novel approach. Stroke 2001; 32 : 2550 – 2553.
41. Keller E, Imhof HG, Gasser S et al. Endovascular cooling with heat exchange catheters: a new method to induce and maintain hypothermia. Intensive Care Med 2003; 29 : 939 – 943.
42. De Georgia MA, Krieger DW, Abou ‑ -Chebl A et al. Cooling for Acute Ischemic Brain Damage (COOL AID): a feasibility trial of endovascular cooling. Neurology 2004; 63 : 312 – 317.
43. Dixon SR, Whitbourn RJ, Dae MW et al. Induction of mild systemic hypothermia with endovascular cooling during primary percutaneous coronary intervention for acute myocardial infarction. J Am Coll Cardiol 2002; 40 : 1928 – 1934.
44. Kandzari DE, Chu A, Brodie BR et al. Feasibility of endovascular cooling as an adjunct to primary percutaneous coronary intervention (results of the LOWTEMP pilot study). Am J Cardiol 2004; 93 : 636 – 639.
45. Stone GW, Dixon SR, Foster M et al. Systemic Hypothermia to Prevent Contrast Nephropathy: the COOL RCN Pilot Trial. Circulation 2006; 114 (Suppl 2): 811. Abstract 3794.
46. Wolff B, Machill K, Schumacher D et al. Early achievement of mild therapeutic hypothermia and the neurologic outcome after cardiac arrest. Int J Cardiol 2009; 133 : 223 – 228.
47. Holzer M, Müllner M, Sterz F et al. Efficacy and safety of endovascular cooling after cardiac arrest: cohort study and Bayesian approach. Stroke 2006; 37 : 1792 – 1797.
48. Pichon N, Amiel JB, Francois B et al. Efficacy of and tolerance to mild induced hypothermia after out ‑ of ‑ hospital cardiac arrest using an endovascular cooling system. Crit Care 2007; 11: R71.
49. Al Senani FM, Graffagnino C, Grotta JC et al. A prospective, multicenter pilot study to evaluate the feasibility and safety of using the CoolGard System and Icy catheter following cardiac arrest. Resuscitation 2004; 62 : 143 – 150.
50. Arrich J. European Resuscitation Council Hypothermia After Cardiac Arrest Registry Study Group. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit Care Med 2007; 35 : 1041 – 1047.
51. Simosa HF, Petersen DJ, Agarwal SK et al. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg 2007; 73 : 461 – 464.
52. Tisherman S, Safar P, Kormos R et al. Clinical feasibility of emergency cardiopulmonary bypass for external CPR - refractory prehospital cardiac arrest. Resuscitation 1994; 28: S5.
53. Nagao K, Hayashi N, Kanmatsuse K et al. Cardiopulmonary cerebral resuscitation using emergency cardiopulmonary bypass, coronary reperfusion therapy and mild hypothermia in patients with cardiac arrest outside the hospital. J Am Coll Cardiol 2000; 36 : 776 – 783.
54. Nagao K, Miki T, Okamoto K et al. Blood cooling system using coil cooling for brain hypothermia. Jpn J Acute Med 1999; 23 : 674 – 704.
55. Behringer W, Safar P, Wu X et al. Veno‑venous extracorporeal blood shunt cooling to induce mild hypothermia in dog experiments and review of cooling methods. Resuscitation 2002; 54 : 89 – 98.
56. Harris SB, Darwin MG, Russell SR et al. Rapid (0.5 °C/ min) minimally invasive induction of hypothermia using cold perfluorochemical lung lavage in dogs. Resuscitation 2001; 50 : 189 – 204.
57. Reed C, Clark D. Heat exchangers and hypothermia. Cardiopulmonary Perfusion. Texas: Texas Medical Press 2002 : 272 – 278.
58. Hong SB, Koh Y, Shim TS et al. Physiologic characteristics of cold perfluorocarbon‑induced hypothermia during partial liquid ventilation in normal rabbits. Anesth Analg 2002; 94 : 157 – 162.
59. Tissier R, Hamanaka K, Kuno A et al. Total liquid ventilation provides ultra ‑ fast cardioprotective cooling. J Am Coll Cardiol 2007; 49 : 601 – 605.
60. Staffey KS, Dendi R, Brooks LA et al. Liquid ventilation with perfluorocarbons facilitates resumption of spontaneous circulation in a swine cardiac arrest model. Resuscitation 2008; 78 : 77 – 84.
61. Polderman KH, Callaghan J. Equipment review: Cooling catheters to induce therapeutic hypothermia? Crit Care 2006; 10 : 234.
62. Srere HK, Wang LC, Martin SL. Central role for differential gene expression in mammalian hibernation. Proc Natl Acad Sci USA 1992; 89 : 7119 – 7123.
63. Katz LM, Young A, Frank JE et al. Neurotensin‑induced hypothermia improves neurologic outcome after hypoxic - ischemia. Crit Care Med 2004; 32 : 806 – 810.
64. Mori K, Saito J, Kurata Y et al. Rapid development of brain hypothermia using femoral ‑ carotid bypass. Acad Emerg Med 2001; 8 : 303 – 308.
65. Hachimi ‑ Idrissi S, Corne L, Ebinger G et al. Mild hypothermia induced by a helmet device: a clinical feasibility study. Resuscitation 2001; 51 : 275 – 281.
66. Storm C, Schefold JC, Kerner T et al. Prehospital cooling with hypothermia caps (PreCoCa): a feasibility study. Clin Res Cardiol 2008; 97 : 768 – 772.
67. Bayegan K, Janata A, Frossard M et al. Rapid non‑invasive external cooling to induce mild therapeutic hypothermia in adult human ‑ sized swine. Resuscitation 2008; 76 : 291 – 298.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání