-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
Examination of function and structure of respiratory cilia of adult patients suffering from chronic obstructive pulmonary disease (COPD) – comparison of nasal and bronchial mucosa (pilot of CILIARY STUDY)
Introduction:
Borderline between upper and lower respiratory tract pathology is probably artificial (bronchial asthma). Also inflammation of bronchial mucosa during chronic obstructive pulmonary disease (COPD) is likely combined with inflammatory involvement of nasal mucosa. Ciliary edge of respiratory epithelium is very important part of mucosa layer. Aim: To investigate and compare nasal and bronchial ciliary beat frequency (CBF), degree of nasal and bronchial ciliary dyskinesia, presence of ciliary akinesia and incidence of spinocellular metaplasia in the both mucosa localities among of stable COPD patients (pts). Method: Nasal and bronchial mucosa were obtained in the course of bronchoscopy examination of COPD pts in general intravenous anesthesia. Native samples of mucosa tissue were assessed by digital high‑speed video microscopy (1,000× magnification). Paired t‑test was used to evaluate differences in average frequencies. Significance level was α = 0.05. Mode was used to describe „index of dyskinesia“, as a measure of association was used κ coefficient. Material: Seventeen COPD pts (6 weeks free of exacerbation) at the age 47 – 80 (average 64.2 years ± 9,7) were examined (13 male), average FEV1 61% predic. value (21 – 81, ± 15). All patients were active smokers (average 42 pack years ± 22.8) and all suffered from bronchitic (daily sputum production) phenotype of COPD. Results: We did not find any difference in average ciliary beat frequencies between nose (6,0 Hz ± 1.3) and bronchus (5.9 ± 1.3) locality (p = 0.427). We find weak association between nose and bronchus in „ciliary akinesia“ (κ = 0.282) but medium association in „metaplasia“ (κ = 0.485), in index of dyskinesia (κ = 0.733). Conclusion: We did not find in our data any difference in nasal and bronchial ciliary beat frequencies and we found medium association between nasal and bronchial spinocellular metaplasia and index of ciliary dyskinesia. Possible generalization of these results would require further investigation and analysis.Key words:
nasal mucosa – bronchial mucosa – chronic obstructive pulmonary disease – ciliary study – ciliary beat frequency – ciliary akinesia – spinocellular metaplasia
Autoři: V. Koblížek 1; T. Dobešová 1; F. Salajka 1; Eva Čermáková 2
; M. Tomšová 3; D. Pohnětalová 3; P. Papoušek 4; V. Bartoš 1; Z. Paráková 1; J. Ruta 1; V. Sedlák 1
Působiště autorů: Plicní klinika Lékařské fakulty UK a FN, přednosta doc. MU Dr. František Salajka, CSc. 1; Ústav lékařské biofyziky Lékařské fakulty UK Hradec Králové, přednosta doc. Ing. Josef Hanuš, CSc. 2; Fingerlandův ústav patologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Aleš Ryška, Ph. D. 3; Ústav patologické fyziologie Lékařské fakulty UK Hradec Králové, přednosta prof. MU Dr. Miroslav Kuba, CSc. 4
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1035-1042
Kategorie: Původní práce
Souhrn
Úvod:
V poslední době je široce diskutován možný koncept jednotných dýchacích cest charakterizovaný plynulým přechodem patologických změn ze sliznice dolních dýchacích do horních dýchacích cest (případně obráceně). Tato hypotéza je téměř bez výhrad přijímána u osob trpících bronchiálním astmatem. Nověji se o pan ‑ respiračním zánětlivém postižení můžeme dozvědět i z některých prací autorů zkoumajících funkční a strukturální parametry nazální a bronchiální sliznice u pacientů s chronickou obstrukční plicní nemocí (CHOPN). Cíl: Předmětem naší práce je právě ověření této hypotézy u nemocných s CHOPN, a to pomocí porovnání struktury a funkce respiračních cilií z oblasti nazální a bronchiální sliznice. Předpokládáme nalezení minimálních nebo žádných rozdílů mezi strukturou a funkcí nazálních a bronchiálních cilií. Metody: Jednalo se o observační, průřezovou studii nemocných se stabilní CHOPN, kteří byli bronchoskopicky vyšetřováni v celkové intravenózní propofolové anestezii pro suspekci na bronchogenní karcinom. Vyšetřovali jsme nativní vzorky nazální a bronchiální sliznice, a to pomocí digitální vysokorychlostní mikroskopie (analyzována byla frekvence ciliárních kmitů – CBF, stupeň ciliární dyskineze, přítomnost akineze a výskyt dlaždicobuněčné metaplazie respiračních epitelií). Při statistickém hodnocení odlišností mezi vzorky obou lokalit bylo použito párového t‑testu (signifikantní úroveň α = 0,05). Ke zjišťování asociací byl použit κ koeficient. Soubor: Během let 2006 – 2007 jsme do studie zahrnuli 17 nemocných (13 mužů) se stabilní fází onemocnění (minimálně 6 týdnů bez exacerbace) průměrného věku 64,2 (47 – 80, ± 9,7), průměrné FEV1 61 % (21 – 81, ± 15) s trvající dlouholetou anamnézou aktivního nikotinizmu (průměr 42 balíčkoroků ± 22,8) a s přítomností bronchitického (tj. expektoračního) fenotypu CHOPN. Výsledky: Nebyl nalezen žádný rozdíl v průměrné CBF mezi oblastí sliznice dolních (CBF bronchiálního vzorku 5,9 Hz ± 1,2) a horních (CBF nazálního vzorku 6,0 Hz ± 1,3) dýchacích cest (p = 0,427). Byla také dokumentována středně významná asociace mezi výskytem dlaždicobuněčné metaplazie (κ = 0,485) a indexem ciliární dyskineze (κ = 0,733) v obou slizničních lokalitách. Přítomnost akinetických cilií v nosní a bronchiální lokalizaci byla asociována pouze lehce (κ = 0,282). Závěr: Nenalezli jsme žádný rozdíl mezi frekvencí kmitání nazálních a bronchiálních cilií u nemocných se stabilní fází CHOPN. Naopak jsme prokázali středně silnou asociaci mezi výskytem dlaždicobuněčné metaplazie a indexem ciliární dyskineze na sliznici obou částí dýchacích cest. Naše pozorování podporuje koncept jednotných dýchacích cest. Ke zobecnění našich dat bude však třeba dalších prací.Klíčová slova:
nazální sliznice – bronchiální sliznice – chronická obstrukční plicní nemoc – ciliární studie – frekvence ciliárních kmitů – ciliární dyskineze – dlaždicobuněčná metaplazieÚvod
Epiteliální buňky lidské nazální a bronchiální sliznice mají velmi podobné morfologické a funkční parametry [11,12,19,44,57]. To je jasně prokázáno u zdravých osob, avšak koncept jednotných dýchacích cest se pravděpodobně týká také některých respiračních patologií, dříve striktně považovaných za problém plic a dolních dýchacích cest. Nyní se již obecně přijímá přítomnost kontinuálního postižení celé respirační sliznice u bronchiálního astmatu. Zejména u atopické varianty této chronické zánětlivé choroby se velmi často setkáváme s klinickými a funkčními projevy také v oblasti horních dýchacích cest (v nose či vedlejších nosních dutinách). Víme například o tom, že nespecifická nosní reaktivita koreluje s nespecifickou bronchiální reaktivitou u osob s alergickou rinitidou a bronchiálním astmatem [64]. Souvislost mezi bronchiálním astmatem a rinitidou podporují další četné práce týkající se epidemiologie [33,62,63], patologie [16,48], patofyziologie [15], imunologie [54] i léčebného přístupu [9,10,61] k alergické rinitidě a bronchiálnímu astmatu. Výrazné projevy postižení nosních dutin a nosu nacházíme také u neatopického fenotypu astmatu [19].
Předmětem našeho zájmu však není astma, nýbrž druhý „zástupce“ bronchiální a bronchiolární patologie, totiž chronická obstrukční plicní nemoc (CHOPN). Také zde, zejména v posledních 5 letech, pomalu přibývá literárních důkazů o tom, že minimálně u některých pacientů s chronickou obstrukční plicní nemocí (CHOPN) dochází vedle postižení bronchiální sliznice též ke změnám ve sliznici nazální a že tyto změny jsou velmi podobné [19]. CHOPN je jistě velkým problémem současnosti, v EU postihuje minimálně 4–6% dospělých osob. S ještě větším výskytem této choroby musíme počítat do budoucnosti, neboť reálně předpokládáme, že se v roce 2020 CHOPN v celosvětovém mortalitním měřítku dostane na pomyslnou 3. příčku [8,27,34,36]. I přes výrazné výzkumné úsilí stále totiž neexistuje optimální terapeutická strategie, jež by dokázala spolehlivě zastavit průběh onemocnění a zabránit nepříznivému trendu progresivního poklesu plicních funkcí [5,6,25]. CHOPN je charakterizována pomalu progredující limitací expiračního proudění vzduchu (neboli bronchiální obstrukcí). Tato obstrukce je pouze částečně reverzibilní, na rozdíl od většiny případů bronchiálního astmatu. Na vývoji choroby se podílí plicní emfyzém s ireverzibilní destrukcí alveolů, jenž vede, mimo jiné, i ke ztrátě ukotvení malých bronchiolů. A právě malé dýchací cesty (bronchioly s průměrem 2mm a méně) jsou hlavní lokalitou bronchiolární obstrukce u nemocných s CHOPN. Procesy přítomné v malých průdušinkách jsou zánětlivé (slizniční zánět s edémem a hypersekrecí hlenu a ložiskové zvětšení slizniční lymfatické tkáně) i fibrózní povahy (peribronchiolární fibrotizace). Chronická bronchitida (klasický popisný termín pro chronickou expektoraci sputa) bývá přítomna u většiny nemocných s CHOPN, avšak ne vždy. Nezřídka existují případy, kdy chronická bronchitida není vůbec asociována s bronchiální obstrukcí (tj. nemocný produktivně kašle, avšak nemá CHOPN) [5,6,38,58–60]. Každý nemocný má jiný poměr mezi emfyzémovým postižením, bronchiolitidou, případně chronickou bronchitidou. Situaci navíc komplikuje občasná přítomnost disproporciální plicní arteriální hypertenze asociovaná s cévním postižením, případně overlap s bronchiálním astmatem a několik dalších (vzácnějších) fenotypů tohoto komplexního systémového onemocnění [28,29,38]. U různých nemocných se proto můžeme setkat s rozmanitými klinickými symptomy a rozdílnou prognózou.
U nemalé části nemocných se CHOPNprojevuje jako hypersekrece hlenu. Hlen je obtížně odstraňován a jeho přítomnost je pravděpodobně spojena s poškozenou mukociliární clearance (tato je do jisté míry suplována akcentací kašle). Mukociliární clearance je velmi sofistikovaná činnost [7], jež se podílí na odstraňování hlenu. Ten má u CHOPN poněkud jiné složení než u zdravých osob (více vazkého mucinu a menší množství antibakteriálně působící seriózní složky). Intenzita a efektivita mukociliární clearance je určena charakterem a množstvím hlenu a také strukturou a funkcí ciliárního aparátu respirační sliznice [28,29,42,43]. A právě detailních informací o formách ciliární patologie u nemocných s CHOPN je v odborné literatuře velmi málo. Jedním z důvodů může být technická obtížnost odběrů sliznice z bronchů, či dokonce z oblasti plicní periferie. Dalším důvodem může být značná fenotypová heterogenita populace nemocných s CHOPN (viz výše). Naše univerzitní pracoviště se péči o nemocné s CHOPN dlouhodobě a systematicky věnuje [31,32,45–47]. A protože máme k dispozici moderní metody ciliárního vyšetřování (digitální vysokorychlostní mikroskopii a elektronový mikroskop), byla naším logickým cílem právě otázka mukociliární clearance. Na úvod jsme jako „pilotní“ projekt provedli srovnání mezi ciliárními parametry nativní sliznice bronchů a nosní dutiny, jež předkládáme v tomto stručném sdělení.
Cíl
Cílem naší práce je detailní porovnání struktury a funkce cilií respiračního epitelu mezi oblastí nazální a bronchiální sliznice u našich stabilních nemocných trpících CHOPN.
Metodika
Soubor nemocných
Během jednoho roku bylo postupně vyšetřeno 17 nemocných s CHOPN (13 mužů a 4 ženy) průměrného věku 64,2 roku (47–80 ± 9,7) s průměrnou hodnotou usilovného jednosekundového výdechu (FEV1) 61% (21–81). Devět nemocných trpělo CHOPN II. stupně dle GOLD, tři I. stupně, čtyři III. stupně a jeden IV. stupně. Terapie odpovídala standardům péče o jednotlivá stadia onemocnění. Jednalo se vždy o současné kuřáky (avšak během hospitalizace na našem oddělení minimálně 24 hod bez aktivního nikotinizmu). Všichni se podrobili celkové anestezii z důvodu diagnostiky suspektního pneumoonkologického onemocnění (primární či sekundární tumory postihující centrální bronchy). CHOPN u všech představovalo komorbiditu, nikoliv důvod k bronchoskopickému výkonu. CHOPN bylo u všech ve stabilní fázi (minimálně 6 týdnů bez exacerbace) umožňující nekomplikované provedení bronchoskopického výkonu i odběru materiálu k vyšetření. Studie byla schválena v rámci Ciliární studie etickou komisí LF UK Hradec Králové. Všichni účastníci podepsali informovaný souhlas.
Typ studie
Jedná se o průřezovou observační studii vyšetřující všechny nemocné se stabilní fází CHOPN, kteří se podrobili od června roku 2006 do května roku 2007 diagnostické bronchoskopii v celkové anestezii na bronchologickém oddělení naší kliniky.
Způsob odběru vzorků respirační sliznice
Nemocní na bronchoskopickém sále byli těsně po úvodu do celkové anestezie (intravenózní anestezie – Fentanyl®, Diprivan® a Mivacron®) podrobeni bioptickému odběru nazální a bronchiální sliznice (kyretkou, resp. kleštěmi flexibilního bronchoskopu). Oba odběry byly provedeny současně dvěma týmy (lékař + sestra) z míst makroskopicky zcela intaktní sliznice (z nosu z oblasti kraniální části dolní nosní skořepy a z bronchu z oblasti některé interlobární či intersegmentální kariny). Všechny odběry byly jemné – nekrvavé (krev je výrazným ciliotoxickým agens) (obr. 1).
Obr. 1. Simultánní odběry nazální a bronchiální sliznice byly provedeny během intravenózní anestezie na bronchoskopickém sále. 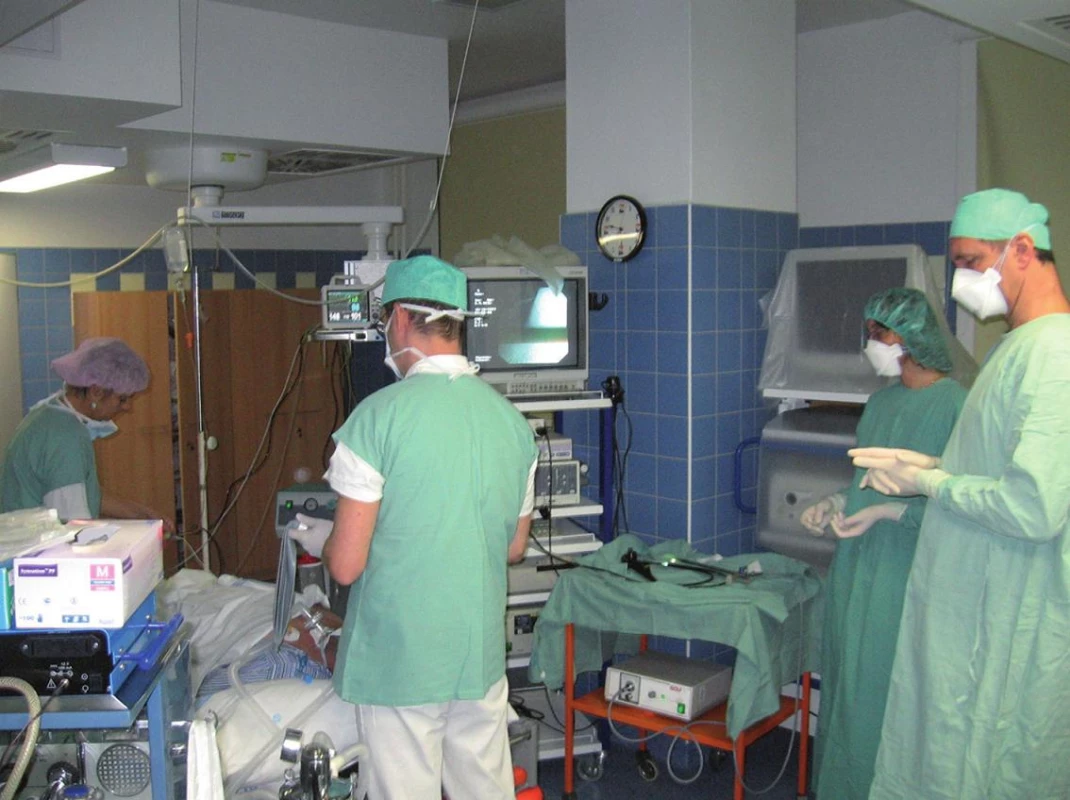
Zpracování vzorků pro digitální vysokorychlostní mikroskopii
Odebrané vzorky byly ihned separátně uloženy do fyziologického roztoku na speciální podložní sklíčko s „mističkou“ a překryty krycím sklíčkem. Podložní sklíčko, krycí sklíčko a roztok byly ohřáté na tělesnou teplotu (36,5 °C). Poté byla obě předem označená podložní sklíčka (nazální i bronchiální) se vzorky (většinou dva z každé lokality) uložena do termoboxu a okamžitě (během 1–3 min) dopravena do laboratoře patologa (obr. 2).
Obr. 2. Během 1–3 min od odběru se oba vzorky dostanou v termoboxu do laboratoře patologa, jenž najde 5–7 reprezentativních lokalit v každém vzorku, tyto zaznamená pomocí digitální vysokorychlostní videokamery do paměti PC (hodnocení záznamu je provedeno až následně pečlivým hodnocením snímek po snímku – dle standardu popsaného v článku). 
Digitální vysokorychlostní mikroskopie
Zde patolog vyšetřil oba vzorky pomocí světelného mikroskopu v zástinu (Nicon Eclipse 80i) v 1 000násobném zvětšení. Během mikroskopického vyšetření byly oba vzorky uloženy vedle sebe při teplotě 36,5 °C. Pořadí vyšetření nazálního a bronchiálního vzorku bylo zcela náhodné. Vyšetření ciliární frekvence (ciliary beat frequency) a stupně ciliární dyskineze bylo provedeno, s drobnými modifikacemi, dle dříve popsané metodiky [22–24]. V krátkosti tuto metodiku popíšeme (obr. 3).
Obr. 3. Několik respiračních epiteliálních buněk v 1 000násobném zvětšení při mikroskopickém vyšetření v zástinu. Dobře patrná je metachronně se pohybující ciliární vrstva (detailní a přesné hodnocení ciliárních parametrů z 5–7 míst vzorku trvá zhruba 20 min). 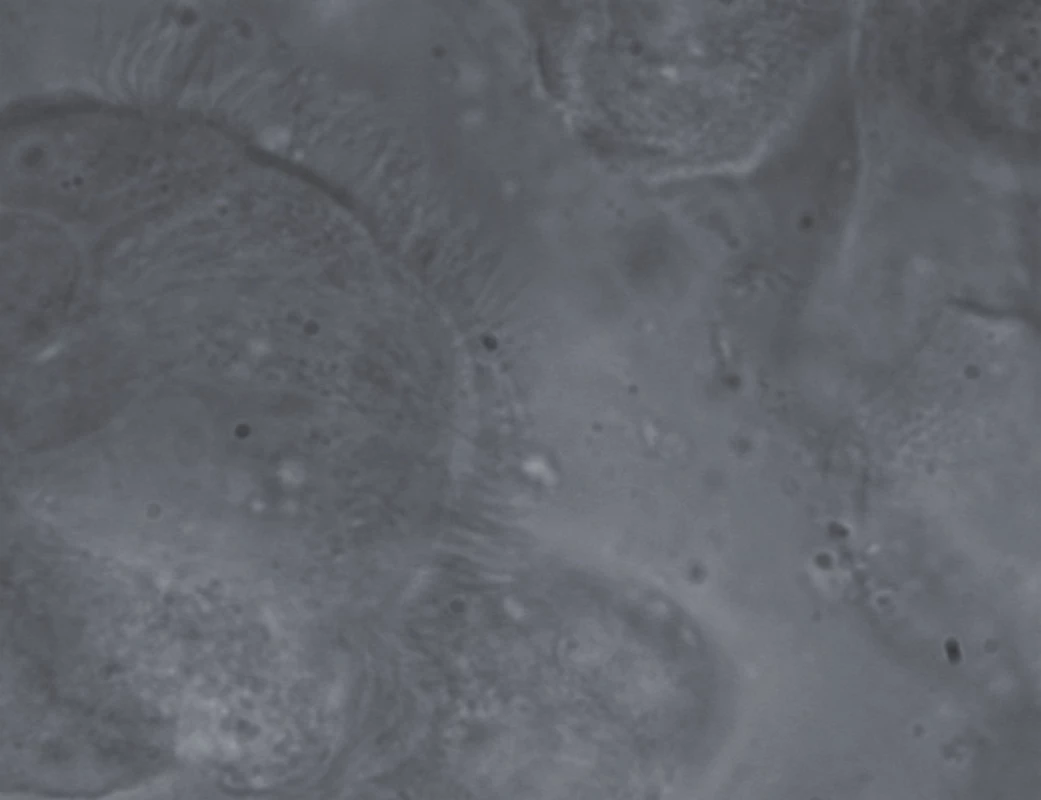
Patolog od každého nemocného (1–2 vzorky) postupně v mikroskopu našel 5–7 reprezentativních míst, jejichž délka byla minimálně 50 μm, a tyto úseky postupně zaznamenal digitální vysokorychlostní kamerou napojenou na okulár mikroskopu (vzorkovací frekvence kamery 50 snímků za sekundu) do paměti připojeného PC a následně vypálil na DVD pro pozdější hodnocení. Záznam této kamery dovoluje všechny získané videosekvence následně hodnotit snímek po snímku (50 snímků = 1 s) na obrazovce počítače. Digitální záznam ve formátu (AVI) byl následně nezávisle hodnocen dvěma pozorovateli. Během pozdějšího hodnocení si pak oba hodnotící lékaři (patolog a klinik v jiném čase, nezávisle na sobě) každý 50μm úsek rozdělili do pěti sousedících úseků dlouhých 10 μm. Každý z pozorovatelů hodnotil slepě bronchiální i nazální sliznici (nevěděl, o jakou jde lokalitu).
Frekvence ciliárních kmitů
Kalkulace ciliární frekvence (CBF) probíhala přímo, a to velmi jednoduchým způsobem (CBF = 50/celkový počet obrázků pro 10 kmitů/× 10). Dvě měření ciliární frekvence (s přesností na 0,5 Hz) byla provedena v každém 10 μm okrsku, to znamená, že v každém proužku tkáně jeden pozorovatel získal 10 výsledků. Každý pozorovatel vyšetřil 5–7 proužků. Dva pozorovatelé tedy dohromady od každého nemocného a z každé ze sledovaných lokalit získali 100–140 (2 × 50–70 výsledků), ze kterých byla kalkulována průměrná ciliární frekvence (CBF).
Analýza indexu ciliární dyskineze
Ke zjištění ciliární dyskineze jsme každýproužek ciliárního epitelu (tj. 5–7 z každélokality) ohodnotili následujícím způsobem. Normální a koordinovaný bičovitý pohyb cilií v celém rozsahu epiteliálního proužku byl hodnocen jako normokineze – a byl označen indexem 0. Ciliární epitelové proužky, jež neměly zcela normální pohyb, byly zhodnoceny indexem 1–3 v závislosti na stupni dyskineze a jejím rozšíření v rámci celého proužku (1 – lehká a pouze fokální dyskineze, 2 – střední dyskineze nesplňující kritérium pro lehkou ani těžkou, 3 – těžká dyskineze v průběhu celého proužku). Následně jsme vypočítali index ciliární dyskineze jako průměrný index z 5–7 proužků jedné lokality, obojí bylo vyšetřeno 2krát (každým pozorovatelem nezávisle). Index ciliární dyskineze tedy dosahoval hodnot 0–3.
Detekce akineze a dlaždicobuněčné metaplazie ciliárního epitelu
Sledování výskytu a rozsahu akineze a detekce dlaždicobuněčné metaplazie respiračního ciliárního epitelu jsme prováděli opět u každého epitelového proužku. Pro jejich kvalitativní popis jsme použili jednoduchý skórovací systém (0 – akineze nebo metaplazie není přítomna ani v jednom epitelovém proužku dané lokality, 2 – akineze nebo metaplazie je přítomna ve všech úsecích všech proužků z dané lokality, 1 – akineze nebo metaplazie je přítomna jen v části epiteliálního proužku). Každý pozorovatel tak vyšetřil z každé lokality 5–7 proužků, tj. oba dohromady 10–14 míst. Pokud nebyla ani na jednom přítomna akineze nebo metaplazie, byl vzorek celkově hodnocen bez akineze nebo bez metaplazie. V případě, že ve všech 5–7 proužcích byla v hodnocení obou pozorovatelů přítomna výhradně akineze či metaplazie, byl celkový vzorek hodnocen jako totální akineze nebo totální metaplazie. Ve zbylých případech jsme danou lokalitu zhodnotili jako parciální akinezi (resp. metaplazii). Výskyt akineze a metaplazie musel být vždy ve shodě obou hodnotitelů.
Statistické hodnocení
Pro statistické zpracování jsme využili program NCSS 2007 (metody deskriptivní statistiky, párový t test a κ koeficient). Ze vzorků bronchiální i nazální sliznice jsme při statistickém hodnocení použili následující veličiny: průměrnou ciliární frekvenci (akineze nebyly započítané jako frekvence 0), medián ciliární frekvence (akineze nebyly započítané jako frekvence 0), modus indexu ciliární dyskineze (pro přehlednost jsme vytvořili 2 kategorie dyskineze 1 + 0 a 2 + 3, při event. rovnosti jsme se přiklonili k horší kategorii), výskyt akineze (0 – nepřítomna, 1 – přítomna) a výskyt metaplazie (0 – nepřítomna, 1 – přítomna). Pokud jde o index ciliární dyskineze, o akinezi a o metaplazii, byl k vyhodnocení shody výsledků mezi nosem a bronchem použit κ koeficient (míra asociace – shody, souvislosti). K vyhodnocení míry asociace není stanovena hladina významnosti, ale podle absolutní velikosti můžeme konstatovat následující: je li koeficient menší než 0,4, jedná se o malou shodu, v případě hodnot 0,4–0,74 o střední shodu a od 0,75 o vysokou shodu.
Výsledky
Pro porovnání ciliárních frekvencí (v lokalitě bronchus a v lokalitě nos) se statistickými metodami testovala hypotéza shody proti alternativě neshody. Vybrané výsledky vyšetření všech 17 pacientů jsou stručně shrnuty v tab. 1. Byl použit párový t test. Pro průměry frekvencí je výsledek testu (přesná hladina významnosti) p = 0,427, pro mediány p = 0,331 a pro modus indexu ciliární dyskineze p = 0,119. V žádném z porovnání nebyla zamítnuta hypotéza shody, resp. lze říci, že nebyl nalezen rozdíl mezi bronchiální a nazální sliznicí, pokud jde o frekvenci ciliárního kmitu (ciliary beat frequency) (graf 1).
Graf 1. Porovnání bronchiální a nazální frekvence ciliárních kmitů u nemocných s CHOPN. 
K vyhodnocení míry shody mezi nazálními a bronchiálními indexy ciliární dyskineze (0 + 1 nebo 2 + 3) a přítomností (či nepřítomností) akineze a metaplazie byl použit κ koeficient. U akineze dosahoval tento koeficient 0,282 (malé shody), u dlaždicobuněčné metaplazie respiračního epitelu a u indexu ciliární dyskineze 0,485, resp. 0,733 (tj. střední míry shody) (tab. 1, grafy 2 a 3).
Tab. 1. Výsledky vyšetření všech 17 nemocných. 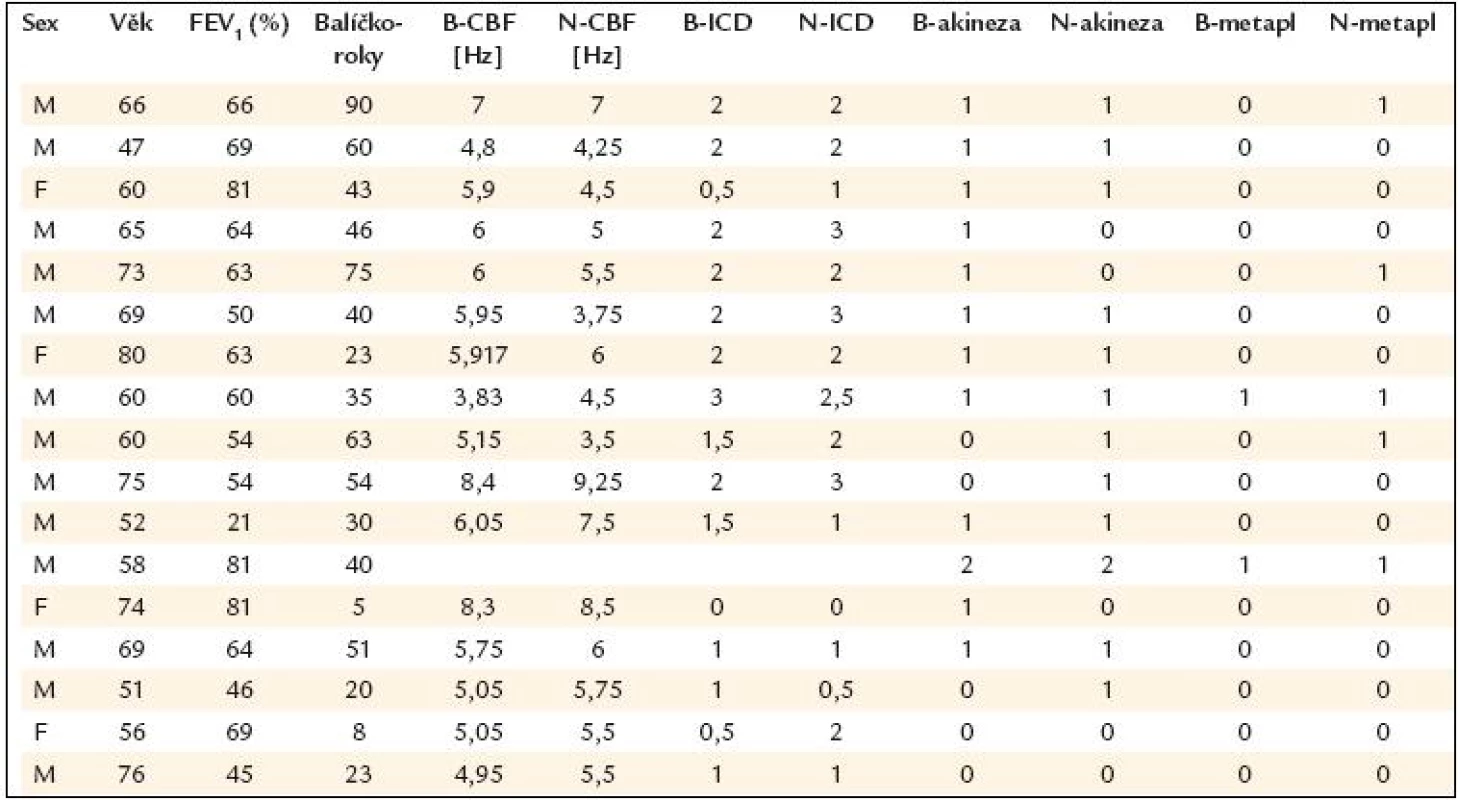
FEV1 – usilovný jednosekundový výdech (% náležitých hodnot), B-CBF – frekvence ciliárního kmitu z bronchiálního vzorku, N- CBF – frekvence ciliárního kmitu z nazálního vzorku, B- ICD – index ciliární dyskineze z bronchu, N- ICD – index ciliární dyskineze z nosní sliznice, B- akineze – akineze v oblasti bronchiálního vzorku (0 – není, 1 – parciální, 2 – totální), analogicky N- akineze, B-metaplazie – metaplazie sliznice z bronchu (0 – není, 1 – parciální, 2 – totální), analogicky N- metaplazie Graf 2. Výskyt akineze u nemocných s CHOPN ve vzorcích nosní a bronchiální sliznice. 
Graf 3. Srovnání výskytu dlaždicobuněčné metaplazie v oblasti nosní a bronchiální sliznice. 
Diskuze
Získané výsledky potvrdily naše předpoklady, tj. nebyl nalezen zjevný rozdíl mezi frekvencí cilií respiračního epitelu z nazální a bronchiální sliznice u současných kuřáků (24 hod bez expozice nikotinu) ve stabilní fázi CHOPN. Všichni nemocní zařazení do studie měli (alespoň částečně) vyjádřený bronchitický fenotyp onemocnění (někteří byli „čistými“ bronchitiky, jiní měli rysy obou nejčastějších klinických fenotypů, tj. jak chronickou expektoraci, tak výraznou hyperinflaci s HRCT verifikovaným plicním emfyzémem). Bronchitický fenotyp byl pro nás důležitý vzhledem k tomu, že chronická expektorace je pravděpodobně více asociována s přítomností porušené mukociliární clearance (ve srovnání s non bronchitickým, tj. emfyzematickým fenotypem) [3,5,6,38,42,43,56].
Také chronický nikotinizmus je pravděpodobnou kauzální příčinou mukociliárního poškození (primární interakce s ciliemi i sekundárně přes svůj zásadní vliv na vznik a vývoj CHOPN a chronické bronchitidy). Akutní vliv aktivního nebo pasivního nikotinizmu na respirační cilie vyšetřovaných osob jsme se snažili eliminovat nejméně 24hodinovou abstinencí – všichni nemocní s celkovou anestezií byli 24 hod před vyšetřením hospitalizováni, během hospitalizace na našem pracovišti je v podstatě vyloučena aktivní i pasivní expozice cigaretovému kouři. Vliv nikotinizmu však skutečně představuje řadu nejasností. Přechodná expozice cigaretovému kouři dle několika autorů neovlivňuje a dle jiných dokonce urychluje ciliární frekvenci respiračních cilií (hlavně u zdravých osob), možná jako projev zvýšené tendence odstraňovat v cigaretovém kouři přítomné škodliviny. Většina prací na experimentálních zvířatech i v lidských studiích však prokazuje ryze negativní působení akutního i dlouhodobého, aktivního či pasivního kouření na ciliární strukturu (ztráta cilií) a celkovou mukociliární aktivitu (pokles mukociliární clearance) a zabraňuje dokonce i normální regeneraci ciliárního epitelu (např. po operačním poškození respirační sliznice). Projevy nežádoucího působení cigaretového kouře i dalších škodlivin jsou patrné v rozsahu celých dýchacích cest – tj. v oblasti nosní, sinusové či bronchiální sliznice [1,2,4,17,40,53]. Dokonce je potvrzena stejná genová exprese v respiračních epiteliích bukální, nazální a bronchiální sliznice u pravidelných kuřáků [52].
Kromě naší práce se možným pan respiračním rozměrem CHOPN zabývají v posledních letech i další autoři. Mikroskopicky byly např. u kuřáků s CHOPN zachyceny v nosní i v bronchiální sliznici velmi obdobné známky dlaždicobuněčné metaplazie či podobně vyjádřené rozšíření subepitelové bazální membrány. Navíc se u kuřáků s CHOPN nevyskytují statisticky významné rozdíly ani v počtu slizničních eozinofilů, neutrofilů a CD8+ T lymfocytů mezi nosní a bronchiální sliznicí [55]. Také subjektivní klinické známky postižení nosní sliznice se u nemocných s CHOPN vyskytují výrazně častěji (nosní příznaky se nachází u 43–75% nemocných s CHOPN) [28,29,35,41]. Souvislost horních a dolních dýchacích cest vyplývá ze studie potvrzující závislost průchodnosti nosní dutiny nemocných s CHOPN (měřené ultrazvukem) na obstrukci dýchacích cest hodnocené spirometricky [20]. Stejní autoři popisují také změny sliznice dýchacích cest při exacerbaci CHOPN, kdy byla zjištěna vyšší koncentrace markerů zánětu (počet leukocytů, IL 6, myeloperoxidáza) ve sputu i hlenovém sekretu nosní dutiny [21]. Možné mechanizmy, jež vedou k současnému postižení horních i dolních dýchacích cest, však nejsou jasné. Pouze se můžeme domnívat, že se na něm podílí současné působení inhalačních škodlivin v celém rozsahu respirační sliznice, komplex nazobronchiálních reflexů, změna dechového vzoru s odlišným prouděním vzduchu u nemocných s CHOPN, případně opakované drobné plicní a nazální aspirace v důsledku špatně koordinovaného dýchání během polykání, kdy normální vzor výdech-polknutí-výdech je u osob s CHOPN významně narušený [18,28,29].
To, že je mukociliární clearance u nemocných s CHOPN poškozená, víme. Nevíme však, jakým způsobem toto poškození vzniká ani jak se vyvíjí v čase, a také to, proč není stejné u všech fenotypů CHOPN. Zajímat se o mukociliární clearence sice není zrovna publikačním hitem. Avšak v současnosti zahajovaný výzkum našich londýnských kolegů (z významné britské výzkumné skupiny zabývající se moderními trendy patogeneze této choroby) se právě nyní věnuje ciliární aktivitě u osob trpících CHOPN [30].
Každá práce, včetně té naší, má své limitace. Tou první je menší velikost souboru (i když v mnoha v literatuře zmiňovaných studiích jsou také uvedeny soubory o 10–15 osobách) a do jisté míry nižší vzorkovací frekvence (50 Hz) naší digitální vysokorychlostní kamery, neboť v současnosti nejčastěji používanými rychlostmi jsou 125–400 Hz [14,22–24]. Existují však mnohé recentní publikace výzkumně využívající stejnou, nebo dokonce menší (30–60 Hz) vzorkovací frekvenci [13,26,50,51]. Další možnou výhradou je použití fyziologického roztoku jako roztoku, do něhož bezprostředně po odběru pokládáme ciliární epiteliální proužky. V literatuře bývá uváděno několik dalších možností, jak lze ciliární buňky po odběru delší dobu uchovat beze změny jejich funkce (Medium 199, HBSS) [39]. Používají je však ta pracoviště, jež odebraný materiál zpracovávají do několika (čtyř) hod po odběru. Náš transportní čas je ale neporovnatelně menší, neboť do 3 min jsou všechny vzorky na vyhřívaném stolku mikroskopu a během dalších 2–3 min jsou cilie zaznamenány do paměti počítače. Fyziologický roztok je navíc pro tento rychlý přesun vyhovujícím médiem využívaným řadou jiných autorů [37,49].
Naopak výhodou a předností naší práce je značně homogenní soubor vyšetřených osob (klinicky stabilních, současných kuřáků, zbavených aktuální cigaretové expozice, s bronchitickým fenotypem onemocnění).
Závěr
Porovnání ciliárních frekvencí neukazuje statisticky významný rozdíl mezi nazální a bronchiální sliznicí nemocných s CHOPN (vzhledem k velikosti souboru a síle statistického testování však nelze s úplnou jistotou tvrdit, že se nos a bronchus vůbec neliší). Mezi výskytem akineze v nazální a bronchiální sliznici byla nalezena jen nízká míra shody. Výskyt metaplazie a index ciliární dyskineze vykazují střední míru shody. Tento pilotní výzkum je v současnosti následován dvěma dalšími ciliárními projekty: prvním, jenž pokračuje ve srovnávání nazální a bronchiální sliznice u dalších jedinců (tj. zvětšuje tento soubor), a druhým, jenž se komplexně vyšetřuje nazální sliznici u stopkuřáků se stabilní fází CHOPN. Naší snahou je nalézt další zajímavá fakta o jednom z důležitých patofyziologických mechanizmů chronické obstrukční plicní nemoci.
Poděkování patří zejména Interní grantové agentuře Ministerstva zdravotnictví České republiky a Kateřině Žohové a Věře Fabiánové, ochotným spolupracovnicím na naší klinice.
Práce byla podpořena zejména grantem IGA MZ ČR (NR 8407-4/2005).
MUDr. Vladimír Koblížek
www.fnhk.cz
e mail: koblivla@fnhk.cz
Zdroje
1. Agius A, Wake M, Pahor A et al. Smoking and middle ear ciliary beat frequency in otitis media with effusion. Acta Otolaryngol 1995; 115 : 44 – 49.
2. Agius A, Smallman L, Pahor A. Age, smoking and ciliary beat frequency. Clin Otolaryngol Allied Sci 1998; 23 : 227 – 230.
3. Agnew J, Little F, Pavia D et al. Mucus clearance from the airways in chronic bronchitis – smokers and ex - smokers. Bull Eur Physiopathol Respir 1982; 18 : 473 – 484.
4. Atef A, Zeid I, Qotb M et al. Effect of passive smoking on ciliary regeneration of nasal mucosa after functional endoscopic sinus surgery in children. J Laryngol Otol 2009; 123 : 75 – 79.
5. Barnes PJ, Shapiro SD, Pauwels RA. New treatments for chronic obstructive pulmonary disease: molecular and cellular mechanisms. Eur Respir J 2003; 22 : 672 – 688.
6. Barnes PJ. Mechanisms in chronic obstructive pulmonary disease: comparisons with asthma. PG 17 An expert view of the differences between astma and COPD. ERS Berlin 2008 Congress – Course Educational Material 5 – 19.
7. Braiman A, Priel Z. Efficient mucociliary transport relies on efficient regulation of ciliary beating. Respir Physiol Neurobiol 2008; 163 : 202 – 207.
8. Celli B. Update on the Management of COPD. Chest 2008; 133 : 1451 – 1462.
9. Corren J, Adinoff A, Buchmeier A et al. Nasal beclomethasone prevents the seasonal increase in bronchial responsiveness in patients with allergic rhinitis and asthma. J Allergy Clin Immunol 1992; 90 : 250 – 256.
10. Corren J. Allergic rhinitis and asthma: How important is the link? J Allergy Clin Immunol 1997; 99: S781 – S786.
11. Devalia J, Sapsford R, Wells C et al. Culture and comparison of human bronchial and nasal epithelial cells in vitro. Respir Med 1990; 84 : 303 – 312.
12. Devalia J, Davies R. Human nasal and bronchial epithelial cells in culture: an overview of their characteristics and function. Allergy Proc 1991; 12 : 71 – 79.
13. Doran S, Koss R, Tran C et al. Effect of serotonin on ciliary beating and intracellular calcium concentration in identified population of embryonic ciliary cells. J Exp Biol 2004; 207 : 1415 – 1429.
14. Fliegauf M, Olbrich H, Horvath J et al. Mislocalization of DNAH5 and DNAH9 in respiratory cells from patients with primary celiary dyskinesia. Am J Respir Crit Care Med 2005; 171 : 1343 – 1349.
15. Fontanari P, Burnet H, Zattara‑Hartmann MC et al. Changes in airway resistance induced by nasal inhalation of cold dry, dry, or moist air in normal individuals. J Appl Physiol 1996; 81 : 1739 – 1743.
16. Gaga M, Lambrou P, Papageorgiou N et al. Eosinophils are a feature of upper and lower airway pathology in non‑atopic asthma, irrespective of the presence of rhinitis. Clin Exp Allergy 2000; 30 : 663 – 669.
17. Goodman R, Yergin B, Landa J et al. Relationship of smoking history and pulmonary function tests to tracheal mucous velocity in nonsmokers, young smokers, ex ‑ smokers and patients with chronic bronchitis. Am Rev Respir Dis 1978; 117 : 205 – 214.
18. Gross RD, Atwood CW jr, Ross SB et al. The coordination of breathing and swallowing in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 176 : 559 – 565.
19. Hens G, Hellings P. The nose: gatekeeper and trigger of bronchial disease. Rhinology 2006; 44 : 179 – 187.
20. Hurst JR, Kuchai R, Michael P et al. Nasal symptoms, airway obstruction and disease severity in chronic obstructive pulmonary disease. Clin Physion Funct Imaging 2006; 26 : 251 – 256.
21. Hurst JR, Perera WR, Wilkinson TM et al. Systemic and upper and lower airway inflammation at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit 2006; 173 : 71 – 78.
22. Chilvers MA, O’Callaghan C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax 2000; 55 : 314 – 317.
23. Chilvers M, McKean M, Rutman A et al. The effects of coronavirus on human nasal ciliated respiratory epithelium. Eur Respir J 2001; 18 : 965 – 970.
24. Chilvers M, Rutman A, O’Callaghan CO. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax 2003; 58 : 333 – 338.
25. Chlumský J, Štěrbová L, Smolíková L et al. Vztah ventilačních plicních parametrů, tolerance fyzické zátěže a kvality života u pacientů s chronickou obstrukční plicní nemocí. Vnitř Lék 2002; 48 : 320 – 324.
26. Ishijima S. High‑speed video microscopy of flagella and cilia. Methods Cell Biol 1995; 47 : 239 – 243.
27. Kašák V. Exacerbace chronické obstrukční nemoci. In: Kašák V, Koblížek V (eds). Naléhavé stavy v pneumologii. Praha: Maxdorf Jessenius 2008 : 250 – 275.
28. Kim J, Rubin B. Nasal and sinus inflammation in chronic obstructive pulmonary disease. COPD 2007; 4 : 163 – 166.
29. Kim J, Rubin B. Nasal and sinus involvement in chronic obstructive pulmonary disease. Curr Opin Pulm Med 2008; 14 : 101 – 104.
30. Kharitonov S, Pedersen L. Inhaled Mannitol and Ciliary Beat Frequency in COPD Patients. London: Imperial College 2007.
31. Koblížek V, Salajka F, Čermáková E et al. Vztah mezi kvalitou života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci. Vnitř Lék 2009; 55 : 940 – 947.
32. Kopecký O, Lukešová Š, Koblížek V et al. Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí. Vnitř Lék 2006; 52 : 1021 – 1029.
33. Leynaert B, Bousquet J, Neukirch C et al. Perennnial rhinitis: An independent risk factor for asthma in nonatopic subjects: Results from the European Community Respiratory Health Survey. J Allergy Clin Immunol 1999; 104 : 301 – 304.
34. Musil J. Léčba chronické obstrukční plicní nemoci. Praha: Grada 1999.
35. Nihlén U, Andersson M, Löfdahl CG et al. Nasal neutrophil activity and mucinous secretory responsiveness in COPD. Clin Physiol Funct Imaging 2003; 23 : 138 – 142.
36. Pauk N. Současné možnosti léčby CHOPN. Stud Pneumol Phtiseol 2008; 5 : 182 – 190.
37. Pifferi O, Cangiotti A, Ragazzo V et al. Primary ciliary dyskinesia: Diagnosis in Children with inconclusive ultrastructural evaluation. Pediiatr Allergy Imunol 2001; 12 : 274 – 282.
38. Pistolesi M, Camiciottoli G, Paoletti M et al. Identification of a predominant COPD phenotype in clinical practice. Respir Med 2008; 102 : 367 – 376.
39. Raphael J, Strupish J, Selwyn D et al. Recovery of respiratory ciliary function after depression by inhalation anaesthetic agents: an in vitro study using nasal turbinate explants. Br J Anaesth 1996; 76 : 854 – 859.
40. Rankin H, Moody A, Moate R et al. Elevated oxygen fraction reduces cilial abundance in explanted human bronchial tissue. Ultrastruct Pathol 2007; 31 : 339 – 346.
41. Roberts N, Lloyd ‑ Owen S, Rapado F et al. Relationship between chronic nasal and respiratory symptoms in patients with COPD. Respir Med 2003; 97 : 909 – 914.
42. Rogers DF. Mucus pathophysiology in COPD: differences to asthma, and pharmacotherapy. Monaldi Arch Chest Dis 2000; 55 : 324 – 332.
43. Rogers DF. Airway Mucus Secretion. In: Barnes PJ (ed). Chronic Obstructive Pulmonary Disease, Cellular and Molecular Mechanisms. Boca Raton, FL: Taylor Francis 2005 : 83 – 111.
44. Rutland J, Griffin W, Cole P. Human ciliary beat frequency in epithelium from intrathoracic and extrathoracic airways. Am Rev Respir Dis 1982; 125 : 100 – 105.
45. Salajka F. Proč hodnotit kvalitu života nemocných s bronchiální obstrukcí? Vnitř Lék 1999; 45 : 480 – 483.
46. Salajka F. Kvalita života nemocných s chronickou obstrukční plicní nemocí. Stud Pneumol Phtizeol 1997; 57 : 137.
47. Salajka F. Kvalita života nemocných s bronchiální obstrukcí. Stud Pneumol Phtizeol 1997; 57 : 262 – 254.
48. Samolinski B, Szczesnowicz ‑ Dabrowska P. Relationship between inflammation of upper and lower respiratory airways. Otolaryngol Pol 2002; 56 : 49 – 55.
49. Santamaria F, Grillo G, Sarnelli P et al. Ciliary motility at light microscopy: a screening technique for ciliary defects? Acta Paediatr 1999; 88 : 853 – 857.
50. Sisson J, Stoner J, Ammons B et al. All‑digital image capture and whole – field analysis of ciliary beat frequency. J Microsc 2003; 211 : 103 – 111.
51. Shirakami G, Li D, Zhan X et al. Propofol stimulates ciliary motility via the nitric oxide - cyclic GMP pathway in cultured rat tracheal epithelial cells. Anesthesiology 2000; 93 : 482 – 488.
52. Sridhar S, Schembri F, Zeskind J et al. Smoking‑induced gene expression changes in the bronchial airway are reflected in nasal and buccal epithelium. BMC Genomics 2008; 9 : 259.
53. Stanley P, Wilson R, Greenstone M et al. Effect of cigarette smoking on nasal mucociliary clearance and ciliary beat frequency. Thorax 1986; 41 : 519 – 523.
54. Togias AG. Systemic immunologic and inflammatory aspects of allergic rhinitis. J Allergy Clin Immunol 2000; 106 (Suppl 5): S247 – S250.
55. Vachier I, Vignola AM, Chiappara G et al. Inflammatory features of nasal mucosa in smokers with and without COPD. Thorax 2004; 59 : 303 – 307.
56. van der Schans C, Piers D, Beekhuis H et al. Effect of forced expirations on mucus clearance in patients with chronic airflow obstruction: effect of lung recoil pressure. Thorax 1990; 45 : 623 – 627.
57. Verra F, Fleury ‑ Feith J, Boucherat M et al. Do nasal ciliary changes reflect bronchial changes? An ultrastructural study. Am Rev Respir Dis 1993; 147 : 908 – 913.
58. Vondra V, Reisová M, Malý M. Metodologie zjišťování kvality života u nemocných s bronchiální obstrukcí. Stud Pneumol Phtiseol 2000; 60 : 57 – 62.
59. Vondra V, Reisová M, Malý M. Kvalita života u nemocných s bronchiální obstrukcí. Stud Pneumol Phtiseol 2000; 60 : 73 – 76.
60. Vondra V, Reisová M, Malý M. Kvalita života u nemocných s chronickou obstrukční plicní nemocí a bronchiálním astmatem. Čas Lék Čes 1998; 137 : 455 – 459.
61. Watson WT, Becker AB, Simons FE. Treatment of allergic rhinitis with intranasal corticosteroids in patients with mild asthma: Effect on lower airway responsiveness. J Allergy Clin Immunol 1993; 91 : 97 – 101.
62. Wright A, Holberg C, Martinez F et al. Epidemiology of physician - diagnosed allergic rhinitis in childhood. Pediatrics 1994; 94 : 895 – 901.
63. Yawn B, Yunginger J, Wollan P et al. Allergic rhinitis in Rochester, Minnesota residents with asthma: Frequency and impact on health care charges. J Allergy Clin Immunol 1999; 103 : 54 – 59.
64. Youngil I, Inseon S. Relationship between Nasal and Bronchial Responsiveness in Perennial Allergic Rhinitic Patients with Asthma. Int Arch Allergy Immunol 2002; 129 : 341 – 347.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



