-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
Endoscopic diagnostics and management of pancreatic - biliary disorders in patients after Billroth II gastric resection
Aims of the study:
The aim of this retrospective study was to analyse diagnostic and therapeutic success of endoscopic retrograde cholangiopancreatography (ERCP) in our sample of patients following Billroth II gastric resection, where, due to significantly modified anatomic ratios, this surgery represents a specific and often extremely difficult technical problem when performing ERCP. Materials and methodology: The sample was followed up for 13 years (November 1994 – December 2007). The data on 112 patients after Billroth II gastric resection were assessed retrospectively; indications for ERCP included cholestasis in 92 patients, acute biliary pancreatitis in 12 patients, acute cholangitis in 6 patients and suspected bile leak following laparoscopic cholecystectomy (LCE) in 2 patients. Results: Cannulation success during ERCP in the 112 patients following Billroth II gastric resection was 90.2% (i.e. 101 of the 112 patients). Normal ERCP finding was recorded in 4 patients. The remaining 97 patients had pathological results on ERCP (choledocholitiasis was found in 78 patients, malignant biliary stenosis in 14, benign biliary stenosis in 3 a bile leak following LCE in 2). Endoscopic treatment was initiated immediately after diagnostic ERCP in all these 97 patients, the initial step was in all cases endoscopic papillotomy using one of the special papillotomes (diathermy wire). Overall, therapeutic ERCP was completely successful in 83 of the 97 patients (85.6% of 97) in whom the originally endoscopic treatment had been initiated. Conclusions: ERCP following Billroth IIgastric resection is, due to modified post‑surgery anatomy, markedly more challenging then the conventional procedure. Availability of a variety of tools as well as, understandably, extensive experience and skill of an endoscopist are prerequisite to ERCP success in these patients. Correctly performed ERCP in patients following Billroth II gastric resection is a highly effective and safe method for diagnostics and, in particular, treatment of pancreatic - biliary diseases, in which similar success as under standard anatomic conditions can be achieved.Key words:
endoscopic retrograde cholangiopancreatography – Billroth II gastrectomy – endoscopic papillotomy – endoscopic treatment
Autoři: Bohuslav Kianička 1
; Petr Dítě 2
; P. Piskač 3
Působiště autorů: Gastroenterologické oddělení II. interní kliniky Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MU Dr. Miroslav Souček, CSc. 1; Interní hepatogastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jan Lata, CSc. 2; I. chirurgická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MU Dr. Ivan Čapov, CSc. 3
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1043-1050
Kategorie: Původní práce
Souhrn
Cíle práce:
Cílem této retrospektivní studie je rozbor úspěšnosti diagnostické a terapeutické endoskopické retrográdní cholangiopankreatikografie (ERCP) v našem souboru pacientů po resekci žaludku podle Billrotha II, kde pro výrazně změněné anatomické poměry se tento druh operace stal specifickým a mnohdy velice obtížným technickým problémem při ERCP. Materiál a metodika: Studium souboru trvalo 13 let (listopad roku 1994 – prosinec roku 2007). V práci bylo retrospektivně hodnoceno 112 pacientů po resekci žaludku podle Billrotha II, kdy indikací k provedení ERCP byla u 92 nemocných cholestáza, 12krát akutní biliární pankreatitida, 6krát akutní cholangoitida a 2krát suspicium na biliární leak po laparoskopické cholecystektomii (LCE). Výsledky: U 112 pacientů po resekci žaludku podle Billrotha II jsme při ERCP dosáhli 90,2% kanylační úspěšnosti (tedy u 101 pacientů ze 112). U 4 nemocných byl na ERCP normální nález. U zbývajících 97 pacientů byl na ERCP patologický nález (u 78 pacientů byla nalezena choledocholitiáza, u 14 maligní biliární stenóza, u 3 benigní biliární stenóza a u 2 biliární leak po LCE). U všech těchto 97 pacientů byla bezprostředně po diagnostické ERCP zahájena endoskopická léčba, jejímž úvodním krokem byla vždy endoskopická papilotomie některým ze speciálních papilotomů. Celkem byla terapeutická ERCP kompletně úspěšná u 83 pacientů z 97 (85,6 % z 97), u kterých byla původně endoskopická léčba zahájena. Závěry: ERCP po resekci žaludku podle Billrotha II je v důsledku odlišné pooperační anatomie oproti standardnímu výkonu podstatně náročnější. Úspěch ERCP je zde podmíněn dostatkem variabilního příslušenství a dále samozřejmě velkou osobní zkušeností a zručností endoskopisty. Správně prováděná ERCP u pacientů po resekci žaludku podle Billrotha II je vysoce efektivní a bezpečná metoda v diagnostice a zejména léčbě pankreatobiliárních onemocnění, kde lze dosáhnout téměř stejné úspěšnosti jako za normální anatomické situace.Klíčová slova:
endoskopická retrográdní cholangiopankreatikografie – Billroth II gastrektomie – endoskopická papilotomie – endoskopická léčbaÚvod
Resekce žaludku podle Billrotha II (B II) se provádí stále méně často. Pro výrazně změněné anatomické poměry se tento druh operace stal mnohdy velice obtížným technickým problémem při endoskopické retrográdní cholangiopankreatikografii (ERCP), kdy v důsledku odlišné pooperační anatomie mají ERCP i endoskopická papilotomie (EPT) své specifické rysy i úskalí.
Cílem této retrospektivní studie je rozbor úspěšnosti diagnostické a terapeutické ERCP v našem souboru pacientů po resekci žaludku podle B II.
Soubor nemocných a metodika
Studium souboru trvalo 13 let (listopad roku 1994 – prosinec roku 2007). V práci bylo retrospektivně hodnoceno 112 pacientů po resekci žaludku podle B II.
ERCP jsme prováděli videolateroskopy Olympus TJF (terapeutický videolateroskop s širokým terapeutickým kanálem 4,2mm), a to TJF 130, TJF 140 nebo TJF 160. Jen zcela sporadicky, a to ještě v počátečních obdobích, jsme použili přístroj s prográdní optikou. Základní technika ERCP a následných terapeutických endoskopických výkonů byla v zahraničním i našem písemnictví opakovaně popsána [1–9].
K premedikaci jsme většinou používali midazolam 2,5–7,5mg a butylscopolamin 20–40mg frakcionovaně intravenózně periferní kanylou a při bolestivé reakci (zejména při použití biliárního balónkového dilatátoru) pak fentanyl 0,1mg intravenózně.
K RTG zobrazení pankreatobiliárního systému jsme používali ionizovanou jodovou kontrastní látku Telebrix N 300 a pro pacienty s pozitivní alergickou anamnézou neionizovanou jodovou kontrastní látku Omnipaque 300.
EPT jsme prováděli některým ze speciálních papilotomů pro nemocné po resekci žaludku II. typu (reverse loop a sigmoid loop). V případě nutnosti jsme nejprve incidovali Vaterskou papilu (VP) technikou precutu (jehlovým nožem nebo precutovým papilotomem). Papilotomii jsme potom dokončili podle potřeby některým ze speciálních papilotomů.
Konkrementy byly z hepatocholedochu extrahovány Dormia košíky nebo extrakčními balónky. V případě výskytu příliš objemného kamene jsme nejprve provedli jeho mechanickou litotrypsi.
K zevní drenáži žlučových cest byly používány nasobiliární drény (NBD) šíře 10 Frenchů.
Vnitřní drenáž žlučových cest byla realizována aplikací plastikových duodenobiliárních endoprotéz (DBE) šíře 10 Frenchů.
K dilataci biliárních stenóz byly použity balónkové hydrostatické biliární dilatátory o průměru 5 a 8mm (fy Wilson Cook) a dále jsme též používali bužiové biliární dilatátory.
Charakteristiku našeho souboru 112 pacientů po resekci žaludku podle B II uvádí tab. 1.
Tab. 1. Charakteristika souboru 112 pacientů po resekci žaludku podle B II. 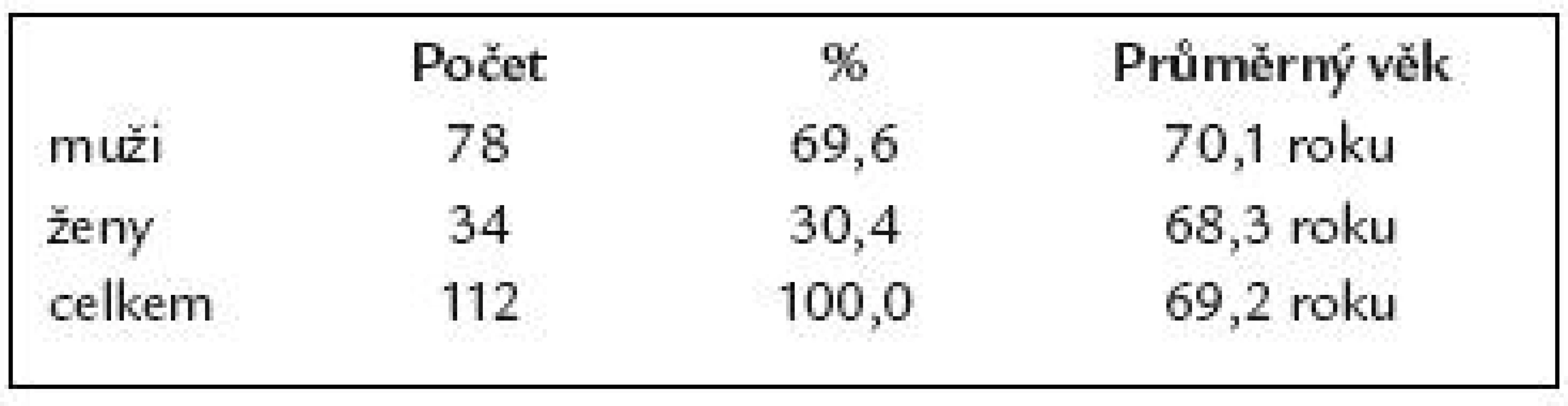
Výsledky
V našem souboru 112 pacientů indikace k provedení ERCP jsou uvedeny v tab. 2. U 112 pacientů po resekci žaludku podle Billrotha II jsme při ERCP dosáhli 90,2% kanylační úspěšnosti – tedy u 101 pacientů ze 112. U 4 nemocných byl na ERCP normální nález. U zbývajících 97 pacientů byl na ERCP patologický nález. Z těchto 97 nemocných byla u 78 nalezena choledocholitiáza (CDL), u 14 maligní biliární stenóza, u 3 benigní biliární stenóza a u 2 biliární leak po LCE. Nálezy při ERCP u těchto pacientů jsou uvedeny v tab. 3. Kanylační neúspěch byl zaznamenán u 11 pacientů ze 112 (9,8%). Příčiny kanylačních neúspěchů jsou uvedeny v tab. 4.
Tab. 2. Indikace ERCP u 112 pacientů po resekci žaludku podle B II. 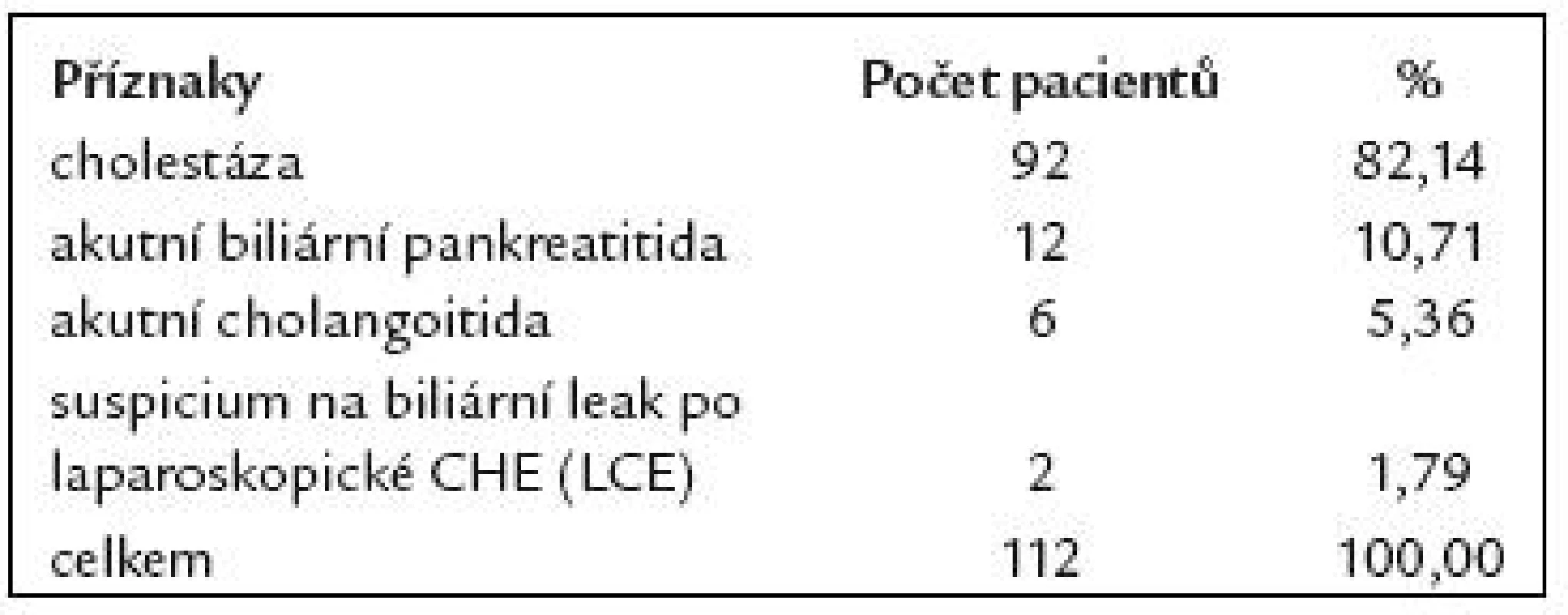
Tab. 3. ERCP diagnostika u 112 pacientů po resekci žaludku podle B II. 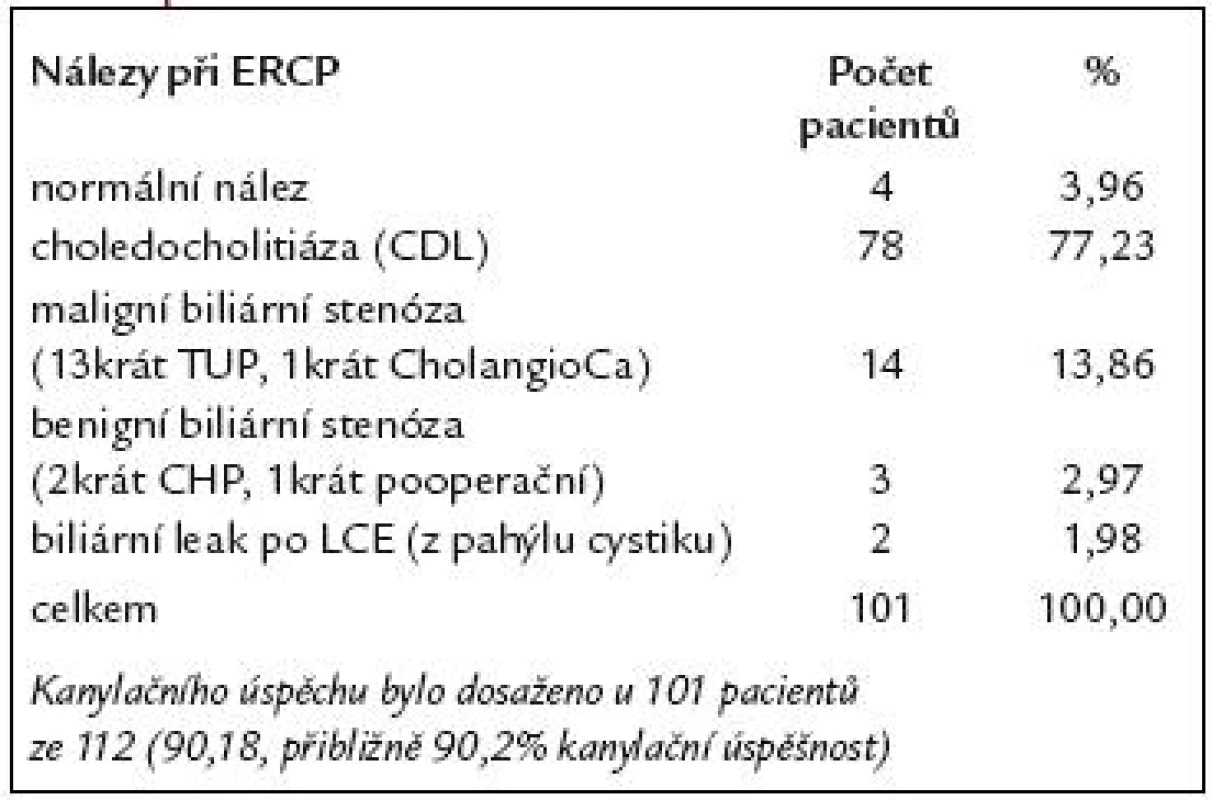
Tab. 4. Příčiny kanylačních neúspěchů. 
U všech 97 pacientů s patologickým nálezem na ERCP byla bezprostředně po diagnostické ERCP zahájena endoskopická léčba, jejímž úvodním krokem byla vždy různě dlouhá EPT některým ze speciálních papilotomů. Z těchto 97 pacientů se podařilo provést suficientní EPT u 92 (95% z 97). U zbývajících 5 nemocných (vždy u pacientů s CDL) se podařilo provést pouze nekompletní EPT.
Celkem byla terapeutická ERCP kompletně úspěšná u 83 pacientů z 97 (85,6% z 97), u kterých byla původně endoskopická léčba zahájena.
Výsledky endoskopické léčby u těchto 97 pacientů jsou uvedeny v tab. 5.
Tab. 5. Výsledky endoskopické léčby u 97 pacientů s patologickým ERCP nálezem. 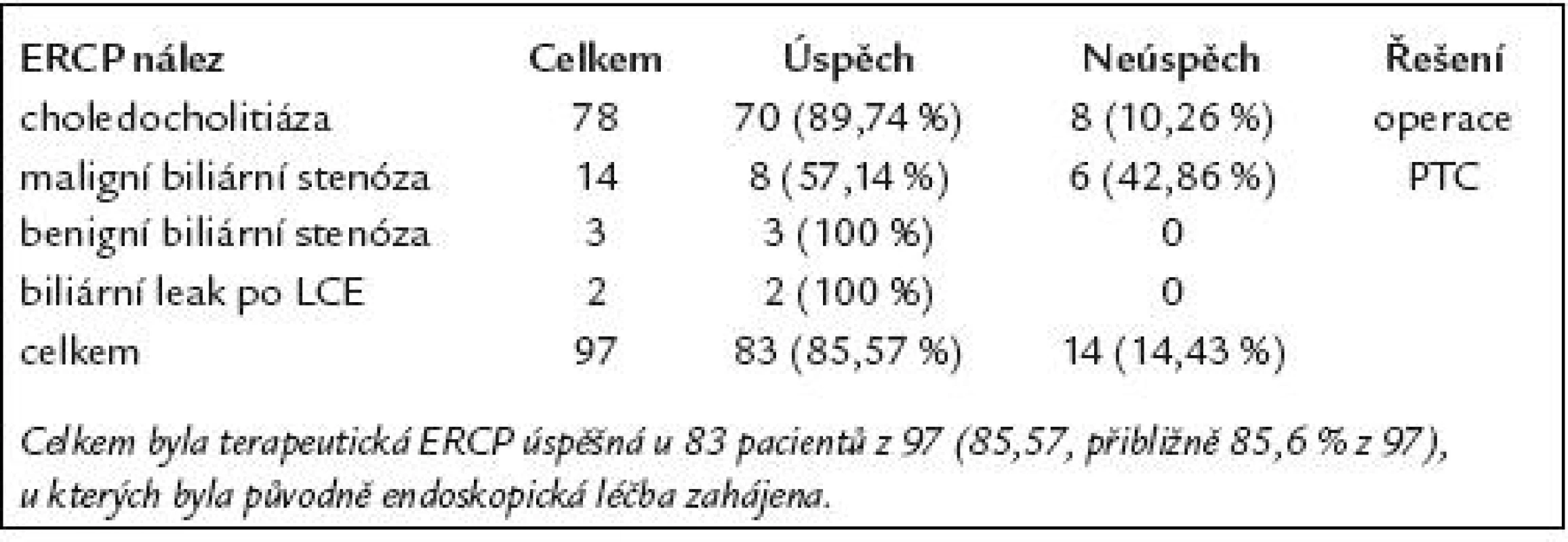
Výsledky endoskopické terapie choledocholitiázy
Nejčastějším nálezem při ERCP v našem souboru pacientů byla CDL, která se vyskytovala u 78 pacientů (ze 101 nemocných, u kterých byl zaznamenán kanylační úspěch).
Z těchto 78 pacientů byla endoskopická léčba CDL kompletně úspěšná u 70 (tedy 89,74%, tj. přibližně 90% úspěšnost endoskopické léčby CDL) (obr. 1–3).
Obr. 1. Při ERC u pacienta po resekci žaludku podle Billrotha II jsou v dilatovaných extrahepatálních žlučových cestách přítomny dva objemné konkrementy. 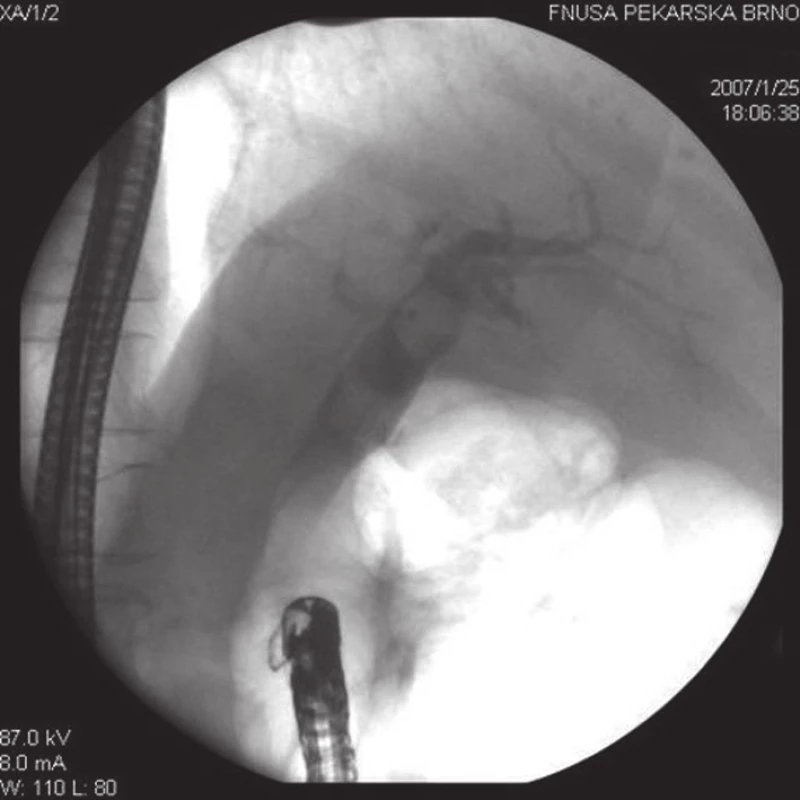
Obr. 2. ERC u pacienta z obr. 1. Nejprve byla provedena endoskopická papilotomie, poté mechanická litotrypse objemné choledocholitiázy a následně endoskopická extrakce veškeré choledocholitiázy z hepatocholedochu do duodena pomocí extrakčního balónku, který je na tomto RTG snímku patrný v oblasti suprapapilárního choledochu. 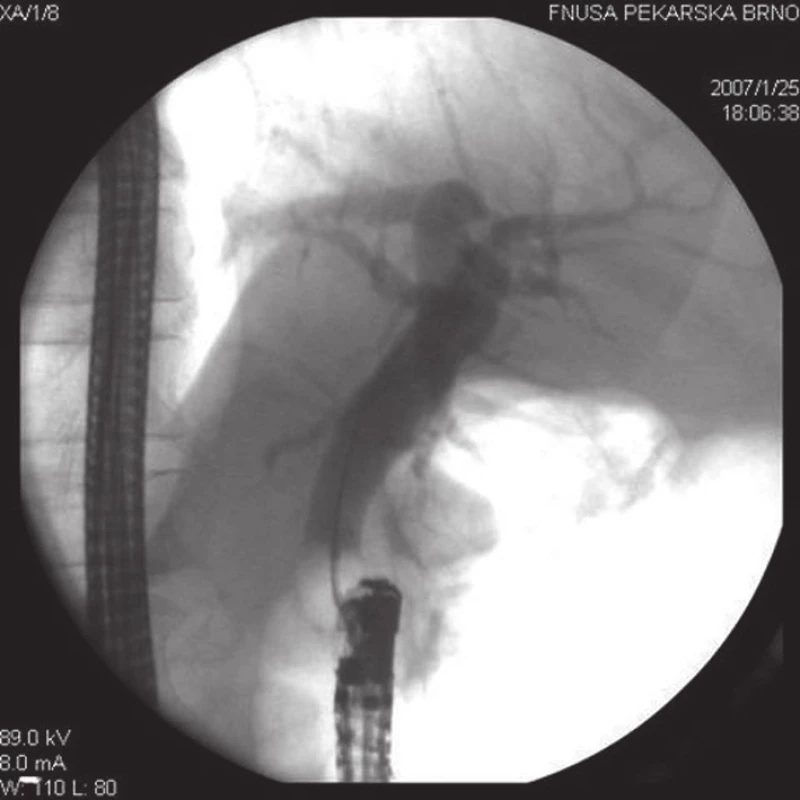
Obr. 3. ERC u pacienta z obr. 1, kdy po endoskopické extrakci veškeré choledocholitiázy jsou žlučové cesty při kontrolním ERC již zcela volné. 
Po provedení EPT probíhá endoskopická léčba CDL u pacientů po resekci žaludku dle B II obvyklým způsobem (včetně použití mechanické litotrypse), ale v některých případech vyžaduje procedura více času a probíhá během několika sezení.
U 8 pacientů ze 78 byla endoskopická léčba CDL neúspěšná. U 5 pacientů z 8 se podařilo provést pouze nekompletní endoskopickou papilotomii a u zbývajících 3 pacientů byla mnohočetná CDL příliš objemná a nebylo možné ji endoskopicky vyřešit. Ve všech těchto 8 případech byla CDL řešena chirurgicky. Chirurgický výkon však může být relativně obtížnější pro plošné adheze, vytvořené po předchozí operační intervenci [10].
Výsledky endoskopického řešení benigních biliárních stenóz
Benigní biliární stenóza se vyskytla u 3 pacientů a u všech byla úspěšně vyřešena endoskopicky (tedy 100% úspěšnost endoskopického řešení benigních biliárních stenóz v našem souboru).
U 2 z nich se jednalo o stenózu suprapapilárního choledochu při chronické pankreatitidě, kdy endoskopická léčba spočívala v provedení EPT (spíše kratší) a následné transpapilární aplikaci plastového duodenobiliárního 10 Fr. stentu do hepatocholedochu, který přemosťoval stenózu suprapapilárního choledochu.
U 1 pacienta se jednalo o pooperační stenózu v oblasti společného hepatiku (v místě odstupu pahýlu cystiku). Po provedení krátké EPT byla situace úspěšně řešena endoskopickou dilatací této stenózy. Opakovaně – celkem 3krát, a to po třech měsících, byla provedena dilatace této stenózy pomocí balónkového dilatátoru. Po dilataci jsme vždy transpapilárně zavedli do hepatocholedochu endoprotézu, a to poprvé jednu, podruhé dvě a potřetí tři plastové duodenobiliární 10 Fr. endoprotézy, které jsme samozřejmě při kontrolním ERCP vždy vyměnili.
Výsledky endoskopického řešení maligních biliárních stenóz
Nemocných s maligní biliární stenózou bylo v našem souboru 14. Ve 13 případech se jednalo – dle všech doposud provedených vyšetření – o tumorózní infiltraci pankreatu (TUP) a 1krát o cholangiokarcinom (kde jsme při ERCP prováděli odběr slizničních vzorků z oblasti biliární stenózy na histologii i cytologii). Endoskopická léčba u maligních biliárních stenóz spočívala v provedení kratší EPT a následné transpapilární aplikaci plastového 10 Fr. duodenobiliárního stentu do hepatocholedochu, kdy tento stent překlenul maligní biliární stenózu, a zajistil tak biliární drenáž.
Ze 14 pacientů s maligní biliární stenózou byla tato endoskopická léčba úspěšná u 8 (tedy 57, 14%, přibližně 57% úspěšnost endoskopického řešení maligních biliárních stenóz) (obr. 4, 5).
Obr. 4. Na ERC po resekci žaludku podle Billrotha II je přítomna těsná stenóza distální etáže hepatocholedochu při tumoru hlavy pankreatu. Ductus pankreaticus major se nenaplnil. 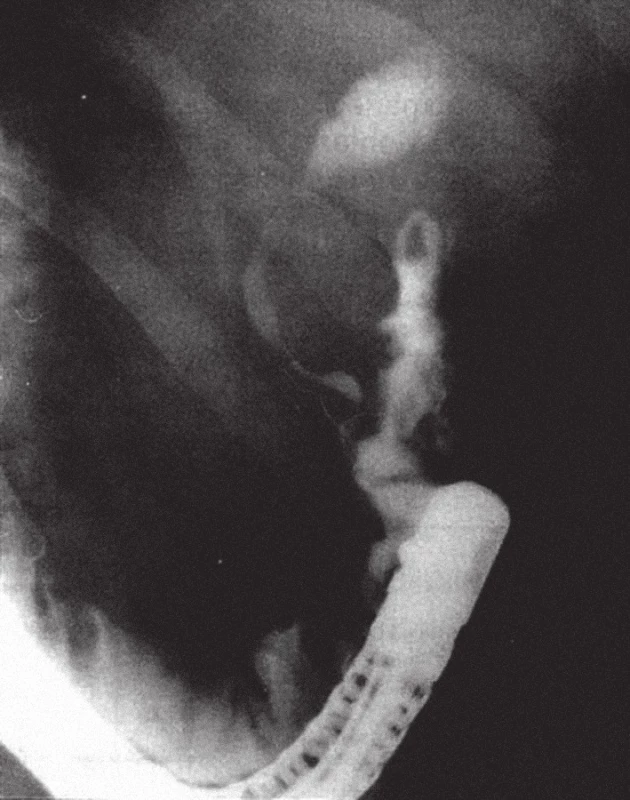
Obr. 5. ERC u pacienta z obr. 4, kdy maligní stenóza choledochu byla překlenuta transpapilárně zavedeným plastovým 10 Fr. duodenobiliárním stentem. 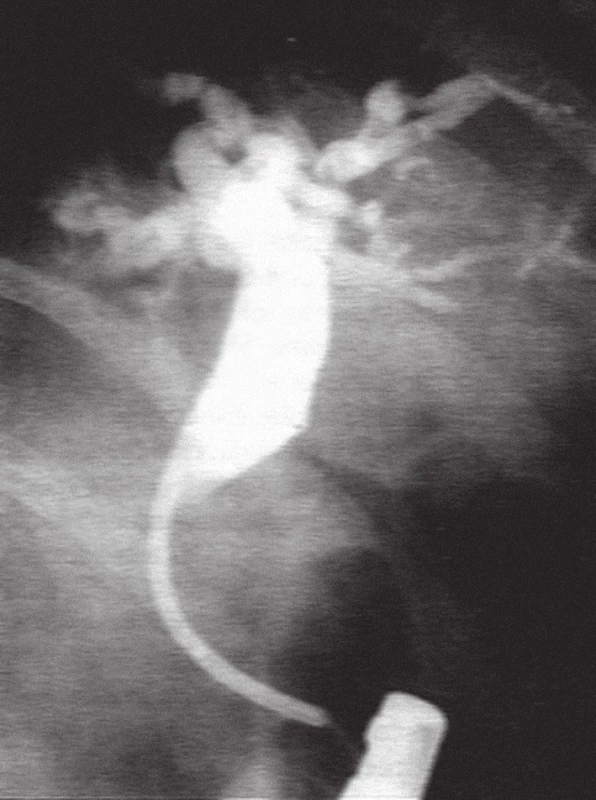
U zbývajících 6 nemocných byla maligní biliární stenóza příliš těsná, a proto ji nebylo možné řešit endoskopicky (tedy transpapilárně zavedeným duodenobiliárním stentem). Stav bylo nutné řešit cestou perkutánní transhepatální cholangiografie (PTC) [11].
Výsledky endoskopické léčby biliárního leaku z pahýlu cystiku po laparoskopické cholecystektomii
U 2 pacientů byl nalezen biliární leak z pahýlu cystiku po LCE – 4. a 6. den po LCE, z nedostatečně zaklipovaného pahýlu cystiku. U obou těchto pacientů byla situace úspěšně vyřešena endoskopicky, takže úspěšnost endoskopického řešení biliárního leaku z pahýlu cystiku po LCE byla 100%.
Endoskopická léčba spočívala v provedení krátké EPT a následné transpapilární aplikaci plastového duodenobiliárního 10 Fr. stentu do hepatocholedochu, kdy tento stent překlenul místo biliárního leaku (tedy oblast pahýlu cystiku). Při kontrolním ERCP za čtyři týdny jsme endoskopicky extrahovali duodenobiliární stent a při kontrolním cholangiogramu jsme konstatovali normální nález, bez biliárního leaku.
Údaje o morbiditě a bezprostřední mortalitě terapeutické ERCP u 97 pacientů, u kterých byla aplikována endoskopická léčba, uvádíme v tab. 6.
Tab. 6. Morbidita a bezprostřední mortalita terapeutické ERCP u 97 pacientů po resekci žaludku podle B II, u kterých byla aplikována endoskopická léčba. 
Je patrné, že komplikace terapeutické ERCP v našem souboru 97 pacientů, kteří prodělali endoskopickou léčbu, nebyly příliš časté.
U 2 pacientů z 97 (2,06% z 97) nastalo mírné krvácení po EPT, které bylo v obou případech vyřešeno endoskopicky a nevyžádalo si krevní převody.
U dalších 2 pacientů z 97 (tedy 2,06% z 97) se vyskytla mírná akutní pankreatitida po EPT, která vždy odezněla po třech dnech na parenterálním příjmu.
U 1 pacienta z 97 (1,03% z 97) se vyskytla intestinální perforace v oblasti gastroenteroanastomózy (GEA), a to na začátku přívodné střevní kličky. Tento stav musel být samozřejmě řešen chirurgicky.
Celkem se tedy komplikace při terapeutické ERCP v našem souboru vyskytly u 5 pacientů z 97, takže morbidita terapeutické ERCP byla 5,15%.
Žádný pacient nezemřel bezprostředně v souvislosti s endoskopickým výkonem, takže bezprostřední mortalita terapeutické ERCP v našem souboru byla nulová.
Shrnutí výsledků diagnostické a terapeutické ERCP v našem souboru pacientů po resekci žaludku podle Billrotha II ukazuje tab. 7.
Tab. 7. Shrnutí výsledků diagnostické a terapeutické ERCP v našem souboru pacientů po resekci žaludku podle Billrotha II. 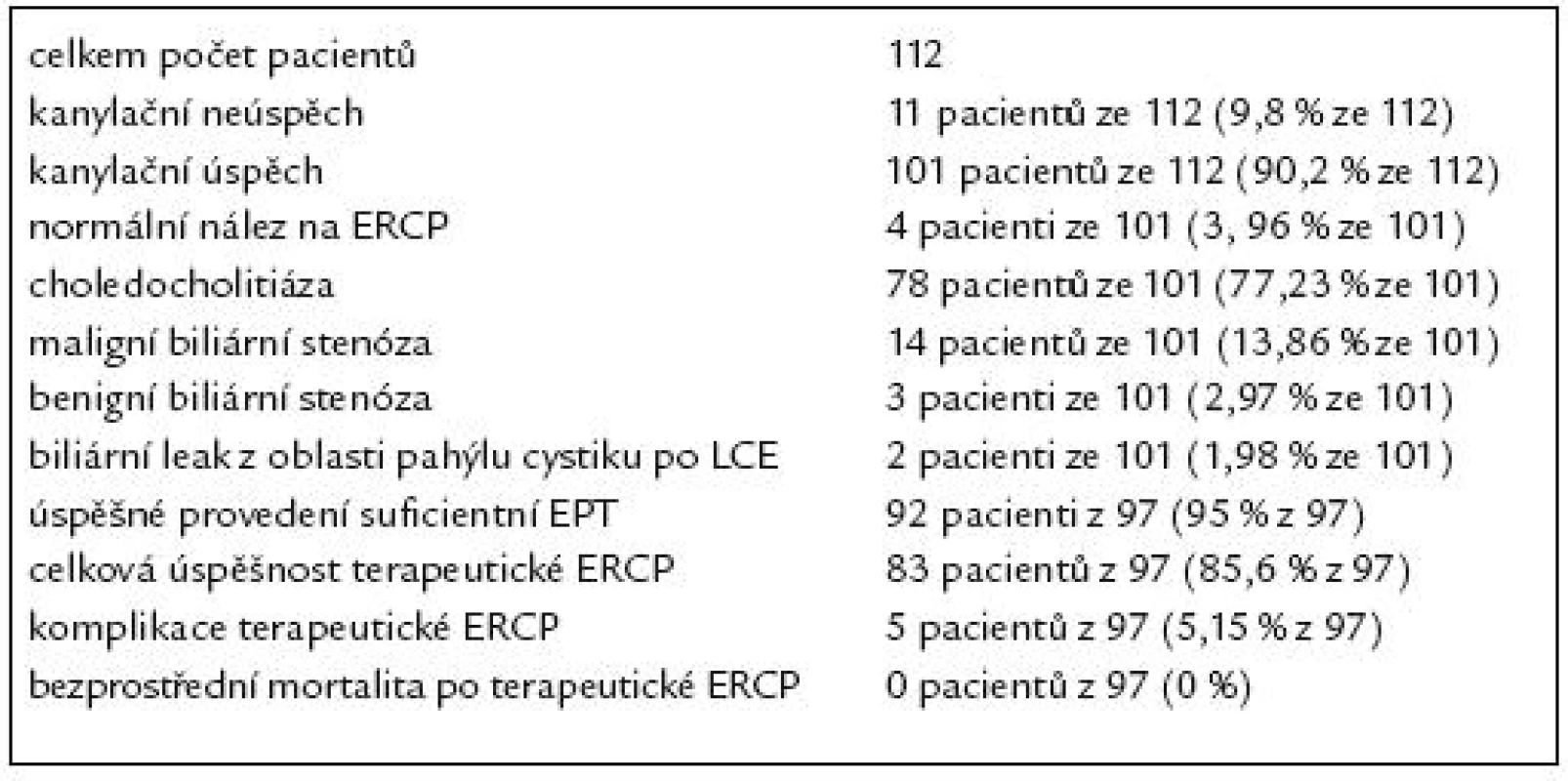
Diskuze
ERCP po resekci žaludku podle B II je oproti standardnímu výkonu podstatně náročnější.
VP je umístěna v blízkosti slepého konce přívodné kličky. ERCP i EPT tak mají svá zcela charakteristická specifika a v důsledku odlišné anatomie je k jejich úspěšnému provedení nutná velká endoskopická zručnost.
Po průchodu pahýlem žaludku může přinést první problémy často již orientace v oblasti GEA. Přestože se udává, že ústí přívodné kličky se objevuje častěji v pravém horním kvadrantu GEA (přibližně na čísle 3), bývá nutné revidovat obě střevní kličky [12]. Odvodná střevní klička obvykle směřuje více v ose pahýlu žaludku, zatímco přívodná střevní klička začíná ostrým ohybem se štěrbinovým luminem.
Dalším obtížným krokem bývá vstup do přívodné kličky, zvláště když je zbytek malé křiviny žaludečního pahýlu velmi krátký a přívodná klička může mířit strmě vzhůru. Při zavádění endoskopu do přívodné kličky se někdy používá technika podobná kolonoskopickému manévru, kdy se přívodná klička vytahuje zpět a vyrovnává se na tubusu endoskopu [13]. Toto se provádí vytvořením ohybu distálního konce přístroje na začátku přívodné kličky, který potom povytáhneme zpět, následně ohyb vyrovnáme a poté endoskop zavedeme hlouběji do přívodné kličky. Může být výhodou provádět tento manévr pod skiaskopickou kontrolou.
Další možností při obtížném zavádění endoskopu do přívodné kličky je ,,kanylace“ jejího ústí pomocí běžné ERCP kanyly (tuto možnost používáme na našem pracovišti nejčastěji) nebo zaváděcího systému biliární endoprotézy nebo bioptických kleští [14,15]. Endoskop se potom pokoušíme ,,vtlačit“ po tomto instrumentáriu jako po vodiči do přívodné kličky.
Další postup endoskopu přívodnoustřevní kličkou směrem k VP, která se nachází na vzdálenějším konci přívodné střevní kličky, se svou technikou částečně podobá kolonoskopii. Využívá se rotačních pohybů, zkracování kliček, sání a lze využít i sledování na RTG monitoru. Při tomto postupu endoskopu přívodnou kličkou směrem k VP může být dalším problematickým místem oblast duodenojejunální flexury (ligamentum Treitzi). Po jejím překonání již většinou nedělá větší problémy zavedení endoskopu z pars horizontalis duodeni, přes mírný oblouk do pars descendens duodena a do bulbu duodena, kde vidíme slepé zakončení celého duodena. Když potom endoskop mírně povytáhneme, identifikujeme VP několik centimetrů před slepým koncem duodena. Pohled na VP je zrcadlově obrácený oproti normální anatomii, takže plica longitudinalis směřuje dolů a papila minor je distálně vlevo. Postup k VP je ještě obtížnější při doplnění resekce podle B II o enteroenteroanastomózu, popřípadě u jiných modifikací. Dále pak postup přívodnou kličkou směrem k VP mohou též ztěžovat např. ostrý ohyb přívodné kličky, její přílišná délka, adheze.
Při vizualizaci situace na RTG monitoru míří odvodná střevní klička dolů do pánve a přívodná střevní klička vytváří po zkrácení tvar písmene J mířící do oblasti pravého hypochondria. Někdy může pomoci instilace RTG kontrastní látky kanylou dále do přívodné kličky, což může zobrazit anatomii kličky, zvláště když ostrý úhel ohybu brání dalšímu postupu endoskopu. Definitivním rozuzlením problému však bývá až nalezení VP nebo alespoň slepě uzavřeného duodena.
Zpočátku jsme se, stejně jako i jiní endoskopisté, domnívali, že k ERCP u B II lze použít endoskopů jak s prográdní, tak s laterální optikou a že rozhodující je vesměs individuální zkušenost.
Prográdní endoskop může být výhodnější v první fázi vyšetření, protože umožňuje lepší orientaci v oblasti GEA, detekci ústí přívodné kličky a posléze vstup do ní.
S postupem času však dáváme nejen my (a to na základě poměrně velkých osobních zkušeností), ale i na jiných pracovištích [14–17] přednost použití terapeutického lateroskopu. Jeho robustnost se vhodně uplatňuje při překonávání ohybů přívodné kličky [12]. Dále identifikuje lépe VP. Další významnou výhodou lateroskopu je možnost pozvednout kanylu i jiná instrumentária Albarranovým můstkem, a tím výrazně zvýšit kanylační efektivitu. Prográdní endoskop byl použit jen v malém procentu případů, a to vesměs až jako druhá možnost po selhání přístupu s lateroskopem.
Kanylace ústí VP a aplikace kontrastní látky do požadovaného vývodu (biliární a/nebo pankreatický vývodný systém) jsou další obtížné kroky při ERCP u pacientů po resekci žaludku dle B II [14]. VP se nachází několik centimetrů před slepým koncem přívodné střevní kličky a v důsledku předchozího resekčního výkonu je uložena zrcadlovitě obráceně oproti normální anatomické situaci. Suprapapilární úsek choledochu tedy směřuje z pohledu endoskopisty (při použití lateroskopu) doleva šikmo dolů [12], a nikoliv doleva šikmo vzhůru jako za normální anatomické situace.
Při kanylaci žlučového systému používáme pokud možno novou, doposud nepoužitou kanylu, která je tedy rovná a nemá obloukovité zahnutí ve své distální partii. Vhodný úhel při kanylaci často získáme povytažením endoskopu, takže kanylujeme na větší vzdálenost.
Kanylace pankreatického vývodu je snazší.
Dosažení požadovaného vývodného systému (stejně jako zavedení papilotomu) může usnadnit použití atraumatického vodicího drátu zaváděného přes kanylu.
Zřejmě v důsledku všech těchto těžkostí je kanylační úspěšnost při ERCP u B II pacientů udávaná v literatuře výrazně variabilní, a to v rozmezí 42–96%. Forbes dosáhl u 53 pacientů 60% kanylační úspěšnosti [18], Ricci u 72 nemocných 89% kanylační úspěšnosti [19], Wilkinson u 26 pacientů 42% kanylační úspěšnosti [20], Burlefinger u 24 pacientů 96% kanylační úspěšnosti [21], Costamagna u 175 pacientů 88% kanylační úspěšnosti [14], Špičák u 120 pacientů 84% kanylační úspěšnosti [21].
V našem souboru pacientů jsme dosáhli poměrně vysoké kanylační úspěšnosti, a to 90,2%, kdy jsme byli kanylačně úspěšní u 101 pacientů ze 112.
Při EPT u pacientů po resekci podle B II lze použít řady různých technik [14] a speciálních papilotomů. Hlavní problém spočívá v zrcadlovitě obráceném uložení VP. Technika EPT se mění v důsledku toho, že k VP v přívodné kličce přistupujeme zespodu.
Standardně zavedený klasický erlangenský papilotom u pacienta s normální anatomickou situací směřuje totiž řezným drátem na č. 12, tedy na opačnou stranu, než je žádoucí u B II.
Při použití standardní techniky EPT u B II pracujeme s tzv. ,,reverze loop“ papilotomy, které mají diatermické lanko v poloze 6 (oproti poloze 12 u klasických erlangenských papilotomů za normální anatomické situace).
Některé další techniky provedení EPT u B II jsou tyto:
- Někteří autoři doporučují užití jehlového nože k provedení ,,free hand“ řezu papilární stříšky [22]
- Další možností je pomocí jehlového nože vytvořit v oblasti podélné řasy suprapapilárně asi 10mm pod orificiem VP fistulu. Vzniklou choledochoduodenální komunikací zavedeme klasický pull type-papilotom a řez vedeme středem podélné řasy od komunikace k ústí VP standardní technikou jako za normální anatomické situace [23]. Tyto metody, ač ve zkušených rukách relativně jednoduché a efektivní, ne zcela splňují některá bezpečnostní kritéria EPT [14] akceptovaná pro pacienty s normální anatomií gastroduodena. Jedná se zejména o hlubokou selektivní kanylaci choledochu.
- Další způsob provedení EPT u B II je tento [19]: nejprve zavedeme do choledochu plastikovou duodenobiliární endoprotézu nebo nazobiliární drenáž, kdy biliární drén slouží jako vodič, který umožňuje následně provést incizi podélné řasy jehlovým nožem až na vlastní drén. Tímto způsobem bezpečně otevřeme celý intramurální úsek choledochu. Tento způsob má výhodu v kontrolovaném směru řezu, ale má však dvě nevýhody: 1. při použití nazobiliárního drénu vyvstává nutnost 2krát zavést endoskop a 2. při použití DB stentu jsou to přídatné manévry kvůli extrakci DB stentu z přívodné kličky, jakmile je EPT ukončena. Tento způsob EPT u B II byl poprvé popsán Riccim v roce 1989, velmi brzy získal značnou popularitu a je poměrně široce užíván.
- Již v roce 1976 Cremer et al [14] vyvinuli tzv. sigmoid shape sfincterotom s dlouhým nosem, kde dochází k rotaci řezného drátu do polohy 6, jakmile dojde k hluboké inserci papilotomu do choledochu a napnutí řezacího vlákna. Při opatrném povytahování zpět je potom patrné, jak se řezný drát papilotomu stáčí do správné polohy, tedy na číslo 6, k provedení EPT obvyklým způsobem. Později pak byly vyvinuty modifikované verze tohoto papilotomu [24–27]. Za zmínku stojí modifikace podle Costamagni, kdy tento papilotom má oproti původnímu Cremer-van Laethemovu papilotomu 2 výhody: 1. lepší, resp. preciznější rotaci řezného drátu směrem k číslu 6 a 2. možnost použití 0,035 atraumatického vodiče. Použití všech těchto výše uvedených modifikací Cremerova-van Laethenova papilotomu předpokládá hlubokou selektivní kanylaci choledochu jako jednu ze základních podmínek bezpečnému provedení EPT.
V našem souboru pacientů jsme k provádění EPT používali (kromě jehlového nože) v počátečním období Soehendrův papilotom pro B II a v pozdějším období pak výše popsaný Costamagnův papilotom. Dále jsme v řadě případů použili metodu podle Ricciho, která byla v předchozím textu rovněž podrobně popsána.
U všech 97 pacientů s patologickým ERCP nálezem v našem souboru byla bezprostředně po diagnostické ERCP zahájena endoskopická léčba, jejímž úvodním krokem byla vždy různě dlouhá EPT některým ze speciálních papilotomů. Z těchto 97 pacientů se podařilo provést suficientní papilotomii u poměrně vysokého počtu, a to u 92 (tedy u 94,8, přibližně 95% z 97 pacientů). U zbývajících 5 nemocných se podařilo provést pouze nekompletní EPT – resp. precut VP.
Ricci provedl EPT úspěšně u 64 ze 72 nemocných (88,9%) pomocí jehlového nože, když řez vedl podél biliárního drénu. Tento způsob provedení EPT byl výše podrobně popsán [19]. Burlefinger používal vesměs sigmoid shape sfincterotom a úspěšná papilotomie se mu zdařila u 23 z 24 nemocných (96%) [21].
Jak již bylo uvedeno výše, v našem souboru u všech 97 pacientů s patologickým nálezem na ERCP byla bezprostředně po diagnostické ERCP zahájena endoskopická léčba, která byla kompletně úspěšná u 83 nemocných z 97 (85,6% z 97).
Forbes s Cottonem dosahovali zpočátku jen 60% kanylačního úspěchu, který se zvýšil v posledních dvou letech, kdy endoskopická léčba byla úspěšná u 8 z 10 nemocných [18]. Costamagna dosáhl úspěšnosti terapeutické ERCP u 92,9% ze 172 pacientů, kdy používal téměř výlučně endoskopy s laterální optikou a z papilotomů sigmoid shape sfincterotom [14]. Špičák et al v letech 1993–1995 dosáhli 95% úspěšnosti terapeutické ERCP u 120 nemocných [21].
Lze říci, že komplikace po ERCP u pacientů po resekci žaludku dle B IIjsou specifickým problémem. Celkově zřejmě nejsou významnější než u normální anatomie. Častěji (3krát u Špičáka, 2krát u Costamagny, 1krát u Ricciho, 2krát u Villkinsona) však dochází k intestinální perforaci, a to nikoliv v oblasti VP, ale v blízkosti GEA a charakteristicky bez zjevné příčiny, jako jsou např. stenóza přívodné kličky či násilné zavádění endoskopu [20,28]. V našem souboru nemocných máme stejnou zkušenost, kdy se u 1 pacienta z 97, kteří prodělali endoskopickou léčbu (1,03% z 97) se vyskytla intestinální perforace na začátku přívodné kličky, bez zjevné příčiny. Základním vyšetřením k vyloučení perforačních komplikací endoskopického vyšetření gastrointestinálního traktu je průkaz pneumoperitonea na RTG, event. CT vyšetření [29].
Dále lze říci, že výskyt komplikací po terapeutické ERCP v našem souboru nebyl vysoký. Mírné krvácení po EPT se vyskytlo u 2 pacientů z 97 (2,06% z 97). V literatuře je udáván výskyt této nejfrekventovanější časné komplikace po EPT ve 2,5% [30,31].
Dále se u 2 pacientů z 97 (2,06% z 97) vyskytla mírná akutní pankreatitida po EPT, která byla vždy zvládnuta konzervativně. Lehká forma akutní pankreatitidy se vyskytuje u 5% nemocných po diagnostické ERCP. Počítáme li pouze těžkou formu nemoci, poklesne incidence pod 1% u diagnostické ERCP a 2% po EPT [32].
Lze říci, že v naší studii pacientů po resekci žaludku dle B II jsme dosáhli poměrně vysoké úspěšnosti diagnostické i terapeutické ERCP, a to při relativně nízkém procentu komplikací terapeutické ERCP. Jak již bylo výše uvedeno, naše výsledky jsou srovnatelné s předními našimi i zahraničními endoskopickými pracovišti, která se danou problematikou zabývají [14,19,21].
Závěr
ERCP po resekci žaludku podle Billrotha II je v důsledku odlišné pooperační anatomie oproti standardnímu výkonu podstatně náročnější. Úspěch diagnostické a především terapeutické ERCP je zde podmíněn dostatkem variabilního příslušenství a dále samozřejmě velkou osobní zkušeností a zručností endoskopisty. Lege artis prováděná ERCP u pacientů po resekci žaludku podle Billrotha II je vysoce efektivní a bezpečná metoda v diagnostice a zejména léčbě pankreatobiliárních onemocnění, kde kvalifikovaný endoskopický tým dosahuje téměř stejné úspěšnosti jako za normální anatomické situace.
MUDr. Bohuslav Kianička, Ph.D.
www.fnusa.cz
e mail: bohuslav.kianicka@fnusa.cz
Zdroje
1. Vavrečka A et al. Diagnostická a liečebná endoskopia žlčových ciest a pankreasu. Bratislava: Osveta 1988.
2. Urban O, Chalupa J. Cysta choledochu. Vnitř Lék 1996; 42 : 418 – 419.
3. Keil R, Lochmannová J, Námešný I et al. Řešení benigních stenóz žlučových cest. Miniinvazivní terapie 1998; 3 : 33 – 35.
4. Keil R. Akutní biliární pankreatitida – endoskopická terapie ano nebo ne? Vnitř Lék 2002; 48 : 847 – 850.
5. Zbořil V, Cigánková E, Studeník P et al. ERCP v diagnostice a terapii komplikací jaterních transplantací. Čes Slov Gastroent Hepatol 1999; 53 : 47 – 50.
6. Procházka V, Konečný M, Král V at al. CRCP v diagnostice a léčbě biliárních komplikací laparoskopické cholecystektomie. Čes Slov Gastroent Hepatol 1999; 53 : 140 – 144.
7. Jurgoš L, Kužela L, Hrušovský Š et al. Gastroenterológia. Bratislava: Veda 2006.
8. Novotný I. Pankreatobiliární terapeutická endoskopie u pacientů geriatrického věku. Čes Ger Rev 2007; 5 : 78 – 84.
9. Paseka T, Veverková L, Diviš P et al. Mirizziho syndrom s cholecystoduodenální píštělí – vzácná komplikace cholecystolitiázy. Čas Lék Čes 2009; 148 : 164 – 167.
10. Vlček P, Korbička J, Žák J. Kýly. In: Pafko Pet al (eds). Základy speciální chirurgie. Praha: Galén 2008.
11. Kala Z, Kiss I, Válek V et al. Nádory podjaterní oblasti – diagnostika a léčba. Praha: Grada 2009.
12. Špičák J, Dufek V, Jirásek V et al. ERCP a terapeutická endoskopie po resekci žaludku podle Billrotha II. Endoskopie 1993; 2 : 3 – 5.
13. Aabakken L, Osnes M, Rosseland A et al. Gastrointestinálna endoskopia. Praha: Maxdorf Jessenius 1999.
14. Costamagna G, Mutignani M, Perri V et al. Diagnostic and therapeutic ERCP in patients with Billroth II gastrectomy. Acta Gastroenterol Belg 1994; 57 : 155 – 162.
15. Aabakken L, Holthe B, Sandstad O et al. Endoscopic pancreaticobiliary procedures in patients with a Billroth II resection: a 10 – ear follow‑up study. Ital J Gastroenterol Hepatol 1998; 30 : 301 – 305.
16. Hintze RE, Adler A, Veltzke W et al. Endoscopic access to the papilla of Vater for endoscopic retrograde cholangiopancreatography in patients with Billroth II or Roux-en - Y gastrojejunostomy. Endoscopy 1997; 29 : 69 – 73.
17. Demarquay JF, Dumas R, Buckley MJ et al. Endoscopic retrograde cholangiopancreatography in patients with Billroth II gastrectomy. Ital J Gastroenterol Hepatol 1998; 30 : 297 – 300.
18. Forbes A, Cotton PB. ERCP and sphincterotomy after Billroth II gastrectomy. Gut 1984; 25 : 971 – 974.
19. Ricci E, Bertoni G, Conigliaro R et al. Endoscopic sphincterotomy in Billroth II patients: an improved method using a diathermic needle as sphincterotome and a nasobiliary drainage as a guide. Gastrointest Endosc 1989; 35 : 47 – 50.
20. Wilkinson ML, Engelman JL, Hanson PJ. Intestinal perforation after ERCP in Billroth II partial gastrectomy. Gastrointest Endosc 1994; 40 : 389 – 390.
21. Zavoral M, Dítě, P, Špičák J et al. Nové trendy v digestivní endoskopické diagnostice a léčbě. Praha: Grada Publishing 2000.
22. Huibregtse K. Difficult cannulation in Billroth II gastrectomy patients. In: Endoscopic biliary and pancreatic drainage. Stuttgart - New York: Thieme Verlag 1988 : 54 – 58.
23. Rosseland A, Osnes M, Krause A. Endoscopic sphincterotomy (EST) in patients with Billroth II gastrectomy. Endoscopy 1981; 13 : 19 – 24.
24. Osnes M, Rosseland A, Aabakken L. Endoscopic retrograde cholangiography and endoscopic papillotomy in patients with a previous Billroth II resection. Gut 1986; 27 : 1193 – 1198.
25. Wang YG, Binmoeller KF, Seifert H et al. A new guide wire papillotome for patients with a previous Billroth II gastrectomy. Endoscopy 1996; 28 : 254 – 255.
26. Hintze RE, Veltzke W, Adler A et al. Endoscopic sphincterotomy using an S - shaped sphincterotome in patients with a Billroth II or Roux - en - Y gastrojejunostomy. Endoscopy 1997; 29 : 74 – 78.
27. Costamagna G, Mutignani M, Gabbrielli A et al. Endoscopic sphincterotomy in patients with Billroth II gastrectomy: improvements with a new inverted sphincterotome (abstract). Gastroenterology 1993; 104: A357.
28. Cuningham JT. Endoscopic papillotomy and stent insertion: B II technique and limitations. In: Barkin J, Opelhan C (eds). Advanced therapeutic endoscopy. New York: Raven Press 1990 : 193 – 200.
29. Korbička J, Čapov I, Vlček P. Pneumoperitoneum bez perforace trávicího ústrojí. Rozhledy v chirurgii 2002; 81 : 364 – 371.
30. Zavoral M. Komplikace endoskopické papilotomie. Endoskopie 1995; 4 : 25 – 28.
31. Novotný I. Krvácení z Vaterovej papily. Gastroenterológia pre prax 2005; 4 : 13 – 16.
32. Frič P, Ryska M. Digestivní endoskopie a laparoskopická chirurgie. Praha: Praha Publishing 1996.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



