-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
Transrectal high-intensity focused ultrasound for the treatment of localized prostate cancer
Over the past 25 years, the average life expectancy for men has increased by four years, and the age of prostate cancer detection has decreased an average of 10 years with diagnosis increasingly made at early‑stage disease where curative therapy is possible. These changing trends in the age and extent of malignancy at diagnosis have revealed limitations in conventional curative therapies for prostate cancer, including a significant risk of aggressive cancer recurrence, and the risk of long‑term genitourinary morbidity and its detrimental impact on patient quality of life (QoL). Greater awareness of the shortcomings in radical prostatectomy, external radiotherapy and brachytherapy have prompted the search for alternative curative therapies that offer comparable rates of cancer control and less treatment‑related morbidity to better preserve QoL. High‑intensity focused ultrasound (HIFU) possesses characteristics that make it an attractive curative therapy option. HIFU is a non‑invasive approach that uses precisely ‑ delivered ultrasound energy to achieve tumor cell necrosis without radiation or surgical excision. In current urological oncology, HIFU is used clinically in the treatment of prostate cancer, and is under experimental investigation for therapeutic use in renal and breast malignancies. Clinical research on HIFU therapy for localized prostate cancer began in the 1990s, and there have now been approximately 30,000 prostate cancer patients treated with HIFU, predominantly with the Ablatherm (EDAP TMS, Lyon, France) device. Transurethral resection of the prostate has been combined with HIFU since 2000 to reduce prostate size, facilitate tissue destruction, and to minimize side effects. Advances in imaging technologies are expected to further improve the already superior efficacy and morbidity outcomes, and ongoing investigation of HIFU as a focal therapy and in salvage and palliative indications are serving to expand the role of HIFU as a highly versatile non‑invasive therapy for prostate cancer.
Key words:
high-intensity focused ultrasound, prostate cancer, non-invasive, focal therapy, resistant to hormonal therapy
Autoři: S. Thüroff; C. G. Chaussy
Vyšlo v časopise: Urol List 2014; 12(2): 6-18
Souhrn
V uplynulých 25 letech se průměrná očekávaná délka života mužů prodloužila o čtyři roky, zatímco věk, kdy je u muže detekován karcinom prostaty, se snížil průměrně o deset let. Onemocnění je navíc stále častěji diagnostikováno v časném stadiu, kdy je stále možná kurativní léčba. Tyto změny ve věku a rozsahu maligního onemocnění v době diagnostikování poukázaly na limitace běžných terapeutických modalit pro léčbu karcinomu prostaty s kurativním záměrem, jako jsou např. významné riziko recidivy agresivního karcinomu nebo riziko dlouhodobé morbidity v močopohlavním systému a jejich významný dopad na kvalitu života pacienta (QoL). Větší povědomí o limitacích radikální prostatektomie, ozařování zevním paprskem i brachyterapie podnítilo vývoj alternativních terapií s kurativním záměrem, které by poskytovaly srovnatelnou kontrolu karcinomu při menší morbiditě, což by umožnilo lépe zachovat QoL. Cílený ultrazvuk o vysoké intenzitě (HIFU) disponuje vlastnostmi, které jej řadí mezi atraktivní kurativní terapeutické modality. HIFU je neinvazivní technika, při níž je pomocí přesně cílené ultrazvukové energie dosaženo nekrózy nádorových buněk bez nutnosti provádět ozařování nebo operační excizi. V současné době se v urologické onkologii HIFU využívá při léčbě karcinomu prostaty a v experimentálním stadiu probíhá testování tohoto přístupu u pacientů s karcinomy ledviny a prsu. Klinický výzkum v oblasti využití HIFU pro léčbu lokalizovaného karcinomu prostaty byl zahájen v 90. letech minulého století a v současné době již tuto léčbu podstoupilo přibližně 30 000 pacientů s karcinomem prostaty, ve většině případů pomocí zařízení Ablatherm (EDAP TMS, Lyon, Francie). Od roku 2000 se užívá kombinace transuretrální resekce prostaty a HIFU s cílem redukovat velikost prostaty, usnadnit destrukci tkáně a minimalizovat výskyt vedlejších účinků. Předpokládá se, že zdokonalení zobrazovacích technologií povede k dalšímu zlepšení vynikajících výsledků v oblasti účinnosti a bezpečnosti léčby. Probíhající výzkum testující využití HIFU v rámci fokální, záchranné i paliativní terapie pomůže rozšířit indikace HIFU jako univerzální neinvazivní modality pro léčbu karcinomu prostaty.
Klíčová slova:
cílený ultrazvuk o vysoké intenzitě, karcinom prostaty, neinvazivní, cílená terapie, rezistentní na hormonální léčbuHistorie HIFU
Ačkoli již ve 30. letech minulého století bylo známo, že pomocí cíleného ultrazvuku o vysoké intenzitě (high-intensity focused ultrasound – HIFU) lze docílit destrukce tkáně, klinické využití této metody brzdila absence zobrazovací technologie, pomocí níž by bylo možné výkon monitorovat [1]. Pilotní výzkumy využití HIFU v urologii byly zahájeny v 80. letech (zejména ve Francii a USA), kdy již počítačové technologie poskytovaly možnosti pro kontrolu a řízení tohoto fascinujícího zdroje energie. V tomto období byly vyvinuty první klinické prototypy zařízení pro urologické indikace.
Na počátku 90. let byla technologie HIFU testována v klinických studiích jak v Evropě, tak Japonsku a USA jako modalita pro léčbu benigní prostatické hyperplazie. Bylo prokázáno, že díky precizní destrukci tkáně je technika HIFU účinná a bezpečná. Dále bylo zjištěno, že léčba spouští významný proces redukce cílového orgánu, ale rovněž je spojena s výskytem vedlejších účinků. HIFU způsoboval destrukci tkáně nezbytnou pro léčbu karcinomu, tato technika však nebyla účinná při léčbě infravezikální obstrukce, protože v důsledku smršťování tkáně a vzniku nekrotické tkáně se obstrukce naopak zhoršovala. První klinické studie testující účinek HIFU při léčbě karcinomu prostaty v polovině/ na konci 90. let prokázaly souvislost mezi koagulovaným objemem prostatické tkáně (při HIFU) a vznikem obstrukce. Analýza prospektivních studií prokázala vysokou míru výskytu močové infekce v nekrotické tkáni. Vzhledem k prokázané souvislosti mezi HIFU a vznikem obstrukce a v souladu s koncepcí léčby celé prostatické žlázy se od roku 2000 HIFU provádí běžně v kombinaci s adjuvantní transuretrální resekcí prostaty (transurethral resection of the prostate – TURP) [2,3]. Tato kombinace umožňuje zmenšit objem tumoru a současně radikálně resekovat střední lalok prostaty, kalcifikace, abscesy a hrdlo močového měchýře [4].
Pro léčbu pomocí HIFU je v současné době nezbytné následující vybavení: počítačová technika, speciální software, jednotka pro transrektální ultrazvuk a magnetickou rezonanci (MRI), která je nezbytná pro monitorování výkonu v reálném čase. Využití HIFU bylo rozšířeno o další indikace jako např. extrakorporální neinvazivní koagulační destrukce tkáně bez nutnosti provádět otevřenou operaci. Díky rostoucím klinickým zkušenostem a publikacím zabývajícím se technikou HIFU se rozšiřují možnosti validace a přijetí této terapeutické modality. Zatím máme k dispozici pouze výsledky léčby po pěti letech [5,6]. Výsledky týkající se dlouhodobé kontroly karcinomu u pacientů sledovaných po dobu deseti let budou teprve publikovány.
Mechanizmus účinku a technologie HIFU
Mechanizmus účinku HIFU
Užití HIFU při destrukci lokální tkáně jako první popsali Lynn a Putman v roce 1944 [7]. Aplikace ultrazvukových vln fokusovaných parabolickým zrcadlem vyvolává mechanické alterace a změny v biologické struktuře cílených buněk (schéma 1) [1]. Terapeutický efekt aplikace cílených ultrazvukových vln mají na svědomí dva různé fyzikální mechanizmy: tepelný a mechanický.
Schéma 1. Fyzikální princip cílené aplikace energie. 
Tepelný účinek
HIFU vytváří ultrazvukovou energii, která je pohlcována cílovou tkání a přeměněna na tepelnou energii. Rozsah zvýšení teploty ve tkáni závisí na jejím absorpčním koeficientu a rovněž na velikosti, tvaru a tepelné senzitivitě zahřívané oblasti [1]. Biologické změny, k nimž dochází v důsledku zahřívání, jsou podmíněny teplotou a délkou působení tepelné energie. „Tepelná dávka“ přesahující určitou teplotní hranici způsobuje koagulaci tkáně a v důsledku koagulační nekrózy vyvolává nezvratné změny ve tkáni [8]. Aplikace cílených ultrazvukových vln způsobí prudký nárůst teploty během několika sekund (přibližně 70 – 100 °C). Okolní citlivé struktury (jako např. rektum, zevní svěrač, neurovaskulární svazky) nepodléhají během HIFU destrukci díky strmému teplotnímu gradientu mezi cílenou tkání a okolím [8,9].
Mechanický účinek
Mechanický účinek HIFU spočívá v působení negativního tlaku ultrazvukových vln na cílenou tkáň [1]. Negativní tlak způsobuje v cílených buňkách vznik bublin, které se zvětšují, dokud není dosaženo rezonance. Při náhlém kolapsu těchto bublin vzniká vysoký tlak až 20 000 – 30 000 barů, který má na svědomí poškození okolních buněk a kavitační efekt ve tkáni, v důsledku něhož dochází k narušování buněčných membrán [10]. Primární léze mají malou velikost (1,7 × 19 – 26 mm) a vedou k ostře vyhraničené ablaci tkáně reprodukovatelného objemu [9]. Malý kousek tkáně zničený při jediném zásahu ultrazvukovou vlnou se označuje jako elementární nebo primární léze. Při vytváření větších lézí se vytvoří několik elementárních lézí vedle sebe (algoritmus je naprogramován na mnohočetné léze (schéma 2a,2b)) a mechanicky se pohybuje sondou nebo se elektronicky nastaví ohnisko, pokud máme k dispozici soustavu s fázovým řízením (phased array) [8,11 – 15].
Schéma 2a. Mód aplikace energie do nekolika lézí. Schéma 2b.Volume koagulace (algoritmus pro pohyb vysílace). 
Experimentální identifikace klinických parametrů
Byla provedena řada studií in vitro, in vivo i počítačových simulací s cílem identifikovat a vylepšit parametry ultrazvukových vln pro klinickou léčbu onemocnění prostaty. Studie popisující destrukci tumorů pomocí HIFU poskytují důkazy o tom, že HIFU umožňuje zničit nádorovou tkáň, aniž by došlo ke vzniku metastáz [16], a že prostatickou tkáň lze účinně cílit pomocí transrektální aplikace HIFU [17,18].
Základní klinické parametry HIFU
Cílené ultrazvukové vlny o vysoké intenzitě lze aplikovat v pulzním nebo kontinuálním režimu [19]. Kontinuální vlnění zahrnuje solární vlny, mikrovlny a radarové technologie, zatímco pulzní HIFU se využívá v lékařství a v rámci extrakorporální litotrypse rázovou vlnou. Vysokofrekvenční vibrace (0,5 – 10 MHz) piezoelektrické nebo piezokeramické sondy generují ultrazvukové vlny, které jsou cíleny do ohniska díky svému konkávnímu nebo parabolickému uspořádání [10].
Základní parametry HIFU pro lékařské účely zahrnují: 1. frekvenci ultrazvukových vln (MHz); 2. akustickou intenzitu (W); 3. délku aplikace (shot ‑ time); 4. délku intervalu mezi jednotlivými pulzy (delay ‑ time); 5. laterální vzdálenost mezi elementárními lézemi; 6. longitudinální vychýlení zdroje energie při cílení vícečetných lézí a 7. hloubku penetrace, jež závisí na designu aplikátoru [1].
Všechny výše uvedené technické parametry jsou nezbytné při sestavování HIFU systému určeného pro léčbu specifických tkání. HIFU vyžaduje celou řadu složitých rozhodnutí technického rázu, jako jsou např. volba typu a designu piezoelektrického aplikátoru, nastavení parametrů ultrazvukových vln pro léčbu (MHz, W), algoritmus pro aplikaci vln (tj. poměr mezi pulzy a pauzami), zobrazovací systém, zajištění pooperačních bezpečnostních opatření, lokalizace cílových tkání během vyšetření transrektální ultrazvukovou sondou (TRUS) nebo MRI [1].
Ultrazvuková sonda má následující parametry: frekvenci vysílání, geometrické a fyzikální rozměry. Užívání piezoelektrických systémů poskytuje dostatečnou energetickou denzitu, reprodukovatelnost a dlouhodobou stabilitu v souladu s požadavky na léčbu, což umožňuje produkovat geometrické tvary odpovídající měnícím se anatomickým potřebám [13]. V současné urologické praxi se užívají HIFU sondy s fixním, ovšem modifikovatelným ohniskem, které je však nutné při léčbě tkání o větším objemu mechanicky přesouvat (obr. 1) [14,15].
Obr. 1. Ruzné HIFU sondy pro systémy Sonablate<sup>®</sup> a Ablatherm<sup>®</sup>. 
Komerčně dostupné HIFU systémy pro léčbu karcinomu prostaty
Od roku 2011 jsou pro léčbu karcinomu prostaty k dispozici dvě transrektální HIFU zařízení: Ablatherm® (EDAP TMS, Lyon, Francie) a Sonablate® (Misonix, Inc., Farmingdale, NY) (obr. 2). Ačkoli ani jedno zařízení zatím nebylo schváleno Úřadem pro kontrolu potravin a léčiv pro americký trh (FDA), je pravděpodobné, že po uveřejnění výsledků prospektivní studie udělí FDA povolení pro zařízení Ablatherm® [1]. Obě zařízení se liší celou řadou parametrů, což znemožňuje souhrnně analyzovat výsledky léčby pomocí obou zařízení. Vzhledem k tomu, že naprostá většina publikací zabývajících se využitím HIFU pro léčbu karcinomu prostaty pojednává o zařízení Ablatherm®, zahrnuje náš přehled výhradně studie testující toto zařízení.
Obr. 2. Dve komercne dostupná zarízení pro transrektální HIFU: Sonablate<sup>®</sup> a Ablatherm<sup>®</sup>. 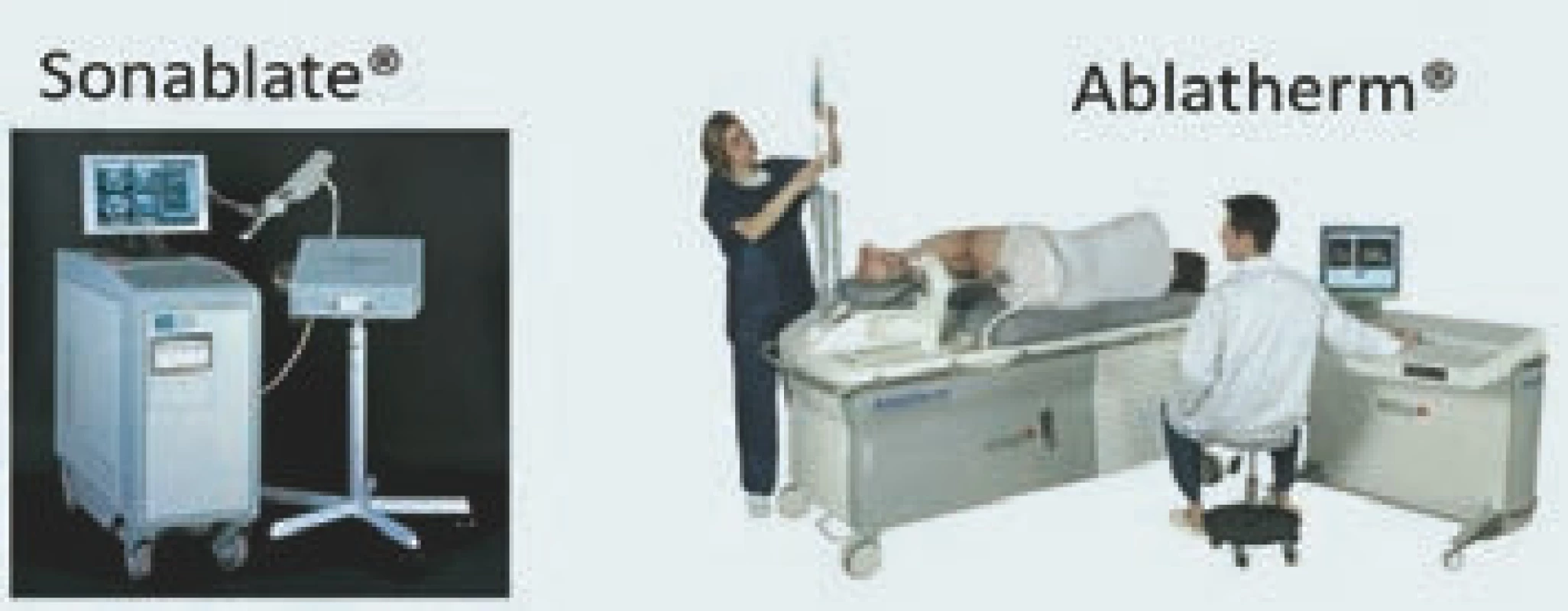
Při hodnocení rychle se vyvíjejících technologií, jakou je např. HIFU, stojí za to zohlednit vedle recenzovaných publikací a odborných prezentací rovněž zkušenosti předávané pouze ústní komunikací. Výbor Cancer Committee Francouzské urologické asociace uvádí přehled příslušných zkušeností týkajících se HIFU [20].
Ablatherm®
Systém Ablatherm® tvoří modul zahrnující lůžko pro pacienta, systém pro navigaci sondy, generátor ultrazvukové energie, chladicí zařízení pro ochranu rektální stěny a ultrazvukový scaner, který se užívá při lokalizaci. Systém rovněž obsahuje endorektální sondu pro zobrazování i samotnou léčbu, která je tvořena biplanární zobrazovací sondou (při 7,5 MHz) se snímačem (při 3 MHz) [21].
Systém obsahuje několik bezpečnostních opatření, jako je bezpečnostní prstenec pro stabilizaci rektální stěny při pohybu sondy, zařízení pro permanentní kontrolu vzdálenosti mezi vysílačem a rektální stěnou a detektor pohybů pacienta, který léčbu pozastaví, pokud se pacient během aplikace vlny pohne [21].
Parametry jsou nastaveny tak, aby byla vytvořena léze adekvátní velikosti, aniž by došlo k zasažení rektální stěny a okolních tkání (schéma 3a,3b). Velikost elementárních lézí se pohybuje v rozmezí 19 – 24 mm (na délku) a 1,7 mm v průměru. Vzhledem k tomu, že tvar léze se odvíjí od perfuze prostatické žlázy, parametry se u individuálních pacientů liší: 5sekundový pulz s 5sekundovým intervalem mezi dávkami při prvním cyklu HIFU v rámci primární terapie, 4,5sekundový pulz s 5sekundovým intervalem mezi dávkami při druhém cyklu HIFU v rámci primární terapie a 4sekundový pulz se 7sekundovým intervalem mezi dávkami při léčbě lokální recidivy po ozařování zevním paprskem [21].
Schéma 3a. Modifikace ohniska: hloubka penetrace (19–26 mm). 
Schéma 3b. Modifikace ohniska: laterolongitudinálne (1,7 mm). 
Léčba pomocí HIFU se provádí v rámci jednoho sezení ve spinální anestezii a trvá 2 – 3 hod. Pacient je umístěn v poloze na boku. Endorektální sonda obsahující obloukový piezoelektrický krystal a TRUS se umístí do latexového balonku, který je naplněn chladicí kapalinou, a zavede se do rekta. Tato sonda soustředí ultrazvukové vlny do ohniska. Operatér vymezí cílový objem a léčba probíhá od apexu po bázi prostaty (obr. 3). Při léčbě celé prostaty je obvykle cílový objem aplikován ve 4 – 8 po sobě jdoucích cyklech. Po ukončení terapie je zaveden Foleyho katetr nebo epicystostomie [21].
Obr. 3. Peroperačně: trojrozměrný, transrektální ultrazvuk v reálném čase pro vizuální plánování léčby a kontrolu na kontrolním monitoru. 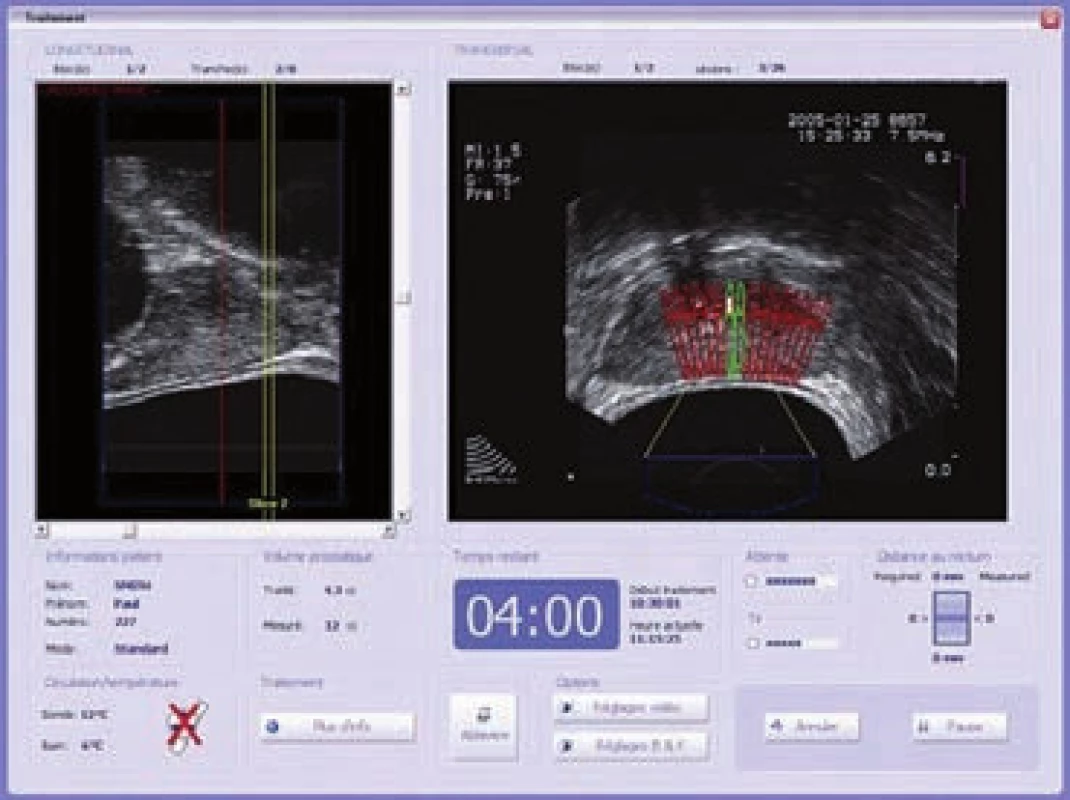
Sonablate®
Na rozdíl od systému Ablatherm® není zařízení Sonablate® vybaveno vlastním jednoúčelovým lůžkem. K dispozici je několik sond, operatér zvolí vhodnou sondu na základě velikosti požadované elementární léze: elementární léze o velikosti 10 × 2 mm pro jeden paprsek je dosaženo pomocí sondy s ohniskovou vzdáleností 25 nebo 45 mm; léze o velikosti 10 × 3 mm pro rozptýlený paprsek s ohniskovou vzdáleností 30, 35 nebo 40 mm [22]. Konkrétní parametry se rovněž mohou lišit na základě preferencí operatéra.
Pacient je uveden do polohy na zádech a léčba probíhá v celkové anestezii. Volba sondy závisí na velikosti prostaty, větší prostata vyžaduje větší ohniskovou vzdálenost. Léčba obvykle probíhá ve třech po sobě jdoucích koronárních vrstvách, sonda je navigována od přední části prostaty směrem k její zadní části. Během výkonu je sonda alespoň jedenkrát přepnuta [22].
Hodnocení účinku HIFU na prostatickou tkáň
Histologický efekt
Klinický potenciál HIFU při léčbě karcinomu prostaty byl prokázán v klinické studii, v níž pacienti podstoupili HIFU 1 – 2 týdny před radikální prostatektomií. Odstraněná prostata byla následně odeslána na histologické vyšetření. HIFU byl cílen do oblastí, ve kterých biopsie prokázala přítomnost karcinomu. Při histologickém vyšetření bylo identifikováno ostře ohraničené rozhraní mezi oblastmi, které byly léčeny pomocí HIFU, a neléčenými oblastmi, ve všech vzorcích byla přítomna kompletní nekróza [23]. MRI s aplikací gadolinia prokázala rozsah poškození tkáně, k němuž došlo při HIFU. Léčené oblasti se zobrazovaly jako nekontrastní hypointenzivní oblasti obklopené periferním kontrastním okrajem o tloušťce 3 – 8 mm. Tyto abnormality odpovídaly jádru koagulační nekrózy obklopené periferní zónou se zánětem. Tyto léčbou vyvolané abnormality viditelné na MRI zobrazení obvykle vymizí během 3 – 5 měsíců dostředivým směrem a kontrakce tkáně vyvolaná HIFU vede po šesti měsících ke zmenšení prostaty přibližně o 5 cm [24].
Klinické využití zobrazovacího vyšetření
MRI představuje standardní metodu pro hodnocení účinnosti léčby pomocí HIFU. Rozsah nekrózy je jasně zobrazen pomocí MRI s aplikací kontrastní látky obsahující gadolinium (T1 vážené obrazy) jako hyposignální ložisko [25]. MRI se užívá rovněž pro navigaci během HIFU [25,26] vzhledem k tomu, že umožňuje monitorovat změny teploty tkáně [25]. Jako další modalita pro hodnocení efektu tepelné ablace (prostřednictvím měření mechanických parametrů léze) byla navrhována magnetická rezonanční elastografie [26]. Zatím není známo, zda elastografické změny souvisejí s dlouhodobou destrukcí tkáně nebo nikoli a zda odrážejí kompletní koagulaci tkáně na buněčné úrovni [27]. Léze vzniklé v důsledku HIFU lze zobrazit pomocí standardního ultrazvukového vyšetření jako hyperechogenní oblasti; skutečný rozsah destrukce primární léze však není možné přesně definovat vzhledem k nejrůznějším rušivým vlivům u jednotlivých pacientů: odraz HIFU (prostatická kapsula, kalcifikace, katetry); absorpce (neléčená nebo již léčená tkáň); a ochlazení (krevní cévy, tekutina v intraprostatické dutině vzniklé po TURP) [28]. Pro přesnější popis rozsahu lézí vzniklých při HIFU [30] jsou doporučovány techniky na bázi ultrazvukového zobrazení, dopplerovský ultrazvuk s aplikací kontrastní látky [29] a měření akustických vlastností tkání [30]. Patnáct let klinických zkušeností s léčbou karcinomu prostaty pomocí HIFU ukazuje, že transrektální ultrazvuková sonda představuje bezpečnou a reprodukovatelnou metodu aplikace dokonce i bez možnosti měření teploty v reálném čase. Technologie umožňující měření v reálném čase kompenzující výše uváděné limitace vizualizace tkání by pomohla optimalizovat účinnost ablace [1].
Indikace pro léčbu karcinomu prostaty pomocí HIFU
Nejrozšířenější indikaci (a zpočátku rovněž jedinou) představuje léčba lokalizovaného karcinomu prostaty (T1 – 2N0M0; Gleasonovo skóre ≤ 6) u pacientů, kteří nejsou vhodnými kandidáty pro operaci z důvodu vyššího věku, celkového zdravotního stavu, komorbiditám nebo vlastnímu požadavku nepodstupovat radikální prostatektomii [1]. Spolu s narůstajícími klinickými zkušenostmi a rozšířením výzkumných protokolů se však indikace pro HIFU rozšířily o parciální terapii u pacientů s unilaterálními tumory o malém objemu a s nízkým Gleasonovým skóre (GS) (T1 – 2aNx/ 0M0; PSA ≤ 20 ng/ ml); záchrannou terapii u pacientů s recidivujícím karcinomem prostaty po radikální prostatektomii, radioterapii nebo hormonální ablaci (všechny TNx/ 0M0; všechna GS/ PSA) [31]; léčbu pokročilého karcinomu prostaty v rámci doplňkové neoadjuvantní metody pro zmenšení objemu tumoru (T3 – 4Nx/ 0M0; všechna GS/ PSA) [32]; a léčbu karcinomu prostaty rezistentního na hormonální léčbu (HRPCa). Na rozdíl od radioterapie lze HIFU indikovat rovněž u pacientů se středním a vysokým rizikem. Ve většině studií byla terapie pomocí HIFU indikována u všech výše zmiňovaných skupin s přijatelnými výsledky [33,34], ale stejně jako tomu je u všech kurativních terapií, u pacientů s vysokým rizikem dosahuje terapie menšího úspěchu než u pacientů s nízkým rizikem. Společné kontraindikace pro obě zařízení zahrnují absenci rekta nebo rektum o malé velikosti a poškozenou rektální stěnu z předchozích operací prostaty/ rekta [1].
Diagnostika karcinomu prostaty je založena na histopatologickém vyšetření vzorku biopsie v případě podezřelého výsledku PSA, digitálním rektálním vyšetření, zobrazovacím vyšetření MRI, TRUS nebo neočekávaném nálezu ve tkáni resekované při otevřené adenomektomii, transuretrální resekci nebo resekci pomocí holmium laseru [35].
Kombinace transuretrální resekce prostaty a HIFU
Kombinace TURP a HIFU je od roku 2000 běžnou praxí. TURP pomáhá redukovat odlučování tkáně po HIFU a případný vznik obstrukce a poskytuje několik dalších výhod oproti samotné HIFU. Provedení TURP před HIFU u pacientů s lokalizovaným karcinomem prostaty umožňuje okamžité odstranění jakýchkoli kalcifikací v přechodové zóně prostaty, které by znemožňovaly provedení HIFU, a rovněž abscesů, intravezikálně prominujících středních laloků a velkých (> 40 ml) adenomů [1]. Vytvoření kavity a její následná komprese rektálním balonkem zlepšuje přístup vln generovaných při HIFU do zbývající části žlázy (schéma 4), fixuje zbývající část prostaty za symfýzou, zabraňuje pohybovým artefaktům a umožňuje kompletní léčbu periferní zóny během jediného cyklu HIFU. HIFU systémy penetrují do hloubky 26 – 28 mm, a bez provedení TURP tak větší žlázy (> 30 ml) představují kontraindikaci pro HIFU. Při TURP dochází ke zmenšení velikosti prostatické žlázy na přibližně 25 ml, což eliminuje omezení velikosti, které klade léčba pomocí HIFU [2,36].
Schéma 4. Komprese a retropubická fixace prostaty po transuretrální resekci. 
Účinnost HIFU v rámci primární terapie
Účinnost při léčbě lokalizovaného onemocnění
Podobně jako ve studiích testujících účinnost ozařování zevním paprskem, brachyterapii a kryoablaci se při hodnocení dlouhodobé kontroly karcinomu po HIFU užívají rovněž biochemické markery a výsledky biopsie. Dosud nebyla stanovena žádná univerzální definice biochemického selhání u pacientů léčených pomocí HIFU [1]. Díky neustálým modifikacím techniky a způsobu měření výsledků se účinnost HIFU při léčbě karcinomu prostaty nalézá mezi radioterapií a radikální prostatektomií, u nichž se podle databáze CaPSURE uvádí po 10 letech 63% míra selhání (po radioterapii) a 30% míra selhání (po RP). V případě selhání dochází po záchranné terapii po obou klasických terapiích k sekundární recidivě průměrně po 34 měsících (po radioterapii) a po 38 měsících (po RP) [37]. Po selhání HIFU je možné HIFU opakovat, pro účely záchranné terapie jsou k dispozici radioterapie nebo ADT. Po selhání RP/ radioterapie jsou záchrannou modalitou HIFU nebo ADT.
V časných studiích, které hodnotí účinnost HIFU, je úplná odpověď definována jako negativní výsledek při kontrolní biopsii a PSA nadir < 4,0 ng/ ml [38,39]. Gelet et al použili přísnější kritéria pro selhání léčby: pozitivní výsledek biopsie nebo tři po sobě se vyskytující zvýšení hladiny PSA a velocita PSA ≥ 0,75 ng/ ml/ rok [40]. Guidelines Francouzské urologické asociace z roku 2005 uvádějí, že provedení biopsie je nutné v případě tří po sobě se vyskytujících zvýšení hladiny PSA v průběhu tří měsíců, ovšem nikoli v případě, že je nadir PSA < 1,0 ng/ ml [41]. Definice společnosti ASTRO (The American Society for Therapeutic Radiology and Oncology) pro stav bez onemocnění na základě biochemického výsledku byla aplikována i pro účely HIFU. Biochemická recidiva byla definována jako tři po sobě se vyskytující zvýšení PSA po dosažení nadir, kdy datum biochemické recidivy bylo přesně v polovině intervalu mezi datem dosažení nadir a prvním zvýšením PSA nebo jakýmkoli dostatečně významným zvýšením PSA, které by bylo impulzem pro zahájení záchranné terapie [34]. Tato definice byla následně modifikována a označena jako definice Phoenix – selhání se rovná době, kdy hodnota PSA > nadir + 2,0 ng/ ml. Několik studií zabývajících se HIFU v současné době využívá definice ASTRO nebo Phoenix. Tab. 1 uvádí přehled účinnosti HIFU při léčbě lokalizovaného karcinomu prostaty.
Tab. 1. Robotický cílený ultrazvuk o vysoké intenzite – přehled účinnosti léčby. 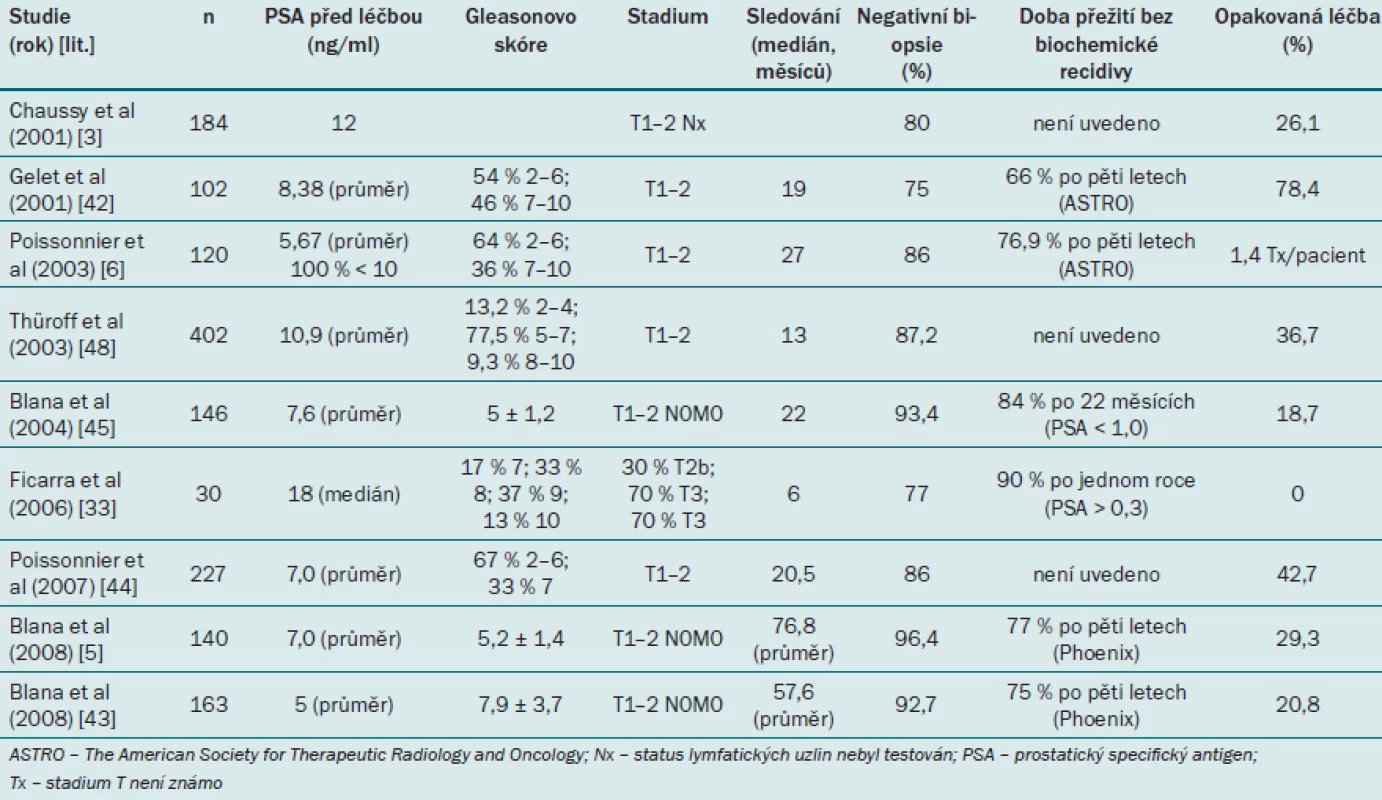
Účinnost HIFU se rovněž uvádí s ohledem na míru negativního výsledku biopsie, což je pravděpodobně nejlepší parametr pro hodnocení definitivní účinnosti i navzdory riziku, že při odběru vzorku může zůstat nedetekován. Nejnižší míru negativního výsledku biopsie uvádí Gelet et al ve studii z roku 2001 [42], která zahrnovala pacienty, kteří byli léčeni prototypem stávajících HIFU zařízení. Jediný další soubor s mírou negativní biopsie < 80 % uvádí Ficarra et al [33], kteří do souboru zahrnuli rovněž pacienty s karcinomem prostaty s vysokým rizikem [6]. Nejnovější studie uvádějí míru negativní biopsie v rozmezí 93 – 96 % [5,43]. Některé publikace uvádějí rovněž míru opakované léčby, interpretaci těchto výsledků však znesnadňuje dřívější praxe dvou terapeutických cyklů, kdy při každém cyklu byl léčen pouze jeden lalok. Tento přístup se často objevuje ve studiích autorů Gelet et al [42] a Poissonnier et al [6,44]. Jediná studie, která neužívá tento přístup, je studie Ficarry et al zahrnující pacienty s vysokým rizikem [33]. Studie bohužel nerozlišuje, kteří pacienti byli léčeni záměrně pomocí dvou cyklů a kteří podstoupili druhý cyklus léčby z důvodu klinického selhání.
Blana et al uvádějí výsledky léčby pomocí HIFU z velkého mezinárodního souboru pacientů z databáze @ - Registry [45]. Pacienti z databáze @ - Registry byli klasifikováni na základě rizika podle klasifikace D’Amica z roku 2003 [46]. Doba přežití bez biochemické recidivy byla stanovena pomocí Kaplan ‑ Meierovy analýzy, kdy selhání bylo definováno pomocí definice Phoenix (PSA nadir + 2 ng/ ml). Celková míra přežití bez biochemické recidivy po pěti letech činila 85 %.
Autoři hodnotili u pacientů po HIFU hodnotu PSA nadir a zjistili, že představuje významný indikátor selhání léčby [46]. V šest měsíců trvající studii zahrnující 115 pacientů léčených pomocí HIFU autoři zaznamenali následující míru selhání léčby: 11 % u pacientů s PSA nadir 0,0 – 0,2 ng/ ml, 46 % u pacientů s PSA nadir 0,21 – 1 ng/ ml a 48 % u pacientů s PSA nadir > 1,0 ng/ ml. Dále odhalili úzkou souvislost mezi hodnotou PSA nadir a předoperační hladinou PSA a reziduálním objemem prostaty. Roli PSA nadir u dlouho sledovaných pacientů potvrzují rovněž Ganzer et al [47]. Pacienti (medián doby sledování 4,9 (3 – 8,6) let) byli rozděleni do tří skupin na základě hodnoty PSA nadir: ≤ 0,2 ng/ ml, 0,21 – 1 ng/ ml a > 1 ng/ ml. Selhání léčby bylo definováno na základě kritérií ASTRO. Tato studie dokazuje, že hodnota PSA nadir po HIFU úzce souvisí se selháním léčby a mírou přežití bez onemocnění (DFSR). Míra selhání během sledování ve výše uváděných třech kategoriích činila 4,5 %, 30,4 % a 100 % (p < 0,001). Míra přežití bez onemocnění po pěti letech ve výše uváděných třech kategoriích činila 95 %, 55 % a 0 % (p < 0,001). Tyto výsledky prokazují dlouhodobé zlepšení kontroly karcinomu po dosažení PSA nadir ≤ 0,2 ng/ ml.
Jiná skupina autorů zkoumá dobu přežití bez karcinomu v souboru 120 pacientů s lokalizovaným karcinomem prostaty a PSA < 10 ng/ ml [6]. Míra doby přežití bez karcinomu po pěti letech pro celkovou populaci pacientů činila 76,9 %, 85,4 % u dobře diferencovaných tumorů (Gleasonovo skóre 2 – 6) a 61,3 % u špatně diferencovaných tumorů (Gleasonovo skóre 7 – 10). S ohledem na objem prostaty nebo počet pozitivních biopsií nebyl zaznamenán žádný významný rozdíl v době přežití. Rovněž hodnota PSA vykazovala prediktivní hodnotu: u pacientů s PSA nadir < 0,5 ng/ ml byla zaznamenána 86% míra přežití po pěti letech.
Evropská multicentrická studie uvádí krátkodobé výsledky u 402 pacientů s lokalizovaným karcinomem prostaty (T1 – 2/ N0 – x/ M0), kteří podstoupili léčbu v období 1995 – 1999 [48]. Po jednom roce sledování mělo 87,2 % kontrolních biopsií negativní výsledek. Při klasifikaci pacientů podle prognostického rizika činila míra negativní biopsie 92,1 % u pacientů s nízkým rizikem (Gleasonovo skóre < 7), 86,4 % u pacientů se středním rizikem (Gleasonovo skóre 7) a 82,1 % u pacientů s vysokým rizikem (Gleasonovo skóre > 7). PSA nadir bylo dosaženo 3 – 4 měsíce po HIFU, hodnota nadir byla významně ovlivněna objemem prostaty v souvislosti s rozsahem HIFU.
Blana et al [5] uvádějí výsledky 140 pacientů s počáteční hladinou PSA ≤ 15 ng/ ml a Gleasonovým skóre ≤ 7. 93,4 % pacientů mělo šest měsíců po HIFU negativní výsledek biopsie naváděné pomocí TRUS. Průměrná hodnota PSA nadir činila 0,07 ng/ ml, hladina PSA zůstávala stabilní (průměr 0,16 ng/ ml) během 22 měsíců sledování. Míra přežití bez biochemické recidivy činila 77 % po pěti letech sledování a 69 % po sedmi letech sledování, což je srovnatelné s výsledky uváděnými ve velkých studiích testujících standardní kurativní léčbu lokalizovaného karcinomu prostaty [49 – 51].
Crouzet et al publikovali v roce 2010 soubor se zatím nejdelším intervalem sledování [52]. Autoři publikovali výsledky multicentrické studie zahrnující 803 pacientů, kteří byli sledováni průměrně po dobu 42 ± 33 měsíců. Při užití definice Phoenix dosáhlo 83 % pacientů s nízkým rizikem pětileté doby přežití bez biochemické recidivy a 75 % pacientů sedmileté doby přežití bez biochemické recidivy, v kategorii středního rizika dosáhlo pětileté doby přežití bez biochemické recidivy 72 % pacientů a sedmileté doby přežití bez biochemické recidivy 63 % pacientů. Míra negativní biopsie činila 84,9 % (pacienti s nízkým rizikem) a 73,5 % (pacienti se středním rizikem). Autoři dále uvádějí 89% míru celkové doby přežití po osmi letech, 97% míru doby přežití bez výskytu metastáz a 99% míru přežití specifickou pro karcinom.
Incidentální karcinom
Histologické vyšetření odhalí karcinom prostaty až u 8 % pacientů, kteří podstoupí adenomektomii/ enukleaci pomocí holmium laseru nebo TURP pro léčbu symptomatické benigní prostatické hyperplazie. Pro tyto pacienty je tedy nutné zvolit terapeutický přístup [35].
K dispozici jsou výsledky u 65 pacientů s incidentálním karcinomem prostaty, kteří podstoupili léčbu pomocí HIFU. Pacienti byli ve věku průměrně 70 let, medián počáteční hodnoty PSA činil 4,9 ng/ ml a medián objemu prostaty 39 ml, průměrně bylo resekováno 20 g (1 – 95 g) tkáně. Histologické vyšetření prokázalo 5 % (5 – 50 %) pozitivních resekovaných plátků tkáně a průměrné Gleasonovo skóre 5 (3 – 9). Pacienti podstoupili jeden cyklus transrektálního HIFU s léčbou celé žlázy. Po 1,8 měsíci sledování bylo dosaženo PSA nadir (medián) 0,07 ng/ ml, 62 % pacientů mělo PSA < 0,1 ng/ ml a 81 % pacientů PSA < 0,5 ng/ ml. Po 48 měsících sledování (medián) byl naměřen medián PSA 0,13 ng/ ml, což je ekvivalentní mediánu PSA velocity 0,01 ng/ ml/ rok. Výskyt peroperačních a pooperačních vedlejších účinků byl minimální (Clavienův stupeň < 15 % I–III). Při dlouhodobém sledování se u 45 % pacientů vyskytla sekundární obstrukce způsobená nekrotickou tkání nebo stenóza hrdla močového měchýře. Další dlouhodobé vedlejší účinky zahrnovaly stresovou močovou inkontinenci I. stupně u 11 % pacientů (0 % II. nebo III. stupně) a UTI u 14 % pacientů. Nebyl zaznamenán žádný případ úmrtí specifického pro karcinom [9].
PSA nadir 0,07 ng/ ml a PSA velocita 0,01 ng/ ml/ rok nasvědčují tomu, že HIFU lze indikovat jako kurativní terapii u pacientů s incidentálním karcinomem prostaty. Tyto výsledky prokazují, že pacienti konfrontovaní s možností výběru mezi strachem ze života s neléčeným maligním onemocněním a radikální operací či ozařováním, které jsou spojeny s rizikem významných a dlouhodobých vedlejších účinků, mají nyní možnost podstoupit neinvazivní léčbu v podobě HIFU [9].
Morbidita spojená s HIFU
Mezi nejčastější vedlejší účinky vyskytující se při primárním HIFU patří dlouhotrvající mikční dysfunkce a retence způsobená otokem, nekrózou nebo obstrukcí výtoku z močového měchýře a erektilní dysfunkce. Z populace pacientů podstupujících HIFU jako primární terapii se stresová močová inkontinence I. stupně vyskytne u 4 – 6 % pacientů, inkontinence II. stupně u 0 – 2 % pacientů a sekundární infravezikální obstrukce u 5 – 10 % pacientů. Výskyt závažné inkontinence (III. stupeň) a uretrorektální píštěle je vzácný (< 1 %). Běžný je výskyt infekce močových cest (2 – 48 %), díky kombinaci HIFU s TURP se však incidence významně snížila. Erektilní dysfunkce se vyskytuje u 32 – 61 % pacientů. Zachování erektilní funkce přímo závisí na poloze primární léze vzhledem k neurovaskulárnímu svazku. Přístup umožňující lepší zachování potence spočívá v ponechání 5mm laterálního okraje na kontralaterální straně prostaty, kde byly pozitivní výsledky biopsie ohraničeny pouze na jednu stranu prostaty. Ačkoli zachování kontralaterální strany z důvodu šetření nervově‑cévních svazků může vést ke zlepšení míry potence, tento přístup je rovněž spojen s vyšší mírou opakované léčby [4,44,53 – 55]. Výskyt morbidity při HIFU je shrnut v tab. 2.
Tab. 2. Přehled morbidity po léčbě pomocí cíleného ultrazvuku o vysoké intenzitě. 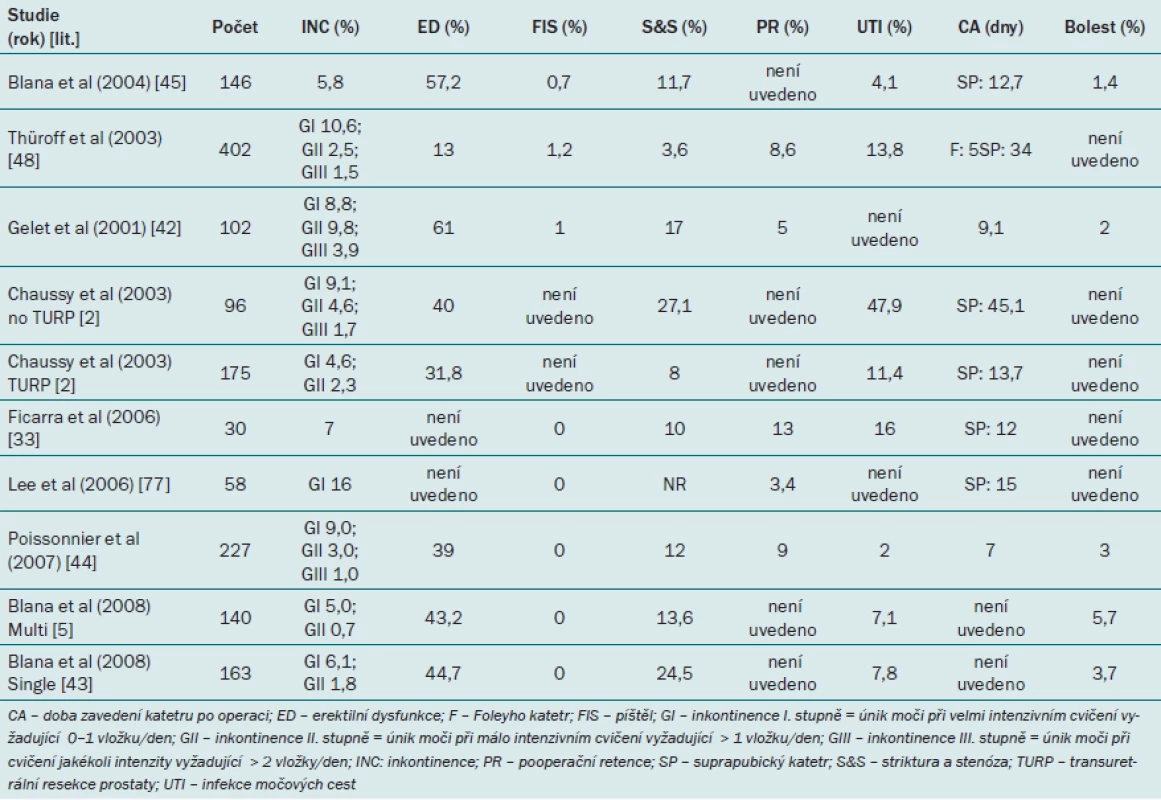
Řada studií se zabývá efektem kombinace HIFU a TURP s cílem zkrátit dobu derivace moči a redukovat související pooperační morbiditu (odlučování tkáně, obstrukce, infekce). Třicet pacientů s lokalizovaným karcinomem prostaty podstoupilo jeden cyklus (v jediné anestezii) kombinované terapie (TURP s HIFU). Po šesti měsících sledování činilo skóre PIPSS (post‑treatment international prostate symptom score) 6,7 ve srovnání s hodnotou 7,5 před léčbou [36]. Jiná studie testující tuto kombinaci srovnává 96 pacientů podstupujících samotný HIFU a 175 pacientů léčených pomocí kombinované terapie. Pacienti léčení pomocí monoterapie měli suprapubický katetr zaveden po dobu 40 dnů, zatímco pacienti podstupující kombinovanou léčbu pouze sedm dnů [2].
Chaussy a Thüroff srovnávají výsledky 175 pacientů léčených pomocí kombinace HIFU a TURP a 96 pacientů, kteří podstoupili pouze samotný HIFU [2]. Mezi oběma skupinami nebyly zjištěny žádné významné rozdíly s ohledem na PSA nadir ani míru pozitivní biopsie, což je v souladu s výsledky dalších studií, které uvádějí srovnatelnou účinnost HIFU a HIFU + TURP [36,43,44]. Nižší míra opakované léčby (4 %) u pacientů léčených pomocí HIFU/ TURP (ve srovnání s 25 % u pacientů podstupujících pouze HIFU) však nasvědčuje tomu, že indikace TURP před HIFU přináší benefit v podobě odstranění kalcifikací v přechodové zóně prostaty, které by mohly bránit optimálnímu provedení HIFU. U pacientů léčených pomocí TURP/ HIFU byla dále zjištěna významně nižší míra výskytu močové infekce než u pacientů podstupujících pouze HIFU (11,4 vs 47,9 %; p ≤ 0,001).
Studie zabývající se souvislostí mezi velikostí dávky HIFU, výskytem vedlejších účinků a výsledkem léčby srovnává méně agresivní strategie léčby (při nichž se léčené oblasti vzájemně nepřekrývají) s agresivnějšími formami (s překrývajícími se oblastmi léčby). Aplikace vyšších dávek byla spojena s vyšší mírou přežití bez karcinomu a nižším PSA nadir, na druhou stranu ale s déletrvající močovou retencí v důsledku přítomnosti většího množství nekrotické tkáně (pakliže nebyla provedena adjuvantní TURP) [56].
Indikace HIFU při léčbě lokálně pokročilého a pokročilého karcinomu a karcinomu refrakterního na hormonální léčbu
Na rozdíl od většiny studií, které zkoumají účinek HIFU u pacientů s onemocněním ve stadiu T1 – T2 a u pacientů, u nichž došlo k recidivě po ozařování, byly v nedávné době uveřejněny výsledky studie zahrnující 113 pacientů s onemocněním ve stadiu T3 – T4 (doba sledování 4,6 let) [57]. Medián PSA velocity u této populace pacientů činil 0,19 ng/ ml/ rok a míra přežití specifická pro karcinom 96,4 %. Jiná studie uvádí výsledky u 55 mužů, u nichž došlo k progresi PSA a lokální recidivě tumoru (prokázáno biopsií) po definitivní hormonální ablaci a u nichž byla léčba pomocí HIFU indikována pro léčbu karcinomu prostaty rezistentního na hormonální léčbu [58]. Po průměrné době sledování 21 měsíců činila míra přežití specifická pro karcinom 87,3 %. Výsledky obou studií jsou ohromující a povzbudivé, protože tato skupina pacientů má velmi špatnou prognózu a krátký medián doby přežití.
Předběžné výsledky HIFU v rámci paliativní léčby u pacientů s pokročilým karcinomem prostaty jsou slibné s ohledem na redukci lokální morbidity, jako např. komprese rekta, infravezikální obstrukce, hydronefróza, hematurie a syndrom pánevní bolesti.
Nezveřejněná data zahrnující několik velkých skupin pacientů (n > 70) s karcinomy T3 a HRPCa (doba sledování 10 let) ukazují post‑HIFU PSA velocitu 0,19 ng/ ml/ rok u pacientů s tumory T3, aniž by podstupovali dodatečnou hormonální ablaci. Lokální ablace nádoru pomocí HIFU vedla u pacientů s HRPCa k redukci PSA o 80 %. Dále byl zaznamenán synergistický efekt HIFU s hormonálními ablačními terapiemi v podobě pozdějšího nástupu hormonální rezistence [59,10].
Využití HIFU v rámci záchranné terapie
Kontext
HIFU lze indikovat v rámci záchranné léčby lokálně recidivujícího karcinomu prostaty téměř po všech terapeutických modalitách s kurativním záměrem: ozařování zevním paprskem, brachyterapii s aplikací nízké i vysoké dávky, kryoablaci, primární HIFU, v případě biochemické recidivy a po kombinovaném předléčení (včetně radikální prostatektomie). Jedním z důvodů, jenž činí ze záchranného HIFU atraktivní modalitu, je velmi omezený výběr možností léčby pro muže, u nichž dojde k recidivě po kurativní terapii. Podle údajů z databáze CaPSURE [37] dojde u 63 % pacientů léčených pomocí radioterapie k recidivě karcinomu. U 93,5 % pacientů byla v rámci záchranné léčby indikována androgenní deprivace, zatímco definitivní lokální léčba pouze u 3,9 % pacientů (záchranná radikální prostatektomie u 0,9 %, kryoablace u 3,0 %). Přitažlivost indikace záchranné radikální prostatektomie i kryoablace po selhání lokální radioterapie je spíše teoretická, ve skutečnosti se jedná o nákladné a složité výkony spojené s vysokou mírou morbidity [9].
Záchranná terapie po selhání léčby ozařováním
Murat et al [60] uveřejnili výsledky 167 mužů, kteří podstoupili záchranný HIFU poté, co u nich došlo k recidivě karcinomu prostaty po radioterapii. Autoři uvádějí 73% míru negativní biopsie a 84% míru celkové doby přežití po pěti letech. Údaje o míře přežití bez biochemické recidivy nejsou k dispozici. Nebyl zaznamenán žádný případ rektálních komplikací, močová inkontinence se však vyskytla u 49,5 % pacientů, což je srovnatelný výsledek jako po záchranné radikální prostatektomii. Berge et al [61] publikovali časné výsledky prospektivní studie a po záchranného HIFU uvádějí 39,1% míru biochemické recidivy. Je zajímavé, že míra močové inkontinence v jejich souboru byla mnohem nižší než v populaci pacientů ve studii Murata et al (u 17,3 % pacientů se vyvinula inkontinence II. nebo III. stupně). U jednoho pacienta došlo ke vzniku rektouretrální píštěle.
Gelet et al rovněž uvádějí výsledky po záchranném HIFU u pacientů s lokálně recidivujícím karcinomem prostaty po ozařování zevním paprskem [31]. Průměrná doba do recidivy po ozařování zevním paprskem u těchto 71 pacientů činila 38,5 měsíců (rozmezí 6 – 120) a průměrná hodnota PSA před HIFU 7,7 ng/ ml (rozmezí 0,5 – 54 ng/ ml). Po průměrné době sledování 14,8 měsíců (rozmezí 6 – 86) mělo 80 % pacientů negativní biopsii, což koresponduje se 73% mírou negativní biopsie po 30 měsících. Míra přežití bez onemocnění po 30 měsících (stanoveno na základě výsledku biopsie a odpovědi PSA) činila 38 %.
Záchranný HIFU představuje schůdnou alternativu pro pacienty, u nichž dojde po ozařování k recidivě karcinomu. Ačkoli jsou změny ve tkáni vyvolané ozařováním příčinou vyšší míry pooperační morbidity (nežli je běžné po primárním HIFU) [9], tato skutečnost nemá vliv na příznivý poměr riziko ‑ benefit indikace HIFU v rámci záchranné terapie ve srovnání s dalšími alternativami [60].
Ačkoli máme k dispozici pouze minimum zkušeností s indikací záchranného HIFU po brachyterapii, tento přístup pravděpodobně není spojen s významnějším nárůstem komplikací (ve srovnání s primárním HIFU). Před zahájením HIFU je naprosto nezbytné precizně monitorovat polohu implantovaných zrn pomocí MRI. Mimo prostatickou kapsulu by se neměla nalézat žádná zrna, zejména mezi rektem a prostatou, vzhledem k tomu, že v této oblasti budou bránit přímému vstupu ultrazvukových vln [1].
Záchranná terapie po selhání radikální prostatektomie
Pro léčbu lokální recidivy po radikální prostatektomii není k dispozici mnoho alternativ. HIFU přichází v úvahu v případě, že lze lokální recidivu identifikovat pomocí transrektálního ultrazvukového vyšetření a potvrdit pomocí biopsie. V malé populaci pacientů, kteří podstoupili po selhání prostatektomie HIFU, prokázala biopsie léčených oblastí negativní výsledek u 77 % jedinců. Průměrná hodnota PSA nadir činila 0,2 ng/ ml a 66 % pacientů dosáhlo PSA nadir < 0,5 ng/ ml. Během pěti let sledování nedošlo u 91 % pacientů k biochemické progresi [59,62].
Záchranná radikální prostatektomie po selhání HIFU
Sedm pacientů, u nichž došlo k recidivě po HIFU v letech 1996 – 2000, podstoupilo radikální prostatektomii. Ačkoli předchozí léčba pomocí HIFU zvýšila technickou náročnost záchranné radikální prostatektomie (vznik těžkých fibrotických adhezí mezi rektem a Denonvilliersovou fascií), nebyla spojena se zvýšením míry morbidity (oproti standardní prostatektomii). Autoři přisuzují tyto případy selhání HIFU nedostatečné léčbě větších prostat před rutinním provedením TURP [1].
Fokální a parciální HIFU
V uplynulých 25 letech se průměrná očekávaná délka života mužů prodloužila o čtyři roky, zatímco věk, kdy je u mužů detekován karcinom prostaty, se snížil průměrně o deset let [63,64]. Karcinom prostaty je nyní detekován v mnohem nižším stadiu než před 20 lety, a většina pacientů je tedy kandidátem pro kurativní léčbu celé prostatické žlázy. Značné procento pacientů s jediným ložiskem tumoru malého objemu podstupuje nadbytečnou léčbu celé prostaty, která spočívá v chirurgickém odstranění nebo ozařování celé žlázy. Je tedy žádoucí vyvinout fokální přístup pro léčbu malých tumorů lokalizovaných v jediném laloku prostaty.
Fokusovaný HIFU spočívá v parciální léčbě, která je omezená pouze na tumor a bezpečnostní okraj u pacientů s neinvazivním, lokalizovaným karcinomem prostaty s jedním ložiskem. Tento přístup by umožnil léčit maligní onemocnění s dostatečným účinkem při současném zachování funkce močopohlavního systému [65,66]. V současné době jsou hodnoceny dva přístupy fokusované aplikace HIFU: 1. precizní fokální technika, při níž je léčeno maximálně 25 % celkového objemu prostaty (bez TURP), a 2. parciální technika umožňující zachování potence, při níž není léčen kontralaterální lalok/ kapsula ani neurovaskulární svazek zachováním 5mm okraje v kontralaterálním laloku. Při této technice je léčeno až 90 % objemu celé prostaty [21].
Zásadní význam při fokusované léčbě karcinomu prostaty má vhodná volba pacientů a eliminace jedinců s bilaterálním karcinomem, což lze zabezpečit pomocí efektivní vizualizace a mapování prostaty. Pro účely eliminace pacientů s klinicky významným karcinomem lokalizovaným mimo oblast určenou k ablaci je vhodnější transperineální 3D mapovací biopsie (než transrektální ultrazvukem naváděná biopsie). Při 3D biopsii se setkáváme s vyšším Gleasonovým skóre (ve srovnání s běžnou biopsií) [67]. Dalším zásadním aspektem je lokalizace tzv. index léze, která je cílena během terapie, a dále monitorování pacienta po operaci. Kolísavá senzitivita MRI [68,69] byla impulzem pro studium dalších funkčních zobrazovacích technik. Výsledky nasvědčují tomu, že přesnost definice a určení stadia karcinomu prostaty lze významně zlepšit pomocí informací o cévním zásobení prostaty (získaných pomocí dynamické MRI s kontrastní látkou nebo difuzně‑vážené MRI) v kombinaci s metabolickými parametry z magnetické rezonanční spektroskopie [70,71]. Dále nebyla jednoznačně stanovena metoda pro nejlepší způsob monitorování pacientů po léčbě [21]. Navzdory všem těmto komplikacím očekáváme výsledky léčby pomocí fokusovaného HIFU s velkým napětím.
Predikce výsledku léčby pomocí HIFU
Výsledek radikální prostatektomie je predikován na základě patologických parametrů odstraněné prostatické žlázy, jako jsou kategorie tumoru, stav lymfatických uzlin a chirurgických okrajů a Gleasonovo skóre stanovené ze vzorku odebraného při prostatektomii. Vzhledem k absenci vzorků pro histologické vyšetření při léčbě pomocí HIFU je nezbytné užívat jiné prediktory. Pro predikci výsledku léčby HIFU se užívají následující parametry: stadium karcinomu, PSA a GS stanovené na základě vzorku biopsie.
Studie publikovaná v roce 2001 zahrnuje 102 pacientů s karcinomy ve stadiu T1 – T2. Po průměrné době sledování 19 měsíců činila celková doba přežití bez onemocnění 66 % [42]. Rozdíly byly zaznamenány v počáteční hodnotě PSA < 10 ng/ ml (73 % vs 50 %; p = 0,02); GS < 6 (81 % vs 46 %; p < 0,001); a výsledku sextantové biopsie prokazující 1 – 4 pozitivních vzorků (68 % vs 40 %; p = 0,01). Poissonier et al analyzovali výsledky 227 pacientů a uvádějí 66% míru DFSR po pěti letech [44]. Míra DFSR se lišila v případě, že byli pacienti klasifikováni do skupin na základě hladiny PSA před léčbou: 90% DFSR u pacientů s PSA < 4 ng/ ml vs 57% DFSR u pacientů s PSA 4,1 – 10 ng/ ml vs 61% DFSR u pacientů s PSA 10,1 – 15 ng/ ml.
Dále byla hodnocena role PSA nadir jako prediktoru klinického selhání po HIFU [72]. V šest měsíců trvající studii zahrnující 115 pacientů léčených pomocí HIFU autoři zaznamenali následující míru selhání léčby: 11 % (4/ 36) u pacientů s PSA nadir 0,0 – 0,2 ng/ ml, 46 % (17/ 37) u pacientů s PSA nadir 0,21 – 1 ng/ ml a 48 % (20/ 42) u pacientů s PSA >1,0 ng/ ml. Dále odhalili úzkou souvislost mezi hodnotou PSA nadir a předoperační hladinou PSA a reziduálním objemem prostaty. Prediktivní význam PSA nadir u dlouho sledovaných pacientů potvrzují rovněž Ganzer et al [47]. Medián doby sledování v jejich studii činil 4,9 let (rozmezí 3 – 8,6). Pacienti byli rozděleni do tří podskupin na základě hodnoty PSA nadir (≤ 0,2; 0,21 – 1 a ≥1 ng/ ml) a selhání léčby bylo definováno podle kritérií ASTRO. Bylo zjištěno, že hodnota PSA nadir po HIFU úzce souvisí se selháním léčby a mírou DFSR; míra selhání během sledování činila 4,5 % u pacientů s PSA nadir ≤ 0,2 ng/ ml, 30,4 % u pacientů s PSA nadir 0,21 – 1 ng/ ml, a 100 % u pacientů s PSA nadir ≥ 1 ng/ ml (p ≤ 0,001). Míra DFSR po pěti letech (pro výše uvedené skupiny) činila 95 %, 55 % a 0 % (p ≤ 0,001). Tyto výsledky prokazují lepší výsledek HIFU při dosažení PSA nadir < 0,2 ng/ ml.
Imunologická odpověď na HIFU
Ve vývoji účinných imunitních strategií pro léčbu karcinomu prostaty byl učiněn pokrok. V současné době probíhá výzkum nejrůznějších imunoterapeutických protokolů, jako např. imunomodulační cytosiny/ efektorové buňky, peptidy a buněčná imunizace, virové vakcíny, vakcíny na bázi dendritických buněk a terapie využívající protilátky. Imunomodulační látky, jako jsou faktor stimulující kolonie granulocytů ‑ makrofágů (GM‑CSF), Flt3 ligand, a IL‑2 se užívají ke stimulaci imunitního systému a vyvolání protinádorové odpovědi proti karcinomu prostaty. Povzbudivé preklinické výsledky však prozatím nebyly využity v klinickém výzkumu.
Několik studií z poslední doby zkoumá potenciál HIFU vyvolat imunitní odpověď. Wu et al zkoumají efekt HIFU na systémovou protinádorovou imunitu, zejména imunitu zabezpečovanou pomocí T lymfocytů u pacientů s karcinomem [73]. Šestnáct pacientů se solidními tumory (osteosarkom, hepatocelulární karcinom a karcinom z renálních buněk) podstoupilo HIFU. HIFU způsoboval signifikantní nárůst populace CD4+ lymfocytů a poměr CD4+/ CD8+ v krevním oběhu. Autoři dospěli k závěru, že HIFU může u pacientů se solidními tumory kromě destrukce lokálního tumoru podporovat systémovou protinádorovou buněčnou imunitu.
Stejná výzkumná skupina zjišťovala, zda je možné po léčbě pomocí HIFU zachovat antigeny exprimované na buňkách karcinomu prsu [74]. Dvacet tři pacientů s karcinomem prsu prokázaným pomocí biopsie podstoupilo léčbu primární léze pomocí HIFU a následně modifikovanou radikální mastektomii. Vzorky resekovaného karcinomu byly následně nabarveny s cílem zobrazit různé buněčné molekuly včetně nádorových antigenů a proteinu teplotního šoku 70 (HSP ‑ 70). Bylo identifikováno několik antigenů, které by mohly sloužit jako potenciální zdroj antigenů ke stimulaci protinádorové imunitní odpovědi.
Byla předložena domněnka, že endogenní signály z buněk tumoru poškozeného při HIFU mohou být spouštěčem aktivace dendritických buněk, a tak se významně podílet na protinádorové imunitní odpovědi (vyvolané pomocí HIFU) [75]. Model myši s adenokarcinomy colon MC ‑ 38 byl léčen pomocí HIFU. Výsledky prokazují, že HIFU vyvolává systémovou protinádorovou imunitní reakci, která úzce souvisí s aktivací dendritických buněk. Aktivace dendritických buněk byla významnější v případě, že byly nádorové buňky mechanicky lyzovány při HIFU.
Bylo zjištěno, že ablace karcinomu prsu u člověka pomocí HIFU vyvolává významný nárůst počtu tumor infiltrujících CD3, CD4, CD8, CD4/ CD8 B lymfocytů a NK buněk a vede k významně zvýšené infiltraci nádorů lymfocyty, zejména podél okrajů, které byly vystaveny ablaci u všech nádorů léčených pomocí HIFU. V HIFU skupině byl rovněž zaznamenán významně větší počet FasL(+), granzym(+), a perforin(+) tumor ‑ infiltrujících lymfocytů než v kontrolní skupině [76].
Další směřování HIFU při léčbě karcinomu prostaty
Pro úspěšnou kontrolu karcinomu při léčbě HIFU budou důležitější (než vývoj terapeutických pomůcek) diagnostické technologie umožňující přesně zobrazit a lokalizovat léze a ložiska tumoru. Po dosažení tohoto cíle se HIFU stane ideální terapeutickou modalitou pro fokální léčbu karcinomu prostaty. S tímto cílem v současné době probíhá výzkum několika novinek v oblasti zobrazovacích technologií pro HIFU, a to včetně MRI, ultrazvuku a dopplerovského vyšetření pro cílení lézí a MRI s ultrazvukem pro použití společně s termometrií.
Karcinom prostaty představuje s více než deseti lety klinické aplikace u více než 30 000 pacientů hlavní indikaci pro HIFU, následován děložními fibromy a myomy. Dále probíhá výzkum využití této technologie při léčbě karcinomu prsu, mozku, štítné žlázy, při trombolýze, jako metoda aplikace medikamentů nebo jako modalita pro „zacelování“ krevních cév. Další klinický výzkum technologie HIFU bude (vzhledem k omezené hloubce penetrace HIFU) zaměřen primárně na léčbu patologií měkkých tkání, které se nalézají přímo pod kůží o objemu < 20 cm3 (prostata, prsa a štítná žláza). Další slibnou oblastí pro využití HIFU se zdá být aplikace léčiv vyžadující jejich akumulaci v konkrétních orgánových strukturách nebo genetická manipulace. V současné době již probíhá výzkum efektu HIFU jako spouštěče imunitní reakce v rámci podpůrné terapie [1].
Závěr
Karcinom prostaty je v současné době diagnostikován v časnějším stadiu a u mladších pacientů s delší očekávanou délkou života, než tomu bylo před 20 lety před masovým rozšířením screeningu PSA. Možnosti úplného vyléčení onemocnění se tak značně rozšířily a vzhledem k tomu, že pacienti žijí ještě mnoho let po definitivní léčbě karcinomu, je kladen větší důraz na výskyt morbidity související s léčbou a její dopad na kvalitu života pacienta. Bez ohledu na terapeutický přístup dojde u 10 – 50 % pacientů k lokální recidivě. Léčba karcinomu prostaty se posunula od indikace jediné terapie k multimodálnímu, sekvenčnímu přístupu, pro nějž se skvěle hodí minimálně invazivní terapie, jakou je např. HIFU. Redukce zdrojů v oblasti lékařské péče podtrhuje nutnost vyvíjet efektivnější a současně cenově výhodnější neinvazivní techniky a zavádět je do klinické praxe.
Od roku 2000, kdy byla léčba karcinomu prostaty pomocí systému Ablatherm® považována za experimentální modalitu, se léčba pomocí HIFU po mnoha letech usilovného výzkumu zařadila mezi přístupy pro primární léčbu lokálního karcinomu prostaty a záchrannou terapii po selhání radioterapie. Předběžné údaje nasvědčují tomu, že aplikace HIFU může být účinná rovněž při léčbě fokálních a incidentálních karcinomů prostaty, v rámci adjuvantní terapie při léčbě onemocnění T3/ T4 a u nemetastazujících karcinomů rezistentních na hormonální léčbu. Toto široké rozmezí indikací skrze celé spektrum různých typů karcinomu prostaty je jedinečnou vlastností HIFU [19,31]. V případě lokální recidivy lze léčbu pomocí HIFU opakovat, což u jiných modalit pro léčbu lokalizovaného karcinomu prostaty (jako kryoperace nebo brachyterapie) není možné.
HIFU nelze chápat jako náhradu za klasickou léčbu, ale spíše jako léčbu první volby u pacientů s dobře diferencovaným karcinomem s jediným ložiskem. Indikace HIFU jako primární terapie může pomoci oddálit potřebu invazivnější léčby spojené s větší morbiditou, jako např. operace nebo ozařování, což pacientům nabízí možnost žít déle bez rizika vzniku nežádoucích příhod v močopohlavním systému v důsledku léčby [77].
Indikaci transrektálního HIFU lze zvážit pro léčbu s kurativním záměrem u pacientů s lokalizovaným onemocněním i v rámci paliativní léčby tumorů ve všech ostatních stadiích. Lze předpokládat, že neustálé zdokonalování zobrazovacích technik povede k dalšímu zlepšování účinku HIFU.
Stefan Thüroff, MD
Harlachinger Krebshilfe e.V. – HIFU project
Vice Chairman Dept. of Urology Klinikum Harlaching
sthueroff@mnet-online.de
Zdroje
1. Chaussy CG, Thüroff S. Transrectal high‑intensity focused ultrasound for local treatment of prostate cancer: current role. Arch Esp Urol 2011; 64(6): 493 – 506.
2. Chaussy C, Thüroff S. The status of high‑intensity focused ultrasound in the treatment of localized prostate cancer and the impact of a combined resection. Curr Urol Rep 2003; 4(3): 248 – 252.
3. Chaussy C, Thüroff S. Results and side effects of high‑intensity focused ultrasound in localized prostate cancer. J Endourol 2001; 15(4): 437 – 440; discussion: 447 – 448.
4. Chaussy CG, Thüroff S. The use of high‑intensity focused ultrasound in prostate cancer. In: Ukimura O, Gill IS (eds). Contemporary interventional ultrasonography in urology. London: Springer 2009 : 63 – 74.
5. Blana A, Murat FJ, Walter B et al. First analysis of the long‑term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 2008; 53(6): 1194 – 1201.
6. Poissonnier L, Gelet A, Chapelon JY et al. Results of transrectal focused ultrasound for the treatment of localized prostate cancer (120 patients with PSA < or + 10 ng/ ml). Prog Urol 2003; 13(1): 60 – 72.
7. Lynn JG, Putman TJ. Histology of cerebral lesions produced by focused ultrasound. Am J Pathol 1944; 20(3): 637 – 649.
8. Ter Haar G. Intervention and therapy. Ultrasound Med Biol 2000; 26 (Suppl 1): S51 – S54.
9. Chaussy CG, Thüroff SF. Robotic high‑intensity focused ultrasound for prostate cancer: what have we learned in 15 years of clinical use? Curr Urol Rep 2011; 12(3): 180 – 187. doi: 10.1007/ s11934 ‑ 011 ‑ 0184 ‑ 2.
10. Chaussy C, Thüroff S. High‑intensity focused ultrasound in the management of prostate cancer. Expert Rev Med Devices 2010; 7(2): 209 – 217. doi: 10.1586/ erd.09.66.
11. Chapelon JY, Margonari J, Theillère Y et al. Effects of high‑energy focused ultrasound on kidney tissue in the rat and the dog. Eur Urol 1992; 22(2): 147 – 152.
12. Uchida T, Sanghvi NT, Gardner TA et al. Transrectal high‑intensity focused ultrasound for treatment of patients with stage T1b ‑ 2n0m0 localized prostate cancer: a preliminary report. Urology 2002; 59(3): 394 – 398; discussion: 398 – 399.
13. Chapelon JY, Cathignol D, Cain C et al. New piezoelectric transducers for therapeutic ultrasound. Ultrasound Med Biol 2000; 26(1): 153 – 159.
14. Curiel L, Chavrier F, Souchon R et al. 1.5 – D high intensity focused ultrasound array for non‑invasive prostate cancer surgery. IEEE Trans Ultrason Ferroelectr Freq Control 2002; 49(2): 231 – 242.
15. Tan JS, Frizzell LA, Sanghvi NT et al. Design of focused ultrasound phased array for prostate treatment. Proc IEEE Ultrason Symp 2000 : 1247 – 1251.
16. Oosterhof GO, Cornel EB, Smits GA et al. Influence of high‑intensity focused ultrasound on the development of metastases. Eur Urol 1997; 32(1): 91 – 95.
17. Foster RS, Bihrle R, Sanghvi N et al. Production of prostatic lesions in canines using transrectally administered high‑intensity focused ultrasound. Eur Urol 1993; 23(2): 330 – 336.
18. Gelet A, Chapelon JY, Margonari J et al. Prostatic tissue destruction by high‑intensity focused ultrasound: experimentation on canine prostate. J Endourol 1993; 7(3): 249 – 253.
19. Chaussy C, Thüroff S, Rebillard X et al. Technology insight: High‑intensity focused ultrasound for urologic cancers. Nat Clin Pract Urol 2005; 2(4): 191 – 198.
20. Rébillard X, Davin JL, Soulié M. Treatment by HIFU of prostate cancer: survey of literature and treatment indications. Prog Urol 2003; 13(6): 1428 – 1456.
21. Chaussy CG, Thüroff S. Robot ‑ assisted high‑intensity focused ultrasound in focal therapy of prostate cancer. J Endourol 2010; 24(5): 843 – 847. doi: 10.1089/ end.2009.0439.
22. Misonix/ U.S. HIFU. HIFU with the Sonablate 5000. [online]. Available from: http:/ / www.ushifu.com.
23. Beerlage HP, van Leenders GJ, Oosterhof GO et al. High‑intensity focused ultrasound (HIFU) followed after one to two weeks by radical retropubic prostatectomy: results of a prospective study. Prostate 1999; 39(1): 41 – 46.
24. Rouviere O, Lyonnet D, Raudrant A et al. MRI appearance of prostate following transrectal HIFU ablation of localized cancer. Eur Urol 2001; 40(3): 265 – 274.
25. Hynynen K, Freund WR, Cline HE et al. A clinical, noninvasive, MR imaging ‑ monitored ultrasound surgery method. Radiographics 1996; 16(1): 185 – 195.
26. Damianou C, Pavlou M, Velev O et al. High intensity focused ultrasound ablation of kidney guided by MRI. Ultrasound Med Biol 2004; 30(3): 397 – 404.
27. Wu T, Felmlee JP, Greenleaf JF et al. Assessment of thermal tissue ablation with MR elastography. Magn Reson Med 2001; 45(1): 80 – 87.
28. Vaezy S, Shi X, Martin RW et al. Real ‑ time visualization of high‑intensity focused ultrasound treatment using ultrasound imaging. Ultrasound Med Biol 2001; 27(1): 33 – 42.
29. Sedelaar JP, Aarnink RG, van Leenders GJ et al. The application of three ‑ dimensional contrast ‑ enhanced ultrasound to measure volume of affected tissue after HIFU treatment for localized prostate cancer. Eur Urol 2000; 37(5): 559 – 568.
30. Lu J, Ying H, Sun Z et al. In vitro measurement of speed of sound during coagulate tissue heating. Ultrasonics Symp Proc IEEE 1996; 2 : 1299 – 1302.
31. Gelet A, Chapelon JY, Poissonnier L et al. Local recurrence of prostate cancer after external beam radiotherapy: early experience of salvage therapy using high‑intensity focused ultrasonography. Urology 2004; 63(4): 625 – 629.
32. Chaussy C, Thüroff S. Complete remission in metastatic prostate cancer after combined local and systemic therapy. Urology 2006; 68 : 197 – 198.
33. Ficarra V, Antoniolli SZ, Novara G et al. Short‑term outcome after high‑intensity focused ultrasound in the treatment of patients with high‑risk prostate cancer. BJU Int 2006; 98(6): 1193 – 1198.
34. Consensus statement: guidelines for PSA following radiation therapy. Society for Therapeutic Radiology and Oncology Consensus Panel. Int J Radiat Oncol Biol Phys 1997; 37(5): 1035 – 1041.
35. Chaussy CG, Thüroff S. Transrectal high‑intensity focused ultrasound for local treatment of prostate cancer. Urologe A 2009; 48(7): 710 – 718. doi: 10.1007/ s00120 ‑ 009 ‑ 1981 ‑ 9.
36. Vallancien G, Prapotnich D, Cathelineau X et al. Transrectal focused ultrasound combined with transurethral resection of the prostate for the treatment of localized prostate cancer: feasibility study. J Urol 2004; 171(6 Pt 1): 2265 – 2267.
37. Agarwal PK, Sadetsky N, Konety BR et al. Treatment failure after primary and salvage therapy for prostate cancer: likelihood, patterns of care, and outcomes. Cancer 2008; 112(2): 307 – 314.
38. Gelet A, Chapelon JY, Bouvier R et al. Treatment of prostate cancer with transrectal focused ultrasound: early clinical experience. Eur Urol 1996; 29(2): 174 – 183.
39. Gelet A, Chapelon JY, Bouvier R et al. Local control of prostate cancer by transrectal high intensity focused ultrasound therapy: preliminary results. J Urol 1999; 161(1): 156 – 162.
40. Gelet A, Chapelon JY, Bouvier R et al. Transrectal high‑intensity focused ultrasound: minimally invasive therapy of localized prostate cancer. J Endourol 2000; 14(6): 519 – 528.
41. Richaud P, Moreau JL, Beuzeboc P et al. Follow‑up of prostate cancer. Guidelines of the Comité de Cancérologie de l‘Association Française d‘Urologie. Prog Urol 2005; 15(4): 586 – 592.
42. Gelet A, Chapelon JY, Bouvier R et al. Transrectal high intensity focused ultrasound for the treatment of localized prostate cancer: factors influencing the outcome. Eur Urol 2001; 40(2): 124 – 129.
43. Blana A, Rogenhofer S, Ganzer R et al. Eight years’ experience with high‑intensity focused ultrasonography for treatment of localized prostate cancer. Urology 2008; 72(6): 1329 – 1333; discussion 1333 – 4. doi: 10.1016/ j.urology.2008.06.062.
44. Poissonnier L, Chapelon JY, Rouviēre O et al. Control of prostate cancer by transrectal HIFU in 227 patients. Eur Urol 2007; 51(2): 381 – 387.
45. Blana A, Brown SC, Chaussy C et al. Primary prostate HIFU without pretreatment hormone therapy: biochemical survival of 763 patients tracked with the @ – Registry. Eur Urol 2009; 8(4): 333.
46. D’Amico AV, Moul J, Carroll PR et al. Cancer ‑ specific mortality after surgery or radiation for patients with clinically localized prostate cancer managed during the prostate ‑ specific antigen era. J Clin Oncol 2003; 21(11): 2163 – 2172.
47. Ganzer R, Rogenhofer S, Walter B et al. PSA nadir is a significant predictor of treatment failure after high‑intensity focused ultrasound (HIFU) treatment of localised prostate cancer. Eur Urol 2008; 53(3): 547 – 553.
48. Thüroff S, Chaussy C, Vallancien G et al. High‑intensity focused ultrasound and localized prostate cancer: efficacy results from the European multicentric study. J Endourol 2003; 17(8): 673 – 677.
49. Kupelian PA, Elshaikh M, Reddy CA et al. Comparison of the efficacy of local therapies for localized prostate cancer in the prostate ‑ specific antigen era: a large single‑institution experience with radical prostatectomy and external ‑ beam radiotherapy. J Clin Oncol 2002; 20(16): 3376 – 3385.
50. Kuban DA, Thames HD, Levy LB et al. Long‑term multi‑institutional analysis of stage T1 – T2 prostate cancer treated with radiotherapy in the PSA era. Int J Radiat Oncol Biol Phys 2003; 57(4): 915 – 928.
51. Potters L, Klein EA, Kattan MW et al. Monotherapy for stage T1 – T2 prostate cancer: radical prostatectomy, external beam radiotherapy, or permanent seed implantation. Radiother Oncol 2004; 71(1): 29 – 33.
52. Crouzet S, Rebillard X, Chevallier D et al. Multicentric oncologic outcomes of high‑intensity focused ultrasound for localized prostate cancer in 803 patients. Eur Urol 2010; 58(4): 559 – 566. doi: 10.1016/ j.eururo.2010.06.037.
53. Chaussy CG, Thüroff S. High‑intensive focused ultrasound in localized prostate cancer. J Endourol 2000; 14(3): 293 – 299.
54. Thüroff S, Chaussy C. High‑intensity focused ultrasound: complications and adverse events. Mol Urol 2000; 4(3): 183 – 187.
55. Thüroff S. High‑intensity focused ultrasound for prostate cancer. In: Su LM and Young CS (eds). Early diagnosis and treatment of cancer: prostate cancer. Philadelphia: Elsevier Saunders 2008 : 177 – 192.
56. Thüroff S, Chaussy C, Gelet A. Focused ultrasound (HIFU) in the treatment of prostate cancer. Energy/ efficacy correlation. WCE Congress, 2001. J Endourol 2001; 15 (1 Suppl): S32.
57. Chaussy CG, Thueroff SF. HIFU treatment of locally advanced prostate cancer. J Endourol 2010; 24 (1 Suppl): PS12 – 2.
58. Chaussy C, Thuroff S, Nanieva R. Hormone resistant prostate cancer treated by robotic high intensive ultrasound. J Urol 2010; 183 (Suppl): e262.
59. Chaussy C, Thüroff S, Bergsdorf T. Local recurrence of prostate cancer after curative therapy. HIFU (Ablatherm) as a treatment option. Urologe A 2006; 45(10): 1271 – 1275.
60. Murat FJ, Poissonnier L, Rabilloud M et al. Mid‑term results demonstrate salvage high‑intensity focused ultrasound (HIFU) as an effective and acceptably morbid salvage treatment option for locally radiorecurrent prostate cancer. Eur Urol 2009; 55(3): 640 – 647. doi: 10.1016/ j.eururo.2008.04.091.
61. Berge V, Baco E, Karlsen SJ. A prospective study of salvage high‑intensity focused ultrasound for locally radiorecurrent prostate cancer: early results. Scand J Urol Nephrol 2010; 44(4): 223 – 227. doi: 10.3109/ 00365591003727551.
62. Hayashi M, Shinmei S, Asano K. Transrectal high‑intensity focused ultrasound for treatment for patients with biochemical failure after radical prostatectomy. Int J Urol 2007; 14(11): 1048 – 1050.
63. Marberger M. Prostate cancer 2008. Challenges in diagnostic and management. Europ Urol 2009; 8 (3 Suppl): 1989 – 1996.
64. Van Leeuwen PJ, Connolly D, Tammela TL et al. Balancing the harms and benefits of early detection of prostate cancer. Cancer 2010; 116(20): 4857 – 4865. doi: 10.1002/ cncr.25474.
65. Klotz L. Active surveillance for Prostate Cancer: For whom? J Clin Oncol 2005; 23(32): 8165 – 8169.
66. Roemeling S, Roobol MJ, Kattan MW et al. Nomogram use for the prediction of indolent prostate cancer: impact on screen ‑ detected populations. Cancer 2007; 110(10): 2218 – 2221.
67. Onik G, Barzell W. Transperineal 3D mapping biopsy of the prostate: an essential tool in selecting patients for focal prostate cancer therapy. Urol Oncol 2008; 26(5): 506 – 510. doi: 10.1016/ j.urolonc.2008.03.005.
68. Rouviēre O, Souchon R, Salomir R et al. Transrectal high‑intensity focused ultrasound ablation of prostate cancer: effective treatment requiring accurate imaging. Eur J Radiol 2007; 63(3): 317 – 327.
69. Kirkham AP, Emberton M, Allen C. How good is MRI at detecting and characterising cancer within the prostate? Eur Urol 2006; 50(6): 1163 – 1174.
70. Kim JK, Hong SS, Choi YJ et al. Wash ‑ in rate on the basis of dynamic contrast ‑ enhanced MRI: usefulness for prostate cancer detection and localization. J Magn Reson Imaging 2005; 22(5): 639 – 646.
71. Haider MA, van der Kwast TH, Tanguay J et al. Combined T2 – weighted and diffusion ‑ weighted MRI for localization of prostate cancer. Am J Roentgenol 2007; 189(2): 323 – 328.
72. Uchida T, Illing RO, Cathcart PJ et al. To what extent does the prostate ‑ specific antigen nadir predict subsequent treatment failure after transrectal high‑intensity focused ultrasound therapy for presumed localized adenocarcinoma of the prostate? BJU Int 2006; 98(3): 537 – 539.
73. Wu F, Wang ZB, Lu P et al. Activated anti‑tumor immunity in cancer patients after high intensity focused ultrasound ablation. Ultrasound Med Biol 2004; 30(9): 1217 – 1222.
74. Wu F, Wang ZB, Cao YD et al. Expression of tumor antigens and heat ‑ shock protein 70 in breast cancer cells after high‑intensity focused ultrasound ablation. Ann Surg Oncol 2007; 14(3): 1237 – 1242.
75. Hu Z, Yang XY, Liu Y et al. Investigation of HIFU‑induced anti‑tumor immunity in a murine tumor model. J Transl Med 2007; 5 : 34.
76. Lu P, Zhu XQ, Xu ZL et al. Increased infiltration of activated tumor ‑ infiltrating lymphocytes after high intensity focused ultrasound ablation of human breast cancer. Surgery 2009; 145(3): 286 – 293. doi: 10.1016/ j.surg.2008.10.010.
77. Lee HM, Hong JH, Choi HY. High‑intensity focused ultrasound therapy for clinically localized prostate cancer. Prostate Cancer Prostatic Dis 2006; 9(4): 439 – 443.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2014 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Editorial
- Roboticky asistovaná radikální cystektomie – operační postupy a hodnocení onkologických a funkčních výsledků a výskyt komplikací
- Funkční a onkologické výsledky po radikální cystektomii a vytvoření ortotopické neoveziky u žen
- Techniky LESS a NOTES: minulost, současnost a další vývoj
- Role nefrometrického skóre RENAL v rámci predikce vzniku pseudoaneurysmatu intrarenálních arterií časně po minimálně invazivní parciální resekci ledviny
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Erektilní dysfunkce a její léčba – farmakologický a klinický profil avanafilu
- Guidelines pro léčbu karcinomu prostaty 1. část
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Guidelines pro léčbu karcinomu prostaty 1. část
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



