-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Roboticky asistovaná radikální cystektomie – operační postupy a hodnocení onkologických a funkčních výsledků a výskyt komplikací
Robot – assisted radical cystectomy – surgical principles and evaluation of oncological, functional and complication outcomes
In 2011, the EAU Guidelines were describing robot – assisted radical cystectomy (RARC) as an experimental procedure. Many centers were still in their learning curve and safe conclusions about the safety and efficacy of the procedure could not be drawn. In 2012, RARC was an option, but not proven. But, in 2013, RARC is a feasible and safe operation. It is advocated that RARC, being a highly complex surgery, consisting of multiple steps, should be performed by a devoted team of robotic surgeons, nurses and anesthetists, which are all experienced and have mastered the above steps. Literature data show that RARC trends to be superior in blood loss, hospitalization, and early and late complication rates. Additionally, there seems to be an advantage of the totally intracorporeal technique of urinary diversion compared to the extracorporeal technique. Moreover, recent long‑term oncological results show similar outcomes for RARC to open cystectomy. Until, high‑powered, randomized controlled trials with sufficient follow‑up will be published, open radical cystectomy remains the gold standard. In this review paper, we will describe our technique step by step, providing useful tips and tricks and present an update on multiple outcomes of the operation.
Key words:
robot-assisted radical cystectomy, urinary diversion, oncological and functional results
Autoři: S. I. Tyritzis; N. P. Wiklund
Vyšlo v časopise: Urol List 2014; 12(2): 40-44
Souhrn
EAU Guidelines z roku 2011 klasifikují roboticky asistovanou cystektomii (RARC) jako experimentální operaci. Operatéři v řadě center se nacházeli teprve ve fázi nácviku této techniky, což znemožňovalo vyvodit jednoznačné závěry o její bezpečnosti a účinnosti. V roce 2012 byla RARC klasifikována jako možnost volby, ovšem bez prokázaných výsledků. V roce 2013 již ovšem bylo možné RARC zařadit na seznam ověřených a bezpečných operačních zákroků. Vzhledem k tomu, že se jedná o velmi složitou operaci sestávající z mnoha kroků, je nutné, aby RARC prováděl pouze dobře školený tým operatérů, sester a anesteziologů, kteří mají s touto technikou zkušenosti a ovládají všechny její fáze. Publikované údaje nasvědčují tomu, že RARC je spojena s menší krevní ztrátou, kratší délkou hospitalizace a menším výskytem časných i pozdních komplikací. Dále poskytuje benefit v podobě intrakorporální techniky derivace moči (ve srovnání s extrakorporální). Nejnovější dlouhodobé onkologické výsledky RARC jsou navíc srovnatelné s otevřenou cystektomií. Ovšem dokud nebudeme mít k dispozici kvalitní, randomizované kontrolované studie s dostatečně dlouhým intervalem sledování, zůstává otevřená radikální cystektomie nadále zlatým standardem. Tento přehledový článek detailně popisuje naši techniku (krok za krokem) včetně užitečných tipů a triků a prezentuje aktuální přehled různých výsledných parametrů této operační techniky.
Klíčová slova:
roboticky asistovaná cystektomie, derivace moči, onkologické a funkční výsledkyÚvod
EAU Guidelines z roku 2011 klasifikují roboticky asistovanou cystektomii (RARC) jako experimentální operaci a jako taková byla terčem kritiky. Operatéři v řadě center se nacházeli teprve ve fázi nácviku této techniky, což znemožňovalo vyvodit jednoznačné závěry o její bezpečnosti a účinnosti. V roce 2012 byla RARC klasifikována jako možnost volby, ovšem bez prokázaných výsledků [1]. V roce 2013 již ovšem bylo možné zařadit RARC na seznam ověřených a bezpečných operačních zákroků [2].
V našem přehledovém článku se zaměřujeme na různé aspekty této operace, např. možnost vytvoření ileální neoveziky zcela intrakorporálně. Dále prezentujeme nejnovější onkologické a funkční výsledky a data týkající se výskytu komplikací.
Operační technika
RARC je velmi složitá operační technika sestávající z několika fází, které je nutné přesně dodržovat. S cílem zlepšit operační výsledky a zkrátit délku výkonu se nám po mnoha modifikacích podařilo standardizovat operační techniku. Podrobný popis jednotlivých kroků naší techniky byl uveřejněn v několika publikacích a videoprezentacích [3,4]. Jednotlivé kroky jsou uvedeny v tab. 1.
Tab. 1. Roboticky asistovaná radikální cystektomie (RARC) s vytvořením ortotopické neoveziky „krok za krokem”. 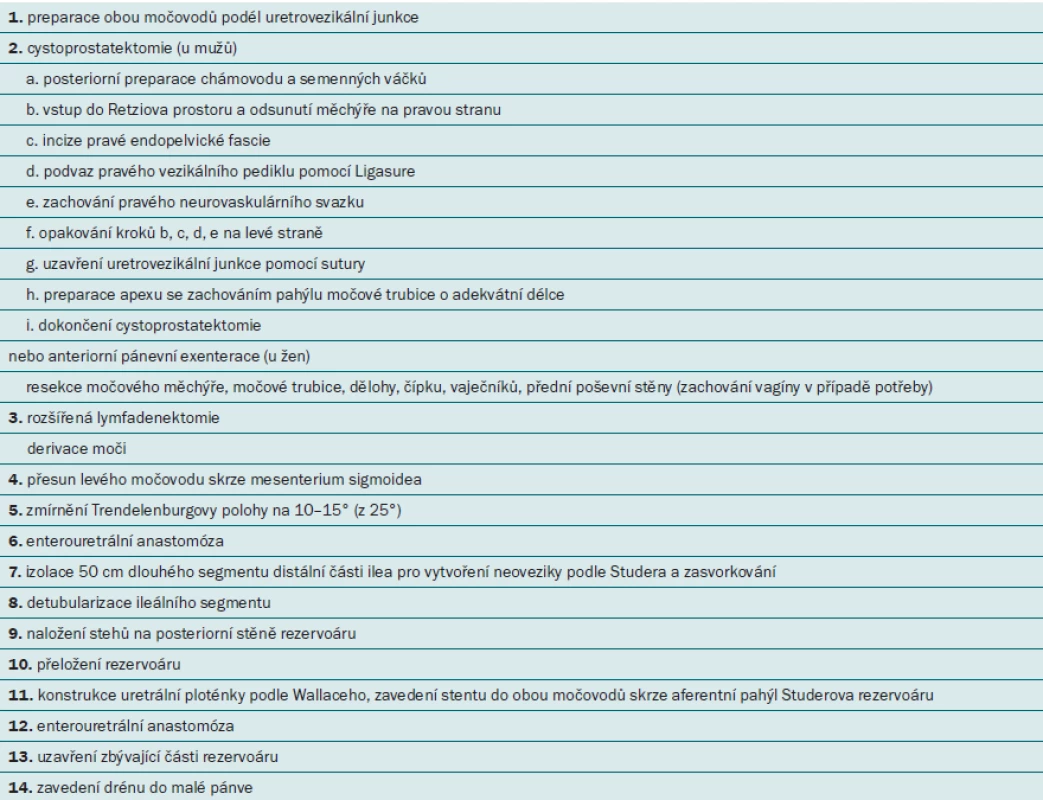
Je nezbytné, aby RARC prováděl pouze dobře školený tým operatérů, sester a anesteziologů, kteří mají s touto technikou zkušenosti a ovládají všechny její fáze. Kromě centralizace provádění tohoto výkonu je vhodnější, aby se na operaci podílely alespoň dva operační týmy – jeden tým bude mít na starosti cystektomii a lymfadenektomii a druhý tým derivaci moči. Tímto způsobem lze potenciálně minimalizovat riziko chybovosti v důsledku únavy operatéra při dlouhotrvajících výkonech, jako je RARC.
Několik tipů a triků:
- Před výkonem není nutné provádět přípravu střeva. Bylo vědecky prokázáno, že v rámci prevence vzniku ileu je vhodné po výkonu dodržovat speciální pooperační protokol [5].
- Během preparace močovodu zachováme periuretrální adventicii, abychom zabránili ischemii.
- Nejprve provedeme anastomózu mezi močovou trubicí a níže uloženým segmentem ilea, protože tak lze anastomózu vytvořit pod menším tahem, a neoveziku můžeme správně umístit do malé pánve. Umístění ileálního segmentu při uretroileální anastomóze může být poměrně náročné, pokud je ileální mezenterium pod tahem. Pro zmírnění většího tahu v anastomóze může operatér provést některý z následujících kroků:
- a) zmírnit Trendelenburgovu polohu,
- b) užít Ligaloops pro napnutí,
- c) preparovat a uvolnit peritoneum překrývající mezenterium,
- d) zasvorkovat mezenterium dále směrem mediálně,
- e) preparovat část ilea kolem ileocekální chlopně.
- Při přesunu levého močovodu pod colon sigmoideum je třeba postupovat velmi opatrně, aby nedošlo k poškození cévních struktur.
- Pro snadnou lokalizaci a manipulaci se doporučuje označit oba močovody pomocí Hem - o - lok® klipu s předpřipravenou Vicrylovou suturou.
- Sutura v posteriorní části rezervoáru vyžaduje speciální pozornost: užívání fixačních stehů celý proces usnadní. Dále by měl operatér dbát na to, aby nedošlo k zapletení stehů se suturou anastomózy k močové trubici. Rovněž je snazší a bezpečnější zahájit suturu od distální části, aby nedošlo k vytvoření nerovnoměrné posteriorní stěny neoveziky podle Studera, což může být velmi obtížné napravit.
- Po vytvoření neoveziky je nutné zkontrolovat případný únik irigační tekutiny. Pro minimalizaci pooperačních komplikací je nezbytné naložení extra stehů pro zajištění vodotěsného uzávěru.
Onkologické výsledky
Stále větší množství onkologických výsledků RARC je podpořeno povzbudivými krátkodobými a střednědobými výsledky.
Hlavní onkologické parametry zahrnují počet lymfatických uzlin, míru výskytu pozitivních chirurgických okrajů a míru přežití (celkovou, specifickou pro karcinom a míru přežití bez recidivy).
Bylo prokázáno, že s ohledem na lymfadenektomii RARC dosahuje srovnatelného výsledku jako otevřená cystektomie. Pomocí robotického systému lze bezpečně a precizně provádět i extrarozšířenou lymfadenektomii. Li et al v nedávné době uveřejnili systematický přehled údajů devíti studií srovnávajících RARC a otevřenou cystektomii. Při hodnocení lymfatických uzlin vypreparovaných u celkem 874 pacientů byl prokázán statisticky významný rozdíl ve prospěch RARC [6].
S ohledem na míru výskytu pozitivních chirurgických okrajů v močové trubici, močovodu a měkkých tkáních dosahovaly oba přístupy srovnatelných výsledků.
Snow - Lisy et al publikovali vlastní výsledky dosažené při RARC a laparoskopické radikální cystektomii (LRC) až po 12 letech sledování, což je soubor dat s dosud nejdelším intervalem sledování [7]. Autoři prezentují přehled onkologických výsledků otevřeného, laparoskopického i robotického přístupu. Míra přežití byla u všech tří přístupů srovnatelná, po pěti letech dosahovala míra přežití specifická pro karcinom přibližně 70 %.
Collins et al publikovali výsledky prvních 113 po sobě jdoucích případů RARC provedených zcela intrakorporálně, které byly provedeny v Karolinska institutu od roku 2003 [4]. Průměrný počet vypreparovaných lymfatických uzlin činil 21 (rozmezí 0 – 57), 20 % pacientů mělo onemocnění ve stadiu pN1. Míra výskytu pozitivních chirurgických okrajů činila 5,3 %. Pacienti byli sledováni po dobu až devíti let, medián činil 25 měsíců (rozmezí 3 – 107 měsíců). Doba přežití specifická pro karcinom (podle Kaplan - Meierovy analýzy) činila 81 % po třech letech a 67 % po pěti letech.
Tab. 2 uvádí přehled komparativních studií (Tyritzis a Wiklund) včetně jediných dvou randomizovaných, kontrolovaných studií (RCT), které však mají malou statistickou sílu [8].
Tab. 2. Přehled onkologických výsledků a míry výskytu komplikací v komparativních studiích. 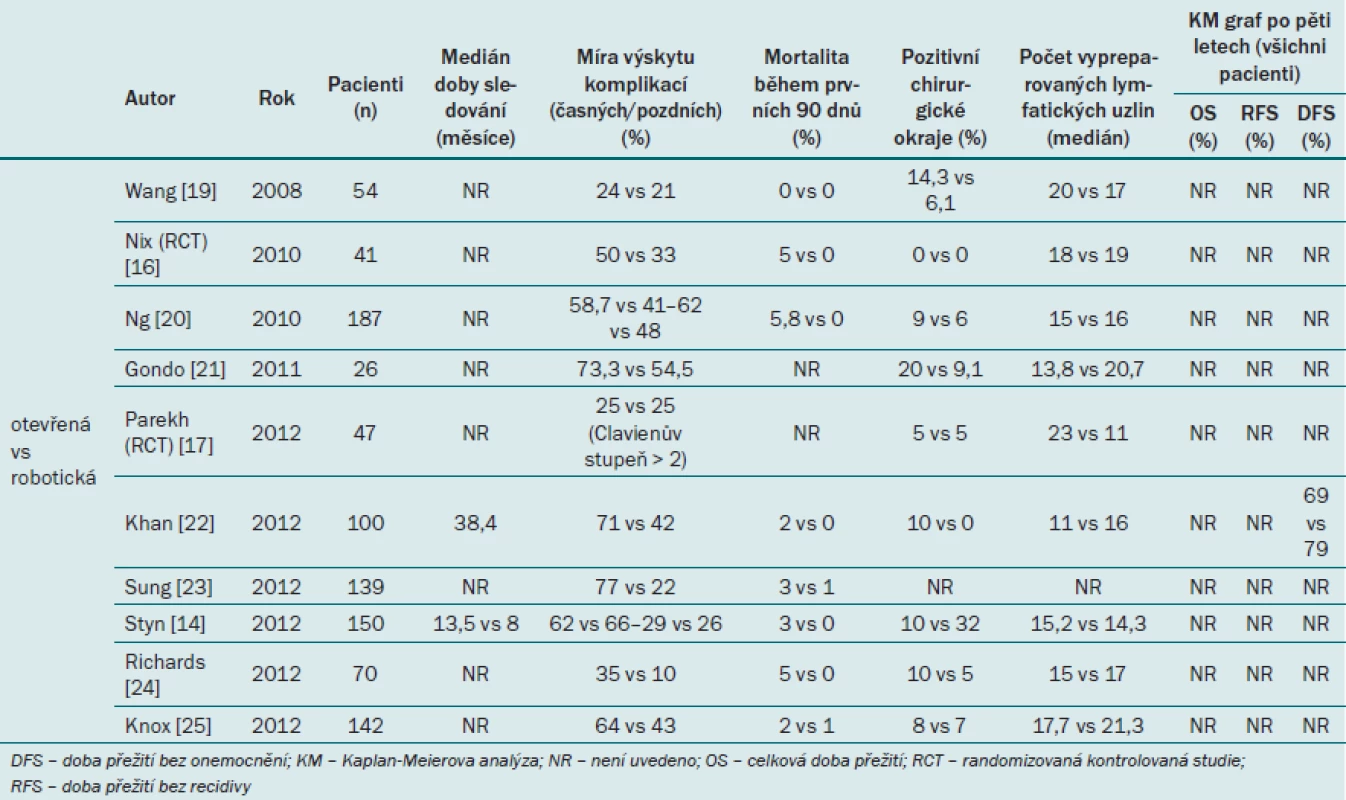
Funkční výsledky
Funkční výsledky mají zásadní význam zejména pro derivaci moči formou neoveziky. K dispozici je pouze omezené množství údajů, funkční výsledky RARC jsou však povzbudivé. Collins et al extrahovali data týkající se denní a noční kontinence a potence po 12 měsících [9]. U pacientů podstupujících nervy šetřící výkon se míra denní kontinence pohybovala v rozmezí 64 – 100 %, míra noční kontinence 17 – 72 % a míra potence činila 81 %. Autoři dokumentu Evropské urologické asociace International Consultation on Bladder Cancer z roku 2012, který hodnotí údaje týkající se derivace moči z let 1970 – 2012, uvádějí, že u pacientů, kteří podstoupí otevřenou radikální cystektomii s vytvořením ortotopické neoveziky, je kontinence během dne dosaženo u 85 – 90 % jedinců a noční kontinence u 60 – 80 % jedinců [10]. Před nedávnem uveřejnil výsledky týkající se kontinence a potence i náš institut [11]. V sérii prvních 70 neovezik bylo 12 měsíců po výkonu kontinentních (definováno jako 0 – 1 vložka/ den) 90 % mužů a 67 % žen. Dvacet šest pacientů (81,2 %) podstupujících nervy šetřící techniku bylo 12 měsíců po výkonu potentních (s aplikací PDE5 i bez nich). V současné době očekáváme výsledky randomizovaných kontrolovaných studií o adekvátní statistické síle.
Komplikace
Shabsigh et al hodnotí 1 142 po sobě jdoucích otevřených cystektomií prováděných v Memorial Sloan Kettering centru. Po 90 dnech se komplikace vyskytly u 64 % pacientů [12]. V této sérii se u 36 % pacientů (n = 407) vyskytly komplikace stupně 0, u 51 % pacientů (n = 582) komplikace stupně 1 – 2 a u 13 % (n = 153) pacientů komplikace stupně 3 – 5. Nejnovější publikace IRCC (International Robotic Cystectomy Consortium) zahrnující rovněž případy z našeho institutu uvádí výskyt komplikací Clavienova stupně 1 – 2 u 29 % pacientů a komplikace stupně 3 – 5 u 19 % pacientů [13]. V odpovídajícím srovnání 50 případů RARC a 100 případů otevřené cystektomie nebyl zaznamenán žádný rozdíl ve výskytu komplikací nízkého/ vysokého stupně podle Clavienovy klasifikace po 30 dnech [14]. Pomocí „US Nationwide Inpatient Sample“ a korekce struktury dat pomocí propensity skóre Yu et al retrospektivně srovnávali RARC a otevřenou cystektomii [15]. Autoři zjistili, že RARC byla spojena s menším výskytem komplikací vyžadujících hospitalizaci než otevřená operace (bez užití jakéhokoli systému pro klasifikaci komplikací). V jediných dvou randomizovaných komparativních studiích (ovšem o nedostatečné statistické síle) srovnávajících RARC vs otevřenou cystektomii bylo zjištěno, že RARC dosahuje srovnatelné nebo nižší míry výskytu časných komplikací [16,17]. A konečně, Li et al v systematickém přehledu komparativních studií prokázali, že RARC je spojena s menším výskytem peroperačních komplikací, menší krevní ztrátou, menší potřebou krevní transfuze a kratší délkou hospitalizace [6].
Intrakorporální vs extrakorporální derivace
Intrakorporální technika byla z obavy ze zvýšení míry výskytu komplikací přijata velmi váhavě. Ve světle nejnovějších údajů publikovaných IRCC [18] však řada center s velkým objemem případů začíná využívat intrakorporální přístup. Multicentrický retrospektivní přehled zahrnuje 167 pacientů, kteří podstoupili RARC s intrakorporální derivací (ileální konduit: 106; neovezika: 61), a 768 pacientů, kteří podstoupili RARC s extrakorporální derivací (ileální konduit: 570; neovezika: 198). Pacienti podstupující výkon s intrakorporální technikou měli menší riziko, že u nich po 90 dnech dojde k výskytu komplikací (32 %) (poměr šancí: 0,68; 95% CI: 0,50 – 0,94; p = 0,02). Limitace tohoto souboru dat však znemožňují stanovit jakékoli definitivní závěry, je tedy nezbytné provedení dalších randomizovaných studií.
Závěr
Dostupné publikace prokazují, že pomocí RARC lze dosáhnout srovnatelných výsledků jako pomocí otevřené radikální cystektomie. RARC jakožto minimálně invazivní technika vykazuje lepší výsledky s ohledem na krevní ztrátu, dobu hospitalizace a míru výskytu časných i pozdních komplikací. Nejnovější dlouhodobé onkologické výsledky RARC jsou navíc srovnatelné s otevřenou cystektomií. Dokud nebudou k dispozici výsledky v současné době probíhajících prospektivních, randomizovaných studií a dlouhodobější onkologické výsledky RARC, zůstává nadále standardním přístupem otevřená operace.
Stavros I. Tyritzis, MD, PhD, FEBU
Department of Molecular Medicine
and Surgery, Section of Urology
Karolinska Institutet
Solna 17176, Sweden
styritzis@gmail.com
Zdroje
1. Stenzl A, Witjes JA, Compérat E et al. Guidelines on bladder cancer muscle - invasive and metastatic. European Association of Urology 2012. Available from: http:/ / www.uroweb.org/ gls/ pdf/ 07_Bladder%20Cancer_LR%20II.pdf.
2. Witjes JA, Compérat E, Cowan NC et al. Guidelines on muscle - invasive and metastatic bladder cancer. European Association of Urology 2013. Available from: http:/ / www.uroweb.org/ gls/ pdf/ 07_Bladder%20Cancer_LRV2.pdf.
3. Tyritzis SI, Hosseini A, Jonsson M et al. Robot - assisted intracorporeal formation of the ileal neobladder. J Endourol 2012; 26(12): 1570 – 1575. doi: 10.1089/ end.2012.0424.
4. Collins JW, Tyritzis S, Nyberg T et al. Robot - assisted radical cystectomy: description of an evolved approach to radical cystectomy. Eur Urol 2013; 64(4): 654 – 663. doi: 10.1016/ j.eururo.2013.05.020.
5. Cerantola Y, Valerio M, Persson B et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: enhanced Recovery After Surgery (ERAS(®)) society recommendations. Clin Nutr 2013; 32(6): 879 – 887. doi: 10.1016/ j.clnu.2013.09.014.
6. Li K, Lin T, Fan X et al. Systematic review and meta‑analysis of comparative studies reporting early outcomes after robot-assisted radical cystectomy versus open radical cystectomy. Cancer Treat Rev 2013; 39(6): 551 – 560. doi: 10.1016/ j.ctrv.2012.11.007.
7. Snow - Lisy DC, Campbell SC, Gill IS et al. Robotic and laparoscopic radical cystectomy for bladder cancer: long‑term oncologic outcomes. Eur Urol 2014; 65(1): 193 – 200. doi: 10.1016/ j.eururo.2013.08.021.
8. Tyritzis SI, Wiklund NP. Robot - assisted radical cystectomy. Comparison of outcomes with open surgery. EUT Congress News 2013; 2 : 15.
9. Collins JW, Wiklund N. Totally intracorporeal robot - assisted radical cystectomy: optimizing total outcomes. BJU Int 2013. doi: 10.1111/ bju.12558.
10. Hautmann RE, Abol - Enein H, Davidsson T et al. ICUD - EAU International Consultation on Bladder Cancer 2012: Urinary diversion. Eur Urol 2013; 63(1): 67 – 80. doi: 10.1016/ j.eururo.2012.08.050.
11. Tyritzis SI, Hosseini A, Collins J et al. Oncologic, functional, and complications outcomes of robot – assisted radical cystectomy with totally intracorporeal neobladder diversion. Eur Urol 2013; 64(5): 734 – 741. doi: 10.1016/ j.eururo.2013.05.050.
12. Shabsigh A, Korets R, Vora KC et al. Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology. Eur Urol 2009; 55(1): 164 – 174. doi: 10.1016/ j.eururo.2008.07.031.
13. Johar RS, Hayn MH, Stegemann AP et al. Complications after robot-assisted radical cystectomy: results from the International Robotic Cystectomy Consortium. Eur Urol 2013; 64(1): 52 – 57. doi: 10.1016/ j.eururo.2013.01.010.
14. Styn NR, Montgomery JS, Wood DP et al. Matched comparison of robotic - assisted and open radical cystectomy. Urology 2012; 79(6): 1303 – 1308. doi: 10.1016/ j.urology.2012.01.055.
15. Yuh BE, Nazmy M, Ruel NH et al. Standardized analysis of frequency and severity of complications after robot - assisted radical cystectomy. Eur Urol 2012; 62(5): 806 – 813. doi: 10.1016/ j.eururo.2012.06.007.
16. Nix J, Smith A, Kurpad R et al. Prospective randomized controlled trial of robotic versus open radical cystectomy for bladder cancer: perioperative and pathologic results. Eur Urol 2010; 57(2): 196 – 201. doi: 10.1016/ j.eururo.2009.10.024.
17. Parekh DJ, Messer J, Fitzgerald J et al. Perioperative outcomes and oncologic efficacy from a pilot prospective randomized clinical trial of open versus robotic assisted radical cystectomy. J Urol 2013; 189(2): 474 – 479. doi: 10.1016/ j.juro.2012.09.077.
18. Ahmed K, Khan SA, Hayn MH et al. Analysis of intracorporeal compared with extracorporeal urinary diversion after robot - assisted radical cystectomy: results from the International Robotic Cystectomy Consortium. Eur Urol 2014; 65(2): 340 – 347. doi: 10.1016/ j.eururo.2013.09.042.
19. Wang GJ, Barocas DA, Raman JD et al. Robotic vs open radical cystectomy: prospective comparison of perioperative outcomes and pathological measures of early oncological efficacy. BJU Int 2008; 101(1): 89 – 93.
20. Ng CK, Kauffman EC, Lee MM et al. A comparison of postoperative complications in open versus robotic cystectomy. Eur Urol 2010; 57(2): 274 – 281. doi: 10.1016/ j.eururo.2009.06.001.
21. Gondo T, Yoshioka K, Nakagami Y et al. Robotic versus open radical cystectomy: prospective comparison of perioperative and pathologic outcomes in Japan. Jpn J Clin Oncol 2012; 42(7): 625 – 631. doi: 10.1093/ jjco/ hys062.
22. Khan MS, Challacombe B, Elhage O et al. A dual – centre, cohort comparison of open, laparoscopic and robotic - assisted radical cystectomy. Int J Clin Pract 2012; 66(7): 656 – 662. doi: 10.1111/ j.1742 ‑ 1241.2011.02888.x.
23. Sung HH, Ahn JS, Seo SI et al. A comparison of early complications between open and robot - assisted radical cystectomy. J Endourol 2012; 26(6): 670 – 675. doi: 10.1089/ end.2011.0372.
24. Richards KA, Kader AK, Otto R et al. Is robot-assisted radical cystectomy justified in the elderly? A comparison of robotic versus open radical cystectomy for bladder cancer in elderly ≥75 years old. J Endourol 2012; 26(10): 1301 – 1306. doi: 10.1089/ end.2012.0035.
25. Knox ML, El - Galley R, Busby JE. Robotic versus open radical cystectomy: identification of patients who benefit from the robotic approach. J Endourol 2013; 27(1): 40 – 44. doi: 10.1089/end.2012.0168.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2014 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Editorial
- Roboticky asistovaná radikální cystektomie – operační postupy a hodnocení onkologických a funkčních výsledků a výskyt komplikací
- Funkční a onkologické výsledky po radikální cystektomii a vytvoření ortotopické neoveziky u žen
- Techniky LESS a NOTES: minulost, současnost a další vývoj
- Role nefrometrického skóre RENAL v rámci predikce vzniku pseudoaneurysmatu intrarenálních arterií časně po minimálně invazivní parciální resekci ledviny
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Erektilní dysfunkce a její léčba – farmakologický a klinický profil avanafilu
- Guidelines pro léčbu karcinomu prostaty 1. část
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
- Karcinom prostaty – od hormonální závislosti po kastračně rezistentní nádor
- Transrektální cílený ultrazvuk o vysoké intenzitě při léčbě lokalizovaného karcinomu prostaty
- Guidelines pro léčbu karcinomu prostaty 1. část
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



