-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chemoterapie u invazivního a metastatického nádoru močového měchýře
CHEMOTHERAPY IN INVASIVE AND METASTATIC BLADDER CANCER
The invasive bladder cancer is an aggressive epithelial tumour. The standard treatment consists of radical cystectomy. Trials of neoajuvant and adjuvant chemotherapy aim at delaying of relapse and improving the chances of curative treatment. Chemotherapy in metastatic bladder cancer patients is based on cisplatin-regimes.
Key words:
invasive bladder cancer, chemotherapy, biological therapy
Autoři: J. Katolická
Působiště autorů: Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
Vyšlo v časopise: Urol List 2011; 9(3): 40-45
Souhrn
Svalovinu infiltrující karcinom močového měchýře je agresivní epiteliální tumor. Standardním postupem léčby je radikální cystektomie. Studie s neoadjuvantní a adjuvantní chemoterapií mají za cíl oddálit relaps onemocnění a zvýšit možnost vyléčení pacienta. Léčba metastatického karcinomu močového měchýře je založena na aplikaci režimů s cisplatinou.
Klíčová slova:
invazivní karcinom močového měchýře, chemoterapie, biologická léčbaNEOADJUVANTNÍ CHEMOTERAPIE
Standardním postupem u pacientů s lokalizovaným, svalovinu infiltrujícím karcinomem močového měchýře je radikální cystektomie s derivací moči. Část pacientů má riziko vzniku vzdálených metastáz a také lokoregionální recidivy. Multi-modální přístup ve formě neoadjuvantní nebo adjuvantní chemoterapie byl hodnocen v randomizovaných trialech a může být použit ke snížení počtu relapsů, a zvýšit tak možnost vyléčení pacienta [1]. U pacientů se svalovinu infiltrujícím karcinomem močového měchýře je nejdůležitější identifikovat jak nemocné, kteří mohou být radikální cystektomií vyléčeni, tak nemocné, kteří mají vysoké riziko lokální rekurence nebo vzniku metastáz. I přes radikální operaci se přibližně u poloviny těchto nemocných do dvou let objeví vzdálené metastázy [2]. Podání systémové chemoterapie založené na cisplatině aplikované před radikální cystektomii (neoadjuvantně) nebo po ní (adjuvantně) má potenciál eradikovat mikrometastázy a může prodloužit přežití takto léčených nemocných. Proto je, zejména předoperační podání chemoterapie, mnohými doporučováno jako nový standard léčby invazivního karcinomu močového měchýře. Aplikace chemoterapie neoadjuvantně má několik výhod: intaktní vaskularizaci, která je často operací změněná, s lepším průnikem chemoterapie, je také předpoklad zmenšení primárního tumoru s možností větší radikality operačního výkonu, a tím navození delší remise a/nebo prodloužení přežití takto léčených nemocných. Pacienti mají často lepší toleranci chemoterapie předoperačně než pooperačně [3]. Určitou nevýhodou tohoto postupu je možnost oddálení definitivní lokální terapie, a tím progrese onemocnění. Výsledky několika randomizovaných studií [4–8] a metaanalýza [9] všech trialů s neoadjuvantní chemoterapií u invazivního karcinomu močového měchýře favorizují kombinaci chemoterapie založené na cisplatině v kombinaci s radikální cystektomií před cystektomií samotnou (tab. 1).
Tab. 1. Výsledky randomizovaných klinických trialů s neoadjuvantní chemoterapií u svalovinu infiltrujícího karcinomu močového měchýře. 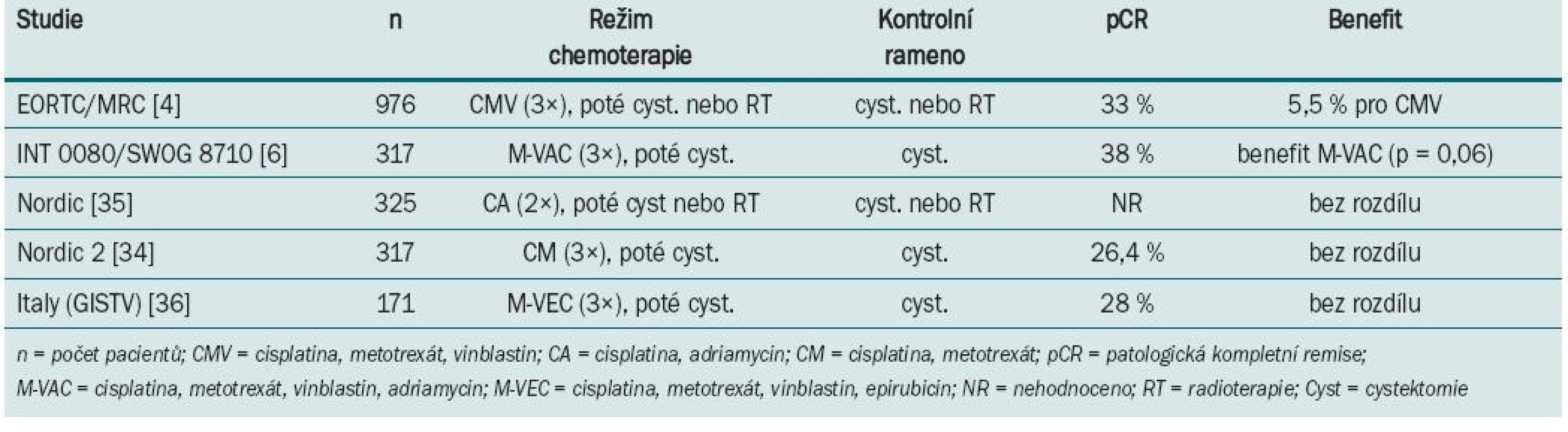
Největší studie s neoadjuvantním podáním chemoterapie (BA0630894) zařadila celkem 976 pacientů s T2–T4 uroteliálním karcinomem grade 3,4, kteří byli v 106 centrech randomizováni v průběhu 5,5 roku do ramene s chemoterapií režimem s cisplatinou, metotrexátem a vinblastinem (CMV) a do ramene bez chemoterapie [4]. Následně podle zvyklostí centra byla provedena radikální cystektomie a/nebo radioterapie. U 42 % pacientů s chemo-terapií a 43 % bez chemoterapie byla jako definitivní řešení zvolena radioterapie. Patologické kompletní remise bylo dosaženo u 33 % nemocných léčených chemoterapií s neoadjuvantním záměrem. Celkové přežití podobu tří let bylo 55 vs 50 % s absolutním benefitem přežití 5 %, který favorizuje rameno s chemoterapií. Poslední aktualizace po osmi letech sledování prokázala signifikantní 16% redukci rizika úmrtí u pacientů, kteří podstoupili neoadjuvantní chemoterapii CMV před radioterapií a/nebo cystektomií; to odpovídá nárůstu tříletého přežití z 50 na 56 %, zvyšuje možnost desetiletého přežití z 30 na 36 % a zvyšuje medián přežití o sedm měsíců (z 37 na 44 měsíců) u pacientů léčených kombinací CMV ve srovnání s těmi, kteří byli léčení pouze lokální terapií [10]. V trialu US Intergroup (INT 0080) bylo 307 z 317 zařazených pacientů s T2–T4a uroteliálním karcino-mem randomizováno do ramene s třemi cykly neoadjuvantní chemoterapie M-VAC (n = 154) před cystektomií nebo ramene bez chemoterapie (n = 153) pouze s cystektomií [6]. Studie trvala celkem 13 let. Patologické kompletní remise (pCR) bylo po neoadjuvantní chemoterapii dosaženo v 38 %. Medián sledování byl 8,7 let. Pacienti léčení chemoterapií měli tendenci zlepšení mediánu celkového přežití (77 vs 46 měsíců, p = 0,06). Následná retrospektivní analýza ukázala, že delší přežití (> 80 % v pěti letech) bylo spojeno nejen s podáním chemoterapie, ale také patologickým hodnocením a technickým provedením cystektomie, zejména nepřítomností pozitivních okrajů a disekcí pelvických lymfatických uzlin, kdy bylo v resekátu minimálně deset lymfatických uzlin. Randomizované klinické trialy NORDIC a GISTV neprokázaly benefit v prodloužení přežití u nemocných léčených chemoterapií.
Některé z randomizovaných klinických studií neprokázaly benefit v prodloužení přežití po podání neoadjuvantní chemo-terapie. Neadekvátní velikost vzorku, suboptimální chemoterapie, předčasné ukončení a/nebo neadekvátní sledování byly často atributy negativních výsledků. Aktualizace přehledů a metaanalýz klinických trialů byla publikována Advanced Bladder Cancer meta-analysis collaboration [9]. U pacientů, kteří byli před cystektomií léčeni chemoterapií založené na cisplatině, byl prokázán 5% absolutní benefit prodloužení přežití (p = 0,003). Data o kvalitě života nebo toxicitě různých chemoterapeutických režimů v neoadjuvantním podání nejsou dostatečně zpracována. Většina pacientů ve studiích EORTC/MRC, INT 0080 a Nordic studiích byli mladší nemocní, s mediánem věku 63–65 let, ve výborném klinickém stavu, s dobrými renálními funkcemi, což neodpovídá běžně léčené, především starší populaci s řadou interkurentních nemocí. Standardně používaný chemoterapeutický režim gemcitabin s cisplatinou používaný u metastatického karcinomu [12] nebyl prospektivně hodnocen v neoadjuvantním podání. Retrospektivní studie Dashe [13] prokázala pCR u 26 %, což je srovnatelné s ostatními režimy založenými na cisplatině. Pro pacienty, u kterých je cisplatina kontraindikována, může být přínosem v neoadjuvantním podání léčba paclitaxelem v kombinaci s gemcitabinem a carboplatinou. Studie fáze II [14] u pacientů s T2–T4, N0 nebo různé T, N1–3 byla prokázána pCR v 30 %. Problémem je ale toxicita, kdy byla pozorována neutropenie G III–IV u každého takto léčeného nemocného. Studie s akcelerovaným MVAC režimem podávaným v čtrnáctidenním intervalu za podpory růstových faktorů prokázala efekt chemoterapie a minimální oddálení definitivního řešení [15]. Plný počet cyklů chemoterapie absolvovalo 84 % léčených, u všech 80 nemocných proběhla plánovaná definitivní terapie (60 radikálních cystektomií, 20 radioterapií). pCR bylo dosaženo u 43 % pacientů a objektivní radiologické odpovědi bylo dosaženo u 75 % léčených. Toxicita minimálně G 3 byla u 11 % nemocných. Tento dobře tolerovatelný režim s dobrou odpovědí by vyžadoval další, především randomizované, studie. V současnosti probíhá několik studií s biologickou léčbou (tab. 2).
Tab. 2. Probíhající studie s neoadjuvantní chemoterapií u invazivního karcinomu močového měchýře. 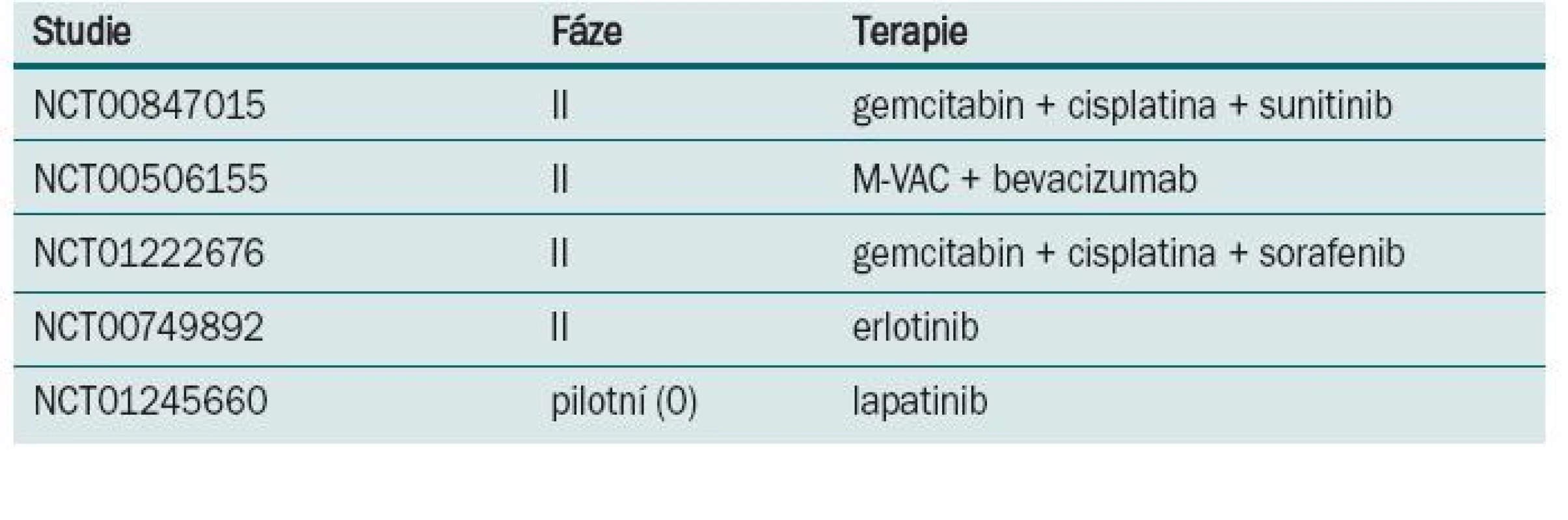
Primárním cílem léčby invazivního karcinomu močového měchýře je léčba s kurativním záměrem, šetření močového měchýře je druhořadé. Orgán šetřící postup je preferován především u starších nemocných s řadou přidružených nemocí a rizikem chirurgického výkonu. Dosažení kompletní remise a zachování močového měchýře je jedna z možných výhod předoperačního podání chemoterapie. Ne-randomizovaná studie se 111 pacienty, s T2–T3 N0 M0 uroteliálním karcinomem léčenými režimem M-VAC v neoadjuvantním podání prokázala stejné desetileté přežití jak ve skupině s radikální cystektomií, kde přežívalo 65 % odléčených, tak ve skupině s transuretrální resekcí nebo parciální cystektomií, kde přežívalo 75 % nemocných [16]. Studie Stenbergové [17] na 104 pacientech s T2–T4 uroteliálním karcinomem léčených M-VAC chemoterapií v neoadjuvanci, kde u 65 nemocných byl podle klinického hodnocení odpovědi na chemoterapii zachován močový měchýř (TURBT nebo parciální cystektomie). U 39 nemocných byla provedena radikálnícystektomie – beze změny. V hodnocení pětiletého přežití ve skupině se zachovaným močovým měchýřem přežívalo 67 % pacientů, ve skupině s radikální cystektomií 46 %. Na základě těchto výsledků při dosažení regrese primárního tumoru po neoadjuvantní chemoterapii je možné uvažovat o parciálním výkonu nebo zachování močového měchýře, ale s rizikem metachronního karcinomu a vědomím, že se nejedná o kurativní výkon.
CHEMOTERAPIE METASTATICKÉHO KARCINOMU MOČOVÉHO MĚCHÝŘE
První linie léčby
Standardním postupem v léčbě inoperabilního lokálně pokročilého nebo metastatického karcinomu je chemoterapie. Chemoterapeutické režimy založené na cisplatině u uroteliálního karcinomu močového měchýře dosahují vysokých odpovědí, ale medián přežití se i přes agresivní terapii pohybuje kolem 15 měsíců.
Režim M-VAC v nerandomizovaném klinickém trialu [18] prokázal regresi tumoru u 72 % nemocných, z toho v 36 % bylo dosaženo kompletní remise. Po dobu tří let přežívalo 55 % léčených, kteří této kompletní remise dosáhli. Následně byl M-VAC srovnáván s monoterapií/cisplatinou v prospektivní randomizované studii [19]. Režimem M-VAC nebo cisplatinou v 28denním intervalu bylo léčeno do progrese nebo maximálně šesti cykly 269 nemocných. M-VAC byl spojen s vysokou toxicitou, zejména leukopenií, mukositidou, febrilní neutropenií a také úmrtím spojeným s léčbou. Procento dosažených odpovědí, doba do progrese i celkové přežití bylo u kombinace M-VAC ve srovnání s monoterapií cisplatinou vyšší (39 vs 12 %, 10,0 vs 4,3 měsíce, 12,5 vs 8,2 měsíce). Další randomizovaný trial [20] srovnával M-VAC s režimem CISCA (cisplatina, cyklofosfamid a doxorubicin). Léčbou M-VAC bylo dosaženo vyšší procento odpovědí (65 vs 45 %) a také delší přežití (48 vs 36 týdnů) ve srovnání s léčbou kombinací CISCA. M-VAC byl v randomizovaném trialu EORTC fáze III (protokol #30924) srovnáván ve standardním dávkovacím režimu a ve vysokodávkovaném režimu [21]. Pacienti byli randomizováni do ramene s high-dose M-VAC podávaným každé dva týdny s podporou růstových faktorů a do ramene se standardním dávkováním podávaným každé čtyři týdny. Bylo dosaženo rozdílů v počtu objektivních odpovědí (63 vs 50 %), kompletních remisí (21 vs 9 %), doby do progrese (9,1 vs 8,2 měsíce), ale nebylo dosaženo rozdílu v celkovém přežití, které bylo stanoveno jako primární cíl (15,5 vs 14,1 měsíce). V následné revizi po sedmi letech sledování prokázal high-dose M-VAC signifikantní redukci rizika úmrtí v pětiletém sledování (21,8 vs 13,5 %; hazard ratio = 0,76). Toxicita byla vyšší v rameni s M-VAC. Na základě této studie byl high-dose M-VAC zaveden v řadě center jako standardní terapeutický režim. Ve studiích fáze II prokázal gemcitabin v kombinaci s cisplatinou odpověď v 50 % s mediánem přežití 14 měsíců. Na základě těchto výsledků byla provedena randomizovaná studie fáze III na 405 pacientech srovnávající čtyřkombinaci M-VAC s dvojkombinací gemcitabin/cisplatina [22]. Chemoterapie byla aplikována každé čtyři týdny s maximem do šesti cyklů. Většího počtu podaných cyklů za menší toxicity bylo dosaženo v dvojkombinačním režimu. Počet odpovědí (49 vs 46 %), doba do progrese (7,4 vs 7,4 měsíce) i celkové přežití (13,8 vs 14,8 měsíce) bylo v obou ramenech stejné. Bezpečnostní profil byl ale jednoznačně lepší pro rameno s gemcitabinem. Tyto výsledky posunuly kombinaci gemcitabin/cisplatina na místo standardního režimu pro pokročilý uroteliální karcinom močového měchýře. U metastatického karcinomu močového měchýře proběhla celá řada studií s taxany. V trialu EORTC fáze III (protokol #30987) byl ke kombinaci gemcitabin/cisplatina přidán paclitaxel. V tripletu sice bylo dosaženo vyššího počtu objektivních odpovědí (57 vs 46 %) a kompletních remisí (15 vs 10 %), ale statisticky signifikantního rozdílu v celkovém přežití dosaženo nebylo (15,7 vs 12,8 měsíce) [23]. Kombinace docetaxel/cisplatina byla srovnávaná s režimem M-VAC ve studii fáze III Hellenic Co-operative Oncology Group [24]. Ve všech sledovaných parametrech – odpověď na léčbu, doba do progrese, doba přežití – bylo v rameni s M-VAC dosaženo lepších výsledků. Studie EORTC (protokol #30986) srovnávala gemcitabin s carboplatinou s metotrexátem, carboplatinou a vinblastinem (M-CAVI) u pacientů s pokročilým karcinomem močového měchýře, kteří pro renální dysfunkci nebo komorbidity nemohou být léčení cisplatinou. Zařazeno bylo 178 nemocných, objektivních odpovědí v rameni s gemcitabinem a carboplatinou bylo dosaženo u 42 % léčených a u kombinace M-CAVI u 30 %. Carboplatina je variantou pro pacienty s kontraindikacemi cisplatiny, studie také ukázala, že věk není kontraindikací pro podání cisplatiny [25]. S lepším a hlubším poznáním biologie tumorů a cest regulace nádorového růstu např. VEGFR, EGFR, mTOR je i u karcinomu močového měchýře testována biologická léčba. Probíhá celá řada studií s biologickou léčbou v I. linii terapie metastatického karcinomu močového měchýře (tab. 3).
Tab. 3. Probíhající klinické studie s biologickou léčbou v I. linii léčby metastatického karcinomu močového měchýře. 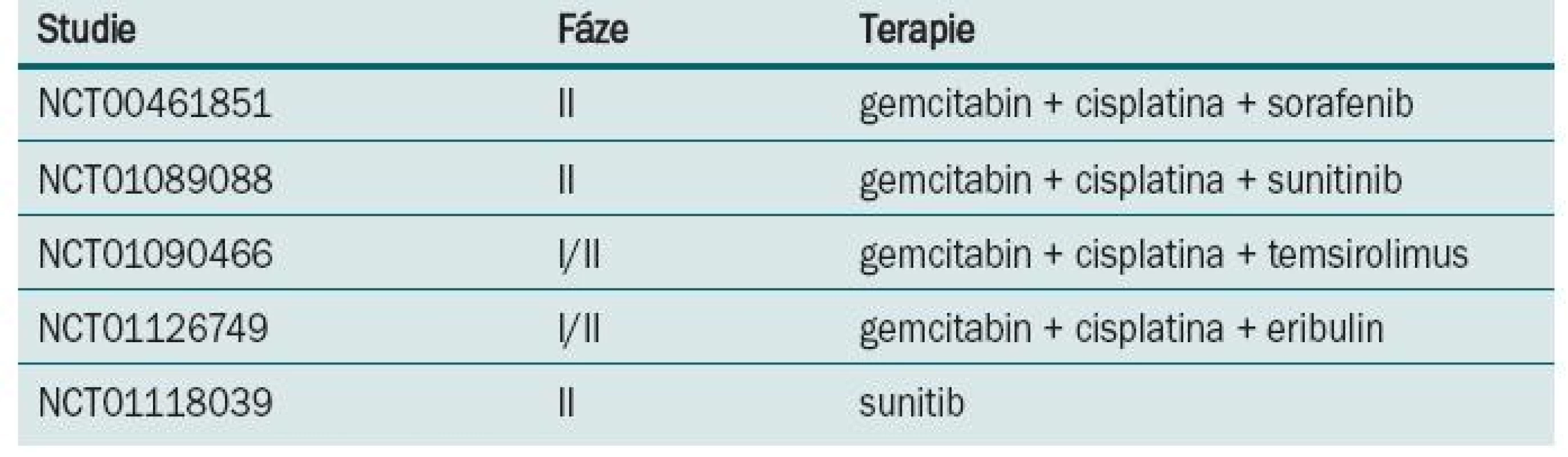
Bevacizumab ve studii fáze II Hoosier Oncology Group (GU 04-75) byl aplikován současně s gemcitabinem a cisplatinou v dávce 15 mg/kg každé tři týdny, u 72 % léčených bylo dosaženo objektivní odpovědi, kompletní remise bylo dosaženo u 21 % pacientů, doba bez progrese onemocnění byla 8,2 měsíce a celková doba přežití 20,4 měsíce. V současné době probíhá velká studie fáze III [26]. Pozitivita HER-2 neu pacientů s uroteliálním karcinomem močového měchýře je velmi variabilní, a to 8,5–81 %. Ve studii fáze II, kde byl trastuzumab u HER-2 neu pozitivních pacientů kombinován s paclitaxelem, carboplatinou a gemcitabinem, bylo u 70 % léčených dosaženo objektivní odpovědi, doba do progrese byla 9,3 měsíců a medián přežití 14,1 měsíců. I když jsou tyto výsledky u HER-2 neu pozitivních pacientů velmi slibné, není prozatím u uroteliálního karcinomu močového měchýře testování HER-2 neu exprese standardem [27].
Druhá linie léčby
Definovat standardní režim pro II. linii léčby uroteliálního karcinomu močového měchýře je velmi složité. Souvisí to především s kondicí pacientů, u kterých je po první linii prokázaná progrese onemocnění. Je poměrně těžké zařadit do klinické studie pro II. linii pacienta a po celou dobu studie ho v ní udržet. Monoterapie s paclitaxelem, ifosfamidem, docetaxelem prokázaly 20% a menší odpověď. Kombinační režimy např. gemcitabin s paclitaxelem a oxaliplatina s fluorouracilem (FOLFOX) demonstrovaly odpovědi od 20–27 % se signifikantní hematologickou toxicitou a periferní neuropatií. Pro druhou linii léčby uroteliálního karcinomu močového měchýře zatím není definován standardní režim.
Vinflunin, vinca alkaloid třetí generace, byl testován v druhé linii léčby u relabujícího nebo refrakterního pokročilého uroteliálního karcinomu močového měchýře po předchozí léčbě založené na cisplatině ve studii fáze III [28]. Trial srovnával léčbu vinfluninem v kombinaci s nejlepší podpůrnou léčbou (BSC) vs BSC. Celkem 370 pacientů bylo randomizováno do ramene vinflunin plus podpůrná léčba a do ramene pouze s podpůrnou léčbou v poměru 2 : 1. V rameni s vinfluninem se z hlediska toxicity G > 3 nejvíce objevila neutropenie (50 %), febrilní neutropenie (6 %), anémie (19 %), únava (19 %) a zácpa (16 %). Pacienti léčení kombinací vinflunin + BSC přežívali 6,9 měsíce, nemocní léčení pouze BSC 4,6 měsíce, tento dvouměsíční rozdíl ale nebyl statisticky signifikantní (p = 0,287). Následná Cox analýza hodnotící i prognostické faktory prokázala statisticky signifikantní efekt vinfluninu na celkové přežití (p = 0,036) a redukci rizika úmrtí o 23 %. Procento objektivních odpovědí (8,6 vs 0 %), procento kontroly nemoci (41,4 vs 24,8 %) a doba do progrese onemocnění (3,0 vs 1,5 měsíce) byly také statisticky signifikantní ve prospěch vinfluninu. Pokud vezmeme v úvahu ještě k tomu dobrý bezpečností profil vinfluninu, můžeme ho doporučit do druhé linie léčby uroteliálního karcinomu po selhání nebo intoleranci cisplatiny v první linii. Německá studie fáze III srovnávala krátkodobou terapii (maximálně šest cyklů chemoterapie po 21 dnech) a dlouhodobou terapii (léčba do progrese onemocnění) v kombinaci paclitaxel plus gemcitabin v druhé linii léčby u metastatického uroteliálního karcinomu po selhání prvoliniové terapie založené na cisplatině [29]. Výsledky neprokázaly rozdíl v celkovém přežití (7,8 vs 8,0 měsíce), době do progrese (4 vs 3,1 měsíce) ani počtu objektivních odpovědí (37,5 vs 41,5 %). Větší počet anémií (26 vs 6,7 %) se vyskytoval v rameni s dlouhodobou léčbou. Účinnost pemetrexedu byla hodnocena v druhé linii léčby studií Hoosier Oncology Group [30]. Objektivních odpovědí bylo 27,7 %, doba do progrese 2,9 měsíce a doba přežití 9,6 měsíce. Vzhledem k roli VEGFR a EGFR na růst a progresi uroteliálního karcinomu probíhá celá řada klinických studií s cílenou léčbou jako sunitinib (multikinázový TKi), everolimus (mTOR inhibitor), dále lapatinib (HER-2 a EGFR TKi), erlotinib (HER-1 a HER-2 TKi) a jiné.
ADJUVANTNÍ CHEMOTERAPIE
Podání adjuvantní chemoterapie má podobně jako aplikace neoadjuvantní chemoterapie řadu otazníků. Je zde několik randomizovaných trialů, kterým jsou ale vyčítány chyby ve statistickém hodnocení, designu a také hodnocení velikosti a biologické aktivity tumoru. Systematická metaanalýza jednotlivých pacientských dat z adjuvantních studií byla publikována v roce 2005 [31]. Výsledky založené na hodnocení 491 nemocných léčených v těchto trialech reprezentují 90 % všech nemocných randomizovaných do trialů založených na cisplatině a 66 % nemocných ze všech hodnocených studií. Výsledkem je 25% redukce rizika úmrtí pro ramena s chemoterapií ve srovnání s rameny s kontrolami, s celkovým hazard ratio pro přežití 0,75 (p = 0,019), což nepředstavuje spolehlivý základ pro adjuvantní léčbu. Italská studie fáze III pro pacienty s pT2G3, pT3–4, N0–2 po radikální cystektomii, kteří byli randomizováni do ramene se čtyřmi cykly gemcitabin plus cisplatina a do ramene se sledováním v mediánu follow-up 32,5 měsíce, prokázala stejné procento relapsů (43 vs 45 %) bez rozdílu v době do progrese onemocnění. V rameni s chemoterapií po dobu tří let přežívalo 67 % léčených, v rameni se sledováním 48 %. Tříletá doba bez progrese onemocnění byla zaznamenána u 47 % pacientů, resp. 35 %. Adjuvantní terapie tedy nepřinesla výraznější benefit [32]. Randomizovaná studie fáze III Spanish Oncology Genitourinary Group trial 99/01 sledovala pacienty s vysoce rizikovým, svalovinu infiltrujícím karcinomem močového měchýře s pT3–4 a/nebo N+, kde v jednom rameni byli léčeni čtyřmi cykly kombinace paclitaxel, gemcitabin a cisplatina nebo v druhém rameni pouze sledováni [33]. V mediánu sledování po dobu 51 měsíců byl zaznamenán statisticky významný rozdíl v celkovém přežití. Pět let přežívalo 60 % nemocných léčených chemoterapií a 31 % pouze sledovaných. Ve skupině s chemoterapií byla také delší doba do progrese, delší doba přežití bez příznaků onemocnění a také delší přežití v závislosti na nádorovém onemocnění. Velké studie jako EORTC trial (protokol #30994) a studie Cancer and Leukemie Group B byly předčasně ukončeny.
Na základě výsledků starších studií, metaanalýz a moderních klinických trialů není jasně definováno doporučení pro adjuvantní chemoterapii u uroteliálního karcinomu močového měchýře. Pacienti s pT2, N0 by po radikální cystektomii měli být pouze sledováni, u pacientů s pT3–4 a/nebo N+ by po radikální cystektomii měla následovat chemoterapie čtyřmi cykly M-VAC nebo gemcitabin/cisplatina [1].
CHEMOTERAPIE JINÝCH HISTOLOGICKÝCH TYPŮ NÁDORŮ MOČOVÉHO MĚCHÝŘE
Spinocelulární karcinom močového měchýře je v západních zemích diagnostikován v 3–5 %. U metastatického karcinomu je možné použít režim s cisplatinou nebo carboplatinou, gemcitabinem, paclitaxelem [37]. Adenokarcinomy jsou diagnostikovány v 0,5–2 % všech typů malignity močového měchýře. Chemoterapie je velmi individuální konvenční léčba, např. režim M-VAC nepřináší benefit [38]. Primární malobuněčný nebo neuroendokrinní karcinom močového měchýře je velmi agresivní. Jeho léčba je vedena podobně jako léčba malobuněčných plicních karcinomů [39]. U diseminovaných sarkomů je možné použít doxorubicin a ifosfamid. Gemcitabin s cisplatinou je doporučován v léčbě pacientů s metastatickým sarkomatoidním karcinomem [1].
MUDr. Jana Katolická, Ph.D.
Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
jkatolicka@tiscali.cz
Zdroje
1. Vishnu P, Mathew J, Tan WW. Current therapeutic strategies for invasive and metastatic bladder cancer. Onco Targets and Therapy 2011; 4 : 97–113.
2. Raghavan D, Shipley WU, Garnick MMB et al. Biology and management of bladder cancer. N Engl J Med 1990; 322(16): 1129–1138.
3. Teramukai S, Nishiyama H, Matsui Y et al. Evaluation for surrogacy of end points by using data from observational studies: tumor downstaging for evaluating neoadjuvant chemotherapy in invasive bladder cancer. Clin Cancer Res 2006; 12(1): 139–143.
4. Neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy formuscle-invasive bladder cancer: a randomised controlled trial. International collaboration of trialists. Lancet 1999; 354(9178): 533–540.
5. Sherif A, Rintala E, Mestad O et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer – Nordic cystectomy trial 2. Scand J Urol Nephrol 2002; 36(6): 419–425.
6. Grossman HB, Natale RB, Tangen CM et al. Neoadjuvant chemotherapy plus cystectomycomparedwithcystectomyaloneforlocallyadvancedbladdercancer. N Engl J Med 2003; 349(9): 859–866.
7. Malstrom PU, Rintala E, Wahlquist R et al. Five-year follow up of prospective trial of radical cystectomy and neoadjuvant chemotherapy: nordic cystectomy trial 1. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155(6): 1903–1906.
8. Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: a randomized prospective clinical trial. American Society of Clinical Oncology Annual Meeting. 1995. Philadelphia, PA.
9. Vale CL. Meta-analysis Group MCTU, London, UK. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005; 48(2): 202–205; discussion 205–206.
10. Griffiths G, trialists. OboIco. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastin chemotherapy for muscle-invasive bladder cancer: long term results of the BA06 30894 Trial. J Clin Oncol 2011. doi: 10.1200/JCO.2010. 32.3139
11. Herr HW, Faulkner JR, Grossman HB et al. Surgical factors influence bladder cancer outcomes: a cooperative group report. J Clin Oncol 2004; 22(14): 2781–2789.
12. von der Maase H, Hansen SW, Roberts JT et al. Gemcitabin and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advance dormetastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068–3077.
13. Dash A, Pettus JA, Bochner BH et al. Efficacy of neoadjuvant gemcitabine plus cisplatine (GC) in muscle-invasive urothelial cancer (UC). American Society of Clinical Oncology Annual Meeting 2007; Chicago, IL.
14. Smith DC, Grivas P, Daignault S et al. A phase II trial ofneoadjuvant ABI-007, carboplatine and gemcitabine (ACG) in patients with localy advanced carcinoma of bladder. American Society of Clinical Oncology Genitourinary cancer symposium; 2011, Orlando, FL.
15. Blick C, Hall P, Pwint T et al. Accelerated MVAC as neoadjuvant chemotherapy for patients with muscle-invasive transitional cell carcinoma of bladder. American Society of Clinical Oncology Genitourinary cancer symposium; 2011, Orlando, FL.
16. Herr HW, Bajorin DF, Scher HI. Neoadjuvant chemotherapy and bladder-sparing surgery for invasive bladder cancer: ten-year outcome. J Clin Oncol 1998; 16(4): 1298–1301.
17. Stenberg CN, Pansadoro V, Calabro F et al. Can patients election for bladder preservation be based on response to chemotherapy? Cancer 2003; 97(7): 1644–1652.
18. Sternberg CN, Yagoda A, Scher HI et al. Methotrexate, vinblastine, doxorubicin and cisplatin for advanced transitional cell carcinoma of the urothelium. Efficacy and patterns of response and relapse. Cancer 1989; 64(12): 2448–2458.
19. Loehrer PJ Sr., Einhorn LH, Elson PJ et al. A randomized comparison of cisplatina loneor in combination with methotrexate, vinblastine and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study. J Clin Oncol 1992; 10(7): 1066–1073.
20. Logothetis CJ, Dexeus FH, Finn L et al. A prospective randomized trial comparing MVAC and CISCA chemotherapy for patients with metastatic urotelial tumors. J Clin Oncol1990; 8(6): 1050–1055.
21. Sternberg CN, de Mulder PH, Schornagel JH et al. Randomized phase III trial of high-dose-intensity methotrexate, vinblastine, doxorubicin and cisplatin (MVAC) chemotherapy and recombinant human granulocyte colony-stimulating factor versus classic MVAC in advanced urothelial tract tumors: European Organization for Research and Treatment of Cancerprotocol no. 30924. J Clin Oncol 2001; 19(10): 2638–2646.
22. von der Maase H, Hansen SW, Roberts JT et al. Gemcitabine and cisplatine versus methotrexate, vinblastine, doxorubicin and cisplatin in advanced ormetastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068–3077.
23. Bellmunt J, von der Maase H, Mead GM et al. Randomized phase III study comparing paclitaxel/cisplatine/gemcitabine (PCG) and gemcitabine/ /cisplatin (GC) in patients with locally advanced (LA) ormetastatic (M) urothelial cancer without prior systemic therapy. American Society of Clinical Oncology Annual Meeting 2007; Chicago, IL.
24. Bamias A, Aravantinos G, Deliveliotis C et al. Docetaxel and cisplatinwith granulocyte colony-stimulating factor (G-CSF) versus MVAC with G-CSF in advanced urothelial carcinoma: a multicenter, randomized phase III study from Helenic Cooperative Oncology Group. J Clin Oncol 2004; 22(2): 220–228.
25. Dreicer R, Manola J, Roth BJ et al. Phase III trial methotrexate, vinblastine, doxorubicin and cisplatin versus carboplatin and paclitaxel in patients with advanced carcinoma of urotelium. Cancer 2004; 100(8): 1639–1645.
26. Hahn NM, Stadler WM, Zon R et al. Mature results from Hoosier Oncology Group GU 04–75 phase II trial ofcisplatin (C), gemcitabine (G) and bevacizumab (B) as first-line chemotherapy for metastatic urothelial carcinoma (UC). American Socienty of Clinical Oncology Annual Meeting:2010. Chicago, IL.
27. Hussain RS, Vaishampayan U, Du W et al. Combination paclitaxel, carboplatin, and gemcitabineisan active treatment for advanced urothelial cancer. J ClinOncol 2001; 19(9): 2527–2533.
28. Bellmunt J, Theodore C, Demkov Z et al. Phase III trial of vinflunine plus best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J ClinOncol 2009; 27(27): 4454–4461.
29. Albers P, Park SI, Niegisch G et al. Randomized phase III trial of 2nd line gemcitabine and paclitaxel chemotherapy in patients with advanced bladder cancer: short-term versus prolonged treatment (German Association of urological Oncology (AUO) trial AB 20/99) Ann Oncol 2011; 22(2): 288–294.
30. Sweeney CJ, Roth BJ, Kabbinavar FF et al. Phase II study of pemetrexedfor second-line treatment of transitional cell cancer of the urothelium. J Clin Oncol 2006; 24(21): 3451–3457.
31. Vale CL, On behalf of Meta-analysis Group MCTU, London, UK. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Eur Urol 2005; 482(2): 189–199; discussion 199–201.
32. Cognetti F, Ruggeri EM, Felici A et al. Adjuvantchemotherapy (AC) withcisplatin + gemcitabine (GC) versus chemotherapy (CT) at relapse (CR) in patients (pts) with muscle-invasive bladder cancer (MIBC) submitted to radical cystectomy (RC). An Italian multicenter randomised phase III trial. American Society of Clinical Oncology Annual Meeting; 2008. Chicago, IL.
33. Paz-Ares G, Solsona E, Esteban E et al. Randomized phase III trial comparing adjuvant paclitaxel/gemcitabine/cisplatin (PGC) to observation in patients with resected invasive bladder cancer: results of the Spanish oncology Genitourinary Group (SOUGUG) 99/01 study. American Society of Clinical Oncology Annual Meeting; 2010. Chicago, IL.
34. Sherif A, Rintala E, Mestad O et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer – Nordic cystectomy trial 2. Scand J Urol Nephrol 2002; 36(6): 419–425.
35. Malmstrom PU, Rintala E, Wahlqvist R et al. Five-years followup of a prospective trial of radical cystectomy and neoadjuvant chemotherapy: nor-dic cystectomy trial I. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155(6): 1903–1906.
36. Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: a randomized prospective clinical trial. American Society of Clinical Oncology Annual Meeting; 1995, Philadelphia, PA.
37. Swanson DA, Liles A, Zagars GK. Preoperative irradiation and radical cystectomy for stages T2 and T3 squamous cell carcinoma of the bladdder. J Urol 1990; 143(1): 37–40.
38. Lughezzani G, Sun M, Jeldres C et al. Adenocarcinoma versus urothelial carcinoma of urinary bladder: comparison between pathologic stage a tradical cystectomy and cancer-specific mortality. Urology 2010; 75(2): 376–381.
39. Choong NW, Quevado JF, Kaur JS. Small cell carcinoma of the urinary bladder. The Mayo Clinic experience. Cancer 2005; 103(6): 1172–1178.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Metabolické a maligní důsledky augmentace močových cest u dětí
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- Ze zahraničních periodik
- Úvodník
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



