-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
6. AKUTNÍ LEUKÉMIE
Vyšlo v časopise: Transfuze Hematol. dnes,28, 2022, No. Supplementum 2, p. 25-28.
Kategorie: XXXIV. OLOMOUCKÉ HEMATOLOGICKÉ DNY
GEMTUZUMAB OZOGAMICIN V INTENZIVNÍ LÉČBĚ U NOVĚ DIAGNOSTIKOVANÉ CD33+ AKUTNÍ MYELOIDNÍ LEUKÉMIE – ZKUŠENOSTI ČESKÝCH HEMATOLOGICKÝCH CENTER
Weinbergerová B.1, Čerňan M.2, Šrámek J.3, Víšek B.4, Benková K.5, Válka J.6, Šálek C.6, Jindra P.3, Semerád L.1, Kabut T.1, Podstavková N.1, Procházková J.1, Szotkowski T.2, Kořístek Z.5, Žák P.4, Mayer J.1
1Interní hematologická a onkologická klinika LF MU a FN Brno
2Hemato-onkologická klinika LF UP a FN Olomouc
3Hematologicko-onkologické oddělení, FN Plzeň
4IV. Interní hematologická klinika LF UK a FN Hradec Králové
5Klinika hematoonkologie LF OU a FN Ostrava
6Ústav hematologie a krevní transfúze, Praha
Úvod: Konjugát protilátka-cytostatikum, gemtuzumab ozogamicin (GO), v kombinaci s intenzivní chemoterapií představuje možnost zlepšení výsledků léčby pacientů s nově diagnostikovanou CD33+ akutní myeloidní leukémií (AML) v nízkém/středním cytogenetickém riziku.
Cíle: Zhodnocení reálných klinických dat týkajících se efektu a tolerance GO v intenzivní terapii u AML.
Metody: Provedli jsme retrospektivní analýzu dat z registru DATOOL-AML hodnotících epidemiologii, léčbu a prognózu pacientů s novou CD33+ AML, u kterých byl na šesti hematoonkologických centrech použit GO v intenzivní léčbě během 06/2020–10/2021. Osm případů léčených GO + midostaurin + intenzivní chemoterapie bylo hodnoceno v separátní analýze.
Výsledky: Analyzováno bylo 34 případů (47 % mužů) s mediánem věku v době diagnózy 46 let (20–68). Medián sledování od diagnózy byl 44 týdnů. Většina pacientů měla de novo AML (94 %) a 2xAML „therapy-related“ (6 %). Sedm případů bylo AML NOS (21 %) a 27× AML s rekurentní genetickou abnormalitou (79 %) (12 NPM1 – 35 %; sedm CBFB-MYH11 – 21 %; čtyři RUNX1-RUNX1T1 – 12 %; dva CEBPA – 6 %; dva MLLT3-KMT2A – 6 %). ELN riziko bylo: 23×x příznivé (68 %), 6× střední (27 %), 2x nehodnotitelné (5 %). Cytogenetické riziko bylo příznivé 10 (29 %) a střední 24 (71 %). Medián doby od diagnózy do zahájení intenzivní léčby [3 (daunorubicin 60 mg/m2) +7+GO] byl 7 dní. Celkem 29 (85 %) pacientů dosáhlo CR, z nich 6 MRD (18 %), 1 PR (3 %), 3 RD (9 %) a 1 neznámo (3 %). Devět pacientů (27 %) bylo alogenně transplantováno. Medián délky neutropenie ≤ 1,0 × 109/l trombocytopenie ≤ 50 x 109/l byl po indukci respektive 1. konzolidaci s GO: 28/28, resp. 18/22 dní. Závažnější toxicita po indukci byla: 3x VOD, 3x GI krvácení, 2x hyperbilirubinémie gr. ≥ 3, 2x elevace ALT/AST gr. ≥ 3. U třetiny pacientů s CR po indukci (10/29; 35 %) nebyl v 1. konzolidaci podáván GO, v 5/29 případech 17 % pro toxicitu. Ve 2. konzolidaci nebyl GO podáván u sedmi pacientů (24 %), u pěti pro toxicitu (17 %). Na posledním „follow up“ žije 30 (88 %) pacientů – 29 v CR (85 %) z nich 21 (62 %) v CRmol. Čtyři pacienti zemřeli (12 %) – většinou pro progresi AML (3; 9 %).
Závěr: Analýza prokázala efektivitu a tolerabilitu intenzivní léčby s použitím GO u pacientů s AML ve smyslu vysoké četnosti dosažení CR a celkového přežívání. Byli pozorovány obvyklé nežádoucí účinky vedoucí u třetiny pacientů k předčasnému ukončení léčby GO, v žádném případě v přímé souvislosti s úmrtím pacienta.
Práce byla podpořena Českou leukemickou skupinou pro život (CELL) a grantem MZ ČR – RVO (FNBr 65269705).
PŘESTAVBY LOKUSŮ PRO T-BUNĚČNÉ RECEPTORY U DĚTÍ S T-BUNĚČNOU AKUTNÍ LYMFOBLASTICKOU LEUKÉMIÍ
Lizcová L.1, Příhodová E.1, Pavlištová L.1, Svobodová K.1, Hodaňová L.1, Mejstříková E.1,2, Hrušák O.2, Luknárová P.2, Janotová I.2,3, Šrámková L.3, Starý J.3, Zemanová Z.1
1Centrum nádorové cytogenomiky, ÚLBLD, 1. LF UK a VFN v Praze
2CLIP-Childhood Leukaemia Investigation Prague, Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha
3Klinika dětské hematologie a onkologie2. LF UK a FN Motol, Praha
Úvod: Leukémie z T-lymfocytů představuje 10–15 % nově diagnostikovaných dětských akutních lymfoblastických leukémií (ALL) a jedná se o heterogenní onemocnění způsobené akumulací genetických aberací v genech, které zodpovídají za normální vývoj T-buněk. Nejčastější strukturní aberace zahrnují přestavby lokusů pro T-buněčné receptory (TCR) – TRA/TRD (14q11) a TRB (7q34), které nacházíme u 20–25 % pacientů. Tyto změny jsou pravděpodobně primární událostí v leukemogenezi T-buněčné akutní lymfoblastické leukémie (T-ALL) a dochází při nich k přemístění protoonkogenů kódujících klíčové transkripční faktory pod vliv regulačních oblastí TCR, což vede k jejich aberantní expresi.
Cíle: Analyzovat přestavby TCR a asociované cytogenomické aberace u dětí léčených podle BFM protokolů a korelovat nálezy s klinickými údaji.
Metody: Vyšetřili jsme vzorky kostní dřeně 66 dětí s T-ALL diagnostikovaných v letech 1996–2017 pomocí cytogenomických metod. Jednalo se o 46 chlapců a 20 dívek (medián věku 7,9 let, medián sledování 86,4 měsíců). Přestavby TCR lokusů a další rekurentní aberace (tj. genů TLX3, CDKN2A/2B a ABL1) jsme detekovali pomocí I-FISH (Abbott Molecular, Dako, Cytocell). K detekci delecí/amplifikací dalších genů jsme využili metodu MLPA (MRC-Holland). Komplexní karyotypy jsme analyzovali metodami mFISH/mBAND (MetaSystems) a/nebo aCGH/SNP (Agilent Technologies).
Výsledky: Přestavby TCR jsme detekovali u 18/66 pacientů (27 %). Aberace TRA/TRD jsme prokázali v devíti případech, aberace TRB v pěti a vzácný nález zahrnující přestavby obou lokusů v jednom patologickém klonu jsme nalezli u dvou pacientů. Rekurentní translokace TRA/TRD lokusu t (8; 14) (q24; q11), t (11; 14) (p13; q11), t (1; 14) (p32; q11) nebo t (10; 14) (q24; q11) zahrnující geny MYC, LMO2, TAL1 a TLX1 jsme detekovali u pěti nemocných. U tří pacientů s aberací TRB jsme identifikovali přestavby vedoucí k aberantní expresi genů TAL1, LMO2 a TAL2 [tj. ins (1; 7) (p32; q34q34), t (7; 11) (q34; p13) a t (7; 9) (q34; q32) ].U ostatních nemocných byly přestavby kryptické nebo součástí komplexního karyotypu. Kromě jedné pacientky jsme společně s přestavbami TCR detekovali další chromosomové aberace, nejčastěji deleci genu CDKN2A/2B. Aberace TCR lokusů byly asociovány se signifikantně lepším EFS (p = 0,011) i OS (p = 0,0074), všichni pacienti žijí v 1. CR.
Závěr: Prokázali jsme, že aberace genů pro T-buněčné receptory tvoří velmi heterogenní skupinu přestaveb, které vedou k aberantní expresi řady onkogenů podílejících se na zrání a proliferaci T-lymfocytů. Zároveň jsme prokázali, že se obvykle vyskytují v kombinaci s dalšími abnormalitami genů podílejících se na regulaci buněčného cyklu a/nebo signálních drah a potvrdili jsme tak teorii vícestupňového procesu patogeneze T-ALL. Z klinického hlediska jsme prokázali, že přes velkou heterogenitu se jedná o prognosticky příznivou skupinu onemocnění.
Podpořeno MZ ČR-RVO-VFN64165.
KOMBINOVANÁ LÉČBA GEMTUZUMAB OZOGAMICINEM S MIDOSTAURINEM V INTENZIVNÍ LÉČBĚ U NOVĚ DIAGNOSTIKOVANÉ CD33+/ FLT3+ AML – ZKUŠENOSTI ČESKÝCH HEMATOLOGICKÝCH CENTER
Weinbergerová B.1, Čerňan M.2, Szotkowski T.2, Semerád L.1, Kabut T.1, Navrátilová J.2, Podstavková N.1, Procházková J.1, Ježíšková I.1, Klemešová I.1, Folta A.1, Mayer J.1
1Interní hematologická a onkologická klinika LF MU a FN Brno
2Hemato-onkologická klinika LF UP a FN Olomouc
Úvod: Midostaurin (MIDO) v kombinaci s intenzivní chemoterapií představuje standardní postup léčby u mladších pacientů s nově diagnostikovanou FLT3+ akutní myeloidní leukémii (AML) a podobně gemtuzumab ozogamicin (GO) pro definovanou skupinu pacientů s CD33+ AML.
Cíle: Naším cílem bylo zhodnocení klinických dat týkajících se současného použití GO a MIDO s intenzivní terapií u nově diagnostikované AML.
Metody: Provedli jsme retrospektivní analýzu dat z registru DATOOL - -AML týkajících se epidemiologie, léčby a prognózy pacientů s novou FLT3+/CD33+ AML, u kterých byla na dvou českých hematoonkologických centrech použita kombinace GO+MIDO+intenzivní chemoterapie během 07/2020–10/2021.
Výsledky: Celkem bylo analyzováno osm případů (62,5 % mužů) s mediánem věku 45 let (27–61). Medián sledování od diagnózy byl 43 týdnů. Většina pacientů měla de novo AML (87,5 %), jeden AML „therapy-related“ (12,5 %). Šest (75 %) případů mělo AML s rekurentní genetickou abnormalitou (NPM1 62,5 %, RUNX1-RUNX1T1 12,5 %), AML NOS 12,5%. FLT3-ITD+ byla u pěti pacientů (62,5 %), FLT3-TKD+ u dvou případů (25 %), jeden případ (12,5 %) měl současně FLT3-ITD+/FLT3-TKD+. Většina měla normální cytogenetický nález 87,5 %. Medián vstupního počtu leukocytů byl 61 × 109/l. Nízké ELN riziko mělo pět případů (62,5 %) a vysoké tři případy (37,5 %). Medián počtu dní od diagnózy do zahájení intenzivní léčby byl 8 dní. Všichni pacienti zahájili indukci 3 (daunorubicin 60 mg/m2) +7+GO+MIDO, z toho sedm (87,5 %) dosáhlo CR, z nich: jeden MRD (NPM1) – 12,5 %, jeden MRD (FLT3-TKD/FLT3-ITD) – 12,5 %, u čtyř pacientů klesla nálož NPM1 v kostní dřeni na medián 181 kopií (22–23 417). Jeden pacient měl RD (12,5 %) a záchranný FLAG zajistil CHR s následnou aloHSCT. Celkem šest pacientů (75 %) pokračovalo 1–2 konzolidacemi vč. GO+MIDO a tři z nich byli následně alogenně transplantováni (37,5 %). U jednoho (12,5 %) pacienta nebyl v konzolidaci GO podáván pro komplikace po indukci. Na posledním „follow up“ žije sedm (87,5 %) pacientů, jeden pacient s AML „therapy-related“ zemřel v aplázii po aloHSCT. Všech sedm žijících pacientů je v CHR.
Závěr: Analýza prokázala efektivitu a tolerabilitu kombinované intenzivní léčby s GO+MIDO u de novo AML ve smyslu vysoké četnosti dosažení CR s hlubokým poklesem MRDmol a celkového přežívání. Nutno však zohlednit menší vzorek analyzovaných pacientů.
Práce byla podpořena Českou leukemickou skupinou pro život (CELL) a grantem MZ ČR – RVO (FNBr 65269705).
NOVÉ TYPY CAR-T LYMFOMŮ PRO LÉČBU AKUTNÍ MYELOIDNÍ LEUKÉMII
Mucha M., Šmilauerová K., Petráčková M., Štach M., Rychlá J., Kaštánková I., Šroller V., Lesný P., Otáhal P.
Ústav hematologie a krevní transfúze, Praha
Léčba akutní myeloidní leukémie (AML) pomocí CAR-T lymfocytů je velmi experimentální léčebný postup. V porovnání s B-buněčnými malignitami není k dispozici žádný molekulární target, který by byl podobně účinný jako je antigen CD19. V současnosti testované targety pro léčbu pomocí CAR-T jsou antigeny CD33, CLL-1 a CD1123, které jsou však exprimovány i na zdravých hematopoetických buňkách a jejich použití je spojené s podobnými nežádoucí účinky – eliminace zdravé hematopoezy v důsledku off-target toxicity. Současně se ale jedná o účinné cíle pro nádorovou imunoterapii a v řadě klinických studií byla popsána jejich efektivita v eliminaci buněk AML. Řešení tohoto problému spočívá v cílené eliminaci CAR-T po navození remise onemocnění pomocí tzv. bezpečnostní pojistky (safety switch). Toho lze dosáhnout např. pomocí koexprese antigenů CD20 nebo EGFR současně s CAR konstruktem. Aplikované CAR-T lymfocyty lze tedy cíleně eliminovat terapeutickými protilátkami rituximab (anti-CD20) nebo cetuximab (anti-EGFR) a zabránit tak vzniku dlouhodobé cytopenie. V ÚHKT byl zahájen vývoj nového typu CAR-T lymfocytů specifických na antigen CD123 a exprimujících EGFR safety switch. Pro přípravu CD123 CAR-T buněk se využívá nevirová metoda transfekce pomocí transpozonu piggyBac. Vektory pro přípravu CD123 CAR-T jsou založené na synteticky vyrobeném DNA transpozonu obsahujícím CD123 CAR a na in vitro transkribované mRNA kódující piggyBac transpozázu, která umožní integraci CD123 CAR transpozonu do genomu buňky. Obě komponenty (DNA transpozon a mRNA transpozáza) se elektroporují do leukocytů získaných z periferní krve a následně se buňky expandují in vitro v bioreaktoru. Takto připravené buňky účinně rozpoznají AML targety in vitro a jsou schopné kontinuální cytotoxicity po dobu několika dnů během in vitro kokultivace s AML targety. Vyvinutý postup výroby je založen na synteticky připravených DNA/RNA vektorech, což je významný benefit pro plánovanou GMP certifikaci tohoto experimentálního léčivého přípravku. Zahájení klinického testování CD123 CAR-T je hlavní cíl tohoto projektu, což ale bude možné až po zavedení GMP výroby a splnění všech podmínek regulačních úřadů (SÚKL).
HODNOCENÍ GERIATRICKÝCH SYNDROMŮ U STARŠÍCH PACIENTŮ S AKUTNÍ MYELOIDNÍ LEUKÉMIÍ – PILOTNÍ PROJEKT JEDNOHO CENTRA
Weinbergerová B.1, Voldřich J.1, Nováková Z.1, Semerád L.1, Podstavková N.1, Kvetková A.1, Procházková J.1, Warren J.2, Tomíška M.1,3, Matějovská Kubešová H.4, Mayer J.1
1Interní hematologická a onkologická klinika LF MU a FN Brno
2Oddělení klinické psychologie, FN Brno
3Oddělení léčebné výživy, LF MU a FN Brno
4Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Úvod: Akutní myeloidní leukémie (AML) nejvíce postihuje starší pacienty s výrazně horšími léčebnými výsledky, toxicitou léčby a přežíváním ve srovnání s mladšími nemocnými vzhledem k nepříznivé biologické charakteristice onemocnění, sníženým rezervám organizmu a komorbiditám. V klinické praxi představuje správná personifikovaná selekce pacientů k příslušné léčbě hlavní nástroj ke zlepšení výsledků, přičemž komplexní hodnocení tzv. geriatrických syndromů se stává v poslední době její rutinní součástí.
Cíle: Naším cílem bylo vytvořit, otestovat a optimalizovat jednoduchý skórovací systém se začleněním hodnocení „geriatrických syndromů“ použitelný pro terapeutickou rozvahu v běžné klinické praxi.
Metody: Provedli jsme prospektivní hodnocení geriatrických syndromů a ostatních prognostických faktorů u pacientů ≥ 60 let s nově diagnostikovanou AML (mimo M3) během 04–12/2021. Skórovací systém zahrnoval kognitivní/fyzickou výkonnost, nutriční stav, komorbidity, polyfarmacii, prognostický model AML. Na základě výsledků byli pacienti rozděleni do tří skupin: fit, vulnerabilní a křehcí (pilotní verze v tab. 1). Následně byly výsledky léčby porovnány s pilotním skórovacím systémem a navržena optimalizace.
Tab. 1. Skórovací systém hodnocení geriatrických syndromů u akutní myeloidní leukémie – pilotní a aktualizovaná verze. 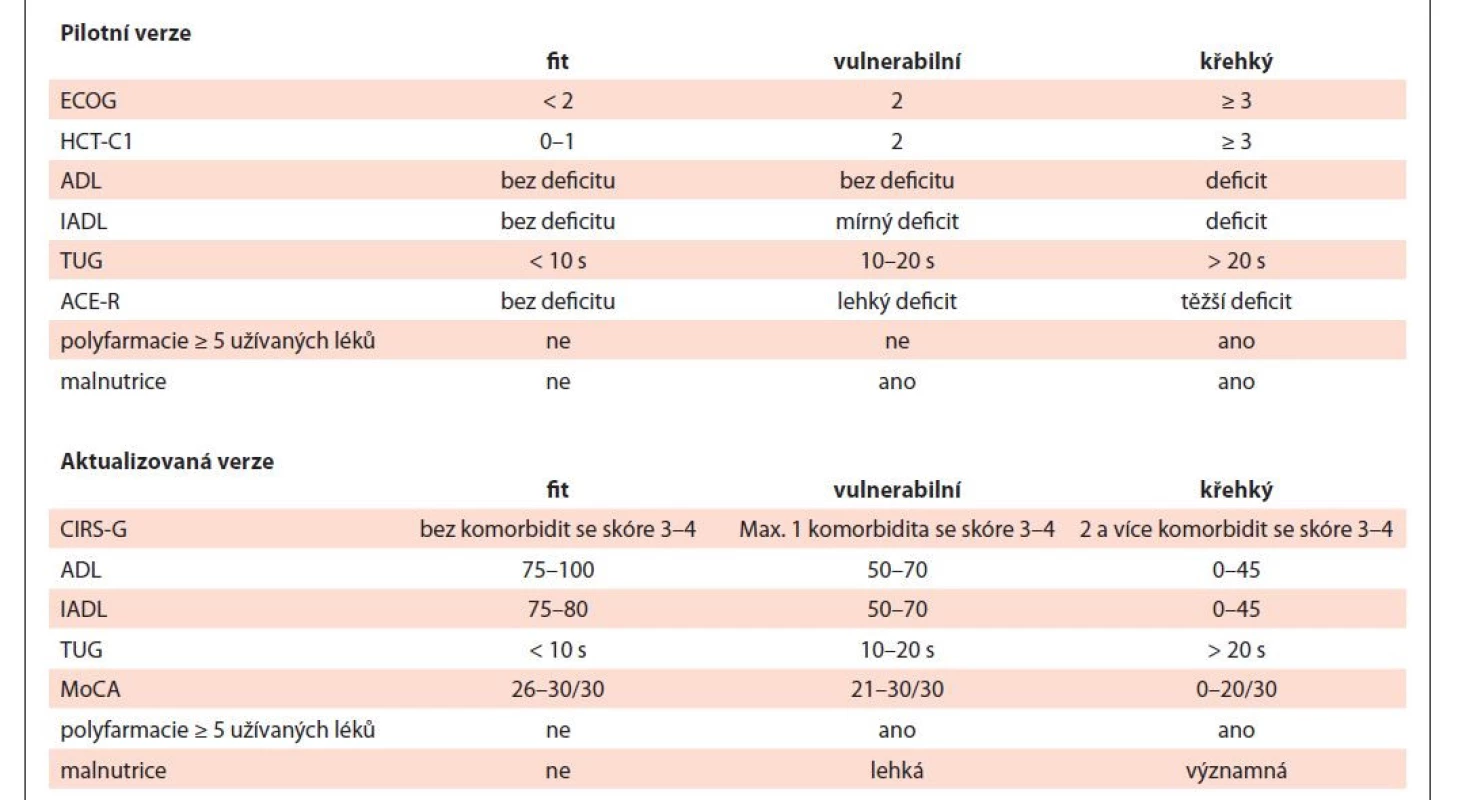
ADL – activities of daily living; ACER-R – Addenbrooke´s Cognitive Examination-Revised; CIRS-G – Cumulative Illness Rating Scale-Geriatric; IADL – Instrumental Activities of Daily Living; MoCA – Montreal Cognitive Assessment; TUG – Timed Up and Go Výsledky: Do pilotního projektu vstoupilo 29 pacientů. U 15/29 pacientů (52 %) byly zhodnoceny všechny parametry (53 % mužů, medián 74 let). Rozdělení do skupin bylo: sedm fit (47 %), šest vulnerabilní (40 %), dva křehcí (13 %). Ve „fit“ skupině byli čtyři pacienti léčeni kurativně s efektem CR, dva pacienti venetoklaxem+azacitidinem (VENE+AZA) s efektem CRi a jeden případ symptomaticky s efektem PROG. Ve „vulnerabilní“ skupině byli tři pacienti léčeni VENE+AZA s efektem 2× CR/CRi a 1× PROG, dva pacienti paliativně a jeden symptomaticky s efektem PROG. V „křehké“ skupině byl jeden pacient léčen paliativně bez hodnoceného efektu a jeden symptomaticky s efektem PROG. U žádného pacienta v souboru nebyly pozorovány neobvyklé komplikující události. Celková doba sledování je 20 týdnů (4–44). Celkem šest (40 %) pacientů zemřelo (jeden fit, čtyři vulnerabilní, jeden křehký), všichni na progresi AML. Ostatních devět pacientů žije v CR/CRi. Většina „fit“ pacientů dosáhla léčbou CR/CRi (86 %), která trvá na posledním follow-up (medián 25 týdnů). „Vulnerabilní“ skupina profitovala z léčby VENE+AZA.
Závěr: Pilotní projekt hodnocení geriatrických syndromů u nově diagnostikovaných starších pacientů s AML prokázal funkčnost ve smyslu adekvátní selekce nemocných do příslušné skupiny a volby léčby. Ve snaze zvýšit zastoupení kompletně skórovaných pacientů jsme ve spolupráci s odborníky nahradili některá vyšetření snáze proveditelnými v klinické praxi a zavedli jsme kvantitativní a jednotný systém hodnocení jednotlivých parametrů (aktualizovaná verze v tab. 1).
Práce byla podpořena Českou leukemickou skupinou pro život (CELL) a grantem MZ ČR – RVO (FNBr 65269705).
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek 2. WIEDERMANNOVA PŘEDNÁŠKAČlánek 3. POSTGRADUÁLNÍ SEKCE 2Článek 4. MALIGNÍ LYMFOMYČlánek 5. MONOKLONÁLNÍ GAMAPATIEČlánek 1. POSTGRADUÁLNÍ SEKCE 1Článek POSTEROVÁ SEKCE
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2022 Číslo Supplementum 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- 2. WIEDERMANNOVA PŘEDNÁŠKA
- 3. POSTGRADUÁLNÍ SEKCE 2
- 4. MALIGNÍ LYMFOMY
- 5. MONOKLONÁLNÍ GAMAPATIE
- 6. AKUTNÍ LEUKÉMIE
- 7. MYELOIDNÍ NEOPLÁZIE A VZÁCNÁ ONEMOCNĚNÍ
- 8. TRANSPLANTACE A BUNĚČNÁ TERAPIE
- 9. CYTOMORFOLOGIE V HEMATOLOGII
- 10. HEMATOLOGIE A TRANSFUZE DNES
- 11. CHRONICKÁ LYMFOCYTÁRNÍ LEUKÉMIE
- 12. MYELOPROLIFERATIVNÍ NEMOCI A CHRONICKÁ MYELOIDNÍ LEUKÉMIE
- 1. POSTGRADUÁLNÍ SEKCE 1
- 13TH SYMPOSIUM ON ADVANCES IN MOLECULAR HEMATOLOGY
- POSTEROVÁ SEKCE
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- 10. HEMATOLOGIE A TRANSFUZE DNES
- 6. AKUTNÍ LEUKÉMIE
- POSTEROVÁ SEKCE
- 12. MYELOPROLIFERATIVNÍ NEMOCI A CHRONICKÁ MYELOIDNÍ LEUKÉMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



