-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kongenitální neutropenie u dětí a dospělých
Congenital neutropenia in children and adults
Congenital neutropenias (CNs) are a group of genetic disorders that may even be diagnosed in adulthood. In such cases, they manifest most often as mild neutropenia and cytopenia and other clinical symptoms tend to be less pronounced compared to CN diagnosed in childhood. Several gene variants responsible for the CN phenotype have been identified by molecular genetic approaches, especially by exome sequencing. Mutations of some of these genes also increase the risk of patients developing myelodysplastic syndrome or acute myeloid leukaemia. Proper patient monitoring strategies, genetic counselling and optimal treatment protocols can substantially affect the prognosis of these disorders.
Keywords:
whole exome sequencing – hereditary neutropenia in adults – gene variants
Autoři: K. Staňo Kozubík 1,2; Z. Vrzalová 1,2; J. Trizuljak 2,3; M. Skalníková 1,2; L. Radová 1; I. Blaháková 1,2; J. Štika 1; V. Bergerová 4; M. Šmída 1,2; Š.- Pospíšilová 1 3; M.- Doubek 1 3
Působiště autorů: Středoevropský technologický institut (CEITEC) MU Brno 1; Interní hematologická a onkologická klinika LF MU a FN Brno 2; Ústav lékařské genetiky LF MU Brno 3; LF MU Brno 4
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 4, p. 297-303.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2021297Souhrn
Dědičné neutropenie (DN) patří mezi geneticky podmíněná onemocnění, která mohou být diagnostikována i v dospělém věku. DN se v dospělosti manifestuje spíše lehkými formami neutropenie a cytopenie. Případné další klinické příznaky bývají mírnější ve srovnání s DN diagnostikovanými u dětí. Molekulárně genetickou analýzou, zejména exomovým sekvenováním, bylo v různých genech identifikováno mnoho patogenních mutací zodpovídajících za fenotyp DN. Mutace některých těchto genů zároveň pacienty predisponuje ke zvýšenému riziku rozvoje myelodysplastického syndromu či akutní myeloidní leukemie. Správná strategie sledování pacientů, genetické poradenství a stanovení optimálního postupu léčby mohou poté významně ovlivnit prognózu tohoto onemocnění.
Klíčová slova:
dědičná neutropenie dospělých – varianty genů – exomové sekvenování
ÚVOD
Dědičné neutropenie (DN) jsou geneticky podmíněnou heterogenní skupinou onemocnění, kterou lze diagnostikovat od raného věku. Neutropenie (periferní neutropenie) je definovaná jako snížení absolutního počtu neutrofilů (ANC) v krevním oběhu pod 2,0×109/l [1] a může být přítomno i postižení dalších orgánů jako pankreatu, centrálního nervového systému, srdce, kostí, svalů a kůže. Neutropenie se podle ANC dělí na těžkou (ANC < 0,5×109/l), středně těžkou (ANC 0,5–1,0×109/l) a mírnou formu (ANC mezi 1,0 a 2,0×109/l). Může se manifestovat v permanentní (stálé) nebo intermitentní (cyklické) formě a podle původu je buď získaná, nebo dědičná.
Diagnózu neutropenie je třeba potvrdit alespoň ze 3 nezávislých odběrů periferní krve zaměřených na vyšetření krevního obrazu v průběhu 3 měsíců. Pokud fenomén neutropenie trvá, je třeba až na výjimky (benigní etnicky podmíněná neutropenie) zvažovat další vyšetření, případně genetickou konzultaci.
Periferní neutropenie se vyskytuje až u 1 % populace, s častějším výskytem v určitých regionech (Afrika, Střední Východ). Naproti tomu DN je velmi vzácná, pozorovaná u méně než 1/100 000 osob [2]. To znamená, že méně než 1/1 000 případů neutropenie je dědičný.
Vzhledem k frekvenci výskytu DN může dojít ke značnému zpoždění ve stanovení správné diagnózy. V tomto přehledu se zaměříme právě na dědičné neutropenie, které se mohou projevit nebo bývají diagnostikovány až v dospělém věku.
DĚDIČNÉ NEUTROPENIE
Diagnóza DN bez ohledu na detekovanou kauzální genetickou mutaci představuje pro pacienty vyšší riziko vzniku hematologické malignity (10–60 %) ve srovnání s obecnou populací (0,01 %) [3].
Distribuce výskytu DN v populaci je částečně podmíněna etnickým původem: mutace genu HAX1 v Kurdistánu (Malé Asii) nebo Švédsku, G6PC3 genu v Arménii a AP14 genu u Mennonitů. Mutace v genech ELANE, SBDS, SLC37A4 a CXCR4 se vyskytují nezávisle na etnickém původu.
DN jsou monogenně podmíněným onemocněním. Dosud bylo identifikováno více než 24 genů asociovaných se vznikem dědičné neutropenie [3]. Většinou jde o mutace v genech zodpovědných za nitrobuněčnou regulaci translace prostřednictvím stresu endoplazmatického retikula, a překvapivě ne o geny angažující se v granulopoéze. Nejefektivnějším způsobem zjištění genetické mutace je použití masivního paralelního sekvenování, zejména sekvenování celých exomů, protože škála genů a jejich variant zodpovědných za vznik DN je široká. Jde o různé typy genetických mutací, často o nové missense záměny, jejichž interpretace bývá vzhledem k absenci funkčních testů obtížnější. Často bývá taková varianta klasifikována dle mezinárodních doporučení [4] jako varianta nejasného významu (VUS). K objasnění patogenity detekované varianty je vhodné provést genetickou konzultaci zejména s ohledem na rodinnou anamnézu nádorových onemocnění (leukemií, ale i solidních tumorů), výskytu infekčních onemocnění od dětství vč. gingivitid a stomatitid, a důležité je také zjistit, zda detekovaná varianta segreguje s fenotypem neutropenie. Optimálním postupem pro zařazení nové, dosud nepopsané varianty je následné provedení funkční analýzy k průkazu její patogenity [5].
Z důvodu mírných nebo chybějících hematologických nebo fyzických abnormalit může u některých pacientů dojít k pozdějšímu stanovení diagnózy DN až na základě dalších komplikací, např. nádorového onemocnění nebo při genotypování celé rodiny.
GRANULOPOÉZA
Hematopoetické kmenové buňky (HSC) ztrácí během vývoje svůj sebeobnovovací potenciál, a vznikají tak multipotentní prekurzory (MPP), ze kterých se mohou tvořit buňky všech krevních řad. Diferenciace MPP v erytro-myeloidní (EMP) nebo lymfo-myeloidní progenitory (LMP) je řízena antagonistickými transkripčními faktory GATA-1 a PU.1. Vysoká hladinu PU.1 je důležitá pro diferenciaci MPP v LMP, který se dále diferencuje ve společný progenitor granulocytů a makrofágů (GMP). Denně vzniká 1010–1011 neutrofilních granulocytů z myeloidních prekurzorů v kostní dřeni (KD) a extramedulární tkáni (vč. sleziny). Časné neutrofilní prekurzory (myeloblasty, promyelocyty a časné myelocyty) si zachovávají schopnost proliferace. Zrání, během kterého se v neutrofilu formují granula a vezikuly, probíhá od fáze metamyelocytu až po zralý neutrofilní granulocyt (obr. 1).
Obr. 1. Vývojový proces neutrofilních granulocytů od hematopoetické kmenové buňky a související klíčové transkripční faktory rané vývojové fáze. 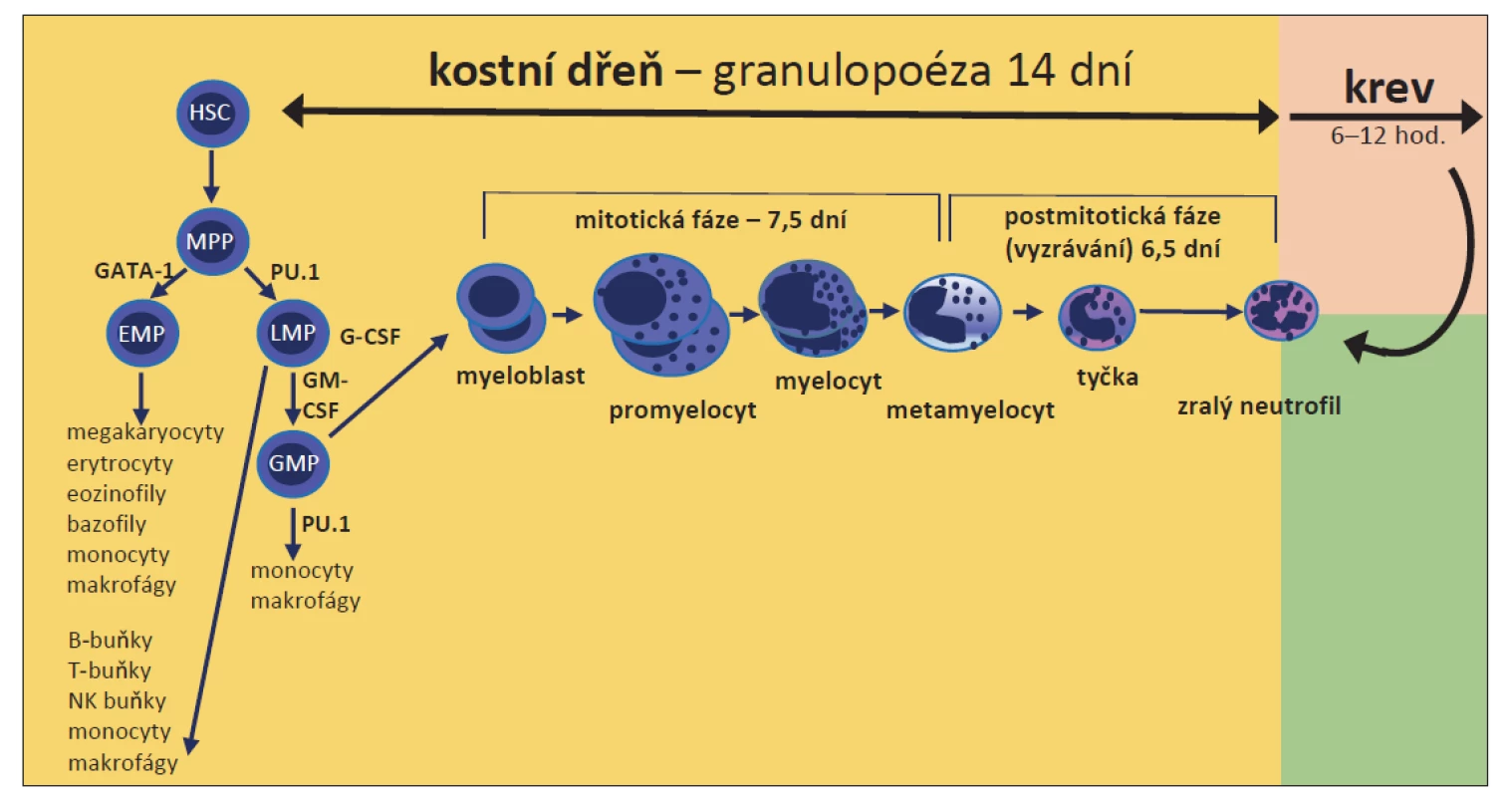
EMP – erytro-myeloidní progenitor, GATA1 – transkripční aktivátor nebo represor, který je přepínacím faktorem pro vývoj erytroidní krevní řady, G-CSF – granulocytární kolonie stimulující faktor, GM-CSF – granulocytární-makrofágové kolonie stimulující faktor, GMP – společný progenitor granulocytů a makrofágů, HSC – hematopoetická kmenová buňka, LMP – lymfo-myeloidní progenitor, MPP – multipotentní prekurzor, PU.1 – transkripční faktor nezbytný pro diferenciaci MPP do LMP a LMP do GMP Nejdůležitějšími regulátory fyziologické granulopoézy jsou granulocytární kolonie stimulující faktor (G-CSF) a jeho receptor, který reguluje proliferaci a diferenciaci granulocytárních prekurzorů, uvolnění zralých neutrofilů z KD a modulace jejich fagocytární funkce [6]. Lidé s nedostatkem G-CSF nebo jeho receptoru mají neutropenii. Interleukin 6, granulocytární-makrofágové kolonie stimulující faktor (GM-CSF) a interleukin 3 rovněž stimulují granulopoézu, ale nejsou nezbytné [6].
LEUKEMOGENEZE U DĚDIČNÉ NEUTROPENIE
Leukemogeneze je proces, ve kterém postupné transformační události zvyšují schopnost hematopoetických progenitorových buněk proliferovat, diferencovat se a přežít. Leukemogeneze probíhá ve více krocích: k zárodečné mutaci, která způsobuje DN, se přidávají další mutace/zásahy v hematopoetických progenitorových buňkách, které vedou k maligní transformaci. V roce 1995 byly pozorovány heterozygotní mutace genu CSF3R (kóduje receptor G-CSF) až u 80 % pacientů s DN vykazujících známky maligní transformace – vždy téměř výhradně po podání granulocytární kolonie stimulujícího faktoru (G-CSF) u pacientů s DN a mutací v ELANE genu. Tyto somatické mutace mohou být přechodné a nebyly nikdy pozorovány u neutropenických pacientů s mutací genu SBDS či s mutací genu GATA2, kteří léčbu G-CSF nedostávali. U pacientů s ELANE mutací podmíněnou DN byla nalezena celá řada získaných mutací v genech ASXL1, CCDC155, EP300, FBXO18, LAMB1, LLGL2, MGA, RUNX1, SUZ12 a ZC3H18 [7]. Tyto mutace se objevují postupně během leukemické transformace. Ve studii 31 případů DN podmíněných mutacemi v genech ELANE, HAX1 nebo WAS byly detekovány somatické mutace CSF3R a RUNX1 u 70 % pacientů během leukemické transformace [8], zatímco u GATA2 DN měla třetina pacientů somatickou mutaci ASLX1 [9], somatické mutace TP53 byly detekovány výhradně u SBDS [10,11].
Leukemická transformace DN závisí na mutaci, která DN způsobuje: mutace genu GATA2 představuje 60% riziko [12,13], mutace genu SBDS 30% riziko [14] a mutace genu ELANE 15% riziko [15] vzniku AML, případně ALL do věku 30 let. Dále byla leukemická transformace popsána u DN podmíněné mutací genu HAX1, WASP, G6PC3 a SLC37A4. Dosud nebyla leukemická transformace popsaná u zárodečných mutací genu VPS13B a CXCR4. U DN pacientů existuje i zvýšené riziko vzniku solidních nádorů: tumory ledvin (mutace genu SLC3A4) [16] nebo karcinomy indukované lidským papilomavirem (mutace genů GATA2, CXCR4) [12,17].
Nejčastějším cytogenetickým nálezem při leukemogenezi nebo po propuknutí leukemie je monozomie chromozomu 7 (až 2/3 malignit u DN), méně častá je trizomie 21 nebo 18.
Pacienti s DN, kteří potřebují vysoké dávky G-CSF a kteří mají sníženou odpověď neutrofilů na tuto léčbu, mají nejvyšší riziko leukemické transformace [18,19].
NESYNDROMOVÉ VROZENÉ NEUTROPENIE V DOSPĚLÉM VĚKU
Základní charakteristika nesyndromových i syndromových neutropenií je uvedena v tab. 1.
Tab. 1. Přehled základních charakteristik dědičné neutropenie u dospělých. 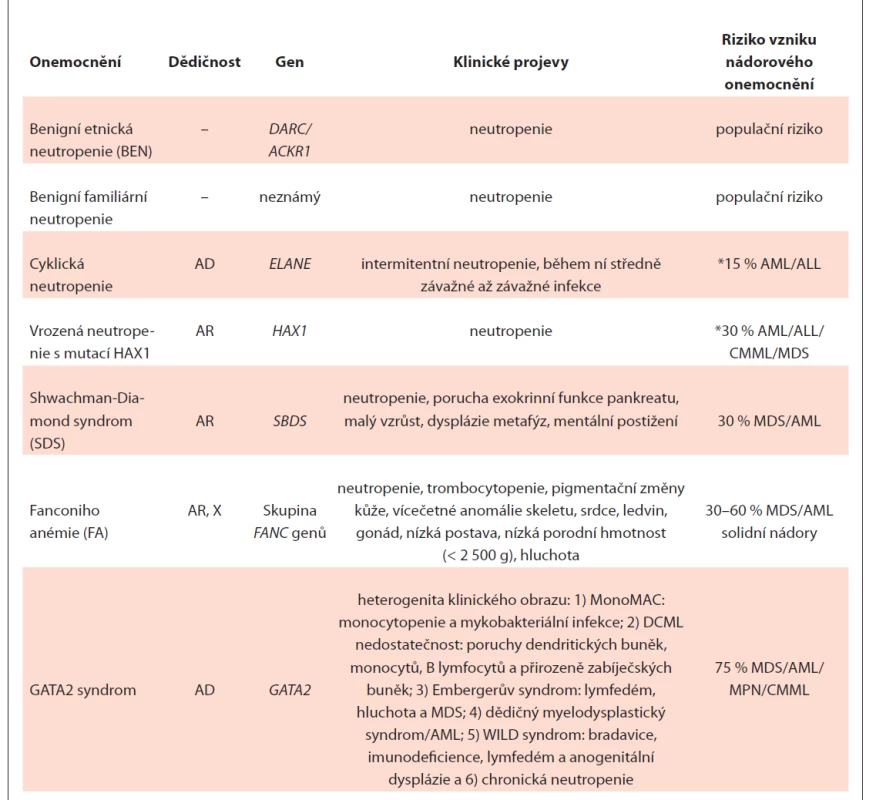
*riziko je uvedeno pro těžkou vrozenou neutropenii, kde je třeba podávat vysoké dávky G-CSF, pro mírnou intermitentní formu bez terapie G-CSF riziko stanovené není
AD – autozomálně dominantní, AML – akutní myeloidní leukémie, AR – autozomálně recesivní, CMML – chronická myelomonocytární leukémie, MDS – myelodysplastický syndrom, MPN – myeloproliferativní neoplázie, X – dědičnost variant genů na chromozomu XBenigní etnická neutropenie (BEN) – typicky mírná, chronická neutropenie, ANC bývá pod 1,5×109/l; opakované infekce nejsou časté. Nemoc je častější u určitých etnik, např.: Afričanů, jemenských a etiopských Židů, Arabů, obyvatel Karibiku nebo potomků Indiánů. Prevalence BEN není přesně známá, ale pro určité populace byla stanovena: 25–50 % africké populace [20–22], 4,5 % Afroameričanů, 10,7 % Arabů [23], 11,8 % jemenských Židů, 15,4 % etiopských Židů [22], ale méně než 1 % bílé populace žijící v USA [24]. Neutropenie v africké populaci souvisí s polymorfizmem rs2814778 (G) v DARC genu (Duffy Antigen Receptor Complex), rovněž známého jako Atypický Chemokinový Receptor 1 – ACKR1. DARC se exprimuje v erytrocytech a v buňkách ledvin, mozku a endotelu [25]. rs2814778 (G) souvisí s absencí DARC pouze na erytrocytech. DARC se na erytrocytech exprimuje jako transmembránový glykoprotein – Duffy antigen (Fy). Pokud se mohou aplikovat výsledky výzkumu na myším modelu na člověka, neutropenie u Duffy-negativního fenotypu vznikne následovně: DARC negativní hematopoetické buňky diferencují do DARC negativních myeloidních progenitorů a později do zralých aktivovaných neutrofilů, které jsou fenotypově odlišné a ihned se z krevního řečiště přemístí do tkání (kůže, střeva, slezina ad.), místo aby tam zůstaly do doby kontaktu s patogenem. To vede k relativní neutropenii v krevním oběhu [26]. Samotný Duffy null fenotyp neznamená vždy BEN. Byl pozorován pozitivní selekční tlak pro Duffy-negativní fenotyp, který chrání před malárií způsobenou parazitickými prvoky druhu Plasmodium vivax nebo Plasmodium knowlesi, které používají Duffy antigen jako receptor vstupu do erytrocytů a pravděpodobně i před souběžným onemocněním Plasmodiem falciparem.
Benigní familiární neutropenie – fenotypově podobná BEN, ale není vázaná na jednu etnickou skupinu. Její genetická podstata je dosud neznámá.
Cyklická neutropenie (intermitentní) – je to vzácné vrozené onemocnění charakterizované opakujícími se epizodami neutropenie, které se vrací v pravidelných cyklech po 2–5 týdnech. Pacienti mají většinou mírné projevy nemoci, přesto u některých může během neutropenické epizody vzniknout infekce nebo ulcerace v ústech. Právě díky mírnému fenotypu bývá diagnostikována až v dospělosti.
Jde o autozomálně dominantní (AD) onemocnění podmíněné nejčastěji mutací v genu ELANE kódujícím neutrofilní elastázu (NE), což je serinová proteáza produkovaná během promyelocytární fáze, uskladněná v granulích neutrofilních granulocytů a makrofágů. Během zánětu se uvolňuje, ničí mikroorganizmy a poškozuje okolní tkáně [27–29]. U ELANE mutantů vzniká v promyelocytech nefunkční nebo „špatně složená“ NE, která se hromadí v endoplazmatickém retikulu (ER), kde způsobuje buněčný stres a vyvolá mechanizmus nazvaný „unfolded protein response“ (UPR) – odpověď na nesbalené nebo špatně sbalené proteiny hromadící se v lumenu ER [30,31]. Stres vzniklý v ER nejprve spustí molekulární mechanizmy cílené na opravu a snížení produkce proteinů, aby se zabránilo zvýšení stresu. Déle trvající stres ER nakonec dovede buňku do apoptózy (programované buněčné smrti), a dojde tak k „maturation arrest“, zástavě zrání, pozorované v aspirátu kostní dřeně (KD) pacientů s těžkou vrozenou neutropenií [32,33]. Stejná mutace tohoto genu se může u jednoho pacienta projevit ve formě cyklické neutropenie, zatímco u druhého jako těžká vrozená neutropenie [34]. Pravděpodobně se tak děje díky přítomnosti určitých inhibičních faktorů UPR, např. inhibitorů serinových proteáz (secretory leukocytes protease inhibitor) u cyklické neutropenie, které mohou posunout rovnováhu z apoptózy do opravy a přežití buňky.
Vrozená neutropenie způsobená autozomálně recesivní (AR) mutací genu HAX1 – existují dva fenotypy podle dvou různých izoforem HAX-1 proteinu. Mutace poškozující pouze izoformu 001 vedou k mírnějším klinickým projevům omezeným na samotnou neutropenii [35], na rozdíl od mutací poškozujících oblasti důležité pro obě proteinové izoformy 001 i 004, které vedou ke vzniku těžké vrozené neutropenie s neurologickými projevy – klasický Kostmannův syndrom. Výskyt HAX1 DN je omezen na oblast Malé Asie a Švédska.
Molekulární mechanizmus vzniku DN
HAX-1 protein se účastní řady signálních drah a hraje nezbytnou roli v přežití neutrofilů ovlivněním membránového potenciálu mitochondrií. Jeho nadměrná exprese se projeví jako proliferace a maligní zvrat, zatímco jeho nedostatek vede k časné apoptóze, která se klinicky projeví jako těžká vrozená neutropenie, mentální postižení, zpožděný neurologický vývoj a epilepsie [35–38].
Vzhledem k mírné, často intermitentní neutropenii není pro tuto skupinu onemocnění léčba nutná – s výjimkou propuknutí závažného infekčního onemocnění během neutropenické fáze.
NEUTROPENIE JAKO SOUČÁST VROZENÝCH SYNDROMŮ
Shwachman-Bodian-Diamondův syndrom (SDS) je charakterizován symptomatickou triádou, která zahrnuje dysfunkci exokrinní části pankreatu, nedostatečnost KD a achondrodysplazii metafýz. Pacienti neprospívají, jsou menšího vzrůstu a mají časté infekce, nástup puberty je opožděný, učení a chování je poznamenáno kognitivními poruchami. Nejdůležitějším hematologickým projevem je vždy přítomná neutropenie, u 1/3 pacientů permanentního typu, u 2/3 pacientů intermitentní. Množství a kvalita neutrofilů je defektní, což vede k závažným infekcím i u pacientů s normálním počtem neutrofilů. U 1/2 pacientů se vyskytuje anémie a/nebo trombocytopenie. SDS pacienti mají tendenci ke vzniku klonálních cytogenetických abnormalit a je popsáno zvýšené riziko vzniku hematologických malignit. SDS je způsoben mutací genu SBDS, který je zapojen do celé řady signálních drah a procesů. Např.: metabolizmus RNA a ribozomů, funkce mitotického vřeténka během buněčného dělení a chemotaxe neutrofilů. Cca 90 % pacientů má homozygotní mutaci genu SBDS, což dramaticky sníží expresi proteinu sbds – většina pacientů jsou složení heterozygoti (bialelická mutace SBDS). Nebyly popsány mutace SBDS bez zbytkové exprese sbds, což naznačuje, že absence exprese sbds není slučitelná se životem [39,40]. Z dat dostupných v odborné literatuře plyne, že je tato diagnóza často nerozpoznaná a že je SBDS mutace, potažmo SDS, zjištěna až při propuknutí myeloproliferace nebo po transplantaci hematopoetických kmenových buněk. Vznik somatických mutací TP53 genu může být předzvěstí progrese onemocnění do MDS [10,11]. Mírné formy onemocnění bývají diagnostikované až v dospělosti.
Jediným léčebným postupem eliminujícím hematologické projevy SDS je alogenní transplantace krvetvorných kmenových buněk (HSCT), která je indikovaná u pacientů s těžkou neutropenií nebo MDS/AML.
Fanconiho anémie (FA) se projevuje vrozenými defekty, progresivním selháním KD a predispozicí k nádorům. U 25–40 % pacientů s FA nejsou přítomné vrozené abnormality nebo nenastane selhání KD [41]. Nicméně pacienti s FA mají proti běžné populaci 50× zvýšené riziko výskytu leukemií i solidních nádorů. Patogenní mutace mohou mít neúplnou penetranci nebo variabilní expresivitu (tj. různé klinické projevy) i v rámci jedné rodiny. Hematologicky se projeví jako pancytopénie – aplastická anémie. U některých FA jedinců se hematologické abnormality nikdy klinicky neprojeví. Příčinou FA jsou mutace v genech zodpovídajících za opravy DNA: FANCA, FANCB, FANCC, ad. – celkem 21 genů [42]. Dědičnost FA je AR, v případě mutací genu FANCB je X-vázaná. Buňky FA pacientů mají nízkou toleranci k poškození DNA jak in vivo, tak in vitro. Diagnóza Fanconiho anémie je založena na cytogenetickém vyšetření, které prokazuje zvýšený výskyt spontánních chromozomálních aberací, jejichž počet stoupá po působení diepoxybutanu (DEB) nebo mitomycinu C (MMC) na leukocyty periferní krve. Tato vyšetření jsou vysoce citlivá a specifická pro FA, ale může se stát, že lymfocytární mozaicizmus způsobený spontánní genovou reverzí může zmást interpretaci výsledku. Při těchto vyšetřeních v případě somatického mozaicizmu lymfocytů může vzniknout pouze několik buněk s chromozomovými zlomy, takže je výsledný průměr počtu zlomů na buňku v normálu. Molekulární mechanizmus podmiňující genovou reverzi zahrnuje intragenové rekombinace (u složených heterozygotů) a mitotickou genovou konverzi (nereciproká výměna genetické informace během formace heteroduplexů mezi nesesterskými chromatidami). Genová reverze udělí kmenové buňce proliferativní výhodu, která vede k expanzi revertovaného klonu a progresivnímu nahrazení poškozených hematopoetických buněk v KD. Ve své podstatě jde o přírodní formu genové terapie. Genová reverze byla dokumentována na hematopoetických buňkách, ale ne na fibroblastech pacientů s FA [43]. U pacientů s klinickým nebo genetickým podezřením na FA, kteří mají negativní DEB nebo MMC test na periferních lymfocytech, je dobré provést test fragility chromozomů na kožních fibroblastech, případně provést molekulárně genetické vyšetření na přítomnost mutace ve FANC genech.
U FA pacientů je třeba v případě potřeby použití radio - nebo chemoterapie přizpůsobit dávkování molekulární podstatě FA. FA pacienti s mírnými hematologickými projevy by měli mít pravidelně sledovaný krevní obraz a kostní dřeň kvůli možné progresi do MDS, která může nastat rychle, a proto je doporučeno mít vypracovaný plán HSCT.
GATA2 syndrom je způsoben heterozygotní mutací hematopoetického transkripčního faktoru a má heterogenní klinické projevy:
1) MonoMAC: onemocnění charakterizované monocytopenií a mykobakteriálními infekcemi;
2) DCML nedostatečnost: poruchy dendritických buněk, monocytů, B lymfocytů a přirozeně zabíječských buněk;
3) Embergerův syndrom: lymfedém, hluchota a MDS;
4) dědičný myelodysplastický syndrom/AML;
5) WILD syndrom: bradavice, imunodeficience, lymfedém a anogenitální dysplazie;
6) chronická neutropenie.
Heterogenita klinických projevů je důsledkem funkce GATA2 proteinu, který hraje důležitou roli v regulaci genů prostřednictvím vazby DNA a interakcí mezi dalšími proteiny. V případě haploinsuficience nebo dominantně negativní ztráty funkce GATA2 v důsledku mutace nebo delece bývá vážně narušena homeostáza kmenových buněk zásahem do regulace progenitorové proliferace [44,45]. GATA2 syndrom bývá často diagnostikován až při zjištění myelodysplazie nebo leukemie, přestože byla pacientovi před lety diagnostikována mírná neutropenie [12,46]. Ke vzniku maligního onemocnění dochází dříve než u běžné populace.
Jediným léčebným postupem je alogenní HSCT, která je ale diskutabilní u pacientů bez klinických projevů. U GATA2 pacientů s MDS existuje vysoké riziko progrese onemocnění do pokročilejšího stádia s vysoce rizikovým karyotypem, což ukazuje na včasnou HSCT, která by měla být provedena před rozvojem MDS-EB s karyotypovými abnormalitami, závažnou imunodeficiencí se systémovými infekcemi nebo závažným onemocněním plic. Ideální dobou pro HSCT je období dřeňové hypocelularity před projevem vážných komplikací, nebo vznikem monozomie 7 a/nebo nárůstu blastů [47–51].
VÝZNAM DIAGNOSTIKY DĚDIČNÝCH NEUTROPENIÍ
Klinické projevy onemocnění DN v některých případech odpovídají typu a umístění genetické mutace v konkrétním genu: např. mutace způsobující posun čtecího rámce u genu GATA2 jsou spojeny s dřívějšími klinickými projevy než mutace substituční. Znalost molekulární diagnózy je důležitá zejména u DN pacientů, u kterých vzniklo nádorové onemocnění vyžadující transplantaci krvetvorných kmenových buněk, a to kvůli vyloučení genetické mutace u potenciálního příbuzného dárce, pokud není nalezen dárce nepříbuzný.
Diagnóza DN bývá stanovena per ex - clusionem po vyloučení ostatních faktorů podmiňujících vznik neutropenie. Pro stanovení diagnózy BEN není třeba dalších vyšetření, pokud pacient pochází z oblasti s výskytem BEN, jeho anamnéza je nevýznamná stran opakovaných infekcí a byly vyloučeny ostatní příčiny vzniku neutropenie jako infekce, užívání léků, nádorové onemocnění, autoimunitní onemocnění, metabolický rozvrat nebo hematologické onemocnění. U jiných DN je třeba zjistit genetickou variantu, která onemocnění podmiňuje, aby se stanovila prognóza a nastavila následná klinická péče pro prevenci vzniku infekcí, management přidružených orgánových postižení a prevenci leukemického zvratu. K tomu se v současnosti využívá masivní paralelní sekvenování (MPS), zejména sekvenování exomu (WES). MPS umožňuje identifikovat i nově vznikající somatické mutace zodpovědné za myeloidní leukemii nebo myelodysplazii.
ZÁVĚR
Správná diagnostika a určení varianty genu podmiňujícího vznik dědičné neutropenie jsou klíčové pro stanovení rizik spojených s diagnózou. Lze předpokládat, že se s rozvojem a dostupností metod molekulární genetiky v budoucnosti stane diagnostika těchto onemocnění rutinní součástí hematologické péče. Nové diagnostické možnosti a rozšiřování poznatků o jednotlivých onemocněních povedou k dřívějšímu stanovení diagnózy DN u pacientů s netypickou klinickou prezentací, a umožní tak nastavit screeningová vyšetření, bezpečný výběr dárců a/nebo intenzitu léčebného režimu pro provedení HSCT a případně zacílit léčbu individuálním směrem.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
KSK – příprava rukopisu; ZV, MS a MŠ – kritická revize a doplnění rukopisu; JT, LR, IB, JŠ, VB a ŠP – korekce a revize rukopisu; MD – kritická revize, doplnění a úpravy rukopisu; všichni spoluautoři schválili konečnou verzi rukopisu.
PROHLÁŠENÍ O KONFLIKTU ZÁJMŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
PODĚKOVÁNÍ
Práce byla podpořena grantovým projektem MZ ČR (grant AZV NU20-08-00137) a COST Action CA18233.
Do redakce doručeno dne: 26. 5. 2021.
Přijato po recenzi dne: 19. 7. 2021.
Mgr. Kateřina Staňo Kozubík, Ph.D.
CEITEC MU a FN Brno
Kamenice 5, budova E35
625 00 Brno
e-mail: 55191@mail.muni.cz
Zdroje
1. Mason BA, Lessin L, Schechter GP. Marrow granulocyte reserves in black Americans. Hydrocortisone-induced granulocytosis in the ‘benign’ neutropenia of the black. Am J Med. 1979; 67 : 201–205.
2. Donadieu J, Beaupain B, Mahlaoui N, Bellanné-Chantelot C. Epidemiology of congenital neutropenia. Hematol Oncol Clin North Am. 2013; 27 : 1–17.
3. Donadieu J, Beaupain B, Fenneteau O, Bellanné-Chantelot C. Congenital neutropenia in the era of genomics: classification, diagnosis, and natural history. Br J Haematol. 2017; 179 : 557–574.
4. Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: A joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015; 17 : 405–424.
5. Brnich SE, Abou Tayoun AN, Couch FJ, et al. Recommendations for application of the functional evidence PS3/BS3 criterion using the ACMG/AMP sequence variant interpretation framework. Genome Med. 2019; 12.
6. Summers C, Rankin SM, Condliffe AM, et al. Neutrophil kinetics in health and disease. Trends Immunol. 2010; 31 : 318–324.
7. Beekman R, Valkhof MG, Sanders MA, et al. Sequential gain of mutations in severe congenital neutropenia progressing to acute myeloid leukemia. Blood. 2012; 119 : 5071–5077.
8. Skokowa J, Steinemann D, Katsman-Kuipers JE, et al. Cooperativity of RUNX1 and CSF3R mutations in severe congenital neutropenia: a unique pathway in myeloid leukemogenesis. Blood. 2014; 123 : 2229–2237.
9. West RR, Hsu AP, Holland SM, Cuellar-Rodriguez J, Hickstein DD. Acquired ASXL1 mutations are common in patients with inherited GATA2 mutations and correlate with myeloid transformation. Haematologica. 2014; 99 : 276–281.
10. Lindsley RC, Saber W, Mar BG, et al. Prognostic mutations in myelodysplastic syndrome after stem-cell transplantation. N Engl J Med. 2017; 376 : 536–547.
11. Xia J, Miller CA, Baty J, et al. Somatic mutations and clonal hematopoiesis in congenital neutropenia. Blood. 2018; 131 : 408–416.
12. Pasquet M, Bellanné-Chantelot C, Tavitian S, et al. High frequency of GATA2 mutations in patients with mild chronic neutropenia evolving to MonoMac syndrome, myelodysplasia, and acute myeloid leukemia. Blood. 2013; 121 : 822–829.
13. Spinner MA, Sanchez LA, Hsu AP, et al. GATA2 deficiency: A protean disorder of hematopoiesis, lymphatics, and immunity. Blood. 2014; 123: 809–821.
14. Donadieu J, Fenneteau O, Beaupain B, et al. Classification of and risk factors for hematologic complications in a French national cohort of 102 patients with Shwachman-Diamond syndrome. Haematologica. 2012; 97 : 1312–1319.
15. Bellanné-Chantelot C, Clauin S, Leblanc T, et al. Mutations in the ELA2 gene correlate with more severe expression of neutropenia: A study of 81 patients from the French Neutropenia Register. Blood. 2004; 103 : 4119–4125.
16. Donadieu J, Barkaoui M, Bézard F, et al. Renal carcinoma in a patient with glycogen storage disease Ib receiving long-term granulocyte colony-stimulating factor therapy. Am J Pediatr Hematol Oncol. 2000; 22 : 188–189.
17. Beaussant Cohen S, Fenneteau O, Plouvier E, et al. Description and outcome of a cohort of 8 patients with WHIM syndrome from the French Severe Chronic Neutropenia Registry. Orphanet J Rare Dis. 2012; 7 : 71.
18. Rosenberg PS, Alter BP, Bolyard AA, et al. The incidence of leukemia and mortality from sepsis in patients with severe congenital neutropenia receiving long-term G-CSF therapy. Blood. 2006; 107 : 4628–4635.
19. Rosenberg PS, Zeidler C, Bolyard AA, et al. Stable long-term risk of leukaemia in patients with severe congenital neutropenia maintained on G-CSF therapy: Short report. Br J Haematol. 2010; 150 : 196–199.
20. Rippey JJ. Leucopenia in West Indians and Africans. Lancet. 1967; 290 : 44.
21. Shoenfeld Y, Alkan ML, Asaly A, Carmeli Y, Katz M. Benign familial leukopenia and neutropenia in different ethnic groups. Eur J Haematol. 1988; 41 : 273–277.
22. Weingarten MA, Pottick-Schwartz EA, Brauner A. The epidemiology of benign leukopenia in Yeminite Jews. Isr J Med Sci. 1993; 29 : 297–299.
23. Denic S, Showqi S, Klein C, et al. Prevalence, phenotype and inheritance of benign neutropenia in Arabs. BMC Blood Disord. 2009; 9 : 3.
24. Hsieh MM, Everhart JE, Byrd-Holt DD, Tisdale JF, Rodgers GP. Prevalence of neutropenia in the U.S. population: age, sex, smoking status, and ethnic. Ann Intern Med. 2007; 146 : 486–492.
25. Le Van Kim C, Tournamille C, Kroviarski Y, Cartron JP, Colin Y. The 1.35-kb and 7.5-kb Duffy mRNA isoforms are differently regulated in various regions of brain, differ by the length of their 5´ untranslated sequence, but encode the same polypeptide. Blood. 1997; 90 : 2851–2853.
26. Duchene J, Novitzky-Basso I, Thiriot A, et al. Atypical chemokine receptor 1 on nucleated erythroid cells regulates hematopoiesis. Nat Immunol. 2017; 18 : 753–761.
27. Cowland JB, Borregaard N. Molecular characterization and pattern of tissue expression of the gene for neutrophil gelatinase-associated lipocalin from humans. Genomics. 1997; 45 : 17–23.
28. Germeshausen M, Deerberg S, Peter Y, et al. The spectrum of ELANE mutations and their implications in severe congenital and cyclic neutropenia. Hum Mutat. 2013; 34 : 905–914.
29. Belaaouaj AA, Kwang Sik Kim, Shapiro SD. Degradation of outer membrane protein A in Escherichia coli killing by neutrophil elastase. Science. 2000; 289 : 1185–1187.
30. Xia J, Link DC. Severe congenital neutropenia and the unfolded protein response. Curr Opin Hematol. 2008; 15 : 1–7.
31. Nanua S, Sajjan U, Keshavjee S, Hershenson MB. Absence of typical unfolded protein response in primary cultured cystic fibrosis airway epithelial cells. Biochem Biophys Res Commun. 2006; 343 : 135–143.
32. Walter P, Ron D. The unfolded protein response: From stress pathway to homeostatic regulation. Science. 2011; 334 : 1081–1086.
33. Szegezdi E, Logue SE, Gorman AM, Samali A. Mediators of endoplasmic reticulum stress‐induced apoptosis. EMBO Rep. 2006; 7 : 880–885.
34. Cho HK, Jeon IS. Different clinical phenotypes in familial severe congenital neutropenia cases with same mutation of the ELANE gene. J Korean Med Sci. 2014; 29 : 452–455.
35. Yap S V., Koontz JM, Kontrogianni-Konstantopoulos A. HAX-1: A family of apoptotic regulators in health and disease. J Cell Physiol. 2011; 226 : 2752–2761.
36. Bartocci A, Laino D, Di Cara G, Verrotti A. Epilepsy in Kostmann syndrome: report of a case and review of the literature. Acta Neurol Belg. 2016; 116 : 359–362.
37. Roques G, Munzer M, Barthez M-AC, et al. Neurological findings and genetic alterations in patients with Kostmann syndrome and HAX1 mutations. Pediatr Blood Cancer. 2014; 61 : 1041–1048.
38. Fadeel B, Grzybowska E. HAX-1: A multifunctional protein with emerging roles in human disease. Biochim Biophys Acta – Gen Subj. 2009; 1790 : 1139–1148.
39. Wilson DB, Link DC, Mason PJ, Bessler M. Inherited bone marrow failure syndromes in adolescents and young adults. Ann Med. 2014; 46: 353–363.
40. Myers KC, Davies SM, Shimamura A. Clinical and molecular pathophysiology of Shwachman-Diamond syndrome. An update. Hematol Oncol Clin North Am. 2013; 27 : 117–128.
41. Giampietro PF, Verlander PC, Davis JG, Auerbach AD. Diagnosis of Fanconi anemia in patients without congenital malformations: An International Fanconi Anemia Registry study. Am J Med Genet. 1997; 68 : 58–61.
42. Parinda A Mehta, MD and Jakub Tolar, MD P. Fanconi Anemia – GeneReviews® – NCBI Bookshelf. Available at: https: //www.ncbi.nlm.nih.gov/books/NBK1401/. (Accessed: 6th April 2021).
43. Waisfisz Q, Morgan N V., Savino M, et al. Spontaneous functional correction of homozygous Fanconi anaemia alleles reveals novel mechanistic basis for reverse mosaicism. Nat Genet. 1999; 22 : 379–383.
44. Dotta L, Badolato R. Primary immunodeficiencies appearing as combined lymphopenia, neutropenia, and monocytopenia. Immunol Lett. 2014; 161 : 222–225.
45. Dickinson RE, Griffin H, Bigley V, et al. Exome sequencing identifies GATA-2 mutation as the cause of dendritic cell, monocyte, B and NK lymphoid deficiency. Blood. 2011; 118 : 2656–2658.
46. Collin M, Dickinson R, Bigley V. Haematopoietic and immune defects associated with GATA2 mutation. Br J Haematol. 2015; 169 : 173–187.
47. Grossman J, Cuellar-Rodriguez J, Gea-Banacloche J, et al. Nonmyeloablative allogeneic hematopoietic stem cell transplantation for GATA2 deficiency. Biol Blood Marrow Transplant. 2014; 20 : 1940–1948.
48. Cuellar-Rodriguez J, Hickstein DD, Grossman JK, et al. Nonmyeloablative Versus Myeloablative Allogeneic Hematopoietic Stem Cell Transplant for GATA2 Deficiency. Blood. 2014; 124 : 1247–1247.
49. Cuellar-Rodriguez J, Gea-Banacloche J, Freeman AF, et al. Successful allogeneic hematopoietic stem cell transplantation for GATA2 deficiency. Blood. 2011; 118 : 3715–3720.
50. Hickstein DD, Shah NN, Freeman A, Zerbe C, Holland SM. Allogeneic hematopoietic stem cell transplant for GATA2 deficiency. Blood. 2016; 128 : 1500–1500.
51. Saida S, Umeda K, Yasumi T, et al. Successful reduced-intensity stem cell transplantation for GATA2 deficiency before progression of advanced MDS. Pediatr Transplant. 2016; 20 : 333–336.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek HypereozinofilieČlánek Redakční sdělení
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hypereozinofilie
- Je možné pomocí časné molekulární odpovědi a její kinetiky předpovědět další osud pacientů s chronickou myeloidní leukemií?
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
- Prvních 50 COVID-19 pozitivních pacientů na Klinice hematoonkologie Fakultní nemocnice Ostrava v roce 2020
- Ohlédnutí za 2. českým hematologickým a transfuziologickým sjezdem
- Prof. MUDr. Jaroslav Malý, CSc., slaví 75 let
- Prof. MUDr. Vladimír Mihál, CSc. – sedmdesátiletý
- Redakční sdělení
- P31. REBOUND BASOPHILIA DURING CYTOREDUCTION IN PATIENTS WITH CHRONIC MYELOID LEUKAEMIA
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hypereozinofilie
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



