-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypereozinofilie
Hypereosinophilia
Hypereosinophilia (HE) and hypereosinophilic syndrome (HES) represent very polymorphic syndromes often involving very difficult differential diagnosis. HES with serious end-organ damage must be treated promptly, especially in the presence of cardiac involvement. Parasitic infections are the most frequent cause of HE worldwide, yet they are rare in our latitudes. In developed countries, the main causes of HE include atopies (asthma, rhinitis, atopic dermatoses), drug reactions, autoagressive diseases and malignancies. In about 50% of patients with HES no specific cause is detected and these cases are termed idiopathic HES (iHES). High-dose corticosteroids represent the first-line therapy of severe HES, with promise being shown by biological treatments in the form of monoclonal antibodies (mepolizumab, reslizumab, benralizumab, alemtuzumab). Tyrosine-kinase inhibitors (TKI) are indicated in HE with proven aberrant tyrosine-kinase activity. Chronic eosinophilic leukaemia – not otherwise specified (CEL-NOS) requires a specific approach. Progress in research may in the near future help elucidate the specific cause of some iHES.
Keywords:
therapy – hypereosinophilia – diagnosis – hypereosinophilic syndrome – chronic eosinophilic leukaemia
Autoři: J. Novotný
Působiště autorů: Oddělení klinické hematologie, FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 4, p. 278-282.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2021278Souhrn
Hypereozinofilie (HE) a hypereozinofilní syndrom (HES) představují etiopatogeneticky velmi polymorfní patologické syndromy mnohdy s obtížnou diferenciální diagnostikou. HES se závažným postižením tkání a orgánů vyžaduje promptní terapeutický zásah, zvláště při poškození srdce. Celosvětově jsou nejčastější příčinou HE parazitární onemocnění, v našich zeměpisných podmínkách je zatím vzácná. V rozvinutých zemích jsou nejčastější etiologií atopie (astma, rinitida, atopické dermatózy), lékové alergie, autoagresivní procesy a neoplazie. Asi u 50 % pacientů s HES se nepodaří prokázat příčinu HE – zde hovoříme o idiopatickém HES (iHES). Lékem první volby u závažného HES jsou vysokodávkované kortikosteroidy, slibná jsou biologická léčiva ve formě monoklonálních protilátek (mepolizumab, reslizumab, benralizumab, alemtuzumab), u HE s prokázanou aberantní tyrozinkinázovou aktivitou indikujeme inhibitory tyrozinové kinázy (TKI). Specifický přístup vyžaduje chronická eozinofilní leukemie (CEL-NOS – not otherwise specified). S postupným odhalováním prozatím nejasných příčin HE bude u řady pacientů s diagnózou iHES odkryta specifická etiologie HE.
Klíčová slova:
terapie – diagnóza – hypereozinofilie – hypereozinofilní syndrom – chronická eozinofilní leukemie
Úvod
Normální zastoupení eozinofilů v periferní krvi odpovídá 0–6 % rozpočtu s absolutními hodnotami 0–0,5×109/l, přičemž hypoeozinofilie není spojena s žádnými patologickými projevy [1]. Normální hodnoty eozinofilů v kostní dřeni jsou 1–6 % rozpočtu. Eozinofily jsou terminálně diferencovanými granulocyty, které hrají roli v přirozené imunitě, tkáňovém remodelingu a reparaci a jsou spojeny s patogenezí určitých onemocnění [1]. Eozinofily jsou primárně tkáňově rezidentními leukocyty. Za normálních okolností eozinofily opouštějí periferní cirkulaci a migrují do tkání, kde mohou perzistovat několik týdnů. Gastrointestinální trakt představuje největší rezervoár eozinofilů, ve kterém jsou tyto buňky přítomné ve sliznici od žaludku po tlusté střevo [2]. O eozinofilii hovoříme při zmnožení těchto elementů v periferii nad hodnotu 0,5×109/l, přičemž hodnoty 0,5–1,5×109/l označujeme jako mírnou eozinofilii. Při hodnotách 1,5–5,0×109/l hovoříme o středně těžké eozinofilii a hodnoty nad 5,0×109/l označujeme jako těžkou eozinofilii [2]
HYPEREOZINOFILIE A HES
Termínem hypereozionofilie (HE) rozumíme zmnožení eozinofilů nad 1,5×109/l, které perzistuje nejméně ve dvou stanoveních v odstupu více než 6 měsíců a/nebo kratší dobu při výrazné tkáňové infiltraci a/nebo výrazné dřeňové hypereozinofilii (zmnožení eozinofilní linie nad 20 % rozpočtu) [2,3]. Pokud je HE spojena s patologiemi cílových orgánů (poškození a/nebo poruchy funkce srdce, nervové soustavy, kůže, plic a GIT), diagnostikujeme po vyloučení klonální a reaktivní (sekundární) hypereozinofilie hypereozinofilní syndrom (HES). HES představuje velmi heterogenní skupinu klinických syndromů. Někteří nemocní vykazují známky HES i roky po stanovení periferní HE [2].
HE můžeme nazírat jako sekundární (reaktivní) formu s přítomností řady klinických syndromů a jednotek a jako primární klonální procesy při přítomnosti specifických genetických odchylek a/nebo u myeloidních patologií, kdy jsou eozinofily součástí klonálních proliferací (myeloidní HES-mHES).
Sekundární formy HE jsou zapříčiněny nadprodukcí IL-3, IL-5 a GM-CSF, které secernují mastocyty, stromální elementy a T-lymfocyty [4]. Nejčastější příčinou sekundární HE celosvětově představují parazitární onemocnění. V našich podmínkách jsou sekundární HE způsobeny přítomností alergií, polékových reakcí, autoagresivních onemocnění a neoplazií [4].
L-HES je zapříčiněn klonální hyperplazií aberantních T-Lymfocytů (CD4+CD3–) s hyperprodukcí IL-5. Klonální expanzi T-lymfocytů prokazujeme přestavbou T-celulárního receptoru [4].
Familiární HES je vzácným autozomálně dominantním onemocněním s nejasnou patogenezí, zatím zde nebyly prokázány specifické mutace. Onemocnění vykazuje většinou benigní průběh [1].
Primární (idiopatický) HES diagnostikujeme per exclusionem při neprokázání reaktivních nebo klonálních etiologií po extenzivním vyšetření pacienta [5]. Až 50 % HES spadá do této kategorie (iHES). S přibývajícími poznatky v diagnostice HES bude u řady případů iHES postupně nalezena specifická příčina.
Orgánová postižení u HES jsou způsobena degranulací eozinofilů s lokálním uvolněním potencionálně toxických substancí (maior basic protein 1 a 2, eozinofilní peroxidáza, eozinofilní kationický protein, eozinofilní neurotoxin). Postiženy mohou být kterékoli tkáně či orgány – nejčastěji se jedná o kůži, plíce, CNS, periferní nervy, GIT, srdce. Zvláště kardiální postižení (endomyokardiální fibróza, srdeční insuficience, trombózy s embolickými příhodami, restriktivní kardiomyopatie, poruchy rytmu, akutní infarkt myokardu, mitrální a trikuspidární valvulární insuficience) je spojeno s významnou mortalitou. U HES často detekujeme všeobecné příznaky (teploty, noční poty, úbytek váhy, artralgie, myalgie). Další příznaky souvisejí s výše uvedenými postiženími orgánů [1].
Nejčastější parazitární onemocnění představují Ancylostoma duodenale, Toxocarosis, Bilharziosis, Trichinelosis, Filariosis, Strongyloidiasis. Mezi infekční příčiny HE mohou patřit i HIV infekce, COVID-19 infekce [6], mykotická onemocnění, scabies, bakteriální infekce, alergická bronchopulmonární aspergilóza [7]. Při podezření na parazitární etiologii HE je nutná anamnéza cestování do tropických oblastí, dále jsou indikována serologická vyšetření a vyšetření stolice na parazity, případně vajíčka helmintů. Je vhodná konzultace parazitologa.
HE může být vzácně přítomna u Addisonovy choroby a tyreotoxikózy [7].
Alergické etiologie HE jsou spojeny s diagnózou astmatu, alergické rinitidy, atopické dermatózy a polékových přecitlivělostí. Řada medikamentů může vyvolat alergickou reakci či reakci se systémovými příznaky (exantém, teploty, lymfadenopatie, pneumonie, hepatitis a renální insuficience), hovoříme zde o DRESS syndromu (drug rash with eosinophilia and systemic symptoms). DRESS syndrom může mít i fatální průběh [1]. Často u alergických symptomů nacházíme zvýšení IgE. V diagnostice alergických syndromů provádíme funkční plicní vyšetření a kožní testy odhalující hypersenzitivitu, eventuálně bronchoskopii s histologickým vyšetřením, dále invazivní bronchoalveolární laváž s průkazem eozinofilů ve vzorku.
Autoagresivní onemocnění mohou být spojena s HE. Jedná se o systémový lupus erythematodes, revmatoidní artritidu, zánětlivá střevní onemocnění (colitis ulcerosa, morbus Crohn), eozinofilní granulomatóza s polyangitidou (EGPA syndrom, dříve Churg-Strauss syndrom) [8], chronická reakce štěpu vůči hostiteli (graft-versus host disease – GvHD) apod. Indikujeme zde vyšetření autoprotilátek (ANA, anti-DS DNA, ANCA aj.).
Neoplazie jako příčina sekundární HE: byly popsány B a T lymfoproliferace, Hodgkinův lymfom, bronchiální karcinom, GIT nádory (tumory žaludku, kolon, pankreatu) [1].
Etiopatogeneticky nejasné syndromy představují eozinofilní fasciitis, eozinofilní ezofagitis, eozinofilní gastroenteritis.
Syndrom eozinofilie myalgie (EMS) je spojen s ingescí tryptofanu. V popředí jsou myalgie, svědění, edémy, myozitida a fasciitida [10]. Toxický Oil syndrom (TOS) po požití anilinem kontaminovaného denaturovaného řepkového oleje postihl 25 000 pacientů eozinofilií, pneumonií, sklerotizující dermatózou a dalšími orgánovými příznaky s 400 až 2500 úmrtími [10,11]. Zajímavostí je zvýšená frekvence výskytu antifosfolipidových protilátek u pacientů s EMS a TOS. Klinický význam těchto protilátek je nejasný [12].
Eozinofilní plicní syndromy vídáme v podobě Löfflerova syndromu (měnlivé eozinofilní plicní infiltráty s eozinofilií různé etiologie – parazitární onemocnění, alergické reakce apod.), alergické bronchopulmonární aspergilózy, chronické eozinofilní pneumonie, aj.
Eozinofilní ezofagitis (EoE) je vzácným onemocněním s příznaky dysfagie a eozinofilní infiltrací omezenou na ezofagus. Při chronickém průběhu vede k remodelaci tkáně a fibróze s výslednou přítomností striktur. Jednotku nutno odlišit od refluxní nemoci. Základním vyšetřením je endoskopie s nejméně 4 bioptickými odběry z různých částí ezofagu. Etiopatogeneze EoE je nejasná, nejčastěji vidíme závislost na antigenech potravy (mléčné výrobky, pšenice, vejce, luštěniny, ořechy, plody moře), častá je přítomnost atopií (astma, rinitidy, ekzémů). V terapii indikujeme dietní opatření, inhibitory protonové pumpy, topické steroidy, eventuální dilataci striktur [13].
EGPA (Churg-Strauss) syndrom je vzácným autoagresivním onemocněním s průkazem vaskulitidy malých a středních cév. Diagnóza je opřena o přítomnost astmatu s eozinofilií, neuropatií, měnlivými plicními infiltráty, postižením paranazálních sinusů a histologickým obrazem vaskulitidy s eozinofilní infiltrací a nekrotizujícími granulomy. Etiopatogeneze EGPA je nejasná (alergeny, infekce, vakcinace a léky). V diferenciální diagnostice je nutné odlišit jiné eozinofilní syndromy a vaskulitidy. Cca 30–60 % nemocných vykazuje pozitivitu ANCA (anti neutrophil cytoplasmatic antibodies). V terapii podáváme kortikoidy a/nebo cyklofosfamid [8]. Diferenciální diagnostika EGPA a HES může být složitá.
S IgG4 asociované onemocnění (IgG4-related disease) může postihnout kterýkoli orgán a může být spojeno se zvýšeným IgE s hypereozinofilií. Časté jsou projevy vaskulitidy malých i velkých cév (vč. aortitidy), histologicky prokážeme denzní lymfoplazmocytární IgG4 infiltrát, fibrózu a mnohdy eozinofilní infiltrát. V terapii je indikováno podání kortikosteroidů, jiných imunosupresiv, v případě refrakterního postižení rituximab [9,10].
Eozinofilní fasciitis byla poprvé popsána Schulmanem v roce 1975 [14]. Jedná se o sklerotizující postižení kůže a fascií s myozitidou. V periferii prokazujeme HE a diagnóza se opírá o bioptické vyšetření. Jsou zvýšeny CRP a muskulární enzymy. Onemocnění příznivě reaguje na kortikoidy, eventuálně na další imunosupresiva. Etiopatogeneze je nejasná (extrémní cvičení, infekce, autoagrese, malignity) [15].
Chronická eozinofilní pneumonie (CEP) je etiopatogeneticky nejasná jednotka s průkazem eozinofilní infiltrace intersticia a alveolů. V terapii jsou indikovány kortikosteroidy, je popsána remise po podání benralizumabu [16].
U klonální HE je eozinofilní linie součástí patologického neoplastického klonu. Prokazujeme zde přestavbu (rearrangement) pro růstový faktor derivovaný z destiček (platelet-derived growth factor receptor alpha – PDGFRA, platelet-derived growth factor receptor beta – PDGFRB), receptor 1 pro růstový faktor fibroblastů (fibroblast growth factor receptor 1 – FGFR1), pericentriolar material 1-Janus kinase 2 (PCM1-JAK2). Jde zde o myeloidní a/nebo lymfoidní neoplazie [17]. Přestavby uvedených genů mají za následek zvýšenou tyrozin-kinázovou aktivitu a terapeuticky je zde indikováno podávání tyrozin-kinázového inhibitoru (TKI) imatinibu, eventuálně dalších TKI [18].
Další skupinu HE tvoří klasické klonální hematologické neoplazie (např. CML, CMML, AML, MDS) s hyperproliferací eozinofilní linie – eozinofily jsou zde rovněž součástí klonální hemoblastózy [18,19]. AML s postižením chromozomu 16 (inv16, t (16; 16)) je spojena s proliferací eozinofilů (AML M4 Eo, ev. vzácná akutní eozinofilní leukemie). U myeloproliferací pravidelně nacházíme zvýšení vitaminu B12 v séru.
Chronická eozinofilní leukemie (CEL-NOS – not otherwise specified) je diagnózou per exclusionem – nejsou přítomny výše popsané genové přestavby nebo BCR/ABL fúze, jsou vyloučeny ostatní klonální hyperproliferace a/nebo sekundární HE. Morfologicky nacházíme zmnožení blastů v periferii (> 2 %) a/nebo ve dřeni (> 5 %), jež nepřesahuje 20 %, a/nebo je prokázána klonální expanze eozinofilní linie. Diferenciální diagnostika idiopatického HES a CEL-NOS může být obtížná [18]. Jsou popsány progrese CEL do AML, vč. akutní eozinofilní leukemie.
Omennův syndrom představuje vrozené onemocnění s absencí B-lymfocytů, infiltrací kůže, jater, sleziny a střevní sliznice oligoklonálními autoreaktivními aktivovanými T-lymfocyty, eozinofilií a zvýšenou koncentrací IgE. Byly prokázány mutace tzv. RAG genů [20].
Systémová mastocytóza může být spojena s HE. Nacházíme zde mutaci KIT D816V a zvýšenou tryptázu v séru s histologickým průkazem mastocytózy v kostní dřeni, kůži a eventuálně v dalších orgánech [18]. Jedná se o vzácné onemocnění. Jde o klonální proliferaci CD34+/KIT+ buněk. HE u mastocytózy je spojena s horší prognózou [21].
VYŠETŘENÍ U HE A HES
Podrobná anamnéza a důkladné fyzikální vyšetření (kožní procesy, hepatosplenomegalie, uzlinový syndrom, astma a rinitida, nosní polypy), kožní alergologické testy, RTG plic, SONO břicha, EKG a echokardiografie, srdeční enzymy, endomyokardiální biopsie, MR a/nebo PET hrudníku, břicha a pánve, KO+diff+trombocyty, morfologie eozinofilů (dysplastické rysy – abnormální granulace, vakuolizace, jaderné hyper - a/nebo hypolobulizace), přítomnost nezralých forem a blastů, cytopenie, sternální punkce a trepanobiopsie – celularita, dysplazie, fibróza, proliferace, blasty. Přítomnost AML, ALL, MDS. Cytogenetika, FISH (PDGFRA,PDGFRB, FGFR1, BCR/ABL, JAK2, jiné aberace, přestavby chromozomu 16, KIT D816V), sérová tryptáza, vitamin B12, průtoková cytometrie (aberantní T-lymfocyty) přestavba T celulárního receptoru, histologická vyšetření dle postižení tkání a orgánů, funkční vyšetření plic, bronchoskopie s eventuální biopsií, eozinofily v invazivní bronchoalveolární laváží, sérologie parazitóz, stolice na parazity opakovaně, autoprotilátky (ANF, ANA, anti-DS DNA, revmatoidní faktor, ANCA), komplement (hypokomplementové vaskulitidy). IgE (zvýšené u sekundárních HE, u HES různé nálezy).
TERAPIE
Terapie sekundární HE spočívá v léčbě základního onemocnění (antiparazitární léky, kortikoidy, další imunosupresiva, mepolizumab u hypereozinofilního astmatu a EGPA, chemoterapie neoplazií) [22].
U idiopatického HES, zvláště s kardiálním postižením, jsou indikovány vysoce dávkované kortikoidy. U kortikoid-rezistentní formy iHES lze vyzkoušet hydroxyureu (HU), avšak nevýhodou je teratogenní účinek HU. Refrakterní iHES s výrazným orgánovým postižením je indikací k transplantační terapii [23]. Mepolizumab a reslizumab viz níže. Cílem terapie HES je snížení počtu eozinofilů pod 1,5×109/l s redukcí orgánových komplikací HES. Pokud je terapie kortikoidy účinná, lze dávku postupně redukovat na nejnižší možnou udržovací léčbu. Variantou je kortikoid šetřící terapie monoklonálními protilátkami.
U klonální HE se zvýšenou tyrozin-kinázovou aktivitou je doporučen TKI imatinib v dávce 100 mg denně, eventuálně další TKI nilotinib a dasatinib [24]. Asi 40 % nemocných vykazuje molekulární remisi i po přerušení léčby TKI, nutno však kontinuálně monitorovat trvání molekulární remise a léčbu TKI zahájit při relapsu [24].
Mepolizumab a reslizumab jsou anti-IL5 monoklonální protilátky, které mají kortikoid šetřící efekt u primární i klonální HE. Mepolizumab je indikován u závažného hypereozinofilního astmatu a EGPA v dávce 100 mg, resp. 300 mg s.c. po 4 týdnech. Reslizumab v dávce 3 mg/kg i.v. každé 4 týdny prokázal účinnost u hypereozinofilního astmatu a EoE. Klinické studie mepolizumabu a reslizumabu u HES probíhají [22].
Benralizumab je humanizovaná monoklonální protilátka proti IL5 receptoru a (IL-5Ra). Po navázání protilátky na povrch eozinofilů se tyto stávají terčem NK (natural killer) buněk prostřednictvím protilátkově dependentní celulární cytotoxitity (ADCC). Výhodou je výrazný pokles eozinofilie. Látka má význam v terapii hypereozinofilního, kortikoid-dependentního astmatu s výrazným kortikoid redukčním efektem. Probíhají studie medikace benralizumabu u HES [22].
Omalizumab je anti-IgE monoklonální protilátka. Význam této protilátky v terapií hypereozinofilních syndromů je omezený.
Dupilumab blokuje IL-4 a IL-13 receptorovou signalizaci. Je indikována v terapii atopické dermatitidy, astmatu, rinitidy s nosními polypy, eozinofilní ezofagitidy (EoE) [22].
Alemtuzumab je anti-CD 52 protilátka. Eozinofily exprimují povrchové CD 52. Protilátka prokázala účinnost u pokročilého HES a CEL-NOS. Pacienti relabovali po vysazení terapie [22].
Ruxolitinib je indikován u HES se zvýšenou JAK1 a JAK2 kinázovou aktivitou (PCM1-JAK2 fúze, JAK2/BCR fúze) [17].
U L-HES kortikoterapie, eventuálně anti-IL5 monoklonální protilátky.
Anti-Siglec-8 (AK002, rilentelimab). Siglec-8 je exprimován na eozinofilech, bazofilech a mastocytech. Klinické studie protilátky u chronické urtikárie, indolentní systémové mastocytózy, HES a atopické keratokonjunktivitidy probíhají [25].
CEL-NOS léčba interferonem α může odpovědět na chemoterapii hydroxyureou nebo léčbou interferonem a. Agresivní formy onemocnění jsou stejně jako refrakterní iHES se závažnými orgánovými komplikacemi indikací k transplantační terapii. Terapie alemtuzumabem viz výše [22].
Trombofilní projevy HES (venózní i arteriální trombózy, intrakardiální tromby s emboliemi) vyžadují medikaci protidestičkovými a/nebo antikoagulačními léky (aspirin, P2Y12 inhibitory, LMWH, warfarin, eventuálně NOACs). Při zahájení kortikoterapie HES se doporučuje prevence hyperkoagulací pomocí LMWH [26].
Chirurgické intervence u HES spočívají v korekci valvulárních postižení (mitrální a trikuspidální chlopeň) a/nebo v operaci endomyokardiální fibrózy – endomyokardektomii. Bioprotézy chlopní jsou vhodnější než mechanické náhrady pro nižší trombotický potenciál [27].
Souhrn dat, týkajících se HE, ilustruje tab. 1.
Tab. 1. Příčiny hypereozinofilního syndromu a jejich léčba. 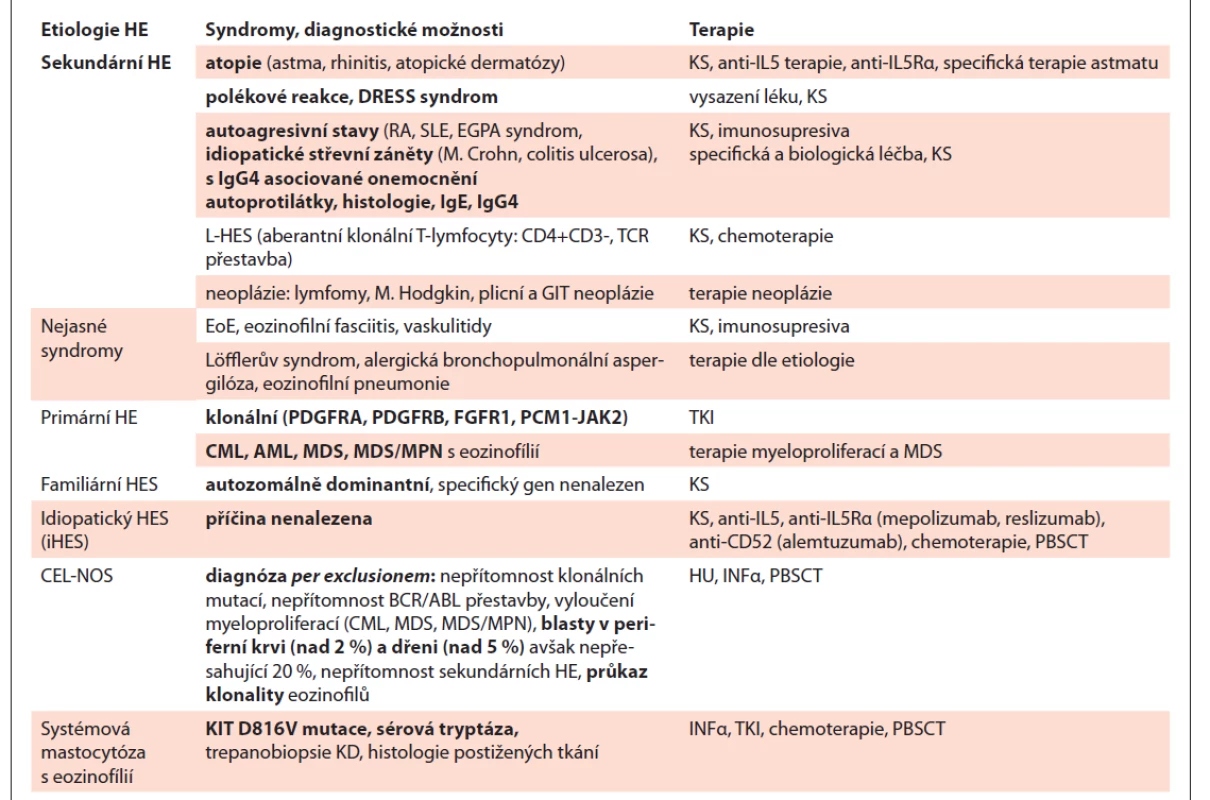
CEL-NOS – chronická eozinofi lní leukémie not otherwise specified, DRESS – drug rush with eosinophilia and systemic symptoms, EGPA – eosinophilic granulomatosis with polyangitis (Churg-Strauss), EoE – eozinofilní ezofagitis, FGFR1 – fibroblast growth factor receptor1, HE – hypereozinofilie, HU – hydroxyurea, IL5Rα – IL5 Receptor α, INFα – interferon α, KS – kostikosteroidy, L-HES – lymfocytární HES, PBSCT – periferal blood stem cell transplantation, PCM1-JAK2 – pericentriolar material1-Janus kinase 2, PDGFRA – platelet derived growth factor receptor alfa, PDGFRB – platelet derived growth factor receptor beta, RA – revmatoidní artritida, SLE – systémový lupus erythematodes, TKI – inhibitory tyrozinové kinázy ZÁVĚR
Nejčastější příčinou HE celosvětově jsou parazitární onemocnění. V našich zeměpisných podmínkách jsou vzácná, s rostoucí migrací budou však parazitózy nabývat na významu i v průmyslově rozvinutých zemích. V České republice jsou t.č. vedoucími etiologiemi HE atopie, polékové reakce vč. závažného DRESS syndromu, autoagresivní stavy a malignity. HES se závažným postižením tkání a orgánů vyžaduje promptní terapeutickou intervenci, zvláště při kardiálním postižení. Lékem první volby u závažného HES jsou vysokodávkované kortikoidy, zkouší se biologická terapie monoklonálními protilátkami (anti-IL5, anti IL5R, alemtuzumab). U HE s prokázanou aberantní tyrozin-kinázovou aktivitou nasazujeme TKI. S postupujícími poznatky budou u dosud idiopatických syndromů (iHES) stále více odkrývány specifické příčiny HE.
Čestné prohlášení
Autor prohlašuje, že v souvislosti s tématem, vznikem a publikací článku není ve střetu zájmů a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne: 10. 5. 2021.
Přijato po recenzi dne: 26. 7. 2021.
MUDr. Jan Novotný, Ph.D.
OKH FN Brno, Jihlavská 20
625 00 Brno
e-mail: novotny.jan@fnbrno.cz
Zdroje
1. Klion AD, Ackerman SJ, Bochner BS. Contributions of eosinophils to human health and disease. Ann Rev Pathol Mech. 2020; 15: 179–209.
2. Schwartz JT, Fulkerson PC. An approach to the evaluation of persistent hypereosinophilia in pediatric patients. Front Immunol. 2018; 9 : 1944.
3. van Balkum M, Kluin-Nelemans H, van Hellemond JJ, et al. Hypereosinophilia: a diagnostic challenge. Netherlands J Med. 2018; 76 : 431–436.
4. Wang SA. The diagnostic work-up of hypereosinophilia. Pathobiol. 2019; 86 : 39–52.
5. Hu Z, Boddu PC, Loghavi S, et al. A multimodality work-up of patients with hypereosinophilia. Am J Hematol. 2018; 93 : 1337–1346.
6. Fraisse M, Logre E, Mentec H, et al. Eosinophilia in critically ill COVID-19 patients: a French monocenter retrospective study. Crit Care. 2020; 24 : 635.
7. Henes JC, Wirths S, Hellmich B. Differenzial Diagnose der Hypereosinophilie. Z Rheumatol. 2019; 78 : 313–321.
8. Venode G, Figueiredo C, Almedia C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome). Rev Assoc Med Bras. 2020; 66 : 904–907.
9. Borges T, Silva S. IgG4-related disease: how to place it in the spectrum of immune-mediated and rheumatologic disorders? Modern Rheumatol. 2020; 30 : 609–616.
10. Schirmer JH, Hoyer BF. HES und weitere rheumatische Erkrankungen mit Hypereosinophilie. Z Rheumatol. 2019; 78 : 322–332.
11. Sanchez-Porro Valades P, Posada de la Plaz M, de Andres Copa P. Toxic oil syndrome: survival in the whole cohort between 1981 and 1995. J Clin Epidemiol. 2003; 56 : 701–708.
12. Carreira PE, Montalvo MG, Kaufman LD, et al. Antiphospholipid antibodies in patients with EMS and TOS. J Rheumatol. 1997; 24 : 69–72.
13. Fernandez-Becker NO, Raja S, Scarpignato C, et al. Eosinophilic esophagitis: updates on key unanswered questions. Ann N Y Acad Sci. 2020; 1481 : 30–42.
14. Shulman LE. Diffuse fasciitis with eosinophilia: a new syndrome? Trans Assoc Am Physic. 1975; 88 : 70–86.
15. Mango RL, Bugdayli K, Crowson C, et al. Baseline characteristics and long-term outcomes of eosinophilic fasciitis in 89 patients seen at a single center over 20 years. Int J Rheum Dis. 2020; 23 : 233–239.
16. Isomoto K, Baba T, Sekine A, et al. Promising effects of benralizumab on chronic eosinophilic pneumonia. Int Med. 2020; 59 : 1195–1198.
17. Mattis DV, Wang SA, Lu CM. Contemporary classification and diagnostic evaluation of HE. Am J Clin Pathol. 2020; 154 : 305–318.
18.Shomali W, Gotlib J. WHO-defined eosinophilic disorders: 2019 update on diagnosis, risk stratification, and management. Am J Hematol. 2019; 94 : 1149–1166.
19. Richardson AI, Skikne BS, Woodroof J. CML, BCR/ABL 1 positive in accelerated phase with marked eosinophilia with eosinophil atypia. Br J Haematol. 2020; 188 : 599.
20. Rigoni R, Fontana E, Dobbs K, et al. Cutaneous barrier leakage nad gut inflammation drive skin disease in Omenn syndrome. J Allergy Clin Immunol. 2020; 146 : 1165–1179.
21. Kluin-Nelemans HC, Reiter A, Illerhaus A, et al. Prognostic impact of eosinophils in mastocytosis: analysis of 2350 patients collected in the ECNM registry. Leukemia. 2020; 34 : 1090–1101.
22. Dispenza MC, Bochner BS. Diagnosis and novel approaches to the treatment of HES. Curr Hematol Malignancy Rep. 2018; 13 : 191–201.
23. Iurlo A, Cattaneo D, Gianelli U. HES in the precision medicine era: clinical, molecular aspects and therapeutic approaches (targeted therapies). Expert Rev Hematol. 2019; 12 : 1077–1088.
24. Helbig G. Imatinib for the treatment of HES. Expert Rev Clin Immunol. 2018; 14 : 163–170.
25. Legrand F, Cao Y, Wechsler JB, et al. Siglec 8 in patients with eosinophilic disorders: receptor expression and targeting using chimeric antibodies. J Allergy Clin Immunol. 2019; 143 : 2227–2237.
26. Brychtová Y, Doubek M. Myeloidní a lymfoidní neoplazie s eozinofilií. In: Doubek M, Mayer J. Léčebné postupy v hematologii 2020 Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. 1. Vyd. Brno, Česká hematologická společnost ČLS JEP, 2020; 173–183.
26. Shomali W, Gotlib J. WHO-defined eosinophilic disorders: 2019 update on diagnosis, risk stratification, and management. Am J Hematol. 2019; 94 : 1149–1167.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Redakční sdělení
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hypereozinofilie
- Je možné pomocí časné molekulární odpovědi a její kinetiky předpovědět další osud pacientů s chronickou myeloidní leukemií?
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
- Prvních 50 COVID-19 pozitivních pacientů na Klinice hematoonkologie Fakultní nemocnice Ostrava v roce 2020
- Ohlédnutí za 2. českým hematologickým a transfuziologickým sjezdem
- Prof. MUDr. Jaroslav Malý, CSc., slaví 75 let
- Prof. MUDr. Vladimír Mihál, CSc. – sedmdesátiletý
- Redakční sdělení
- P31. REBOUND BASOPHILIA DURING CYTOREDUCTION IN PATIENTS WITH CHRONIC MYELOID LEUKAEMIA
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hypereozinofilie
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



