-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
Revaccination of adult patients following allogeneic haematopoietic stem cell transplantation: CELL recommendations
Allogenic haematopoietic stem cell transplantation is associated with a significant alteration of the immune functions and patients after haematopoietic stem cell transplant are at high risk of infectious complications that are associated with significant mortality. Increased susceptibility to infections is caused by many factors such as an immature immune system during the first months after transplantation or functional hyposplenism. Gradual decrease of specific antibodies in most patients with loss of specific immunity acquired in childhood following a vaccination series has also been described. Revaccination after haematopoietic stem cell transplantation is a widely accepted practice for preventing these risks. Patients are indicated for revaccination with inactivated vaccines against Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae type B, pertussis, tetanus, diphtheria, poliomyelitis, influenza and hepatitis B and with live vaccines against measles, rubella, mumps in some cases. Vaccination with inactivated vaccines is initiated according to current recommendations as early as 3 months after transplantation for some types of vaccines. For most vaccines, vaccination consists of 2 to 3 doses 1–2 months apart. Vaccination with live antiviral vaccines is only indicated in selected patients and starts not sooner than 24 months after transplantation. This article presents specific recommendations for vaccination and an overall summary of this topic based on current international recommendations for revaccination of haematopoietic transplant patients.
Keywords:
opportunistic infections – vaccination – haematology – haematopoietic stem cell transplantation – allogeneic haematopoietic transplantation – revaccination
Autoři: T. Kabut 1; I. Kocmanová 2; P. Žák 3; M. Kouba 4; L. Drgoňa 5; M. Navrátil 6; P. Múdrý 7; P. Sedláček 8; J. Haber 9; N. Mallátová 10; D. Dóczyová 11; J. Novák 12; E. Faber 13; B. Weinbergerová 1; J. Štěrba 7; J. Mayer 1; Z. Ráčil 4
Působiště autorů: Interní hematologická a onkologická klinika, FN Brno a LF MU, Brno 1; Oddělení klinické mikrobiologie, FN Brno a LF MU, Brno 2; IV. interní hematologická klinika, FN Hradec Králové, Hradec Králové 3; Ústav hematologie a krevní transfuze, Praha 4; Klinika onkohematológie, LF UK a Národný onkologický ústav, Bratislava 5; Klinika hematoonkologie, FN Ostrava a LF OSU, Ostrava 6; Klinika dětské onkologie, FN Brno, Brno 7; Klinika dětské hematologie a onkologie, FN v Motole, Praha 8; Klinika hematologie, Všeobecná fakultní nemocnice, Praha 9; Pracoviště parazitologie a mykologie, Nemocnice České Budějovice a. s., České Budějovice 10; Transplantačná jednotka kostnej drene – Klinika detskej hematológie a onkológie, Detská fakultná nemocnica s poliklinikou, Bratislava 11; Interní hematologická klinika, FN Královské Vinohrady, Praha, Za Českou leukemickou skupinu – pro život (CELL) 12
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 3, p. 269-280.
Kategorie: Doporučené postupy
Souhrn
Alogenní transplantace krvetvorných buněk je spojena s významnou alterací imunitního systému a pacienti jsou ve významném riziku infekčních komplikací, které jsou spojené s nezanedbatelnou mortalitou. Na této zvýšené vnímavosti k infekcím se spolupodílí četné faktory, jako nezralost imunitního systému v prvních měsících po transplantaci nebo funkční hyposplenismus. U většiny pacientů je také popsán postupný pokles hladiny specifických protilátek se ztrátou specifické imunity získané v dětství po sérii povinného očkování nebo přímým setkáním s infekčním agens. Revakcinace pacientů po transplantaci krvetvorných buněk je tak dnes již všeobecně přijímaným postupem. V rámci revakcinace je indikováno očkování neživými vakcínami proti Streptococcus pneumonie, Neisseria meningitidis, Haemophilus influenzae typ B, pertusi, tetanu, záškrtu, poliomyelitidě, chřipce a hepatitidě B a u části nemocných živými vakcínami proti spalničkám, zarděnkám, příušnicím. Vakcinace neživými vakcínami je podle současných doporučení zahajována již od 3. měsíce po transplantaci. U většiny vakcín se skládá z 2–3 dávek v odstupu 1–2 měsíců. Vakcinace živými antivirovými vakcínami je indikována jen u části pacientů a probíhá nejdříve 24 měsíců po transplantaci. Tato práce vycházející ze současných mezinárodních doporučení shrnuje problematiku revakcinace nemocných po transplantaci krvetvorných buněk.
Klíčová slova:
transplantace krvetvorných buněk – vakcinace – hematologie – oportunní infekce – alogenní transplantace krvetvorby – revakcinace
ÚVOD
Infekční komplikace jsou u pacientů po transplantaci krvetvorných buněk (haematopoietic stem cell transplantation, HSCT) spojeny se signifikantní morbiditou a mortalitou [1–4]. Zvýšená vnímavost k infekcím, často s těžkým průběhem, je dána významným, komplexním a dlouhodobým oslabením imunitních funkcí. Tato dysfunkce imunity bývá významnější zejména u nemocných po alogenní HSCT. Přestože se stav imunity po alogenní HSCT může v jednotlivých případech vlivem různých faktorů významně lišit (základní choroba, intenzita přípravného režimu, typ a kvalitativní parametry transplantátu, prevence nemoci štěpu proti hostiteli (graft versus host disease, GVHD) metody T-buněčné deplece, věk pacienta a další), lze rekonstituci imunity částečně rozčlenit do několika fází [2, 5, 6]. Tyto fáze mohou být provázeny komplikacemi, včetně infekčních, charakteristickými pro dané období. Časně po podání přípravného režimu a provedení HSCT prochází pacienti obdobím dřeňové aplazie, které trvá přibližně 2–3 týdny a je stran infekčních komplikací charakterizováno především bakteriálními a mykotickými infekcemi [3]. Posléze se jako první postupně obnovuje nespecifická imunita při restituci monocytů, neutrofilů a NK buněk. Naproti tomu obnova specifické imunity, vázané na funkci T a B lymfocytů (celulární a humorální složka), může, zejména po alogenní HSCT, trvat v řádu měsíců až let [5, 7]. V potransplantační obnově T lymfocytární imunity se uplatňují dva mechanismy – časná obnova vázaná na periferní expanzi paměťových T lymfocytů z infuze transplantovaných buněk (především cytotoxické CD8+) a pozdní vázaná na de novo vznik T lymfocytů z darovaných hematopoetických prekurzorů (především regulační CD4+) [2, 5, 7]. Časově dochází k restituci T-buněčné imunity v řádech měsíců (od 6–9 měsíce po HSCT) a je ovlivněna řadou faktorů jako užití T-deplečních postupů (např. antithymocytární imunoglobulin (ATG)), involucí thymu u starších pacientů a dalších [5]. K obnově počtu B-lymfocytů dochází v průběhu prvních měsíců po HSCT. Samotný deficit humorální imunity charakterizovaný nízkým počtem paměťových B buněk, poklesem protektivních titrů protilátek a stavem odpovídajícím funkční hyposplenii ale může trvat až řadu let [5]. Kromě ostatních faktorů je tento proces závislý na správné funkci T-buněčné imunity (regulace CD4+ lymfocyty) a je významně negativně ovlivněn terapií anti-CD20 protilátkami podávanými především v rámci udržovací léčby [2, 5]. V období neplnohodnotné funkce T-lymfocyty a B lymfocyty zajišťované imunity se můžeme setkat dominantně s virovými infekcemi (cytomegalovirus (CMV), Epsteina-Barrové virus (EBV), BK virus, respirační viry a další), incidence bakteriálních infekcí přítomných v období aplazie klesá [1, 3, 5]. Vlivem postupného poklesu protektivních titrů protilátek a funkční hyposplenie se ovšem zvyšuje riziko specifických infekcí vyvolaných opouzdřenými bakteriemi jako Streptococcus pneumonie, Neisseria meningitidis a další [3, 8, 9].
Celkový stav imunitního systému po HSCT vede u většiny nemocných ke ztrátě specifické imunity získané v minulosti. Ta je u běžné populace zajištěna sérií povinného očkování proti vybraným patogenům v dětském věku, nebo dokonce prodělanou infekcí při plně funkčním imunitním systému [1, 3, 8, 10, 11]. Ztráta této specifické imunity spolu s obecně zvýšenou vnímavostí k infekcím je navíc akcentována současnou epidemiologickou situací. Ještě v nedávné minulosti se některé infekční choroby (spalničky, černý kašel) vyskytovaly v běžné populaci díky povinnému očkování jen ojediněle. V současnosti vlivem poklesu proočkovanosti všeobecné populace proti těmto onemocněním dochází k jejich opětovnému výskytu, místy až charakteru lokálních epidemií, jež je dalším rizikem pro imunokompromitované pacienty [12, 13]. V rámci prevence těchto infekčních komplikací, které mohou mít u pacientů po HSCT velmi závažný průběh, jsou pacienti po transplantaci krvetvorných buněk indikovaní k revakcinaci proti vybrané skupině patogenů [1, 8, 14, 15].
1 OBECNÉ POSTUPY PRO VAKCINACI PO HSCT
1. 1 Rozsah vakcinace
V aktuálních dostupných mezinárodních doporučeních (European Conference on Infections in Leukaemia (ECIL), Infectious Diseases Society of America (IDSA) a další) [8, 15–18] nejsou stran revakcinace rozlišováni pacienti po alogenní nebo autologní HSCT. Nicméně indikace a provedení vakcinace u pacientů po autologní HSCT může být v klinické praxi problematická. Jen obtížně proveditelná je u pacientů s mnohočetným myelomem, kteří transplantaci často podstupují opakovaně i v krátkých časových intervalech. Druhou skupinou nemocných jsou především pacienti s non-hodgkinovými lymfomy (NHL), u kterých v mnoha případech předchází a/nebo následuje terapie anti-CD20 protilátkami (rituximab), jež dlouhodobě výrazně snižuje efekt vakcinace [19–22]. Imunitní deficit však nedosahuje stavu po alogenní transplantaci (není imunosupresivní terapie a cílená deplece T lymfocytů v buněčných štěpech, absence rizika GVHD s její léčbou atd.) a kompletní revakcinace trvající několik měsíců může být samotným pacientem vnímána negativně. Její nezbytnost a provedení jsou proto i u nemocných s NHL v klinické praxi často problematické, a nejednoznačné, vzhledem k relativně malému množství dat. Všichni tito pacienti by ovšem měli být pravidelně očkovaní proti chřipce (minimálně 2 roky od HSCT nebo po dobu předpokládaného imunodeficitu). U splenektomovaných nemocných po autologní HSCT je samozřejmostí kompletní vakcinace proti pneumokokům, meningokokům a hemofilu typu B [9, 23]. Revakcinace po alogenní HSCT je složena z očkování neživými vakcínami proti Streptococcus pneumonie, Neisseria meningitidis, Haemophilus influenzae typ B (HiB), pertusi, tetanu, záškrtu, poliomyelitidě, chřipce a hepatitidě B [1, 8, 15, 16]. Vakcinace živými vakcínami proti spalničkám, zarděnkám, příušnicím a varicella-zoster viru (VZV) může být spojena s rozvojem infekce vakcinačním kmenem a je proto indikována pouze u části pacientů [1, 15, 24, 25].
1. 2 Časování vakcinace
Na době zahájení vakcinace po HSCT nepanuje v odborné veřejnosti zcela jednoznačná shoda, i když rozdíly mezi jednotlivými doporučeními jsou jen malé. Deficit imunity v prvních měsících po HSCT může vést k nedostatečné odpovědi na vakcínu s následným poklesem protektivních protilátek. Protože je riziko infekčních komplikací časně po transplantaci nejvyšší [3, 5] a v mnoha případech byla prokázána podobná účinnost vakcinace při časném i pozdějším podání po HSCT, dochází k posunu zahájení očkování neživými vakcínami (inaktivované, toxoidy, rekombinantní aj.) již do prvních měsíců (6.–12. měsíc) [2, 15]. S ohledem na možnou nižší účinnost vakcín podaných časně po HSCT je u všech očkovacích látek k upevnění imunitní odpovědi nutný opakovaný „booster“ (opakovaní dávky s cílem posílení imunitní odpovědi) [2]. Odlišná oproti neživým vakcínám je situace v případě živých oslabených vakcín (spalničky, zarděnky, příušnice, VZV aj.), kde panuje obava z možných infekčních komplikací vakcinačním kmenem. Aplikace živých vakcín bývá doporučována nejdříve 24 měsíců po provedení HSCT, přičemž ale i poté je nutné zhodnotit možné kontraindikace a očkovat jen specifickou indikovanou skupinu nemocných (viz dále) [1, 15, 16]. Odklad veškeré vakcinace minimálně 6 měsíců po poslední dávce (živé i neživé očkovací látky) je nezbytný u pacientů léčených rituximabem [16] v udržovací terapii po HSCT, neboť byla opakovaně prokázána snížená imunitní odpověď po autologní transplantaci až několik měsíců od poslední dávky rituximabu [26]. Ještě významnější je potlačení imunitní odpovědi rituximabem u nemocných po alogenní transplantaci, u kterých tato snížená efektivita v některých případech trvala i déle než 24 měsíců od poslední dávky [20, 27, 28]. Na rozdíl od rituximabu nebyla dosud jednoznačně prokázána nedostatečná účinnost vakcinace při standardní imunosupresivní terapii (cyklosporin, metotrexát, mykofenolát aj.). Určité snížení odpovědi lze pravděpodobně očekávat, nicméně podle současných doporučení není probíhající imunosuprese jednoznačnou indikací k odkládání vakcinace a odklad by měl být zvažován pouze při vysoce intenzivní kombinované imunosupresi nebo vysokodávkované kortikoterapii [15, 16]. Dalším možným důvodem pro odklad vakcinace může být v mnoha případech GVHD. Ta je kontraindikací pouze k podání živých vakcín [1, 15, 16]. Podání neživých vakcín (většina očkovacích látek) není spojeno s jejich zásadně nižší účinností [20, 27–28], ani se zhoršením GVHD nebo vyšším výskytem nežádoucích účinků [30–32]. Naopak, protože přítomnost GVHD u pacientů po alogenní transplantaci krvetvorných buněk je významným přídatným rizikovým faktorem pro řadu infekcí, mohou tito pacienti o to více profitovat z časně provedené vakcinace, zejména z vakcinace proti chřipce a pneumokokům. Z těchto důvodů by mělo být očkování neživými vakcínami odkládáno pouze v případě těžké nebo maximálně středně těžké formy GVHD [16]. Podobná je situace při nízké koncentraci lymfocytů (CD4+ nebo CD19+), která bývá v některých případech považována za známku nedostatečné obnovy imunitního systému spojené s rizikem snížené vakcinační odpovědi [31, 33]. Jelikož není stanoven konkrétní práh pro množství lymfocytů, při kterém je vhodné vakcinaci zahájit, opět by ani tento parametr neměl být důvodem pro odklad vakcinace [16, 29, 34, 35]. Na zvážení je naopak odklad vakcinace neživými vakcínami při těžké hypogamaglobulinemii pod 3 g/l [16], kdy lze očekávat významnou alteraci imunitní odpovědi [34]. Plně indikován je odklad aplikace živých vakcín v případech substituce imunoglobulinů, které inhibují virovou replikaci, a zhoršují tak účinnost očkování [36].
Tato popsaná kritéria, kdy je u pacienta indikován odklad vakcinace, jsou sumarizována v tabulce 1. Nesplňuje-li pacient žádné z těchto kritérií, měla by být zahájena vakcinace dle dále uvedených doporučení.
Tab. 1. Indikace k odkladu vakcinace u pacientů po alogenní transplantaci krvetvorných buněk 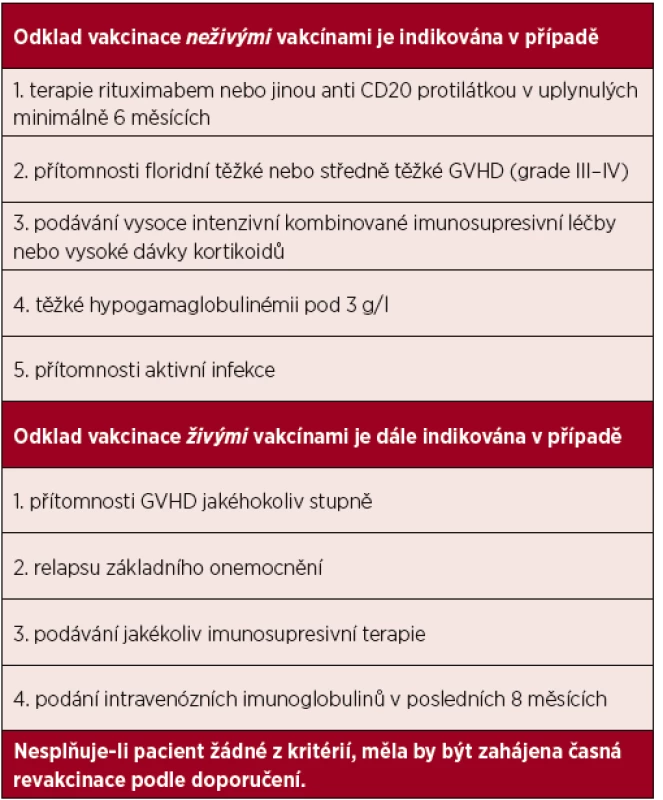
GVHD – reakce štěpu proti hostiteli (graft versus host disease) Vzhledem k složitosti imunitních procesů po alogenní HSCT s možnou významnou individuální variabilitou je v případě obavy o nedostatečnou imunitní odpověď (GVHD, rituximab) vhodná kontrola protektivních titrů protilátek. Problematická může ovšem být interpretace jejich nízké hladiny po vakcinaci, která nemusí jednoznačně korelovat s reálnou obranyschopností proti testovanému patogenu. Zároveň u většiny vakcín není zodpovězena otázka, jaký je další optimální postup v případě zjištění nízké hladiny protilátek (opakování booster dávek, dočasná profylaxe).
1. 3 Organizace vakcinace a úhrada
Vzhledem k složitosti a komplexnosti péče o pacienty po HSCT, by měla být revakcinace v ideálním případě zajišťována zkušeným hematologem, který je s touto problematikou, včetně diagnostiky a léčby oportunních infekcí, dobře obeznámen. V takovém případě lze pravděpodobně očekávat lepší spolupráci samotného pacienta, neboť vakcinace může probíhat v rámci pravidelných kontrol na hematologické ambulanci. Jednoznačnou výhodou je zejména znalost případu konkrétního nemocného (stav základní choroby, dosavadních komplikací, přítomnosti GVHD aj.). Další možnou variantou je vakcinace ve specializovaných vakcinačních centrech, kde je jistě výhodou erudice v oblasti samotné vakcinologie. Problémem může být malá zkušenost s nemocnými po HSCT a omezená znalost základního hematologického onemocnění. Je proto vždy nutná úzká spolupráce s ošetřujícím hematologem. Jako ne zcela vhodné se jeví úplné přenesení této péče na praktické lékaře nebo periferní hematologické ambulance. Výjimkou je pravidelné očkování proti chřipce.
Aktuální úhrada vakcín v rámci revakcinace po HSCT je řešena v České republice metodickým pokynem ministerstva zdravotnictví platným od 1/2018 (§ 30 vyhlášky č. 537/2006 Sb.), kde jsou transplantovaní pacienti řešeni v rámci očkování obecně rizikových imunokompromitovaných jedinců. V této směrnici nejsou ovšem rozlišovány jednotlivé rizikové skupiny a nemocní po HSCT se zde neliší například od pacientů po splenektomii nebo s primárními imunodeficity. Vakcinace proti Streptococcus pneumonie, Neisseria meningitidis, Haemophilus influenzae a chřipce jsou hrazeny v rámci očkovacího schématu pro asplenické pacienty, které naprosto nerespektuje potřebu vyššího počtu dávek po HSCT, jak je uvedeno v obecně celosvětově přijímaných doporučeních. Ostatní očkování nejsou v současnosti z veřejného pojištění pro pacienty po HSCT hraze-na vůbec a náklady na revakcinaci leží buď na samot-ném pacientovi, nebo příslušném hematologickém pracovišti.
2 VAKCINACE PACIENTŮ PO ALOGENNÍ HSCT
Doporučení pro konkrétní očkování pacientů po alogenní HSCT jsou shrnuta v následujícím textu a návrh vhodného vakcinačního kalendáře po HSCT je uveden formou tabulky 2.
Tab. 2. Vakcinační kalendář po alogenní transplantaci krvetvorných buněk 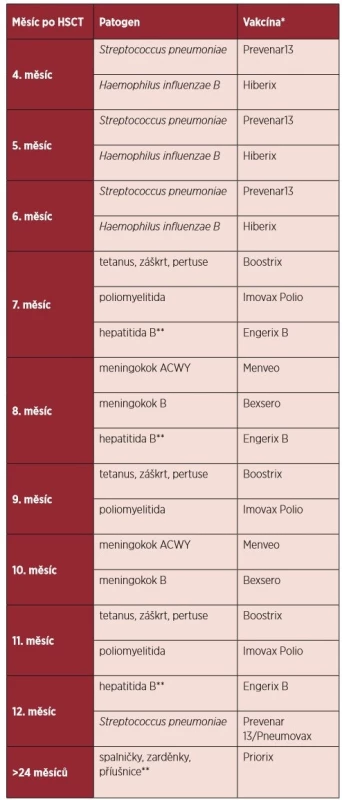
*Komerční názvy vakcín. **Vakcinace se provádí pouze za specifických podmínek. 2. 1 Neživé vakcíny
Streptococcus pneumonie. Pacienti po HSCT jsou ve srovnání s běžnou populací ve zvýšeném riziku vážných invazivních pneumokokových infekcí (IPD) [37–39]. Nejčastěji se IPD manifestují jako pneumonie, bakteremie nebo kombinace obou a mortalita u pacientů po HSCT může dosahovat až 20 % [38–42]. Tyto infekce se vyskytují častěji v pozdním období po HSCT než v období aplazie. Riziko dále zvyšuje přítomnost chronické GVHD [42] a koreluje s nízkými hladinami protektivních IgG protilátek [43]. Vzhledem k vysoké mortalitě a vyšší incidenci by měli být proti pneumokokům očkováni všichni pacienti po alogenní transplantaci. V současnosti jsou používány především konjugované vakcíny, které jsou vysoce imunogenní a vytvářejí dlouhodobou imunitní odpověď vázanou na T lymfocyty. Nejčastěji používaná je 13valentní konjugována vakcína (PCV13) pokrývající 13 nejčastějších sérotypů způsobujících IPD. Starší 23valentní polysacharidová vakcína (PPSV23) vyvolává slabší, pouze krátkodobou, na T lymfocytech nezávislou imunitní odpověď [44]. Navíc opakované „booster“ dávky touto vakcínou vedou k „vyčerpávání“ imunitní paměti a snížení odpovědi na vakcinaci [45, 46]. Tato vakcína navíc není v České republice v současnosti běžně dostupná. Účinnost konjugovaných pneumokokových vakcín a polysacharidové vakcíny byla u pacientů po HSCT srovnávána v několika různých studiích. Téměř neúčinná je samotná polysacharidová vakcína v prvním roce po provedení HSCT a i poté je její účinnost nízká, především v případě pacientů s chronickou GVHD a kortikoterapií [47]. Naproti tomu konjugovaná pneumokoková vakcína oproti polysacharidové vakcíně vykazuje u pacientů po HSCT dobrou imunogenicitu [32]. Imunitní odpověď po jedné dávce vakcíny u pacientů po HSCT je sice dosažena pouze u 38 % pacientů [32], ale po podání 3 dávek aplikovaných s odstupem 1–2 měsíců je dostatečné imunitní odpovědi dosaženo u 54–98 % pacientů [34, 48, 49]. V případě zahájení vakcinace časně po transplantaci (od 3 měsíců po HSCT) nebylo pozorováno snížení efektivity ve srovnání s pozdějším zahájením vakcinace (od 9 měsíců po transplantaci) [35]. Za účelem dosažení co nejčasnější imunity, pro kterou je nutné podání minimálně 3 dávek, je tak účelné začít vakcinaci časně po transplantaci [16, 35]. Přestože účinnost samotné polysacharidové vakcíny po HSCT je minimální, následuje-li podání polysacharidové vakcíny předchozí 3 dávky vakcíny konjugované, může být imunitní odpovědi proti vakcinačním sérotypům nezastoupeným v PCV13 dosaženo až u 89 % pacientů, a dochází tak k rozšíření ochrany proti dalším sérotypům [50]. Aplikace PPSV23 by však vždy měla následovat až po plné vakcinaci PCV13, vzhledem k riziku nižší efektivity PCV13 při primárním podání PPSV23 [51, 52]. U pacientů s GVHD nelze po podání PPSV23 očekávat uspokojivou odpověď a je naopak vhodné provést „booster“ další dávkou PCV13 [16].
Vakcinace by měla být zahájena 3–6 měsíců od HSCT 3 dávkami PCV13 s odstupy 1–2 měsíců [1, 8, 15, 16]. Následně by 12 měsíců po HSCT měla být podána 1 dávka PSSV23 k rozšíření pokrytí vakcinačních sérotypů. U pacientů s chronickou GVHD podání PSSV23 není doporučováno a má být proveden „booster“ čtvrtou dávkou PCV13 k posílení vakcinační odpovědi [16, 35].
Haemophilus influenzae (HiB). Stejně jako ostatní bakteriální infekce mohou infekce vyvolané HiB probíhat u imunokompromitovaných nemocných pod obrazem závažné sepse, meningitidy či pneumonie [53]. Pacienti po HSCT jsou ve zvýšeném riziku, a to i přes všeobecnou proočkovanost v populaci, především v pozdější fázi po restituci krvetvorby v souvislosti s funkční asplenií a případnou GVHD [54, 55], stejně jako v případech IPD. V současnosti se pro očkování proti HiB užívají konjugované vakcíny, které jsou vysoce imunogenní i u populace pacientů po HSCT. V minulosti byly srovnávány imunitní odpovědi po očkování 1–3 dávkami konjugované HiB vakcíny časně (3 měsíce) a později (6 měsíců) po HSCT [35, 56]. V případě 3 dávek v průběhu 2 let po HSCT byly dosaženy odpovědi 47–81 %. Nárůst specifických protilátek byl prokázán po 3. dávce vakcíny [57, 58]. Vzhledem k obavám o slabou imunitní odpověď velmi časně po HSCT (od 3 měsíců), bylo dříve doporučováno podání 3 dávek od 6. měsíce po transplantaci s odstupem 1–2 měsíců mezi jednotlivými dávkami [1, 10, 14, 15, 17]. Nicméně podle některých současných doporučení je, vzhledem k rizikům invazivních onemocnění HiB i časně po HSCT, vhodné zahájit vakcinaci již od 3. měsíce, a to společně s očkováním proti pneumokokům [16].
Neisseria meningitidis. Invazivní meningokoková onemocnění (IMO) jsou v běžné populaci často spojena s dramatickým průběhem pod obrazem fulminantní sepse nebo meningitidy s vysokou mortalitou i přes intenzivní terapii. Přestože většina dostupných dat u pacientů po HSCT je u pacientů dětského věku a adolescentů, lze předpokládat zvýšenou vnímavost všech takto léčených jedinců vlivem funkčního hyposplenismu [11, 17]. Za faktory zvyšující riziko rozvoje meningokokové infekce jsou obecně považovány mladý věk pacienta, specifické rizikové skupiny jako studenti žijící v univerzitních kampusech či vojáci a nepříznivá epidemiologická situace nebo cestování do oblastí s endemickým výskytem [8, 16]. Významným rizikovým faktorem je pak anatomický asplenismus, kde je očkování proti meningokokům nutností [9,23]. Co se týká účinnosti vakcín proti Neisseria meningitidis u pacientů po HSCT, jsou k dispozici pouze limitovaná data získaná především na souborech adolescentů a dětí. V analýze imunitní odpovědi u 46 alogenně transplantovaných pacientů očkovaných tetravalentní konjugovanou vakcínou cca 2 roky po HSCT, byla po jedné dávce odpověď na všechny 4 vakcinační sérotypy pouze u 15 % a alespoň na některé vakcinační sérotypy u 31–56 % očkovaných [28]. U 50 % pacientů s nedostatečnou imunitní reakcí po jedné dávce vakcíny byla odpověď dosažena podáním druhé dávky [28]. V recentní práci byla u dospělých nemocných s aplikací 1 dávky konjugované tetravalentní vakcíny rok po HSCT dosažena specifická protilátková odpověď proti jednotlivým sérotypům u 52–77 % očkovaných [59]. Imunitní odpověď byla dosažena v prospektivní studii u všech transplantovaných pacientů, kterým byly podávány celkem 3 dávky konjugované monovalentní vakcíny [60].
V České republice jsou k dispozici dva typy vakcín, které zajišťují pokrytí proti 5 hlavním sérotypům (tetravalentní konjugovaná vakcína proti meningokokům A, C, W, Y a novější rekombinantní 4složková vakcína proti meningokoku B) způsobujícím invazivní meningokoková onemocnění. Vzhledem k malému množství dat o meningokokových infekcích po HSCT nejsou zatím mezinárodní doporučení zcela jednotná a jednoznačně je vakcinace doporučena jen u rizikových skupin (mladí pacienti, studenti a vojáci, cestovatelé, aspleničtí pacienti aj.) [8, 16]. U ostatních pacientů je očkování indikováno na základě lokální epidemiologické situa-ce a místních doporučení. V České republice je sice u zdravé populace podle dat Státního zdravotnického ústavu výskyt IMO nízký [61], ale vzhledem k často vážnému průběhu a vysoké mortalitě je Českou vakcinologickou společností u nemocných po HSCT očkování jednoznačně doporučeno [62]. S ohledem na zastoupení sérotypů způsobujících IMO v České republice (v roce 2017 dominantní sérotyp B /48,5 % IMO/ a sérotyp C /36,8 % IMO/) je nutná vakcinace nejen konjugovanouu, ale i rekombinantní vakcínou proti meningokoku B [61, 62]. Sérotypy W a Y jsou v České republice sice zastoupeny významně méně, ale infekce těmito kmeny jsou spojeny s vyšší mortalitou a vyskytují se častěji v některých oblíbených turistických destinacích [61, 62]. Proto je v současnosti použití monovalentní konjugované vakcíny proti meningokoku typu C nedostatečné a je indikováno použití tetravalentní konjugované vakcíny proti sérotypům A, C, W, Y [61, 62]. Vakcinační schéma je složeno ze 2 dávek tetravalentní konjugované vakcíny a 2 dávek rekombinantní vakcíny proti meningokoku B s dvouměsíčním odstupem mezi dávkami [1, 8, 15, 16]. Tato vakcinace by mělo být zahájena s odstupem minimálně 6 měsíců od HSCT [8, 16].
Záškrt – tetanus – černý kašel. Vzhledem ke klesající proočkovanosti proti černému kašli, s nárůstem výskytu tohoto onemocnění v posledních letech [13] a stále přetrvávajícímu riziku tetanu, je vakcinace proti těmto patogenům po HSCT všeobecně doporučována [1, 15, 16]. K dispozici je pro očkování proti záškrtu, tetanu a černému kašli několik kombinovaných vakcín obsahujících toxoidy jednotlivých patogenů. Vakcíny se liší množstvím difterického toxoidu („DT“ obsahující plnou dávku a „Td“ obsahující redukovanou dávku difterického toxoidu) a toxoidu Bordetella pertussis („DTaP“ s plnou a „Tdap“ s redukovanou dávkou toxoidů). Přestože například ve Spojených státech amerických není u zdravé dospělé populace podání vakcíny s plnou dávkou schváleno z důvodů vyššího rizika nežádoucích účinků [15], nebyl u dospělých pacientů po HSCT častější výskyt nežádoucích účinků prokázán [29]. U transplantovaných nemocných byl testován především efekt redukovaných vakcín „Td“, kde byla pro oba patogeny zaznamenána velice dobrá odpověď u 70–100 % pacientů po 3 dávkách vakcíny aplikovaných s odstupy 1–2 měsíců a se zahájením očkování 6–12 měsíců od transplantace [58, 63, 64]. Podle dostupných dat podání „DT“ vakcíny s vyšší náloží antigenů pacientům po HSCT pravděpodobně zlepšuje dlouhodobou imunitu proti záškrtu [33]. V případě černého kašle, který je součástí kombinované vakcíny, je odpověď po jedné dávce zcela minimální [65, 66]. Při podání 3 dávek dochází, obdobně jako u tetanu a záškrtu, k jejímu zlepšení, i když ani pak nedosahuje takové účinnosti jako u ostatních dvou patogenů [20, 33]. I zde se tedy jeví jako vhodnější použití kombinované vakcíny „DTaP“ s vyšší dávkou antigenu [8, 15, 16]. V České republice, podobně jako i v jiných zemích, však není použití „DTaP“ u dospělých pacientů schváleno. Pro oba typy vakcíny platí schéma s aplikací celkem 3 dávek s odstupy 1–2 měsíců, se zahájením vakcinace 6–12 měsíců po transplantaci [1, 8, 15, 16].
Poliomyelitida. Očkování proti přenosné dětské obrně patří spolu s ostatními mezi standartní povinná očkování v dětském věku. U pacientů po HSCT je ve všech mezinárodních doporučeních běžnou součástí revakcinace, i když data o výskytu a průběhu infekce po této specifické léčbě nejsou k dispozici. V České republice se infekce poliomavirem od zavedení povinného očkování de facto nevyskytuje. Rizikové však mohou být země bez zavedeného povinného očkování, kde se i v současnosti lze s onemocněním setkat. Indikováno je použití inaktivované vakcíny ve 3 dávkách, po kterých byla prokázána odpověď u 80 až 100 % pacientů [33, 58, 63, 67, 68], u dospělých s dostatečnou imunogenicitou již 6 měsíců po HSCT. V České republice lze u dospělých použít buď variantu kombinované vakcíny „Tdap“ rozšířené o antigeny viru, nebo samostatnou inaktivovanou vakcínu. V obou případech je vakcinační schéma obdobné jako v předchozím případě – 3 dávky v rozmezí 1–2 měsíců 6–12 měsíc po HSCT [1, 8, 15, 16].
Influenza. Ve srovnání s většinou ostatních očkováním preventabilních onemocnění jsou data o výskytu a průběhu chřipkové infekce po HSCT relativně četná. Pacienti po HSCT jsou ve významném riziku chřipkové infekce s možným závažným průběhem i několik let po transplantaci. Celková mortalita chřipkové infekce po HSCT se pohybuje kolem 6 %. Bez adekvátní antivirotické terapie pak může dosahovat 10–15 % [69, 70], i když podle některých analýz může dosahovat i významně vyšších čísel [71]. Navíc riziko progrese influenzy do chřipkové pneumonie u transplantovaných pacientů je 29–33 % [69, 70] s mortalitou pneumonie až 28 % i přes zavedenou terapii oseltamivirem [70]. Vzhledem k riziku vážných komplikací s možným fatálním dopadem chřipkové infekce je u pacientů po HSCT doporučeno ideálně doživotní (minimálně 2 sezony po HSCT) každoroční očkování proti chřipce sezonně připravovanou, inaktivovanou vakcínou [1, 8, 15, 16, 72]. Účinnost vakcíny po HSCT je ovlivněna řadou faktorů, jako například doba vakcinace od transplantace a trvající imunosuprese [27, 31, 73–75], nízká hladina lymfocytů a hladiny protilátek [30, 31, 76] nebo léčba anti-CD20 protilátkami v posledním roce [27]. Efektivita vakcinace se tak může u jednotlivých pacientů odlišovat, ale ve většině prací bylo dosaženo uspokojivých výsledků při podání vakcíny po 6 a více měsících od transplantace [30, 31, 74, 75, 77–79]. Zatím nejednoznačné jsou závěry prací hodnotících benefit „booster“ dávky vakcíny [22, 74, 75, 80] a dostupná doporučení odborných společností tak nejsou v tomto případě zcela jednotná. Určitý pozitivní dopad druhé dávky s odstupem 3–4 týdnů je ale možný a měl by být zvažován u pacientů s těžkou GVHD, nízkým množstvím lymfocytů nebo v případě časného podání první dávky [16, 72]. Vakcinace by v ideálním případě měla proběhnout v podzimních měsících před začátkem chřipkové sezony. Nejvhodnější je očkování proti chřipce s odstupem alespoň 6 měsíců od provedené transplantace [1, 8, 15, 16, 72]. Ovšem v případě vážně probíhající epidemie v populaci je eventuálně možné i zahájení již od třetího měsíce po HSCT, v takovém případě je na zvážení podání již zmíněného „boosteru“ [16, 72].
Hepatitida B (HBV). Riziko přenosu hepatitidy B je sice v současnosti v zemích se zavedeným povinným očkováním a vyspělým zdravotnictvím relativně nízké. Nicméně možný přenos, například rizikovým pohlavním stykem nebo při podávání krevních produktů, nelze u pacientů po HSCT se ztrátou získané imunity zcela vyloučit. U nemocných s již prodělanou, neaktivní HBV infekcí (pozitivní anti-HBc s negativními známkami virové replikace) je riziko reverzní sérokonverze po alogenní HSCT až 50% [81, 82, 83]. Očkování proti hepatitidě B by měli podstoupit všichni dříve neimunizovaní pacienti a pacienti, u kterých je prokázána ztráta imunity získané v minulosti vakcinací [1, 15, 16]. U nemocných s již dříve prodělanou hepatitidou B by měla být provedena kontrola hladiny protilátek a v případě neprotektivní hodnoty by měli být taktéž přeočkováni v rámci prevence reverzní sérokonverze [1, 16, 84]. Standardní vakcinační schéma obsahuje 3 dávky rekombinantní vakcíny v rozmezí 6.–12. měsíce od HSCT (schéma dávek 0-1-6) [15, 16]. Po takto provedené vakcinaci dosahuje sérokonverze s dostatečným titrem protilátek asi 1/2 až 2/3 očkovaných pacientů [86, 87]. Očkovaní pacienti by proto měli být za 1–2 měsíce po poslední dávce testováni na hladinu protektivních protilátek anti-HBs. Nejsou-li dosaženy hodnoty anti-HBs 10 mIU/ml a více, je vhodné zopakovaní celého cyklu 3 dávek v obdobném schématu [1, 15, 16].
2. 2 Živé atenuované (oslabené) vakcíny
Problematika očkování živými oslabenými vakcínami po HSCT byla zmíněna již na začátku. U pacientů po HSCT je na zvážení vakcinace kombinovanými vakcínami proti spalničkám, zarděnkám a příušnicím a eventuálně vakcinace proti varicella-zoster viru (VZV). Všeobecně je doporučováno podání těchto vakcín ne dříve než 24 měsíců po provedení HSCT, a to především z důvodu obav z infekčních komplikací. U těchto nemocných po HSCT byly v minulosti popsány i fatální infekce způsobené vakcinačními patogeny (VZV vakcína) [24, 25, 86]. Pro tyto obavy je tak navíc podání živých vakcín po HSCT indikováno pouze u určitých skupin pacientů (viz dále). Všeobecnou kontraindikací po HSCT je přítomnost GVHD (z důvodu obav o její zhoršení), relaps základního onemocnění, trvající imunosupresivní terapie nebo podání intravenózních imunoglobulinů v posledních 8 měsících [1, 15, 16, 18]. Důvodem, proč by měla být vakcinace živými vakcínami proti těmto patogenům zvažována i přes obavy z možných komplikací, je významné riziko rozvoje vážných až život ohrožujících infekcí. Nejvýznamnějším rizikem pro pacienty po HSCT jsou pravděpodobně infekce spalničkami a VZV. Obě tyto nemoci mohou u imunokompromitovaných pacientů probíhat pod obrazem až život ohrožující pneumonitidy, encefalitidy nebo těžké diseminované infekce [87, 88]. U VZV séropozitivních pacientů je také riziko reaktivace herpes zoster 23–59 % [89] s rizikem postherpetických neuralgií asi u 1/3 pacientů [90]. Obava ze spalniček v současnosti narůstá vzhledem ke snižující se proočkovanosti populace a poklesu komunitní imunity v posledních letech a významnému vzestupu výskytu tohoto onemocnění v Evropě a České republice [12].
Spalničky – příušnice – zarděnky. U většiny pacientů po HSCT je dokumentován postupný pokles protektivních protilátek proti všem třem patogenům s pravděpodobností úplné séronegativity 5 let po HSCT až 52–73 % v závislosti na konkrétním patogenu [91, 92]. Mezi faktory zvyšující riziko rozvoje séronegativity je přítomnost GVHD po transplantaci a imunita získaná v dětství po proběhlé vakcinaci ve srovnání s imunitou po prodělané infekci [92, 93]. U všech pacientů by proto měla být 24 měsíců od transplantace testována hladina protilátek. Indikováno je podání 1 dávky vakcíny u všech pacientů séronegativitních pro spalničky a u žen s potenciálem otěhotnění v případě séronegativity pro zarděnky [1, 8, 16]. Podle některých doporučení je na zvážení také podání druhé dávky vakcíny s odstupem minimálně 4 týdnů, zejména u dětí a adolescentů se sníženou odpovědí po pouze jedné dávce [8, 15, 16]. V České republice je dostupná kombinovaná vakcína proti všem třem patogenům, která je schválena pro použití u dětí i dospělých.
Varicella – zoster virus. Pro očkování proti VZV jsou k dispozici dvě varianty živých atenuovaných vakcín. „Varicellová“ vakcína s nízkým titrem vakcinačního kmene, která je u zdravé, séronegativní populace indikována k prevenci planých neštovic, a „zoster“ vakcína s vyšším titrem, určená pro séropozitivní populaci v rámci prevence rozvoje pásového oparu a postherpetických neuralgií. Použití těchto vakcín je u imunokompromitovaných pacientů významně limitováno již zmíněným rizikem infekcí způsobených vakcinačními kmeny a u obou těchto vakcín byly popsány diseminované infekce s fatálním průběhem [24, 25, 86]. Stejně jako u předchozí živé vakcíny je nutné indikaci důkladně zvažovat. Pacienti by měli být v dobré klinické kondici a samozřejmě důkladně zhodnoceni, není-li přítomna některá z kontraindikací. V případě rozhodnutí o vakcinaci je indikováno podání jedné dávky „varicellové“ vakcíny nejdříve 24 měsíců od HSCT. Použití oslabené živé vakcíny „zoster“ je u pacientů po HSCT vzhledem k limitovanému množství dat o účinnosti a bezpečnosti kontraindikováno [1, 15, 16].
3 OČKOVÁNÍ DOMÁCÍCH KONTAKTŮ A ZDRAVOTNICKÉHO PERSONÁLU
Součástí prevence infekčních komplikací po HSCT není pouze revakcinace samotných pacientů, ale její nedílnou součástí by mělo být očkování proti chřipce osob žijících ve společné domácnosti s nemocnými a ošetřujícího zdravotnického personálu. Chřipka se vyznačuje svým epidemickým charakterem výskytu v jarních měsících s relativně vysokou incidencí i v běžné populaci. Zvýšená vnímavost pacientů po HSCT s významnou morbiditou a mortalitou již byla zmíněna. Osoby žijící s pacientem ve společné domácnosti a ošetřující zdravotnický personál může vytvářet nezanedbatelný zdroj nákazy pro transplantované pacienty vzhledem k frekvencím kontaktu s pacientem. Snížení nebezpečí přenosu očkováním těchto skupin hraje důležitou úlohu zvláště v situacích, kdy pacient nemůže být sám včas očkován nebo u něj není očkováním dosaženo dostatečné imunitní odpovědi. Zatímco příbuzní a blízcí pacientů jsou k vakcinaci většinou motivování obavou o jejich blízkého, je dostatečné proočkování zdravotnického personálu v situaci všeobecné zdrženlivosti k očkování v České republice často výzvou. Nicméně pozitivní vliv očkování u zdravotnického personálu na snížení nemocnosti byl již opakovaně prokázán a je spolu s očkováním domácích kontaktů ve všech dostupných materiálech jednoznačně doporučován [1, 15, 16, 72].
ZÁVĚR
Revakcinace pacientů po alogenní transplantaci krvetvorných buněk má dnes ustálené místo v rámci preventivních opatření snižující riziko vážných infekčních komplikací, které tvoří jeden z nejvýznamnějších příčin morbidity a mortality po HSCT. Ukazuje se, že moderní vysoce imunogenní vakcíny vyvolávají dostatečnou imunitní odpověď i časně po transplantaci, a to často i za přítomnosti faktorů jako GVHD, které dříve byly pro provedení vakcinace úplnou kontraindikací. Spolu s výborným bezpečnostním profilem těchto vakcín je tak umožněno zahájení vakcinace stále časněji po HSCT, kdy je výskyt infekčních komplikací většinou nejvyšší. V současnosti roste význam očkování těchto pacientů také v souvislosti s rostoucím výskytem nedávno ještě raritních onemocnění, jako černý kašel či spalničky, který souvisí se snižující se proočkovaností zdravé populace a dalšími faktory. Přestože dat o účinnosti vakcinace po HSCT přibývá, zvyšující se počet a heterogenita pacientů, spolu s užitím nových terapeutických možností, si vyžadují další detailnější analýzy, které umožní další optimalizaci vakcinačních schémat přizpůsobených přípravnému režimu před alo HSCT, typu transplantovaného štěpu a použité imunosupresi.
Podíl autorů na přípravě rukopisu
TK – hlavní autor, příprava první a finální verze rukopisu
IK, PŽ, MK, LD, MN, PM, PS, JH, NM, DD, JN, EF, BW, JŠ, JM – spoluautor a revize rukopisu
ZR – spoluautor a finální revize rukopisu
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Do redakce doručeno dne 5. 4. 2019.
Přijato po recenzi dne 28. 5. 2019.
prof. MUDr. Zdeněk Ráčil, Ph.D.
Interní hematologická a onkologická klinika LF MU
Jihlavská 20
62500 Brno
e-mail: racil.zdenek@uhkt.cz
Zdroje
1. Ullmann AJ, Schmidt-Hieber M, Bertz H, et al. Infectious diseases in allogeneic haematopoietic stem cell transplantation: prevention and prophylaxis strategy guidelines 2016. Ann Hematol 2016;95(9):1435–1455.
2. van den Brink MR, Velardi E, Perales MA, et al. Immune reconstitu-tion following stem cell transplantation. Hematology Am Soc Hematol Educ Program 2015;2015 : 215–219.
3. Sahin U, Toprak SK, Atilla PA, et al. An overview of infectious complications after allogeneic hematopoietic stem cell transplantation. J Infect Chemother 2016;22(8):505–514.
4. Schuster MG, Cleveland AA, Dubberke ER, et al. Infections in hematopoietic cell transplant recipients: results from the organ transplant infection project, a multicenter, prospective, cohort study. Open Forum Infect Dis 2017;4(2):ofx050.
5. Ogonek J, Kralj Juric M, Ghimire S, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation. Front Immunol 2016;7 : 507.
6. Seggewiss R, Einsele H, et al. Immune reconstitution after allogeneic transplantation and expanding options for immunomodulation: an update. Blood 2010;115(19):3861–3868.
7. Chaudhry MS, Velardi E, Malard F, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation: time to T up the thymus. J Immunol 2017;198(1):40–46.
8. Carpenter PA, Englund JA, et al. How I vaccinate blood and marrow transplant recipients. Blood 2016;127(23):2824–2832.
9. Hammerquist RJ, Messerschmidt KA, Pottebaum AA, et al. Vaccinations in asplenic adults. Am J Health Syst Pharm 2016;73(9):220–228.
10. Chong PP, Avery RK. A comprehensive review of immunization practices in solid organ transplant and hematopoietic stem cell transplant recipients. Clin Ther 2017;39(8):1581–1598.
11. Staehelin C, Hirzel C, Hauser C, et al. Vaccinations for immunocompromised hosts – focussing on patients after a hematological stem cell or organ transplantation, with HIV or with functional or anatomical asplenia. Ther Umsch 2016;73(5):281–289.
12. Lexová P, Manďáková Z, Kynčl J, et al. Spalničky – význam onemocnění a aktuální situace v Evropě. Oddělení epidemiologie infekčních nemocí SZÚ 2018. [cit. 2.11.2018]. Dostupné na www: http://www.szu.cz/tema/prevence/vyskyt-spalnicek-v-cr.
13. Fabiánová K, Zavadilová J, Šebestová H, et al. Syndrom dávivého kašle. Pertuse a parapertuse v České republice v roce 2017 – epidemiologická situace a přehled očkování proti pertusi. Zprávy SZÚ 2018;27(3–4):75–83.
14. Ljungman P, Cordonnier C, Einsele H, et al. Vaccination of hematopoietic cell transplant recipients.Bone Marrow Transplant 2009;44(8):521–526.
15. Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014;58(3):309–318.
16. Cordonnier C, Einarsdottir S, Cesaro S, et al. Vaccination of haemopoietic stem cell transplant recipients: guidelines of the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect Dis 2019;19(6):e200–e212.
17. L‘Huillier AG, Kumar D. Immunizations in solid organ and hematopoeitic stem cell transplant patients: A comprehensive review. Hum Vaccin Immunother 2015;11(12):2852–2863.
18. Kroger T, Sumaya CV, Pickering LA, et al. General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2011;60(2):1–64.
19. Yri OE, Torfoss D, Hungnes O, et al. Rituximab blocks protective serologic response to influenza A (H1N1) 2009 vaccination in lymphoma patients during or within 6 months after treatment. Blood 2011;118(26):6769–6771.
20. Shah GL, Shune L, Purtill D, et al. Robust vaccine responses in adult and pediatric cord blood transplantation recipients treated for hematologic malignancies. Biol Blood Marrow Transplant 2015;21(12):2160–2166.
21. Pao M, Papadopoulos EB, Chou J, et al. Response to pneumococcal (PNCRM7) and haemophilus influenzae conjugate vaccines (HIB) in pediatric and adult recipients of an allogeneic hematopoietic cell transplantation (alloHCT). Biol Blood Marrow Transplant 2008;14(9):1022–1030.
22. de Lavallade H, Garland P, Sekine T, et al. Repeated vaccination is required to optimize seroprotection against H1N1 in the immunocompromised host. Haematologica 2011;96(2):307–314.
23. Bonanni P, Grazzini M, Niccolai G, et al. Recommended vaccinations for asplenic and hyposplenic adult patients. Hum Vaccin Immunother 2017;13(2):359–368.
24. Bhalla P, Forrest GN, Gershon M. Disseminated, persistent, and fatal infection due to the vaccine strain of varicella-zoster virus in an adult following stem cell transplantation. Clin Infect Dis 2015;60(7):1068–1074.
25. Alexander KE, Tong PL, Macartney K, et al. Live zoster vaccination in an immunocompromised patient leading to death secondary to disseminated varicella zoster virus infection. Vaccine 2018;36(27):3890–3893.
26. Horwitz SM, Negrin RS, Blume KG, et al. Rituximab as adjuvant to high-dose therapy and autologous hematopoietic cell transplanta-tion for aggressive non-Hodgkin lymphoma. Blood 2004;103(3):777–783.
27. Issa NC, Marty FM, Gagne LS, et al. Seroprotective titers against 2009 H1N1 influenza A virus after vaccination in allogeneic hematopoietic stem cell transplantation recipients. Biol Blood Marrow Transplant 2011;17(3):434–438.
28. Mahler MB, Taur Y, Jean R, et al. Safety and immunogenicity of the tetravalent protein-conjugated meningococcal vaccine (MCV4) in recipients of related and unrelated allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2012;18(1):145–149.
29. Parkkali T, Olander RM, Ruutu T, et al. A randomized comparison between early and late vaccination with tetanus toxoid vaccine after allogeneic BMT. Bone Marrow Transplant 1997;19(9):933–938.
30. Engelhard D, Zakay-Rones Z, Shapira MY, et al. The humoral immune response of hematopoietic stem cell transplantation recipients to AS03-adjuvanted A/California/7/2009 (H1N1)v-like virus vaccine during the 2009 pandemic. Vaccine 2011;29(9):1777–1782.
31. Mohty B, Bel M, Vukicevic M, et al. Graft-versus-host disease is the major determinant of humoral responses to the AS03-adjuvanted influenza A/09/H1N1 vaccine in allogeneic hematopoietic stem cell transplant recipients. Haematologica 2011;96(6):896–904.
32. Kumar D, Chen MH, Welsh B, et al. A randomized, double-blind trial of pneumococcal vaccination in adult allogeneic stem cell transplant donors and recipients. Clin Infect Dis 2007;45(12):1576–1582.
33. Inaba H, Hartford CM, Pei D, et al. Longitudinal analysis of antibody response to immunization in paediatric survivors after allogeneic haematopoietic stem cell transplantation. Br J Haematol 2012;156(1):109–117.
34. Cordonnier C, Labopin M, Chesnel V, et al. Randomized study of early versus late immunization with pneumococcal conjugate vaccine after allogeneic stem cell transplantation. Clin Infect Dis 2009;48(10):1392–1401.
35. Parkkali T, Käyhty H, Ruutu T, et al. A comparison of early and late vaccination with Haemophilus influenzae type b conjugate and pneumococcal polysaccharide vaccines after allogeneic BMT. Bone Marrow Transplant 1996;18(5):961–967.
36. Siber G, Werner B, Halsey N, et al. Interference of immune globulin with measles and rubella immunization. J Pediatr 1993;122 : 204–211.
37. Kumar D, Humar A, Plevneshi A, et al. Invasive pneumococcal disease in adult hematopoietic stem cell transplant recipients: a decade of prospective population-based surveillance. Bone Marrow Transplant 2008;41(8):743–747.
38. Engelhard D, Cordonnier C, Shaw PJ, et al. Early and late invasive pneumococcal infection following stem cell transplantation: a European Bone Marrow Transplantation survey. Br J Haematol 2002;117 : 444–450.
39. Youssef S, Rodriguez G, Rolston KV, et al. Streptococcus pneumoniae infections in 47 hematopoietic stem cell transplantation recipients: clinical characteristics of infections and vaccine-breakthrough infections, 1989–2005. Medicine (Baltimore) 2007;86(2):69–77.
40. Schutze GE, Mason EO, Wald ER, et al. Pneumococcal infections in children after transplantation. Clin Infect Dis 2001;33(1):16–21.
41. Olarte L, Lin PL, Barson WJ, et al. Invasive pneumococcal infections in children following transplantation in the pneumococcal conjugate vaccine era. Transpl Infect Dis 2017;19(1):e12630.
42. Kulkarni S, Powles R, Treleaven J, et al. Chronic graft versus host disease is associated with long-term risk for pneumococcal infections in recipients of bone marrow transplants. Blood 2000;95(12):3683–3686.
43. Sheridan JF, Tutschka PJ, Sedmak DD, et al. Immunoglobulin G subclass deficiency and pneumococcal infection after allogeneic bone marrow transplantation. Blood 1990;75(7):1583–1586.
44. Jackson LA, Gurtman A, van Cleeff M, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults. Vaccine 2013;31(35):3577–3584.
45. Clutterbuck EA, Lazarus R, Yu LM, et al. Pneumococcal conjugate and plain polysaccharide vaccines have divergent effects on antigen-specific B cells. J Infect Dis 2012;205(9):1408–1416.
46. Jackson LA, Gurtman A, van Cleeff M, et al. Influence of initial vaccination with 13–valent pneumococcal conjugate vaccine or 23 – valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older. Vaccine 2013;31(35):3594–3602.
47. Gandhi MK, Egner W, Sizer L, et al. Antibody responses to vaccinations given within the first two years after transplant are similar between autologous peripheral blood stem cell and bone marrow transplant recipients. Bone Marrow Transplant 2001;28(8):775–781.
48. Meisel R, Kuypers L, Dirksen U, et al. Pneumococcal conjugate vaccine provides early protective antibody responses in children after related and unrelated allogeneic hematopoietic stem cell transplantation. Blood 2007;109(6):2322–2326.
49. Cordonnier C, Ljungman P, Juergens C, et al. Immunogenicity, safety, and tolerability of 13 - valent pneumococcal conjugate vaccine followed by 23 – valent pneumococcal polysaccharide vaccine in recipients of allogeneic hematopoietic stem cell transplant aged ≥2 years: an open-label study. Clin Infect Dis 2015;61(3);313–323.
50. Cordonnier C, Labopin M, Chesnel V, et al. Immune response to the 23 – valent polysaccharide pneumococcal vaccine after the 7 – valent conjugate vaccine in allogeneic stem cell transplant recipients: results from the EBMT IDWP01 trial. Vaccine 2010;28(15):2730–2734.
51. Sigurdardottir ST, Center KJ, Davidsdottir K. Decreased immune response to pneumococcal conjugate vaccine after 23 – valent pneumococcal polysaccharide vaccine in children. Vaccine 2014;32(3):417–424.
52. O‘Brien KL, Hochman M, Goldblatt D, et al. Combined schedules of pneumococcal conjugate and polysaccharide vaccines: is hyporesponsiveness an issue? Lancet Infect Dis 2007;7 : 597–606.
53. McNair J, Smith, A, Bettinger J, et al. Invasive Haemophilus influenzae type b infections in children with cancer in the era of infant HIB immunization programs (1991–2014): a report from the Canadian Immunization Monitoring Program Active. Pediatr Infect Dis J 2018;37(7):726–728.
54. Roy V, Ochs L, Weisdorf D, et al. Late infections following allogeneic bone marrow transplantation: suggested strategies for prophylaxis. Leuk Lymphoma 1997;26(1–2):1–15.
55. Ochs L, Shu XO, Miller J, et al. Late infections after allogeneic bone marrow transplantations: comparison of incidence in related and unrelated donor transplant recipients. Blood 1995;86(10):3979–3986.
56. Parkkali T, Käyhty H, Anttila M, et al. IgG subclasses and avidity of antibodies to polysaccharide antigens in allogeneic BMT recipients after vaccination with pneumococcal polysaccharide and Haemophilus influenzae type b conjugate vaccines. Bone Marrow Transplant 1999;24(6):671–678.
57. Molrine DC, Guinan EC, Antin JH, et al. Donor immunization with Haemophilus influenzae type b (HIB)-conjugate vaccine in allogeneic bone marrow transplantation. Blood 1996;87(7):3012–3018.
58. Parkkali T, Käyhty H, Hovi T, et al. A randomized study on donor immunization with tetanus-diphtheria, Haemophilus influenzae type b and inactivated poliovirus vaccines to improve the recipient responses to the same vaccines after allogeneic bone marrow transplantation. Bone Marrow Transplant 2007;39(3):179–188.
59. Cheng MP, Pandit A, Antin JH, et al. Safety and immunogenicity of conjugate quadrivalent meningococcal vaccination after hematopoietic cell transplantation. Blood Adv 2018;2(11):1272–1276.
60. Patel SR, Ortín M, Cohen BJ, et al. Revaccination of children after completion of standard chemotherapy for acute leukemia. Clin Infect Dis 2007;44(5):635–642.
61. Křížová P, Musílek M, Okonji Z, et al. Invazivní meningokokové onemocnění v České republice v roce 2017. Zprávy CEM SZÚ 2018; 27(1). [cit. 6.11.2018]. Dostupné na www: http://www.szu.cz/tema/prevence/invazivni-meningokokove-onemocneni-v-ceske-republice-v-roce-7.
62. Česká vakcinologická společnost ČLS. Doporučení České vakcinologické společnosti ČLS JEP pro očkování proti invazivním meningokokovým onemocněním. 2018. [cit. 6.11.2018]. Dostupné na www: http://www.vakcinace.eu/doporuceni-a-stanoviska.
63. Olkinuora H, Käyhty H, Davidkin I, et al. Immunity after (re)vaccination of paediatric patients following haematopoietic stem cell transplantation. Acta Paediatr 2012;101 : 373–377.
64. Ljungman P, Wiklund-Hammarsten M, Duraj V, et al. Response to tetanus toxoid immunization after allogeneic bone marrow transplantation. J Infect Dis 1990;162(2):496–500.
65. Papadopoulos EB, Young JW, Kernan NA, et al. Use of the tetanus toxoid, reduced dose diphtheria and pertussis vaccine (Tdap) in allogeneic transplant (alloHCT) recipients. Blood 2008;112 : 2214.
66. Small TN, Zelenetz AD, Noy A, et al. Pertussis immunity and response to tetanus-reduced diphtheria-reduced pertussis vaccine (Tdap) after autologous peripheral blood stem cell transplantation. Biol Blood Marrow Transplant 2009;15(12):1538–1542.
67. Ljungman P, Duraj V, Magnius L. Response to immunization against polio after allogeneic marrow transplantation. Bone Marrow Transplant 1991;7(2):89–93.
68. Pauksen K, Hammarström V, Ljungman P, et al. Immunity to poliovirus and immunization with inactivated poliovirus vaccine after autologous bone marrow transplantation. Clin Infect Dis 1994;18(4):547–552.
69. Ljungman P, de la Camara R, Perez-Bercoff L, et al. Outcome of pandemic H1N1 infections in hematopoietic stem cell transplant recipients. Haematologica 2011;96(8):1231–1235.
70. Nichols WG, Guthrie KA, Corey L, et al. Influenza infections after hematopoietic stem cell transplantation: risk factors, mortality, and the effect of antiviral therapy. Clin Infect Dis 2004;39(9):1300–1306.
71. Ljungman P, Ward KN, Crooks BN, et al. Respiratory virus infections after stem cell transplantation: a prospective study from the Infectious Diseases Working Party of the European Group for Blood and Marrow Transplantation. Bone Marrow Transplant 2001;28 (5):479–484.
72. Engelhard D, Mohty B, de la Camara R, et al. European guidelines for prevention and management of influenza in hematopoietic stem cell transplantation and leukemia patients: summary of ECIL-4 (2011), on behalf of ECIL, a joint venture of EBMT, EORTC, ICHS, and ELN. Transpl Infect Dis 2013;15(3):219–232.
73. Natori Y, Shiotsuka M, Slomovic J, et al. A double-blind, randomized trial of high-dose vs standard-dose influenza vaccine in adult solid-organ transplant recipients. Clin Infect Dis 2018;66(11):1698–1704.
74. Engelhard D, Nagler A, Hardan I, et al. Antibody response to a two-dose regimen of influenza vaccine in allogeneic T cell-depleted and autologous BMT recipients. Bone Marrow Transplant 1993;11(1):1–5.
75. Karras NA, Weeres M, Sessions W, et al. A randomized trial of one versus two doses of influenza vaccine after allogeneic transplantation. Biol Blood Marrow Transplant 2013;19(1): 109–116.
76. Fukatsu Y, Nagata Y, Adachi M, et al. Serum IgM levels independently predict immune response to influenza vaccine in long-term survivors vaccinated at >1 year after undergoing allogeneic hematopoietic stem cell transplantation. Int J Hematol 2017;105(5):638–645.
77. Machado CM, Cardoso MR, da Rocha IF, et al. The benefit of influenza vaccination after bone marrow transplantation. Bone Marrow Transplant 2005;36(10):897–900.
78. Avetisyan G, Aschan J, Hassan M, et al. Evaluation of immune responses to seasonal influenza vaccination in healthy volunteers and in patients after stem cell transplantation. Transplantation 2008;86(2):257–263.
79. Roll D, Ammer J, Holler B, et al. Vaccination against pandemic H1N1 (2009) in patients after allogeneic hematopoietic stem cell transplantation: a retrospective analysis. Infection 2012;40(2):153–161.
80. Gueller S, Allwinn R, Mousset S, et al. Enhanced immune response after a second dose of an AS03 adjuvanted H1N1 influenza A vaccine in patients after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2011;17(10):1546–1550.
81. Knöll A, Boehm S, Hahn J, et al. Long-term surveillance of haematopoietic stem cell recipients with resolved hepatitis B: high risk of viral reactivation even in a recipient with a vaccinated donor. J Viral Hepat 2007;14(7):478–483.
82. Knöll A, Boehm S, Hahn J, et al. Reactivation of resolved hepatitis B virus infection after allogeneic haematopoietic stem cell transplantation. Bone Marrow Transplant 2004;33(9):925–929.
83. Pompili M, Basso M, Hohaus S, et al. Prospective study of hepatitis B virus reactivation in patients with hematological malignancies. Ann Hepatol 2015;14(2):168–174.
84. Onozawa M, Hashino S, Darmanin S, et al. HB vaccination in the prevention of viral reactivation in allogeneic hematopoietic stem cell transplantation recipients with previous HBV infection. Biol Blood Marrow Transplant 2008;14(11):1226–1230.
85. Jaffe D, Papadopoulos EB, Young JW, et al. Immunogenicity of recombinant hepatitis B vaccine (rHBV) in recipients of unrelated or related allogeneic hematopoietic cell (HC) transplants. Blood 2006;108(7):2470–2475.
86. Costa E, Buxton J, Brown J, Templeton KE, Breuer J, Johannessen I. Fatal disseminated varicella zoster infection following zoster vaccination in an immunocompromised patient. BMJ Case Rep 2016; bcr2015212688; DOI: 10.1136/bcr-2015-212688.
87. Leung TF, Chik KW, Li CK, et al. Incidence, risk factors and outcome of varicella-zoster virus infection in children after haematopoietic stem cell transplantation. Bone Marrow Transplant 2000;25(2):167–172.
88. Suzuki J, Ashizawa M, Okuda S, et al. Varicella zoster virus meningoencephalitis after allogeneic hematopoietic stem cell transplantation. Transpl Infect Dis 2012;14(4):7–12.
89. Blennow O, Fjaertoft G, Winiarski J, et al. Varicella-zoster reactivation after allogeneic stem cell transplantation without routine prophylaxis – the incidence remains high. Biol Blood Marrow Transplant 2014;20(10):1646–1649.
90. Onozawa M, Hashino S, Haseyama Y, et al. Incidence and risk of post-herpetic neuralgia after varicella zoster virus infection in hematopoietic cell transplantation recipients: Hokkaido Hematology Study Group. Biol Blood Marrow Transplant 2009;15(6):724–729.
91. Ljungman P, Lewensohn-Fuchs I, Hammarström V, et al. Long-term immunity to measles, mumps, and rubella after allogeneic bone marrow transplantation. Blood 1994;84(2): 657–663.
92. Ljungman P, Aschan J, Barkholt L, et al. Measles immunity after allogeneic stem cell transplantation; influence of donor type, graft type, intensity of conditioning, and graft-versus host disease. Bone Marrow Transplant 2004;34(7):589–593.
93. Kawamura K, Yamazaki R, Akahoshi Y, et al. Evaluation of the immune status against measles, mumps, and rubella in adult allogeneic hematopoietic stem cell transplantation recipients. Hematology 2015;20(2):77–82.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Klinické obrazy histiocytózy z Langerhansových buněk v dospělosti
- Farmakokinetika v léčbě hemofilie
- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Nábor dárců krvetvorných buněk do Českého národního registru dárců dřeně v letech 2013–2017 (demografická data)
- Externí hodnocení kvality stanovení CD34+ buněk v České a Slovenské republice – dlouhodobé zkušenosti z osmiletého období
- Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Monografie profesora Adama a kolektivu: Maligní onemocnění, psychika a stres
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Farmakokinetika v léčbě hemofilie
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



